Enhancement of Hesperidin Stability and Bioavailability Using Plant Proteins Based on pH-Driven Approach
-
摘要: 采用pH驱动法制备橙皮苷与不同植物蛋白(大米蛋白、豌豆蛋白、豌豆/大米复合蛋白)的复合物,以提高橙皮苷的水溶性、环境稳定性以及生物利用率,并采用扫描电镜、动态散射光、X射线衍射技术等手段表征复合物的形成,同时使用高效液相色谱法测定橙皮苷含量以分析复合物环境稳定性和生物利用率。结果表明,三种植物蛋白均能提高橙皮苷水溶性,其中豌豆/大米复合蛋白提升了19.6倍,使橙皮苷在水中溶解度达到340.78 μg/mL。橙皮苷-豌豆/大米复合蛋白复合物环境稳定性基本优于单一植物蛋白,其中热稳定效果最好,在80 ℃加热2 h橙皮苷保留率在65.09%。体外消化结果表明橙皮苷-豌豆/大米复合蛋白复合物的生物利用率最高,约为游离橙皮苷的5.22倍。本研究为提升橙皮苷稳定性和生物利用度提供了新思路,有助于拓展橙皮苷的应用范围。Abstract: Complexes of hesperidin with different plant proteins (rice protein, pea protein, pea/rice complex protein) were prepared by pH-driven method to improve the water solubility, environmental stability, and bioavailability of hesperidin. The complexes were characterized by scanning electron microscopy, dynamically scattered light, and X-ray diffraction. Meanwhile, the high performance liquid chromatography was used to determine the hesperidin content to analyze the environmental stability of complexes and bioavailability of hesperidin. The results showed that three plant proteins were able to improve the water solubility of hesperidin, among which the pea/rice complex protein improved 19.6-fold, and the solubility of hesperidin in water reached 340.78 μg/mL. The environmental stability of hesperidin-pea/rice complex protein complex was basically better than that of single plant protein, in which the heat stabilization was the most effective, and the retention of hesperidin was at 65.09% after heating at 80 ℃ for 2 h. The in vitro digestion results showed that the bioavailability of hesperidin in hesperidin-pea/rice complex protein complex was the highest, which was about 5.22-fold of free hesperidin. This study provided a new idea to enhance the stability and bioavailability of hesperidin and helped to expand the application of hesperidin.
-
Keywords:
- hesperidin /
- plant protein /
- pH-driven method /
- stability /
- bioavailability
-
橙皮苷是橙皮素与芸香糖形成的糖苷,即橙皮素-7-O-芸香糖苷,为二氢黄酮衍生物[1],大量存在于柑橘类水果(芸香科)中。橙皮苷以其广泛的生物活性而闻名,包括降低毛细血管渗透性和脆弱性、抗氧化、抗炎、抗菌、抗癌和抗过敏等[2−3]。但由于该化合物的水溶性极差[4−5],其在水中的溶解度仅有0.02 mg/mL,限制了其在水中的溶解速率,导致生物利用度相当低,极大地限制了其在食品、医药、化妆品等工业产品中的应用[6]。目前对橙皮苷的研究大多集中于脱糖基、甲基化等改性处理或微胶囊、乳液等包封运载的方式来提升其溶解性和生物利用率,但成功率低并且成本过高,因此探索出简便快捷且有效的方式十分重要。
pH驱动法,也称为pH转换法,是多酚类化合物封装方法之一,它是一种绿色、无有机溶剂、低能耗且易于扩展的技术。PAN等[7]根据生物聚合物(蛋白质)的“解离-重折叠”和植物多酚从碱性环境到酸性环境的“去质子化-质子化”开发了该方法,并成功地将水溶性差的姜黄素包封在酪蛋白胶束中,这是因为姜黄素在水溶液中的溶解度强烈依赖于pH。大量研究表明,生物活性化合物通过与蛋白的非共价结合制备复合粒子可以改善生物活性化合物的溶解性、生物利用度和抗氧化活性[8]。目前,大多研究集中于将动物蛋白与溶解性依赖pH的酚类化合物复合来改善酚类化合物的性质。XU等[9]报道了通过pH驱动方法制备负载白藜芦醇的乳清分离蛋白纳米粒子在不同pH条件下的超声处理,发现pH12.0的超声处理后有最高的包封率和负载量,这可能是由于在pH12.0条件下超声处理的蛋白质具有最高的表面疏水性。KEVIJ等[10]采用pH驱动法将乳清分离蛋白与姜黄素复合制备姜黄素-蛋白聚合物粒子,该方法显著提高了姜黄素的水溶性、热稳定性和光稳定性,且在pH3.0时的稳定性高于pH7.0时的稳定性。同时乳清分离蛋白-姜黄素聚合物粒子在模拟肠道条件下也显示出高的抗氧化活性和缓释特性。PENG等[11]基于纳米包封技术并结合pH驱动法制备姜黄素酪蛋白酸钠纳米粒子,所得的酪蛋白酸钠聚合物粒子具有高负载率(27%),并且提升了姜黄素的水分散性。ZHOU等[12]采用酪蛋白酸盐通过pH驱动法来稳定百里酚,其负载能力高达45.9%。然而,使用植物蛋白通过pH驱动法来提升酚类化合物的性质研究报道较少,且复合植物蛋白在提升酚类化合物稳定性的方面研究更为少见。
近年来,植物蛋白因其安全、环保、来源广泛、价格低廉等优点,逐渐部分或完全取代了动物蛋白。大米蛋白和豌豆蛋白均是低过敏性植物蛋白[13−14]。研究表明大米蛋白和豌豆蛋白可作为运载体结合生物活性小分子从而提升活性物质的性质。MA等[15]研究发现大米蛋白与叶黄素通过非共价相互作用形成纳米颗粒,显著提高了叶黄素的溶解度,荧光光谱分析表明二者具有很强的亲和力。豌豆蛋白与蜂胶形成微粒,对蜂胶的抗氧化性和抗菌活性均有显著保护作用[16]。豌豆蛋白与葡萄籽原花青素通过氢键形成胶体复合物,提高了葡萄籽原花青素的储藏稳定性[17]。但由于大米蛋白的赖氨酸含量较低,是其第一限制性氨基酸,单一大米蛋白无法充分地满足人体的蛋白质需求,而豌豆蛋白富含赖氨酸。因此将大米蛋白与豌豆蛋白复合,不仅可以解决大米蛋白氨基酸不均衡以及溶解度差的缺点,还能提升大米蛋白的功能性质。HU等[18]研究发现豌豆/大米复合蛋白与甜菜苷通过疏水相互作用复合后可以显著提升甜菜苷的热稳定性,在80 ℃加热60 min后,甜菜苷的降解率从93.74%降至56.48%,表明复合植物蛋白对甜菜苷具有一定的热保护作用。
综上所述,本研究以豌豆蛋白、大米蛋白、豌豆/大米复合蛋白为原料通过pH驱动法分别与橙皮苷复合,通过扫描电镜、动态散射光、X射线衍射技术表征橙皮苷-蛋白复合物的形成,探究并比较不同蛋白对橙皮苷环境稳定性的影响,提高橙皮苷的水溶性和生物利用率,为拓展橙皮苷在食品等领域的应用提供理论依据和指导。
1. 材料与方法
1.1 材料与仪器
橙皮苷 纯度:95%,上海源叶生物科技有限公司;大米蛋白 纯度:83.4%,江西恒顶食品有限公司;豌豆蛋白 纯度:82.8%,烟台双塔食品股份有限公司;氢氧化钠、0.1 mol/L盐酸标准液 阿拉丁试剂有限公司(中国上海)。
RT-10磁力搅拌器 德国IKA公司;Zetasizer Nano ZS 纳米粒度仪 英国Malvern公司;SU8100扫描电子显微镜 日本Hitachi公司;D8 Advance X-射线衍射 德国Bruker公司;1260 series高效液相色谱仪 美国Agilent公司;ME303E电子分析天平 上海梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 橙皮苷-蛋白复合物的制备
参照HU等[18]的方法处理植物蛋白,分别将豌豆蛋白、大米蛋白和豌豆/大米复合蛋白(质量比=1:1)溶解在蒸馏水中,并用1 mol/L氢氧化钠溶液将pH调节至12.0。搅拌1 h后,用0.1 mol/L盐酸溶液将pH重新调节至7.0。以4800 r/min离心30 min后,取上清液备用。经pH循环处理后的豌豆蛋白、大米蛋白和豌豆/大米复合蛋白的溶解度分别从12.2、0.5、4.1 mg/mL提升到99、31.2、36.4 mg/mL。将经pH循环制备的豌豆蛋白(PP)、大米蛋白(RP)、豌豆/大米复合蛋白(PP-RP)用蒸馏水稀释至10 mg/mL,磁力搅拌2 h充分水化后使用3 mol/L的氢氧化钠溶液将蛋白溶液调到pH12.0,磁力搅拌80 min后分别加入一定量的橙皮苷粉末使橙皮苷浓度分别为0.5、1、2、3、4 mg/mL,继续搅拌20 min,使用2 mol/L的盐酸溶液将pH调到7.0并持续搅拌30 min,后经4800 r/min离心20 min后取上清液分别制得橙皮苷-豌豆蛋白复合物(PP-H)、橙皮苷-大米蛋白复合物(RP-H)和橙皮苷-豌豆/大米复合蛋白复合物(PP-RP-H)。
1.2.2 橙皮苷浓度测定
采用高效液相色谱法对橙皮苷-蛋白复合物进行检测,色谱柱为Agilent C18分析柱(250 mm×4.6 mm,5 μm);流动相A为0.1%甲酸水溶液,流动相B为乙腈,采用紫外可见光检测器,紫外检测波长为283 nm,柱温为35 ℃,进样量为20 μL,一个梯度程序的跑样时间为30 min,流速为1 mL/min。应用以下梯度程序:0~1 min,85% A;1~5 min,85%~75% A;5~15 min,75%~60% A;15~25 min,60%~50% A;25~30 min,50%~85% A[19]。
1.2.3 橙皮苷-蛋白复合物的基本性质表征
1.2.3.1 包封率和载药量的测定
参考TIAN等[8]的方法稍作修改,取1 mL橙皮苷-蛋白复合物与29 mL甲醇溶液混合均匀,涡旋2 min,然后在4800 r/min离心15 min。离心后取上清液。使用高效液相色谱法测定上清液中橙皮苷对应的峰面积。将橙皮苷标准品溶解于甲醇溶液中配制橙皮苷标准溶液,采用高效液相色谱法测定其峰面积,建立标准曲线用于计算稀释上清液中的橙皮苷浓度,利用下述公式计算包封率和载药量。
包封率(%)=C1C0×100 (1) 载药量(%)=C1C2×100 (2) 式中:C1表示离心后上清液橙皮苷的浓度,mg/mL;C0表示制备橙皮苷-蛋白复合物时添加的橙皮苷浓度,mg/mL;C2表示蛋白浓度,mg/mL。
1.2.3.2 保留率和溶解浓度的测定
将贮藏3 d后的三种橙皮苷-蛋白复合物分别在4800 r/min条件下离心30 min,取上清液并采用1.2.2方法进行橙皮苷浓度测定,通过以下公式计算保留率:
保留率(%)=C3C0×100 (3) 式中,C3表示贮藏3 d后的样品离心后上清液橙皮苷的浓度;C0表示橙皮苷-蛋白复合物贮藏前的橙皮苷初始浓度。
将橙皮苷添加量为2 mg/mL所制备好的橙皮苷-蛋白复合物采用1.2.2方法对其橙皮苷浓度进行测定,所得橙皮苷浓度即为橙皮苷实际溶解浓度。
1.2.3.3 橙皮苷-蛋白复合物粒径及电位的测定
通过马尔文纳米粒度电位仪在室温下测定橙皮苷-蛋白复合物的粒径、电位,蛋白质和水的折射率分别为1.45和1.33。为避免多次散射效应,同时产生足够大的信号,在测定之前,橙皮苷-蛋白复合物采用去离子水进行适当稀释[20]。
1.2.3.4 橙皮苷-蛋白复合物表面形态的测定
将橙皮苷-蛋白复合物冻干,采用扫描电镜对冻干后的橙皮苷-蛋白复合物进行微观形态的观察。取少量样品均匀平铺于双面导电胶上,经过离子溅射镀膜仪将样品镀金至250~500 nm的水平,在Quanta 200扫描电镜中观察颗粒形貌结构,工作电压为3 kV,放大倍数为25000倍[20]。
1.2.3.5 X射线衍射(XRD)分析
采用XRD技术分别考察橙皮苷、蛋白和橙皮苷-蛋白复合物的结晶形态。发射和接收狭缝分别设置为1°和0.1 mm,扫描速度为2°/min,扫描范围(2θ)为5°~50°[21]。
1.2.4 橙皮苷-蛋白复合物环境稳定性研究
1.2.4.1 热稳定性
考察温度对橙皮苷-蛋白复合物热稳定性的影响,将橙皮苷-蛋白复合物在20~90 ℃的温度下处理2 h,测定处理后的橙皮苷-蛋白复合物平均粒径的变化以及经4800 r/min离心20 min后上清液的橙皮苷保留率。
保留率(%)=CHC0×100 (4) 式中:CH表示样品加热后橙皮苷所剩浓度,mg/mL;C0表示未处理样品的初始橙皮苷浓度,mg/mL。
1.2.4.2 pH稳定性
使用HCl和NaOH溶液,将橙皮苷-蛋白复合物的pH调至2.0~8.0,平衡12 h后,用激光纳米粒度仪测定其平均粒径和表面电位变化,并用摄像机记录外观变化。
1.2.4.3 离子稳定性
参照彭盛峰[22]的方法,在一价阳离子和二价阳离子中各自选取一种食品工业中最常见的阳离子,分别为NaCl和CaCl2,然后向橙皮苷-蛋白复合物中加入不同浓度NaCl溶液和CaCl2溶液,在室温下平衡1 h后,测定处理后经4800 r/min离心20 min的上清液橙皮苷保留率的变化,用摄像机记录离子处理后的外观变化。
保留率(%)=CIC0×100 (5) 式中:CI表示样品加入阳离子后橙皮苷所剩浓度,mg/mL;C0表示未处理样品的初始橙皮苷浓度,mg/mL。
1.2.4.4 贮藏稳定性
将橙皮苷-蛋白复合物溶液贮藏在4 ℃和25 ℃中,考察贮藏时间对橙皮苷-蛋白复合物的稳定性影响,测定一个月内平均粒径以及经4800 r/min离心20 min后上清液的橙皮苷保留率的变化,用摄像机记录贮藏前后的外观变化。
保留率(%)=CSC0×100 (6) 式中:CS表示样品贮藏一段时间后上清液橙皮苷所剩浓度,mg/mL;C0表示未处理样品的初始橙皮苷浓度,mg/mL。
1.2.5 体外消化
体外消化实验参照ZHANG等[23]的方法略做修改。在消化前将配制好的消化液进行灭菌操作,保持无菌状态。
口腔阶段:将7.5 mL橙皮苷-蛋白复合物与7.5 mL配制好的模拟口腔液(氯化钠1.594 mg/mL、硝酸铵0.328 mg/mL、氯化钾0.202 mg/mL、磷酸二氢钾0.636 mg/mL、柠檬酸钾0.308 mg/mL、尿酸钠0.021 mg/mL、尿素0.198 mg/mL、乳酸钠0.146 mg/mL、口腔粘膜蛋白3.0 mg/mL)混合,将pH调至6.8,37 ℃下100 r/min振荡10 min。
胃阶段:在上述溶液中加入含有胃蛋白酶(3.2 mg/mL)、氯化钠(2 mg/mL)和盐酸(7 mL/L)的模拟胃液(1:1 v/v)。将混合溶液的pH调至2.0,在37 ℃水浴中以100 r/min振荡2 h,模拟人胃内消化情况。
小肠阶段:胃消化后,将溶液的pH调至7.0,然后加入2.5 mL胰酶(24 mg/mL)、2.5 mL脂肪酶(24 mg/mL)、3.5 mL胆盐(全部溶解于5 mmol/L磷酸盐缓冲液溶液,pH7.0)和1.5 mL模拟肠液(36.7 mg/mL氯化钙、218.7 mg/mL氯化钠),在37 ℃条件下以100 r/min消化2 h,采用电位滴定仪监测pH保持在7.0,模拟人小肠消化情况。
分别取胃消化、肠消化后的终产物,按照1.2.2的方法测定橙皮苷体外消化后的含量。
参考彭盛峰[22]的方法,完成模拟体外消化后,将消化液离心(4800 r/min,30 min)后取上清液,用液相色谱分析橙皮苷含量,上清液被认为是包含了已吸收的橙皮苷的混合胶束部分。橙皮苷的转化率和生物可接受率通过以下公式计算:
转化率(%)=CCC0×100 (7) 生物可接受率(%)=CMCC×100 (8) 生物利用率(%)=转化率×生物可接受率×100 (9) 式中:CC表示食糜(经过口腔、胃、肠三个消化阶段后得到的最终全部产物)中橙皮苷的浓度,mg/mL;C0表示初始样品橙皮苷的浓度,mg/mL;CM表示混合胶束(上清液中的全部混合物)中橙皮苷的浓度,mg/mL。
1.3 数据处理
所有实验均至少重复三次,采用IBM SPSS Statistics 26统计学分析软件对数据进行方差分析和显著性差异检验,不同字母表示存在显著性差异(P<0.05)。采用Origin 2021软件进行绘图。
2. 结果与分析
2.1 橙皮苷-蛋白复合物的包封率及载药量
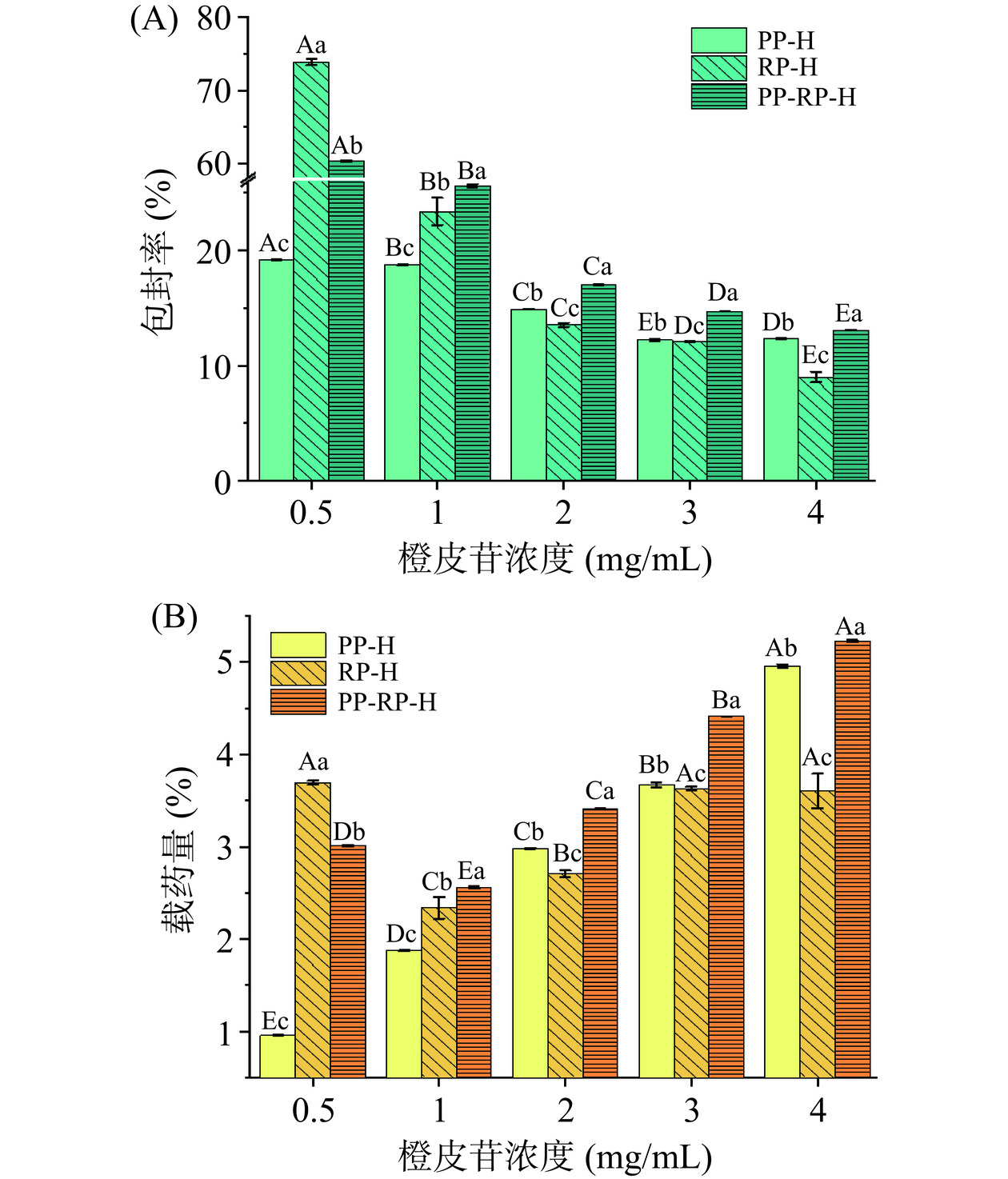
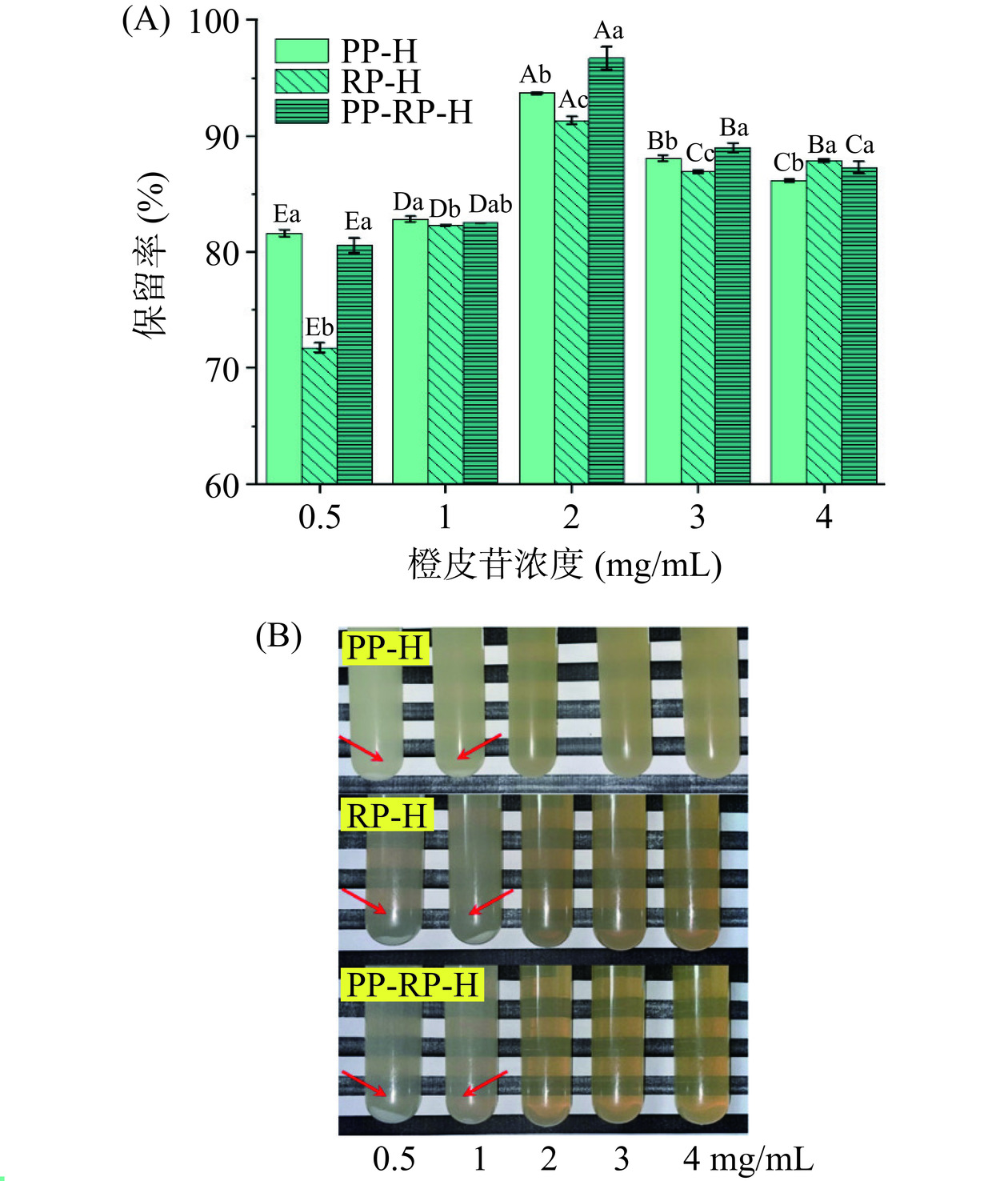
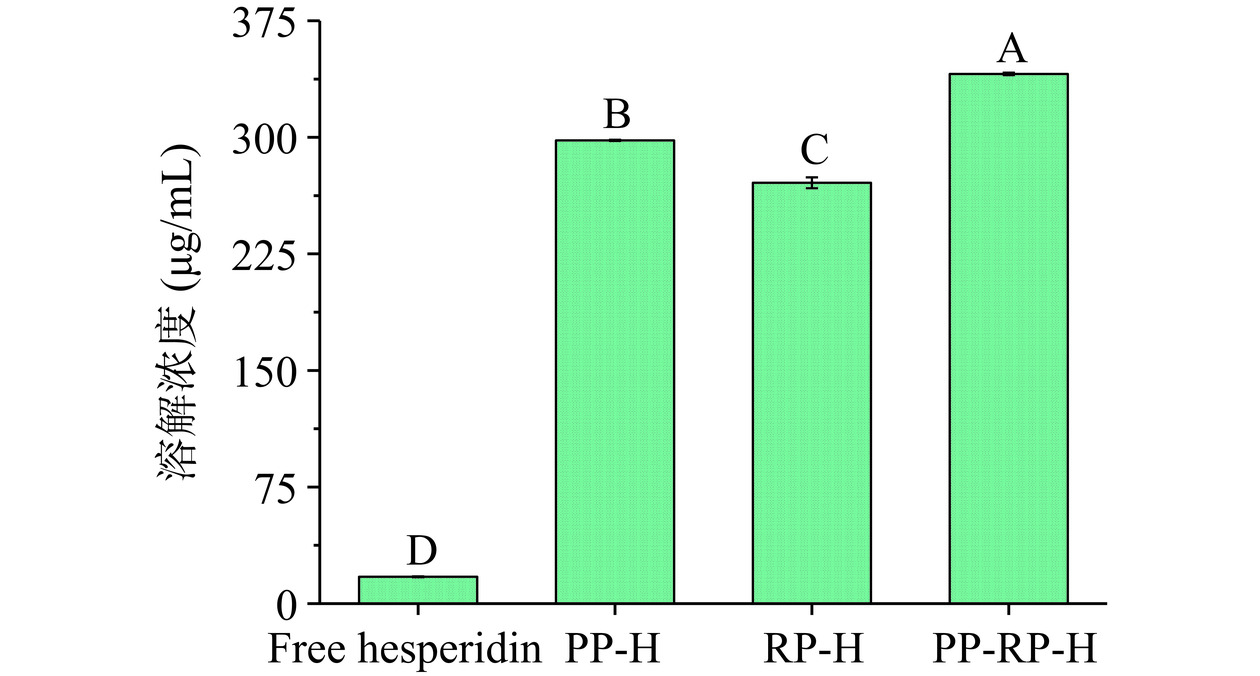
如图1(A)所示,随橙皮苷浓度的增加,三种植物蛋白的包封率呈现下降的趋势,分别由19.18%、73.89%、60.29%下降到12.23%、9.01%、13.07%。TIAN等[8]也报道了类似现象,这可能是由于橙皮苷的添加浓度高于蛋白包封能力的范围,导致很多橙皮苷没有与蛋白结合,从而出现包封率随橙皮苷浓度增高而下降的趋势。由图1(B)可以看到在橙皮苷浓度大于0.5 mg/mL时,载药量基本呈现上升的趋势。PP-H和PP-RP-H在橙皮苷浓度为4 mg/mL时,载药量仍有显著提升(P<0.05),而RP-H无显著性变化(P>0.05),表明PP与PP-RP的载药能力高于RP。除橙皮苷浓度为0.5 mg/mL外,PP-RP-H的包封率及载药量均优于两种单一蛋白。由图1(A)可观察到在橙皮苷浓度为0.5 mg/mL以及1 mg/mL时的包封率显著高于其他橙皮苷浓度(P<0.05),但由图2(B)可以看到,在4 ℃条件下贮藏3 d后这两种浓度出现明显的沉淀,且由图2(A)可以看到橙皮苷保留率下降到82.8%以下,其中在橙皮苷浓度为2 mg/mL时保留率最高,即此时橙皮苷-蛋白复合物最为稳定,并且PP-RP的橙皮苷保留率高于另两种蛋白,在96.73%左右,TIAN等[8]报道了高含量橙皮苷复合物的包封率和载药量在24 h内保持稳定,而低含量橙皮苷复合物的包封率和载药量在储存过程中显著下降,并表明高浓度的橙皮苷可以改善复合物的稳定性。由图3可知经高效液相色谱分析得到在橙皮苷添加浓度为2 mg/mL时,PP-H、RP-H和PP-RP-H三种复合物最终上清液橙皮苷浓度分别为298.06、270.76和340.78 μg/mL,相较于游离橙皮苷在水中溶解度(17.40 μg/mL),最高提升了近19.6倍,表明三种蛋白均对橙皮苷的水溶性有显著的提升效果,这可能是因为处理后的植物蛋白的溶解度远高于橙皮苷,蛋白表面疏水基团与橙皮苷的疏水基团结合后形成新的复合物阻断了橙皮苷在水中的自结晶从而使得橙皮苷的水溶性大幅提升[24−25]。其中当橙皮苷浓度为2 mg/mL时,PP-RP-H复合物包封率和载药量最高,分别为17.04%、3.41%,且经3 d贮藏后PP-RP-H橙皮苷的保留率也最高,为96.73%,表明复合蛋白对橙皮苷的负载效果要优于单一蛋白,不同蛋白包封效果不同的原因可能是蛋白之间分子量及结构的不同[22]。
![]() 图 1 橙皮苷浓度对橙皮苷-蛋白复合物包封率(A)和载药量(B)的影响注:大写字母表示相同蛋白对应不同橙皮苷浓度间的显著性(P<0.05);小写字母表示相同橙皮苷浓度对应不同蛋白间的显著性(P<0.05);图2同。Figure 1. Effect of hesperidin concentration on the encapsulation rate (A) and drug loading (B) of hesperidin-protein complexes
图 1 橙皮苷浓度对橙皮苷-蛋白复合物包封率(A)和载药量(B)的影响注:大写字母表示相同蛋白对应不同橙皮苷浓度间的显著性(P<0.05);小写字母表示相同橙皮苷浓度对应不同蛋白间的显著性(P<0.05);图2同。Figure 1. Effect of hesperidin concentration on the encapsulation rate (A) and drug loading (B) of hesperidin-protein complexes2.2 橙皮苷-蛋白复合物的结构表征
2.2.1 粒径与电位
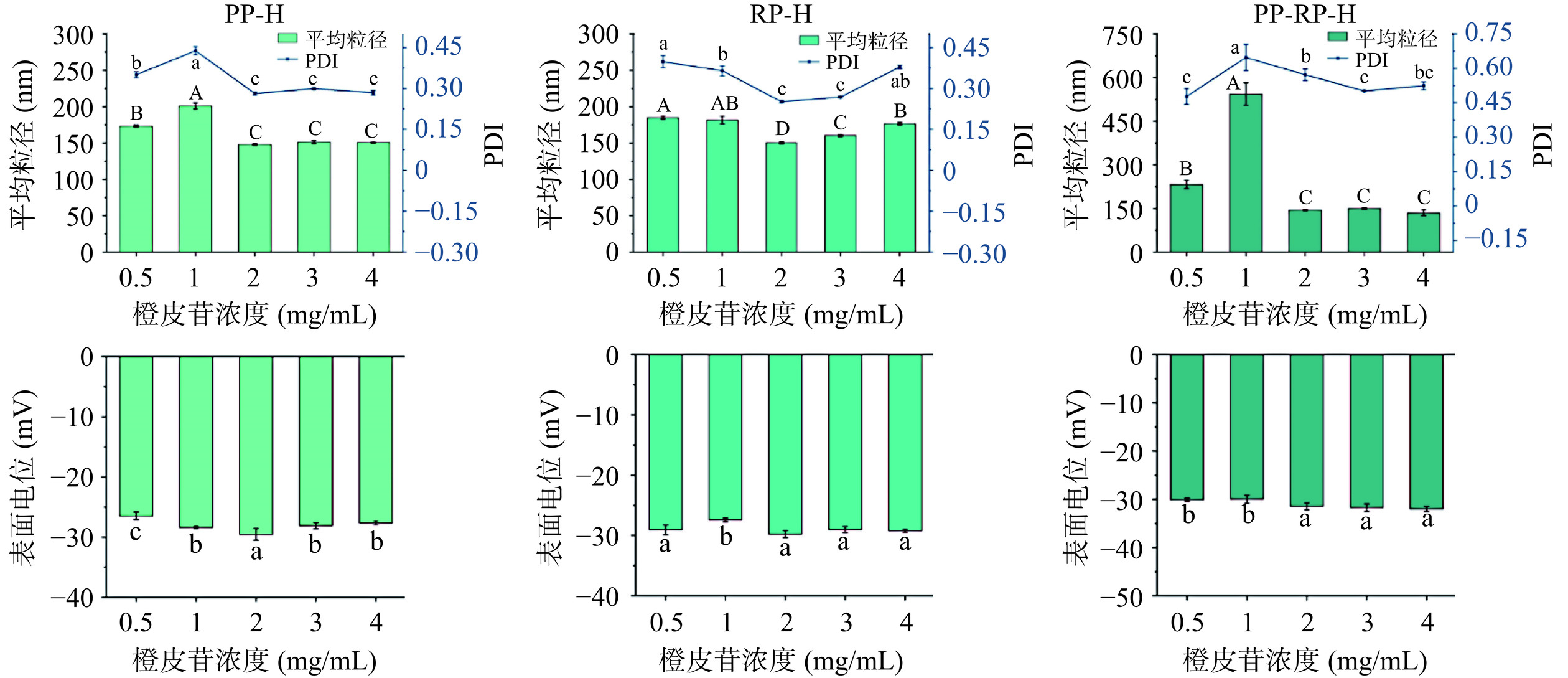
由图4可知,橙皮苷与不同蛋白复合均在橙皮苷浓度为2 mg/mL时平均粒径最小,分别为147.93、150.33、144.90 nm,其PDI值较小,均在0.7以下,分别为0.28、0.25、0.57。PDI值(多分散系数)越小表明样品粒径尺寸越均一,反之表明粒径分布不均匀,部分发生聚集现象,表明橙皮苷浓度为2 mg/mL时,复合物在水中分散最为均匀稳定。一般情况下,电位绝对值越大,带有相同电荷粒子之间的静电斥力越大,纳米粒子越不容易发生聚集沉淀,有利于维持体系的稳定[26]。橙皮苷浓度为2 mg/mL时电位的绝对值最大,分别为−29.53、−29.77、−31.47 mV,说明橙皮苷浓度为2 mg/mL时形成的复合物最为稳定,与3 d贮藏后的橙皮苷保留率结果一致,因此后续实验均使用橙皮苷浓度为2 mg/mL的复合物作为研究对象。
2.2.2 蛋白质以及橙皮苷-蛋白复合物的表面形态
橙皮苷与蛋白复合后,会改变蛋白表面形态,如图5所示,通过扫描电子显微镜在放大25000倍的条件下观测前处理后的蛋白以及橙皮苷-蛋白复合物的表面形态,发现在与橙皮苷复合后三种蛋白的表面均由原来的粗糙多孔变得平滑且孔隙结构明显减少,说明橙皮苷与蛋白复合后改变了蛋白的表面形态,也进一步说明了橙皮苷与蛋白的成功复合。
2.2.3 X射线衍射(XRD)分析
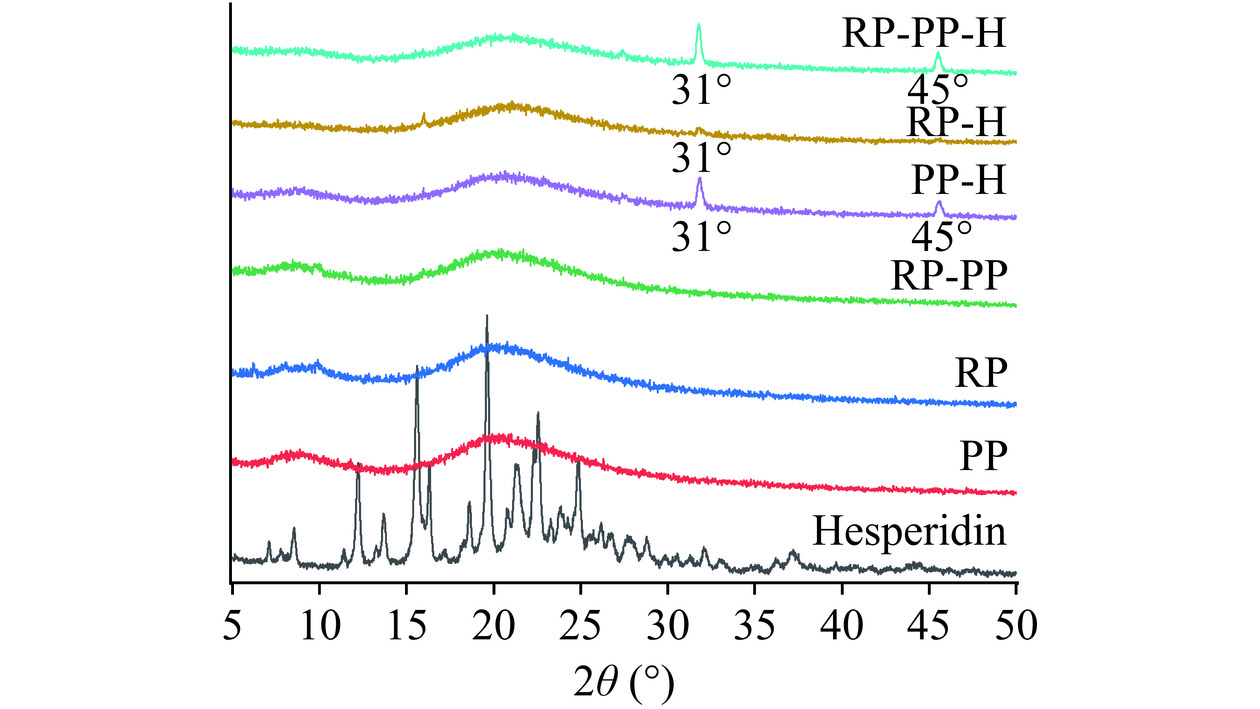
通过采用X射线衍射技术来考察橙皮苷在复合物中的晶体结构的变化,如图6所示,橙皮苷在2θ衍射角5°~30°的范围内具有多个尖锐的衍射峰,表明在该范围内橙皮苷的结晶度较高,蛋白质仅在20°附近有一个宽且平坦光滑的峰,表明蛋白质主要以无定形状态存在。橙皮苷与蛋白复合之后,可以明显地观察到原本存在的尖锐的特征结晶峰全部消失了,说明成功将橙皮苷包埋在蛋白质的疏水腔并有效地抑制了橙皮苷的结晶,使橙皮苷由结晶态变为无定形态,并且发现橙皮苷-蛋白复合物的衍射图谱在31°和45°产生了新的衍射峰,这可能是由于使用pH驱动法将橙皮苷与蛋白复合的过程中使用了NaOH和HCl从而引入了NaCl,产生的新衍射峰恰好是NaCl的特征峰,KEVIJ等[10]和ZHAN等[27]也报道了类似的现象。总体而言,植物蛋白均有效抑制了橙皮苷的结晶,不同的植物蛋白没有显著区别。
2.3 橙皮苷-蛋白复合物的环境稳定性
2.3.1 热稳定性
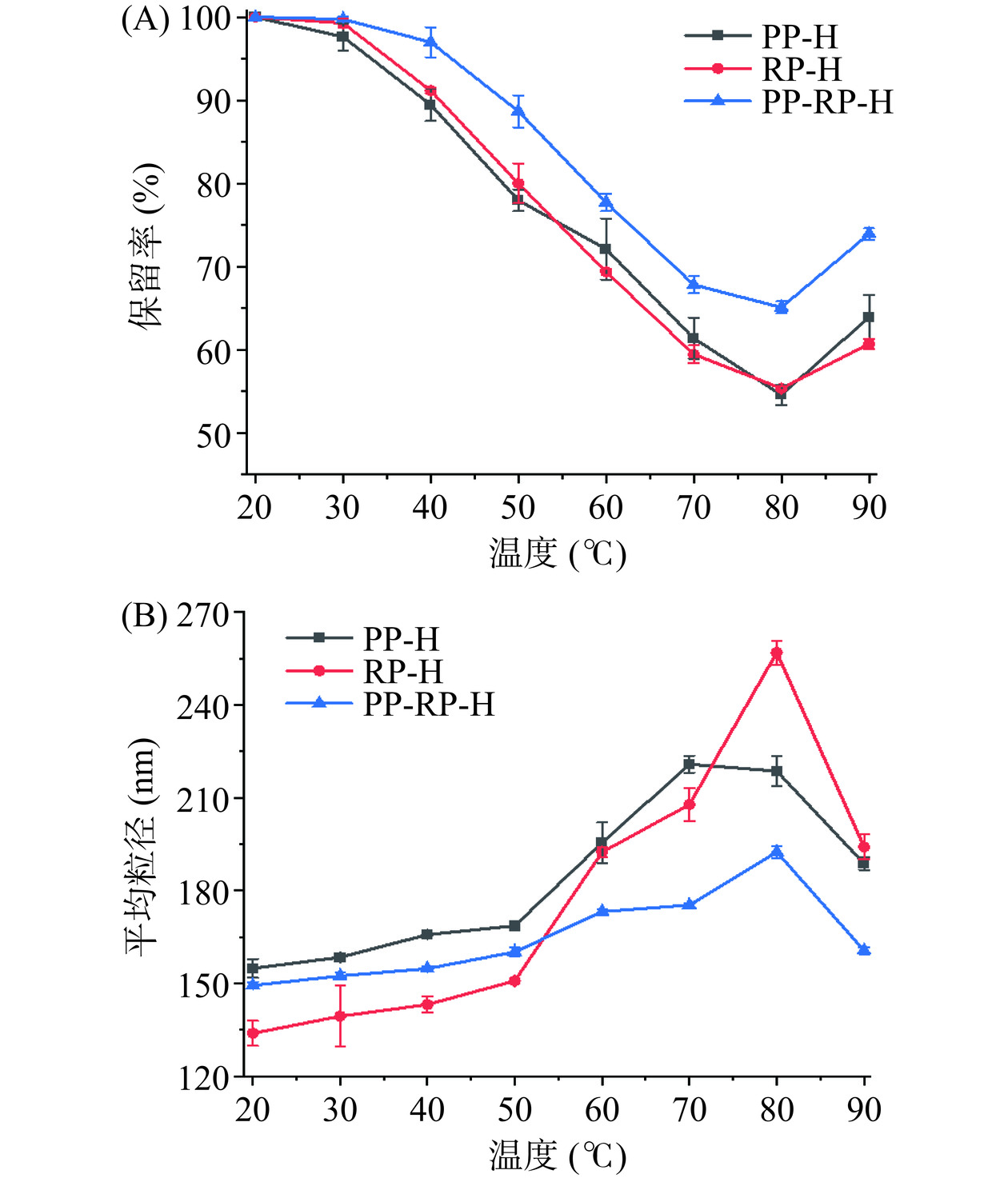
由于橙皮苷为黄酮苷类化合物,其在水溶液中可能发生水解,酚羟基可能被氧化破坏,而温度会加速降解反应的进程,因此探究橙皮苷复合物的热稳定性具有重要意义。由图7(A)可以看出经过不同温度加热2 h后,不同蛋白对与橙皮苷的保护效果不同,橙皮苷保留率总体趋势均为先下降后上升,在温度超过80 ℃时橙皮苷保留率有所提升,可能是因为在90 ℃时蛋白发生了热变性从而形成了热聚集体将部分橙皮苷再次包封[28],根据彭盛峰[22]的研究发现,随着加热温度的升高姜黄素的保留率降低,这是由于加热过程中部分姜黄素与蛋白发生解吸附导致保留率下降,与此同时泄露率呈现先上升后下降的趋势,这可能是由于蛋白的热聚集作用导致90 ℃条件下再次包埋部分游离姜黄素。其中PP-RP的热保护效果优于另两种蛋白,80 ℃时PP-H、RP-H、PP-RP-H的橙皮苷保留率分别为54.57%、55.37%、65.09%。由图7(B)可以看出热处理后的复合物的平均粒径先上升后下降,PP-H、RP-H、PP-RP-H的粒径分别由最初的154.83、133.83、149.33 nm上升到在80 ℃条件下的粒径218.60、256.97、192.47 nm,其中PP-RP-H的粒径变化最小,表明该复合物的热稳定性优于PP-H和RP-H。
2.3.2 pH稳定性
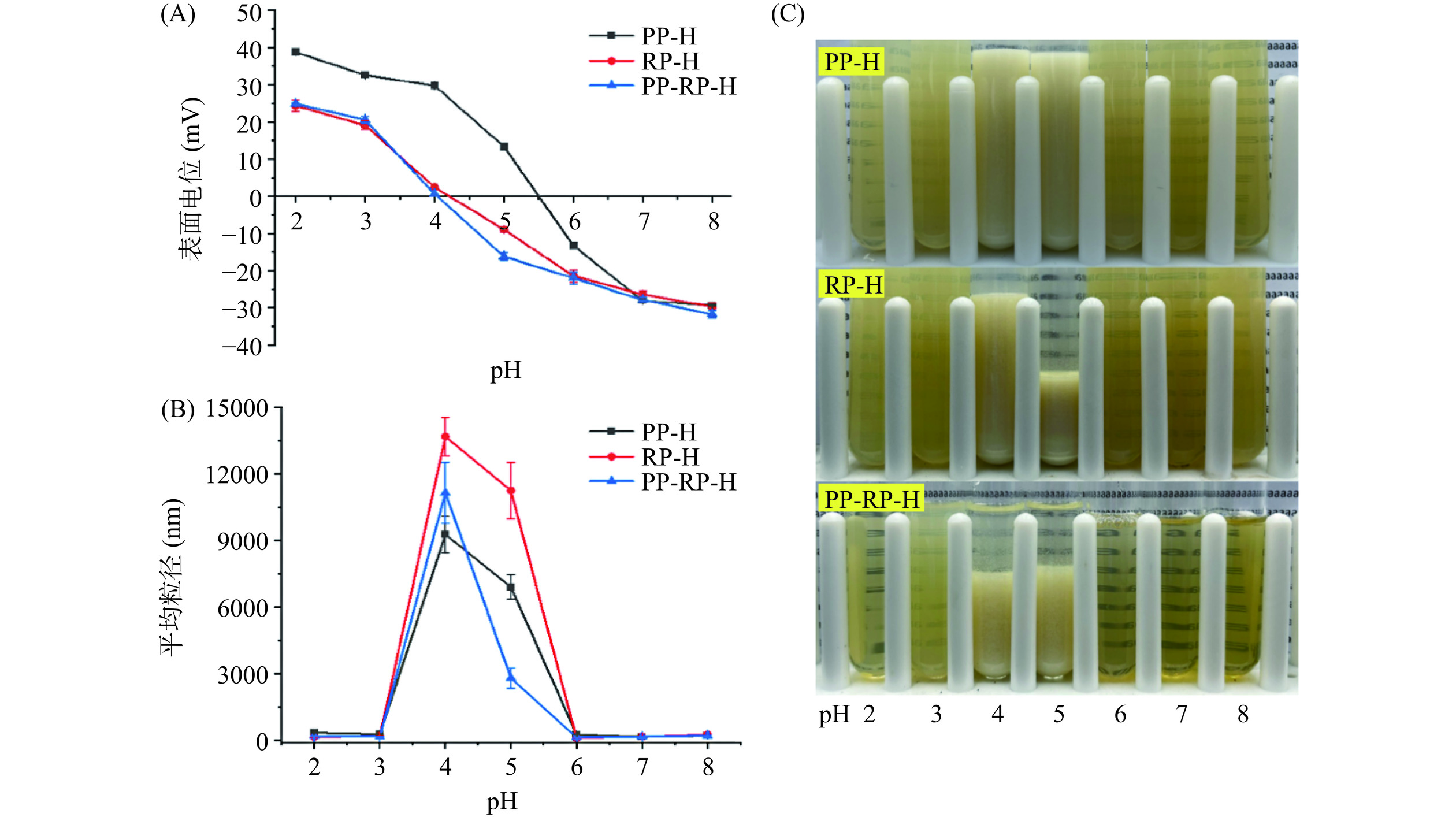
考察橙皮苷-蛋白复合物在不同pH条件下理化性质的变化,以反映不同pH对其稳定性的影响。如图8(A)所示,随着pH由2.0升高到8.0,三种复合物的表面电位逐渐下降,由带正电变为带负电,其中RP-H、PP-RP-H两种复合物的电位变化较PP-H小。通过图8(C)可以明显看到出现絮凝和沉淀现象,这是由于蛋白在等电点附近稳定性较差,而三种蛋白的等电点均在pH为4.0~5.0之间。如图8(B)所示,由于蛋白在等电点附近产生沉淀导致三种复合物的粒径在pH为4.0和5.0极度增大,在pH2.0强酸的条件下PP-H、RP-H、PP-RP-H三者平均粒径分别为328.47、129.07、172.27 nm,在pH8.0弱碱条件下平均粒径分别为193.80、247.77、201 nm,相较于在pH7.0中性条件下的平均粒径149.33、153.70、151.23 nm,RP-H和PP-RP-H的粒径变化相比PP-H较大,在强酸和弱碱条件下相比PP较为稳定。
2.3.3 离子稳定性
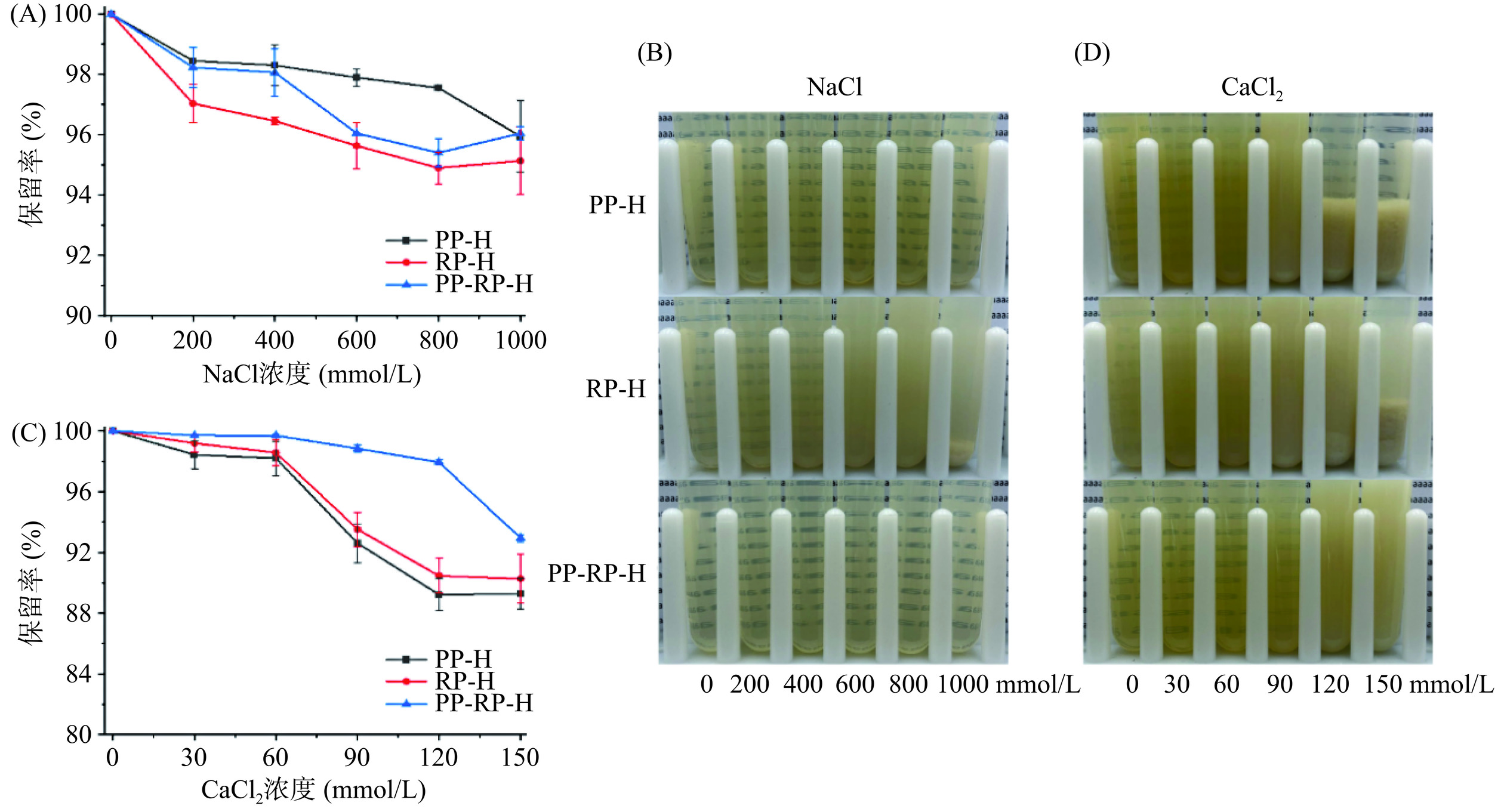
考察橙皮苷-蛋白复合物在不同离子浓度下的稳定性,选取食品工业中较常用的NaCl和CaCl2分别作为考察一价阳离子和二价阳离子对离子稳定性影响的离子种类。如图9所示,橙皮苷-蛋白在0~1000 mmol/L NaCl浓度下,三种复合物的橙皮苷保留率均较高,其中PP-H的稳定性优于另外两种复合物,其在1000 mmol/L NaCl浓度下橙皮苷保留率为95.96%。RP的稳定性较差,不仅保留率最低且在高浓度的NaCl条件下出现了沉淀现象。在0~150 mmol/L CaCl2条件下,可以看出PP-RP-H最稳定,其橙皮苷的保留率为92.95%,明显高于另两种复合物,且从图9(D)可以看出PP-H和RP-H在高浓度CaCl2条件下,出现了明显的沉淀现象,这可能是由于Ca2+与蛋白结合,降低了表面电位,发生了桥接,导致沉淀。此外,盐溶液浓度升高,溶液中离子强度增加,极性增强,蛋白质可能发生“盐析”现象,同时蛋白质包被的颗粒由于静电排斥的屏蔽而在高盐浓度下聚集[29−30]。
![]() 图 9 橙皮苷-蛋白复合物在不同NaCl浓度条件下的橙皮苷保留率(A)、外观形貌(B)和不同CaCl2浓度条件下的橙皮苷保留率(C)、外观形貌(D)的变化Figure 9. Changes of hesperidin-protein complexes in hesperidin retention (A), appearance and morphology (B) at different NaCl concentrations and hesperidin retention (C), appearance and morphology (D) at different CaCl2 concentrations
图 9 橙皮苷-蛋白复合物在不同NaCl浓度条件下的橙皮苷保留率(A)、外观形貌(B)和不同CaCl2浓度条件下的橙皮苷保留率(C)、外观形貌(D)的变化Figure 9. Changes of hesperidin-protein complexes in hesperidin retention (A), appearance and morphology (B) at different NaCl concentrations and hesperidin retention (C), appearance and morphology (D) at different CaCl2 concentrations2.3.4 贮藏稳定性
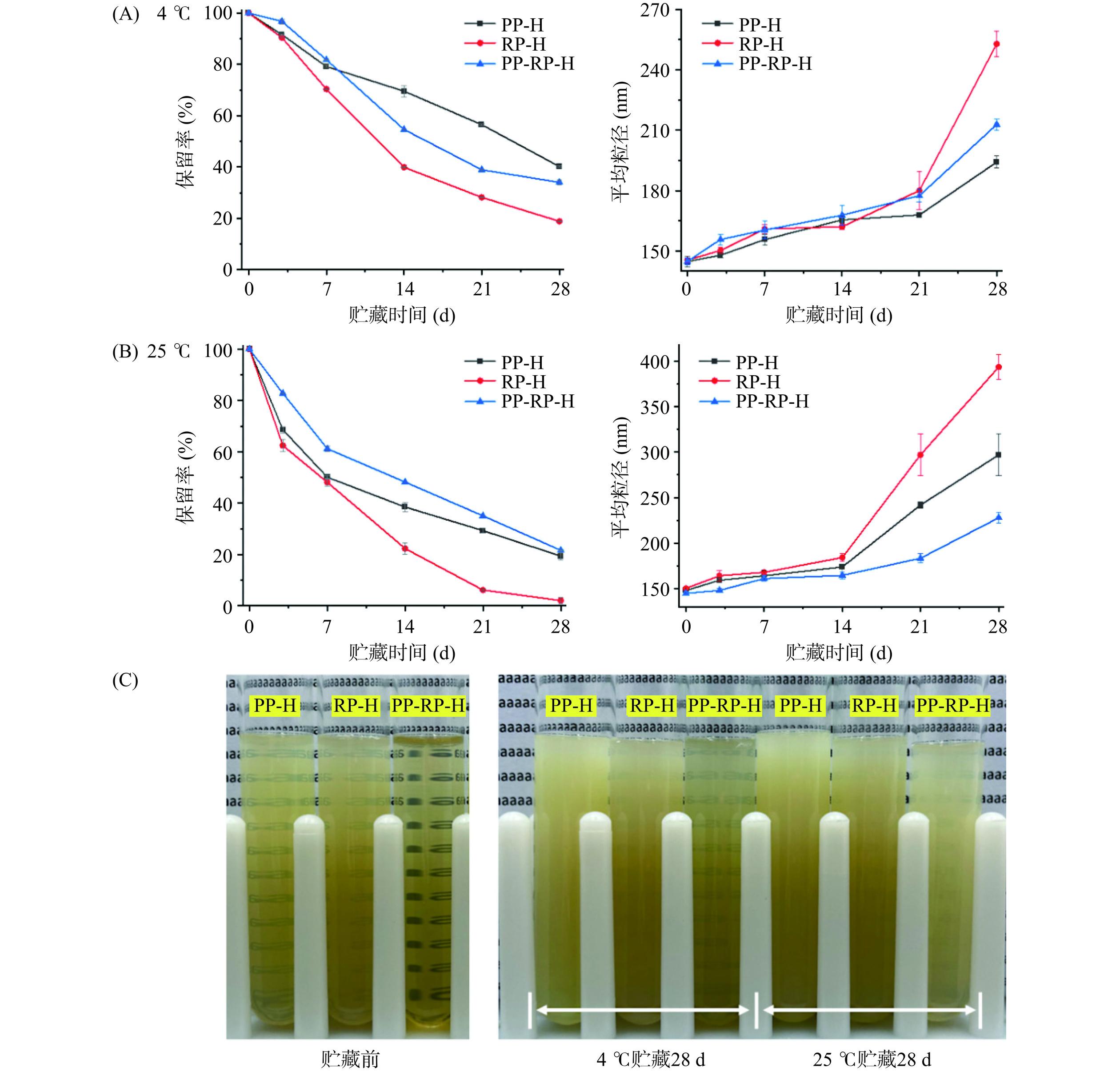
随着贮藏时间延长,橙皮苷-蛋白复合物会发生降解、沉淀,橙皮苷与蛋白部分发生解吸附,导致橙皮苷在水溶液中的保留率下降,通过探究在不同温度下贮藏时间对橙皮苷-蛋白复合物的影响,来对比稳定性的优劣。如图10(A)所示,在4 ℃条件下贮藏时复合物的稳定性为PP-H>PP-RP-H>RP-H,贮藏28 d后PP-H的橙皮苷保留率最高,为40.22%,且粒径变化最小,由144.80 nm增加到194.17 nm,PP-RP-H和RP-H在28 d贮藏后,橙皮苷保留率分别为34.07%和18.87%,粒径分别从144.90 nm和145.50 nm增加到212.87 nm和252.90 nm。如图10(B)所示,在25 ℃条件下贮藏时复合物的稳定性为PP-RP-H>PP-H>RP-H,贮藏28 d后PP-RP-H的橙皮苷保留率最高,为21.65%±0.11%,且粒径变化最小,由144.90 nm增加到227.93 nm,PP-H和RP-H在28 d贮藏后,橙皮苷保留率分别为19.40%和2.09%,粒径分别从147.93 nm和150.33 nm增加到296.93 nm和393.30 nm。
2.4 体外消化
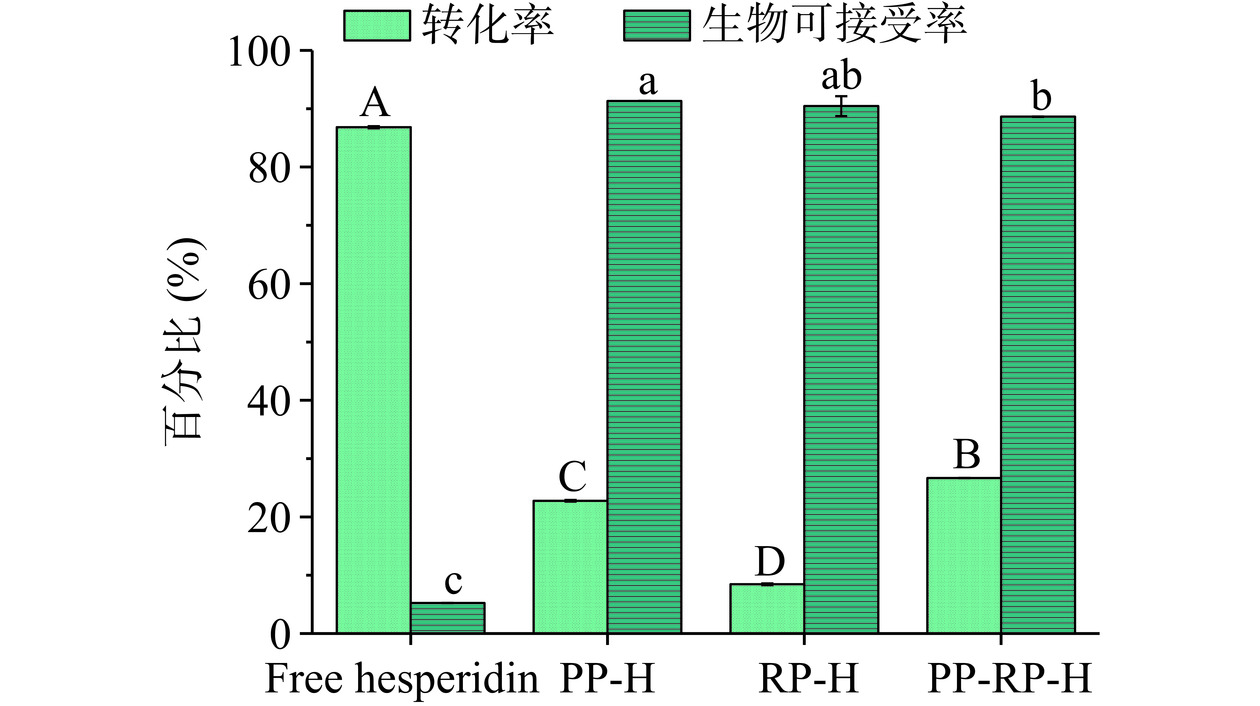
橙皮苷是由黄酮环与鼠李糖和葡萄糖糖基单糖连接组成,由于糖苷键的存在,降低了橙皮苷的溶解性,使其不容易透过生物膜被肠道吸收利用,造成生物利用率低[31−34]。通过体外消化模拟来考察橙皮苷-蛋白复合物的生物利用率,体外消化结果以转化率、生物可接受率和生物利用率三个指标来评估,转化率主要是表现酚类活性物质经体外消化过程后仍保持其活性的质量比[21,35],生物可接受率是指在经消化后活性物质释放在消化液中可被小肠吸收的部分占消化液中总量的比例[36−37],生物利用率是指在经消化后活性物质释放在消化液中可被小肠吸收的部分占摄入总量的比例。由图11所示,PP-H、RP-H、PP-RP-H的转化率分别为22.76%、8.45%、26.66%,游离橙皮苷的转化率为86.81%高于橙皮苷-蛋白复合物,这是由于游离的橙皮苷是以晶体的形式存在,其晶核相较于水分散性较好的橙皮苷-蛋白复合物与水相接触的表面积小,因此相较于复合物更不易被降解,所以转化率显著高于橙皮苷-蛋白复合物。由于橙皮苷-蛋白复合物的水溶性远高于游离橙皮苷,因此复合物的生物可接受率显著高于游离橙皮苷,PP-H、RP-H、PP-RP-H的生物可接受率分别为91.33%、90.44%、88.63%,差异较小,三种复合物的生物可接受率几乎是游离橙皮苷(5.22%±0.03%)的17倍左右。经计算可得,游离橙皮苷、PP-H、RP-H、PP-RP-H的生物利用率分别为4.53%±0.03%、20.79%±0.14%、7.64%±0.01%、23.63%±0.02%,其中PP-RP-H的生物利用率最高约为游离橙皮苷的5.22倍,这是由于无定型形态的复合物粒径小且与水接触的表面积更大,从而更易被吸收。以上结果说明,三种植物蛋白均能在不同程度上提高橙皮苷的生物利用率,其中豌豆/大米复合蛋白的效果最好。
3. 结论
本研究以经过前处理后的高溶豌豆蛋白、大米蛋白以及豌豆/大米复合蛋白为原料,采用pH驱动法成功制备出三种橙皮苷-蛋白复合物。结果表明,复合蛋白的包封率、载药量优于另两种单一蛋白,当橙皮苷浓度在2 mg/mL时复合物比较稳定,且在该浓度下复合蛋白的增溶效果最好,是游离橙皮苷水中溶解度的19.6倍。扫描电镜、X射线衍射技术的结果验证了橙皮苷与蛋白成功复合,由难溶的结晶态变为水溶性较好的无定型形态。通过对环境稳定性的测定比较三种蛋白的稳定效果,结果表明橙皮苷-豌豆/大米蛋白复合物的热稳定性最好,豌豆蛋白和复合蛋白与橙皮苷形成的复合物在强酸和弱碱条件下较为稳定,三种复合物均有较好离子稳定性,其中橙皮苷-豌豆复合物的钠离子稳定性最好,橙皮苷-豌豆/大米复合蛋白的钙离子稳定性最好,在4 ℃贮藏条件下,贮藏稳定性效果豌豆蛋白>豌豆/大米复合蛋白>大米蛋白,在25 ℃贮藏条件下,复合物的稳定性豌豆/大米复合蛋白>豌豆蛋白>大米蛋白。体外消化结果表明橙皮苷-豌豆/大米复合蛋白复合物的生物利用率最高,约为游离橙皮苷的5.22倍。这些研究为利用蛋白质以及pH驱动法来提升橙皮苷稳定性及生物利用率提供了实践基础,拓宽了提高橙皮苷的水溶性、稳定性以及生物利用率的思路与方法,对促进橙皮苷在食品、医药中的应用以及产品开发具有重要意义。
-
图 1 橙皮苷浓度对橙皮苷-蛋白复合物包封率(A)和载药量(B)的影响
注:大写字母表示相同蛋白对应不同橙皮苷浓度间的显著性(P<0.05);小写字母表示相同橙皮苷浓度对应不同蛋白间的显著性(P<0.05);图2同。
Figure 1. Effect of hesperidin concentration on the encapsulation rate (A) and drug loading (B) of hesperidin-protein complexes
图 9 橙皮苷-蛋白复合物在不同NaCl浓度条件下的橙皮苷保留率(A)、外观形貌(B)和不同CaCl2浓度条件下的橙皮苷保留率(C)、外观形貌(D)的变化
Figure 9. Changes of hesperidin-protein complexes in hesperidin retention (A), appearance and morphology (B) at different NaCl concentrations and hesperidin retention (C), appearance and morphology (D) at different CaCl2 concentrations
-
[1] JIANG H H, HU X, PAN J H, et al. Effects of interaction between hesperetin/hesperidin and glutenin on the structure and functional properties of glutenin[J]. LWT-Food Science and Technology,2022,155(3):32−41.
[2] DING Z, SUN G Y, ZHU Z M. Hesperidin attenuates influenza A virus (H1N1) induced lung injury in rats through its anti-inflammatory effect[J]. Antiviral Therapy,2018,23(7):611−615. doi: 10.3851/IMP3235
[3] HASANIN A H, MATBOLI M, SELEEM H S. Hesperidin suppressed hepatic precancerous lesions via modulation of exophagy in rats[J]. Journal of Cellular Biochemistry,2020,121(2):1295−1306. doi: 10.1002/jcb.29363
[4] ANWER M K, AL-SHDEFAT R, JAMIL S, et al. Solubility of bioactive compound hesperidin in six pure solvents at (298.15 to 333.15) K[J]. Journal of Chemical and Engineering Data,2014,59(6):2065−2069. doi: 10.1021/je500206w
[5] OLIVEIRA R M M, DANIEL J F D, DE AGUIAR I, et al. Structural effects on the hesperidin properties obtained by chelation to magnesium complexes[J]. Journal of Inorganic Biochemistry,2013,129:35−42. doi: 10.1016/j.jinorgbio.2013.08.005
[6] LI Z, JIANG H, XU C M, et al. A review:Using nanoparticles to enhance absorption and bioavailability of phenolic phytochemicals[J]. Food Hydrocolloids,2015,43:153−164. doi: 10.1016/j.foodhyd.2014.05.010
[7] PAN K, LUO Y, GAN Y, et al. pH-Driven encapsulation of curcumin in self-assembled casein nanoparticles for enhanced dispersibility and bioactivity[J]. Soft Matter,2014,10(35):6820−6830. doi: 10.1039/C4SM00239C
[8] TIAN Y, XU G, CAO W W, et al. Interaction between pH-shifted beta-conglycinin and flavonoids hesperetin/hesperidin:Characterization of nanocomplexes and binding mechanism[J]. LWT-Food Science and Technology,2021,140(2):32.
[9] XU Y Z, WU J L, WANG S Y. Comparative study of whey protein isolate and gelatin treated by pH-shifting combined with ultrasonication in loading resveratrol[J]. Food Hydrocolloids,2021,117:106694. doi: 10.1016/j.foodhyd.2021.106694
[10] KEVIJ H T, MOHAMMADIAN M, SALAMI M. Complexation of curcumin with whey protein isolate for enhancing its aqueous solubility through a solvent-free pH-driven approach[J]. Journal of Food Processing and Preservation,2019,43(12):14227.
[11] PENG S F, ZHOU L, CAI Q Z, et al. Utilization of biopolymers to stabilize curcumin nanoparticles prepared by the pH-shift method:Caseinate, whey protein, soy protein and gum arabic[J]. Food Hydrocolloids,2020,107(6):105963.
[12] ZHOU W, ZHANG Y, LI R Y, et al. Fabrication of caseinate stabilized thymol nanosuspensions via the pH-driven method:Enhancement in water solubility of thymol[J]. Foods,2021,10(5):1074. doi: 10.3390/foods10051074
[13] HOU F, DING W, QU W, et al. Alkali solution extraction of rice residue protein isolates:Influence of alkali concentration on protein functional, structural properties and lysinoalanine formation[J]. Food Chemistry,2017,218:207−215. doi: 10.1016/j.foodchem.2016.09.064
[14] GE J, SUN C X, CORKE H, et al. The health benefits, functional properties, modifications, and applications of pea (Pisum sativum L.) protein:Current status, challenges, and perspectives[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):1835−1876. doi: 10.1111/1541-4337.12573
[15] MA X Y, CHEN X X, MA M Y, et al. Lutein transport systems loaded with rice protein-based self-assembled nanoparticles[J]. Food Bioscience,2021,42:101061. doi: 10.1016/j.fbio.2021.101061
[16] JANSEN-ALVES C, MAIA D S V, KRUMREICH F D, et al. Propolis microparticles produced with pea protein:Characterization and evaluation of antioxidant and antimicrobial activities[J]. Food Hydrocolloids,2019,87:703−711. doi: 10.1016/j.foodhyd.2018.09.004
[17] DAI T T, LI T, LI R Y, et al. Utilization of plant-based protein-polyphenol complexes to form and stabilize emulsions:Pea proteins and grape seed proanthocyanidins[J]. Food Chemistry,2020,329:127219. doi: 10.1016/j.foodchem.2020.127219
[18] HU T, CHEN J, HE X M, et al. Complex plant protein prepared from rice protein and pea protein:Improve the thermal stability of betanin[J]. Food Research International,2023,164:112341. doi: 10.1016/j.foodres.2022.112341
[19] 王幻. 橙皮素单葡萄糖苷的酶法合成、分离纯化及其应用[D]. 广州:华南理工大学, 2019. [WANG H. Synthesis, purification and application of hesperetin-7-O-glucoside by enzymatic method[D]. Guangzhou:South China University of Technology, 2019.] WANG H. Synthesis, purification and application of hesperetin-7-O-glucoside by enzymatic method[D]. Guangzhou: South China University of Technology, 2019.
[20] 胡婷, 韩嘉龙, 耿勤, 等. 动物蛋白与植物蛋白对甜菜苷的热保护作用机制研究[J]. 食品工业科技,2023,44(7):10−18. [HU T, HAN J L, GENG Q, et al. Study of the thermal protection mechanism of animal proteins and plant proteins on betanin[J]. Science and Technology of Food Industry,2023,44(7):10−18.] HU T, HAN J L, GENG Q, et al. Study of the thermal protection mechanism of animal proteins and plant proteins on betanin[J]. Science and Technology of Food Industry, 2023, 44(7): 10−18.
[21] CHENG C, PENG S F, LI Z L, et al. Improved bioavailability of curcumin in liposomes prepared using a pH-driven, organic solvent-free, easily scalable process[J]. Rsc Advances,2017,7(42):25978−25986. doi: 10.1039/C7RA02861J
[22] 彭盛峰. pH驱动法制备姜黄素食品运载体及其生物利用率[D]. 南昌:南昌大学, 2019. [PENG S F. The preparation and bioavailability of curcumin loaded food delivery system by pH-driven method[D]. Nanchang:Nanchang University, 2019.] PENG S F. The preparation and bioavailability of curcumin loaded food delivery system by pH-driven method[D]. Nanchang: Nanchang University, 2019.
[23] ZHANG Z, GU M, YOU X, et al. Encapsulation of bifidobacterium in alginate microgels improves viability and targeted gut release[J]. Food Hydrocolloids,2021,116:106634. doi: 10.1016/j.foodhyd.2021.106634
[24] WORANUCH S, YOKSAN R. Preparation, characterization and antioxidant property of water-soluble ferulic acid grafted chitosan[J]. Carbohydrate Polymers,2013,96(2):495−502. doi: 10.1016/j.carbpol.2013.04.006
[25] JIANG H H, FEI X Y, ZHANG G W, et al. Complexing with fibrillated glutenin and orange peel pectin improves the aqueous dispersion and storage stability of hesperitin/hesperidin[J]. Food Hydrocolloids,2023,145:109138. doi: 10.1016/j.foodhyd.2023.109138
[26] CHEN Y F, ZHAO Z L, XIA G B, et al. Fabrication and characterization of zein/lactoferrin composite nanoparticles for encapsulating 7,8-dihydroxyflavone:Enhancement of stability, water solubility and bioaccessibility[J]. International Journal of Biological Macromolecules,2020,146:179−192. doi: 10.1016/j.ijbiomac.2019.12.251
[27] ZHAN X Y, DAI L, ZHANG L, et al. Entrapment of curcumin in whey protein isolate and zein composite nanoparticles using pH-driven method[J]. Food Hydrocolloids,2020,106:105839. doi: 10.1016/j.foodhyd.2020.105839
[28] MESSION J L, SOK N, ASSIFAOUI A, et al. Thermal denaturation of pea globulins (Pisum sativum L.)-molecular interactions leading to heat-induced protein aggregation[J]. Journal of Agricultural and Food Chemistry,2013,61(6):1196−1204. doi: 10.1021/jf303739n
[29] LIU W L, LIU W, YE A Q, et al. Environmental stress stability of microencapsules based on liposomes decorated with chitosan and sodium alginate[J]. Food Chemistry,2016,196:396−404. doi: 10.1016/j.foodchem.2015.09.050
[30] 陈霞, 姜晓雷, 李明达, 等. 离子强度和pH对大麦中热稳定蛋白稳定性的影响[J]. 食品工业科技,2010,31(12):87−89,175. [CHEN X, JIANG X L, LI M D, et al. Effect of ionic strength and pH on stability of heat-stable protein in the barley[J]. Science and Technology of Food Industry,2010,31(12):87−89,175.] CHEN X, JIANG X L, LI M D, et al. Effect of ionic strength and pH on stability of heat-stable protein in the barley[J]. Science and Technology of Food Industry, 2010, 31(12): 87−89,175.
[31] ARTS I C W, SESINK A L A, FAASSEN-PETERS M, et al. The type of sugar moiety is a major determinant of the small intestinal uptake and subsequent biliary excretion of dietary quercetin glycosides[J]. British Journal of Nutrition,2004,91(6):841−847. doi: 10.1079/BJN20041123
[32] ERLUND I, KOSONEN T, ALFTHAN G, et al. Pharmacokinetics of quercetin from quercetin aglycone and rutin in healthy volunteers[J]. European Journal of Clinical Pharmacology,2000,56(8):545−553. doi: 10.1007/s002280000197
[33] HOLLMAN P C H, KATAN M B. Dietary flavonoids:Intake, health effects and bioavailability[J]. Food and Chemical Toxicology,1999,37(9-10):937−942. doi: 10.1016/S0278-6915(99)00079-4
[34] NEMETH K, PLUMB G W, BERRIN J G, et al. Deglycosylation by small intestinal epithelial cell beta-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans[J]. European Journal of Nutrition,2003,42(1):29−42. doi: 10.1007/s00394-003-0397-3
[35] PENG S F, LI Z L, ZOU L Q, et al. Enhancement of curcumin bioavailability by encapsulation in sophorolipid-coated nanoparticles:An in vitro and in vivo study[J]. Journal of Agricultural and Food Chemistry,2018,66(6):1488−1497. doi: 10.1021/acs.jafc.7b05478
[36] PENG S F, LI Z L, ZOU L Q, et al. Improving curcumin solubility and bioavailability by encapsulation in saponin-coated curcumin nanoparticles prepared using a simple pH-driven loading method[J]. Food & Function,2018,9(3):1829−1839.
[37] FERNANDEZ G E, CARVAJAL L I, PEREZ G A. In vitro bioaccessibility assessment as a prediction tool of nutritional efficiency[J]. Nutrition Research,2009,29(11):751−760. doi: 10.1016/j.nutres.2009.09.016





 下载:
下载:

 下载:
下载:



