Functional Activity and Optimization of Synthesis Factors of Lignans from Phomopsis sp. XP-8 Assisted Eucommia ulmoides Oliv.
-
摘要: 对杜仲协同拟茎点霉XP-8生物合成松脂醇(Pinoresinol,Pin)、松脂醇单葡萄糖苷(Pinoresinol-4-O-β-D-glucopyranoside,PMG)和松脂醇二葡萄糖苷(Pinoresinol diglucoside,PDG)的条件进行优化,研究培养方式、杜仲添加量和静息处理时间对Pin、PMG和PDG产量的影响,并对相关产物的抗氧化性和抑癌性进行研究。结果表明,3%杜仲PDB培养基培养菌体并静息处理5 d时Pin、PMG和PDG产量较高。该条件下代谢产物液对DPPH和ABTS+自由基的清除能力显著高于杜仲空白培养基,说明发酵过程中产生了增强抗氧化功能的物质。其还能抑制肝癌细胞HepG-2的增殖,通过纯品验证活性说明,Pin是其中主要抑制癌细胞的活性成分,代谢产物液抑制肝癌细胞的作用是一种协同效应。Abstract: Optimization of process conditions for biosynthesis of pinoresinol (Pin), pinoresinol-4-O-β-D-glucopyranoside (PMG) and pinoresinol diglucoside (PDG) by Phomopsis sp. XP-8 assisted Eucommia ulmoides Oliv. was performed. The effects of the cultured method, the addition of Eucommia ulmoides Oliv. and the time of resting on the production of Pin, PMG and PDG by Phomopsis sp. XP-8 assisted Eucommia ulmoides Oliv. were studied. The antioxidative, anticancer properties of the related products were also investigated. The results showed that the optimal yield of Pin, PMG and PDG was obtained at the condition with the PDB medium contained 3% Eucommia ulmoides Oliv. with resting treatment for 5 d. Under the optimal condition, the free radical scavenging ability for DPPH and ABTS+ of metabolite liquid was significantly better than that of the blank culture medium. This indicated that the antioxidative substances were generated during the fermentation process. The hepatocellular carcinoma HepG-2 proliferation was suppressed by the extract solution. The pure product verifications of activity of the standard samples (Pin, PMG and PDG) were performed. It indicated that Pin was identified as the main active ingredient that suppressed HepG-2. The suppressed effect of the metabolite liquid on HepG-2 was a synergistic effect.
-
Keywords:
- lignans /
- Phomopsis sp. XP-8 /
- Eucommia ulmoides Oliv. /
- antioxidant activity /
- tumor suppressor
-
杜仲(Eucommia ulmoides Oliv.)是杜仲科杜仲属单种植物,我国重要的国家战略资源树种[1],含有丰富的生物活性化合物,因此具有较高的医药和经济价值。杜仲中有效成分有木脂素类、黄酮、萜类和多糖类等[2],其中木脂素是成分最明确、活性研究最多的一类化合物[3]。松脂醇((+)-pinoresinol,Pin)、松脂醇单葡萄糖苷((+)-pinoresinol-4-O-β-D-glucopyranoside,PMG)和松脂醇二葡萄糖苷((+)-1-pinoresinol 4,4′-di-O-β-D-glucopyranoside,PDG)均属于木脂素类,具有降血压、降血糖、调血脂和抑癌等药理功能[4−5]。获取木脂素的传统方法是利用杜仲的皮、叶进行提取[6],但由于杜仲资源稀缺、提取周期长、目标物含量低等原因使得该方法并不适用于木脂素工业化生产,并且也不符合特种植物资源保护及可持续发展要求。
微生物法合成植物功能性物质具有简单、便宜、天然、过程可控等优点,具有很好的应用前景[7]。近年来,从药用植物中分离的内生真菌能产生和宿主植株相同或相似的生物活性物质[8],如黄酮[9]、生物碱[10]等。仅Sih[11]报道通过海洋真菌(Caldariomyces fumage ATCC 16373)转化松伯醇合成Pin。前期研究发现,杜仲内生真菌拟茎点霉XP-8能够代谢合成Pin、PMG和PDG,但其天然产量较低,且经过多代纯化培养,目前菌种退化现象严重[12−15],PDG的产量急剧下降,和内生真菌F. solani结果一致[16],可能是缺乏关键酶、精确碱基难以合成生物活性物质或内生菌脱离寄主植物的稳定生存空间妨碍了关键酶等的活性,使产物难以合成[16−17],亟需采用一些方法恢复或提高其代谢产物的含量。
前期采用丁酸钠、杜仲、乙醇、共培养、静息体系等方法处理拟茎点霉XP-8,发现杜仲处理分别提高 PDG 和 PMG 产量 1.75 倍和 1.64 倍,但 Pin 的产量略有下降,qRT-PCR结果发现 4CL1、FLS1、FLS2 等苯丙烷和黄酮途径的基因均有不同程度的上调,而糖基转移酶基因GT-1,GT-2和CHS影响较小[15],可能是因为杜仲作为寄主能合成木脂素类,含有多种内生真菌合成代谢产物的前体或中间产物,为代谢产物的合成提供相应的物质或原微生存环境,可以提高内生真菌合成和药用植物相同的产物。本文从培养状态、培养时间、杜仲的添加量对杜仲促进拟茎点霉XP-8合成木脂素类物质条件进行优化,获得最佳Pin、PMG和PDG合成的方法,并以纯品为对照研究提取物的抗氧化性和抑癌活性,以期为内生真菌次生代谢产物产量的提高及拟茎点霉XP-8相关代谢产物的开发利用提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
杜仲药材 西安北大街老百姓大药房,西北工业大学生命学院生物医学工程系鉴定为杜仲科植物杜仲的干燥树皮;人体肝癌细胞株HepG-2 美国标准菌库;RPMI-1640培养基 美国Gibco公司;DMEM培养基 美国HyClone公司;AnnexinV-FITC凋亡检测试剂盒 碧云天生物技术研究所;PDG 纯度≥99%,中国食品药品检定研究院;PMG 纯度>98%,云南西力生物技术股份有限公司;Pin 纯度≥98%,上海源叶生物科技有限公司;甲醇、乙腈 均为色谱纯,美国Sigma公司;拟茎点霉XP-8 前期分离自杜仲皮,现保藏于中国典型微生物保藏中心,保藏号为Phomopsis sp. CCTCC M 209291;马铃薯葡萄糖琼脂培养基(PDA) 20%的马铃薯浸汁1000 mL中加入葡萄糖20 g和琼脂20 g,煮沸30 min,纱布过滤,滤液加水补至1000 mL,主要用于菌种的保藏和活化;马铃薯葡萄糖液体培养基(PDB) 除去不加入琼脂以外,其它组成与PDA相同,主要用于拟茎点霉XP-8种子液和生长细胞的培养;静息细胞培养液 15 g/L葡萄糖水溶液,115 ℃,灭菌15 min;杜仲PDB培养基 将杜仲皮用剪刀剪成约0.5 mm的小块,真空封存,常温干燥避光保存。称取5 g处理好的杜仲皮,加入到100 mL PDB培养基中,121 ℃灭菌20 min;CCK-8试剂盒 日本同仁化学研究所。
SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;SPX-300B-Ⅱ生化培养箱 上海跃进医疗器械厂;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;MS3750全自动高压灭菌锅 日本三洋公司;2695高效液相色谱仪(配有2996紫外检测器及Empower色谱工作站) 美国Waters公司;LX71倒置荧光显微镜 奥林巴斯株氏会社;BD FACSCalibur流式细胞仪 Biosciences公司;BioTek Synergy4多功能酶标仪 美国伯腾仪器。
1.2 实验方法
1.2.1 杜仲拟茎点霉XP-8合成木脂素类的条件优化
1.2.1.1 菌体培养体系对拟茎点霉XP-8代谢产物的影响
参考Zhu等[15]方法进行并略作调整,将拟茎点霉XP-8以5%接种量接种于5%杜仲PDB培养基,28 ℃、180 r/min的条件下恒温培养5 d,即为PDB体系;5%杜仲PDB条件下培养菌体,抽滤,菌体用灭菌蒸馏水清洗3次,加入15 g/L葡萄糖水溶液,28 ℃,120 r/min处理48 h,即为静息体系;以未接种拟茎点霉XP-8的5%杜仲PDB培养基为对照,研究培养体系对拟茎点霉XP-8合成Pin、PMG和PDG的影响。
1.2.1.2 杜仲添加量对拟茎点霉XP-8代谢产物的影响
以不同杜仲添加量(1%、3%、5%、7%、9%和11%)的PDB培养基培养菌体5 d后,经无菌水冲洗后转入静息培养体系培养2 d,以未接种拟茎点霉XP-8的不同杜仲添加量的PDB培养基为对照组[15],研究杜仲添加量对拟茎点霉XP-8合成Pin、PMG和PDG的影响。
1.2.1.3 静息培养时间对拟茎点霉XP-8代谢产物的影响
采用3%杜仲PDB培养基培养后的拟茎点霉XP-8菌体加入静息培养体系中[15],每隔1 d取一次样,考察静息培养时间(0~5 d)对拟茎点霉XP-8合成Pin、PMG和PDG的影响。
1.2.2 Pin、PMG和PDG的提取和检测
PDB、杜仲PDB、杜仲PDB+静息体系培养拟茎点霉XP-8 5 d后,用灭菌蒸馏水清洗3次,然后转入15 g/L的葡萄糖水溶液中静息处理5 d,取100 mL静息转化液,抽滤去除菌丝体,取发酵液30 mL,冷冻干燥至干,加入10 mL 50%色谱级甲醇的双蒸水溶液溶解,4 ℃静置过夜浸提后,28 ℃超声30 min进一步提取,氮吹仪浓缩至5 mL,经有机系滤膜(0.22 μm)过滤后即得代谢产物液。采用高效液相色谱法测定Pin、PMG和PDG产量[12]。
色谱柱:Shimadzu Wondasil C18柱(250×4.6 mm),二元梯度洗脱流动相A为乙腈,B为水。起始为5% A,95% B,保持10 min;10 min时调整A为20%,B为80%;20 min时A为70%,B为30%,保持20 min;40 min时A为10%,B为90%,保持20 min。总流速为1.0 mL/min,柱温30 ℃,检测波长分别为227 nm(PDG)、229 nm(PMG)和226 nm(Pin),结果以μg/L计。
1.2.3 代谢产物液体外抗氧化活性测定
1.2.3.1 最佳条件代谢产物液的提取
根据1.2.1优化的培养条件,采用3%杜仲PDB培养基培养拟茎点霉XP-8 5 d后,用灭菌蒸馏水清洗3次,然后转入15 g/L的葡萄糖水溶液中静息处理5 d,同1.2.2处理获得最佳条件代谢产物液,进行抗氧化实验和抑癌活性测定。
1.2.3.2 DPPH自由基清除能力
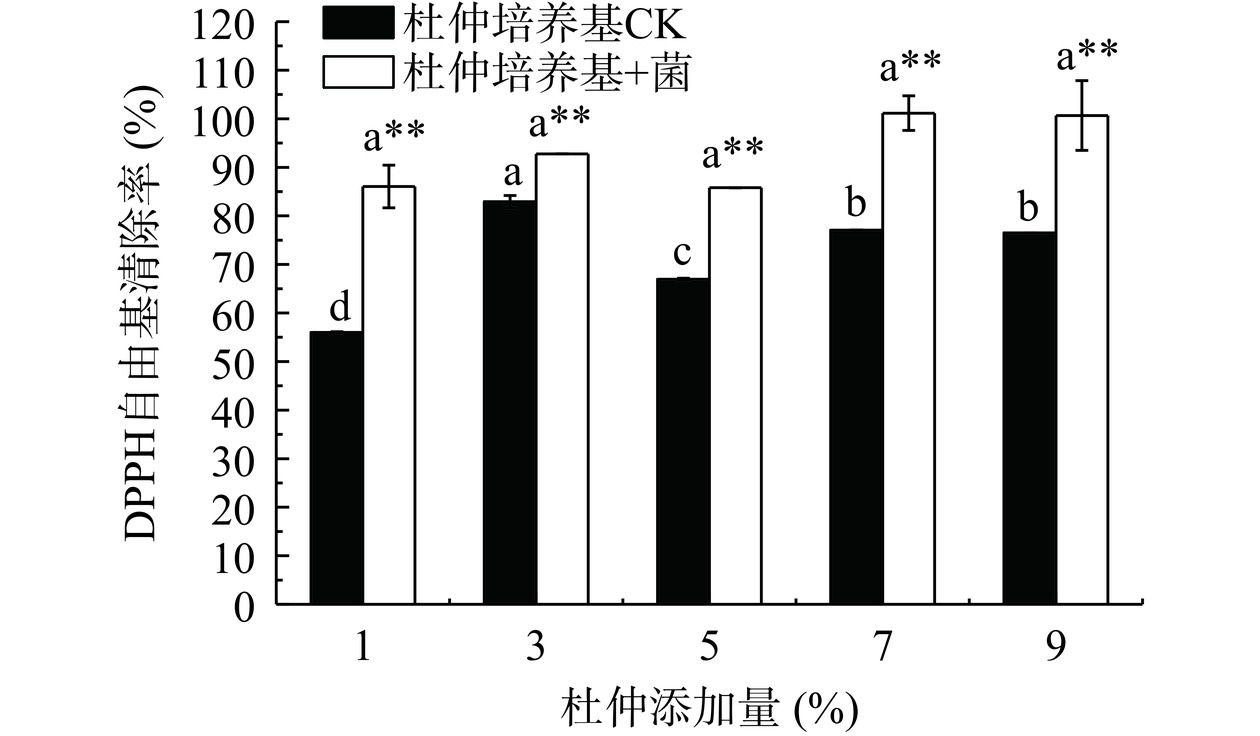
参考Lee等[18]的方法,稍作修改。吸取0.5 mL 6.0×10−5 mol/L的DPPH乙醇溶液加入到3.0 mL不同杜仲添加量(1%、3%、5%、7%、9%)的代谢产物液中,混匀后,25 ℃下水浴30 min,在517 nm波长处测定吸光值,按式(1)计算DPPH自由基清除率:
(1) 式中:A1为发酵液+DPPH自由基组吸光度;A0为空白组吸光度。
1.2.3.3 ABTS+自由基清除能力测定
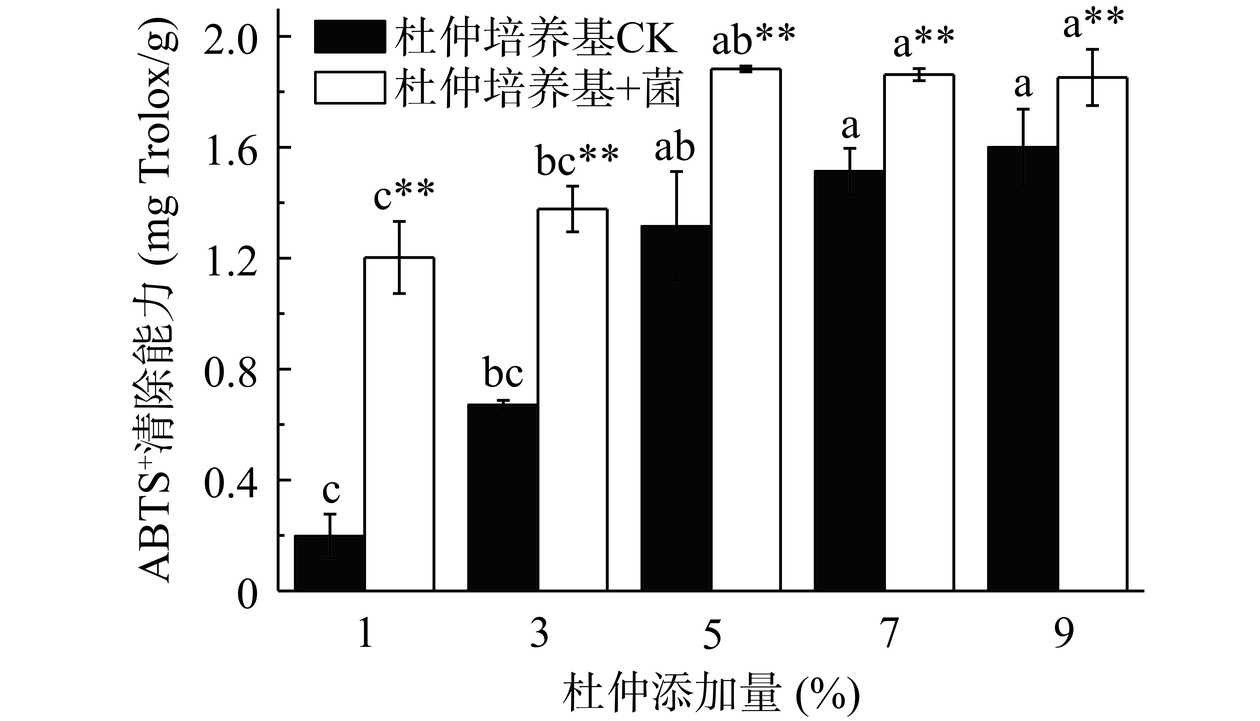
参考Yang等[19]的方法,稍作修改。称取38.4 mg ABTS粉末,使其溶于10 mL双蒸水中,得到7.00 mmol/L ABTS溶液。将ABTS溶液与1.34 g/L过硫酸钾溶液等体积混合,在室温避光反应12 h得到ABTS+自由基溶液,临用前用双蒸水稀释40倍制成ABTS+自由基工作液。在不同杜仲添加量的代谢产物液中加入等体积ABTS+自由基工作溶液,室温反应10 min后在734 nm波长处测定吸光度。用100~1000 μmol/L的Trolox制作标准曲线,将发酵液测定管测得的OD值代入标准曲线y=0.6621x+1.8736(R2=0.99916)中,求得结果,结果以每克干质量样品中Trolox质量表示(mg Trolox/g)。
1.2.4 代谢产物液抑癌活性测定
1.2.4.1 细胞培养
人体肝癌细胞HepG-2的培养采用RPMI-1640培养基(含10%胎牛血清,10 mmol/L非必需氨基酸,100 IU/mL青霉素和100 mg/mL链霉素),在37 ℃、5% CO2条件下进行培养,取对数生长期细胞用于后续实验。
1.2.4.2 CCK-8试剂盒检测代谢产物液对癌细胞增殖的影响
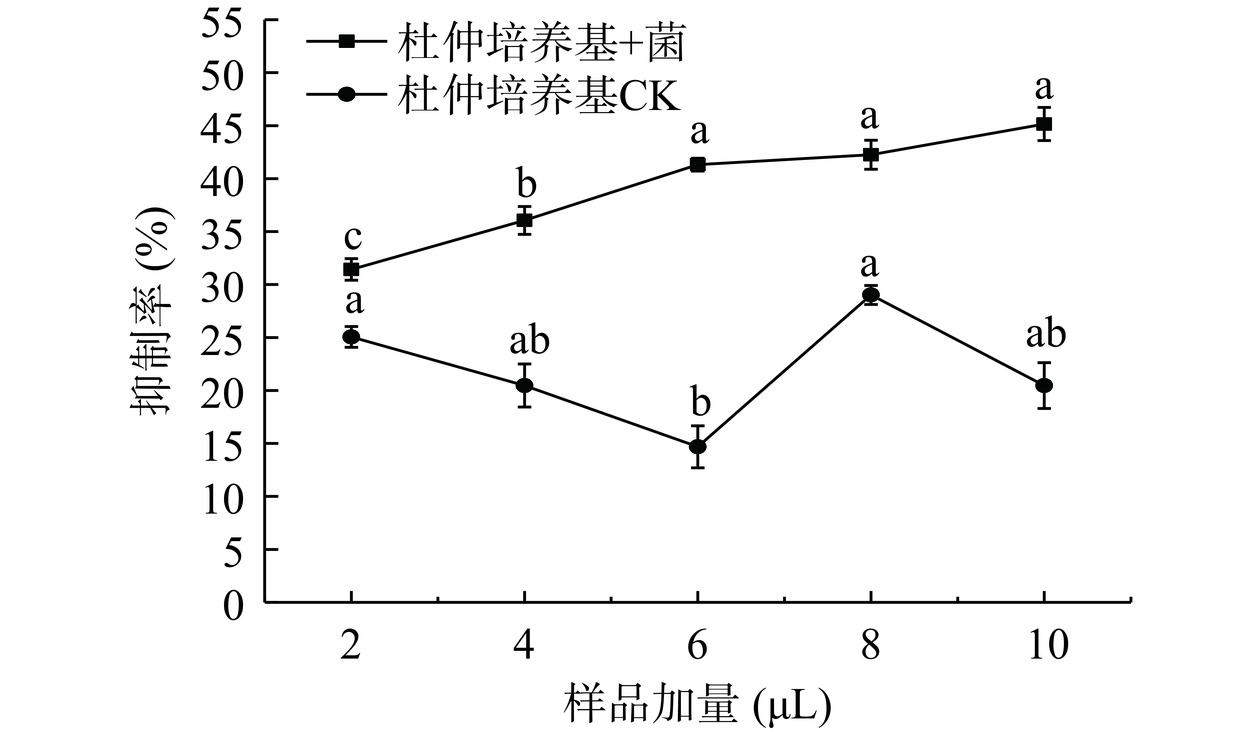
分别将癌细胞悬浮液接种到96孔板中,调整细胞密度为1×104个/孔,200 μL/孔,再分别加入2、4、6、8、10 μL代谢产物液,于二氧化碳培养箱中37 ℃,5% CO2条件下培养2 d,以等体积的50%乙醇水的处理组为对照。培养结束后,每孔加入20 μL CCK-8试剂盒试剂。之后放入二氧化碳培养箱中37 ℃,5% CO2条件下培养2 h后将96孔板放入酶标仪中在450 nm下读取OD值。细胞抑制率按式(2)计算:
(2) 式中:A3为样品组OD值;A4为空白组OD值。
1.2.4.3 流式细胞仪检测代谢产物液对癌细胞凋亡的影响
取对数生长期的HepG-2细胞接种至24孔培养板中(5×105个/孔),使细胞贴壁生长后弃去原培养液,分别加入代谢产物液,终浓度为5%,对照组中加入等量的50%乙醇水,置于37 ℃,含5% CO2培养箱中2 d后于4 ℃下1000 r/min离心5 min收集细胞。用PBS缓冲液冲洗3次并调整细胞浓度为2×106/mL,加入预冷的75%的乙醇−20 ℃下固定过夜,RNA酶处理10 min,碘化丙锭在4 ℃下染色1 h。以未处理的HepG-2细胞作为对照。
1.2.4.4 倒置显微镜观察代谢产物液对细胞形态的影响
同1.2.4.2操作,细胞经1%、3%、5%、7%、9%杜仲培养基代谢产物液处理后,采用倒置显微镜观察细胞的形态变化,并拍照。
1.3 数据处理
全部实验数据均重复3次,实验结果以平均值±标准偏差表示。数据结果使用DPS(version 6.55)软件进行显著性分析,具体选用事后比较中假定方差齐性为Tukey test。采用Origin 2018软件作图。
2. 结果与分析
2.1 菌体培养体系对拟茎点霉XP-8代谢产物的影响
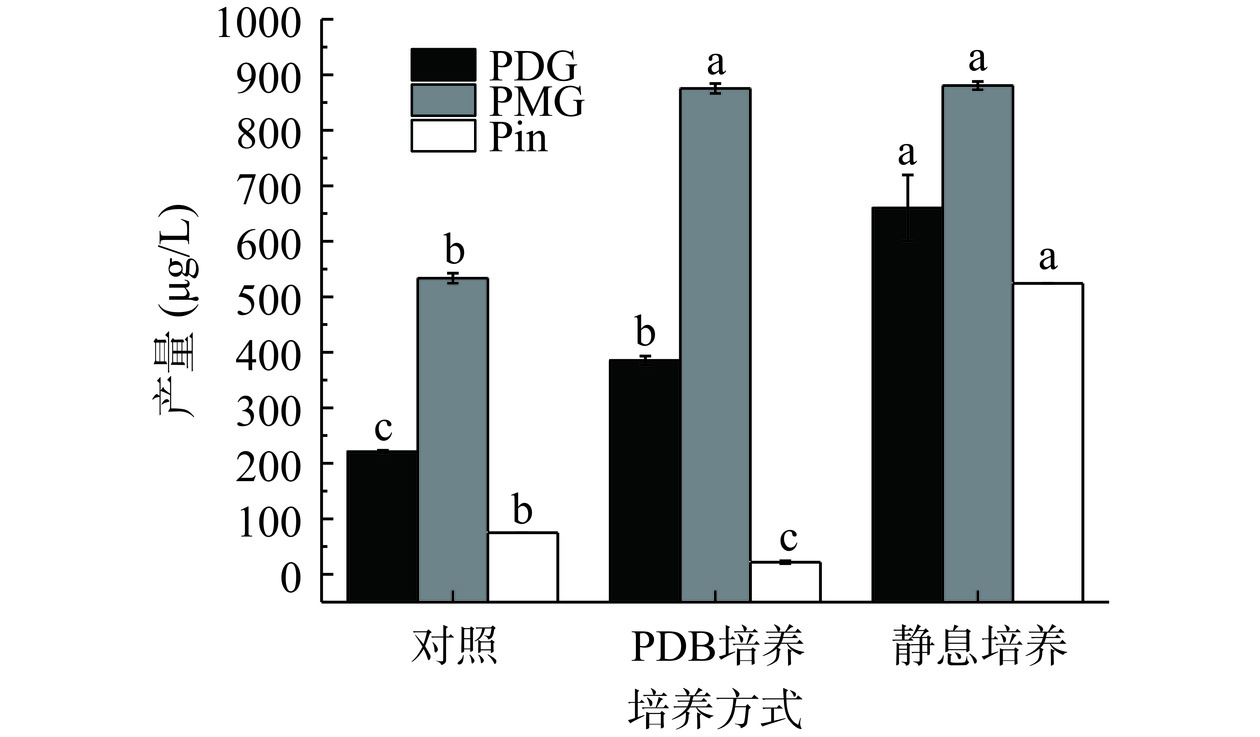
PDB和静息条件对拟茎点霉XP-8合成Pin、PDG和PMG产量的影响见图1。由图1可知拟茎点霉XP-8经PDB体系和静息体系处理后,木脂素类物质合成能力均比对照组显著提高(P<0.05)。PDB体系和静息体系PDG产量分别为385.32和659.93 μg/L,与对照组相比提高了0.74和1.99倍;PMG产量分别为875.34和880.50 μg/L,与对照组相比提高了0.64和0.65倍;Pin产量分别为21.87和524.15 μg/L,前者与对照组相比降低了71%,后者提高了5.99倍。静息体系处理后,Pin、PMG和PDG的产量较5%杜仲PDB培养的产量高,所以后续实验采用5%杜仲PDB培养基培养菌体5 d,然后清洗后转入静息体系处理2 d。静息体系排除了菌体生长对次生代谢产物的影响,由于缺乏大量细胞生长所必需的营养成分,细胞生长缓慢,但因其含有代谢过程的各种酶类,仍然能够执行产物转化的功能,其实质就是利用菌体细胞的酶类进行催化反应,生成目标产物[20−21]。
2.2 杜仲添加量对拟茎点霉XP-8代谢产物的影响
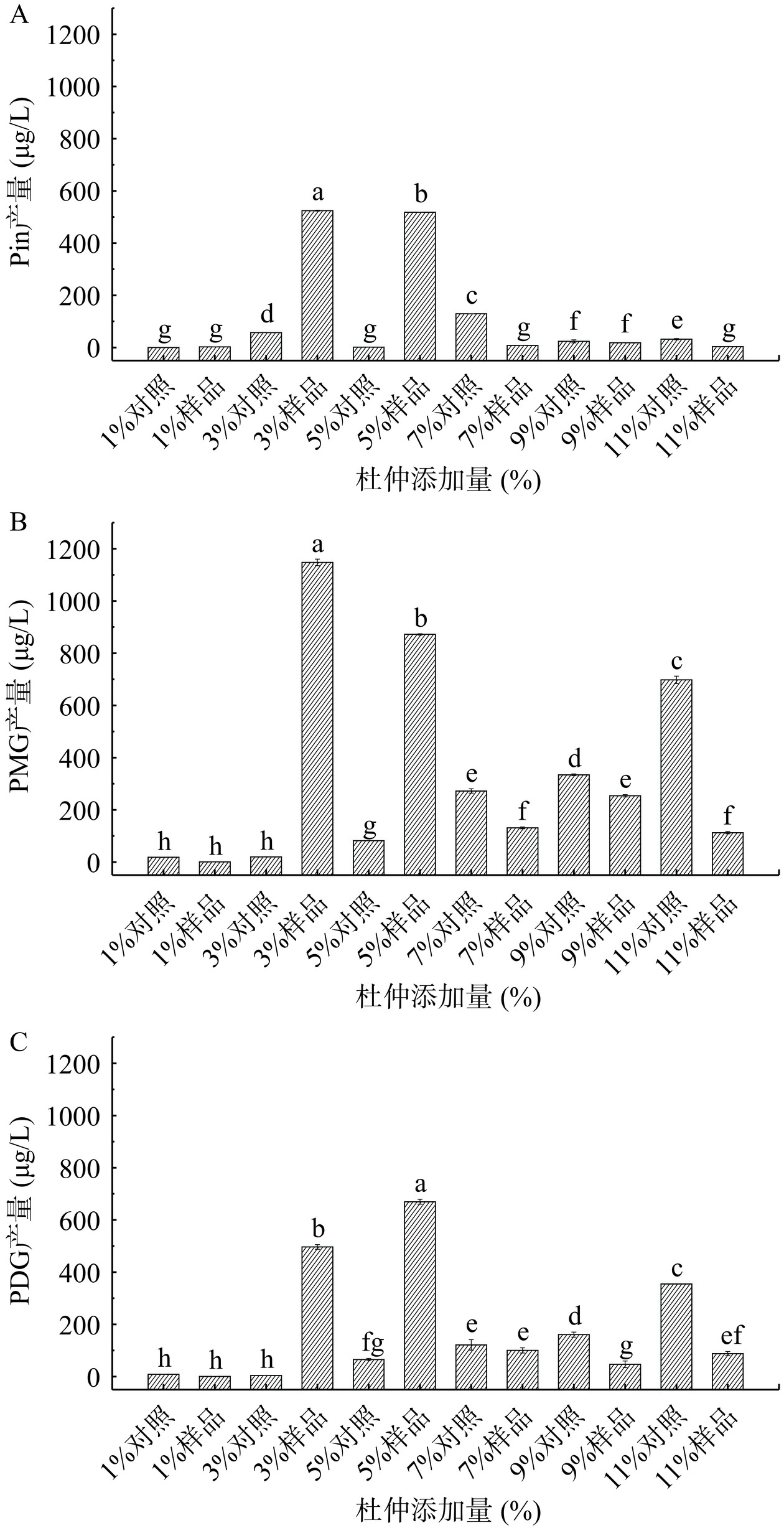
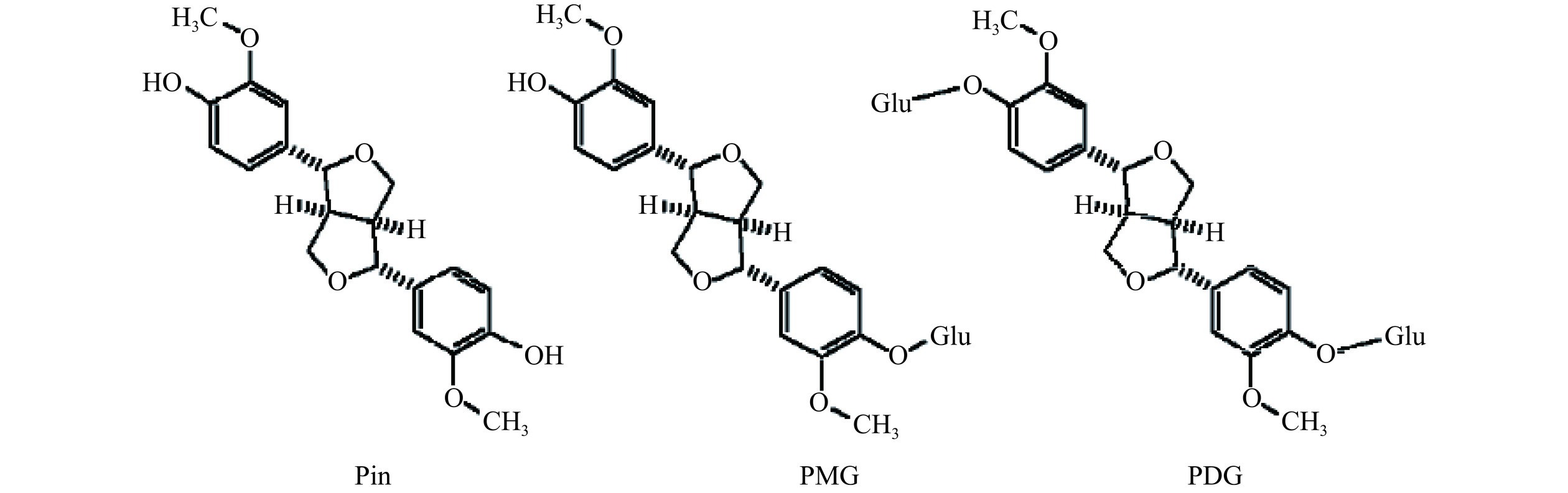
杜仲添加量对Pin、PDG和PMG产量的影响见图2。由图2可知,当杜仲添加量为3%时,样品中Pin、PMG和PDG的产量显著升高(P<0.05),分别为524.35、1147.8和496.60 μg/L,较对照提高了8.15、56.16和117.2倍;当杜仲添加量为5%时,样品中Pin、PMG和PDG的产量分别为517.84、871.91和669.63 μg/L,此时PDG的产量较3%时高,但PMG的产量显著降低(P<0.05)。如图3所示,PMG是在Pin的结构上增加了一个糖基,PDG是在Pin的基础上增加了两个糖基,PMG可以向PDG转化。当杜仲添加量分别为7%、9%、11%时,Pin、PMG和PDG的产量呈下降趋势,这可能是因为菌体受到杜仲成分的影响,产生吸附作用,生长量较差,后续还需要进一步研究确定具体原因。综上结果并出于经济考虑,杜仲添加量为3%。
本文发现在PDB培养基中添加杜仲可以提高Pin、PDG和PMG的含量。相关研究发现,滑桃树种子提取物能促进内生菌Streptomyces sp. WXC的次级代谢,使其全面上调,其中包括活性代谢产物富伦菌素B,其也可通过诱导活性化合物生物合成基因的表达,从而提高富伦菌素B的产量[22]。植物提取物对内生菌生长和代谢方面的影响,很可能是内生菌对植物宿主长期适应的结果[23]。
2.3 静息培养时间对拟茎点霉XP-8代谢产物的影响
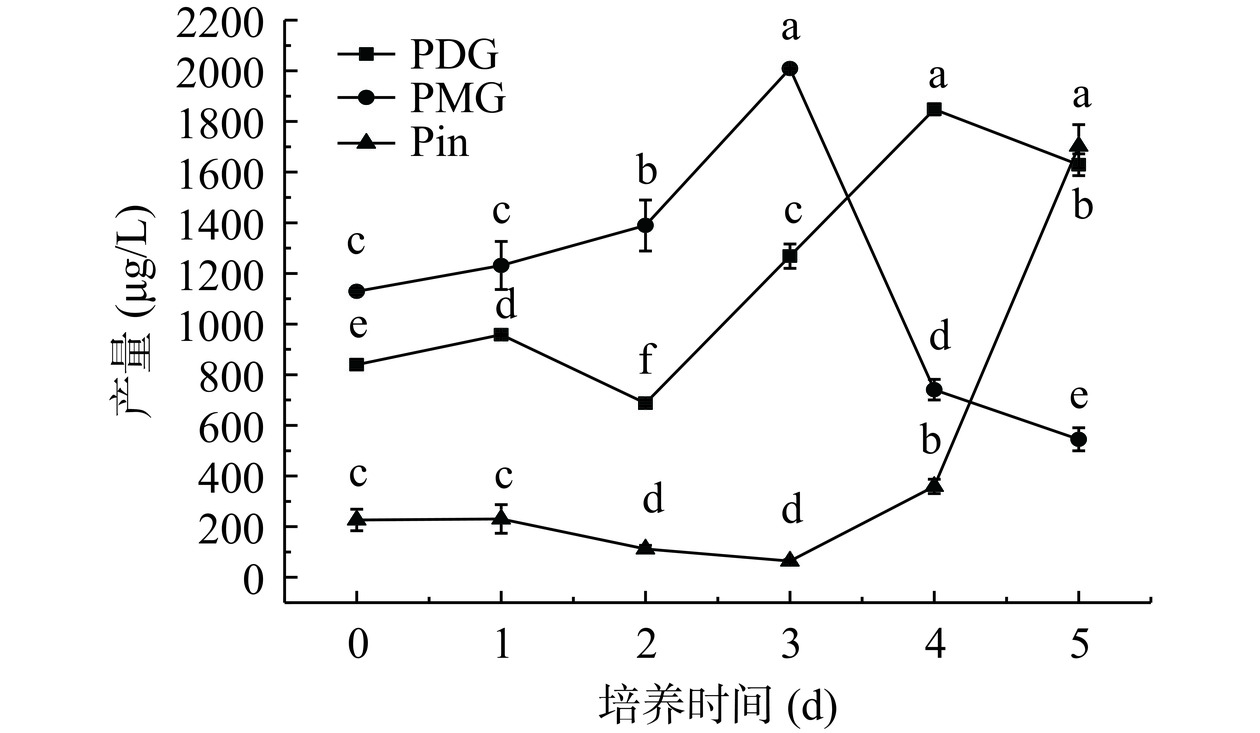
静息培养时间对Pin、PDG和PMG产量的影响见图4。由图4可知,随着培养时间延长,PMG整体呈先增高后下降的趋势,第3 d时PMG的含量最高为2008.74 μg/L;PDG呈先上升后下降再上升后下降的趋势,第4 d时PDG的含量最高为1847.72 μg/L;Pin呈先略微下降后升高的趋势,较高产量出现在第5 d,产量达到1702.56 μg/L。PMG、PDG和Pin分别在第3 d、4 d和第5 d达到最大值,但静息培养5 d时,PDG和Pin产量较高,后续采用静息培养时间为5 d进行相关研究。目前关于杜仲内生菌产木脂素类的研究较少,主要针对PDG展开,本课题组前期对拟茎点霉属菌株XP-8进行了培养条件优化,PDG产量可达30 mg/L[24],随着菌种传代,菌种退化情况严重,通过本实验培养条件的优化可一定程度上恢复拟茎点霉属菌株XP-8产PDG的产量,并且同时提高Pin和PMG的产量。
综上所述,采用添加3%杜仲PDB培养基培养菌体并静息处理5 d的代谢产物液进行后续实验。
2.4 代谢产物液体外抗氧化活性
过量的自由基会加速机体的氧化衰老,因此自由基清除能力是评价抗氧化活性的重要指标[25]。DPPH是一种以氮为中心的自由基,抗氧化剂可以传递氢原子或转移电子给DPPH来中和其自由基,故对DPPH自由基的清除能力能够反映抗氧化剂的供氢能力[26]。不同杜仲添加量的代谢产物液对DPPH自由基的清除能力如图5所示。加入菌体培养的杜仲代谢产物液对DPPH自由基的清除能力较强,且极显著高于未加菌体组(P<0.01)。除3%杜仲添加量组,随着杜仲添加量的提高,代谢产物液对DPPH自由基的清除率呈先增后缓的趋势,这可能是由于在该杜仲添加量下,其木脂素类产量高于其他浓度,对DPPH自由基的清除率有一定影响,与姜侃等[27]的报道一致,华中五味子根部木脂素类化合物具有较强的抗氧化活性。在生长过程及抽滤时发现,7%和9%杜仲加量对拟茎点霉XP-8的生长有一定的抑制,因此后期对DPPH自由基的清除率出现平缓的趋势,与胡杨等[28]的报道一致,杜仲成分具有抑菌作用。
ABTS+是一种比较稳定的自由基,抗氧化剂可以与ABTS+结合,引起颜色变化[29]。由图6可知,杜仲与拟茎点霉菌XP-8共同培养可显著提高代谢产物液的ABTS+自由基清除能力,且随着杜仲添加量的增加,代谢产物液的ABTS+自由基清除能力呈现先增后缓的趋势,5%杜仲培养基发酵后的代谢产物液的抗氧化能力最强,之后趋于平缓,无极显著性差异(P>0.01),这可能是由于菌体在7%和9%杜仲培养基中的生长受到一定的抑制,ABTS+自由基的清除能力趋于平缓。
本文发现代谢产物液对DPPH自由基和ABTS+自由基的清除能力显著高于空白组,说明其发酵过程中产生了增强抗氧化功能的次级代谢产物。相关研究表明,药用植物内生菌可以生成具有较强抗氧化活性的次级代谢产物[30]。已有研究指出,拟茎点霉菌发酵过程中会生成相应次级代谢产物,具有较强的DPPH自由基、ABTS+自由基清除能力[31]。
2.5 代谢产物液对HepG-2细胞增殖的影响
根据1.2.3.1的方法处理获得代谢产物液,根据1.2.2的方法检测并计算Pin、PMG和PDG的含量,分别为2117.93、109.33和3383.01 μg/L。此代谢产物液后续用于HepG2肝癌细胞的处理。
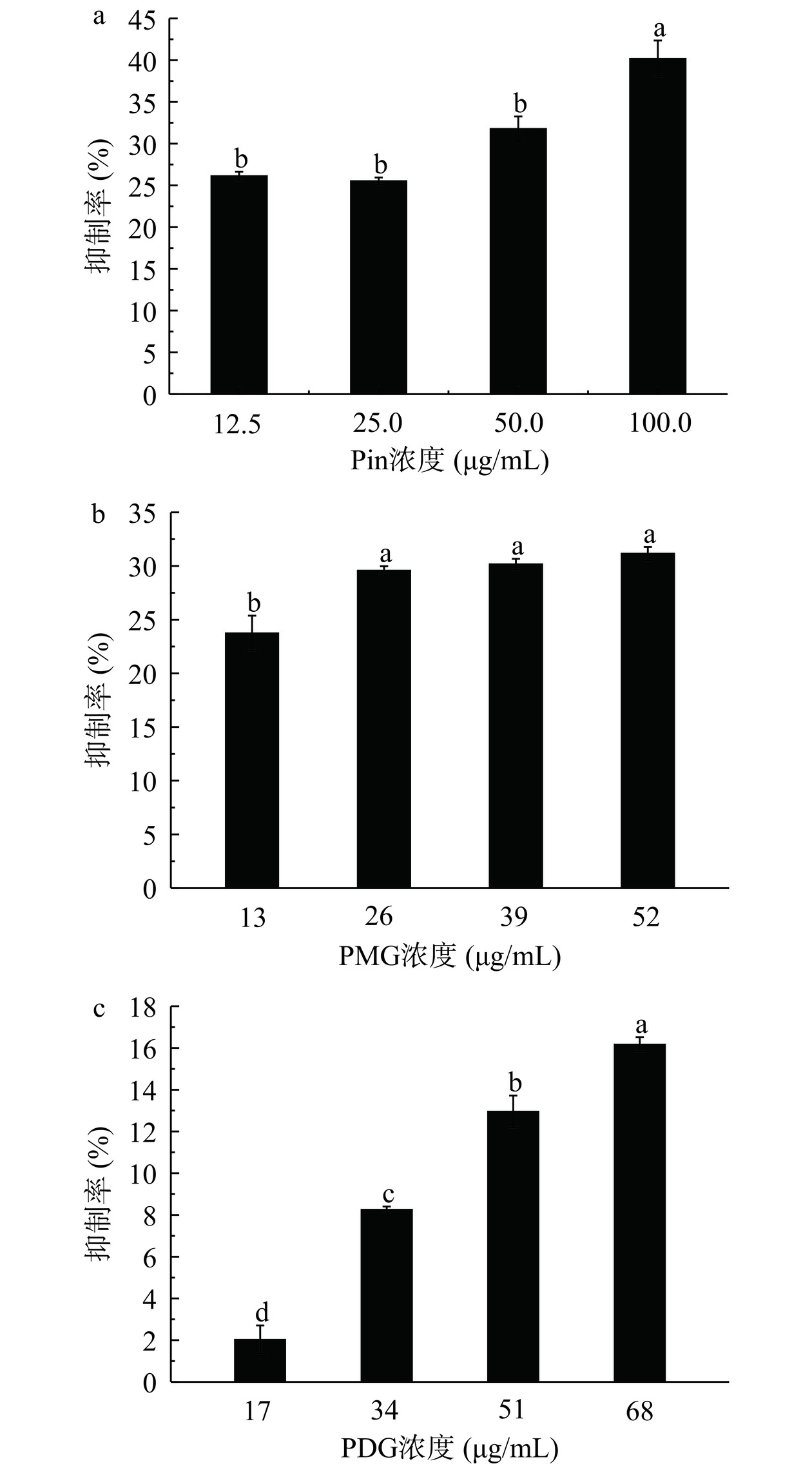
如图7所示,HepG-2细胞对杜仲菌体发酵代谢产物液的敏感程度要高于对照组。代谢产物液中有效抑制癌细胞的物质和癌细胞抑制率有一定的浓度依赖性,但对照组没有此依赖性。当加入2 μL代谢产物液其对HepG-2细胞的抑制率为31.43%,是对照抑制率的1.25倍;而提高到10 μL时,抑制率提高至45.15%,是对照抑制率的2.2倍。Pin、PMG和PDG标准品对HepG-2细胞的抑制率如图8所示,Pin和PMG对HepG-2细胞的抑制效果较明显,其中Pin呈现出和样品加量正相关的趋势,当PMG浓度高于13 μg/mL后,其对HepG-2细胞的抑制率基本保持不变,无浓度依赖性。而PDG对HepG-2细胞的抑制能力呈一定剂量依赖性,但弱于Pin和PMG,代谢产物液对细胞的增殖作用应该是以Pin为主的协同效应。
![]() 图 7 代谢产物液对HepG-2癌细胞活力的影响注:不同小写字母表示差异显著,P<0.05;图8同。Figure 7. Effect of metabolite liquid on the viability of HepG-2 cancer cells
图 7 代谢产物液对HepG-2癌细胞活力的影响注:不同小写字母表示差异显著,P<0.05;图8同。Figure 7. Effect of metabolite liquid on the viability of HepG-2 cancer cells2.6 代谢产物液对HepG-2细胞周期及凋亡的影响
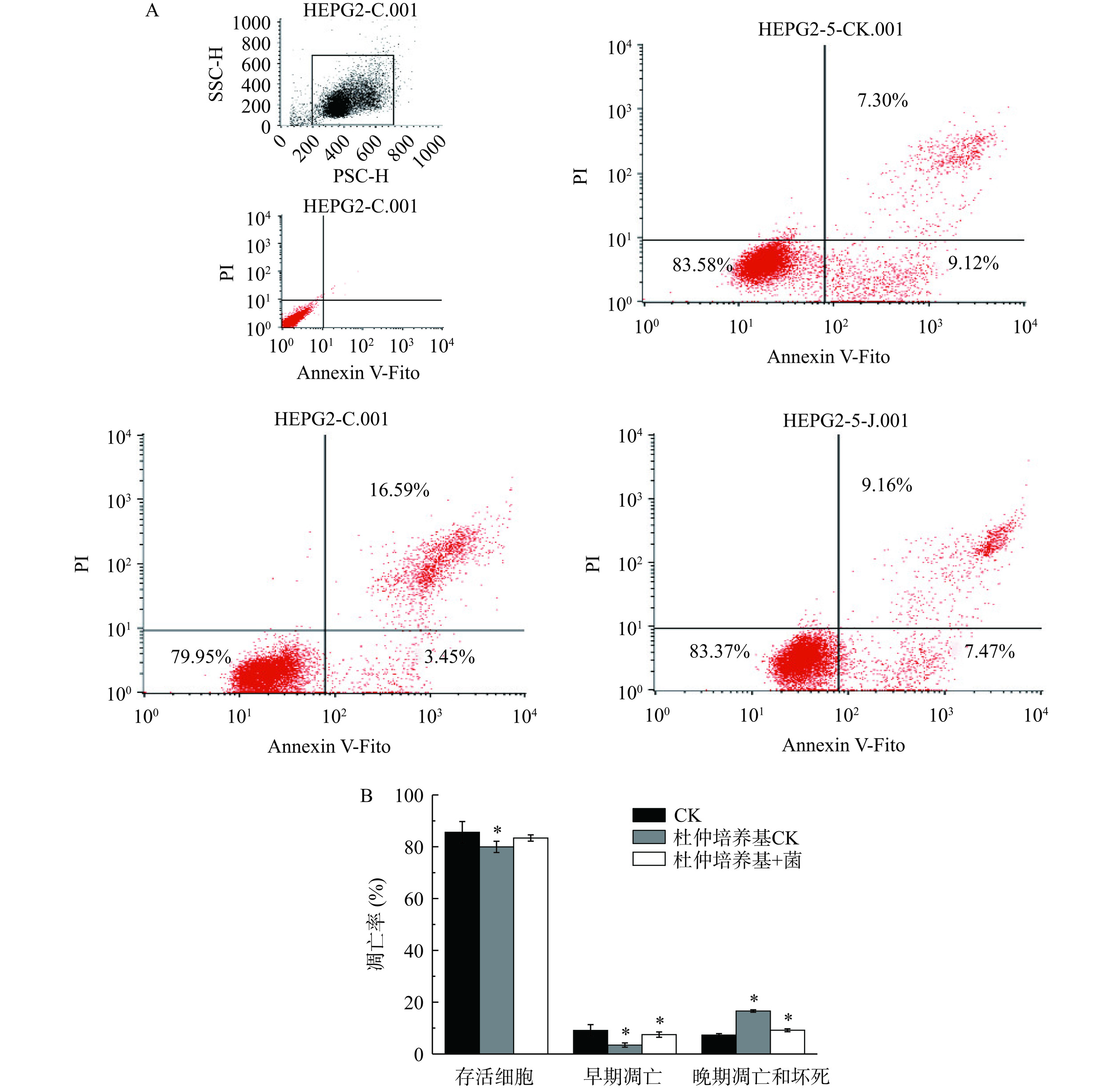
用不同方式处理HepG-2细胞2 d后收集细胞,在流式细胞仪中测定细胞凋亡情形,结果如图9所示,代谢产物液对肝癌细胞HepG-2的细胞周期和细胞凋亡有显著影响(P<0.05)。
2.7 代谢产物液对HepG-2细胞形态的影响
培养2 d贴壁的HepG-2细胞,经过代谢产物液处理后如图10所示,代谢产物液不仅抑制了细胞的生长也影响了细胞的数量,并且改变了细胞的形态,由不规则形状转变为圆形或椭圆形。当杜仲含量为1%~5%时,杜仲加菌培养后对HepG-2细胞的作用更强,当杜仲含量超过5%时,可能由于菌体生长受到抑制,对照杜仲培养组和杜仲菌体培养组的细胞形态差异不大。本文发现代谢产物液对HepG-2细胞的增殖具有较强的抑制作用,利用代谢产物液中主要检测到的单品Pin、PMG和PDG作用HepG-2时发现,Pin对其抑制作用最强,PDG最弱,代谢产物液对细胞的增殖作用应该是以Pin为主的协同效应。作为结构最简单的木脂素类化合物,Pin具有多种生物活性。Pin对于人体肠道Caco-2细胞具有非常强的抗炎活性[32],还有研究报道了其对脂多糖激活小胶质细胞相似的活性[33]。Sepporta等[34]发现,Pin对人体HL-60白血病细胞生长与诱导分化有一定的抑制活性。此外,木脂素类物质还具有抑制前列腺癌[35]、白血病[36]和乳腺癌[37]等生物活性。
3. 结论
本文发现3%杜仲PDB培养基培养菌体并静息处理3 d,PMG产量最高可达2008.74 μg/L,第4 d时PDG产量最高可达1847.72 μg/L,第5 d时Pin产量可达1702.56 μg/L,但静息培养5 d时,PDG和Pin产量较高,选择静息培养时间为5 d时获得的代谢产物液进行抗氧化及抑癌活性研究。代谢产物液对DPPH自由基和ABTS阳离子自由基的清除能力显著高于空白组,说明其发酵过程中产生了增强抗氧化功能的次级代谢产物。代谢产物液对HepG-2细胞的增殖具有较强的抑制作用,利用代谢产物液中主要检测到的单品Pin、PMG和PDG作用HepG-2时发现,Pin对其抑制作用最强,PDG最弱,代谢产物液对细胞的增殖作用应该是以Pin为主的协同效应。
综上所述,拟茎点霉XP-8的杜仲发酵代谢产物液具有被开发为新型抗肿瘤药物的潜力,在抑制或治疗肝癌等癌症方面有一定效果。在此研究的基础上,未来需要继续探究杜仲处理后拟茎点霉XP-8的代谢产物的抑癌作用机制,扩大其在食品工业中的应用范围。
-
图 7 代谢产物液对HepG-2癌细胞活力的影响
注:不同小写字母表示差异显著,P<0.05;图8同。
Figure 7. Effect of metabolite liquid on the viability of HepG-2 cancer cells
-
[1] 刘辰露, 钟健, 庆军, 等. 杜仲F1代叶片性状变异及杂种优势[J]. 经济林研究,2023,41(1):225−235. [LIU C L, ZHONG J, QING J, et al. Leaf phenotypic variation and heterosis of F1 generation of Eucommia ulmoides[J]. Non-wood Forest Research,2023,41(1):225−235.] LIU C L, ZHONG J, QING J, et al. Leaf phenotypic variation and heterosis of F1 generation of Eucommia ulmoides[J]. Non-wood Forest Research, 2023, 41(1): 225−235.
[2] HUANG W X, DING L Q, ZHANG N, et al. Flavonoids from Eucommia ulmoides and their in vitro hepatoprotective activities[J]. Natural Product Research,2021,35(21):3584−3591. doi: 10.1080/14786419.2020.1715402
[3] 黄玲, 苏彦红, 蒋跃平, 等. 杜仲皮中木脂素类化学成分及其对高糖诱导的肾小球系膜细胞保护作用研究[J]. 天然产物研究与开发,2023,35(3):405−409,419. [HUANG L, SU Y H, JIANG Y P, et al. Lignans from Eucommia ulmoides barks and their protective effect on high-glucose-stimulated human renal mesangial cells[J]. Natural Product Research and Development,2023,35(3):405−409,419.] HUANG L, SU Y H, JIANG Y P, et al. Lignans from Eucommia ulmoides barks and their protective effect on high-glucose-stimulated human renal mesangial cells[J]. Natural Product Research and Development, 2023, 35(3): 405−409,419.
[4] LIU Ban, LI Chaopeng, WANG Wenqi, et al. Lignans extracted from Eucommia Ulmoides Oliv. protects against ages-induced retinal endothelial cell injury[J]. Cellular Physiology and Biochemistry,2016,39(5):2044−2054. doi: 10.1159/000447900
[5] LI Ling, YAN Jin, HU Kai, et al. Protective effects of Eucommia lignans against hypertensive renal injury by inhibiting expression of aldose reductase[J]. Journal of Ethnopharmacology,2012,139(2):454−461. doi: 10.1016/j.jep.2011.11.032
[6] 陈晓青, 李宇萍, 彭密军, 等. 杜仲中松脂醇二葡萄糖甙的提纯[J]. 中南工业大学学报:自然科学版,2003,34(3):262−265. [CHEN X Q, LI Y P, PENG M J, et al. The extraction and purification of pinoresinol diglucoside in Eucommia ulmoide oliver[J]. Journal of Central South University (Science and Technology),2003,34(3):262−265.] CHEN X Q, LI Y P, PENG M J, et al. The extraction and purification of pinoresinol diglucoside in Eucommia ulmoide oliver[J]. Journal of Central South University (Science and Technology), 2003, 34(3): 262−265.
[7] ZOU X Y, GUO L X, HUANG L L, et al. Pathway construction and metabolic engineering for fermentative production of β-alanine in Escherichia coli[J]. Applied Microbiology and Biotechnology,2020,104(6):2545−2559. doi: 10.1007/s00253-020-10359-8
[8] KAUL S, GUPTA S, AHMED M, et al. Endophytic fungi from medicinal plants:A treasure hunt for bioactive metabolites[J]. Phytochemistry Reviews,2012,11(4):487−505. doi: 10.1007/s11101-012-9260-6
[9] 程庭峰, 吕东晋, 王环, 等. 麻花艽产黄酮类物质内生真菌的分离与鉴定及抗氧化活性分析[J]. 分子植物育种,2022,20(19):6541−6549. [CHENG T F, LÜ D J, WANG H, et al. Isolation, identification and antioxidant activity of endophytic fungi producing flavonoids from Gentiana straminea Maxim J]. Molecular Plant Breeding,2022,20(19):6541−6549.
[10] 金婧. 产喹诺里西啶生物碱苦豆子内生真菌的筛选与产碱条件的优化[D]. 银川:宁夏大学, 2022:5−8. [JIN J. Screening and optimization of alkaloid-producing endophytic fungi of Sophora alopecuroides L. for quinolizidine alkaloids[D]. Yinchuan:Ningxia University, 2022:5−8.] JIN J. Screening and optimization of alkaloid-producing endophytic fungi of Sophora alopecuroides L. for quinolizidine alkaloids[D]. Yinchuan: Ningxia University, 2022: 5−8.
[11] SIH C J. Glycosides of 2,6-bis(hydroxy-phenyl)-3,7-dioxabicyclo [3,3,0] octane:US05/688275[P]. 1978-07-25[2023-07-14].
[12] ZHANG Y, SHI J L, LIU L P, et al. Bioconversion of pinoresinol diglucoside and pinoresinol from substrates in the phenylpropanoid pathway by resting cells of Phomopsis sp. XP-8[J]. PLoS One,2015,10:e0137066. doi: 10.1371/journal.pone.0137066
[13] ZHANG Y, SHI J, GAO Z, et al. Comparison of pinoresinol diglucoside production by Phomopsis sp. XP-8 in different media and the characterisation and product profiles of the cultivation in mung bean[J]. Journal of the Science of Food & Agriculture,2015,99:4629−4643.
[14] SHI J L, LIU C, LIU L, et al. Structure identification and fermentation characteristics of pinoresinol diglucoside produced by Phomopsis sp. isolated from Eucommia ulmoides Oliv[J]. Applied Microbiology and Biotechnology,2012,93(4):1475−1483. doi: 10.1007/s00253-011-3613-8
[15] ZHU Jing, LU Yan, XU Xiaoguang, et al. Strategies to enhance the production of pinoresinol and its glucosides by endophytic fungus (Phomopsis sp. XP-8) isolated from Tu-chung bark[J]. AMB Express,2018,8(1):55. doi: 10.1186/s13568-018-0584-5
[16] KUSARI S, SEBASTIAN Z, SPITELLER M. Effect of artificial reconstitution of the interaction between the plant Camptotheca acuminata and the fungal endophyte Fusarium solani on camptothecin biosynthesis[J]. Journal of Natural Products,2011,74(4):764−75. doi: 10.1021/np1008398
[17] SACHIN N, MANJUNATHA B L, MOHANA K P, et al. Do endophytic fungi possess pathway genes for plant secondary metabolites?[J]. Current Science,2013,104(2):178−182.
[18] LEE M C, HUANG Y C. Soluble eggshell membrane protein-loaded chitosan/fucoidan nanoparticles for treatment of defective intestinal epithelial cells[J]. International Journal of Biological Macromolecules,2019,131:949−958. doi: 10.1016/j.ijbiomac.2019.03.113
[19] YANG Qian, CAI Xixi, YAN Ana, et al. A specific antioxidant peptide:Its properties in controlling oxidation and possible action mechanism[J]. Food Chemistry,2020,327:126984. doi: 10.1016/j.foodchem.2020.126984
[20] 郭前婉, 彭舒悦, 王晨晨, 等. 10-羟基-12-十八碳烯酸的静息细胞合成[J]. 中国食品学报,2022,22(12):144−152. [GUO Q W, PENG S Y, WANG C C, et al. Resting cell biosynthesis of 10-hydroxy-12-octadecenoic acid[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(12):144−152.] GUO Q W, PENG S Y, WANG C C, et al. Resting cell biosynthesis of 10-hydroxy-12-octadecenoic acid[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(12): 144−152.
[21] ZHANG Y, SONG L, GAO Q, et al. The two-step biotransformation f monosodium glutamate to GABA by Lactobacillus brevis growing and resting cells[J]. Applied Microbiology and Biotechnology,2012,94(6):1619−162. doi: 10.1007/s00253-012-3868-8
[22] 吴欣. 滑桃树种子化学成分对其内生菌WXC的影响及植物愈伤-内生菌WXE的共培养[D]. 厦门:厦门大学, 2009:106−127. [WU X. The influence of chemical components of Trewia nudiflora seed on its endophyte WXC and the co-culture of plant callus and its endophyte WXE[D]. Xiamen:Xiamen University, 2009:106−127.] WU X. The influence of chemical components of Trewia nudiflora seed on its endophyte WXC and the co-culture of plant callus and its endophyte WXE[D]. Xiamen: Xiamen University, 2009: 106−127.
[23] SHUDO E, IWASA Y. Inducible defense against pathogens and parasites:Optimal choice among multiple options[J]. Journal of Theoretical Biology,2001,209(2):233−247. doi: 10.1006/jtbi.2000.2259
[24] 王维, 师俊玲, 杨保伟. 茎点菌属产松脂醇二葡萄糖苷的培养条件优化[J]. 农业工程学报,2008(6):287−290. [WANG W, SHI J L, YANG B W. Optimization of conditions for production of pinoresinol diglucoside by a strain of Phoma sp doi: 10.3321/j.issn:1002-6819.2008.06.061 J]. Transactions of the Chinese Society of Agricultural Engineering,2008(6):287−290. doi: 10.3321/j.issn:1002-6819.2008.06.061
[25] GULCIN İ. Antioxidants and antioxidant methods:An updated overview[J]. Archives of Toxicology,2020,94(3):651−715. doi: 10.1007/s00204-020-02689-3
[26] NAIK G H, PRIYADARSINI K I, SATAV J G, et al. Comparative antioxidant activity of individual herbal components used in Ayurvedic medicine[J]. Phytochemistry,2002,63(1):97−104.
[27] 姜侃, 郭晔红. 华中五味子根部木脂素类化学成分及其抗氧化活性研究[J]. 中草药,2022,53(21):6666−6673. [JIANG N, GUO Y H. Lignans chemical constituents of roots of Schisandra sphenanthera and their anti-oxidative effects[J]. Chinese Traditional and Herbal Drugs,2022,53(21):6666−6673.] doi: 10.7501/j.issn.0253-2670.2022.21.003 JIANG N, GUO Y H. Lignans chemical constituents of roots of Schisandra sphenanthera and their anti-oxidative effects[J]. Chinese Traditional and Herbal Drugs, 2022, 53(21): 6666−6673. doi: 10.7501/j.issn.0253-2670.2022.21.003
[28] 胡杨, 李先芝, 刘洋, 等. 杜仲化学成分、药理作用及应用研究进展[J]. 亚太传统医药,2022,18(2):234−239. [HU Y, LI X Z, LIU Y, et al. Research progress on chemical constituents, pharmacological effects and application of Eucommia ulmoides[J]. Asia-Pacific Traditional Medicine,2022,18(2):234−239.] HU Y, LI X Z, LIU Y, et al. Research progress on chemical constituents, pharmacological effects and application of Eucommia ulmoides[J]. Asia-Pacific Traditional Medicine, 2022, 18(2): 234−239.
[29] 张星, 毕金峰, 陈芹芹, 等. 4种浆果成分分析及抗氧化活性研究[J]. 食品科技,2020,45(6):52−58. [ZHANG X, BI J F, CHEN Q Q, et al. Components analysis and antioxidant activities of four varieties of berries[J]. Food Science and Technology,2020,45(6):52−58.] ZHANG X, BI J F, CHEN Q Q, et al. Components analysis and antioxidant activities of four varieties of berries[J]. Food Science and Technology, 2020, 45(6): 52−58.
[30] 张国荣, 翟丽霞, 王燕萍, 等. 药用植物内生菌次级代谢产物药理作用研究进展[J]. 中国药房,2021,32(7):880−884. [ZHANG G R, ZHAI L X, WANG Y P, et al. Research progress on pharmacological effects of secondary metabolites from endophytic fungi in medicinal plants[J]. China Pharmacy,2021,32(7):880−884.] doi: 10.6039/j.issn.1001-0408.2021.07.19 ZHANG G R, ZHAI L X, WANG Y P, et al. Research progress on pharmacological effects of secondary metabolites from endophytic fungi in medicinal plants[J]. China Pharmacy, 2021, 32(7): 880−884. doi: 10.6039/j.issn.1001-0408.2021.07.19
[31] 鲁祎晗. 一株拟茎点霉菌次生代谢产物的研究[D]. 昆明:云南大学, 2022:38−41. [LU Y H. Study on the secondary metabolites from a Phomopsis strain[D]. Kunming:Yunnan University, 2022:38−41.] LU Y H. Study on the secondary metabolites from a Phomopsis strain[D]. Kunming: Yunnan University, 2022: 38−41.
[32] ALEXANDRINE D, CELINE D, THOMAS R, et al. Among plant lignans, pinoresinol has the strongest antiinflammatory properties in human intestinal Caco-2 cells[J]. The Journal of Nutrition,2012,142(10):1798−1805. doi: 10.3945/jn.112.162453
[33] HYOWON J, MAHESH R, LEE J G, et al. Pinoresinol from the fruits of Forsythia koreana inhibits inflammatory responses in LPS-activated microglia[J]. Neuroscience Letters,2010,480(3):215−220. doi: 10.1016/j.neulet.2010.06.043
[34] SEPPORTA M V, MAZZA T, MOROZZI G, et al. Pinoresinol inhibits proliferation and induces differentiation on human HL60 leukemia cells[J]. Nutrition & Cancer,2013,65(8):1208−1218.
[35] TEODOR E D, MOROEANU V, RADU G L. Lignans from medicinal plants and their anticancer effect[J]. Mini Reviews in Medicinal Chemistry,2020,22(12):1083−1090.
[36] TANNOUS S, HAYKAL T, DHAINI J, et al. The anti-cancer effect of flaxseed lignan derivatives on different acute myeloid leukemia cancer cells[J]. Biomedicine & Pharmacotherapy,2020,132:110884.
[37] YEUNG A W K, TZVETKOV N T, BALACHEVA A A, et al. Lignans:Quantitative analysis of the research literature[J]. Frontiers in Pharmacology,2020,11:37. doi: 10.3389/fphar.2020.00037
-
期刊类型引用(2)
1. 程晓,文辉. 淀粉改性及在造纸工业中的应用与研究进展. 造纸科学与技术. 2024(10): 61-66+137 .  百度学术
百度学术
2. 胡方洋,邓健,张得祥,刘彩华,麦馨允,朱正杰. 凯特芒果淀粉的提取及其性质研究. 食品与生物技术学报. 2024(10): 163-172 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:

 下载:
下载:



