Progress on the Mechanism of Interaction between Volatile Flavor Substances and Muscle Proteins
-
摘要: 风味是肉及肉制品关键的品质属性,肌肉蛋白与风味化合物之间的相互作用影响了挥发性风味化合物释放和保留的动态平衡,这在很大程度上决定了肉的感官质量和消费者可接受性。阐明蛋白质与风味物质相互作用的机制是预测和控制风味物质结合行为的基础。本文综述了近年来肌肉蛋白溶液中风味保持和释放的研究进展,包括利用数学模型法和荧光光谱法计算结合参数(结合位点、结合常数等)、采用多光谱和分子对接技术分析蛋白质构象和结合模式,以及影响蛋白质-风味结合相互作用的因素,这对于风味结合行为的定性和定量预测至关重要。未来的研究还应进一步关注复合蛋白体系和其他食品基质对风味结合行为的影响。Abstract: Flavor significantly influences the quality of meat and meat products. The dynamic equilibrium between the release and retention of volatile flavor compounds, influenced by the interaction of muscle proteins and flavor compounds, is crucial in determining meat's sensory quality and consumer acceptability. Elucidating the interaction mechanisms between proteins and flavor substances lays the foundation for accurately predicting and controlling the binding behavior of these substances. This article reviews the recent advancements on flavor retention and release in muscle protein solutions. It includes the calculation of binding parameters (such as binding sites and constants) using mathematical modeling and fluorescence spectroscopy, the analysis of protein conformation and binding modes employing multispectral and molecular docking techniques, as well as factors influencing protein-flavor interaction. These studies are crucial for both qualitative and quantitative prediction of flavor binding behavior. Future research should further investigate the influence of complex protein systems and other food matrices on flavor binding behavior.
-
Keywords:
- muscle protein /
- flavor substances /
- binding parameters /
- protein conformation /
- binding mode
-
风味是肉类品质最重要的指标之一,是影响消费者购买产品的决定性因素[1−2]。肉的风味包括香气和滋味,分别是由肉中挥发性风味化合物和滋味呈味物质构成的。目前在肉中发现的挥发性风味物质包括烷、烯、醇、醛、酮、醚、酯、羧酸及含氧、氮、硫杂环化合物等[3−4]。这些挥发性风味物质赋予肉类特有的风味特征。肉类风味能否被人体感知一方面取决于挥发性风味物质的浓度和阈值,另外还受其在肉类基质中的释放或保留程度影响[5]。肌肉蛋白是存在于动物肌肉组织中的蛋白质,主要包括肌动蛋白、肌球蛋白等。它们在食品中不仅负责肌肉的结构和功能,同时也对肉类风味有重要影响。一方面肌肉蛋白降解的氨基酸通过发生美拉德反应生成多种挥发性成分[6],另一方面肌肉蛋白还通过与香气成分的相互作用影响其释放或保留[7]。肌肉蛋白作为肉类中的重要基质成分,其与挥发性风味物质的相互作用决定了挥发性香气的稳定性。
目前,肌肉蛋白和风味物质相互作用的研究主要集中于机制、影响因素等方面。近年来,随着分析技术如高分辨率气相色谱质谱联用、荧光光谱、圆二色谱以及分子对接技术的发展,科研工作者对肌肉蛋白和风味物质在分子水平上的相互作用进行了深入研究,这些研究为深入理解相互作用机制提供了基础。了解肌肉蛋白与风味物质的相互作用机制有助于预测和控制风味-蛋白质的释放/保留行为,从而降低肉及肉制品加工过程的风味损失,以开发出具有理想风味属性的产品。另外在肉类香精的生产和设计中也非常有帮助,特别是对于一些植物肉、培养肉制品,成功模拟和保留产品中的肉味对于最终的食用体验至关重要。
因此,本文综述了近年来肌肉蛋白与风味物质相互作用的研究进展,包括相互作用的类型,结合参数、蛋白质构象和结合模式的分析方法,以及影响蛋白质-风味结合相互作用的因素,总结了现有研究的发展动态和存在的不足,同时提出了未来研究的重点和方向,以期为肉制品的风味改善研究提供指引,通过调控肌肉蛋白与风味物质相互作用,开发更具吸引力的肉制品,满足消费者的需求。
1. 肌肉蛋白的组成及与挥发性风味物质的相互作用类型
根据溶解度和在肌肉细胞内的位置,肌肉蛋白可分为三类,肌浆蛋白,肌原纤维蛋白和基质蛋白[8]。肌浆蛋白包括肌红蛋白、血红蛋白等,可溶于低离子强度(0.15 mol/L或者更低)的水溶液。肌原纤维蛋白又可分为收缩蛋白、收缩调控蛋白和细胞骨架蛋白三大类[9],其中肌球蛋白、肌动蛋白、肌联蛋白、原肌球蛋白、肌钙蛋白和伴肌动蛋白占肌原纤维蛋白总量的90%。肌原纤维蛋白不溶于低离子强度的水溶液,但可被更高离子强度(0.3 mol/L或者更高)的钠或钾溶液提取出来,因此又被称为盐溶蛋白。基质蛋白包括胶原蛋白、弹性蛋白等不溶性蛋白[10]。
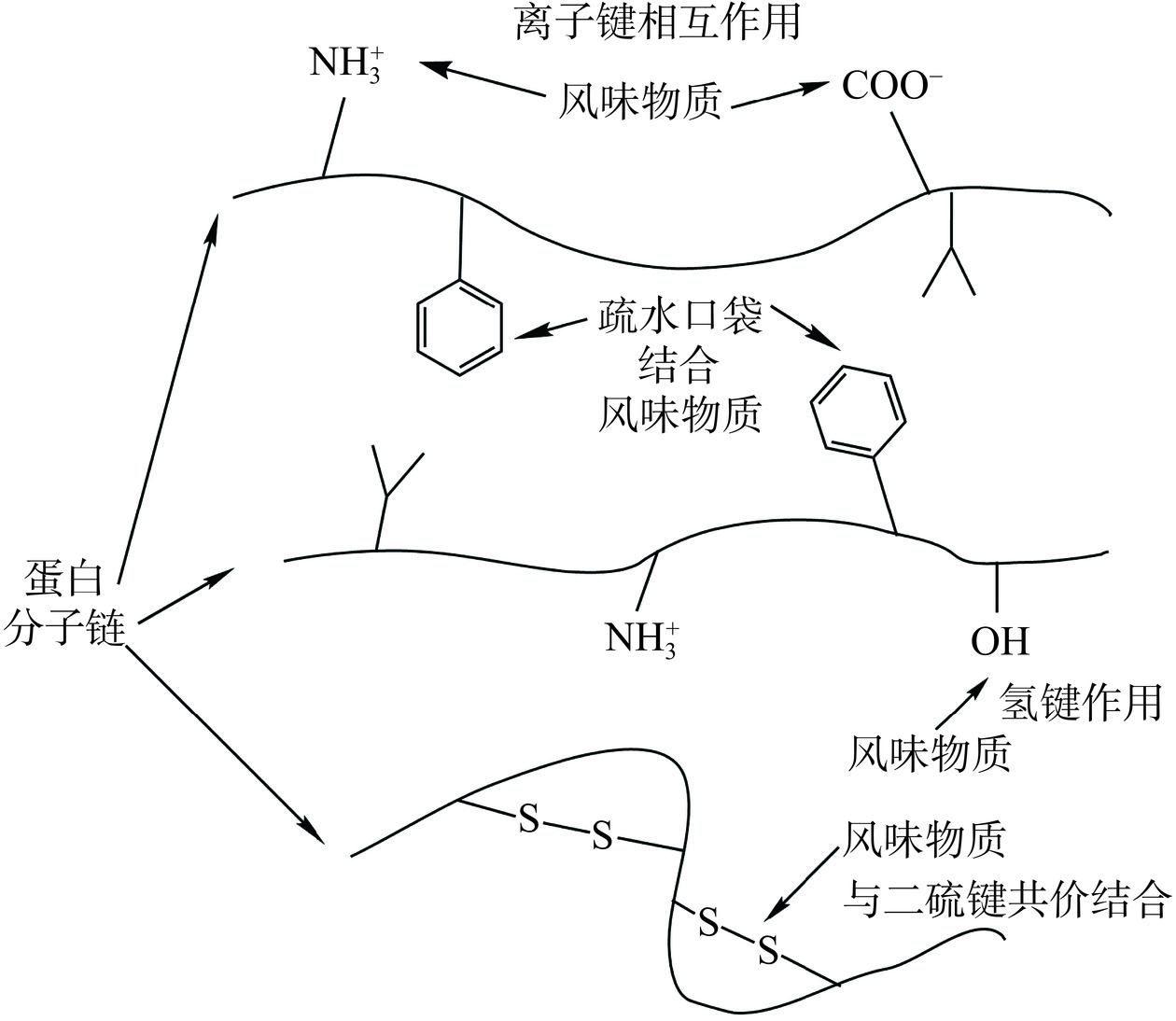
肌肉蛋白种类多,形态结构各异,风味物质与肌肉蛋白相互作用时,主要与肌肉蛋白侧链的结构有关,这些侧链可以提供包括非共价力和共价力在内的多种作用力,如图1所示。通常,大多数相互作用是可逆的,例如范德华力、离子键、氢键和疏水相互作用[11]。其中疏水相互作用是维持蛋白质与风味物质相互作用的主要作用力之一。对于表面疏水性强的蛋白质,会对风味物质直接产生吸附,对于表面疏水性较弱的蛋白质,风味物质则会进入到蛋白分子内部或空腔的位置与蛋白质进行结合[12]。一些含极性基团的风味物质(如羟基、羧基等)可通过氢键和离子键与蛋白质产生作用[12]。范德华力产生于分子之间的弱静电相互作用,键能较低。还有一些风味分子可以通过共价键与蛋白质侧链相互作用,包括醛-赖氨酸和胺-羧基,以及含硫化合物与蛋白质的结合,这些相互作用通常是不可逆的[5]。因此风味成分与蛋白质的结合强度与蛋白质的构象、风味成分的种类及其环境介质有关。
2. 挥发性风味物质与肌肉蛋白结合的分析方法
2.1 确定结合参数(结合位点、结合常数等)
研究风味物质与蛋白质的结合位点数和结合常数主要在平衡条件下进行,利用仪器测定溶液顶空自由风味化合物浓度,其中包括平衡透析法、超滤法、反相色谱法等、亲和色谱法、静态顶空以及顶空固相微萃取-气质联用法(SPME-GC/MS)等[14]。由于大多数蛋白质-风味物质的相互作用都是可逆的非共价结合,描述风味物质与蛋白质在平衡条件下的经典理论模型遵循式(1)Scatchard方程或式(2)Hill方程[15−16]。Scatchard模型假设蛋白质具有相等和独立的结合位点,Hill模型表示风味和蛋白质之间是协同结合。
(1) (2) 其中,υ代表每摩尔蛋白质结合的挥发物摩尔数;[L]代表游离挥发物的摩尔浓度;n代表蛋白质中结合位点数;K代表固定结合常数;h是希尔系数。υ和[L]可由式(3)和式(4)计算得到:
(3) (4) 其中,Cp代表样品中蛋白质的浓度(mol/L),O代表风味物质的浓度(mol/L);[HS]P表示蛋白风味溶液中风味物质的实测顶空浓度;[HS]C表示对照组蛋白溶液中风味物质的实测顶空浓度。
根据Scatchard方程,1/υ对1/([L])作双倒数图,是一条y=a+bx的直线(a=1/n,b=1/nK)。根据Hill方程,1/υ对1/([L])作双倒数图,是一条y=a+bxh的曲线(a=1/n,b=1/nKh)。由双倒数图即可计算出蛋白质和风味物质的结合参数n,K和h,结合常数K可以被认为是气-液分配系数,它定义了平衡时空气和液相中风味物的浓度比。希尔系数h代表了协同作用的强弱,当系数为1时,说明结合作用是完全独立的,大于1表示正协同作用,即一旦一个配体分子结合到大分子上,大分子对其他配体的亲和力就会增加[16]。Gianelli等[17]利用结合参数n、K来评估肌肽、鹅肌肽和肌红蛋白与关键风味化合物(己醛,辛醛,甲硫基丙醛,2-戊酮,2-甲基丁醛,3-甲基丁醛)的相互作用,结果显示它们之间的结合遵循Scatchard模型,不存在协同作用。Gu等[18]通过SPME-GC-MS研究了关键腥味物质与鲢鱼蛋白结合行为,结果显示风味物质结合模型均遵循Scatchard方程,肌球蛋白与三种线性链醛的结合位点数约为1.0,与1-辛烯-3-醇的结合位点数约为1.6。关于肌肉蛋白和风味物质之间的协同结合的报道较少,而在植物蛋白中研究较广泛。Guo等[19]研究大豆分离蛋白(SPI)和香茅醛、醋酸香茅酯、丙酸香茅酯、香茅醇的相互作用,利用Scatchard和Hill结合模型比较了风味物质在低浓度和高浓度下与SPI的结合,结果表明,低浓度风味物质与SPI的结合遵循Scatchard模型,为线性结合;而高浓度风味物质与SPI的结合遵循Hill模型,为非线性结合。说明随着风味物质与蛋白质摩尔比的增加,协同结合力增加,形成新的结合位点。
除了上述方法外,荧光光谱法也可以用来确定蛋白质和风味物质之间的结合参数[20]。蛋白质的内源性荧光主要来源于色氨酸残基(Trp)和酪氨酸残基(Tyr),他们吸收一定波长的激发光后发出荧光。如果配体的加入使蛋白质溶液的荧光强度降低,称为荧光淬灭,这是由于配体与蛋白质荧光团发生相互作用,从而使荧光量子产率降低[21]。荧光淬灭可用于评价蛋白质和风味化合物(淬灭剂)之间的相互作用。荧光淬灭根据其淬灭机理的不同,分为动态淬灭和静态淬灭。动态淬灭是指被激发的荧光分子与其他分子碰撞时荧光减弱的现象,静态淬灭是指荧光分子与其他物质反应产生非荧光配合物,导致荧光消失的现象[22]。通常情况下,荧光团的荧光可以被同一淬灭剂同时通过动态碰撞和形成复合物的方式淬灭。式(5)Stern-Volumer方程可以表示荧光淬灭过程[23]。
(5) 其中,F0和F分别代表了无淬灭剂和有淬灭剂时的荧光强度;Kq表示生物聚合物的淬灭速率常数;τ0表示无淬灭剂时生物大分子的荧光寿命(其平均值约为10−8 s);KSV代表了淬灭常数;[Q]表示淬灭剂的浓度。
根据式(5),Kq和KSV可通过F0/F曲线的线性回归来确定。Kq和KSV可以用来判断淬灭类型,若Kq大于淬灭剂与生物大分子的最大扩散碰撞淬灭速率常数2.0×1010 L·mol−1·s−1,说明动态淬灭的同时还存在静态淬灭[24]。另外由于较高的温度会导致较大的扩散系数,因此,如果KSV随温度升高而增加,说明是动态淬灭,如果KSV随温度的升高而下降,说明是静态淬灭[25]。
当存在静态淬灭时,可以应用式(6)双对数Stern-Volmer方程来确定风味物质与蛋白质的结合位点的数量[26]。n为蛋白质和配体结合的位点数;Ka表示静态淬灭的平衡常数。
(6) Wang等[27]在肌原纤维蛋白和庚醛结合实验中观察到静态淬灭,表明肌原纤维蛋白和庚醛之间发生相互作用。利用双对数Stern-Volmer方程计算二者的结合位点数n值约为1,静态淬灭的平衡常数Ka保持在约102 mol·L−1的数量级内。综上所述,Scatchard/Hill模型法和荧光光谱法都可以用来评估蛋白质和挥发性风味物质的结合参数。Scatchard/Hill模型法还可以判断风味和蛋白质之间是否存在协同效应。
2.2 确定蛋白构象
在蛋白质和风味物质相互作用的过程中,通常伴随着蛋白质构象的变化。上述结合参数的计算方法可用于确定挥发性风味物质和蛋白质之间的相互作用的程度。然而,它们不提供关于蛋白质构象的信息。光谱技术已被成功地用来解释二者相互作用的本质。如同步荧光光谱法、圆二色谱法、傅里叶红外光谱法、拉曼光谱等。
同步荧光光谱广泛应用于研究蛋白质与小分子相互作用的构象变化,通过测量荧光基团Tyr和Trp附近的发射波长变化来监测氨基酸残基的微环境。当激发波长和发射波长之间的Δλ值为15或60 nm时,同步荧光可以提供分别在Tyr和Trp残基周围发生的变化[28]。发射峰的红移表示荧光团所处的微环境极性增强,疏水性减弱;蓝移表示微环境疏水性增强,极性减弱。Yin等[29]研究猪肉肌原纤维蛋白和呋喃衍生物相互作用时的构象变化,发现在糠醛、2-乙酰基呋喃和糠醇存在下,猪肉肌原纤维蛋白Δλ值15和60 nm处的发射光谱均发生红移,这表明Tyr残基和Trp残基暴露于亲水性环境,增加了微环境的极性。而在5-甲基糠醛存在时猪肉肌原纤维蛋白在Δλ 60 nm处的发射光谱显示蓝移,表明Trp残基附近的疏水性增加。因此,糠醛、5-甲基糠醛、2-乙酰基呋喃和糠醇通过结合引起肌原纤维蛋白构象变化。
傅里叶红外光谱法、圆二色谱和拉曼光谱等可用于确定蛋白质中各二级结构的含量。通过二级结构单元含量的变化,可以来推测蛋白质构象的伸展与折叠。傅里叶变换红外光谱是分析蛋白质二级结构的有力工具,特别是对于酰胺Ⅰ带(1700~1600 cm−1)的谱峰指认技术已非常成熟,可用于定量分析蛋白二级结构。其中,1624~1642 cm−1归属为β折叠,1646~1650 cm−1归属为无规则卷曲,1654~1658 cm−1归属为α螺旋,1660、1672、1680、1688 cm−1归属为β转角[30]。圆二色谱是利用溶液中的光学活性分子(如蛋白质、DNA)的圆二色性解析其二级构象的技术。肽键的吸收范围为200~250 nm的远紫外区,通过电子跃迁能够产生这个区域的信号,从而揭示肽链骨架结构信息[31]。拉曼光谱是通过生物大分子对光的散射,得到分子振动能级信息。利用拉曼光谱可以获取蛋白质的主链构象,特别是酰胺Ⅰ带、酰胺Ⅲ带、C-C、C-N等的伸缩振动信息,用于计算蛋白质的二级结构含量和氨基酸残基的微环境变化,基于此来分析蛋白质的构象变化情况[32]。Shen等[33]研究氧化的肌原纤维蛋白质凝胶与风味物质相互作用,利用拉曼光谱测定氧化后的肌原纤维蛋白凝胶中二级结构的变化,发现α-螺旋和β-折叠含量均显著性下降,而β-转角和无规则卷曲含量则显著性上升。说明蛋白质的结构逐渐伸展,暴露出更多的疏水性结合位点,促进了蛋白凝胶对风味化合物的吸附。
总之,光谱技术对蛋白质构象的敏感性使其成为监测蛋白构象变化的重要工具。当蛋白质发生构象变化时,其光谱的吸收峰位置、强度或形状也会相应改变。蛋白质的折叠或解折叠、结构变化、构象转变等都可能在光谱上得到反映,这为理解蛋白质的功能和相互作用提供了重要的信息。根据研究目的和样品性质等可选择合适的光谱技术,通常综合使用多种技术可以提供更全面、深入的蛋白质构象变化信息。
2.3 确定结合模式
为了判断蛋白质和风味物质相互作用的具体结合力(范德华力、离子键、氢键和疏水相互作用),通常采用热力学分析方法计算结合自由能(ΔG)、结合焓(ΔH)和结合熵(ΔS)的变化,见式(7)和式(8)。
(7) (8) 式中,K相当于相应温度下的有效淬灭常数Ka;R是气态常数。
一般来说,风味物质与蛋白质的结合属于自发过程(ΔG<0)。根据蛋白质和风味物质二者相互作用过程中的焓变(ΔH)和熵变(ΔS)情况,结合驱动力分为三种:ΔH>0和ΔS>0,为疏水相互作用;ΔH<0和ΔS<0,为范德华力和氢键;ΔH<0和ΔS>0,为静电相互作用。因此,从热力学参数的角度可以解释蛋白质-风味物质的相互作用的模式[34]。Wang等[35]建立肌原纤维蛋白和4种酯类的吸附模型,发现肌原纤维蛋白的风味吸附能力辛酸乙酯>己酸乙酯>丁酸乙酯>乙酸乙酯。另外通过热力学计算发现肌原纤维蛋白与辛酸己酯的结合反应ΔG为负值,表明二者之间相互作用是自发的,另外ΔH和ΔS均为负,表明在相互作用中范德华力或氢键起主要作用。
近年来分子对接技术也逐渐被用于研究风味物质和蛋白质的相互作用中,它可以直观地观察二者的结合位点和结合作用力[29,35−36]。首先需要在数据库查找目标蛋白受体的晶体结构或者通过同源建模的方法建立受体蛋白构象,其次对蛋白结构的可靠性进行评估,若构象符合立体化学的规则,说明蛋白结构可靠,可以用于分子对接[27];之后小分子配体和蛋白质被导入特定软件中进行加氢、计算总电荷和设置原子类型等前处理,最后进行分子对接,以评估受体-配体复合物的亲和力,并给出综合评分。目前分子对接技术在肌肉蛋白对风味物质的吸附机制研究中应用广泛,利用该技术发现猪肉肌原纤维蛋白与4种呋喃衍生物(糠醛、5-甲基糠醛、2-乙酰基呋喃和糠醇)之间的主要相互作用力是氢键、范德华力和疏水相互作用[29]。肌球蛋白-辛酸乙酯结合的主要驱动力是氢键和范德华力[35]。肌球蛋白与戊醛之间的主要作用力是疏水作用和氢键[36]。但对于其他类型的风味物质研究较少,特别是含氮含硫的杂环类化合物,因此肌肉蛋白与挥发性风味成分的结合机理还有待深入研究。
3. 挥发性风味物质与肌肉蛋白的相互作用的影响因素
挥发性风味物质和蛋白质的结合能力随结合位点的变化而改变,而位点的变化又与蛋白质的结构、蛋白之间相互作用相关。蛋白质种类和浓度、风味物质种类及外界因素,例如pH、温度、氧化、离子强度、添加物等,都会影响风味物质的结合与释放。
3.1 蛋白质种类和浓度
不同种类的肌肉蛋白在结构和氨基酸组成上有所差异,这导致它们与风味物质的结合能力不同。研究表明肌浆蛋白结合挥发性化合物的能力(3-甲基丁醛、2-甲基丁醛、己醛、甲硫基丙醛和辛醛)高于肌原纤维蛋白。G-肌动蛋白对上述挥发性物质没有结合能力,但其聚合形式(F-肌动蛋白)能够结合这些挥发性化合物[7]。另有研究对比了肌红蛋白和二肽(鹅肌肽和肌肽)对选定的风味物质的吸附能力,结果显示肌红蛋白仅与2-甲基丁醛具有相互作用,鹅肌肽对2-甲基丁醛和己醛有吸附作用,而肌肽能吸附大多数选定的挥发性化合物[17]。不同种类蛋白质的氨基酸组成对其与风味物质的结合具有重要影响,特定氨基酸残基(如亲水或疏水残基)可能在结合过程中发挥重要作用。蛋白质的结构特征,如折叠状态、二级结构等,也会影响其与风味物质的相互作用,蛋白质的构象变化可能导致结合位点的暴露或隐藏。基于这些原因,不同肌肉蛋白对风味物质的相互作用具有特异性。蛋白质浓度对风味的吸附也有一定的影响,蛋白质的浓度影响着可用的结合位点数量和相互作用的强度。Wang等[27]研究了不同浓度的肌原纤维蛋白和四种醛类的吸附能力差异,发现随着蛋白质浓度的升高(2~6 mg/mL),吸附能力逐渐增强,这归因于蛋白质提供的结合位点数目的增加,但随着浓度继续升高,吸附能力反而降低。这由于蛋白质-蛋白质相互作用导致蛋白质-风味相互作用减少,另一个可能的原因是随着蛋白质的增加,表面张力降低,促进了醛类在气相中的分配。这与周昌瑜等[37]研究结果一致。在较高浓度下,一些蛋白质可能发生沉淀或交联,这可能导致结合位点的改变或者部分蛋白质结构的隐藏,从而影响其与风味物质的结合。一方面较高浓度的蛋白质还可能导致对一些风味物质的掩蔽效应,减轻其感知强度。因此通过改变蛋白质的种类和浓度可以实现风味物质的释放或吸附,进而调控食品的口感。
3.2 风味物质种类
肌肉蛋白可以结合各类风味化合物,如醛类、酮类、醇类、酯类等,进而影响肉制品的最终风味属性。一般认为,风味成分与蛋白质的结合强度醛>酯>酮>醇[20],这可能与风味物质的极性有关,如前所述,极性风味物质可能与蛋白质中的极性残基形成氢键或离子键,而疏水性风味物质可能与蛋白质的疏水区域相互作用。而且同一类别的风味物质随着链长的增加,保留程度也发生了变化。如肌原纤维蛋白对四种醛的结合亲和性依次为:庚醛>己醛=3-甲基丁醛>戊醛[27],原因可能是碳链长度的增加,风味物质疏水性逐渐增强,肌原纤维蛋白通过与风味物质的疏水相互作用增强吸附作用[27]。但Liu等[36]的研究显示,肌球蛋白与戊醛的结合能力显著高于己醛、庚醛、辛醛和壬醛,可能是与肌球蛋白相互作用时,戊醛具有最小的分子尺寸和最小的位阻。为了进一步阐明分子结构对吸附能力的影响,Shen等[38]系统评价了肌原纤维蛋白与酮类的结合能力,结果表明分子中更多的酮基可增强与蛋白质分子之间的相互作用,当分子支链较小且距离酮基较远时,对酮基的活性和酮分子的位阻效应影响均较小,亲和力更高。因此挥发性风味物质种类对其与蛋白质的相互作用具有显著的影响,这不仅与风味物质的分子极性和大小有关,还涉及到官能团的数量和位置等因素,所以不同种类的风味物质与蛋白质之间的相互作用是多样的,并且这些相互作用对于食物的感官特性具有重要的影响。在食品工业中,了解和控制这些相互作用对于调控食物的口感、风味至关重要。
3.3 pH
pH变化对蛋白质结构有较大影响,随着pH向等电点pI处移动,肌原纤维蛋白的表面疏水性增强,蛋白质构象逐渐伸展,暴露出埋藏在内部的疏水性基团。另外肌原纤维蛋白电荷减少导致蛋白质分子间排斥力减弱,蛋白之间相互作用增强,从而导致分子聚集[39]。因此pH变化会对蛋白质和风味的结合产生影响,但pH对不同的蛋白质与风味的相互作用有不同的影响。Gianelli等[17]采用固相微萃取和气相色谱法对选定的风味物质与肌红蛋白的相互作用进行分析。结果表明,肌红蛋白和己醛的结合率在较高pH下增加,而肌红蛋白和2-甲基丁醛的相互作用不受pH的影响。Shen等[39]研究猪肉肌原纤维蛋白和2,5-二甲基吡嗪的相互作用,当pH下降至5.5时,肌原纤维蛋白表面疏水性增强,蛋白之间的相互作用增强,蛋白趋于沉降,降低了蛋白对吡嗪的吸附,当pH继续下降时,肌原纤维蛋白构象进一步改变,充分暴露内部的疏水性结合位点,增强蛋白质对吡嗪的疏水性结合。Yang等[40]研究pH对鸭肉肌原纤维蛋白与风味物质的吸附作用影响时,发现随着pH的升高(pH5.0~8.0),肌原纤维蛋白对醛类和酯类的吸附能力增加,可归因于蛋白质的展开;而对醇类的吸附能力下降,归因于氢键的变化。这一结果说明pH可以通过改变蛋白质表面疏水性、蛋白质分子所带电荷量,进而导致蛋白质聚集程度、蛋白的二级结构等的变化,从而改变了蛋白质与风味物质之间的吸附作用。同时也说明不同的风味物质与蛋白质结合作用的主要驱动力并不相同。
3.4 离子强度
离子强度是影响蛋白质溶解度的关键因素,特别是对于盐溶蛋白。通常添加氯化钠会削弱各类蛋白质对风味化合物的吸附作用,促进风味物质的释放,被称为“盐析现象”。这是由于盐的存在改变了蛋白质表面极性,从而影响了其结合能力[7]。楼宵玮等[41]研究不同浓度的NaCl对肌原纤维蛋白吸附风味物质能力的影响,结果显示肌原纤维蛋白对醇类、醛类、酮类的吸附作用,在氯化钠浓度0.0~1.0 mol/L范围内显著减弱。但肌原纤维蛋白对酯类的吸附能力随氯化钠浓度增加呈现先下降后上升的变化趋势。Pérez-Juan等[7]对比了不同种类盐对蛋白风味吸附能力的影响。NaCl和KCl的加入降低了肌浆蛋白与风味的结合能力,对肌原纤维蛋白和风味物质结合的影响很小,而加入CaCl2和MgCl2不影响肌浆蛋白和风味物质的结合,但增加了肌原纤维蛋白溶液中3-甲基丁醛、2-甲基丁醛、己醛和甲硫基丙醛的释放。离子强度对肌肉蛋白和风味物质的相互作用具有复杂的影响,涉及蛋白质结构的变化、水合作用、离子效应等多个方面,具体的机制仍需进一步研究。通过离子强度对肌肉蛋白吸附风味能力的研究发现,氯化钠作为常见的调味品,不仅能够提供咸味,调整食品中各种滋味的平衡,还能通过改变食品介质的离子强度影响食品的气味,这为食品的风味调控提供了新思路。
3.5 温度
热处理是食品加工的最重要的方式之一,加热过程中风味前体物质发生美拉德反应和脂质氧化降解等生成各类挥发性风味化合物,同时加热会导致蛋白质的变性聚集和交联,改变蛋白质的结构,进而对风味产生吸附或释放。Liu等[42]以兔肌球蛋白为对象,建立了肌球蛋白-醛类作用模拟体系,发现在恒温处理过程中,肌球蛋白对醛类的吸附能力显著增强。吕彤等[43]研究了不同温度处理对肌球蛋白吸附醛类和酮类物质的影响,发现肌球蛋白对3-甲基丁醛、戊醛、庚醛、2-庚酮、2-辛酮、2-壬酮的吸附能力先升高后下降,即在蛋白展开过程中吸附能力增强,在蛋白质聚合过程中吸附能力减弱;蛋白对2-戊酮的吸附能力呈现先降低后升高的变化。而周昌瑜等[44]研究热处理条件下肌原纤维蛋白的吸附能力变化,结果显示,随着加热的进行,肌原纤维蛋白凝胶对戊醇和己醇的吸附作用增强,对1-辛烯-3-醇和辛醇的吸附能力显著降低,对醛类的吸附作用总体也呈现降低趋势。热处理条件下肌肉蛋白对不同的风味物质的吸附能力没有发现特定的规律,因此需要进一步探究热变性对肌原纤维蛋白吸附风味物质的影响机制。
除此之外,氧化[45−46]、酶[47]、蛋白水解[48]、微波[49−50]等条件都会对肌肉蛋白的风味结合能力产生影响。综上所述,蛋白质和风味物质的结合能力增强或减弱的原因包括以下几方面,通过改变蛋白质的构象,引起结合位点的包埋或暴露;风味物质之间或者外来物质存在竞争性吸附或者协同吸附;蛋白与蛋白相互作用增强,蛋白质发生聚集,进而影响蛋白与风味化合物之间的相互作用。
4. 结论与展望
在肉类及其制品的加工和食用过程中,肌肉蛋白与风味化合物发生相互作用,这对于肉的整体风味具有重要影响。系统性研究这些风味化合物与蛋白质之间的相互作用机理是进行风味调控的基础。通过各种促进或抑制肌原纤维蛋白吸附风味物质的方法,包括改变体系的pH或离子强度,或使用表面活性剂或其他添加剂来改变蛋白质的表面性质等,为香气的保留和异味的去除提供了新的策略。但目前关于肌肉蛋白与风味物质相互作用的研究,都是在蛋白溶液模拟体系中完成。然而食品基质非常复杂,因此需要进一步研究复合蛋白体系和其他食品基质对风味吸附的影响。此外,与其他液体食品不同,肉和肉制品呈现固体或凝胶状态,而风味的释放很大程度上又受到传质效应的影响,凝胶基质和热处理诱导的蛋白质变性阻碍了向空气相的传质,因此还需要进一步研究食品基质的流变学特性对风味物质释放的影响。总之阐明真实食品体系与风味的相互作用是未来研究的发展趋势之一。
其次随着替代性蛋白来源的兴起,研究肌肉蛋白与不同来源的蛋白质(如植物蛋白、昆虫蛋白)与风味物质的相互作用将成为未来研究的重要领域,这不仅有助于减少对环境的负担,还有助于促进健康和可持续的食品生产。另外消费者对天然食品和标签食品的需求增加,研究者可以探索如何利用天然风味物质改善肌肉蛋白产品的风味,以实现更自然、健康的风味。在深入了解风味吸附机制的基础上,还可进一步研究先进的风味控制技术,例如纳米技术、微胶囊化等,以实现对风味物质的更精确控制。综合而言,未来的研究可以更加全面地深入了解食品基质与风味物质之间的相互作用,这对于优化食品配方、开发新型肉制品、迎合消费者需求、促进行业发展具有重要意义。
-
[1] GUICHARD E. Flavour retention and release from protein solutions[J]. Biotechnology Advances,2006,24(2):226−229. doi: 10.1016/j.biotechadv.2005.11.003
[2] O'QUINN T, LEGAKO J, BROOKS J, et al. Evaluation of the contribution of tenderness, juiciness, and flavor to the overall consumer beef eating experience[J]. Translational Animal Science,2018,2:26−36. doi: 10.1093/tas/txx008
[3] BASSAM S M, NOLETO-DIAS C, FARAG M A. Dissecting grilled red and white meat flavor:Its characteristics, production mechanisms, influencing factors and chemical hazards[J]. Food Chemistry,2022,371:131139. doi: 10.1016/j.foodchem.2021.131139
[4] WEI M, LIU X C, XIE P, et al. Characterization of volatile profiles and correlated contributing compounds in pan-fried steaks from different chinese yellow cattle breeds through GC-Q-Orbitrap, E-nose, and sensory evaluation[J]. Molecules, 2022, 27(11): 3593.
[5] ZHANG J, KANG D C, ZHANG W G, et al. Recent advantage of interactions of protein-flavor in foods:Perspective of theoretical models, protein properties and extrinsic factors[J]. Trends in Food Science & Technology,2021,111:405−425.
[6] SOHAIL A, AL-DALALI S, WANG J A, et al. Aroma compounds identified in cooked meat:A review[J]. Food Research International,2022,157:111385. doi: 10.1016/j.foodres.2022.111385
[7] PÉREZ-JUAN M, FLORES M, TOLDRÁ F. Effect of pork meat proteins on the binding of volatile compounds[J]. Food Chemistry,2008,108(4):1226−1233. doi: 10.1016/j.foodchem.2007.04.037
[8] LEE S H, JOO S T, RYU Y C. Skeletal muscle fiber type and myofibrillar proteins in relation to meat quality[J]. Meat Science,2010,86(1):166−170. doi: 10.1016/j.meatsci.2010.04.040
[9] 胡亚芹, 葛雨珺, 白妍, 等. 热处理对肉类蛋白质构的影响[J]. 渔业科学进展,2019,40(5):175−184. [HU Y Q, GE Y J, BAI Y, et al. Effect of heat treatments on the protein structures and meat textural properties[J]. Progress in Fishery Sciences,2019,40(5):175−184.] HU Y Q, GE Y J, BAI Y, et al. Effect of heat treatments on the protein structures and meat textural properties[J]. Progress in Fishery Sciences, 2019, 40(5): 175−184.
[10] 尹靖东. 动物肌肉生物学与肉品科学[M]. 北京:中国农业大学出版社, 2011:58−62. [YIN J D. Animal muscle biology and meat quality[M]. Beijing:China Agricultural University Press, 2011:58−62.] YIN J D. Animal muscle biology and meat quality[M]. Beijing: China Agricultural University Press, 2011: 58−62.
[11] BI S, PAN X, ZHANG W T, et al. Non-covalent interactions of selected flavors with pea protein:Role of molecular structure of flavor compounds[J]. Food Chemistry,2022,389:133044. doi: 10.1016/j.foodchem.2022.133044
[12] 殷小钰, 刘昊天, 邹汶蓉, 等. 肌肉蛋白与挥发性风味物质的相互作用机制及影响因素研究进展[J]. 食品科学,2020,41(15):288−294. [YIN X Y, LIU H T, ZOU W R, et al. Mechanism of the interaction of muscle proteins with flavor compounds and factors influencing it:A review[J]. Food Science,2020,41(15):288−294.] doi: 10.7506/spkx1002-6630-20190815-158 YIN X Y, LIU H T, ZOU W R, et al. Mechanism of the interaction of muscle proteins with flavor compounds and factors influencing it: A review[J]. Food Science, 2020, 41(15): 288−294. doi: 10.7506/spkx1002-6630-20190815-158
[13] WANG K, ARNTFIELD S D. Effect of protein-flavour binding on flavour delivery and protein functional properties:A special emphasis on plant-based proteins[J]. Flavour and Fragrance Journal,2017,32(2):92−101. doi: 10.1002/ffj.3365
[14] 郭军. 大豆分离蛋白与水果风味化合物相互作用影响因素研究[D]. 无锡:江南大学, 2021. [GUO J. Study on the factors affecting interaction between soy protein isolate and fruit flavor compounds[D]. Wuxi:Jiangnan University, 2021.] GUO J. Study on the factors affecting interaction between soy protein isolate and fruit flavor compounds[D]. Wuxi: Jiangnan University, 2021.
[15] KÜHN J, ZHU X Q, CONSIDINE T, et al. Binding of 2-nonanone and milk proteins in aqueous model systems[J]. Journal of Agricultural and Food Chemistry,2007,55(9):3599−3604. doi: 10.1021/jf063517o
[16] CADWALLADER K R, CHANG S K C. Chemistry, texture, and flavor of soy[M]. Washington, DC:American Chemical Society, 2010:339-359.
[17] GIANELLI M P, FLORES M, TOLDRÁ F. Interactions of soluble peptides and proteins from skeletal muscle on the release of volatile compounds[J]. Journal of Agricultural and Food Chemistry,2003,51(23):6828−6834. doi: 10.1021/jf0303666
[18] GU S Q, DAI W L, CHONG Y Q, et al. The binding of key fishy off-flavor compounds to silver carp proteins:A thermodynamic analysis[J]. RSC Advances,2020,10(19):11292−11299. doi: 10.1039/D0RA01365J
[19] GUO J, HE Z Y, WU S F, et al. Effects of concentration of flavor compounds on interaction between soy protein isolate and flavor compounds[J]. Food Hydrocolloids,2020,100:105388. doi: 10.1016/j.foodhyd.2019.105388
[20] KÜHN J, CONSIDINE T, SINGH H. Interactions of milk proteins and volatile flavor compounds:implications in the development of protein foods[J]. Journal of Food Science,2006,71(5):R72−R82.
[21] SHEN L, TANG C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International,2012,48(1):108−118. doi: 10.1016/j.foodres.2012.03.006
[22] WU D, MEI S, DUAN R, et al. How black tea pigment theaflavin dyes chicken eggs:Binding affinity study of theaflavin with ovalbumin[J]. Food Chemistry,2020,303:125407. doi: 10.1016/j.foodchem.2019.125407
[23] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. 3rd ed. Boston, MA:Springer New York, 2006:277−330.
[24] ZHANG Y Z, ZHOU B, ZHANG X P, et al. Interaction of malachite green with bovine serum albumin:Determination of the binding mechanism and binding site by spectroscopic methods[J]. Journal of Hazardous Materials,2009,163(2):1345−1352.
[25] ZHANG H X, HUANG X, MEI P, et al. Studies on the interaction of tricyclazole with β-cyclodextrin and human serum albumin by spectroscopy[J]. Journal of Fluorescence,2006,16(3):287−294. doi: 10.1007/s10895-006-0087-7
[26] WANG K, ARNTFIELD S D. Effect of salts and pH on selected ketone flavours binding to salt-extracted pea proteins:The role of non-covalent forces[J]. Food Research International,2015,77:1−9. doi: 10.1016/j.foodres.2015.03.017
[27] WANG H T, ZHU J M, ZHANG H W, et al. Understanding interactions among aldehyde compounds and porcine myofibrillar proteins by spectroscopy and molecular dynamics simulations[J]. Journal of Molecular Liquids,2022,349:118190. doi: 10.1016/j.molliq.2021.118190
[28] YU X, CAI X H, LUO L Y, et al. Influence of tea polyphenol and bovine serum albumin on tea cream formation by multiple spectroscopy methods and molecular docking[J]. Food Chemistry,2020,333:127432. doi: 10.1016/j.foodchem.2020.127432
[29] YIN X Y, GAO M K, WANG H T, et al. Probing the interaction between selected furan derivatives and porcine myofibrillar proteins by spectroscopic and molecular docking approaches[J]. Food Chemistry,2022,397:133776. doi: 10.1016/j.foodchem.2022.133776
[30] KONG J L, YU S N. Fourier transform infrared spectroscopic analysis of protein secondary structures[J]. Acta Biochimica et Biophysica Sinica,2007,39(8):549−559. doi: 10.1111/j.1745-7270.2007.00320.x
[31] 齐宝坤, 赵城彬, 江连洲, 等. 大豆分离蛋白组成及二级结构对表面疏水性的影响[J]. 中国食品学报,2018,18(5):288−293. [QI B K, ZHAO C B, JIANG L Z, et al. Effect of composition and secondary structure of soybean protein isolate on surface hydrophobicity[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(5):288−293.] QI B K, ZHAO C B, JIANG L Z, et al. Effect of composition and secondary structure of soybean protein isolate on surface hydrophobicity[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(5): 288−293.
[32] SUN W Z, ZHAO Q Z, ZHAO M M, et al. Structural evaluation of myofibrillar proteins during processing of cantonese sausage by raman spectroscopy[J]. Journal of Agricultural and Food Chemistry,2011,59(20):11070−11077. doi: 10.1021/jf202560s
[33] SHEN H, STEPHEN E J, ZHAO M M, et al. Effect of oxidation on the gel properties of porcine myofibrillar proteins and their binding abilities with selected flavour compounds[J]. Food Chemistry,2020,329:127032. doi: 10.1016/j.foodchem.2020.127032
[34] 申辉. 猪肉肌原纤维蛋白与特定风味化合物的相互作用机制研究[D]. 广州:华南理工大学, 2019. [SHEN H. The interaction mechanism of porcine myofibrillar proteins with typical flavor compounds[D]. Guangzhou:South China University of Technology, 2019.] SHEN H. The interaction mechanism of porcine myofibrillar proteins with typical flavor compounds[D]. Guangzhou: South China University of Technology, 2019.
[35] WANG H T, GUAN H N, ZHANG H W, et al. Elucidation of interaction mechanisms between myofibrillar proteins and ethyl octanoate by SPME-GC-MS, molecular docking and dynamics simulation[J]. LWT-Food Science and Technology, 2022, 154.
[36] LIU H, WEI X R, NIE R T, et al. Molecular docking simulation combining with multi-spectroscopy techniques clarify how small molecule ligands bind to biomacromolecule:Myosin and aldehydes as a case study[J]. LWT-Food Science and Technology, 2022, 155.
[37] 周昌瑜, 蒋娅婷, 曹锦轩, 等. 肌原纤维蛋白浓度对风味物质吸附能力的影响[J]. 核农学报,2016,30(5):904−911. [ZHOU C Y, JIANG Y T, CAO J X, et al. Effect of the myofibril proteins concentrations on the adsorbing capacity for the flavor compounds[J]. Journal of Nuclear Agricultural Sciences,2016,30(5):904−911.] doi: 10.11869/j.issn.100-8551.2016.05.0904 ZHOU C Y, JIANG Y T, CAO J X, et al. Effect of the myofibril proteins concentrations on the adsorbing capacity for the flavor compounds[J]. Journal of Nuclear Agricultural Sciences, 2016, 30(5): 904−911. doi: 10.11869/j.issn.100-8551.2016.05.0904
[38] SHEN H, HUANG M Q, ZHAO M M, et al. Interactions of selected ketone flavours with porcine myofibrillar proteins:The role of molecular structure of flavour compounds[J]. Food Chemistry,2019,298:125060. doi: 10.1016/j.foodchem.2019.125060
[39] SHEN H, ZHAO M M, SUN W Z. Effect of pH on the interaction of porcine myofibrillar proteins with pyrazine compounds[J]. Food Chemistry,2019,287:93−99. doi: 10.1016/j.foodchem.2019.02.060
[40] YANG Q, LOU X, WANG Y, et al. Effect of pH on the interaction of volatile compounds with the myofibrillar proteins of duck meat[J]. Poultry Science,2017,96(6):1963−1969. doi: 10.3382/ps/pew413
[41] 楼宵玮, 蒋娅婷, 潘道东, 等. 氯化钠对肌原纤维蛋白与风味物质相互作用的影响[J]. 食品科学,2017,38(5):74−79. [LOU X W, JIANG Y T, PAN D D, et al. Effect of NaCl on the interaction of flavor compounds with myofibrillar proteins[J]. Food Science,2017,38(5):74−79.] doi: 10.7506/spkx1002-6630-201705012 LOU X W, JIANG Y T, PAN D D, et al. Effect of NaCl on the interaction of flavor compounds with myofibrillar proteins[J]. Food Science, 2017, 38(5): 74−79. doi: 10.7506/spkx1002-6630-201705012
[42] LIU H, HUI T, ZHENG X C, et al. Characterization of key lipids for binding and generating aroma compounds in roasted mutton by UPLC-ESI-MS/MS and Orbitrap Exploris GC[J]. Food Chemistry,2022,374:131723. doi: 10.1016/j.foodchem.2021.131723
[43] 吕彤, 林俊杰, 周昌瑜, 等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J]. 农业工程学报,2016,32(8):285−291. [LÜ T, LIN J J, ZHOU C Y, et al. Effect of heat treatment intensity on structure and binding capacity of volatile compounds of myosin[J]. Transactions of the Chinese Society of Agricultural Engineering,2016,32(8):285−291.] doi: 10.11975/j.issn.1002-6819.2016.08.040 LÜ T, LIN J J, ZHOU C Y, et al. Effect of heat treatment intensity on structure and binding capacity of volatile compounds of myosin[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(8): 285−291. doi: 10.11975/j.issn.1002-6819.2016.08.040
[44] 周昌瑜, 蒋娅婷, 曹锦轩, 等. 热处理时间对鸭肉肌原纤维蛋白凝胶的风味吸附能力影响[J]. 现代食品科技,2016,32(3):218−224. [ZHOU C Y, JIANG Y T, CAO J X, et al. The effects of heat treatment time on the absorption capacity of duck myofibrillar protein gels on flavor compounds[J]. Modern Food Science and Technology,2016,32(3):218−224.] ZHOU C Y, JIANG Y T, CAO J X, et al. The effects of heat treatment time on the absorption capacity of duck myofibrillar protein gels on flavor compounds[J]. Modern Food Science and Technology, 2016, 32(3): 218−224.
[45] ZHOU F B, ZHAO M M, SU G W, et al. Binding of aroma compounds with myofibrillar proteins modified by a hydroxyl-radical-induced oxidative system[J]. Journal of Agricultural and Food Chemistry,2014,62(39):9544−9552. doi: 10.1021/jf502540p
[46] CAO J X, ZHOU C Y, WANG Y, et al. The effect of oxidation on the structure of G-actin and its binding ability with aroma compounds in carp grass skeletal muscle[J]. Food Chemistry,2018,240:346−353. doi: 10.1016/j.foodchem.2017.07.068
[47] LÜ T, WANG Y, PAN D D, et al. Effect of trypsin treatments on the structure and binding capacity of volatile compounds of myosin[J]. Food Chemistry,2017,214:710−716. doi: 10.1016/j.foodchem.2016.07.115
[48] LI H, ZHENG R, ZUO F F, et al. Influence of proteolysis on the binding capacity of flavor compounds to myofibrillar proteins[J]. Foods,2022,11(6):891. doi: 10.3390/foods11060891
[49] HAN Z, CAI M J, CHENG J H, et al. Effects of microwave and water bath heating on the interactions between myofibrillar protein from beef and ketone flavour compounds[J]. International Journal of Food Science & Technology,2019,54(5):1787−1793.
[50] HAN Z, CAI M J, CHENG J H, et al. Effects of constant power microwave on the adsorption behaviour of myofibril protein to aldehyde flavour compounds[J]. Food Chemistry,2021,336:127728. doi: 10.1016/j.foodchem.2020.127728





 下载:
下载:
 下载:
下载:



