Screening, Expression and Analysis of Enzymatic Properties of a Cold-active Lipase-producing Strain
-
摘要: 为筛选高产低温脂肪酶的菌株,并为脂肪酶的工业化开发提供生产资料。利用罗丹明B培养法从漠河县兴安落叶松林为主的林下土壤中分离出1株低温脂肪酶产生菌,对其形态学、生理生化特性进行鉴定,并结合16S rDNA基因序列,确定该菌株为苏云金芽孢杆菌(Bacillus thuringiensis)。以苏云金芽孢杆菌基因组为模板克隆脂肪酶基因Lip240,对Lip240进行异源表达以及酶学性质的分析。结果表明:该重组脂肪酶Lip240的最适反应温度为30 ℃,在4~30 ℃条件下处理6 h能维持60%以上的活性,是一种低温脂肪酶,最适pH为8.0。Ca2+、Mn2+、Fe2+、Fe3+和Cr3+对脂肪酶Lip240的酶活有一定的促进作用。该酶具有较好的有机溶剂耐受性,SDS能够显著(P<0.05)抑制脂肪酶Lip240的酶活。该酶更偏好于水解中短链底物。该结论可为微生物资源开发利用和低温脂肪酶的工业应用提供一定的理论依据。Abstract: High-yield strains of cold-active lipase are screened to provide production information for the industrial development of lipase. A cold-active lipase-producing strain was isolated from Xing'an larch forest soil in Mohe County using the Rhodamine B plate method. Its morphological, physiological, and biochemical characteristics were identified, and combined with the 16S rDNA gene sequence, the strain was determined to be Bacillus thuringiensis. The lipase gene Lip240 was cloned using the Bacillus thuringiensis genome as a template, and heterologous expression and enzymatic properties of Lip240 were analyzed. The results showed that the recombination lipase Lip240 had an optimal reaction temperature of 30 ℃, and could maintain more than 60% activity when treated at 4~30 ℃ for 6 hours, thus a cold-active lipase. Besides, its optimal pH was 8.0. Additionally, Ca2+, Mn2+, Fe2+, Fe3+, and Cr3+ had a certain enhancing effect on the activity of Lip240. Notably, Lip240 had a good organic solvent tolerance, while SDS could significantly (P<0.05) inhibit its activity. Lip240 exhibited good substrate specificity towards medium and short-chain substrates. The conclusions of this study would provide a theoretical basis for the development and utilization of microbial resources and the industrial application of cold-active lipase.
-
脂肪酶(EC 3.1.1.3,lipase)又称甘油三酯水解酶,能够将甘油三酯水解为甘油二酯、单甘油酯、甘油和游离脂肪酸[1]。脂肪酶还可以催化非水相中的酯合成、酯交换、醇解和酸解[2−4],是工业生产应用的关键酶,在食品工业、生物柴油、化妆品、医药等领域具有良好的应用前景[5]。
脂肪酶广泛存在于动物、植物和微生物体内,与动植物脂肪酶相比,微生物脂肪酶具有种类多、酶学性质优异、易于规模化生产等优势[6−7],是工业脂肪酶的重要来源。产脂肪酶的微生物主要包括芽孢杆菌属Bacillus[8−9]、嗜冷杆菌属(Psychrobacter sp.)[10]、假单胞菌属(Pseudomonas sp.)[11]、沙雷氏菌属(Serratia)[12]、根霉属(Rhizopus)[13]、曲霉属(Aspergillus)[14]等。桑鹏等[15]从大理弥渡白总旗热泉筛选出1株产高温脂肪酶的不动杆菌(Acinetobacter sp.),该菌株耐高温,所产脂肪酶的最适温度为45 ℃,最适pH为5.0。Chen等[16]从冲绳南部深海沉积物中分离出的嗜冷杆菌C18具有胞外脂肪酶活性,克隆其脂肪酶基因并在大肠杆菌中表达发现,脂肪酶的最适温度为30 ℃,最适pH为8.0,对底物C14具有最高的水解活性。周换景等[17]从富油土壤中筛选到1株产脂肪酶的黑曲霉 HF45,采用正交试验对HF45菌株的发酵产酶条件进行优化,优化后的酶活提高了4倍。
目前对于微生物来源脂肪酶的研究大多集中在中高温脂肪酶,而对于低温脂肪酶的研究较少。刘元利等[18]从青海污染原油筛选出的沙雷氏菌脂肪酶的最适为20 ℃,但在5 ℃的酶活不足10%。张悦[19]报道的嗜冷杆菌低温脂肪酶的最适温度为40 ℃,20 ℃下能保留54.38%的酶活。低温脂肪酶是一种能有效催化低温反应的酶,由于其松散的结构和高柔韧性,具有最适反应温度低、酶促反应活化能低以及热稳定性低的特点[20−22],已逐渐成为酶学研究的热点。低温脂肪酶具有独特的冷适应性和催化活性,在食品工业、医药、废水处理以及洗涤业等领域具有巨大的应用潜力[23]。
大兴安岭寒地森林是典型的低温环境,开发漠河森林微生物具有巨大的经济和科学价值。本研究以漠河县兴安落叶松林为主的林下土壤为材料,筛选出能产低温脂肪酶的菌株,并对其进行形态学、生理生化特性以及分子生物学鉴定,克隆其脂肪酶基因并在大肠杆菌中成功表达,研究了重组脂肪酶的酶学性质,为发酵工业低温脂肪酶的新备选菌株的开发应用提供参考,也为脂肪酶的工业应用奠定理论基础。
1. 材料与方法
1.1 材料与仪器
土样 采自漠河县兴安落叶松林为主的林下土壤,样品采集前先拂去土壤表面的地面枯落物和动植物残体,采集离地表5~10 cm的土壤,每份样品不少于50 g,采集后置于无菌密封袋中,放在保温箱,带回实验室进行后续处理;蛋白胨、酵母膏、琼脂 分析纯,采购于北京奥博星生物技术有限公司;葡萄糖、蔗糖、氯化钠、Na2HPO4、KH2PO4、(NH4)2SO4、MgSO4·7H2O、FeSO4·7H2O等 分析纯,采购于上海生工生物工程有限公司;罗丹明B 上海源叶生物科技有限公司;聚乙烯醇 上海国药集团;橄榄油、对硝基苯酚(pNP)、对硝基苯酚己酸酯(pNPC,C6)、对硝基苯酚辛酸酯(pNPC,C8)、对硝基苯酚癸酸酯(pNPD,C10)、对硝基苯酚月桂酸酯(pNPL,C12)、对硝基苯酚豆蔻酸酯(pNPM,C14)、对硝基苯酚棕榈酸酯(pNPP,C16)、对硝基苯酚硬脂酸酯(pNPS,C18) 上海阿拉丁生化科技股份有限公司;细菌基因组DNA提取试剂盒、DNA纯化回收试剂盒 天根生化科技有限公司;Clon Express® II One Step Cloning Kit 南京诺唯赞生物公司。
MicroCL Fresco高速冷冻离心机 美国赛默飞世尔科技公司;MLS-3780高压蒸汽灭菌锅 济南欧莱博科学仪器有限公司;Ni NTA Beads 6FF重力柱 常州天地人和生物科技有限公司;JY92-IIDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;250B恒温培养箱 上海博讯医疗生物仪器股份有限公司;THZ-300C恒温培养摇床 上海一恒科技有限公司;CX43光学显微镜 日本奥林巴斯;Mini-Protean Ⅱ型电泳仪、S1000PCR扩增仪 美国伯乐公司;SpectraMax13连续波长多功能酶标仪 美国Molecular Devices公司;PHS-3C数字式pH计 上海佑科仪器仪表有限公司。
1.2 实验方法
1.2.1 培养基的配制
橄榄油乳化液:聚乙烯醇9 g溶于300 mL去离子水,加热煮沸溶解,冷却后用纱布过滤,加入100 mL橄榄油,超声20 min至乳白色,121 ℃,15 min。
富集培养基(1 L):酵母膏0.2 g,Na2HPO4 3.5 g,KH2PO4 1.5 g,MgSO4·7H2O 0.5g,NaCl 0.5 g,橄榄油乳化液10 mL,121 ℃,15 min。
初筛培养基(1 L):葡萄糖1 g,酵母膏1 g,蛋白胨2 g,FeSO4·7H2O 1 g,K2HPO4 1 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.01 g,橄榄油乳化液12 mL,琼脂20 g,3%的罗丹明B溶液1 mL,121 ℃,15 min。
种子培养基(1 L):葡萄糖20 g,(NH4)2SO4 5 g,K2HPO4 1 g,MgSO4·7H2O 0.5 g,橄榄油乳化液10 mL,121 ℃,15 min。
发酵培养基(1 L):蛋白胨40 g,蔗糖10 g,(NH4)2SO4 1 g,K2HPO4 2 g,MgSO4·7H2O 0.1 g,橄榄油乳化液500 μL,121 ℃,15 min。
1.2.2 菌体富集培养
称取10 g土样与90 mL无菌水混匀,加入玻璃珠,在28 ℃,150 r/min条件下振荡30 min制成10−1菌悬液。静置2 h后,在无菌条件下,取5 mL上清液加入含有50 mL富集培养基的三角瓶中,以30 ℃,150 r/min培养2~3 d。
1.2.3 产脂肪酶菌株的初筛及分离纯化
将富集培养基用0.9%的无菌生理盐水稀释为10−5、10−6、10−7、10−8的菌悬液,分别取200 μL涂布在初筛平板培养基上,在恒温培养箱中30 ℃倒置培养3~5 d,观察平板的菌落生长情况,挑取在365 nm紫外光下有荧光圈的菌落,平板划线至新的初筛平板培养基上,30 ℃培养2~3 d,分离至单一菌落,将其保存在斜面培养基。
1.2.4 产脂肪酶菌株的复筛
将初筛得到的菌种转接到种子培养基中,30 ℃,150 r/min,培养24 h,将种子液以2%的接种量接种至发酵培养基,在相同条件下培养3 d。取一定量的发酵液,8000 r/min,4 ℃,离心10 min,取上清液为粗酶液,进行酶活力的测定。
1.2.5 酶活测定
采用pNP法测定脂肪酶活力[24],步骤如下:将0.2 mL底物溶液(p-NPP溶于异丙醇中至终浓度为10 mmol/L)加入到1.5 mL缓冲液(50 mmol/L Tris-HCl,pH8.0)中,充分混匀后在37 ℃预热15 min,加入0.1 mL适当稀释的酶溶液,37 ℃反应15 min后,加入1 mL SDS终止反应,测定反应物在OD410处的吸光度值。
脂肪酶活力单位定义为:在一定条件下,每分钟催化p-NPP水解产生1 μmol对硝基苯酚所需要的酶量定义为一个酶活力单位。
1.2.6 菌株鉴定
形态学鉴定和生理生化特性鉴定:对产酶菌株进行革兰氏染色并观察菌落的形状、颜色、表面、边缘特征,生理生化特性的鉴定包括糖类发酵实验、明胶水解实验、硫化氢产气实验、硝酸盐产气实验等[25]。
分子生物学鉴定:采用细菌组DNA提取试剂盒提取产酶菌株的基因组DNA,并利用16S rDNA通用引物进行PCR扩增,Primer 1-AGAGTTTGATCMTGGCTCAG;Primer 2-TACGGYTACCTTGTTACGACTT。反应体系(50 μL):10×Ex Taq buffer 5 μL,2.5 mmol/L dNTP Mix 4 μL,10 μmol/L Primer 1 2 μL,10 μmol/L Primer 2 2 μL,5U Ex Taq 0.5 μL,Template 2 μL,无菌水34.5 μL。PCR扩增程序:94 ℃预变性3 min。94 ℃ 30 s,54 ℃ 30 s,72 ℃ 90 s,24个循环,末次循环后72 ℃ 10 min。将PCR产物送至美吉生物医药科技有限公司进行测序。
1.2.7 重组菌株的构建、表达与纯化
脂肪酶基因的克隆:通过在NCBI对苏云金芽孢杆菌脂肪酶基因进行序列比对,选择脂肪酶基因进行引物设计,为方便后续载体连接,每条引物前都引入一段载体同源臂,LipZ-240F-TGTTTAACTTTAAGAAGGAGATATACCATGCGTACTCCTTTATCCTTTGATAAAGACAC;LipZ-240R-CTCAGCTTCCTTTCGGGCTTTGTTAGTGGTGGTGGTGGTGGTGAAAATGAGAAGTCAGACATGTTTTGTATGTPCR。反应体系(50 μL)包括LipZ-240F 1 μL,LipZ-240R 1 μL,基因组模板1 μL,DNA聚合酶(2×)25 μL,无菌水22 μL。PCR扩增程序:95 ℃预变性5 min,95 ℃ 30 s,60 ℃ 15 s,72 ℃ 2 min进行30个循环。末次循环后72 ℃ 5 min,4 ℃ ∞。扩增后使用1%琼脂糖凝胶电泳验证PCR产物,利用DNA回收试剂盒进行纯化回收。
重组载体的构建:设计引物通过反向PCR将载体Pet28a线性化,通过无缝克隆技术将含有载体同源臂的脂肪酶片段与载体重组连接,具体操作参考Clon Express® II One Step Cloning Kit说明书。将重组PCR产物转化至感受态(DH5α)中,过夜培养,挑单菌落送至华大基因生物科技公司进行测序,提取测序正确的质粒转化到表达宿主大肠杆菌BL21(DE3)。37 ℃,150 r/min过夜培养后保存为甘油菌。
脂肪酶的表达、分离与纯化:将甘油菌转接于含有卡那霉素的LB培养基试管中活化,将活化后的种子液按照2%的接种量接种至含有卡那霉素LB培养基的三角瓶,37 ℃,200~250 r/min,摇床培养2~3 h,待OD600值为0.6~0.8,加入终浓度为0.4 mmol/L的IPTG诱导,20 ℃,220 r/min,摇床培养16 h,离心(10000 r/min,4 ℃,5 min),弃上清,用含有10 mmol/L的缓冲液重悬菌体后,置于冰水浴中超声破碎30 min,离心收集上清液,经0.22 μm滤膜过滤后使用Ni NTA Beads 6FF重力柱纯化,纯化后过夜透析即为酶液,通过SDS-PAGE检测蛋白表达情况。
1.2.8 温度对脂肪酶活力和稳定性的影响
分别在不同温度(4、20、30、40、50和60 ℃)下测定脂肪酶的活力,确定酶的最佳反应温度;将酶液分别在上述温度下孵育6 h。每隔1 h取样测定酶活,来评估脂肪酶的温度稳定性[26]。
1.2.9 pH对脂肪酶活力和稳定性的影响
缓冲液体系:柠檬酸-磷酸盐缓冲液(pH5.0~7.0)、Tris-HCl缓冲液(pH8.0~9.0)和碳酸氢钠-碳酸氢钠缓冲液(pH10.0)[27]。分别在各缓冲液中加入纯化后的酶液,15 min后测定pH(5、6、7、8、9、10和11)条件下的酶活;将酶液分别在不同pH(5、6、7、8、9、10和11)缓冲液中处理12 h,在37 ℃,pH8.0条件下测定脂肪酶的稳定性[27]。
1.2.10 金属离子对脂肪酶活力的影响
将酶液分别加入终浓度为5 mmol/L和10 mmol/L的含有K+、Na+、Ca2+、Mg2+、Mn2+、Zn2+、Cu2+、Fe2+、Fe3+、Cr3+的缓冲液,在37 ℃,pH8.0条件下测定酶活,以不添加金属离子的酶液为对照[28]。
1.2.11 有机溶剂和表面活性剂对脂肪酶活力的影响
将甲醇、乙醇、异丙醇、乙腈、二甲基亚砜(DMSO)、乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、Tween-80和Triton X-100分别按照5%和10%的 体积分数加入酶反应体系中。在最适温度下孵育1 h后测定脂肪酶剩余活性,以不添加化学试剂的酶液作为对照[29]。
1.2.12 脂肪酶的底物特异性
分别配制对硝基苯酚己酸酯(pNPC,C6)、对硝基苯酚辛酸酯(pNPC,C8)、对硝基苯酚癸酸酯(pNPD,C10)、对硝基苯酚月桂酸酯(pNPL,C12)、对硝基苯酚豆蔻酸酯(pNPM,C14)、对硝基苯酚棕榈酸酯(pNPP,C16)和对硝基苯酚硬脂酸酯(pNPS,C18)的底物溶液,在最适温度和pH条件下测定酶活。
1.3 数据处理
实验数据均测定3次平行,实验结果采用平均值±标准差表示。采用Microsoft Excel 2017进行数据统计,运用SPSS 20.0进行单因素方差分析及显著性分析,采用Microsoft Excel 2017进行图像绘制。
2. 结果与分析
2.1 脂肪酶产生菌的筛选
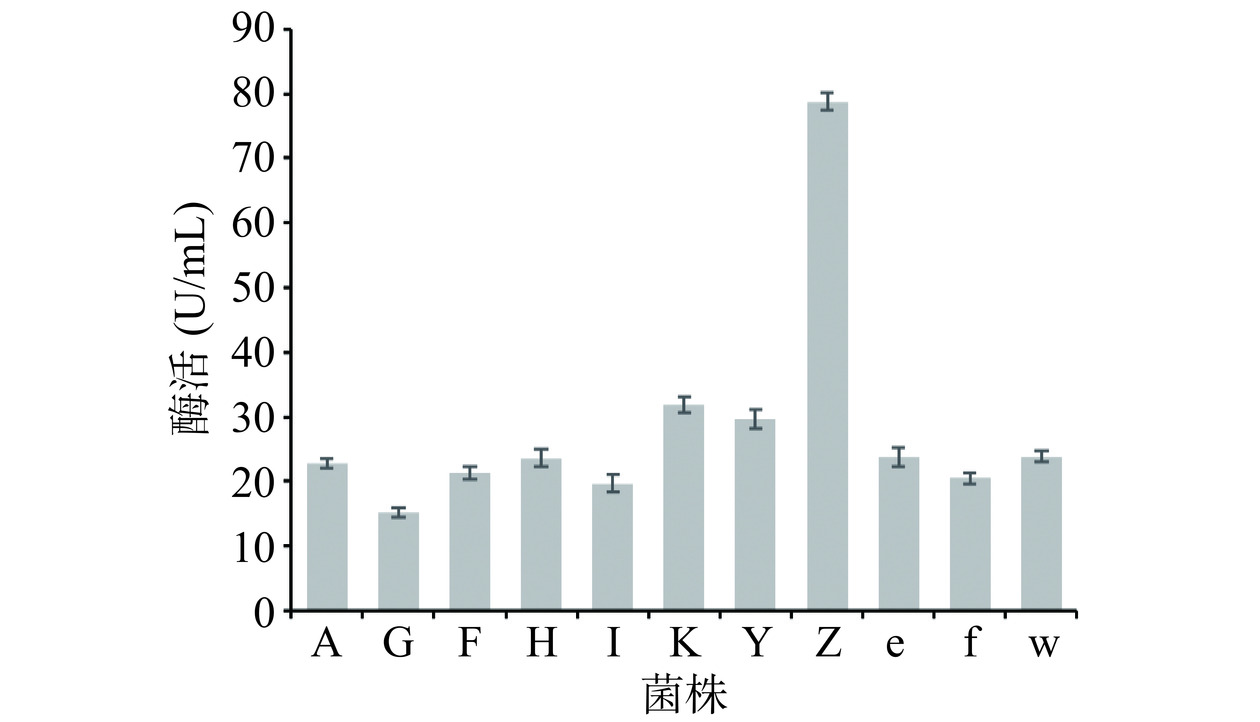
经过初筛,共11株菌株(A、G、F、H、I、K、Y、Z、e、f、w)具有产脂肪酶的能力,对初筛结果中11株菌株进行复筛,通过测定粗酶液的酶活(图1)发现菌株Z的酶活力最高,为78.82±1.47 U/mL,因此选取菌株Z进行后续实验研究。
2.2 脂肪酶产生菌的形态学鉴定
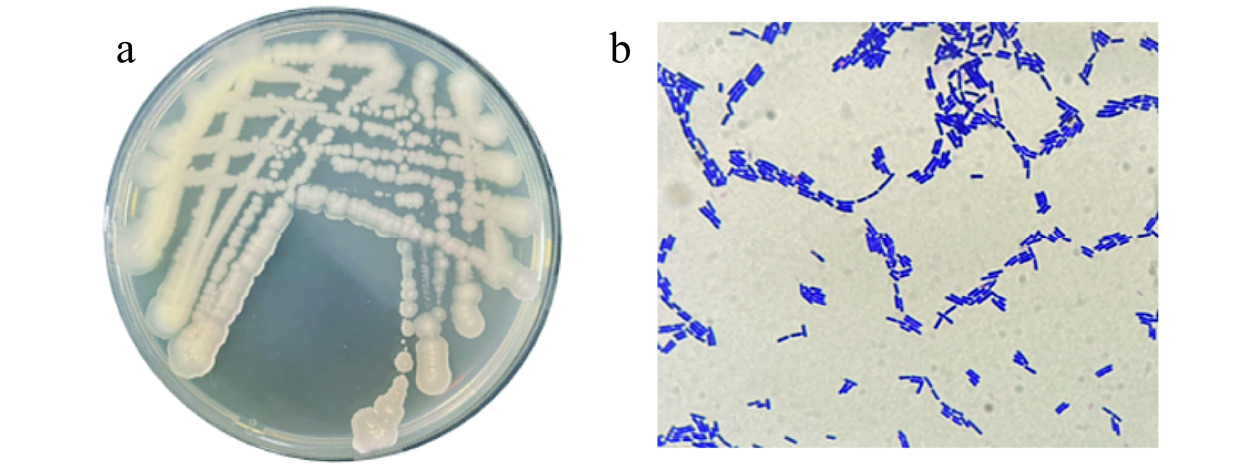
将菌株Z在营养琼脂培养基上30 ℃培养24 h,菌落呈乳黄色,近圆形,表面湿润不透明、菌落外沿稍有扩散、边缘不整齐(图2a)。革兰氏染色呈阳性,菌体呈杆状(图2b)。
2.3 脂肪酶产生菌的生理生化特性鉴定
菌株Z的生理生化特性见表1。该菌株可以利用葡萄糖并产气、不能利用阿拉伯糖、山梨醇、蔗糖、乳糖和木糖醇,紫牛乳试验和明胶试验结果为阳性,能产生硫化氢气体,硝酸盐产气试验为阳性。
表 1 菌株Z生理生化鉴定Table 1. Physiological and biochemical identification of strain Z实验名称 结果 实验名称 结果 葡萄糖产气 + 木糖醇 − 阿拉伯糖 − 紫牛乳 + 山梨醇 − 明胶 + 蔗糖 − 硫化氢 + 乳糖 − 硝酸盐产气 + 注:“+”为阳性,“−”为阴性。 2.4 脂肪酶产生菌的分子生物学鉴定
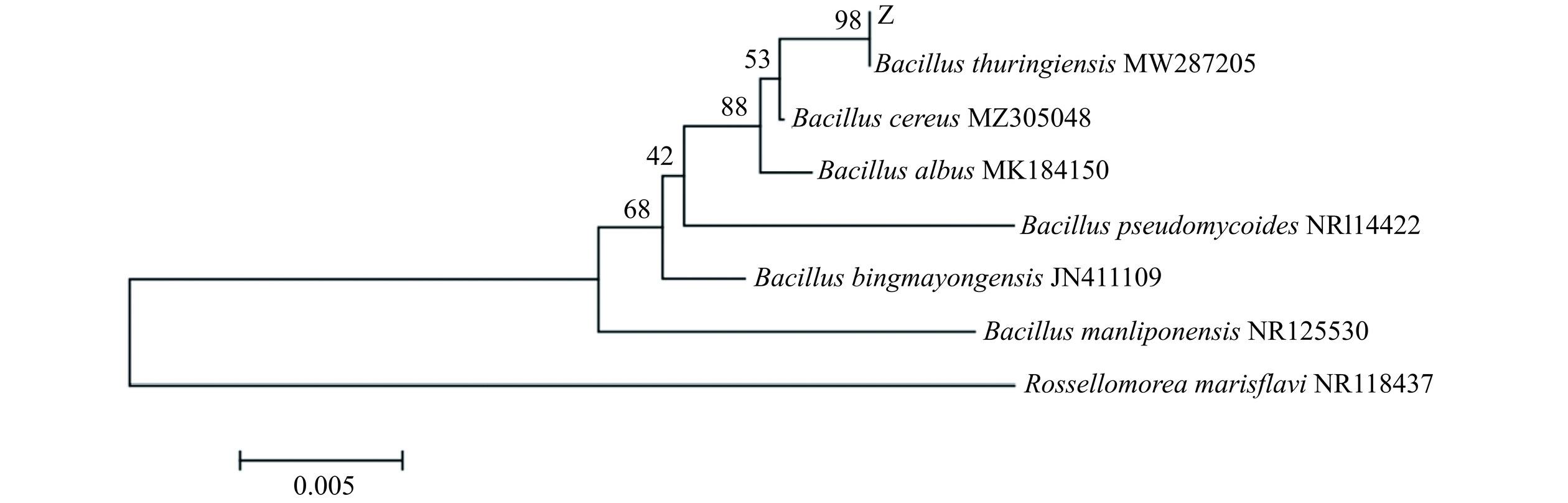
PCR扩增结果表明,菌株Z的16S rDNA片段大小为1500 bp左右,将该序列在GenBank中进行Blast序列比对,发现菌株Z与芽孢杆菌属多个菌种的16S rDNA的同源性高达98%,根据比对结果构建系统发育树见图3,从见图3中可以看出,Z与苏云金芽孢杆菌MW287205的亲缘关系是最近的,结合前述的生化鉴定结果以及系统发育树分析,判定Z为苏云金芽孢杆菌。
2.5 脂肪酶基因的克隆表达与纯化
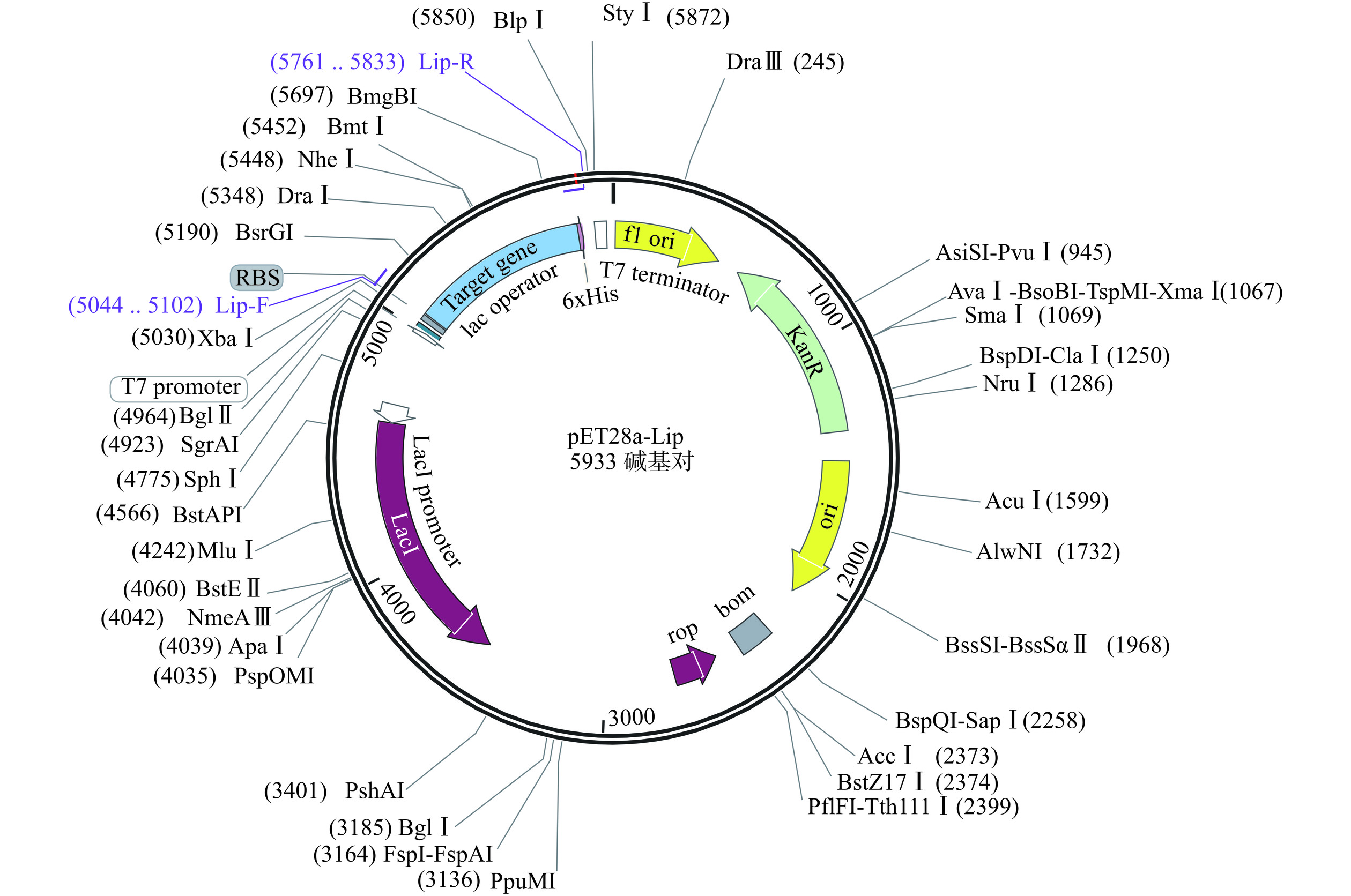
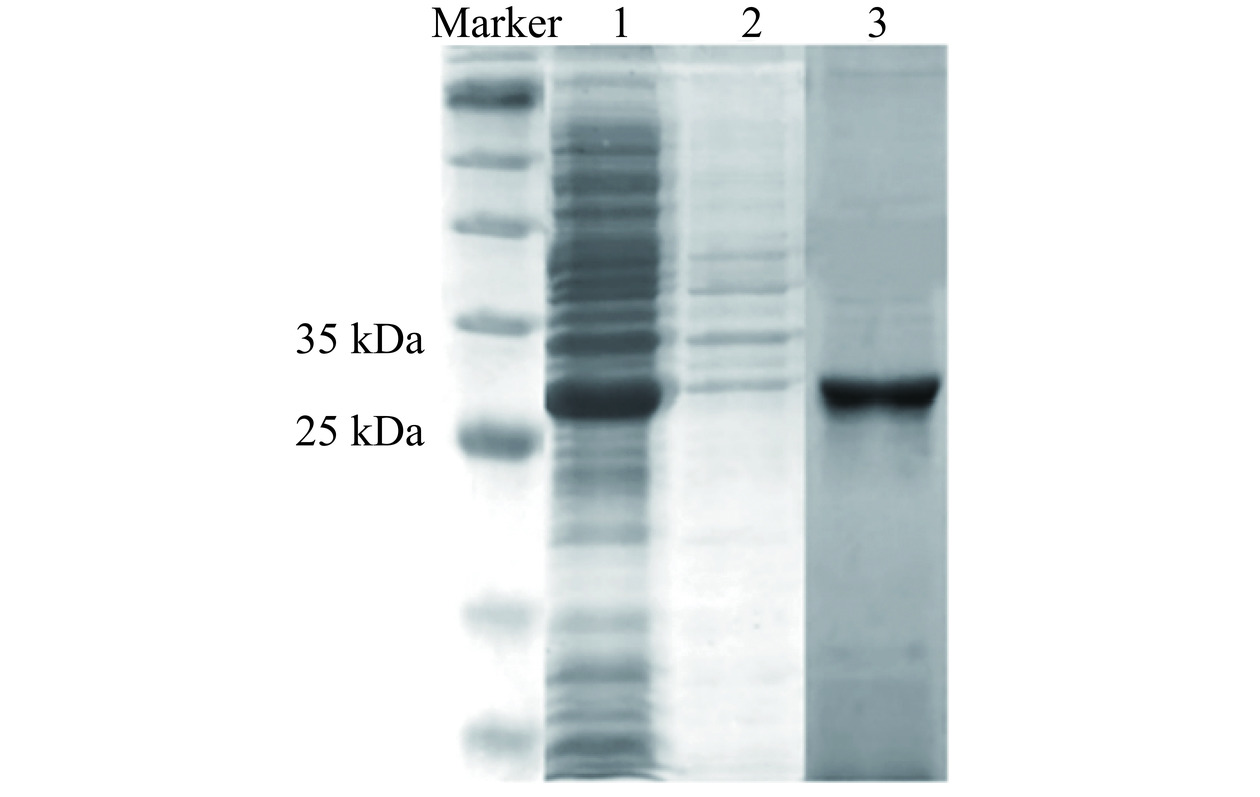
构建的重组载体pET28a-Lip如图4所示,重组质粒大小为5933 bp。重组菌经过诱导表达、菌体破碎以及Ni NTA Beads 6FF重力柱纯化后,经过SDS-PAGE验证蛋白条带,从图5中可以看出,目的蛋白分子量为27 kDa,与目标蛋白分子量的理论值一致。对目标蛋白过夜透析去除咪唑小分子,用于后续酶学性质的研究。
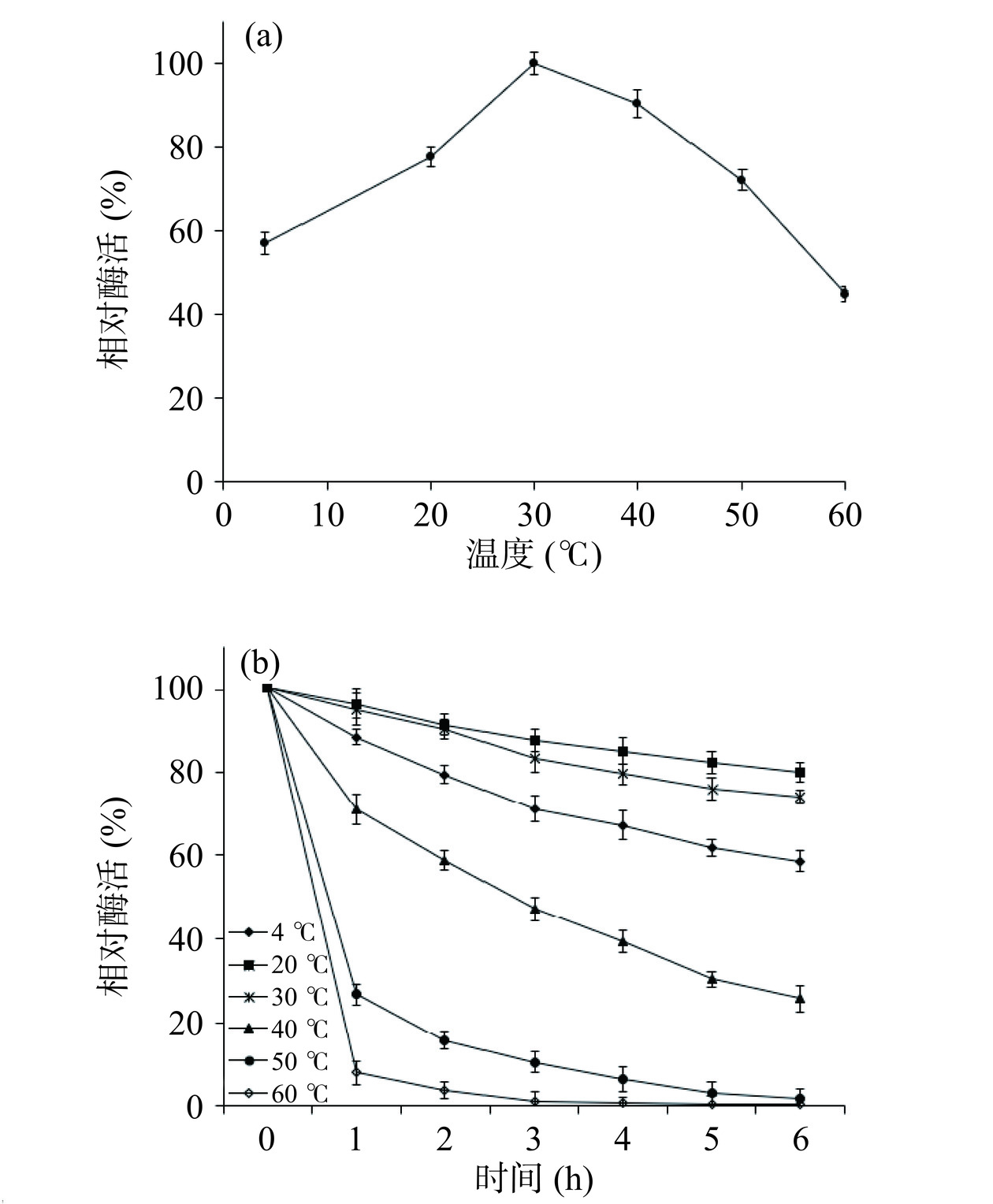
2.6 温度对脂肪酶Lip240活性和稳定性的影响
如图6a所示,脂肪酶Lip240的最适反应温度为30 ℃,在4 ℃仍可保持56%以上的酶活力,表明该酶属于低温脂肪酶,并且低温下的酶活高于前人报道。刘思远等[30]研究报道来源于Serratia plymuthica脂肪酶的最适反应温度为30 ℃,4 ℃仅能保持30%的酶活。将脂肪酶在各温度下孵育一定时间,酶的活性如图6b所示,该酶在20 ℃下的相对酶活最高,6 h后仍保持80.02%以上的酶活,其次在4和30 ℃保持较高酶活,6 h后的酶活均在58%以上,当温度升高到50 ℃以上时,稳定性开始降低,6 h后酶活几乎完全丧失,此时高温破坏了脂肪酶的构象,改变了活性位点的构型,从而减少了酶与底物的相互作用[27]。
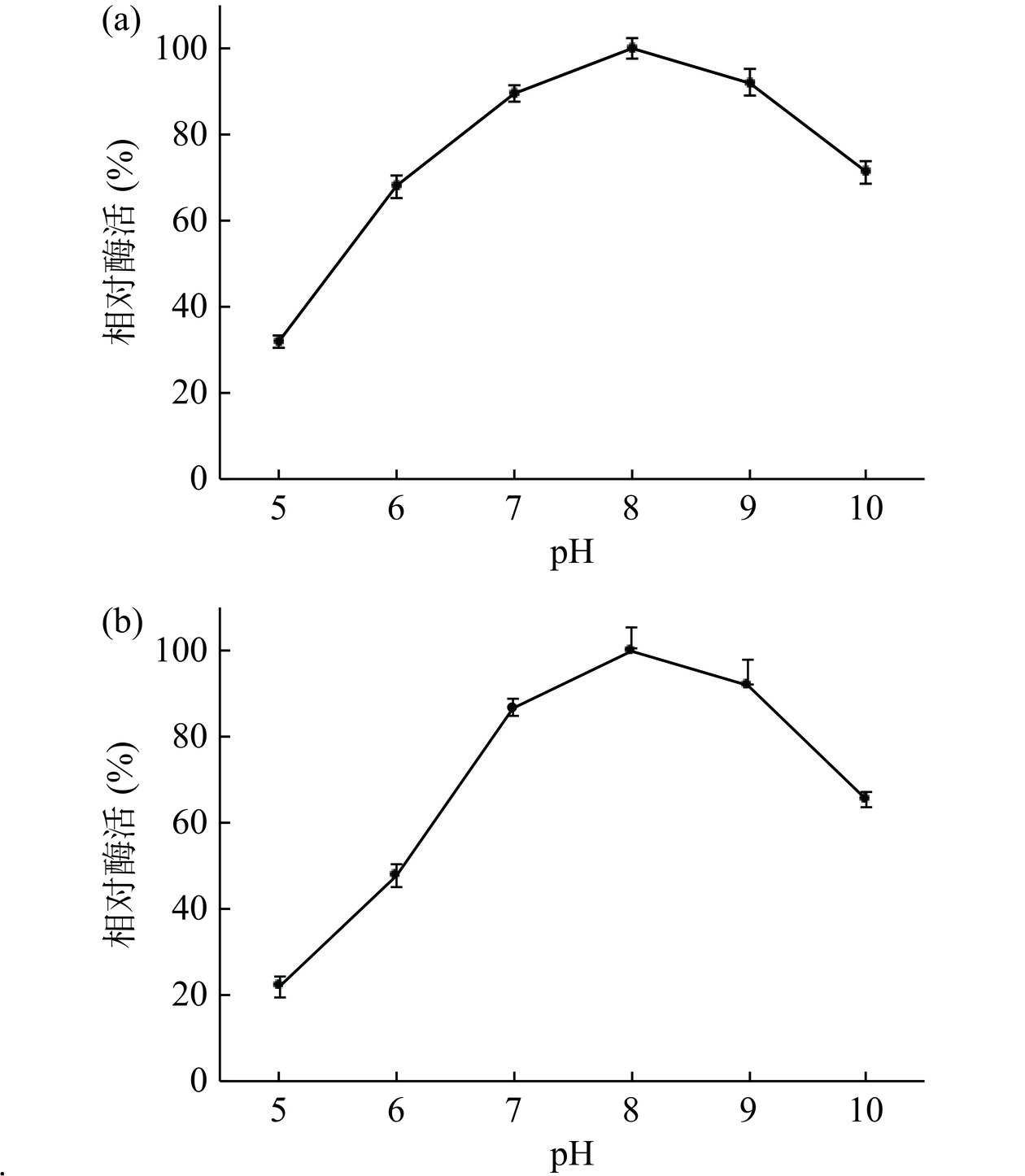
2.7 pH对脂肪酶Lip240活性和稳定性的影响
pH通过影响脂肪酶与底物的解离状态,从而影响酶对底物分子的结合能力以及催化能力[10]。从图7a中可以看出,脂肪酶在pH8.0条件下具有最高活性。当pH低于6.0时,脂肪酶的活性显著(P<0.05)下降,pH9.0~10.0范围内,脂肪酶能保持71.25%以上的活性。将脂肪酶在不同pH条件下放置12 h,结果如图7b所示,脂肪酶在最适条件下最稳定,在pH7.0~10.0范围内的活力保持在65.51%以上,具有良好的稳定性,表明该酶是一种弱碱性脂肪酶。
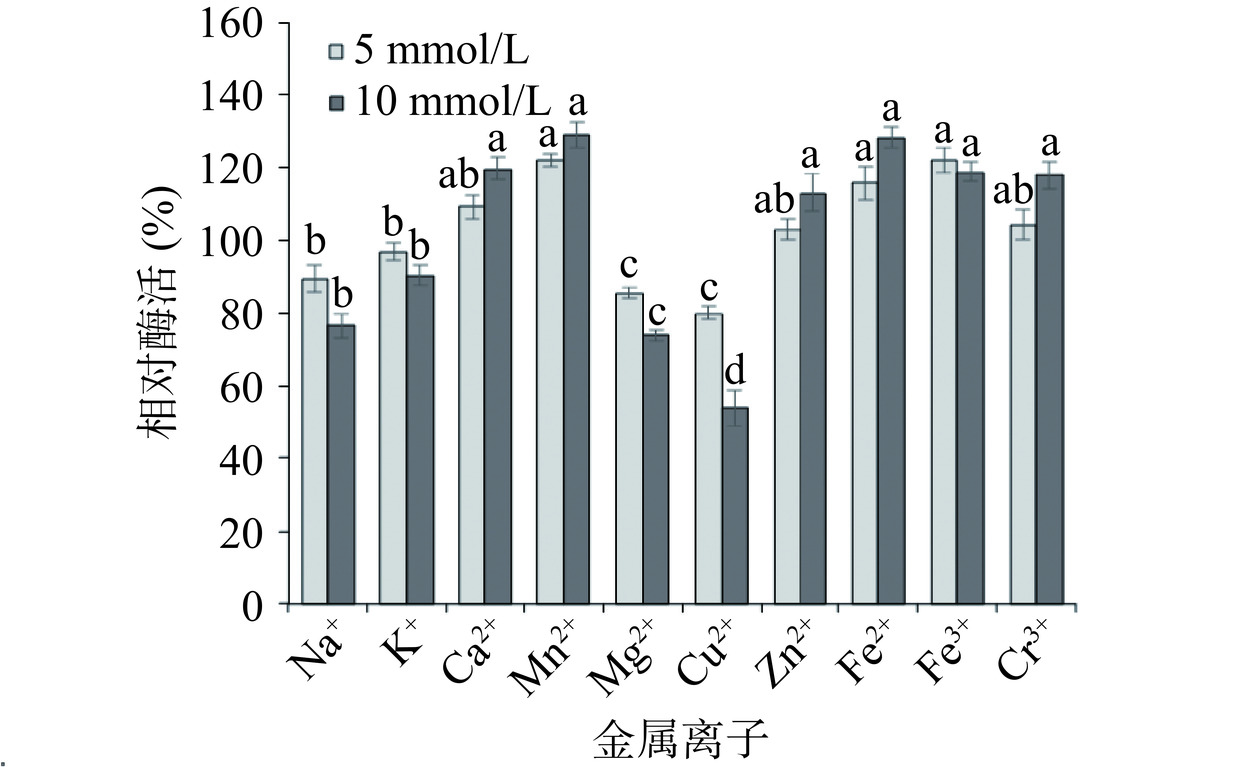
2.8 金属离子对脂肪酶Lip240活力的影响
金属离子是影响酶催化活性的重要因素。金属离子可以通过与酶的二硫键作用从而改变酶的结构,或与底物形成盐来影响酶的催化性能[31]。以不添加金属离子的酶液为对照,酶活定义为100%,不同浓度的金属离子对脂肪酶活性的影响如图8所示。Mg2+和Cu2+能显著(P<0.05)抑制脂肪酶Lip240的酶活,脂肪酶Lip240的活性在Ca2+、Mn2+、Zn2+、Fe2+、Fe3+和Cr3+存在时升高,其中,10 mmol/L的Mn2+对脂肪酶活性的促进作用最为显著(P<0.05),是对照组酶活的128.89%。Yüceer等[32]研究也证明了当有Mn2+存在时,脂肪酶活性达到最高,并且Mn2+和Ca2+离子被认为是脂肪酶生成的活化剂。
2.9 有机溶剂和表面活性剂对脂肪酶Lip240活力的影响
有机溶剂和表面活性剂对脂肪酶Lip240活力的影响如表2所示,以不添加有机溶剂和表面活性剂的酶液为对照,酶活定义为100%。其中有机溶剂对脂肪酶的活性没有显著影响,经过10%体积分数的有机溶剂处理后,酶活仍能保持在89.18%±1.79%以上,说明该酶对于有机溶剂具有良好的耐受性。严晓云等[33]研究报道JXJ-54脂肪酶经50%的乙醇溶液处理后的相对酶活力仅为15.28%。金属螯合剂(EDTA)的存在对酶活性没有显著影响,10%的EDTA处理后,脂肪酶的剩余酶活仍为88.43%±2.16%。SDS和Tween-80和Triton X-100能较明显的抑制脂肪酶的活性,其中SDS的抑制作用最为显著(P<0.05),SDS是一种阴离子表面活性剂,能使脂肪酶的构象发生变化,从而导致酶活降低[34]。
表 2 有机溶剂和表面活性剂对脂肪酶Lip240活性的影响Table 2. Effect of chemical reagent on the activity of lipase Lip240试剂名称 相对酶活力(%) 体积分数为5% 体积分数为10% 甲醇 94.14±3.12a 90.28±1.59ab 乙醇 92.18±1.84ab 91.34±1.73ab 异丙醇 97.34±2.51a 92.39±2.23ab 乙腈 92.47±1.87ab 89.18±1.79ab 二甲基亚砜 86.28±1.98b 82.71±1.63bc EDTA 91.19±1.71ab 88.43±2.16ab SDS 58.82±1.79c 44.27±1.48c Tween-80 80.15±1.62bc 59.07±2.22c Triton X-100 77.91±2.41bc 49.62±1.21c 注:5%和10%分别表示脂肪酶中有机溶剂或表面活性剂的体积分数为5%或10%时的相对酶活;不同的小写字母表示具有显著性差异(P<0.05)。 2.10 脂肪酶Lip240的底物特异性
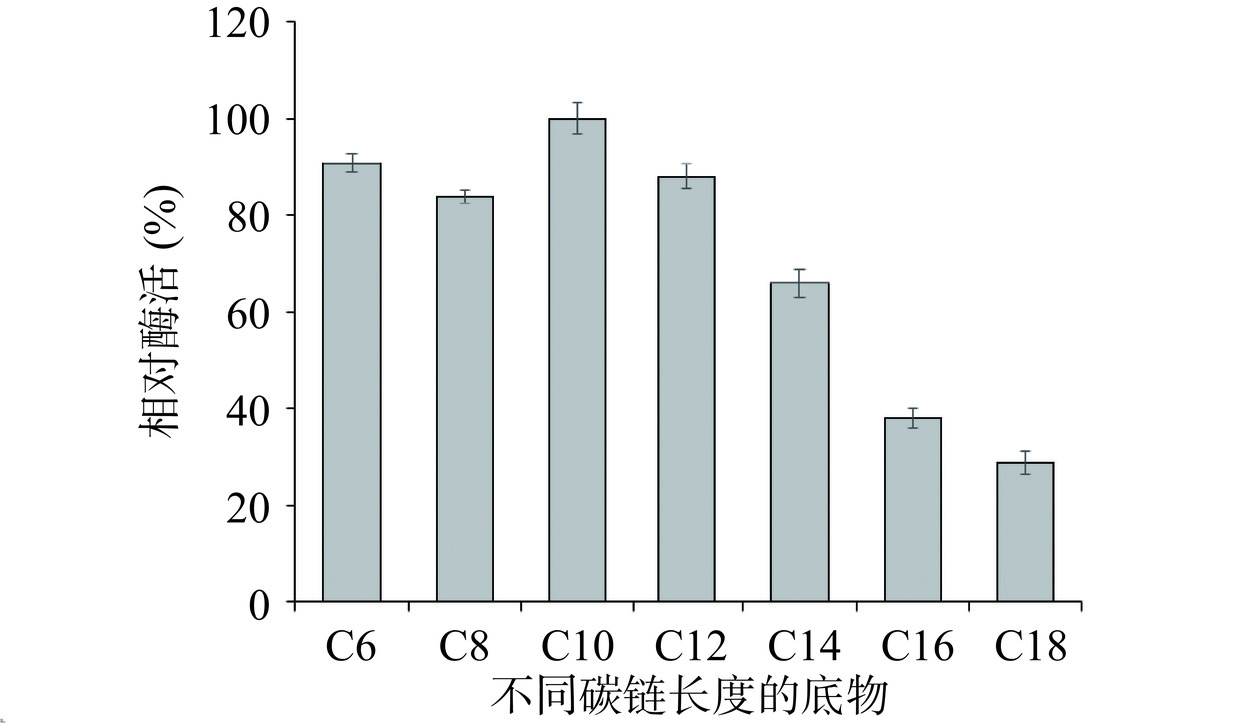
分别以不同碳链长度(C6~C18)的脂肪酸甘油酯为底物,在最佳条件下测定脂肪酶的底物特异性,由图9可知,脂肪酶对中短链底物具有水解偏好性,其中对于对硝基苯酚癸酸酯(pNPD,C10)的水解活性最高,对长链底物表现出较低的水解活性。赵鹤云等[35]研究报道了来源于Y. lipolytica的脂肪酶LIP4和LIP5偏好水解中短链底物(C4~C10)。
3. 结论
本研究从漠河县兴安落叶松林为主的林下土壤中筛选出11株产低温脂肪酶的菌株,通过pNP法测定酶活复筛得到1株酶活力最高(78.82±1.47 U/mL)的菌株(Z),经过形态学、生理生化特性以及分子生物学鉴定,确定该菌株为苏云金芽孢杆菌。通过NCBI序列比对,成功克隆了苏云金芽孢杆菌中的脂肪酶基因Lip240,并实现了苏云金芽孢杆菌脂肪酶在大肠杆菌中的异源表达,该重组酶的蛋白分子量为27 kDa。酶学性质研究表明:脂肪酶Lip240的最适反应温度为30 ℃,在4 ℃仍能保持较高酶活,最适pH为8.0。高浓度的Ca2+、Mn2+、Fe2+、Fe3+和Cr3+对脂肪酶Lip240有明显的激活作用。脂肪酶Lip240对于大多数有机溶剂表现出较好的耐受性,SDS对脂肪酶Lip240活力的抑制效果最明显。偏好水解中短链底物,最适底物为pNPD(C10)。本研究筛选的脂肪酶具有良好的有机溶剂耐受性,虽然低温下的酶活高于部分前人报道,但是对长链底物的水解活性相对较低,后续可以考虑从与底物特异性密切相关的区域适当的引入突变,拓宽该低温脂肪酶的底物谱,从而扩大该酶的应用范围。该结论可为微生物资源开发利用和低温脂肪酶的工业应用提供一定的理论指导。
-
表 1 菌株Z生理生化鉴定
Table 1 Physiological and biochemical identification of strain Z
实验名称 结果 实验名称 结果 葡萄糖产气 + 木糖醇 − 阿拉伯糖 − 紫牛乳 + 山梨醇 − 明胶 + 蔗糖 − 硫化氢 + 乳糖 − 硝酸盐产气 + 注:“+”为阳性,“−”为阴性。 表 2 有机溶剂和表面活性剂对脂肪酶Lip240活性的影响
Table 2 Effect of chemical reagent on the activity of lipase Lip240
试剂名称 相对酶活力(%) 体积分数为5% 体积分数为10% 甲醇 94.14±3.12a 90.28±1.59ab 乙醇 92.18±1.84ab 91.34±1.73ab 异丙醇 97.34±2.51a 92.39±2.23ab 乙腈 92.47±1.87ab 89.18±1.79ab 二甲基亚砜 86.28±1.98b 82.71±1.63bc EDTA 91.19±1.71ab 88.43±2.16ab SDS 58.82±1.79c 44.27±1.48c Tween-80 80.15±1.62bc 59.07±2.22c Triton X-100 77.91±2.41bc 49.62±1.21c 注:5%和10%分别表示脂肪酶中有机溶剂或表面活性剂的体积分数为5%或10%时的相对酶活;不同的小写字母表示具有显著性差异(P<0.05)。 -
[1] JAVED S, AZEEM F, HUSSAIN S, et al. Bacterial lipases:A review on purification and characterization[J]. Progress in Biophysics & Molecular Biology,2018,132:23−34.
[2] SARMAH N, REVATHI G, SHEELU G, et al. Recent advances on sources and industrial applications of lipases[J]. Biotechnology Progress,2017,34(1):100027.
[3] LIU Y Q, ZHOU X W, WEI X. A review on lipase-catalyzed synthesis of geranyl esters as flavor additives for food, pharmaceutical and cosmetic applications[J]. Food Chemistry Advances,2022,1:100052. doi: 10.1016/j.focha.2022.100052
[4] BANOTH L, DEVARAPALLI K, PAUL I, et al. Screening, isolation and selection of a potent lipase producing microorganism and its use in the kinetic resolution of drug intermediates[J]. Journal of the Indian Chemical Society,2021,98:100143. doi: 10.1016/j.jics.2021.100143
[5] CHANDRA P, SINGH R, ARORA P K. Microbial lipases and their industrial applications:A Comprehensive review[J]. Microbial Cell Factories,2020,19(1):169. doi: 10.1186/s12934-020-01428-8
[6] REETZ M T. Biocatalysis in organic chemistry and biotechnology:Past, present, and future[J]. Journal of the American Chemical Society,2013,135(34):12480−12496. doi: 10.1021/ja405051f
[7] MENDES A A, OLIVEIRA P C, DE CASTRO H F. Properties and biotechnological applications of porcine pancreatic lipase[J]. Journal of Molecular Catalysis B:Enzymatic,2012,78:119−134. doi: 10.1016/j.molcatb.2012.03.004
[8] 郝文惠, 王凡羽, 郭玉, 等. 南极深海沉积物中产低温脂肪酶菌株的筛选与基因克隆[J]. 应用海洋学学报,2014,33(3):306−311. [HAO W H, WANG F Y, GUO Y, et al. Screening of cold-active lipase producing strains from Antarctic sediments and cloning of the gene[J]. Journal of Applied Oceanography,2014,33(3):306−311.] HAO W H, WANG F Y, GUO Y, et al. Screening of cold-active lipase producing strains from Antarctic sediments and cloning of the gene[J]. Journal of Applied Oceanography, 2014, 33(3): 306−311.
[9] WI A R, JEON S J, KIM S, et al. Characterization and a point mutational approach of a psychrophilic lipase from an arctic bacterium, Bacillus pumilus[J]. Biotechnology Letters,2014,36(6):1295−1302. doi: 10.1007/s10529-014-1475-8
[10] ZHANG Y, JI F L, WANG J Y, et al. Purification and characterization of a novel organic solvent-tolerant and cold-adapted lipase from Psychrobacter sp. ZY124[J]. Extremophiles,2018,22(2):287−300. doi: 10.1007/s00792-018-0997-8
[11] 吴子君. 铜绿假单胞菌产脂肪酶发酵条件及其酶学性质研究[D]. 郑州:河南工业大学, 2023. [WU Z J. Study on fermentation conditions and enzymatic properties of lipase produced by Pseudomonas aeruginosa[D]. Zhengzhou:Henan University of Technology, 2023.] WU Z J. Study on fermentation conditions and enzymatic properties of lipase produced by Pseudomonas aeruginosa[D]. Zhengzhou: Henan University of Technology, 2023.
[12] 李婧玒, 李仁宽, 林娟, 等. 粘质沙雷氏菌低温脂肪酶的基因克隆与酶学性质分析[J]. 福州大学学报:自然科学版,2016,44(5):738−745. [LI J H, LI R K, LIN J, et al. Gene cloning and characterization of low-temperature lipase from Serratia sp J]. Journal of Fuzhou University (Natural Science Edition),2016,44(5):738−745.
[13] 范凯, 王栋, 徐岩. 华根霉液态培养生产脂肪酶不同形态菌体的转录组差异分析[J]. 微生物学通报,2018,45(1):29−41. [FAN K, WANG D, XU Y. Transcriptome comparison of Rhizopus chinensis mycelia with different morphology in submerged fermentation for lipase production[J]. Microbiology China,2018,45(1):29−41.] FAN K, WANG D, XU Y. Transcriptome comparison of Rhizopus chinensis mycelia with different morphology in submerged fermentation for lipase production[J]. Microbiology China, 2018, 45(1): 29−41.
[14] 徐鹏钧. 黑曲霉C112脂肪酶基因的克隆与鉴定及异源表达研究[D]. 长沙:中南林业科技大学, 2023. [XU P J. A novel lipase gene from Aspergillus niger C112:identification, cloning and heterologous expression and optimization[D]. Changsha:Central South University of Forestry and Technology, 2023.] XU P J. A novel lipase gene from Aspergillus niger C112: identification, cloning and heterologous expression and optimization[D]. Changsha: Central South University of Forestry and Technology, 2023.
[15] 桑鹏, 刘林波, 陈贵元, 等. 大理弥渡热泉耐热脂肪酶产生菌的筛选及其酶活性研究[J]. 中国饲料,2020(3):27−31. [SANG P, LIU L B, CHEN G Y, et al. Isolation and identification of a strain producing thermostable lipase and studying on its enzymatic properties[J]. China Feed,2020(3):27−31.] SANG P, LIU L B, CHEN G Y, et al. Isolation and identification of a strain producing thermostable lipase and studying on its enzymatic properties[J]. China Feed, 2020(3): 27−31.
[16] CHEN R, GUO L, DANG H. Gene cloning, expression and characterization of a cold-adapted lipase from a psychrophilic deep-sea bacterium Psychrobacter sp. C18[J]. World Journal of Microbiology and Biotechnology,2011,27:431−441. doi: 10.1007/s11274-010-0475-7
[17] 周换景, 何腊平, 张义明, 等. 脂肪酶产生菌的筛选及其产酶条件优化[J]. 酿酒科技,2014(1):6−11. [ZHOU H J, HE L P, ZHANG Y M, et al. Screening of a lipase-producing microbial strain and optimization of its lipase-producing conditions[J]. Liquor-Making Science & Technology,2014(1):6−11.] ZHOU H J, HE L P, ZHANG Y M, et al. Screening of a lipase-producing microbial strain and optimization of its lipase-producing conditions[J]. Liquor-Making Science & Technology, 2014(1): 6−11.
[18] 刘元利, 陈吉祥, 李彦林, 等. 一株产低温脂肪酶沙雷氏菌的鉴定、基因表达及酶学性质[J]. 中国食品学报,2018,18(6):121−129. [LIU Y L, CHEN J X, LI Y L, et al. Identification, gene expression, and enzymatic properties of a low-temperature lipase producing Salmonella strain[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(6):121−129.] LIU Y L, CHEN J X, LI Y L, et al. Identification, gene expression, and enzymatic properties of a low-temperature lipase producing Salmonella strain[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(6): 121−129.
[19] 张悦. 嗜冷杆菌低温脂肪酶分离纯化及表征[D]. 大连:大连理工大学, 2015. [ZHANG Y. Purification and characterization of cold-adapted lipase from Psychrobacter sp D]. Dalian:Dalian University of Technology, 2015.
[20] MAIANGWA J, ALI M S, SALLEH A B, et al. Adaptational properties and applications of cold-active lipases from psychrophilic bacteria[J]. Extremophiles,2015,19(2):235−247. doi: 10.1007/s00792-014-0710-5
[21] LITANTRA R, LOBIONDA S, YIM J H, et al. Expression and biochemical characterization of cold-adapted lipases from Antarctic Bacillus pumilus strains[J]. Journal of Microbiology and Biotechnology,2013,23(9):1221−1228. doi: 10.4014/jmb.1305.05006
[22] FU J, LEIROS H K, PASCALE D, et al. Functional and structural studies of a novelcold-adaptedesterase from an Arctic intertidal metagenomic library[J]. Applied Microbiology and Biotechnology,2013,97(9):3965−3978. doi: 10.1007/s00253-012-4276-9
[23] CLEONICE A S, CLARISSA I A, MARIA C D. Microbial lipases:Propitious biocatalysts for the food industry[J]. Food Bioscience,2022,45:101509. doi: 10.1016/j.fbio.2021.101509
[24] 陈瑞鹏. 深海嗜冷杆菌低温脂肪酶基因的克隆表达、酶的纯化及性质研究[D]. 青岛:青岛农业大学, 2012. [CHEN R P. Gene cloning, expression and characterization of a cold-adapted lipase from a psychrophilic deep-sea bacterium[D]. Qingdao:Qingdao Agricultural University, 2012.] CHEN R P. Gene cloning, expression and characterization of a cold-adapted lipase from a psychrophilic deep-sea bacterium[D]. Qingdao: Qingdao Agricultural University, 2012.
[25] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:370−398. [DONG X Z, CAI M Y. Handbook for identification of common bacterial systems[M]. Beijing:Science Press, 2001:370−398.] DONG X Z, CAI M Y. Handbook for identification of common bacterial systems[M]. Beijing: Science Press, 2001: 370−398.
[26] GUO C, ZHENG R, CAI R, et al. Characterization of two unique cold-active lipases derived from a novel deep-sea cold seep bacterium[J]. Microorganisms,2021,9(4):802−802. doi: 10.3390/microorganisms9040802
[27] XIANG M, WANG L, YAN Q, et al. Heterologous expression and biochemical characterization of a cold-active lipase from Rhizopus microspores suitable for oleate synthesis and bread making[J]. Biotechnology Letter,2021,43:1921−1932. doi: 10.1007/s10529-021-03167-1
[28] 赵格. 米曲霉脂肪酶AOL的酶学性质、晶体学及定点突变研究[D]. 广州:华南理工大学, 2018. [ZHAO G. Study on biochemical properties, crystal structure and site-directed mutagenesis of a lipase from Aspergillus oryzae[D]. Guangzhou:South China University of Technology, 2018.] ZHAO G. Study on biochemical properties, crystal structure and site-directed mutagenesis of a lipase from Aspergillus oryzae[D]. Guangzhou: South China University of Technology, 2018.
[29] 李菲. 三种无“盖子”结构脂肪酶的制备及其酶学性质研究[D]. 广州:华南理工大学, 2018. [LI F. A study on preparation and enzymatic characteristics of three no-lid domain lipases[D]. Guangzhou:South China University of Technology, 2018.] LI F. A study on preparation and enzymatic characteristics of three no-lid domain lipases[D]. Guangzhou: South China University of Technology, 2018.
[30] 刘思远, 申东晨, 刘峥, 等. 产低温脂肪酶菌株鉴定、发酵条件优化及酶学性质分析[J]. 食品工业科技,2023,44(20):116−125. [LIU S Y, SHEN D C, LIU Z, et al. Identification of a cold-active lipase producing strain, optimization of fermentation conditions and analysis of enzymatic properties[J]. Science and Technology of Food Industry,2023,44(20):116−125.] LIU S Y, SHEN D C, LIU Z, et al. Identification of a cold-active lipase producing strain, optimization of fermentation conditions and analysis of enzymatic properties[J]. Science and Technology of Food Industry, 2023, 44(20): 116−125.
[31] GOKBULUT A, ARSLANOGLU A. Purification and biochemical characterization of an extracellular lipase from psychrotolerant Pseudomonas fluorescens KE38[J]. Turkish Journal of Biology,2013,37:538−546. doi: 10.3906/biy-1211-10
[32] YÜCEER M, ASIK H. Texture, rheology, storage stability, and sensory evaluation of meringue's prepared from lipase enzyme-modified liquid egg white[J]. Journal of Food Processing and Preservation,2020,44:e14667.
[33] 严晓云, 石红璆, 查代明, 等. 耐有机溶剂低温碱性脂肪酶产酶条件优化及其酶学性质[J]. 安徽农业科学,2019,47(3):76−81. [YAN X Y, SHI H Q, CHA D M, et al. Optimization of enzyme production conditions and enzymatic properties of organic solvent-tolerant and cold-adapted alkaline lipase[J]. Journal of Anhui Agricultural Sciences,2019,47(3):76−81.] YAN X Y, SHI H Q, CHA D M, et al. Optimization of enzyme production conditions and enzymatic properties of organic solvent-tolerant and cold-adapted alkaline lipase[J]. Journal of Anhui Agricultural Sciences, 2019, 47(3): 76−81.
[34] 唐薇. 海洋地衣芽孢杆菌脂肪酶的酶学性质表征及催化机制研究[D]. 广州:华南理工大学, 2019. [TANG W. Characterization of enzymatic properties and catalyzation mechanism of lipase from Geobacillus sp. 12AMOR1[D]. Guangzhou:South China University of Technology, 2019.] TANG W. Characterization of enzymatic properties and catalyzation mechanism of lipase from Geobacillus sp. 12AMOR1[D]. Guangzhou: South China University of Technology, 2019.
[35] 赵鹤云, 肖潇, 徐莉, 等. 解脂耶氏酵母脂肪酶LIP4和LIP5在毕赤酵母中的异源表达及酶学性质[J]. 微生物学报,2011,51(10):1374−1381. [ZHAO H Y, XIAO X, XU L, et al. Heterologous expression and characterization of Yarrowia lipolytica lipase 4 and lipase 5 in Pichia pastoris[J]. Acta Microbiologica Sinica,2011,51(10):1374−1381.] ZHAO H Y, XIAO X, XU L, et al. Heterologous expression and characterization of Yarrowia lipolytica lipase 4 and lipase 5 in Pichia pastoris[J]. Acta Microbiologica Sinica, 2011, 51(10): 1374−1381.
-
期刊类型引用(1)
1. 田怀香,黄宁炜,葛畅,杨睿,于海燕,陈臣. 高产脂肪酶乳酸菌的筛选及其对切达干酪内酯类化合物形成的影响. 食品科学. 2025(07): 711-722 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



