Protective Effect of Probiotic-fermented Gardenia jasminoides Ellis against Alcoholic Oxidative Damage in HepG2 Cells
-
摘要: 探究乳酸芽孢杆菌DU-106和植物乳杆菌混合菌发酵栀子对HepG2细胞酒精性氧化损伤的影响。采用CCK-8法探索最佳酒精性氧化损伤造模浓度和栀子提取液干预浓度,评价发酵栀子水提液对超氧化物歧化酶(SOD)、过氧化物酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活力、丙二醛(MDA)、谷胱甘肽(GSH)含量等抗氧化能力指标以及丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)等转氨酶类释放量、促炎细胞因子(IL-1β、IL-6、TNF-α)等肝损伤评价指标的影响。结果表明栀子提取液(Gardenia jasminoides Ellis extract,GE)和发酵栀子提取液(fermented Gardenia jasminoides Ellis extract,FGE)可显著提高酒精诱导HepG2细胞活力(P<0.05),与模型组(MN)相比,GE和FGE显著提高细胞的抗氧化应激能力,减轻脂质过氧化、减少GSH耗竭、降低细胞因子水平(P<0.01),减少细胞中AST、ALT和LDH的释放,改善酒精诱导的HepG2细胞膜的受损程度。其中,FGE具有显著的抗氧化和抗炎特性,在酒精性肝损伤中具有潜在的应用前景,可以保护HepG2细胞免受酒精性氧化损伤,为开发具有护肝功能的食品提供了有益的线索。
-
关键词:
- 乳酸芽孢杆菌DU-106 /
- 肝损伤 /
- 氧化应激 /
- 抗炎 /
- HepG2细胞
Abstract: This study was to evaluate the effect of fermented Gardenia jasminoides Ellis by a mixture of Bacillus sp. DU-106 and Lactobacillus plantarum on alcoholic oxidative damage in HepG2 cells. The CCK-8 method was used to explore the optimal alcoholic oxidative damage modelling concentration and the intervention concentration of Gardenia jasminoides Ellis extract. The effect of fermented Gardenia jasminoides Ellis extract on antioxidant capacity indicators such as superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GSH-Px) activity, malondialdehyde (MDA), glutathione (GSH) content, as well as the release of transaminase-like enzymes such as alanine aminotransferase (ALT), aspartate aminotransferase (AST), and lactate dehydrogenase (LDH), and indicators of evaluation of hepatic injury, such as pro-inflammatory cytokines (IL-1β, IL-6, and TNF-α), were detected. The results showed that Gardenia jasminoides Ellis extract (GE) and fermented Gardenia jasminoides Ellis extract (FGE) significantly increased the viability of ethanol-induced HepG2 cells (P<0.05), and compared with the model group (MN), GE and FGE significantly increased the cellular antioxidative stress, attenuated lipid peroxidation, reduced GSH depletion, lowered cytokine levels (P<0.01), reduced the release of AST, ALT and LDH in the cells, and improved ethanol-induced damage to HepG2 cell membranes. Among them, FEG had significant antioxidant and anti-inflammatory properties, which were potentially valuable for protecting HepG2 cells from alcoholic oxidative damage, and the present study provided useful clues for the development of food products with hepatoprotective function.-
Keywords:
- Bacillus sp. DU-106 /
- liver injury /
- oxidative stress /
- anti-inflammatory /
- HepG2 cells
-
近年来,随着社会观念的变化和人们生活水平的提高,全球酒精消费量逐年增加[1]。长期酗酒或过量饮酒引起的脂肪肝、肝纤维化、肝硬化、肝炎等酒精性肝病成为全球关注的健康问题[2]。酒精性肝病的发展过程中,酒精代谢会产生大量的乙醛和自由基等有害物质,导致细胞内氧化应激增加,细胞膜的脂质过氧化和蛋白质氧化损伤,最终导致肝细胞的损伤和死亡[3]。预防和治疗酒精性肝损伤的主要机制包括减少氧化应激和细胞凋亡、调节炎症介质的释放、干预炎症信号通路、抑制核转录因子活性以保护肝脏,同时涉及调节肠道菌群平衡、维护肠屏障功能等多途径的干预[4−6]。中草药在护肝研究中备受关注,主要集中在其抗炎和肝保护方面[7]。肝脏是人体最大的内脏器官,承担着多种生理功能,包括新陈代谢、解毒、合成蛋白质等。肝炎、脂肪肝等疾病都与肝脏炎症和损伤密切相关,炎症反应使得肝脏组织遭受破坏,进而导致纤维化、肝硬化甚至肝癌等严重后果,现有研究表明金银花[8]、人参[9]、黄芪[10]等具有抑制炎症反应的潜力。因此,寻找一种能够减轻酒精性氧化损伤的药食同源物质对于预防和治疗酒精性肝病具有重要意义。
栀子(Gardenia jasminoides Ellis),别名黄栀子、山栀子、大红栀,属茜草科栀子属植物栀子的干燥成熟果实,是一种常见的食药同源中药材[11],现代药理学表明栀子含有栀子苷、西红花苷、黄酮、挥发油等多种活性成分[12−13],具有清热解毒、抗炎、抗氧化等药理作用[14]。栀子生品苦寒之性较强,用现代炮制方法驱除其苦寒之性对栀子的应用具有重要作用。现有研究报道,益生菌具有保肝利胆、降血糖血脂等功效,采用益生菌发酵中草药,可以降低苦涩味,增加风味,还可以促进一些成分的转化,产生更多的抗氧化、抗炎等其他生物活性的物质,提高生物利用率,更好地减轻氧化应激损伤[15−16]。苦荞提取物经过杏鲍菇发酵具有较好的抗氧化活性,并对小鼠慢性酒精性肝脏、胃黏膜损伤具有明显的保护作用;黑木耳经金黄色葡萄球菌发酵可以显著增强细胞的活性,并保护细胞免受H2O2的破坏,对急性酒精中毒小鼠的肝脏和胃具有保护作用[17];乳酸菌发酵黑大麦提高了多酚、黄酮类等抗氧化活性物质含量,具有显著改善肝脏脂肪变性的作用[18];Zhang等[19]研究发现栀子对酒精性肝损伤具有保护作用。然而,目前,栀子及其相关活性物质的研究主要聚焦在抗炎[20]、降血糖[21]、抗抑郁[22]、改善肝损伤[23−24]等方面,少有研究利用益生菌发酵技术改善其药理作用方面的报道,而益生菌作为一种对人体有益的微生物,已经被广泛应用于食品和医药领域[25]。因此,将益生菌发酵技术应用于栀子的研究可能会提高其药理作用,并产生更多的潜在益处。但目前在这方面的研究还相对较少,需要进一步的探索和研究来验证其效果。
基于此,本文利用酒精诱导建立HepG2细胞氧化损伤模型,探讨乳酸芽孢杆菌DU-106和植物乳杆菌混合菌发酵栀子对HepG2细胞酒精性氧化损伤的保护作用,以期为预防和治疗酒精性肝病提供新的策略和理论依据。通过测定栀子发酵液对HepG2细胞活力、细胞损伤程度、氧化应激指标和相关炎症细胞因子水平的影响,评估益生菌发酵栀子在减轻酒精性氧化损伤中的潜力,为益生菌发酵栀子在酒精性肝病防治中的应用提供科学依据。
1. 材料与方法
1.1 材料与仪器
栀子 浙江骄栀科技有限公司;乳酸芽孢杆菌DU-106(Bacillus sp. DU-106)、植物乳杆菌(nbk-MA2) 保藏于华南农业大学食品学院新资源食品与功能性原料评价中心;人肝癌HepG2细胞 武汉普诺赛生命科技有限公司;无水乙醇(分析纯99.5%)、胰酶、PBS缓冲液 上海麦克林生物科技有限公司;CCK-8检测液、BCA蛋白浓度测定试剂盒 碧云天生物技术有限公司;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化物酶(CAT)试剂盒 南京建成生物工程研究所;白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)试剂盒 上海酶免生物科技有限公司;DMEM高糖培养基、胎牛血清 上海源培生物科技公司。
PHSJ-3F pH计 上海仪电科学仪器股份有限公司;SH CO2细胞培养箱 上海一恒科学仪器有限公司;HH-4 数显恒温水浴锅 常州市华普达仪器有限公司;ZEISS Lab.A1 显微镜 德国蔡司公司;GL-GⅡ 立式冷冻离心机 上海安亭科学仪器厂;VersaMax 光栅型酶标仪 美国Melecular Devices公司。
1.2 实验方法
1.2.1 不同处理方法下栀子提取液的制备
栀子提取液(GE):挑选外观完整、颜色鲜黄、果皮光滑的栀子果实,用清水清洗干净后,低温冷冻干燥,按料液比1:10(w/v)加入无菌水,于温度20 ℃环境中浸泡3 d,过滤,滤液保存备用。
发酵栀子提取液(FGE):参考严静等[26]的方法稍作修改,取一定量的栀子清洗、干燥,取60 g栀子于锥形瓶中,料液比1:10(w/v),封口,121 ℃灭菌30 min,冷却后,在超净工作台中分别添加2%(w/w)白砂糖;称量0.1 g植物乳杆菌和乳酸芽孢杆菌DU-106的混合菌粉(1:1)添加到100 mL 0.9%生理盐水中活化30 min,即1×107 CFU/mL,分别向发酵罐中添加2%菌种活化液质量的活化液,于28 ℃密封发酵3 d,发酵结束后过滤,滤液保存,备用。
1.2.2 HepG2细胞培养、传代、冻存与复苏
培养:将人肝癌细胞HepG2培养在含有10%胎牛血清和1%双抗的DMEM培养基中,在37 ℃、5% CO2的恒温培养箱培养,待细胞密度达到85%时进行传代培养。
传代:在灭菌的超净工作台内吸弃原培养液,加入2 mL无菌PBS缓冲液清洗3次,用1 mL胰酶消化2 min,加入1 mL新鲜培养终止消化,轻轻吹打数次,使细胞悬浮。随后将细胞悬液置于无菌EP管内,1000 r/min离心5 min,弃除上清液,重新加入细胞培养基重悬细胞,分装至新培养瓶内培养。
细胞冻存与复苏:冻存按传代培养步骤,将生长密度达到95%的对数生长期细胞,取细胞悬液装入冻存管中,−80 ℃下放置24 h后转移到液氮罐长期保存。复苏则将冻存管置于37 ℃水浴锅,快速解冻后,将细胞液吸入无菌EP管中,加入等量新鲜培养液混匀,1000 r/min离心弃除上清液,加入1 mL新鲜培养基重悬,将其转移到培养瓶内,用移液枪吹打培养基,使细胞均匀分散在培养液中培养。细胞复苏后至少经3次传代后才可以进行实验。
1.2.3 酒精诱导HepG2细胞氧化损伤模型建立
采用CCK-8法对HepG2细胞活力进行测定。取对数生长期的HepG2细胞悬液100 μL接种于96孔板(每组平行3次),密度为1×104/孔,在37 ℃培养箱孵育24 h,待细胞贴壁,弃除原有培养基,向实验组中分别加入100 μL酒精浓度分别为200、300、400、500、600、700、800、900、1000 mmol/L的培养液,向对照组加入100 μL的新鲜培养液,培养6 h后,吸弃培养基,每孔加入90 μL新鲜培养基和10 μL CCK-8试剂,在37 ℃孵育3 h,测定其在450 nm处的吸光值,其中调零液为90 μL新鲜培养基和10 μL CCK-8试剂,根据公式计算细胞活力:
细胞活力(%)=A−A0A1−A0×100 式中:A,实验组的吸光值;A1,对照组的吸光值;A0,调零组的吸光值。
1.2.4 GE和FGE对HepG2细胞活力的影响
取对数生长期的HepG2细胞悬液,按照密度为1×104/孔接种于96孔板,每组平行3次,于37 ℃培养箱孵育24 h,待细胞贴壁,弃除培养基,向实验组中分别加入100 μL的提取液12.5、25、50、75、100、250、500、750、1000 μg/mL,向对照组加入100 μL的新鲜培养液,培养24 h,取出孔板,吸弃培养基,每孔加入90 μL新鲜培养基和10 μL CCK-8试剂,在37 ℃孵育3 h,测定其在450 nm处的吸光值,其中调零液为90 μL新鲜培养基和10 μL CCK-8试剂,计算不同浓度的栀子提取液干预后HepG2细胞活力。
1.2.5 GE和FGE对酒精诱导HepG2细胞活力的影响
取对数生长期的HepG2细胞悬液在96孔板中以每孔1×104个细胞接种,每组3个复孔,培养孵育24 h,待细胞贴壁后,弃除原有培养液。向实验组分别加入100 μL含不同浓度的GE和FGE培养基干预24 h,模型组加入100 μL培养基培养24 h,吸弃培养基,每孔用含600 mmol/L酒精的新鲜培养基预处理6 h,对照组加入100 μL新鲜培养基,培养30 h。取出孔板,吸弃培养基,每孔加入90 μL新鲜培养基和10 μL CCK-8试剂,孵育3 h后,在450 nm下测定吸光度,按照公式(1)计算在酒精诱导HepG2细胞氧化损伤模型下不同GE和FGE浓度干预后的细胞活力。
1.2.6 GE和FGE对酒精诱导HepG2细胞中ALT、AST和LDH释放量的影响
取对数生长期的HepG2细胞悬液1 mL接种于12孔板(每组3个复孔),密度为2×105/孔,孵育24 h后,吸弃培养基,分别设置对照组、模型组和实验组。对照组仅加入1 mL新鲜培养基,培养30 h;模型组加入1 mL新鲜培养基培养24 h,吸弃培养基,加入1 mL的酒精浓度600 mmol/L的新鲜培养基培养6 h;样品组加入1 mL含250和750 μg/mL GE和FGE的培养基干预24 h后,吸弃培养基,加入1 mL的酒精浓度为600 mmol/L的新鲜培养基培养6 h。培养结束后取出孔板,取出上清液,参考试剂盒说明测定ALT、AST和LDH释放量。
1.2.7 GE和FGE对酒精诱导HepG2细胞中抗氧化酶活性和MDA含量的影响
取对数生长期的HepG2细胞悬液2 mL接种于6孔板,每组3个复孔,密度为1.5×106/孔,孵育24 h,待细胞贴壁后,吸弃原有培养基,按1.2.6分组进行干预细胞,培养结束后取出孔板,加入细胞裂解液对细胞进行冰浴裂解,1000 r/min离心5 min,取上清液,参考试剂盒说明书进行测定。
1.2.8 GE和FGE对酒精诱导HepG2细胞中IL-1β、IL-6、TNF-α的影响
按1.2.6处理方法后,取上清液,按ELISA试剂盒说明书进行测定。
1.3 数据处理
实验结果表示为平均值±标准差(x̅±s),使用SPSS 25软件对数据进行统计学分析,其中P<0.05被认为具有显著性差异,数据处理采用Excel 2010、GraphPad Prism 9软件进行图表绘制。
2. 结果与分析
2.1 不同浓度的酒精和栀子提取液对HepG2细胞活力的影响
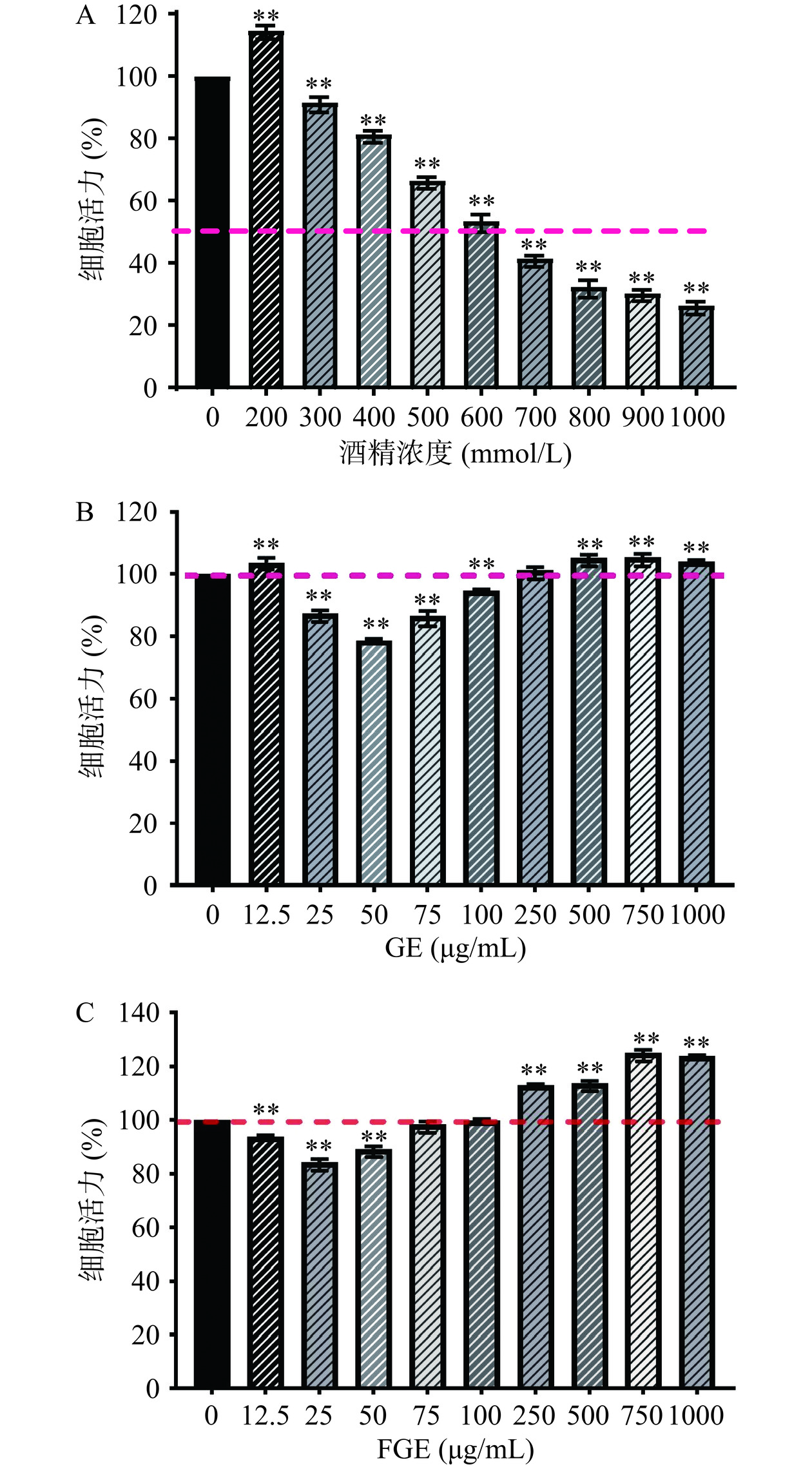
酒精在体内代谢后生成乙醛,乙醛是酒精代谢的中间产物,具有较强的氧化性。乙醛可以与细胞内的氧自由基反应,引起ROS积累并随后诱导细胞氧化损伤[27]。不同浓度的酒精对HepG2细胞活力的影响如图1A所示,与对照组相比,酒精浓度为200 mmol/L时,对细胞具有促增殖作用,这可能是低浓度的酒精可能通过调节细胞内的氧化还原状态来促进HepG2肝细胞的增殖。当酒精浓度在300~1000 mmol/L时,细胞存活率呈剂量依赖型下降。当酒精浓度为600 mmol/L时,细胞活力为53.55%±2.03%(P<0.01),达到IC50,符合构建细胞氧化应激模型细胞活力需在50%~70%之间[28]。随着酒精浓度进一步升高到700 mmol/L时,细胞活力下降到41.58%±0.79%,此时酒精对细胞表现为较强的杀伤作用,细胞内氧化损伤严重,导致细胞大量凋亡,故选择600 mmol/L作为适宜的酒精浓度,建立酒精诱导HepG2细胞氧化损伤模型,进行后续实验。
图1B和图1C分别是不同浓度的GE和FGE干预对HepG2细胞活力的影响,与对照组相比,在低浓度时,GE和FGE对细胞增殖有一定的抑制作用,对于GE,在25~100 μg/mL内具有极显著的抑制作用(P<0.01),在浓度为250~1000 μg/mL范围内,对细胞有促增殖作用,并且在一定范围内,浓度越大,促增殖作用越强;当GE浓度分别为250、750和1000 μg/mL时,细胞活力分别为101.38%±0.91%、105.54%±1%(P<0.01)和104.07%±0.51%(P<0.01);对于FGE,在浓度为12.5~50 μg/mL对HepG2细胞增殖具有显著抑制作用(P<0.01),浓度为250~1000 μg/mL对细胞促增殖作用呈剂量依赖性增强,但GE和FGE在浓度为1000 μg/mL时相比于750 μg/mL有抑制趋势,细胞活力分别从105.54%±1%下降到104.07%±0.51%、124.87%±1.23%下降到123.69%±0.42%,可能是栀子提取液含有的活性成分超出了细胞的承受范围,导致细胞活力略有降低,这与细胞的应激反应、毒性效应等有关,故实验选择浓度250、750 μg/mL作为实验组的低、高剂量,进一步探究不同浓度和处理方法的栀子提取液对酒精诱导的HepG2细胞的损伤程度、氧化应激指标和相关炎症细胞因子的影响。
2.2 不同处理方法的栀子提取液对酒精诱导HepG2细胞活力的影响
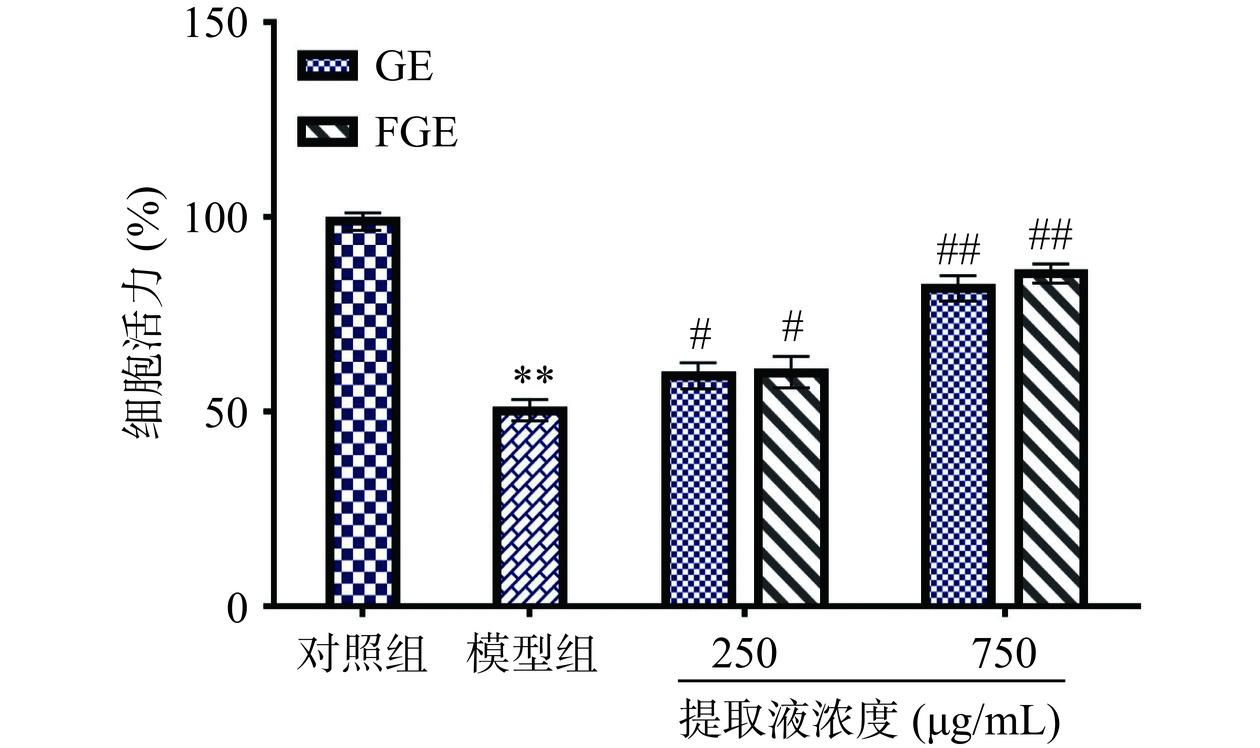
GE与FGE在不同浓度下对酒精诱导的HepG2细胞活力影响如图2所示。与对照组相比,模型组在酒精的干预后,细胞活力降低到51.26%±1.92%,差异极显著(P<0.01),与模型组相比,GE和FGE处理后对HepG2细胞活力均有不同程度的升高作用,并且表现一定的浓度依赖性,其中经过750 μg/mL的GE和FGE干预后,细胞活力分别达到82.96%±2.15%和86.66%±1.45%,细胞活力相比酒精干预组极显著提高(P<0.01),表明FGE可以显著抑制酒精对HepG2细胞的毒性作用,缓解酒精诱导的HepG2细胞氧化损伤。
2.3 不同处理方法的栀子提取液对酒精诱导的HepG2细胞中ALT、AST和LDH释放量的影响
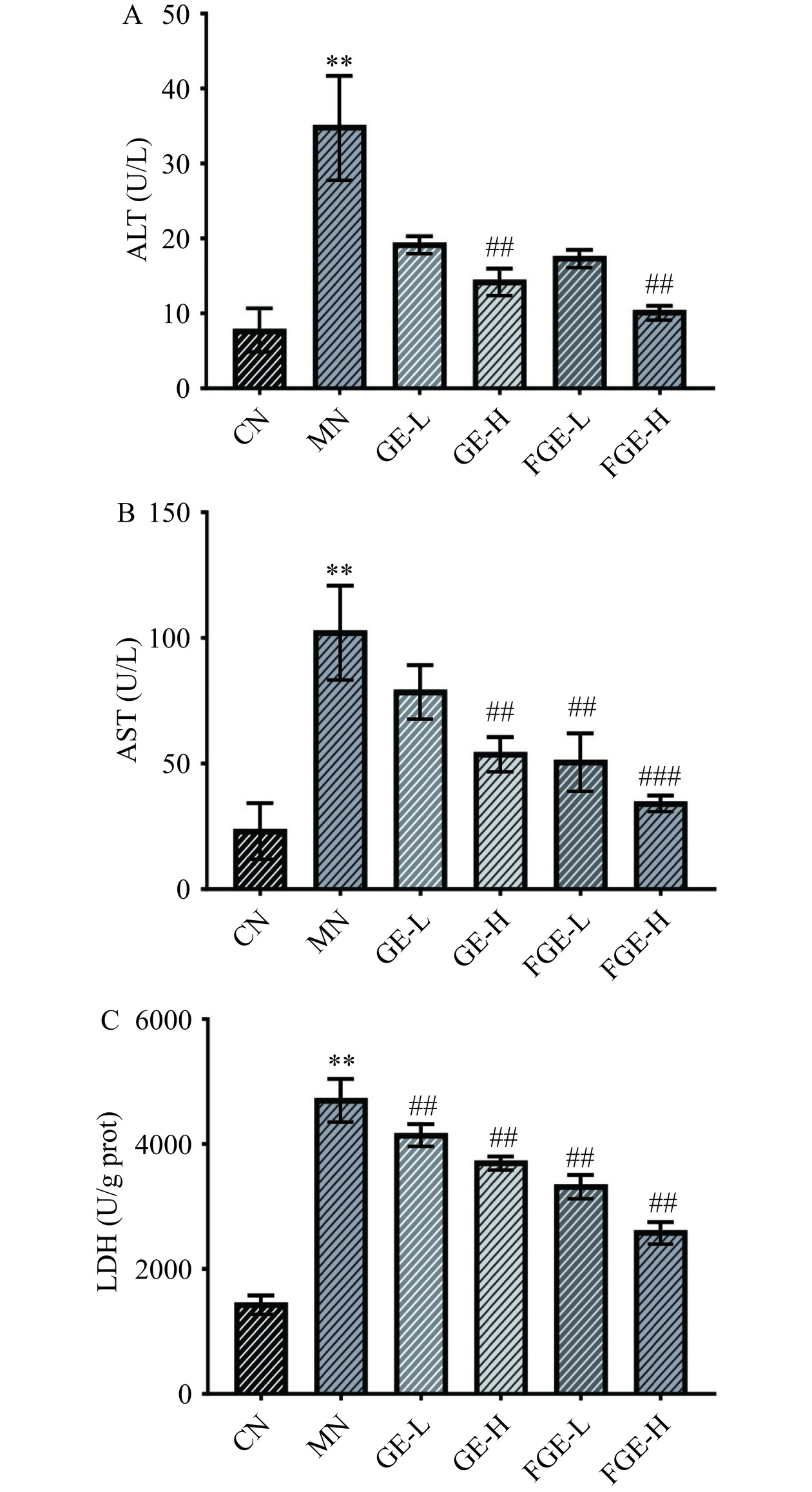
ALT、AST和LDH是一种存在于多种细胞内的酶类物质,在正常细胞状态下,ALT、AST和LDH主要存在于细胞内[29]。当细胞受到损伤后,会引起细胞膜结构的破坏,ALT、AST和LDH会从细胞内释放到细胞外,其在细胞培养液中的活性将增加。酒精诱导HepG2细胞氧化损伤模型会导致ALT、AST和LDH活力水平升高[30−31],因此,通过检测AST、ALT和LDH的变化,可以了解酒精对HepG2细胞的损伤程度。由图3可知,与CN组相比,MN组中HepG2细胞经600 mmol/L酒精诱导后,ALT、AST和LDH的活力水平分别为33.57±8.47 U/L、105.36±24.45 U/L和4735.68±212.13 U/g prot,分别为CN组的4.21、4.05和3.09倍,提示酒精对HepG2细胞造成了一定程度的损伤。在酒精诱导的HepG2细胞经过250、750 μg/mL的GE和FGE干预后,AST(GE-L组差异不显著)和LDH的活力极显著低于模型组(P<0.01),ALT在750 μg/mL活力极显著降低(P<0.01)。AST、ALT和LDH的活力水平都随着干预浓度的升高而降低,呈一定的浓度依赖效应,并且在相同剂量下FGE抑制氧化损伤细胞的ALT、AST和LDH活力的效果优于GE,由此可见,FGE能改善酒精诱导的HepG2细胞膜的受损程度,与七叶苷原通过降低AST、ALT水平抑制酒精对HepG2细胞造成的损伤结果相似[32]。
![]() 图 3 不同处理方法下栀子提取液对氧化损伤HepG2细胞中ALT、AST和LDH释放量的影响注:与对照组相比,*表示P<0.05,差异具有显著性,**表示P<0.01,差异极显著;与模型组相比,#表示P<0.05,差异具有显著性,##表示P<0.01,差异极显著,###表示P<0.001,差异非常显著;图中字母CN表示对照组;MN表示模型组;GE-L表示未发酵栀子提取液低剂量组;GE-H表示未发酵栀子提取液高剂量组;FGE-L表示发酵栀子提取液低剂量组;FGE-H表示发酵栀子提取液高剂量组;图4、图5同。Figure 3. Effect of gardenia extract on ALT, AST and LDH release in oxidatively damaged HepG2 cells under different treatments
图 3 不同处理方法下栀子提取液对氧化损伤HepG2细胞中ALT、AST和LDH释放量的影响注:与对照组相比,*表示P<0.05,差异具有显著性,**表示P<0.01,差异极显著;与模型组相比,#表示P<0.05,差异具有显著性,##表示P<0.01,差异极显著,###表示P<0.001,差异非常显著;图中字母CN表示对照组;MN表示模型组;GE-L表示未发酵栀子提取液低剂量组;GE-H表示未发酵栀子提取液高剂量组;FGE-L表示发酵栀子提取液低剂量组;FGE-H表示发酵栀子提取液高剂量组;图4、图5同。Figure 3. Effect of gardenia extract on ALT, AST and LDH release in oxidatively damaged HepG2 cells under different treatments2.4 不同处理方法的栀子提取液对酒精诱导的HepG2细胞中抗氧化酶活性和MDA含量的影响
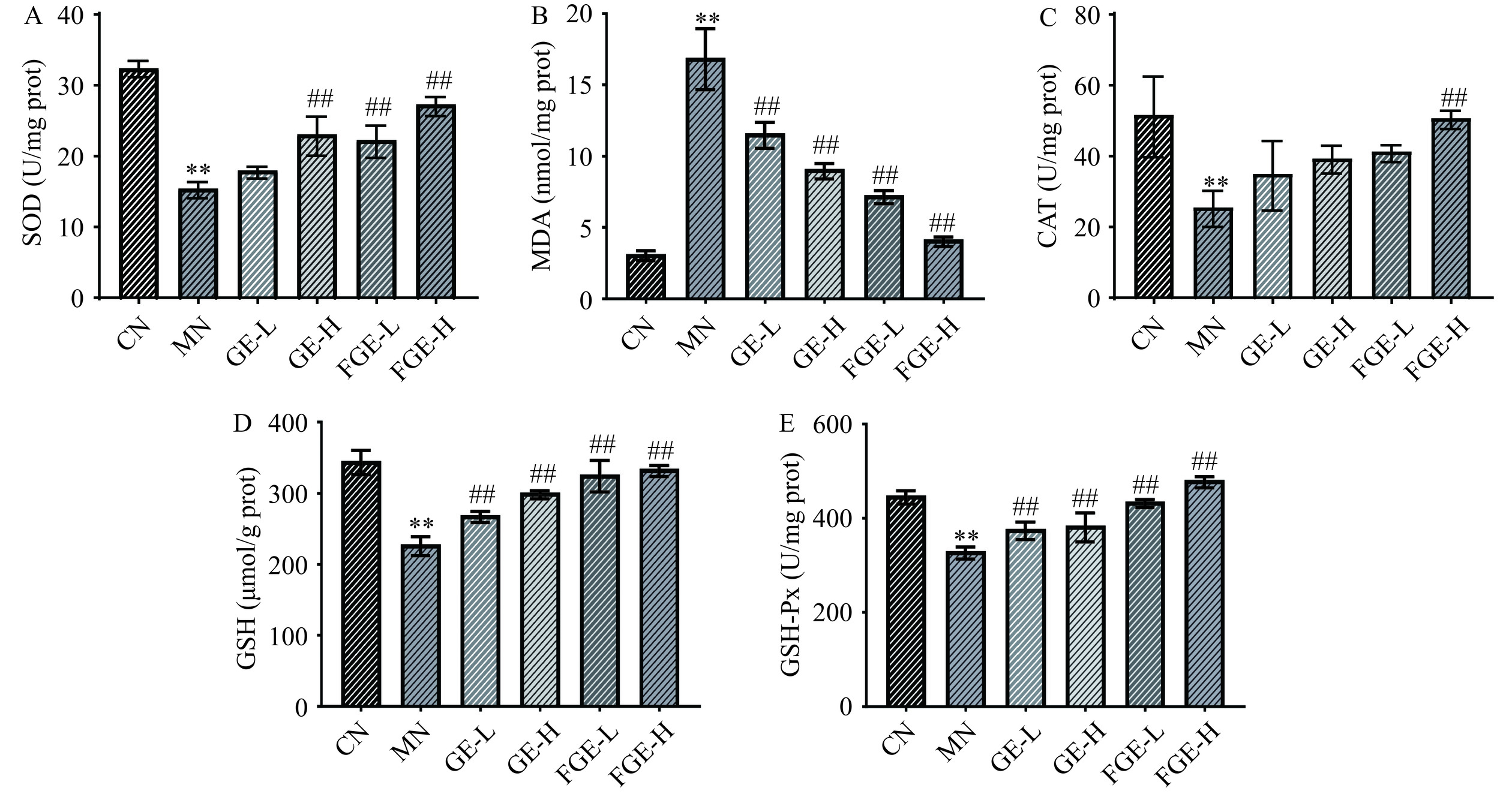
如图4所示,与CN组相比,MN组中的GSH、GSH-Px、SOD和CAT的酶活力极显著降低(P<0.01),提示经过酒精诱导损伤后,细胞的氧化还原稳态发生破坏,但在给予250、750 μg/mL的栀子提取液预处理后,与MN组相比,SOD、GSH、GSH-Px三种抗氧化酶的活性均有不同程度的提高,并表现出浓度依赖性,CAT酶活性增加,其中发酵栀子提取液高剂量组的活性极显著提升(P<0.01)。当细胞内的抗氧化防御系统受到破坏时,会产生大量的ROS,过量的ROS攻击脂质物质,促进脂质发生过氧化反应[33],其中MDA是细胞内脂质过氧化反应的主要产物之一,由图4B可知,MN组的HepG2细胞受酒精诱导后,MDA含量显著升至17.9±0.47 nmol/mg prot(P<0.01),为CN组的5.5倍。经提取液干预后,MDA含量相对于MN组极显著降低(P<0.01),表明栀子提取液和发酵栀子提取液有效减少MDA的生成,对酒精诱导的HepG2细胞脂质过氧化反应具有一定的抑制作用,并且发酵栀子提取液组改善效果最显著。综上所述,益生菌发酵栀子可以通过提高抗氧化酶的活力、降低MDA含量、抑制GSH耗竭来发挥对HepG2细胞的抗氧化损伤作用,与玉竹多糖对HepG2酒精性氧化损伤的研究结果相似[34],这表明益生菌发酵栀子和玉竹多糖可能含有一些具有抗氧化作用的成分,能够帮助降低细胞内的氧化损伤。
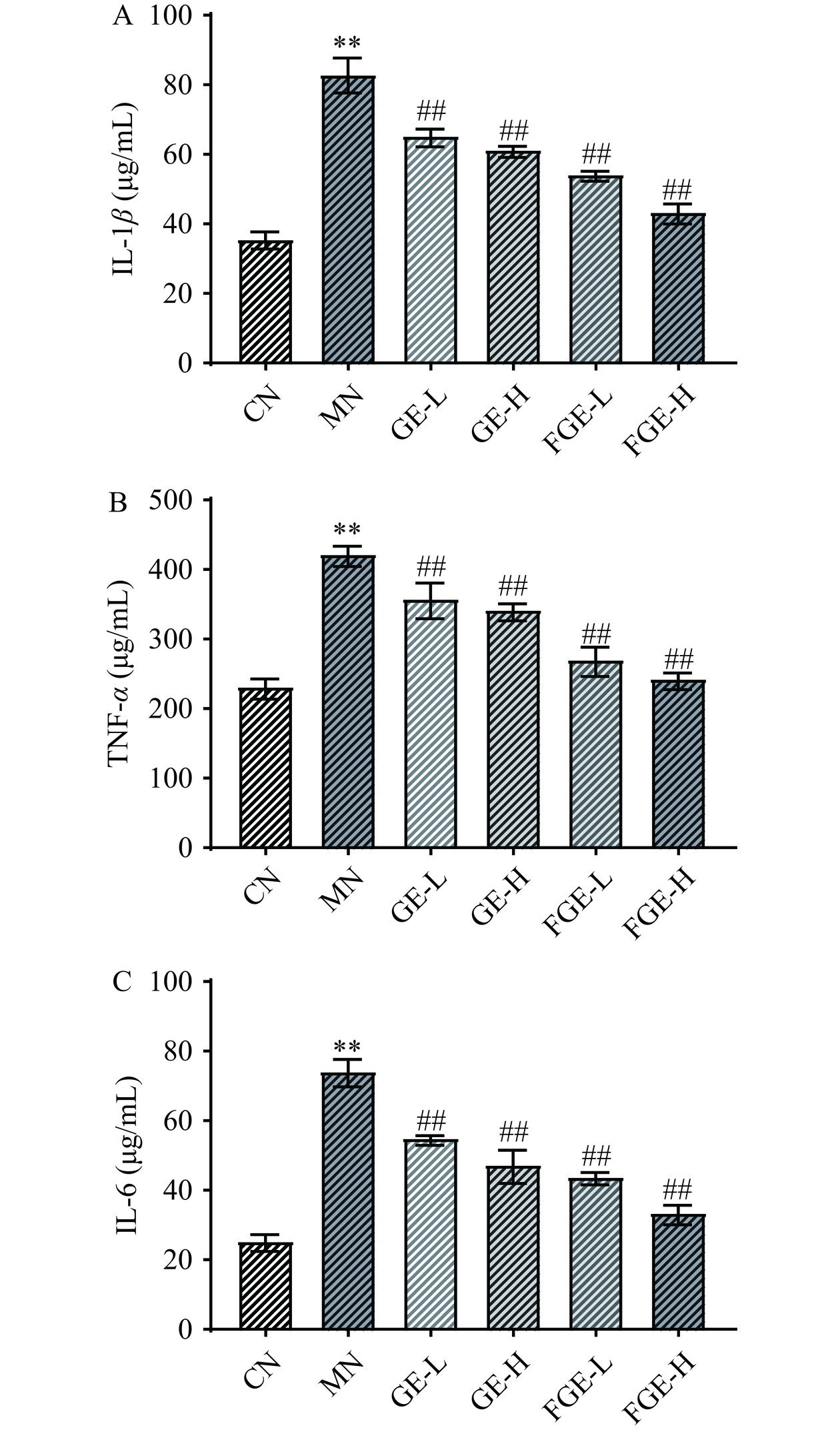
2.5 不同处理方法的栀子提取液对酒精诱导的HepG2细胞中炎症因子水平的影响
IL-1β、IL-6、TNF-α等炎症细胞因子参与调节炎症反应和免疫反应,在酒精摄入引起的肝脏损伤中,通过检测这些指标可以帮助评估酒精氧化损伤下的炎症程度以及对肝脏的影响[35]。由图5可知,与CN组相比,MN组细胞的IL-1β、IL-6、TNF-α水平极显著增加(P<0.01),经低、高剂量GE和FGE干预后,IL-1β、IL-6、TNF-α水平极显著下降(P<0.01),并且经FGE干预的细胞下降最显著,发酵栀子提取液高剂量(FGE-H)组的IL-1β、IL-6、TNF-α 分别降低到44.73±1.36、34.73±1.36、247.95±3.39 μg/mL,相比于MN组,分别降低了1.89、2.11、1.75倍,表明益生菌发酵栀子提取物能抵御酒精性氧化损伤的炎症反应。
3. 讨论与结论
栀子,因其富含黄酮、绿原酸、栀子苷和西红花苷等抗氧化成分,在维护肝脏健康方面展现了极大潜力[36]。鉴于这些成分的保健价值,本研究首次探讨了经乳酸芽孢杆菌DU-106和植物乳杆菌混合培养发酵处理后的栀子提取液,对酒精诱导的HepG2细胞氧化损伤的保护作用,揭示了该发酵提取液相比未发酵提取液,在缓解酒精诱导的HepG2肝细胞氧化损伤方面表现出更显著的保护效果。这一保护作用可能源于发酵过程中产生的有益代谢产物,如有机酸和多肽,它们通过增强抗氧化能力和抑制炎症反应,降低了氧化应激对细胞的损害。相关研究如Zhao等[37]的工作,也支持了发酵过程增强生物活性物质效果的观点,他们发现益生菌发酵的马齿苋在抗特应性皮炎方面的效果超过了未发酵样品,原因可能与发酵过程中活性成分的增加有关。此外,发酵提取液在降低AST、ALT和LDH释放量、减少氧化应激引起ROS的产生及炎症因子表达方面的效果,进一步证实了其对酒精性氧化损伤的保护作用。益生菌发酵栀子提取液的应用不仅显著改善了HepG2细胞的氧化损伤,也为利用天然植物资源开发新型保健品和治疗策略提供了新思路。尽管我们已初步理解了其保护机制,包括代谢产物的作用和对细胞因子调节的影响,但具体的分子机制仍需进一步研究。未来工作应关注细胞信号传导、细胞凋亡及其调控机制的详细探索,为发酵栀子提取液在防治酒精性肝疾病中的应用奠定更深入的科学基础。
-
图 3 不同处理方法下栀子提取液对氧化损伤HepG2细胞中ALT、AST和LDH释放量的影响
注:与对照组相比,*表示P<0.05,差异具有显著性,**表示P<0.01,差异极显著;与模型组相比,#表示P<0.05,差异具有显著性,##表示P<0.01,差异极显著,###表示P<0.001,差异非常显著;图中字母CN表示对照组;MN表示模型组;GE-L表示未发酵栀子提取液低剂量组;GE-H表示未发酵栀子提取液高剂量组;FGE-L表示发酵栀子提取液低剂量组;FGE-H表示发酵栀子提取液高剂量组;图4、图5同。
Figure 3. Effect of gardenia extract on ALT, AST and LDH release in oxidatively damaged HepG2 cells under different treatments
-
[1] LIU L C, WANG Y, ZHANG J, et al. Probiotics in treating with alcoholic liver disease and nonalcoholic fatty liver disease[J]. Food Reviews International,2021,39(5):1−19.
[2] MARICA M, MIRIAM L, PAOLA D. Alcohol or gut microbiota:Who is the guilty?[J]. International Journal of Molecular Sciences,2019,20:456. doi: 10.3390/ijms20020456
[3] MADUSHANI HERATH K H I N, BING S J, CHO J, et al. Sasa quelpaertensis leaves ameliorate alcohol-induced liver injury by attenuating oxidative stress in HepG2 cells and mice[J]. Acta Histochemica:Zeitschrift fur Histologische Topochemie,2018,120(5):477−489.
[4] 刘玲玲, 张鲁宁, 姜胜男, 等. 基于Keap1/Nrf2/ARE信号通路探讨丹皮酚改善酒精性肝脑损伤小鼠氧化应激损伤与炎症的作用机制[J]. 安徽中医药大学学报,2024,43(2):73−80. [LIU L L, ZHANG L N, JIANG S N, et al. Mechanism of action of paeonol in improving oxidative stress injury and inflammation in mice with alcohol-induced liver and brain injury:A study based on the Kelch-like ECH-associated protein 1/nuclear factor erythroid 2-related factor 2/antioxidant response element signaling pathway[J]. Journal of Anhui University of Chinese Medicine,2024,43(2):73−80.] LIU L L, ZHANG L N, JIANG S N, et al. Mechanism of action of paeonol in improving oxidative stress injury and inflammation in mice with alcohol-induced liver and brain injury: A study based on the Kelch-like ECH-associated protein 1/nuclear factor erythroid 2-related factor 2/antioxidant response element signaling pathway[J]. Journal of Anhui University of Chinese Medicine, 2024, 43(2): 73−80.
[5] CHEN J C, ZHANG Q, WANG R H, et al. Preliminary study on the effective site and mechanism of action of Meconopsis quintuplinervia Regel in alleviating acute alcoholic liver injury in mice[J]. Journal of Ethnopharmacology,2023,308:116230. doi: 10.1016/j.jep.2023.116230
[6] SU Z W, YAN T Y, FENG J, et al. Protective effects and mechanism of polysaccharides from edible medicinal plants in alcoholic liver injury:A review[J] International Journal of Molecular Sciences, 2023, 24 (22):16530.
[7] LAM P Y, CHEUNG F, TAN H Y, et al. Hepatoprotective effects of Chinese medicinal herbs:A focus on anti-inflammatory and antioxidative activities[J]. International Journal of Molecular Sciences,2016,17(4):465. doi: 10.3390/ijms17040465
[8] 张景媛. 基于生物信息学的茵陈蒿汤和茵栀黄颗粒抑制肝脏炎癌转化机制研究[D]. 北京:北京中医药大学, 2021. [ZHANG J Y. Bioinformatics-based study on the mechanism of inhibition of hepatic inflammatory cancer transformation by Artemisia capillaris soup and gardenia capillaris granules[D]. Beijing:Beijing University of Chinese Medicine, 2021.] ZHANG J Y. Bioinformatics-based study on the mechanism of inhibition of hepatic inflammatory cancer transformation by Artemisia capillaris soup and gardenia capillaris granules[D]. Beijing: Beijing University of Chinese Medicine, 2021.
[9] 谢建寰, 李冬春, 刘春凤, 等. 人参皂苷Rg1对非酒精性脂肪肝大鼠的干预作用[J]. 中成药,2023,45(11):3799−3802. [XIE J H, LI D C, LIU C F, et al. Interventional effects of ginsenoside Rg1 on non-alcoholic fatty liver in rats[J]. Chinese Traditional Pate-nt Medicine,2023,45(11):3799−3802.] doi: 10.3969/j.issn.1001-1528.2023.11.051 XIE J H, LI D C, LIU C F, et al. Interventional effects of ginsenoside Rg1 on non-alcoholic fatty liver in rats[J]. Chinese Traditional Pate-nt Medicine, 2023, 45(11): 3799−3802. doi: 10.3969/j.issn.1001-1528.2023.11.051
[10] 马燕花, 邱晓青, 师霞, 等. 黄芪多糖对非酒精性脂肪性肝炎大鼠ACE2-[Ang-(1-7)]-Mas轴及胰岛素抵抗的影响[J]. 中成药,2019,41(5):1012−1017. [MA Y H, QIU X Q, SHI X, et al. Effects of Astragali Radix polysaccharides on ACE2-[Ang-(1-7)]-Mas axis and insulin resistance in non-alcoholic steatohepatitis rats[J]. Chinese Traditional Patent Medicine,2019,41(5):1012−1017.] MA Y H, QIU X Q, SHI X, et al. Effects of Astragali Radix polysaccharides on ACE2-[Ang-(1-7)]-Mas axis and insulin resistance in non-alcoholic steatohepatitis rats[J]. Chinese Traditional Patent Medicine, 2019, 41(5): 1012−1017.
[11] 饶志, 张帆, 董毓松, 等. 栀子“辨状论质”及其品质因研究进展[J]. 中草药,2023,54(6):1998−2004. [RAO Z, ZHANG F, DONG Y S, et al. The gardenia "discriminates the shape to discuss the quality" and its quality factor research progress[J]. Chinese Herbal Medicine,2023,54(6):1998−2004.] RAO Z, ZHANG F, DONG Y S, et al. The gardenia "discriminates the shape to discuss the quality" and its quality factor research progress[J]. Chinese Herbal Medicine, 2023, 54(6): 1998−2004.
[12] 陈榕, 何梓炫, 颜烨, 等. 栀子及其主要成分的药理及毒性作用研究进展[J]. 中草药,2023,54(18):6092−6105. [CHEN R, HE Z X, YAN Y, et al. Research progress on pharmacological and toxic effects of Gardeniae Fructus and its main components[J]. Chinese Herbal Medicine,2023,54(18):6092−6105.] CHEN R, HE Z X, YAN Y, et al. Research progress on pharmacological and toxic effects of Gardeniae Fructus and its main components[J]. Chinese Herbal Medicine, 2023, 54(18): 6092−6105.
[13] 陈冠宁. 栀子的药物成分及药理作用研究进展[J]. 特种经济动植物,2022,25(11):20−22,32. [CHEN G N. Progress in the study of the pharmaceutical constituents and pharmacological effects of Gardenia jasminoides[J]. Special Economic Flora and Fauna,2022,25(11):20−22,32.] CHEN G N. Progress in the study of the pharmaceutical constituents and pharmacological effects of Gardenia jasminoides[J]. Special Economic Flora and Fauna, 2022, 25(11): 20−22,32.
[14] PYUN B J, LEE J Y, KIM Y J, et al. Gardenia jasminoides attenuates allergic rhinitis-induced inflammation by inhibiting periostin production[J]. Pharmaceuticals,2021,14(10):986. doi: 10.3390/ph14100986
[15] 夏琦, 郑宏宇, 孙银玲, 等. 青蒿在发酵中药炮制中的应用及其主要成分生物转化研究进展[J]. 中华中医药杂志,2023,38(9):4296−4299. [XIA Q, ZHENG H Y, SUN Y L, et al. Application of Artemisiae Annuae Herba in the processing of fermented traditional Chinese medicine and research progress on biotransformation of its main components[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2023,38(9):4296−4299.] XIA Q, ZHENG H Y, SUN Y L, et al. Application of Artemisiae Annuae Herba in the processing of fermented traditional Chinese medicine and research progress on biotransformation of its main components[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2023, 38(9): 4296−4299.
[16] JOAQUIM C L, ANDREA A G, JORGE G, et al. Exploring the impact of solid-state fermentation on macronutrient profile and digestibility in Chia (Salvia hispanica) and Sesame (Sesamum indicum) seeds[J]. Foods (Basel, Switzerland),2022,11(3):410.
[17] YU X T, WANG R Y, LAI B, et al. Effect of Auricularia auricula fermentation broth on the liver and stomach of mice with acute alcoholism[J]. Food & Function,2021,12(1):191−202.
[18] GUAN Q, DING X W, ZHONG L Y, et al. Beneficial effects of Lactobacillus-fermented black barley on high fat diet-induced fatty liver in rats[J]. Food & Function,2021,12(14):6526−6539.
[19] ZHANG H, WEI Z, TONG Y, et al. Spectrum-effect relationship study to reveal the pharmacodynamic substances in Flos Puerariae-Semen Hoveniae medicine pair for the treatment of alcohol-induced liver damage[J]. Journal of Ethnopharmacology,2023,314:116628. doi: 10.1016/j.jep.2023.116628
[20] KIM S H, SHIN M R, LEE A R, et al. Improvement of inflammation through antioxidant pathway of Gardeniae Fructus 50% EtOH extract (GE) from acute reflux esophagitis rats[J]. BioMed Research International,2020,2020:4826176.
[21] 黎砚书, 徐丽瑛, 周艳艳, 等. 栀子黄色素类单体对糖尿病小鼠降血糖作用[J]. 实验动物与比较医学,2018,38(5):387−389. [LI Y S, XU L Y, ZHOU Y Y, et al. Hypoglycaemic effect of gardenia yellow pigment-like monomers in diabetic mice[J]. Laboratory Animal and Comparative Medicine,2018,38(5):387−389.] LI Y S, XU L Y, ZHOU Y Y, et al. Hypoglycaemic effect of gardenia yellow pigment-like monomers in diabetic mice[J]. Laboratory Animal and Comparative Medicine, 2018, 38(5): 387−389.
[22] 王婷, 赵娜. 栀子提取物对抑郁症小鼠的治疗作用及机制研究[J]. 中国社区医师,2023,39(16):18−21,28. [WANG T, ZHAO N. Therapeutic effect and mechanism of gardenia extracts on depressed mice[J]. Chinese Community Physician,2023,39(16):18−21,28.] WANG T, ZHAO N. Therapeutic effect and mechanism of gardenia extracts on depressed mice[J]. Chinese Community Physician, 2023, 39(16): 18−21,28.
[23] DING J F, CHEN W D. Proteomic investigations of transcription factors critical in geniposide-mediated suppression of alcoholic steatosis and in overdose-induced hepatotoxicity on liver in rats[J]. Journal of Proteome Research,2019,18(11):3821−3830. doi: 10.1021/acs.jproteome.9b00140
[24] LUO Y, GAO F, CHANG R, et al. Metabolomics based comprehensive investigation of Gardeniae Fructus induced hepatotoxicity[J]. Food & Chemical Toxicology,2021,153:112250.
[25] 骆雪, 俞伟辉. 复方中草药添加剂对断奶仔猪生长性能、血清生化指标及免疫指标的影响[J]. 饲料研究,2021,44(18):40−43. [LUO X, YU W H. Effects of compound herbal additives on growth performance, serum biochemical indexes and immunological indexes of weaned piglets[J]. Feed Research,2021,44(18):40−43.] LUO X, YU W H. Effects of compound herbal additives on growth performance, serum biochemical indexes and immunological indexes of weaned piglets[J]. Feed Research, 2021, 44(18): 40−43.
[26] 严静, 蔡易熹, 薛秋艳, 等. 不同处理方式对米荞营养成分及抗氧化活性的影响[J]. 食品工业科技,2022,43(5):121−129. [YAN J, CAI Y X, XUE Q Y, et al. Effects of different treatments on nutritional composition and antioxidant activity of rice buckwheat[J]. Science and Technology of Food Industry,2022,43(5):121−129.] YAN J, CAI Y X, XUE Q Y, et al. Effects of different treatments on nutritional composition and antioxidant activity of rice buckwheat[J]. Science and Technology of Food Industry, 2022, 43(5): 121−129.
[27] 王宝宝. 人体内酒精代谢过程及交通执法中酒精检测的方法[J]. 生物学教学,2023,48(7):87−88. [WANG B B. Alcohol metabolism in the human body and methods of alcohol detection in traffic enforcement[J]. Teaching Biology,2023,48(7):87−88.] WANG B B. Alcohol metabolism in the human body and methods of alcohol detection in traffic enforcement[J]. Teaching Biology, 2023, 48(7): 87−88.
[28] 吉正梅, 张晓春, 彭钰迪, 等. 鸭胚源抗氧化肽 TD12 对 HepG2 细胞氧化应激损伤的保护作用[J]. 食品与发酵工业,2021,47(18):141−148. [JI Z M, ZHANG X C, PENG Y D, et al. Protective effect of duck embryo-derived antioxidant peptide TD12 against oxidative stress injury in HepG2 cells[J]. Food and Fermentation Industries,2021,47(18):141−148.] JI Z M, ZHANG X C, PENG Y D, et al. Protective effect of duck embryo-derived antioxidant peptide TD12 against oxidative stress injury in HepG2 cells[J]. Food and Fermentation Industries, 2021, 47(18): 141−148.
[29] 朱平生, 焦炎杰, 付双楠, 等. 酒精致大鼠肝损伤早期血清生物标志物水平的变化规律[J]. 中国实验方剂学杂志,2019,25(2):129−133. [ZHU P S, JIAO Y J, FU S N, et al. Changes of serum biomarkers levels in early stage of alcohol-induced liver injury in rats[J]. Chinese Journal of Experimental Traditional Medical Formulae,2019,25(2):129−133.] ZHU P S, JIAO Y J, FU S N, et al. Changes of serum biomarkers levels in early stage of alcohol-induced liver injury in rats[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(2): 129−133.
[30] SID B, VERRAX J, CALDERON P B. Role of oxidative stress in the pathogenesis of alcohol-induced liver disease[J]. Free Radical Research,2013,47(11):894−904. doi: 10.3109/10715762.2013.819428
[31] 其布勒, 吉日木图, 明亮. 驼乳对小鼠急性酒精性肝损伤的干预作用[J]. 中国食品学报,2023,23(6):147−158. [QI B L, JI RI M T, MING L. The intervention of camel milks on acute alcoholic liver injury in mice[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(6):147−158.] QI B L, JI RI M T, MING L. The intervention of camel milks on acute alcoholic liver injury in mice[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(6): 147−158.
[32] LEE J, YANG J, JEON J, et al. Hepatoprotective effect of esculetin on ethanol-induced liver injury in human HepG2 cells and C57BL/6J mice[J]. Journal of Functional Foods,2018,40:536−543. doi: 10.1016/j.jff.2017.11.024
[33] WANG, X, LIU M, ZHANG C, et al. Antioxidant activity and protective effects of enzyme-extracted Oudemansiella radiata polysaccharides on alcohol-induced liver injury[J]. Molecules,2018,23:481.
[34] ZHU Q, WU Y W, WANG X H. Protective effects of Polygonatum odoratum polysaccharides on alcohol-induced injury of HepG2 cells and its mechanisms[J]. Chinese Journal of Applied Physiology,2022,38(3):227−232.
[35] 段晓梦, 马心予, 白天宇, 等. 不同药对配伍对栀子引起的肝损伤的保护作用研究[J]. 中南药学,2023,21(11):2901−2907. [DUAN X M, MA X Y, BAI T Y, et al. Protective effect of different formula compatibilities on Fructus Gardeniae induced hepatotoxicity[J]. Central South Pharmacy,2023,21(11):2901−2907.] DUAN X M, MA X Y, BAI T Y, et al. Protective effect of different formula compatibilities on Fructus Gardeniae induced hepatotoxicity[J]. Central South Pharmacy, 2023, 21(11): 2901−2907.
[36] CHEN P, CHEN Y, WANG Y R, et al. Comparative evaluation of hepatoprotective activities of Geniposide, Crocins and Crocetin by CCl4-induced liver injury in mice[J]. Biomolecules & Therapeutics,2016,24(2):156−162.
[37] ZHAO W J, ZHANG Y W, LI W J, et al. Probiotic-fermented Portulaca oleracea L. alleviated DNFB-induced atopic dermatitis by inhibiting the NF-κB signaling pathway[J]. Journal of Ethnopharmacology,2023,313:116613. doi: 10.1016/j.jep.2023.116613





 下载:
下载:
 下载:
下载:



