Preparation of Soybean Oil Body Complex Emulsions by Ultrasonic Treatment and Transport of β-Carotene
-
摘要: 本研究以大豆油体为原料,将其作为乳化剂,通过超声技术制备大豆油体复合乳液,优化超声处理条件,并将油体复合乳液用于运载脂溶性生物活性物质。通过对乳液的理化性质研究,揭示超声处理增强油体复合乳液稳定性的机理并考察油体复合乳液对β-胡萝卜素的运载效果。结果表明,通过超声处理成功制备大豆油体复合乳液,乳液氧化稳定性和贮藏稳定性在功率为450 W(10 min)时最好,此时乳液平均粒径为1537 nm,液滴形状呈圆形且分布均匀。傅里叶变换红外光谱结果表明,超声引起的空化效应增加了湍流和剪切力等物理作用,使油体蛋白的多肽链部分打开,蛋白中的氢键网络发生重新排列,蛋白质二级结构发生改变:α-螺旋结构相对含量减少,β-折叠结构相对含量增多。电泳结果表明蛋白质亚基组成没有显著变化,但随着超声强度的增加,增强了外源蛋白在液滴界面的吸附。贮藏结果显示经过功率为450 W的超声处理可以抑制乳液中氧化产物的产生,提高乳液的氧化稳定性。通过超声处理可成功制备大豆油体-β-胡萝卜素乳液,其中在450 W条件下β-胡萝卜素的包封率最高(94.9%),且经过11 d室温贮藏后保留率为81.8%。本研究为大豆油体作为乳化剂运载脂溶性生物活性物质的应用提供参考。Abstract: In this study, soybean oil bodies were used as raw materials and emulsifiers to prepare soybean oil body complex emulsions by ultrasonication, to optimise the ultrasonication conditions and to use the oil body complex emulsions for the transport of fat-soluble bioactives. The mechanism of ultrasonic treatment to enhance the stability of oil-body complex emulsions was revealed through the study of the physicochemical properties of the emulsions. The effect of oil-body complex emulsions on the transport of β-carotene was also examined. As a result, soybean oil body complex emulsion was successfully prepared by ultrasonication, and the oxidative and storage stability of the emulsion was best at a power of 450 W (10 min). At this time, the average particle size of emulsion was 1537 nm, and the shape of droplets was round and evenly distributed. The results of Fourier transform infrared spectroscopy indicated that the ultrasound-induced cavitation effect increased the physical forces, such as turbulence and shear forces. This caused partial unfolding of the protein polypeptide chains in oil bodies, leading to the rearrangement of hydrogen bond networks within the proteins. Consequently, the protein secondary structure changed: The relative content of α-helix structures decreased and the relative content of β-sheet structures increased. The electrophoresis results showed that there were no significant changes in the composition of protein subunits. But with the ultrasound intensity increased, the adsorption of extrinsic proteins at the droplet interface was enhanced. The results of storage stability showed that ultrasonic treatment (450 W) could inhibit the generation of oxidation products and improved the oxidation stability of emulsions. The soybean oil body-β-carotene emulsions could be successfully prepared by ultrasonic treatment, and the encapsulation rate of β-carotene was the highest (94.9%) at 450 W, and the retention rate was 81.8% after 11 days of room temperature storage. This study provides insights into the application of soybean oil bodies as emulsifiers for the delivery of fat-soluble bioactive substances.
-
Keywords:
- oil body /
- ultrasound /
- carriers /
- β-carotene /
- natural emulsifier
-
β-胡萝卜素是一种脂溶性天然色素,主要存在于红橙色果蔬等的植物叶绿体中,着色能力强,具有抗氧化、抗癌、增强免疫力和防止衰老引起的退化性疾病等功能[1],广泛应用于食品加工工业中[2−3]。 β-胡萝卜素含有多个双键,由于这种高度不饱和结构,对光、热、氧化降解等条件敏感,化学稳定性差,生物利用率低,限制了其在食品中的应用[4−5]。近年来,孙瑞瑞[6]制备的阿拉伯胶和明胶微胶囊可明显提高β-胡萝卜素的贮藏稳定性及生物利用率。周叶红等[7]分别用β-环糊精及改性后的β-环糊精包埋β-胡萝卜素,结果发现包埋后的β-胡萝卜素的稳定性和抗氧化能力均提高。Jain等[8]以单硬脂酸甘油酯和明胶作为原料制备成的固体脂质纳米颗粒包埋β-胡萝卜素,可提高其生物利用率和抗癌特性。虽然目前运载β-胡萝卜素的方法很多,但仍然存在很多问题:例如β-环糊精的水溶性不理想,固体脂质纳米颗粒的包埋率较低并且成本较高等,因此需要开发新型的运载体系,提高β-胡萝卜素包埋率和保留率的同时降低成本,真正实现β-胡萝卜素的高效利用。
油体(Oil body,OB)是植物组织中用来贮存和保护甘油三酯的细胞器,直径约为0.5~2.0 μm,其核心是甘油三酯,表面由单层磷脂和内源蛋白质(油体蛋白、油体钙蛋白和油体固醇蛋白)组成[9],在通常情况下,油体的提取涉及到植物种子的湿磨,该过程破坏储存液泡并释放蛋白质(α、α′、β和Bd 30 K等),这些释放的液泡中的蛋白被称为外源蛋白[10]。由于油体这一天然的结构,其表面膜中的磷脂和蛋白质都包含疏水区域与亲水区域,因此油体可作为天然的乳化剂[11]。除此之外,植物油体中还含有必需脂肪酸、维生素E和植物甾醇等营养物质,提高了其作为乳化剂的应用价值。Francisca等[12]用甘蓝型油菜油体制备虾青素微胶囊,为稳定和输送虾青素提供了一种新的选择;王钧渤[13]用高压均质制备的核桃油体运载β-胡萝卜素体系具有较好的稳定性,但对生物活性物质的包封率和保留率还不明确,包封率的提升对提高生物活性物质的生物利用率具有重要意义。
超声作为一种非热加工的物理方法,在食品加工中应用广泛,样品经过超声处理,可以改变乳液中蛋白质的物理化学性质[14],这主要与超声处理产生的空化效应、剪切力、动态搅拌等作用有关[15]。Li等[16]经过研究发现超声处理促进了鸡肌原纤维蛋白在油滴表面的吸附,还有助于形成更小、更均匀的乳化油滴,提高乳液的稳定性。Lin等[17]还发现经过超声预处理的大豆分离蛋白对槲皮素的包埋率显著提高。因此超声有利于促进蛋白质与油脂之间的相互作用,帮助制备生物活性物质运载体。
因此,本文通过水提取法富集大豆油体,将油体作为乳化剂,利用超声技术制备油体复合乳液,分析超声功率对油体界面蛋白及大豆油体复合乳液稳定性的影响,并考察超声处理制备的大豆油体复合乳液对β-胡萝卜素的包埋效果,实现脂溶性生物活性物质的高效利用,并拓展油体在运载体系中的应用。
1. 材料与方法
1.1 材料与仪器
大豆(东农68号) 东北农业大学农学院;β-胡萝卜素(纯度98%) 上海源叶生物科技有限公司;大豆油 九三食品有限公司;其他化学试剂均为分析纯。
IKA T18数显型高速分散机 德国IKA公司;Zetasizer Nano ZS90纳米粒度电位仪 英国马尔文公司;JY92-ⅡN超声波细胞破碎仪 宁波新芝生物科技股份有限公司;UV-2600紫外-可见分光光度计 日本岛津公司;Nicolet 6700红外光谱仪 美国珀金埃尔默仪器有限公司。
1.2 实验方法
1.2.1 油体的提取
参照Tzen等[18]的方法,将大豆清洗后在4 ℃下浸泡20~24 h,然后将大豆与蒸馏水(1:8,w/v)混合,用磨浆机研磨,将所得浆液用4层纱布过滤除去不溶性成分,然后向浆液中加入蔗糖(蔗糖:浆液,1:8,w/v),混合溶液在冰水浴的条件下搅拌溶解,调节pH为11.0,离心(8000 r/min,30 min)后将其转移到分液漏斗中,分离得到富含油体的乳化层。将得到的乳化层再次分散到20%的蔗糖溶液中,分散均匀后调节pH为11,离心条件相同,上述步骤重复三次。最后,收集富含油体的乳化层,将其分散到去离子水中(1:8,w/v)调节pH为11,离心得到最终的油体,于4 ℃冰箱中保存备用。
1.2.2 油体复合乳液的制备
将提取的油体中加入去离子水至油体乳液浓度为10%作为水相,大豆油作为油相,将油相与水相(1:9,v/v)混合,乳液总体积为15 mL,高速剪切(10000 r/min,2 min)后,在20 kHz和150 W(振幅:23%)、300 W(振幅:46%)、450 W(振幅:69%)、600 W(振幅:92%)频率下,使用直径6.36 mm的钛探头对乳液进行超声处理,每次功率输出持续10 min(定时脉冲持续时间:3 s;间隔:2 s),最终制备成油体复合乳液,并将其储存在4 ℃的冰箱中备用。
1.2.3 粒径、电位的测定
测定油体复合乳液的粒径和ζ-电位时,为了减少多重散射,将不同超声功率下制备的油体复合乳液用磷酸缓冲盐溶液(Phosphate buffer saline,PBS)进行稀释(粒径稀释1000倍,ζ-电位稀释500倍),在25 ℃下测定其平均粒径和电位,分散相的折射率为1.456,连续相的折射率为1.330。
1.2.4 油体复合乳液稳定性的测定
1.2.4.1 油体复合乳液的乳析指数
参照康梦雪等[19]的方法,并稍作改动。新制样品在室温下放置7 d之后,乳液分为两层,测量并计算乳析指数(CI),公式为:
CI(%)=HSHT×100 (1) 式中:HS为乳清层的高度;HT为乳液的总高度。
1.2.4.2 油体复合乳液的氧化稳定性
将新制样品置于培养箱中,温度设置为45 ℃,利用紫外-可见分光光度计进行测定。参考Zhao等[20]的方法测定氢过氧化值(Hydroperoxide value,POV),并稍作修改。将样品与异辛烷/异丙醇(2/1,v/v)混合,在快速混匀器上振荡30 s,随后将乳液离心(5000 r/min,10 min),得到上层有机相,再加入甲醇/正丁醇(2/1,v/v)、硫氰酸盐和Fe2+水溶液,充分混合均匀,在黑暗环境下反应20 min,然后在510 nm处测定样品的吸光度,根据标准曲线确定氢过氧化物浓度。参考Zhang等[21]的方法测定硫代巴比妥酸值(Thiobarbituric acid reactive substance,TBARS),并稍作改动。取样品与硫代巴比妥酸测试液混合,在快速混匀器上振荡10 s以充分混匀,在100 ℃下加热30 min,冷却后过0.22 μm滤膜,在532 nm处测定样品的吸光度,根据标准曲线确定硫代巴比妥酸浓度。
1.2.5 超高分辨率显微镜观察
参考Liao等[22]的方法,并稍作改动。将制备好的样品用PBS缓冲溶液(pH7.4,10 mmol/L)稀释10倍,配制好1.0%尼罗蓝染液和0.1%尼罗红染液,分别加入到样品中,避光30 min,尼罗蓝和尼罗红分别在488 nm Ar/Kr和633 nm He/Ne激光下激发,在超高分辨率显微镜60×的放大倍数下观察。
1.2.6 油体界面蛋白提取
根据Ding等[23]的方法从油体复合乳液中提取油体界面蛋白,并稍作改动。将1.2.2制备的乳液在4 ℃下离心(9000 r/min,30 min),获得乳化层和清液,以1:3(v/v)的比例将得到的乳化层与丙酮混合摇匀,离心(4 ℃、10000×g)15 min,离心完成后收集下层物质,上述过程重复三次,将脱脂后的样品冷冻干燥。
1.2.7 傅里叶变换红外光谱
将1.2.6中提取的油体界面蛋白样品(2 mg)和纯KBr(198 mg)研磨成细粉,压成颗粒,并通过FTIR光谱测定,光谱采集在4000~500 cm−1波数范围内,共累积32次扫描。
1.2.8 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
将1.2.6中提取的油体界面蛋白样品配制成浓度为3 mg/mL,将蛋白质样品(45 μL)与还原性(含β-巯基乙醇)缓冲溶液(15 μL)混合,在100 ℃下加热5~7 min,分别在80 V和120 V下进行电泳,完成后染色30 min,再脱色,用凝胶成像仪观察蛋白质条带。
1.2.9 油体运载β-胡萝卜乳液的制备
取10%大豆油体乳液作为水相,β-胡萝卜素含量为0.1%(w/v)溶于大豆油中作为油相,油相与水相的比例为1:9,高速剪切(10000 r/min,2 min)后,在相同超声条件下制备大豆油体运载 β-胡萝卜素乳液,所有的样品均用铝箔纸包裹,置于4 ℃的冰箱中保存。
1.2.9.1 β-胡萝卜素包埋率的测定
首先进行标准曲线的绘制。精准称取0.01 g β-胡萝卜素,用正己烷定容到100 mL容量瓶中得到初次样液,取1 mL,再用正己烷定容到10 mL容量瓶为第二次样液,分别取0.5、1、2、3、4、5 和 6 mL置于容量瓶中,定容至10 mL,在450 nm处使用紫外可见分光光度计测定吸光度。
将β-胡萝卜素乳液和正己烷以1:3的比例混合,在快速混匀器上振荡30 s,离心(10000×g,5 min)。离心结束后取上层清液定容于10 mL棕色容量瓶中,在450 nm处测定吸光度。β-胡萝卜素在乳液中的包埋率由下式计算:
包埋率(%)=M1−M0M1×100 (2) 式中:M0和M1分别表示游离 β-胡萝卜素和乳液中总 β-胡萝卜素含量。
1.2.9.2 油体运载 β-胡萝卜素乳液的贮藏稳定性
参照吴子涵等[24]的方法,并稍作改动。在室温下将 β-胡萝卜素乳液贮藏11 d,分别在第1、3、5、7、9、11 d取部分乳液测定其保留率。将乳液与乙醇和正己烷(1:2,v/v)混合,在快速混匀器上振荡30 s,取上清液,上述操作重复三次,定容,在450 nm处测定吸光度。结果以保留率表征其贮藏稳定性,公式为:
保留率(%)=AA0×100 (3) 式中:A为贮藏一定时间后乳液中β-胡萝卜素的浓度(μg/mL),A0为最初乳液中β-胡萝卜素的浓度(μg/mL)。
1.2.9.3 光学显微镜观察
取新鲜制得的大豆油体运载 β-胡萝卜素乳液1 mL,将乳液稀释5倍,在光学显微镜40×的放大倍数下观察。
1.3 数据处理
上述所有测试至少进行三次,结果表示为平均值±标准差,采用SPSS 25.0分析软件进行数据分析,作图使用Origin 2021软件。
2. 结果与分析
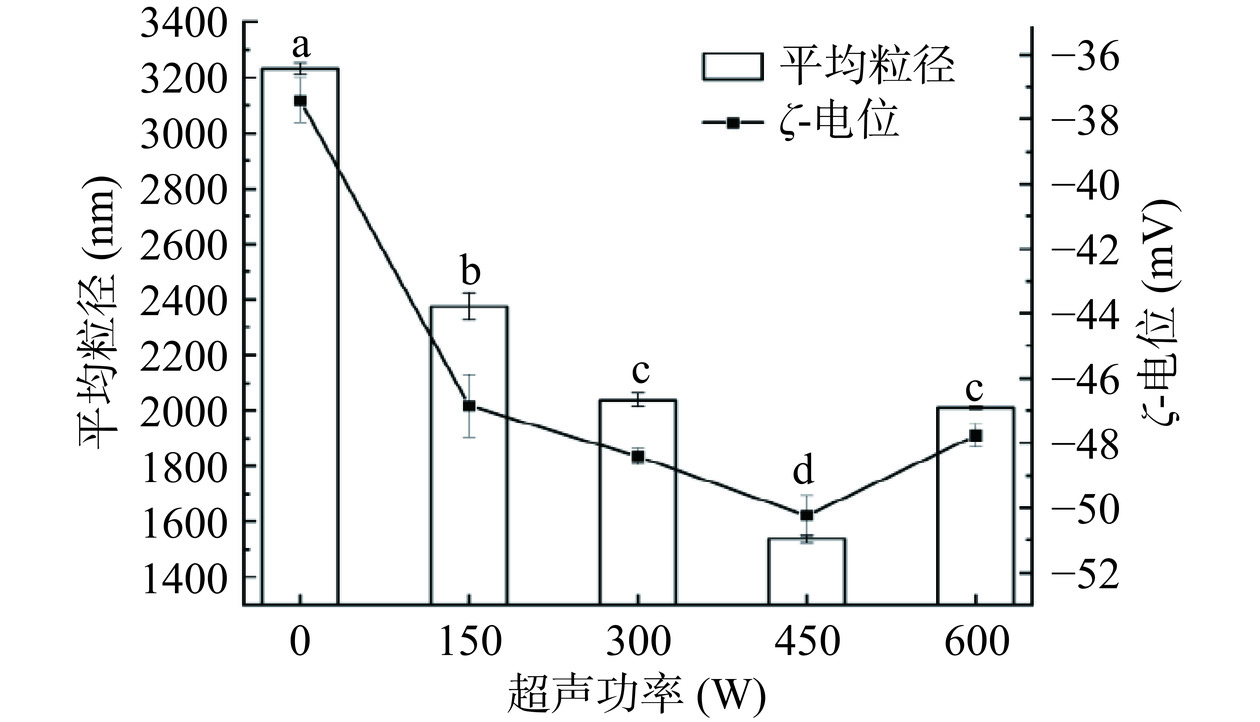
2.1 大豆油体复合乳液的平均粒径和ζ-电位分析
图1列出了在不同超声功率条件下制备的大豆油体复合乳液的平均粒径和ζ-电位。经过超声处理后,大豆油体复合乳液的平均粒径先减小后增大,这是由于超声处理过程中产生的超微束和紊流作用力以及空化效应导致平均粒径降低,因此超声有助于提高乳液的稳定性[25]。当超声功率为600 W时,可能是由于高功率超声使乳液结构被破坏,油体表面蛋白分子间的相互作用力减小,小颗粒进一步聚集,导致平均粒径增大[26]。
ζ-电位测定带电粒子表面的电势电位情况,其有效表面电荷决定粒子间的分散和聚集状态,从而表征体系的稳定性。从图中可以看出,经过超声处理后的乳液ζ-电位绝对值变大,通过超声处理可以使更多带有负电荷的氨基酸在蛋白质分子表面暴露[27],粒子表面负电荷增多,粒子之间相互排斥,抑制进一步聚集,提高乳液体系的稳定性,这一现象与平均粒径结果一致。当样品进行高功率(600 W)超声处理时,可能与高功率超声产生的高声场和强空化效应促进了高活性自由基的形成有关,导致部分带电荷氨基酸氧化损失,ζ-电位绝对值降低[28]。
2.2 大豆油体复合乳液的稳定性分析
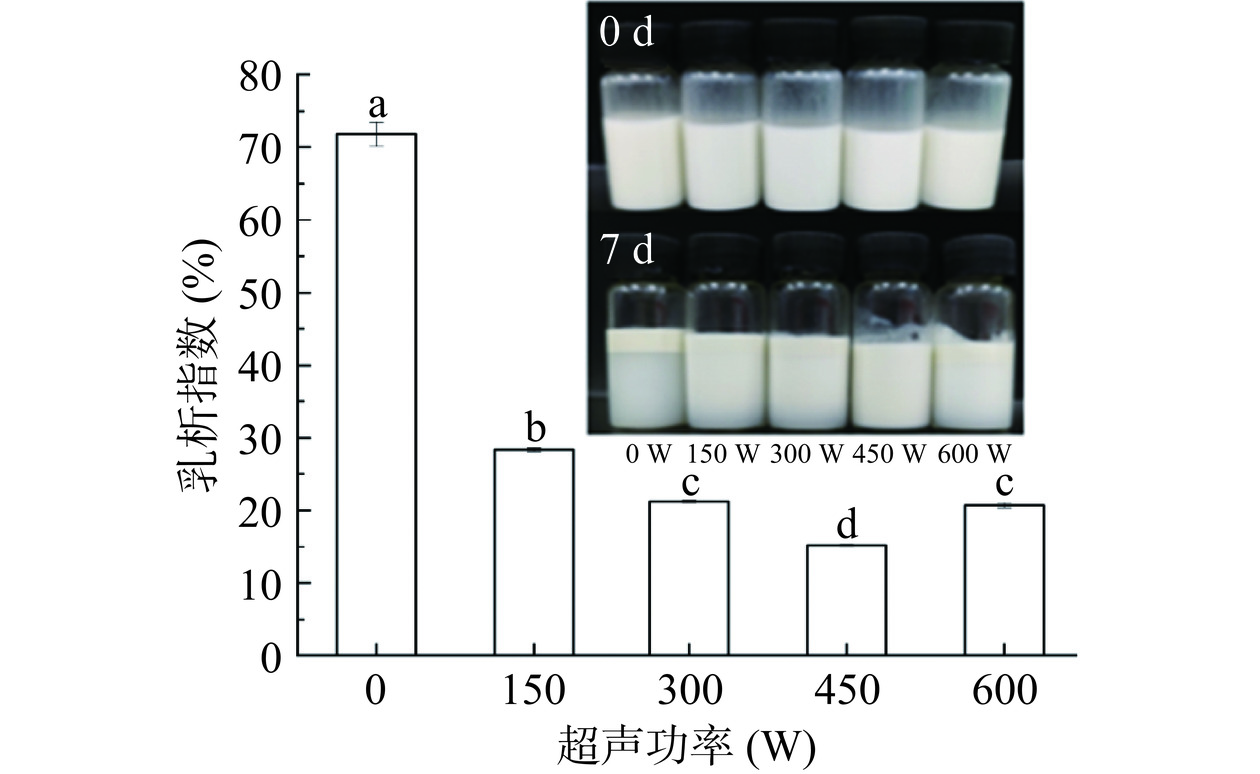
2.2.1 大豆油体复合乳液的乳析指数
通过乳析指数测定大豆油体复合乳液的贮藏稳定性,通过不同超声处理的大豆油体复合乳液的CI如图2所示(由于新制备的乳液乳析指数都是0,因此没有在图2中体现)。未经处理的乳液的乳析指数显著高于经过超声处理的油体复合乳液,表明经过超声处理的油体复合乳液具有良好的贮藏稳定性,这与ζ-电位结果一致,可能是由于通过超声处理可以暴露更多带有负电荷的氨基酸到蛋白质分子表面,粒子间相互排斥力增大,抑制进一步聚集,提高系统的稳定性,但由于贮藏时间的进一步延长,小液滴逐渐融合成大液滴,由于密度的作用油滴逐渐上浮,在宏观上出现析油现象,导致乳液外观出现分层现象。随着超声功率的增加,乳液的乳析指数先降低后升高,在超声功率为450 W时最低(15.2%),与对照组(0 W)相比,其他乳液均出现微小的乳析现象,证明了乳析指数的结论。
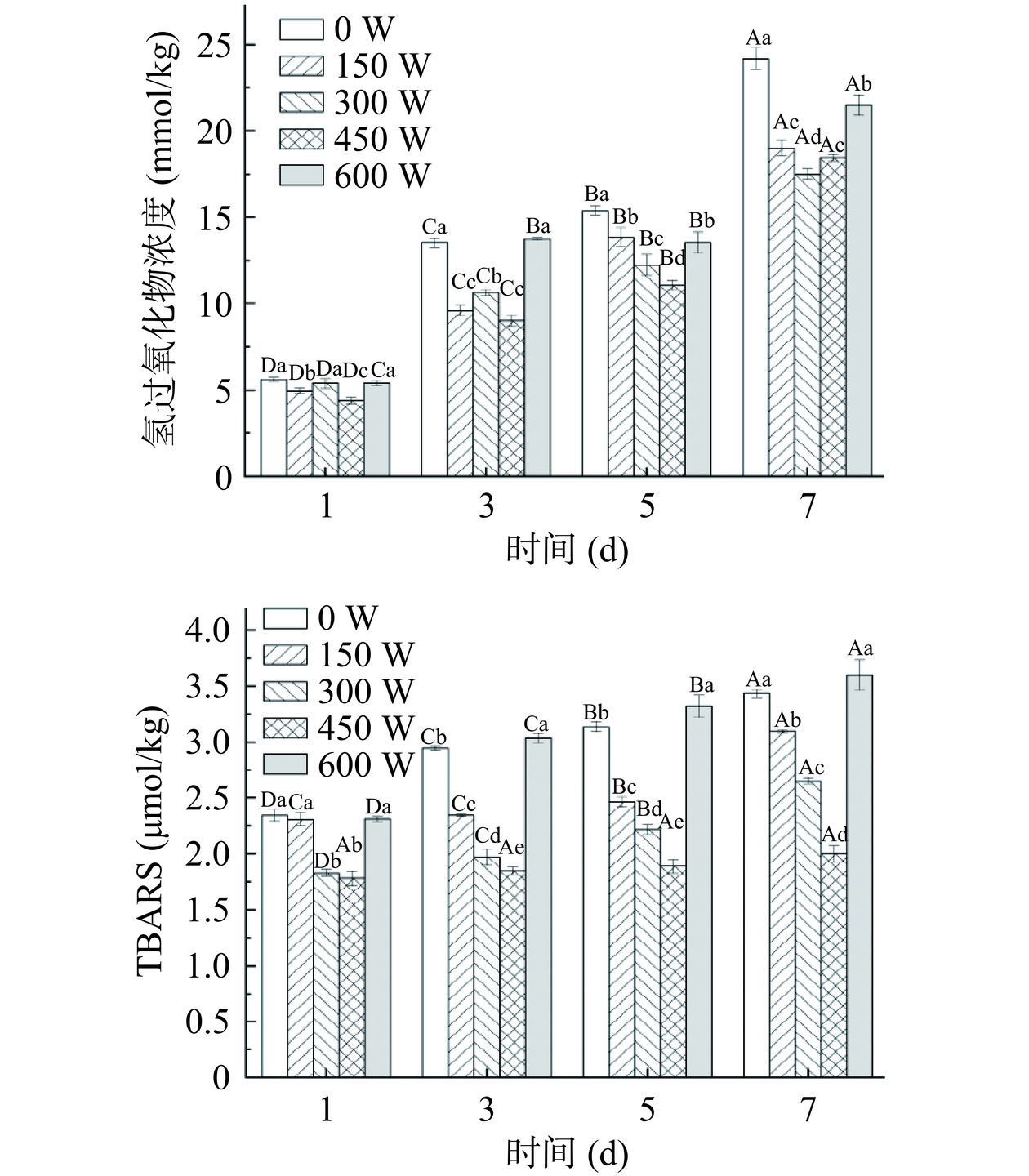
2.2.2 大豆油体复合乳液的氧化稳定性分析
脂类氧化降解在食品中是常见的现象,决定了食品的安全性和可接受性,通过测定脂质初级氧化产物(氢过氧化物)和次级氧化产物(TBARS)的浓度,说明乳液的氧化稳定性。在45 ℃的加速氧化条件下,不同超声功率下处理的大豆油体复合乳液在第1、3、5、7 d的氢过氧化物和TBARS产物的浓度如图3所示。从图中明显看出,大豆油体复合乳液的氢过氧化物和TBARS产物浓度随储存时间的延长而增加。在相同时间内,与对照组(0 W)相比,当超声功率为150、300和450 W时,油体复合乳液的氢过氧化物和TBARS产物的浓度显著降低(P<0.05),氧化作用受到抑制,提高了乳液的氧化稳定性,超声功率为450 W时抑制效果最佳,可能是由于经过超声处理蛋白质分子结构重排,在脂滴周围形成致密的界面膜,从而抑制脂质氧化[29]。当超声功率为600 W时,抑制氧化产物生成作用减弱,可能是由于超声作用产生的强烈空化效应促进了高活性自由基的形成,使乳液进一步氧化[30]。因此,在450 W的超声功率下进行超声处理可以提高乳液的氧化稳定性。
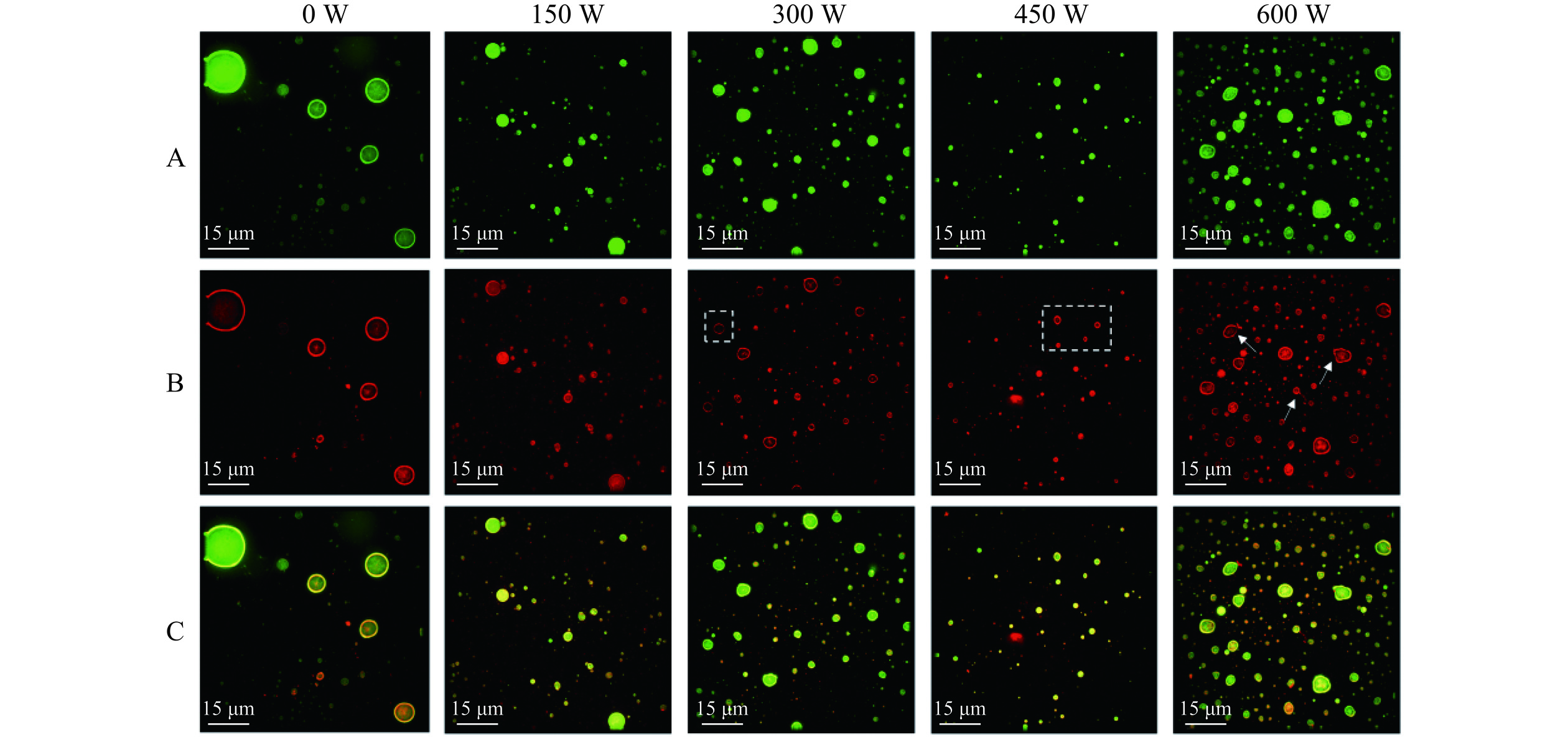
2.3 大豆油体复合乳液的微观结构
超高分辨率显微镜可以清晰地观察超声制备的大豆油体复合乳液的微观结构,结果如图4所示,其中乳液中的绿色荧光表示油脂(图4A),红色荧光表示蛋白质(图4B),图4C表示两者的叠加。从图中可以看出,当乳液未经过超声处理时,油脂的圆环结构明显,且液滴大小极不均匀,可能是油体不均匀地堆积在油水界面处。而经过功率为150、300、450 W的超声处理后,大豆油体复合乳液油相在内部,油相基本上为球形或椭圆形,油体蛋白在油滴表面形成一个封闭环,表明经过超声处理已成功制备O/W乳液。随着超声功率的增加,颗粒先减小后增大,这与平均粒径的结果一致,可能是由于平均粒径减小,液滴的表面积增加,导致乳液油水界面处的吸附蛋白质增加,形成更均匀的乳化油滴,乳液的稳定性提高[31]。而当超声功率为600 W时,图中乳液液滴部分呈不规则圆形,部分油体蛋白未形成封闭环结构,颗粒变大,可归因于高功率超声处理产生的热量及其振动作用导致部分乳液液滴结构被破坏,影响了乳液体系的稳定性。
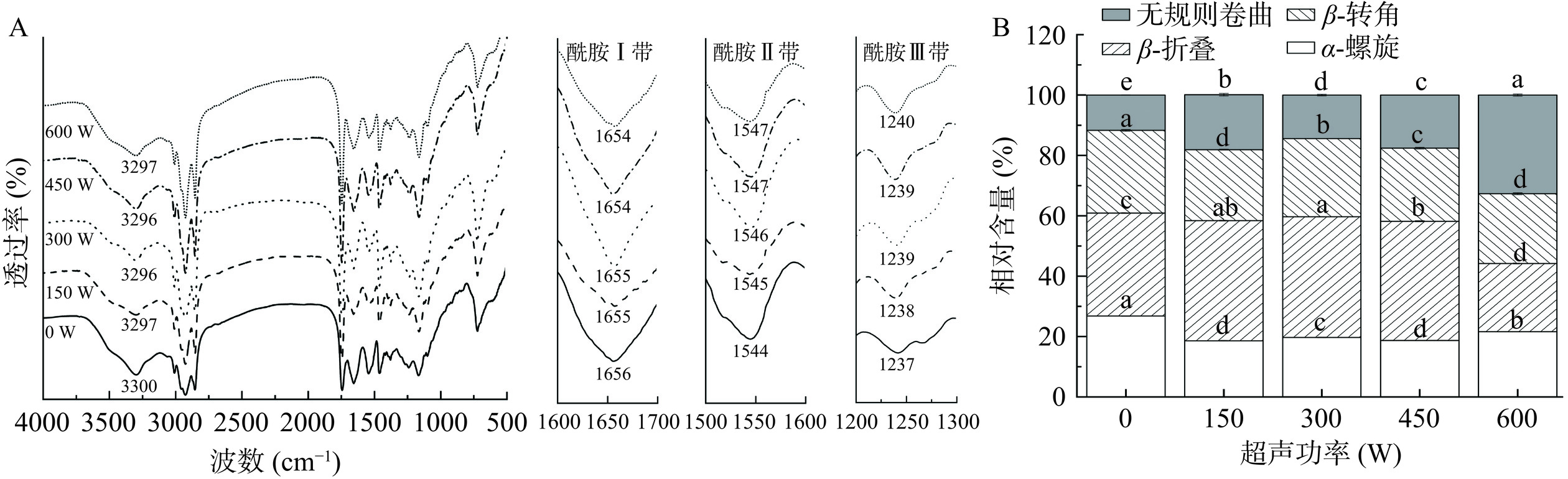
2.4 傅里叶变换红外光谱分析
傅里叶红外光谱结果如图5A所示。从图中可以看出,光谱在3200~3600 cm−1范围出现一个强峰,这与氢键的O-H基团拉伸振动有关,样品经过超声处理,峰值发生移动,表明氢键的形成[32]。1600~1700 cm−1区域代表酰胺I带,归因于C=O和C-N基团的伸缩振动,1500~1600 cm−1区域代表酰胺II带,取决于N-H基团和C-N基团的弯曲、伸缩振动[33]。图中随着超声功率的增加,酰胺Ⅱ谱带发生红移,表明脂肪中的C=O基团与油体蛋白中的N-H或O-H基团形成氢键。酰胺Ⅲ谱带在1200~1300 cm−1区域,该谱带从1237 cm−1移动到1240 cm−1,这与蛋白质氨基酸侧链上的化学取代基有关[34]。三个谱带都出现了明显偏移,因此经过超声后油体界面蛋白的二级结构会发生变化。
采用高斯面积法拟合和计算样品中的蛋白质,确定二级结构的类型及相对含量,结果如图5B所示。经过不同超声功率处理后,各个二级结构的相对含量发生变化,当超声功率增加到450 W时,油体界面蛋白的α-螺旋结构相对含量减少,β-折叠结构相对含量增多,可能是由于超声引起的空化效应,增加了湍流和剪切力等物理作用,使油体蛋白的多肽链部分打开,暴露出更多的疏水性氨基酸区域,多肽中氢键网络发生重新排列[35],有利于油体蛋白和脂质通过氢键结合发生相互作用,β-折叠相对含量的增加使乳液界面蛋白的空间结构变大,使乳液更加稳定[36]。当超声功率为600 W时,α-螺旋和无规则卷曲结构相对含量与其他样品相比显著增加(P<0.05),油体界面蛋白结构刚性结构减弱,分子无序性增加,部分乳液结构被破坏,导致蛋白质聚集,在油-水界面的吸附性减弱[37]。
2.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE)揭示超声处理后大豆油体复合乳液界面蛋白的分子量分布,如图6所示。图中经过超声处理的电泳条带具有相似的特征,表明超声没有改变大豆油体复合乳液界面蛋白的亚基组成[38]。当提取pH为11.0时外源蛋白对油体的吸附能力减弱,因此图中各个条带的外源蛋白含量较少[39]。与未经过超声处理的乳液相比,经过超声处理的大豆油体复合乳液界面蛋白中的内源性蛋白条带明显。从表1中可以看出,经过150 W和300 W超声处理的油体复合乳液界面蛋白电泳条带的外源蛋白光密度值较低,有研究表明油体中的外源蛋白在储存过程中极易氧化,外源蛋白过多会降低油体的氧化稳定性,并且外源蛋白形成的是一种多孔的蛋白层结构,游离相中的促氧化剂可以轻松通过外源蛋白层接触油体,因此外源蛋白层对油体并不能起到保护和抗氧化的作用[20]。当超声强度为450 W和600 W时,外源性蛋白质分子条带颜色变深,可能是由于超声波产生的空化和湍流效应,增强了外源蛋白在界面的吸附性[40]。
表 1 不同超声功率制备的大豆油体复合乳液界面蛋白电泳条带外源蛋白的光密度值Table 1. Optical density values of extrinsic proteins of the interfacial protein electrophoretic bands of soybean oil-body composite emulsions prepared with different ultrasonic powers蛋白质种
类及总和光密度值 0 W 150 W 300 W 450 W 600 W 外源蛋白 60120 54792 38808 60192 113544 7272 11592 16200 14040 20304 2088 13680 17064 10800 18792 27504 13752 21024 37008 17784 20880 18648 15696 29952 14760 总和 117864 112464 108792 151992 185184 2.6 大豆油体运载β-胡萝卜素乳液的包封率
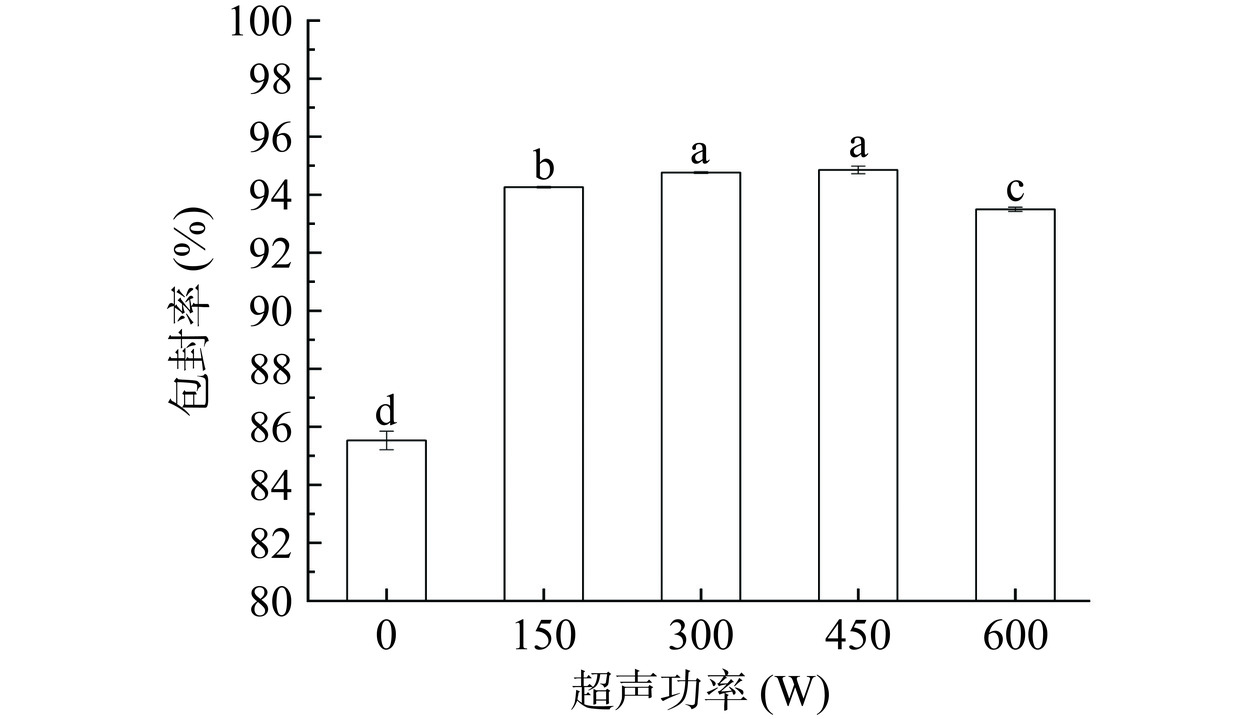
不同超声功率制备的大豆油体运载β-胡萝卜素乳液的包封率如图7所示。包封率随着超声功率的增加显示出先升高后降低的趋势,当超声功率为450 W时,大豆油体复合乳液对β-胡萝卜素的包封率为94.9%,与对照组(0 W)相比提高了9.3%,油体复合乳液经过超声处理后平均粒径减小,乳液液滴分布更均匀,乳液界面蛋白β-折叠结构相对含量增加,乳液稳定性提高,包封率升高。当超声功率为600 W时,可能由于在高功率超声产生的热量及其振动作用下,部分乳液液滴结构被破坏,导致包封率降低。与Xu等[41]制备的脂质体对β-胡萝卜素的包封率(92.49%)相比,本研究中包封率相对较高。结果表明,通过超声处理可成功制备大豆油体运载β-胡萝卜素乳液,并提高了大豆油体对β-胡萝卜素的包封率。
2.7 大豆油体运载 β-胡萝卜素乳液的贮藏稳定性
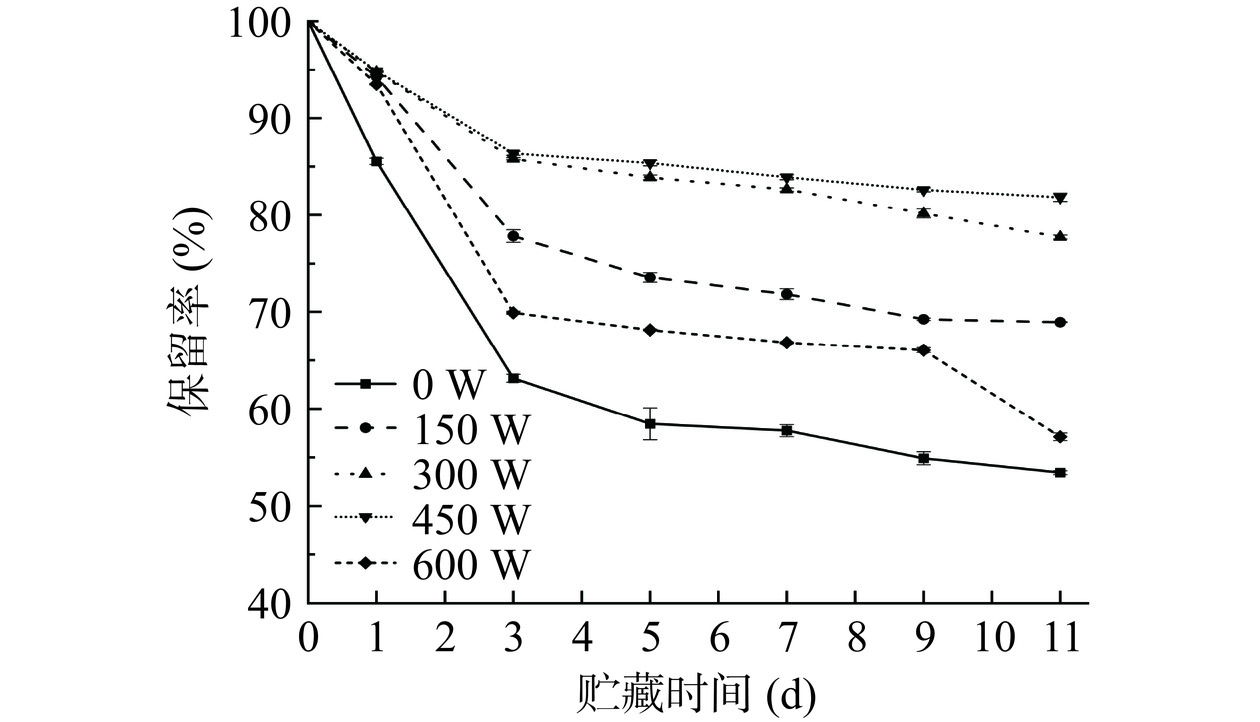
减少β-胡萝卜素的降解对提高其生物利用率具有重要意义,因此测定了在室温贮藏过程中不同超声功率处理的大豆油体乳液运载β-胡萝卜素的保留率。如图8所示,从图中明显看出,经过11 d室温贮藏后,β-胡萝卜素在乳液中的含量随贮藏时间的增加而降低,与对照组(0 W)相比,经过超声处理的乳液中β-胡萝卜素的保留率较高且降解速度较慢,说明超声处理可以提高大豆油体乳液中 β-胡萝卜素的保留率,其中在450 W的超声功率下乳液中β-胡萝卜素的保留率最高(81.8%),相较于对照组(0 W)提高了53.2%。当超声功率为600 W时,由于乳液在高功率超声产生的振动作用下结构被破坏,油脂析出导致保留率降低。因此,经过450 W超声处理后的大豆油体复合乳液可以更好地保护和稳定β-胡萝卜素。
2.8 大豆油体运载β-胡萝卜素乳液的光学显微镜图
通过乳液的微观结构可以较为直观地观察乳液液滴的分布状态,图9为不同超声功率制备的大豆油体运载β-胡萝卜素乳液的光学显微镜微观图。从图中可以看出,乳液液滴形状呈圆形或椭圆形,与对照组(0 W)相比,超声处理提高了乳液液滴的分散性。随着超声功率不断增加,乳液液滴尺寸先减小后增大,液滴尺寸的减小可能是由于超声处理产生的空化力引起的,促进了小颗粒尺寸的形成[42]。这与本实验中平均粒径的研究结果一致。其中在超声功率为300 W和450 W条件下制备的乳液液滴较小,形成了更均匀的乳化油滴,当超声功率为600 W时,乳液液滴大小不一,部分乳液结构被破坏,与超高分辨率显微镜观察到的结果一致。
3. 结论
本研究揭示了超声功率对大豆油体复合乳液理化性质的影响。经过超声处理成功制备出大豆油体复合乳液,且当超声功率为450 W时,乳液的平均粒径较小,ζ-电位绝对值较高。傅里叶变换红外光谱和SDS-PAGE表明,经过超声处理油体界面蛋白二级结构中β-折叠结构相对含量增多,二级结构发生改变,但蛋白质亚基组成没有变化。此外,当超声功率为450 W时,与对照组(0 W)相比,大豆油体复合乳液的贮藏稳定性和氧化稳定性都提高,油体复合乳液对β-胡萝卜素的包封率为94.9%,经过11 d时间贮藏后保留率高于对照组。本实验结果为大豆油体在包埋脂溶性生物活性物质中的应用以及利用超声技术提高生物活性物质的包封率和保留率提供理论依据。
-
表 1 不同超声功率制备的大豆油体复合乳液界面蛋白电泳条带外源蛋白的光密度值
Table 1 Optical density values of extrinsic proteins of the interfacial protein electrophoretic bands of soybean oil-body composite emulsions prepared with different ultrasonic powers
蛋白质种
类及总和光密度值 0 W 150 W 300 W 450 W 600 W 外源蛋白 60120 54792 38808 60192 113544 7272 11592 16200 14040 20304 2088 13680 17064 10800 18792 27504 13752 21024 37008 17784 20880 18648 15696 29952 14760 总和 117864 112464 108792 151992 185184 -
[1] ASEMI Z, ALIZADEH S A, AHMAD K, et al. Effects of beta-carotene fortified synbiotic food on metabolic control of patients with type 2 diabetes mellitus:A double-blind randomized cross-over controlled clinical trial[J]. Clinical Nutrition,2016,35(4):819−825. doi: 10.1016/j.clnu.2015.07.009
[2] 曲蕙名, 楚杰, 韩利文, 等. β-胡萝卜素提取方法、生理功能及应用研究进展[J]. 中国食物与营养,2017,23(8):37−41. [QU H M, CHU J, HAN L W, et al. Research progress on extraction methods, physiological function and application of β-carotene[J]. China Food and Nutrition,2017,23(8):37−41.] doi: 10.3969/j.issn.1006-9577.2017.08.010 QU H M, CHU J, HAN L W, et al. Research progress on extraction methods, physiological function and application of β-carotene[J]. China Food and Nutrition, 2017, 23(8): 37−41. doi: 10.3969/j.issn.1006-9577.2017.08.010
[3] DE PAZ E, MARTÍN Á, ESTRELLA A, et al. Formulation of β-carotene by precipitation from pressurized ethyl acetate-on-water emulsions for application as natural colorant[J]. Food Hydrocolloids,2012,26(1):17−27. doi: 10.1016/j.foodhyd.2011.02.031
[4] LU Y, MAO L, HOU Z, et al. Development of emulsion gels for the delivery of functional food ingredients:From structure to functionality[J]. Food Engineering Reviews,2019,11(4):245−258. doi: 10.1007/s12393-019-09194-z
[5] CHAARI M, THEOCHARI I, PAPAOLIMITRIOU V, et al. Encapsulation of carotenoids extracted from halophilic Archaea in oil-in-water (O/W) micro- and nano-emulsions[J]. Colloids and Surfaces B:Biointerfaces,2018,161(161):219−227.
[6] 孙瑞瑞. 紫苏β-胡萝卜素的超临界CO2萃取及其微胶囊产品的研究[D]. 哈尔滨:东北农业大学, 2017. [SUN R R. Supercritical CO2 extraction of β-carotene from Perilla frutescens and its microencapsulated products[D]. Harbin:Northeast Agricultural University, 2017.] SUN R R. Supercritical CO2 extraction of β-carotene from Perilla frutescens and its microencapsulated products[D]. Harbin: Northeast Agricultural University, 2017.
[7] 周叶红, 马学文, 梁文婷, 等. β-环糊精及衍生物与β-胡萝卜素包合物性质[J]. 应用化学,2016,33(7):827−833. [ZHOU Y H, MA X W, LIANG W T, et al. Properties of β-cyclodextrin and derivatives encapsulated with β-carotene[J]. Applied Chemistry,2016,33(7):827−833.] doi: 10.11944/j.issn.1000-0518.2016.07.150352 ZHOU Y H, MA X W, LIANG W T, et al. Properties of β-cyclodextrin and derivatives encapsulated with β-carotene[J]. Applied Chemistry, 2016, 33(7): 827−833. doi: 10.11944/j.issn.1000-0518.2016.07.150352
[8] JAIN A, SHARMA G, THAKUR K, et al. Beta-carotene-encapsulated solid lipid nanoparticles (BC-SLNs) as promising vehicle for cancer:An investigative assessment[J]. AAPS PharmSciTech,2019,20(3):100. doi: 10.1208/s12249-019-1301-7
[9] HOU J, FENG X, JIANG M, et al. Effect of NaCl on oxidative stability and protein properties of oil bodies from different oil crops[J]. LWT,2019,113(113):108263.
[10] CHEN Y, ONO T. Simple extraction method of non-allergenic intact soybean oil bodies that are thermally stable in an aqueous medium[J]. Journal of Agricultural and Food Chemistry,2010,58(12):7402−7407. doi: 10.1021/jf1006159
[11] IWANAGA D, GRAY D A, FISK I D, et al. Extraction and characterization of oil bodies from soy beans:A natural source of pre-emulsified soybean oil[J]. Journal of Agricultural and Food Chemistry,2007,55(21):8711−8716. doi: 10.1021/jf071008w
[12] FRANCISCA A, MÓNICA R, IGNACIO J, et al. Oil bodies as a potential microencapsulation carrier for astaxanthin stabilisation and safe delivery[J]. Journal of Microencapsulation,2014,31(5):488−500. doi: 10.3109/02652048.2013.879931
[13] 王钧渤. 两种油体乳液及运载β-CE乳液的稳定性与体外消化研究[D]. 哈尔滨:哈尔滨工业大学, 2021. [WANG J B. Stability and in vitro digestion of two oil emulsions and transported β-CE emulsions[D]. Harbin:Harbin Institute of Technology, 2021.] WANG J B. Stability and in vitro digestion of two oil emulsions and transported β-CE emulsions[D]. Harbin: Harbin Institute of Technology, 2021.
[14] SU Y J, CHEN J H, ZHANG S W, et al. Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J]. Journal of Food Engineering,2014,124(124):11−18.
[15] ZHOU L, ZHANG J, XING L, et al. Applications and effects of ultrasound assisted emulsification in the production of food emulsions:A review[J]. Trends in Food Science & Technology,2021,110(110):493−512.
[16] LI K, FU L, ZHAO Y Y, et al. Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J]. Food Hydrocolloids,2020,98(98):105275.
[17] LIN J, AGNES Y K Y, YIGE Z, et al. Improved in vitro bioaccessibility of quercetin by nanocomplexation with high-intensity ultrasound treated soy protein isolate[J]. Food Chemistry,2023,406(406):135004.
[18] TZEN J T C, PENG C C, CHENG D J, et al. A new method for seed oil body purification and examination of oil body integrity following germination[J]. Journal of Biochemistry,1997,121(4):762−768. doi: 10.1093/oxfordjournals.jbchem.a021651
[19] 康梦雪, 孙禹凡, 宋晗钰, 等. pH值偏移大豆油体-姜黄素复合乳液的物理特性及稳定性[J]. 食品科学,2023,44(4):1−8. [KANG M X, SUN Y F, SONG H Y, et al. Physical properties and stability of pH-shifted soybean oleosomes-curcumin composite emulsions[J]. Food Science,2023,44(4):1−8.] doi: 10.7506/spkx1002-6630-20220430-401 KANG M X, SUN Y F, SONG H Y, et al. Physical properties and stability of pH-shifted soybean oleosomes-curcumin composite emulsions[J]. Food Science, 2023, 44(4): 1−8. doi: 10.7506/spkx1002-6630-20220430-401
[20] ZHAO L, CHEN Y, YAN Z, et al. Physicochemical and rheological properties and oxidative stability of oil bodies recovered from soybean aqueous extract at different pHs[J]. Food Hydrocolloids,2016,61(61):685−694.
[21] ZHANG H, FAN Q, LI D, et al. Impact of gum arabic on the partition and stability of resveratrol in sunflower oil emulsions stabilized by whey protein isolate[J]. Colloids and Surfaces B:Biointerfaces,2019,181(181):749−755.
[22] LIAO Y, SUN Y, PENG X, et al. Effects of tannic acid on the physical stability, interfacial properties, and protein/lipid co-oxidation characteristics of oil body emulsions[J]. Food Hydrocolloids,2023,135(135):108230.
[23] DING J, WEN J, WANG J, et al. The physicochemical properties and gastrointestinal fate of oleosomes from non-heated and heated soymilk[J]. Food Hydrocolloids,2020,100(C):105418.
[24] 吴子涵, 陈泽平, 刘震宇, 等. 大豆蛋白纤维聚集体Pickering乳液提高β-胡萝卜素的包埋稳定性[J]. 食品与发酵工业,2022,48(21):152−159. [WU Z H, CHEN Z P, LIU Z Y, et al. Improvement of β-carotene encapsulation stability by Pickering emulsion of soy protein fibre aggregates[J]. Food and Fermentation Industry,2022,48(21):152−159.] WU Z H, CHEN Z P, LIU Z Y, et al. Improvement of β-carotene encapsulation stability by Pickering emulsion of soy protein fibre aggregates[J]. Food and Fermentation Industry, 2022, 48(21): 152−159.
[25] JAMBRAK A R, LELAS V, MASON T J, et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering,2009,93(4):386−393. doi: 10.1016/j.jfoodeng.2009.02.001
[26] ARZENI C, MARTíNEZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering,2012,108(3):463−472. doi: 10.1016/j.jfoodeng.2011.08.018
[27] TAHA A, HU T, ZHANG Z, et al. Effect of different oils and ultrasound emulsification conditions on the physicochemical properties of emulsions stabilized by soy protein isolate[J]. Ultrasonics Sonochemistry,2018,49(49):283−293.
[28] TAO Y, SUN D W. Enhancement of food processes by ultrasound:A review[J]. Critical Reviews in Food Science and Nutrition,2015,55(4):570−594. doi: 10.1080/10408398.2012.667849
[29] HU J N, ZHENG H, CHEN X X, et al. Synergetic effects of whey protein isolate and naringin on physical and oxidative stability of oil-in-water emulsions[J]. Food Hydrocolloids,2020,101(C):105517.
[30] NA L, TONG W, XINRUN Y, et al. Effect of high-intensity ultrasonic treatment on the emulsion of hemp seed oil stabilized with hemp seed protein[J]. Ultrasonics Sonochemistry,2022,86(86):106021.
[31] KINSELLA J E. Functional properties of soy proteins[J]. Journal of the American Oil Chemists' Society,1979,56(3Part1):242−258. doi: 10.1007/BF02671468
[32] KHAN A, WANG C, SUN X, et al. Preparation and characterization of whey protein isolate-DIM nanoparticles[J]. International Journal of Molecular Sciences,2019,20(16):3917. doi: 10.3390/ijms20163917
[33] REN X, HOU T, LIANG Q, et al. Effects of frequency ultrasound on the properties of zein-chitosan complex coacervation for resveratrol encapsulation[J]. Food Chemistry,2019,279(279):223−230.
[34] JUN S, TENGMEI L, FENG Z, et al. Tea polyphenols on emulsifying and antioxidant properties of egg white protein at acidic and neutral pH conditions[J]. LWT,2022,153(153):112537.
[35] WANG T, CHEN X, WANG W N, et al. Effect of ultrasound on the properties of rice bran protein and its chlorogenic acid complex[J]. Ultrasonics Sonochemistry,2021,79(79):105758.
[36] SUN Y, ZHONG M, WU L, et al. Loading natural emulsions with nutraceuticals by ultrasonication:Formation and digestion properties of curcumin-loaded soybean oil bodies[J]. Food Hydrocolloids,2022,124(124):107292.
[37] 白银, 高悦, 王中江, 等. 射流空化对大豆分离蛋白的理化性质及结构的影响[J]. 食品科学,2020,41(7):110−116. [BAI Y, GAO Y, WANG Z J, et al. Effects of jet cavitation on the physicochemical properties and structure of soybean isolates[J]. Food Science,2020,41(7):110−116.] doi: 10.7506/spkx1002-6630-20190304-028 BAI Y, GAO Y, WANG Z J, et al. Effects of jet cavitation on the physicochemical properties and structure of soybean isolates[J]. Food Science, 2020, 41(7): 110−116. doi: 10.7506/spkx1002-6630-20190304-028
[38] HUANG L, DING X, DAI C, et al. Changes in the structure and dissociation of soybean protein isolate induced by ultrasound-assisted acid pretreatment[J]. Food Chemistry,2017,232(232):727−732.
[39] CHEN Y M, ZHAO L P, CAO Y Y, et al. Oleosins (24 and 18 kDa) are hydrolyzed not only in extracted soybean oil bodies but also in soybean germination[J]. Journal of Agricultural and Food Chemistry,2014,62(4):956−965. doi: 10.1021/jf405382w
[40] QAYUM A, LI M, SHI R, et al. Laccase cross-linking of sonicated α-lactalbumin improves physical and oxidative stability of CLA oil in water emulsion[J]. Ultrasonics Sonochemistry,2021,71(71):105365.
[41] XU T, ZHANG J, JIN R, et al. Physicochemical properties, antioxidant activities and in vitro sustained release behaviour of co-encapsulated liposomes as vehicle for vitamin E and β-carotene[J]. Journal of the Science of Food and Agriculture,2022,102(13):5759−5767. doi: 10.1002/jsfa.11925
[42] O'SULLIVAN J, MURRAY B, FLYNN C, et al. The effect of ultrasound treatment on the structural, physical and emulsifying properties of animal and vegetable proteins[J]. Food Hydrocolloids,2016,53(53):141−154.





 下载:
下载:


 下载:
下载:



