Identification of Procyanidins in the Pericarps of Different Litchi Cultivars and Their in Vitro Antioxidant Activities
-
摘要: 为筛选适合开发天然抗氧化产品的荔枝优良品种,本研究对7个不同品种荔枝壳中总酚、总原花青素、总黄酮含量及A型低聚原花青素组分进行了分析,采用DPPH、ABTS+自由基清除法及FRAP法测定其体外抗氧化活性。结果表明,褐毛荔果壳提取物中所含抗氧化活性成分如总酚、总原花青素、总黄酮以及总A型低聚原花青素含量均为最高。经电喷雾液质联用四级杆飞行时间质谱(HPLC-Q-TOF-MS/MS)分析鉴定,得到所含物质的一级及二级质谱。质谱结果显示荔枝壳中含有的低聚原花青素组分主要为表儿茶素、原花青素A2、原花青素A4、A型三聚体及四聚体,不同品种荔枝壳中原花青素含量具有差异性(P<0.05)。褐毛荔果壳提取物表现出较强的自由基清除活性(DPPH∙:1144.60 μmol Trolox/g DW,ABTS+∙:2905.56 μmol Trolox/g DW,FRAP:868.84 μmol Trolox/g DW)。经皮尔逊相关性分析,原花青素单体、二聚体、三聚体含量与抗氧化活性具有显著相关性(P<0.05)。综合分析,与其他品种相比,褐毛荔果壳提取物中A型低聚原花青素含量最高,体外抗氧化活性方面表现最佳,可作为开发天然抗氧化产品的新型潜在原料加以利用。Abstract: To screen eminent litchi varieties suitable for the development of natural antioxidant products, the total phenol, total proanthocyanidin, total flavonoid contents and A-type oligomeric procyanidin fractions in the pericarps of seven diverse litchi cultivars were analyzed. The in vitro antioxidant activities including DPPH, ABTS+ free radical scavenging and FRAP were determined. The results demonstrated that the total phenols, total proanthocyanidins, total flavonoids as well as total A-type oligomeric procyanidins contained in the pericarp extract of 'Hemaoli' were the highest. In addition, the primary and secondary mass spectra of the contained substances were analyzed and identified by electrospray liquid-mass spectrometry with quadrupole time-of-flight mass spectrometry (HPLC-Q-TOF-MS/MS). The mass spectrometry results demonstrated that the oligomeric procyanidin fractions contained in litchi pericarps were mainly epicatechin, procyanidin A2, procyanidin A4, A-type trimer and tetramer. Moreover, the content of A-type oligomeric procyanidins in litchi pericarp varied significantly (P<0.05) among diverse cultivars. The pericarp extract of 'Hemaoli' possessed potent free radical scavenging activity (DPPH∙: 1144.60 μmol Trolox/g DW, ABTS+∙: 2905.56 μmol Trolox/g DW, FRAP: 868.84 μmol Trolox/g DW). The contents of A-type procyanidin monomer, dimer and trimer were significantly correlated with antioxidant activity by Pearson's correlation analysis (P<0.05). In summary, a comprehensive analysis indicated that the pericarp extract of 'Hemaoli' contained the highest content of A-type oligomeric procyanidins as well as remarkable antioxidant activity compared to other cultivars. Therefore, 'Hemaoli' could be utilized as a novel potential material for the development of natural antioxidant products.
-
Keywords:
- Lingnan fruit /
- Litchi chinensis Sonn. /
- A-type proanthocyanidins /
- polymerization /
- bioactivity
-
荔枝(Litchi chinensis Sonn.),一种广泛种植于中国南部、越南及泰国等地的亚热带水果作物,属于无患子科荔枝属,是自然界为数不多富含A型原花青素的水果[1]。A型原花青素在荔枝果壳、果肉及种子中均有分布,但以果壳中含量最高,可占荔枝壳总原花青素含量的41.7%,含量远高于B型原花青素[2−5]。它是荔枝中主要的功能性物质,具有抗糖尿病[6]、降压[7]、抗动脉粥样硬化[8]、抗炎[9]等功效。一般来说,聚合度小于5的原花青素一般称作低聚原花青素,大于5的称为高聚原花青素[10]。研究表明,人体细胞和组织不断受到自由基和活性氧造成的损害的威胁,这些自由基和活性氧是在正常氧气代谢过程中产生的或由外源性损伤引起的[11]。而低聚原花青素拥有强大的抗氧化能力,能有效抑制脂氧合酶、羟基、超氧化物和过氧自由基活性[12]。通过消除体内过多的自由基,低聚原花青素可防止脂质氧化和阻断自由基链反应,从而维持自由基和抗氧化酶之间的动态平衡(氧化稳态),有助于预防由自由基或脂质过氧化引起的各种不良后果,例如皮肤炎症、辐射损伤和细胞老化[13]。低聚原花青素抗氧化能力是维生素E的50倍,维生素C的20倍,并且可以被人体小肠迅速吸收,生物利用度>90%[14]。Gong等[15]对妃子笑果壳中的原花青素进行分离纯化得到4个原花青素组分,DPPH自由基清除率均要强于维生素C。Liu等[5]从桂味果壳提取出的低聚原花青素、原花青素A2和A型三聚体[epicatechin-(4β→8, 2β→O→7)-epicatechin-(4β→8)-epicatechin]对羟基自由基均有较强的清除作用,IC50值分别为2.60、1.75和1.65 μg/mL。谢翀等[16]从荔枝生理落果中分离纯化的原花青素组分具有较强的ABTS+∙和DPPH∙清除能力,在100 μg/mL时,清除率可分别达到92.52%和46.98%,总抗氧化能力显著高于维生素C(P<0.05)。Li等[17]则证明了益生菌生物转化是一种将荔枝果皮原花青素转化为更有效抗氧化剂的可行有效的方法。
目前,关于不同品种荔枝果壳中的A型低聚原花青素组成、含量以及抗氧化活性研究未见报道。因此,本研究以国内7个品种的荔枝为研究对象,用甲醇作为提取溶剂对荔枝壳中低聚原花青素进行提取,利用高效液相质谱(HPLC)对各原花青素组分进行分离,利用高效液相色谱电喷雾四级杆飞行时间质谱(HPLC-Q-TOF-MS/MS)对各原花青素组分进行物质鉴定,深入探究荔枝壳中原花青素组分的组成、含量及抗氧化活性,为荔枝壳的废物利用提供理论依据,为A型原花青素的获取探索新的天然植物来源。
1. 材料与方法
1.1 材料与仪器
荔枝 试验选取7个品种荔枝,包括白糖罂、白蜡、风鸡头、妃子笑、桂味、褐毛荔及仙桃荔。不同品种荔枝达到各自商业采收成熟度时采摘,采摘后于当天立即运回果蔬加工实验室,挑选大小和成熟度一致,且无病虫害及机械损伤的果实进行实验,采样情况见表1。将荔枝迅速去壳后经−70 ℃冷冻干燥72 h,打粉过60目筛网后密封避光储存于−20 ℃冰箱中备用;正己烷、无水甲醇 分析纯,上海润捷科技发展有限公司;福林酚(分析纯)、没食子酸(标准品)、表儿茶素(标准品)、原花青素A2(标准品)、原花青素A4(标准品) 上海源叶生物科技有限公司;香草醛、硫酸 分析纯,上海麦克林生化科技有限公司;甲酸 色谱纯,天津科密欧化学试剂有限公司;乙腈 色谱纯,德国默克公司;二苯基苦基苯肼(DPPH)、硫酸亚铁、水杨酸、2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、过硫酸钾、氢氧化钠、硝酸铝、亚硝酸钠、碳酸钠、无水乙醇等 均为分析纯,上海国药集团化学试剂有限公司。
表 1 供试荔枝品种以及采样情况Table 1. Cultivars of litchi and sampling condition编号 荔枝品种 产地 采样时间 北纬 东经 1 白糖罂 广东高州 2023.06.03 21°55’ 110°51’ 2 白蜡 广东高州 2023.06.03 21°55’ 110°51’ 3 风鸡头 广东高州 2023.06.14 21°55’ 110°51’ 4 妃子笑 广东高州 2023.06.03 21°55’ 110°51’ 5 桂味 广东高州 2023.06.08 21°55’ 110°51’ 6 褐毛荔 云南屏边 2023.05.17 22°59’ 103°41’ 7 仙桃荔 广东徐闻 2023.06.08 22°19’ 110°10’ SCIENTZ-10N/A型真空冷冻干燥机 宁波新芝冻干设备有限公司;1260 Infinity型高效液相色谱仪、Agilent 6540UHD型四级杆串联飞行时间质谱联用仪、Zorbox SB-C18柱(4.6 mm×250 mm 5-Micron) 美国安捷伦科技有限公司;Uvmini-1240型紫外分光光度计 日本岛津公司;TD5-II低速离心机 长沙平凡仪器仪表有限公司;H01-1D恒温磁力搅拌器 梅颖浦仪器仪表制造有限公司。
1.2 实验方法
1.2.1 荔枝壳多酚化合物的提取
参考Guyot等[18]的方法并稍作修改。将荔枝壳粉末与正己烷按1:10(g/mL)的料液比混合,搅拌过夜,使用G3漏斗进行固液分离除去正己烷后,按1:10(g/mL)的料液比与含1%乙酸的70%甲醇溶液混合后在40 ℃下400 r/min磁力搅拌提取40 min,提取三次并将提取液合并,40 ℃下真空浓缩除去甲醇后,冷冻干燥72 h得荔枝壳多酚提取物,−20 ℃条件下冷藏备用。
1.2.2 总酚含量测定
参考Wang等[19]的方法对总酚含量进行测定,以没食子酸为标准品比对。配制5 g/L的没食子酸标准储备溶液,用移液管分别移取0、0.2、0.5、0.8、1.0、1.2、1.5 mL的没食子酸标准储备溶液于10 mL容量瓶中,分别用水定容至刻度,摇匀,得到浓度分别为0、100、250、400、500、600、750 mg/L的没食子酸标准工作溶液。用移液管分别移取没食子酸工作液、水(作空白对照用)及稀释后的提取液各0.1 mL于10 mL刻度比色管内,在每个试管内分别加入0.5 mL的福林酚(Folin-Ciocalteu)试剂,摇匀,反应5 min,继续加入1.5 mL 20%Na2CO3溶液,再加水定容、摇匀,室温放置2 h,于765 nm处测定吸光值,重复测定3次。根据没食子酸工作液的浓度与吸光值制作标准曲线(Y=0.001X+0.0424,R2=0.9975),并根据测试液的吸光值计算样品中总酚含量。
1.2.3 总原花青素含量测定
参考Sun等[20]的方法对总原花青素含量进行测定。以表儿茶素为标准品比对。配制5 g/L的表儿茶素标准储备溶液,用移液管分别移取0、0.4、0.5、0.6、0.8、1.0、1.2 mL的表儿茶素标准储备溶液于10 mL容量瓶中,分别用水定容至刻度,摇匀,得到浓度分别为0、0.2、0.25、0.3、0.4、0.5、0.6 mg/mL的表儿茶素标准提取溶液。用移液管分别移取表儿茶素工作液、甲醇(作空白对照用)及稀释后的测试液各1 mL于10 mL刻度比色管内,在每个试管内分别加入2.5 mL 1%香草醛-甲醇溶液和2.5 mL 20%硫酸-甲醇溶液,振荡混匀,30 ℃水浴20 min,500 nm下测定吸光值,重复测定3次。根据表儿茶素工作液的浓度与吸光值制作标准曲线(Y=0.8676X−0.0001,R2=0.9994),并根据测试液的吸光值计算样品中总原花青素含量。
1.2.4 总黄酮含量测定
参考Zhang等[21]的方法对总黄酮含量进行测定。以芦丁为标准品比对。配制0.1 g/L的芦丁标准储备溶液,用移液管分别移取0、2、4、6、8、10 mL的表儿茶素标准储备溶液于10 mL容量瓶中,分别用30%乙醇定容至刻度,摇匀,得到浓度分别为0、0.02、0.04、0.06、0.08、0.10 mg/mL的芦丁标准工作溶液。用移液管分别移取芦丁工作液、水(作空白对照用)及稀释后的提取液各5 mL于10 mL刻度比色管内,在每个试管内分别加入0.3 mL 5%NaNO2溶液和0.3 mL 10% Al(NO3)3溶液,振荡混匀,放置5 min,加入2 mL 1 mol/L NaOH溶液,30%乙醇定容至10 mL,摇匀,放置5 min。510 nm下测定吸光值,重复测定3次。根据芦丁工作液的浓度与吸光值制作标准曲线(Y=4.715X+0.0101,R2=0.9979),并根据测试液的吸光值计算样品中总黄酮含量。
1.2.5 原花青素组分的测定
参考Xie等[22]的方法并稍作修改。使用高效液相色谱(HPLC)系统分析酚类化合物,使用 Zorbox SB-C18柱,紫外分光光度检测器。进样量为10 μL,柱温维持35 ℃,流速 0.7 mL/min,检测波长280 nm。流动相为含0.4%(v/v)甲酸水溶液(溶液A)和乙腈(溶液B)。洗脱条件如表2所示,每个样品重复测定3次。
表 2 HPLC梯度洗脱条件Table 2. Gradient elution program of HPLC保留时间(min) 流动相A(%) 流动相B(%) 0 83 17 10 80 20 12 80 20 15 77 23 22 77 23 25 50 50 30 45 55 32 20 80 35 83 17 为进行物质鉴定,所选样品在Agilent 6540UHD Q-TOF进行ESI负离子分析上进行分析,流动相和洗脱条件与高效液相色谱分析相同。质谱使用ESI离子源收集条件:孔板电压−30 V;雾化压力45 Psi;热毛细管温度275 ℃;质量范围m/z 100~1200;干燥气体为氮气。
根据HPLC-Q-TOF-MS/MS,得到相应出峰时间物质的分子量及碎片离子峰,对各原花青素组分进行定性分析。根据HPLC绘制出的各标准品质量浓度与峰面积关系的标准曲线,对各原花青素组分定量分析,标准品包括表儿茶素、原花青素A2及原花青素A4。由于缺少对应标准品,本研究样品中A型二聚体、三聚体以及四聚体均以原花青素A2当量表示。
1.2.6 DPPH自由基清除能力测定
参考Xie等[22]的方法并做适当修改。精确称取7.89 mg DPPH溶于95%乙醇中,定容到100 mL,配制成浓度为2×10−4 mol/L的DPPH溶液,并在517 nm波长处加入95%乙醇调节吸光度值为0.700±0.002,避光待用。称取0.025 g Trolox(水溶性VE,TE),加入10 mL 95%乙醇溶解,定容至100 mL,配制成1 mmol/L的Trolox标准母液,用移液管分别移取0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL的Trolox标准母液于5 mL容量瓶中,分别用95%乙醇定容至刻度,摇匀,得到浓度分别为0、100、200、300、400、500、600、700 μmol/L的Trolox标准工作溶液。取0.1 mL Trolox标准工作溶液、稀释后的提取液于10 mL棕色容量瓶,并与3.9 mL DPPH溶液混合,摇晃均匀,室温(25 ℃)下避光静置反应30 min,95%乙醇做空白对照,在517 nm处测定吸光值,重复测定3次。根据Trolox标准工作液的浓度与吸光值制作标准曲线(Y=−0.0005X+0.6753,R2=0.9997),并根据提取液的吸光值衡量样品的DPPH自由基清除能力。
1.2.7 ABTS+自由基清除能力测定
参考Wang等[23]的方法并做适当修改。将25 mL 7 mmol/L ABTS水溶液与0.44 mL 140 mmol/L的过硫酸钾水溶液混合,并在4 ℃环境下避光放置12~16 h。之后在734 nm波长处加入适量95%乙醇将该工作液吸光值调整为0.700±0.002,得到ABTS溶液,避光备用。称取0.025 g Trolox,加入10 mL 95%乙醇溶解,定容至100 mL,配制成1 mmol/L的Trolox标准母液,用移液管分别移取0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL的Trolox标准母液于5 mL容量瓶中,分别用95%乙醇定容至刻度,摇匀,得到浓度分别为0、100、200、300、400、500、600、700 μmol/L的Trolox标准工作溶液。取0.1 mL Trolox标准工作溶液、稀释后的提取液于10 mL棕色容量瓶,并与3.9 mL现配的ABTS溶液混合,摇晃均匀,室温(25 ℃)下避光静置反应30 min,在734 nm处测定吸光值,重复测定3次。根据Trolox标准工作液的浓度与吸光值制作标准曲线(Y=−0.0006X+0.508,R2=0.9994),并根据提取液的吸光值衡量样品的ABTS+自由基清除能力。
1.2.8 FRAP总抗氧化能力测定
参考Zhou等[24]的方法并做适当修改,将250 mL醋酸缓冲液(pH3.6)、25 mL 10 mmol/L TPTZ、25 mL 20 mmol/L FeCl3∙6H2O混合均匀(10:1:1,v/v/v),放置于37 ℃水浴锅避光预热10 min,备用,现配现用。称取0.025 g Trolox,加入10 mL 95%乙醇溶解,定容至100 mL,配制成1 mmol/L的Trolox标准母液,用移液管分别移取0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL的Trolox标准母液于5 mL容量瓶中,分别用95%乙醇定容至刻度,摇匀,得到浓度分别为0、100、200、300、400、500、600、700 μmol/L的Trolox标准工作溶液。取0.1 mL Trolox标准工作溶液、稀释后的提取液于10 mL棕色容量瓶,并与3.9 mL现配的FRAP溶液混合,摇晃均匀,37 ℃下避光静置反应30 min,在593 nm处测定吸光值,重复测定3次。根据Trolox标准工作液的浓度与吸光值制作标准曲线(Y=0.001X+0.0236,R2=0.9995),并根据提取液的吸光值衡量样品的FRAP值。
1.2.9 相关性分析
对不同品种荔枝壳提取物清除DPPH∙、ABTS+∙能力、总抗氧化能力与总酚、总原花青素、总黄酮、总A型低聚原花青素含量之间进行相关性分析,采用Person进行相关性分析,P<0.05表示差异有统计学意义。
1.3 数据处理
采用Origin 2023软件处理数据并作图,每个样品测定3个平行,所有实验均重复3次,结果以平均数±标准误差表示。通过SPSS 26.0对数据进行显著性分析(P<0.05)。
2. 结果与分析
2.1 荔枝壳多酚提取物中主要抗氧化活性成分测定结果
多酚是一类主要由植物合成的次级代谢产物,也是人类饮食中最丰富的抗氧化剂,因其强大的抗氧化能力和调节细胞功能的其他特性而被广泛研究[25−26]。荔枝壳中的多酚也被证明具有抑制亚油酸的过氧化及清除自由基等功能[1]。不同品种荔枝壳中的总酚、总原花青素、总黄酮含量如表3所示。不同品种荔枝壳之间的总酚含量差异显著(P<0.05),其含量变化幅度介于154.13~243.80 mg GAE/g DW,由高到低依次是褐毛荔>白糖罂>凤鸡头>白蜡>妃子笑>仙桃荔>桂味。原花青素是具有各种药理特性的缩合单宁,是类黄酮生物合成途径的最终产物,也是影响荔枝壳提取物抗氧化能力大小的主要物质之一[27−28]。研究结果显示不同荔枝壳的总原花青素含量存在较大的变异系数(>20%),总原花青素含量介于77.09~158.16 mg EPE/g DW,褐毛荔、白糖罂、凤鸡头三个品种的总原花青素含量较高,分别为158.16、137.03、127.61 mg EPE/g DW,显著高于其他4个品种(P<0.05);而桂味中总原花青素含量最低,显著低于其他品种(P<0.05)。黄酮类化合物广泛存在于水果、蔬菜和饮料中,人体胃肠吸收的黄酮类化合物及其代谢产物均表现出体内抗氧化活性[11]。研究显示,7个品种荔枝壳总黄酮含量介于356.71~476.61 mg RE/g DW,其中褐毛荔、妃子笑总黄酮含量较高,分别为476.61、433.06 mg RE/g DW,均明显高于其他5个品种;而仙桃荔、桂味中总黄酮含量最低,显著低于其他品种(P<0.05)。
表 3 不同品种荔枝壳提取物中总酚、总原花青素和总黄酮含量(干重)Table 3. Contents of total phenolics, procyanidins and flavonoids in litchi pericarp extracts (dry weight)品种 总酚
(mg GAE/g)总原花青素
(mg EPE/g)总黄酮
(mg RE/g)白蜡 194.63±5.51c 117.82±3.13c 404.18±1.23c 白糖罂 211.13±2.05b 137.03±7.56b 427.55±17.97bc 凤鸡头 198.97±1.84c 127.61±5.41b 420.23±0.53bc 妃子笑 177.47±5.33d 98.61±0.47d 433.06±2.61b 桂味 154.13±3.79f 77.09±1.90e 356.71±9.27e 褐毛荔 243.80±0.82a 158.16±1.96a 476.61±8.25a 仙桃荔 164.47±1.31e 97.84±0.72d 384.78±6.14d 平均值 192.09 116.31 415.30 标准误差 26.24 25.36 35.18 变异系数(%) 13.66 21.81 8.47 注:同一列不同字母代表显著性差异(P<0.05);GAE、EPE、RE分别表示没食子酸、表儿茶素、芦丁。 2.2 不同品种荔枝壳多酚提取物中A型低聚原花青素的鉴定与含量分析
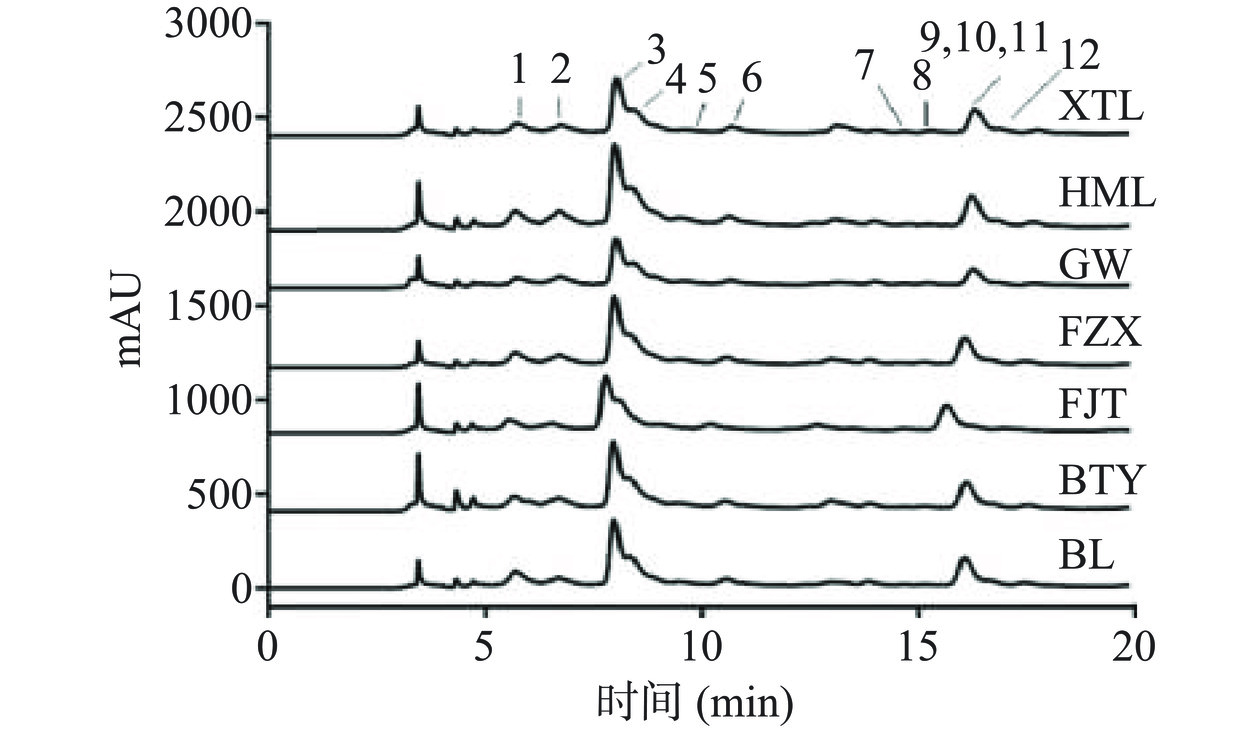
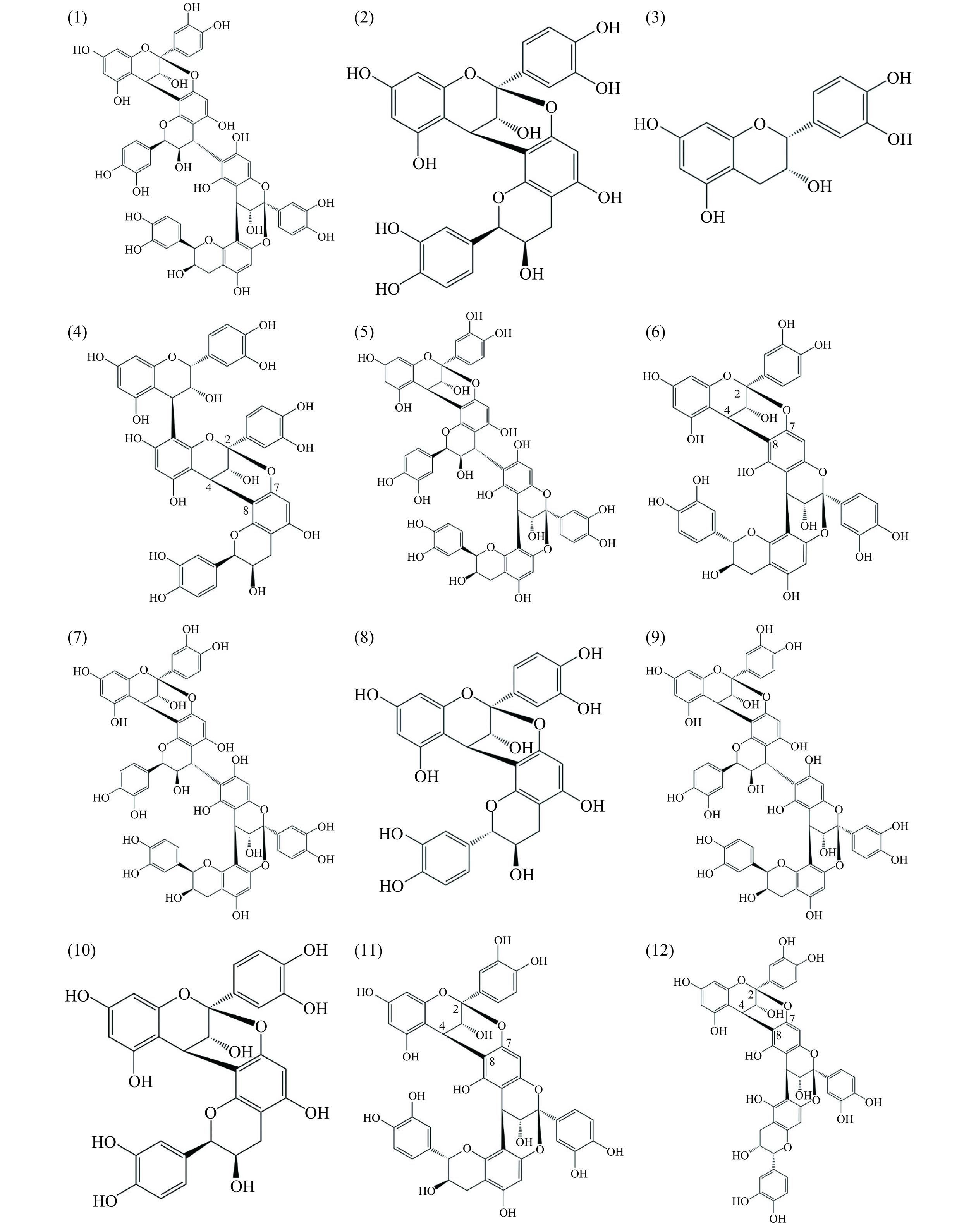
原花青素是荔枝中重要的酚类物质之一,研究表明荔枝果皮多酚中约有60%对应于原花青素[29]。为了比较不同品种荔枝壳A型低聚原花青素组成和含量并为荔枝壳中原花青素开发利用提供理论依据,采用HPLC-Q-TOF-MS/MS对荔枝壳中的原花青素结构进行鉴定。图1为荔枝壳中原花青素的液相色谱图,由图可见,所有样品均分离出3个大峰及8个小峰,分离效果良好,其中4 min的色谱峰为溶剂峰。各样品中化合物的出峰时间基本一致,可以初步判断品种差异对化合物的组成没有明确的影响。为了进一步明确物质组成,对荔枝壳中的原花青素组分进行鉴定,在荔枝壳提取物中共鉴定出12种原花青素组分(表4),包括一种单体、三种A型二聚体、四种A型三聚体、四种A型四聚体,其中保留时间为8.15 min的物质,其质荷比(m/z)为289.0,经与标准品进行外标对照,鉴定其为表儿茶素。而保留时间为6.89、15.21、16.25 min的物质,其m/z为575.1,比B型二聚体少2个质子,表明其结构中存在一个附加的C-O-C键,碎片离子峰为425.09、289.07及125.02,符合A型二聚体的裂解途径[30],并且经与标准品对照,保留时间为15.21、16.25 min的化合物分别是原花青素A4和原花青素A2。而化合物4、6、7、12的m/z为863.1,经二级质谱鉴定确认为A型三聚体[29]。保留时间为5.90、9.81、14.06、16.25 min的化合物,其m/z为1151.2,其二级质谱包括863.1、575.1及423.0的碎片离子峰,初步鉴定为A型原花青素四聚体[31]。各峰对应各物质分子式如图2所示。
表 4 HPLC-Q-TOF-MS/MS 表征荔枝壳提取物中各原花青素组分Table 4. HPLC-Q-TOF-MS/MS characterization of procyanidins in the litchi pericarps extracts编号 保留时间 (min) 质量 分子式 化合物 1 5.90 1152.25 C60H48O24 A型四聚体1 2 6.89 576.13 C30H24O12 A型二聚体1 3 8.15 290.08 C15H14O6 表儿茶素 4 8.64 864.19 C45H36O18 A型三聚体1 5 9.81 1152.25 C60H48O24 A型四聚体2 6 10.84 864.19 C45H36O18 A型三聚体2 7 14.06 1152.25 C60H48O24 A型四聚体3 8 15.21 576.13 C30H24O12 原花青素A4 9 16.25 864.19 C45H36O18 A型三聚体3 10 16.25 576.13 C30H24O12 原花青素A2 11 16.25 1152.25 C60H48O24 A型四聚体4 12 17.66 864.19 C45H36O18 A型三聚体4 为了计算在相同保留时间内同时出峰的原花青素含量,以标准品的质量浓度为横坐标(μg/mL),色谱峰面积为纵坐标,得到三种标准品的定量标准曲线,各标品峰面积和浓度线性关系良好,回归方程系数R2均大于0.9990(表5)。表6为7个样品中的12种原花青素组分含量以及总A型二聚体、三聚体、四聚体、总A型原花青素含量。所有样品均含有较高水平的A型原花青素,其中表儿茶素、原花青素A2、A型三聚体含量相对较高,为荔枝壳中最主要的原花青素组分。这与Xie等[9]对不同品种荔枝落果原花青素组分鉴定结果一致。总A型原花青素含量在161.12~297.97 mg/g DW之间,含量从高到低依次为褐毛荔>妃子笑>白蜡>白糖罂>凤鸡头>仙桃荔>桂味。在各原花青素低聚物中,单体表儿茶素含量与原花青素A2含量相当,含量变化幅度分别在31.53~57.94 mg/g DW以及26.74~53.18 mg/g DW之间。另外,除原花青素A4含量略低于仙桃荔,其他原花青素组分含量均为褐毛荔最高。
表 5 原花青素标准品的回归方程及相关系数Table 5. Linear regression equations and correlation coefficients of procyanidin standards原花青素标准品名称 回归方程 回归方程系数(R2) 线性范围(μg/mL) 表儿茶素 Y=14.30X−159.30 0.9992 50~800 原花青素A2 Y=7.65X−53.80 0.9998 50~800 原花青素A4 Y=7.81X−1.90 0.9999 50~800 表 6 不同品种荔枝壳提取物中各A型低聚原花青素组分含量(mg/g DW)Table 6. Content of each A-type procyanidin fraction in the pericarp extracts of different litchi varieties (mg/g DW)原花青素组分 白蜡 白糖罂 凤鸡头 妃子笑 桂味 褐毛荔 仙桃荔 表儿茶素 44.68±1.12b 45.24±1.72b 36.14±1.47c 44.61±0.45b 31.53±0.63d 57.94±3.70a 38.71±0.86c 原花青素A2 49.20±0.60b 45.61±0.16c 45.31±2.39c 46.11±1.89c 26.74±0.72e 53.18±0.53a 41.36±1.29d A型二聚体1 17.41±0.04c 15.06±0.72d 15.06±0.24d 20.32±0.43b 17.02±0.07c 30.58±0.45a 17.34±0.17c 原花青素A4 2.73±0.33d 2.95±0.11d 2.88±0.24d 4.75±0.23bc 4.04±0.46c 5.05±0.72ab 5.83±0.09a A型三聚体1 50.93±2.78bc 54.66±4.17b 46.73±3.07cd 57.21±1.32b 42.56±1.83d 75.31±2.75a 40.83±2.50d A型三聚体2 11.80±0.10b 11.99±0.33b 9.94±0.25c 12.57±1.70b 7.39±0.12d 15.06±0.51a 11.34±0.08bc A型三聚体3 3.10±0.03b 2.92±0.01c 2.91±0.12c 2.95±0.09c 1.99±0.04e 3.30±0.030a 2.71±0.06d A型三聚体4 8.06±0.13bc 8.40±0.24ab 6.29±1.17cd 9.55±0.66ab 3.62±0.45e 9.96±0.99a 5.35±0.80de A型四聚体1 29.68±0.89a 17.07±0.33c 23.24±0.13b 24.66±1.13b 12.55±0.06d 29.29±3.04a 22.45±0.71b A型四聚体2 3.79±0.19cd 4.88±0.35bc 4.74±0.67cd 6.08±0.87b 3.94±0.29cd 7.42±0.42a 3.55±0.26d A型四聚体3 6.90±0.32ab 7.19±0.59ab 3.21±0.65c 7.36±0.75a 5.98±0.16b 7.57±0.70a 4.52±0.49c A型四聚体4 4.52±0.05a 4.23±0.01a 4.21±0.19a 4.27±0.15a 2.75±0.06b 4.33±0.75a 3.90±0.10a 总A型二聚体 69.61±0.97b 63.62±0.79c 63.24±2.70c 71.19±1.26b 48.81±1.52d 87.80±1.28a 64.53±1.54c 总A型三聚体 73.90±2.66c 77.97±3.61bc 65.87±3.39d 82.27±3.27b 55.56±2.12e 103.63±1.56a 60.23±3.29de 总A型四聚体 44.90±0.78b 33.37±0.53c 35.40±1.44c 42.37±0.42b 25.22±0.16d 48.60±2.76a 34.41±0.63c 总A型原花青素 233.09±3.12b 220.20±1.25c 200.65±6.42d 240.44±2.52b 161.12±0.15d 297.97±2.02a 197.89±4.57d 注:同一行不同字母代表显著性差异(P<0.05);样品中A型三聚体和四聚体由于缺少相应标准品,均以原花青素A2当量表示。 2.3 不同品种荔枝壳多酚提取物的体外抗氧化活性分析
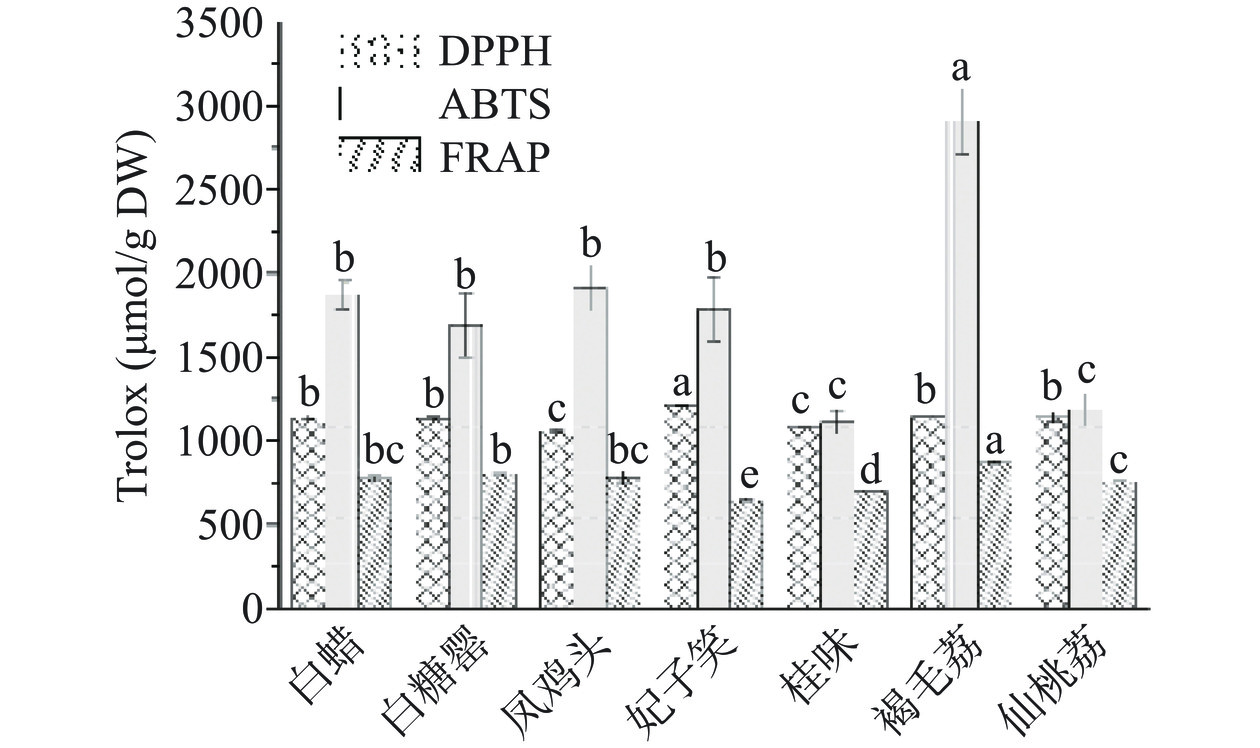
荔枝果壳强大的抗氧化活性与酚类物质有关[32,19]。因此,采用DPPH∙、ABTS+∙清除法及铁还原力(FRAP)法评价不同品种荔枝壳提取物的抗氧化能力。结果如图3所示。DPPH∙清除能力由大到小排序为妃子笑>褐毛荔>仙桃荔>白蜡>白糖罂>桂味>凤鸡头;而在ABTS+∙清除能力由大到小排序为褐毛荔>凤鸡头>白蜡>妃子笑>白糖罂>仙桃荔>桂味;FRAP法并非针对某种自由基的清除能力,它所反映的是所测样品的总抗氧化能力,也就是说,样品的总抗氧化能力越强,对自由基的清除能力越高,其抗氧化能力越强[33],总抗氧化能力由大到小排序为褐毛荔>白糖罂>白蜡>凤鸡头>仙桃荔>桂味>妃子笑。这些结果表明,总酚含量越高的品种,其体外抗氧化活性越强。这可能是因为羟基具有较好的供氢能力,是酚类物质清除自由基的重要因素[34]。
2.4 荔枝壳多酚提取物中低聚原花青素与抗氧化活性的关联
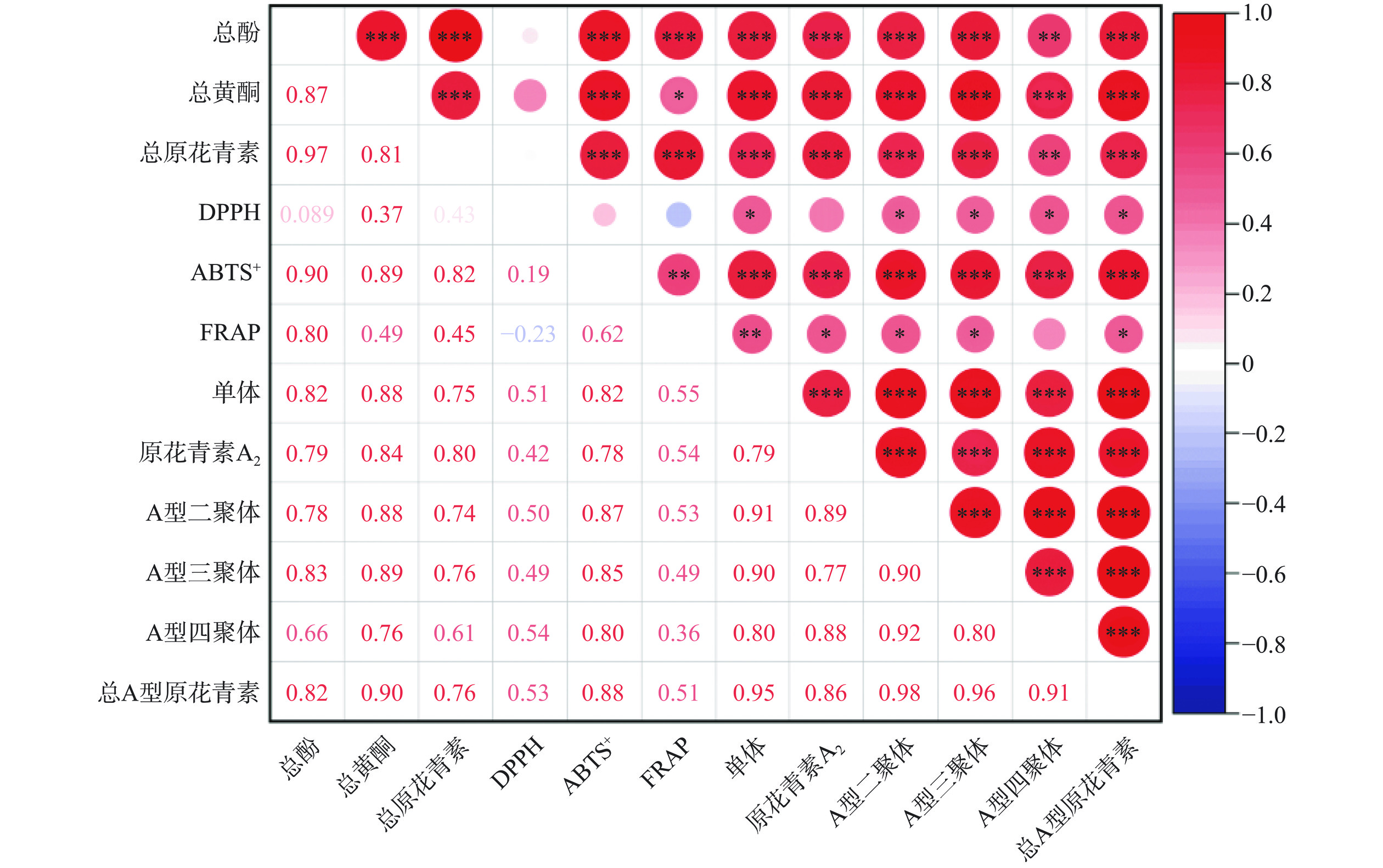
研究表明,植物的抗氧化活性与其生物活性物质含量之间存在一定的相关性[35]。采用皮尔逊相关系数明晰各指标之间的相关性程度,结果以皮尔逊相关系数热图表示。如图4所示,总酚分别与单体(表儿茶素)(r=0.82;P<0.001)、A型二聚体(r=0.78;P<0.001)、A型三聚体(r=0.83;P<0.001)、A型四聚体(r=0.66;P<0.01)、总A型原花青素(r=0.82;P<0.001)均呈显著正相关。这表明A型原花青素是荔枝壳中主要的酚类化合物,与表6的结果相互印证。Li等[36]研究表明荔枝壳低聚原花青素中有超过41.7%的A型原花青素。同时,体外抗氧化活性(DPPH、ABTS+、FRAP)与单体(r≥0.51,P<0.05)、原花青素A2(r≥0.54,P<0.05(DPPH除外))、A型二聚体(r≥0.50,P<0.05)、A型三聚体(r≥0.49,P<0.05)、A型四聚体(r≥0.54,P<0.05(FRAP除外))、总A型原花青素(r≥0.51,P<0.05)含量具有显著正相关性。羟基是影响酚类化合物体外抗氧化活性的重要因素,这也是提取物酚类化合物含量越高其抗氧化活性越好的原因。2个单体(表儿茶素)的羟基数目比一个A型二聚体要多一个,这是由于随着原花青素的聚合形成C-O-C键,化合物的羟基减少。因此在相同的浓度下,单体比A型原花青素聚合物含有更多的羟基。所以A型原花青素的聚合度越高,A型原花青素表现出与体外抗氧化活性越弱的相关性[37],这也在本研究中得到验证。
3. 结论
对7个品种荔枝壳提取物的抗氧化活性成分及体外抗氧化活性进行测定。结果表明7个样品的总酚含量在154.13~243.80 mg/g DW之间,总原花青素含量在77.09~158.16 mg/g DW之间,总黄酮含量在356.71~476.61 mg/g DW之间,相比较而言,褐毛荔总酚、总原花青素、总黄酮含量在7种荔枝中相对较高。通过HPLC-Q-TOF-MS/MS对不同品种荔枝壳样品原花青素组分进行结构鉴定与含量分析,得出7个荔枝壳样品中含有的主要原花青素组分为表儿茶素、原花青素A2、原花青素A4、A型三聚体及A型四聚体,总A型原花青素含量介于161.12~297.97 mg/g DW之间,褐毛荔含量最高,桂味含量最低。
通过DPPH∙、ABTS+∙、FRAP这3种体外抗氧化方法来比较不同品种荔枝壳提取物抗氧化活性,综合比较可知妃子笑、褐毛荔、仙桃荔对DPPH自由基清除能力较强,褐毛荔、凤鸡头对ABTS+自由基清除能力较强,FRAP总抗氧化能力在7个品种中也较强。皮尔逊相关分析发现总酚、总原花青素、总黄酮含量以及单体、A型二聚体、A型三聚体、A型四聚体与抗氧化能力间有着显著相关性(P<0.05)。综上,褐毛荔果壳提取物有着较高的A型低聚原花青素含量以及较强的综合体外抗氧化活性。
本文表明褐毛荔果壳是A型低聚原花青素理想的天然植物来源,而A型低聚原花青素又与抗氧化活性具有显著相关性。本研究不仅有利于荔枝加工副产物的再利用,同时为新型功能保健品的开发提供了理论依据和技术指导。
-
表 1 供试荔枝品种以及采样情况
Table 1 Cultivars of litchi and sampling condition
编号 荔枝品种 产地 采样时间 北纬 东经 1 白糖罂 广东高州 2023.06.03 21°55’ 110°51’ 2 白蜡 广东高州 2023.06.03 21°55’ 110°51’ 3 风鸡头 广东高州 2023.06.14 21°55’ 110°51’ 4 妃子笑 广东高州 2023.06.03 21°55’ 110°51’ 5 桂味 广东高州 2023.06.08 21°55’ 110°51’ 6 褐毛荔 云南屏边 2023.05.17 22°59’ 103°41’ 7 仙桃荔 广东徐闻 2023.06.08 22°19’ 110°10’ 表 2 HPLC梯度洗脱条件
Table 2 Gradient elution program of HPLC
保留时间(min) 流动相A(%) 流动相B(%) 0 83 17 10 80 20 12 80 20 15 77 23 22 77 23 25 50 50 30 45 55 32 20 80 35 83 17 表 3 不同品种荔枝壳提取物中总酚、总原花青素和总黄酮含量(干重)
Table 3 Contents of total phenolics, procyanidins and flavonoids in litchi pericarp extracts (dry weight)
品种 总酚
(mg GAE/g)总原花青素
(mg EPE/g)总黄酮
(mg RE/g)白蜡 194.63±5.51c 117.82±3.13c 404.18±1.23c 白糖罂 211.13±2.05b 137.03±7.56b 427.55±17.97bc 凤鸡头 198.97±1.84c 127.61±5.41b 420.23±0.53bc 妃子笑 177.47±5.33d 98.61±0.47d 433.06±2.61b 桂味 154.13±3.79f 77.09±1.90e 356.71±9.27e 褐毛荔 243.80±0.82a 158.16±1.96a 476.61±8.25a 仙桃荔 164.47±1.31e 97.84±0.72d 384.78±6.14d 平均值 192.09 116.31 415.30 标准误差 26.24 25.36 35.18 变异系数(%) 13.66 21.81 8.47 注:同一列不同字母代表显著性差异(P<0.05);GAE、EPE、RE分别表示没食子酸、表儿茶素、芦丁。 表 4 HPLC-Q-TOF-MS/MS 表征荔枝壳提取物中各原花青素组分
Table 4 HPLC-Q-TOF-MS/MS characterization of procyanidins in the litchi pericarps extracts
编号 保留时间 (min) 质量 分子式 化合物 1 5.90 1152.25 C60H48O24 A型四聚体1 2 6.89 576.13 C30H24O12 A型二聚体1 3 8.15 290.08 C15H14O6 表儿茶素 4 8.64 864.19 C45H36O18 A型三聚体1 5 9.81 1152.25 C60H48O24 A型四聚体2 6 10.84 864.19 C45H36O18 A型三聚体2 7 14.06 1152.25 C60H48O24 A型四聚体3 8 15.21 576.13 C30H24O12 原花青素A4 9 16.25 864.19 C45H36O18 A型三聚体3 10 16.25 576.13 C30H24O12 原花青素A2 11 16.25 1152.25 C60H48O24 A型四聚体4 12 17.66 864.19 C45H36O18 A型三聚体4 表 5 原花青素标准品的回归方程及相关系数
Table 5 Linear regression equations and correlation coefficients of procyanidin standards
原花青素标准品名称 回归方程 回归方程系数(R2) 线性范围(μg/mL) 表儿茶素 Y=14.30X−159.30 0.9992 50~800 原花青素A2 Y=7.65X−53.80 0.9998 50~800 原花青素A4 Y=7.81X−1.90 0.9999 50~800 表 6 不同品种荔枝壳提取物中各A型低聚原花青素组分含量(mg/g DW)
Table 6 Content of each A-type procyanidin fraction in the pericarp extracts of different litchi varieties (mg/g DW)
原花青素组分 白蜡 白糖罂 凤鸡头 妃子笑 桂味 褐毛荔 仙桃荔 表儿茶素 44.68±1.12b 45.24±1.72b 36.14±1.47c 44.61±0.45b 31.53±0.63d 57.94±3.70a 38.71±0.86c 原花青素A2 49.20±0.60b 45.61±0.16c 45.31±2.39c 46.11±1.89c 26.74±0.72e 53.18±0.53a 41.36±1.29d A型二聚体1 17.41±0.04c 15.06±0.72d 15.06±0.24d 20.32±0.43b 17.02±0.07c 30.58±0.45a 17.34±0.17c 原花青素A4 2.73±0.33d 2.95±0.11d 2.88±0.24d 4.75±0.23bc 4.04±0.46c 5.05±0.72ab 5.83±0.09a A型三聚体1 50.93±2.78bc 54.66±4.17b 46.73±3.07cd 57.21±1.32b 42.56±1.83d 75.31±2.75a 40.83±2.50d A型三聚体2 11.80±0.10b 11.99±0.33b 9.94±0.25c 12.57±1.70b 7.39±0.12d 15.06±0.51a 11.34±0.08bc A型三聚体3 3.10±0.03b 2.92±0.01c 2.91±0.12c 2.95±0.09c 1.99±0.04e 3.30±0.030a 2.71±0.06d A型三聚体4 8.06±0.13bc 8.40±0.24ab 6.29±1.17cd 9.55±0.66ab 3.62±0.45e 9.96±0.99a 5.35±0.80de A型四聚体1 29.68±0.89a 17.07±0.33c 23.24±0.13b 24.66±1.13b 12.55±0.06d 29.29±3.04a 22.45±0.71b A型四聚体2 3.79±0.19cd 4.88±0.35bc 4.74±0.67cd 6.08±0.87b 3.94±0.29cd 7.42±0.42a 3.55±0.26d A型四聚体3 6.90±0.32ab 7.19±0.59ab 3.21±0.65c 7.36±0.75a 5.98±0.16b 7.57±0.70a 4.52±0.49c A型四聚体4 4.52±0.05a 4.23±0.01a 4.21±0.19a 4.27±0.15a 2.75±0.06b 4.33±0.75a 3.90±0.10a 总A型二聚体 69.61±0.97b 63.62±0.79c 63.24±2.70c 71.19±1.26b 48.81±1.52d 87.80±1.28a 64.53±1.54c 总A型三聚体 73.90±2.66c 77.97±3.61bc 65.87±3.39d 82.27±3.27b 55.56±2.12e 103.63±1.56a 60.23±3.29de 总A型四聚体 44.90±0.78b 33.37±0.53c 35.40±1.44c 42.37±0.42b 25.22±0.16d 48.60±2.76a 34.41±0.63c 总A型原花青素 233.09±3.12b 220.20±1.25c 200.65±6.42d 240.44±2.52b 161.12±0.15d 297.97±2.02a 197.89±4.57d 注:同一行不同字母代表显著性差异(P<0.05);样品中A型三聚体和四聚体由于缺少相应标准品,均以原花青素A2当量表示。 -
[1] ZHAO L, WANG K, WANG K, et. al. Nutrient components, health benefits, and safety of litchi (Litchi chinensis Sonn.):A review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):2139−2163. doi: 10.1111/1541-4337.12590
[2] XU X, XIE H, WANG Y, et. al. A-type proanthocyanidins from lychee seeds and their antioxidant and antiviral activities[J]. Journal of Agricultural and Food Chemistry,2010,58(22):11667−11672. doi: 10.1021/jf1033202
[3] LI X, SUI Y, LI S, et. al. A-type procyanidins from litchi pericarp ameliorate hyperglycaemia by regulating hepatic and muscle glucose metabolism in streptozotocin (STZ)-induced diabetic mice fed with high fat diet[J]. Journal of Functional Foods,2016,27:711−722. doi: 10.1016/j.jff.2016.08.010
[4] LÜ Q, LUO F, ZHAO X, et. al. Identification of proanthocyanidins from litchi (Litchi chinensis Sonn.) pulp by LC-ESI-Q-TOF-MS and their antioxidant activity[J]. PLoS One,2015,10(3):e0120480. doi: 10.1371/journal.pone.0120480
[5] LIU L, XIE B, CAO S, et. al. A-type procyanidins from Litchi chinensis pericarp with antioxidant activity[J]. Food Chemistry,2007,105(4):1446−1451. doi: 10.1016/j.foodchem.2007.05.022
[6] LI X, SUI Y, XIE B, et. al. Diabetes diminishes a typical metabolite of litchi pericarp oligomeric procyanidins (LPOPC) in urine mediated by imbalanced gut microbiota[J]. Food & Function,2021,12(12):5375−5386.
[7] KESSY H N E, WANG K, ZHAO L, et. al. Enrichment and biotransformation of phenolic compounds from litchi pericarps with angiotensin I-converting enzyme (ACE) inhibition activity[J]. LWT,2018,87:301−309. doi: 10.1016/j.lwt.2017.09.003
[8] RONG S, ZHAO S, KAI X, et. al. Procyanidins extracted from the litchi pericarp attenuate atherosclerosis and hyperlipidemia associated with consumption of a high fat diet in apolipoprotein-E knockout mice[J]. Biomedicine & Pharmacotherapy,2018,97:1639−1644.
[9] XIE C, WANG K, LIU X, et. al. Characterization and bioactivity of A-type procyanidins from litchi fruitlets at different degrees of development[J]. Food Chemistry,2023,405(30):134855.
[10] LIU X, LE BOURVELLEC C, GUYOT S, et. al. Reactivity of flavanols:Their fate in physical food processing and recent advances in their analysis by depolymerization[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20:4841−4880. doi: 10.1111/1541-4337.12797
[11] PANCHE A N, DIWAN A D, CHANDRA S R. Flavonoids:An overview[J]. Journal of Nutritional Science,2016,5:e47. doi: 10.1017/jns.2016.41
[12] ZHOU W, ZHAO L, WANG K, et. al. Plant leaf proanthocyanidins:From agricultural production by-products to potential bioactive molecules[J]. Critical Reviews in Food Science and Nutrition,2023,1:1−39.
[13] LAI R, XIAN D, XIONG X, et. al. Proanthocyanidins:novel treatment for psoriasis that reduces oxidative stress and modulates Th17 and Treg cells[J]. Redox Report,2018,23(1):130−135. doi: 10.1080/13510002.2018.1462027
[14] LU Y, YEAP FOO L. Antioxidant and radical scavenging activities of polyphenols from apple pomace[J]. Food Chemistry,2000,68(1):81−85. doi: 10.1016/S0308-8146(99)00167-3
[15] GONG E S, GAO N, LI T, et. al. Effect of in vitro digestion on phytochemical profiles and cellular antioxidant activity of whole grains[J]. Journal of Agricultural and Food Chemistry,2019,67(25):7016−7024. doi: 10.1021/acs.jafc.9b02245
[16] 谢翀, 林琳, 吴戈仪, 等. 荔枝生理落果中 A 型原花青素提取纯化鉴定及抗氧化活性研究[J]. 食品工业科技,2022,43(3):81−87. [XIE C, LIN L, WU G Y, et al. Extraction, purification, identification of A-type pocyanidine from litchi fruitlet and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(3):81−87.] XIE C, LIN L, WU G Y, et al. Extraction, purification, identification of A-type pocyanidine from litchi fruitlet and its antioxidant activity[J]. Science and Technology of Food Industry, 2022, 43(3): 81−87.
[17] LI S, CHEN L, YANG T, et al. Increasing antioxidant activity of procyanidin extracts from the pericarp of Litchi chinensis processing waste by two probiotic bacteria bioconversions[J]. Journal of Agricultural and Food Chemistry,2013,61(10):2506−2512. doi: 10.1021/jf305213e
[18] GUYOT S, MARNET N, DRILLEAU J F. Thiolysis−HPLC characterization of apple procyanidins covering a large range of polymerization states[J]. Journal of Agricultural and Food Chemistry,2001,49(1):14−20. doi: 10.1021/jf000814z
[19] WANG H C, HU Z Q, WANG Y, et al. Phenolic compounds and the antioxidant activities in litchi pericarp:Difference among cultivars[J]. Scientia Horticulturae,2011,129(4):784−789. doi: 10.1016/j.scienta.2011.05.042
[20] SUN B, RICARDO-DA-SILVA J M, SPRANGER I. Critical factors of vanillin assay for catechins and proanthocyanidins[J]. Journal of Agricultural and Food Chemistry,1998,46(10):4267−4274. doi: 10.1021/jf980366j
[21] ZHANG R, ZENG Q, DENG Y, et al. Phenolic profiles and antioxidant activity of litchi pulp of different cultivars cultivated in Southern China[J]. Food Chemistry,2013,136(3-4):1169−1176. doi: 10.1016/j.foodchem.2012.09.085
[22] XIE F, LI M, LAN X, et. al. Modification of dietary fibers from purple-fleshed potatoes (Heimeiren) with high hydrostatic pressure and high pressure homogenization processing:A comparative study[J]. Innovative Food Science & Emerging Technologies,2017,42:157−164.
[23] WANG D, LIU X, WANG K, et al. Impact of non-thermal modifications on the physicochemical properties and functionality of litchi pomace dietary fibre[J]. LWT,2023,182:114878. doi: 10.1016/j.lwt.2023.114878
[24] ZHOU Y, XIE F, ZHOU X, et al. Effects of maillard reaction on flavor and safety of Chinese traditional food:Roast duck[J]. Journal of the Science of Food and Agriculture,2016,96(6):1915−1922. doi: 10.1002/jsfa.7297
[25] XIAO Y, AHMAD T, BELWAL T, et al. A review on protein based nanocarriers for polyphenols:Interaction and stabilization mechanisms[J]. Food Innovation and Advances,2023,2(3):193−202. doi: 10.48130/FIA-2023-0021
[26] XI Y, ZENG X, PU Y, et al. The synergistic effect of dietary cholesterol with fruit tannins in forming kidney stones[J]. Food Innovation and Advances,2023,2(2):163−170. doi: 10.48130/FIA-2023-0019
[27] RAUF A, IMRAN M, ABU-IZNEID T, et al. Proanthocyanidins:A comprehensive review[J]. Biomedicine and Pharmacotherapy,2019,116:108999. doi: 10.1016/j.biopha.2019.108999
[28] 张瑞芬. 荔枝果壳原花青素的分离鉴定及其抗动脉粥样硬化作用分子机制[D]. 武汉:华中农业大学, 2017. [ZHANG R F. Separation and identification of litchi pericarp procyanidins and their action mechanism in attenuating atherosclerosis[D]. Wuhan:Huazhong Agricultural University, 2017.] ZHANG R F. Separation and identification of litchi pericarp procyanidins and their action mechanism in attenuating atherosclerosis[D]. Wuhan: Huazhong Agricultural University, 2017.
[29] MIRANDA-HERNÁNDEZ A M, MUÑIZ-MÁRQUEZ D B, WONG-PAZ J E, et al. Characterization by HPLC–ESI–MS2 of native and oxidized procyanidins from litchi (Litchi chinensis) pericarp[J]. Food Chemistry,2019,291:126−131. doi: 10.1016/j.foodchem.2019.04.020
[30] SUI Y, LI X, LI S, et al. Characterization and preparation of oligomeric procyanidins from Litchi chinensis pericarp[J]. Fitoterapia,2016,112:168−174. doi: 10.1016/j.fitote.2016.06.001
[31] LIN L Z, SUN J, CHEN P, et al. UHPLC-PDA-ESI/HRMSn profiling method to identify and quantify oligomeric proanthocyanidins in plant products[J]. Journal of Agricultural and Food Chemistry,2014,62(39):9387−9400. doi: 10.1021/jf501011y
[32] QI Q, CHU M, YU X, et al. Anthocyanins and proanthocyanidins:Chemical structures, food sources, bioactivities, and product development[J]. Food Reviews International,2022(2):1−29.
[33] GUO C, YANG J, WEI J, et al. Antioxidant activities of peel, pulp and seed fractions of common fruits as determined by FRAP assay[J]. Nutrition Research,2003,23(12):1719−1726. doi: 10.1016/j.nutres.2003.08.005
[34] WANG H, SUN W, WANG L H, et al. Molecular structures of nonvolatile components in the Haihong fruit wine and their free radical scavenging effect[J]. Food Chemistry,2021,353(15):129298.
[35] PINEDO-ESPINOZA J M, GUTIÉRREZ-TLAHQUE J, SANTIAGO-SAENZ Y O, et al. Nutritional composition, bioactive compounds and antioxidant activity of wild edible flowers consumed in semiarid regions of Mexico[J]. Plant Foods for Human Nutrition,2020,75(3):413−419. doi: 10.1007/s11130-020-00822-2
[36] LI S, XIAO J, CHEN L, et al. Identification of A-series oligomeric procyanidins from pericarp of Litchi chinensis by FT-ICR-MS and LC-MS[J]. Food Chemistry,2012,135(1):31−38. doi: 10.1016/j.foodchem.2012.04.039
[37] ZHOU P, ZHANG L, LI W, et al. In vitro evaluation of the anti-digestion and antioxidant effects of grape seed procyanidins according to their degrees of polymerization[J]. Journal of Functional Foods,2018,49:85−95. doi: 10.1016/j.jff.2018.08.001
-
期刊类型引用(0)
其他类型引用(2)





 下载:
下载:
 下载:
下载:



