Effects of Polysaccharides from Urtica macrorrhiza Hand.-Mazz. on Phagocytic Function and Polarization of Macrophage
-
摘要: 目的:研究粗根荨麻鼠李半乳糖醛酸聚糖(Urtica macrorrhiza Hand.-Mazz. Rhamnnogalacturonans,UMRG)和粗根荨麻阿拉伯半乳聚糖(Urtica macrorrhiza Hand.-Mazz. Arabinogalactan,UMAG)对巨噬细胞的吞噬功能和极化的影响。方法:CCK8法研究粗根荨麻多糖UMRG、UMAG对巨噬细胞活力的影响;中性红实验、流式细胞术、激光共聚焦研究UMRG、UMAG对巨噬细胞吞噬功能的影响;流式细胞术研究UMRG、UMAG对巨噬细胞极化的影响;Griess法和酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)检测UMRG、UMAG对巨噬细胞一氧化氮(Nitric oxide,NO)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素6(Interleukin 6,IL-6)、白细胞介素1β(Interleukin 1β,IL-1β)分泌水平的影响。结果: UMRG和UMAG在10~320 µg/mL浓度范围内对巨噬细胞均无显著的细胞毒性;UMRG和UMAG均可显著增强巨噬细胞对中性红和模式抗原的吞噬作用(P<0.05),其中UMRG促进巨噬细胞吞噬的作用较UMAG强。UMRG和UMAG均能极显著刺激巨噬细胞CD86和CD206分子表达量的上调(P<0.01),其中CD86上调比例显著高于CD206,UMRG的作用较UMAG强;UMRG、UMAG均能极显著刺激巨噬细胞分泌NO、TNF-α、IL-6(P<0.01)。结论:粗根荨麻多糖UMRG、UMAG可激活巨噬细胞,增强巨噬细胞的吞噬功能,主要促进巨噬细胞向M1型极化,增强免疫活性,且UMRG活性强于UMAG。Abstract: Objective: To investigate the effects of Urtica macrorrhiza Hand.-Mazz. rhamnnogalacturonans (UMRG), and Urtica macrorrhiza Hand.-Mazz. arabinogalactan (UMAG) on the immunological function by regulating phagocytic and polarization of macrophages. Methods: The effects of UMRG and UMAG on the viability of macrophage were studied by the cell counting kit-8 (CCK-8). The effects of UMRG and UMAG on the phagocytosis of macrophage were investigated by neutral red assay, flow cytometry and laser confocal microscopy. The effects of UMRG and UMAG on macrophage polarization were studied by flow cytometry. The effects of UMRG and UMAG on the secretion of nitric oxide (NO), tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), and interleukin-1β (IL-1β) were detected by Griess assay and enzyme-linked immunosorbent assay (ELISA). Results: UMRG and UMAG exhibited no significant cytotoxicity to macrophages in the concentration range of 10~320 µg/mL. Both UMRG and UMAG significantly enhanced the macrophage phagocytosis of neutral red and model antigens (P<0.05) by macrophage, and the activity of UMRG was stronger than UMAG. Both UMRG and UMAG significantly up-regulated the expression of CD86 and CD206 molecules on macrophage (P<0.01), however, the up-regulation proportion of CD86 was significantly higher than that of CD206, and the activity of UMRG was stronger than UMAG. Both UMRG and UMAG stimulated the secretion of NO, TNF-α, and IL-6 by macrophage (P<0.01). Conclusion: UMRG and UMAG from Urtica macrorrhiza Hand.-Mazz. can activate macrophage, enhance its phagocytic function and predominantly promote its polarization towards M1 type, thus they may be natural imunopotentiators. The activity of UMRG is stronger than UMAG.
-
Keywords:
- Urtica macrorrhiza Hand.-Mazz. /
- polysaccharides /
- macrophage /
- phagocytosis /
- polarization
-
荨麻为被子植物门、荨麻科、荨麻属,一年生或多年生草本植物,是一种重要的“药食同源”食材,拥有悠久的食用和药用历史,被人们添加于蔬菜沙拉、肉汤、奶酪、茶叶等食品中[1]。宋代《图经本草》记载,荨麻具有祛风定惊、消食通便之功效;明代李时珍《本草纲目》记载,荨麻具有祛风通络、活血止痛、平肝定惊等功效[2]。其中,粗根荨麻(Urtica macrorrhiza Hand.-Mazz.)具长而粗的木质化根状茎,特产于云南大理地区,具有祛风除湿、平肝解痉、解毒的功效[3]。现代药理学实验表明,荨麻可用于治疗类风湿性关节炎、痛风和良性前列腺增生等疾病[4−6]。荨麻中含有大量的生物活性物质,例如其叶片中富含萜类、类胡萝卜素、多糖、脂肪酸、各种必需氨基酸、维生素和矿物质[7−9];其根部含有甾醇和甾醇糖苷等[10]。其中,多糖是构成生命体的四大基本物质之一,在机体多种生物学过程中发挥重要作用。本课题组前期研究表明,粗根荨麻的叶、茎、根中分别含有4.62%、0.69%、1.13%的粗多糖,且不同部位的粗多糖均能够在一定程度上激活巨噬细胞,而对于粗根荨麻均一多糖是否能够激活巨噬细胞发挥免疫增强作用仍未可知。
巨噬细胞的吞噬功能和极化在其免疫调节中具有重要作用。巨噬细胞是机体最重要的专职吞噬细胞,其将吞噬的抗原加工后提呈给淋巴细胞而激活适应性免疫应答。研究表明,多种食物活性成分通过刺激巨噬细胞吞噬功能进而增强机体免疫功能,如从紫锥菊、铁皮石斛、槟榔中提取的高菊苣酸、铁皮石斛多糖、槟榔多糖等均可通过促进巨噬细胞吞噬而增强巨噬细胞免疫功能[11−13]。另外,巨噬细胞在受到不同刺激后可极化为经典的M1型巨噬细胞和替代活化的M2型巨噬细胞[14−16],共同维持机体免疫环境的稳态,例如从人参、灵芝中提取的人参皂苷、灵芝多糖等成分通过刺激机体向M1型极化,分泌NO、TNF-α等免疫因子,从而增强机体免疫功能[17]。
本课题组在前期基础上,进一步从产量最高的粗根荨麻叶粗多糖中分离纯化出两种均一多糖粗根荨麻鼠李半乳糖醛酸聚糖(Urtica macrorrhiza Hand.-Mazz. Rhamnnogalacturonans,UMRG)和粗根荨麻阿拉伯半乳聚糖(Urtica macrorrhiza Hand.-Mazz. Arabinogalactan,UMAG),为进一步明确粗根荨麻中的多糖成分对巨噬细胞的调节作用,本研究主要探讨了UMRG和UMAG对RAW 264.7细胞的吞噬功能、细胞极化及其进而影响的免疫因子分泌水平的变化,为明确粗根荨麻多糖在免疫调节制剂中的应用提供基础。
1. 材料与方法
1.1 材料与仪器
实验细胞小鼠巨噬细胞系RAW 264.7 购买于中国科学院上海生命科学研究院细胞资源中心;药材云南粗根荨麻 于2021年7月采自云南大理,经中国科学院昆明植物研究所杨文光鉴定为粗根荨麻(Urtica macrorrhiza Hand.-Mazz.)的全草;UMRG、UMAG 分别为本实验室从粗根荨麻的叶中提取到的均一多糖,核磁共振波谱、紫外光谱、红外光谱分析表明UMRG和UMAG中不含有蛋白、核酸等杂质,高效液相色谱图显示为均一对称单峰,UMRG主要由鼠李糖、葡萄糖醛酸、半乳糖醛酸和半乳糖组成,重均分子量为743353 Da,UMAG主要由半乳糖和阿拉伯糖组成,重均分子量为46951 Da;DMEM高糖培养基、青霉素-链霉素双抗 购自美国Gibco;大肠杆菌来源的脂多糖(Lipopolysaccharide,LPS) 购自美国Sigma-Aldrich;中性红 购自上海阿拉丁生化科技股份有限公司;荧光素5-异硫氰酸酯标记的鸡卵清白蛋白(Fluorescein isothiocyanate labeled chicken egg albumin,FITC-OVA) 购自北京索莱宝科技有限公司(批号:SF069);4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI) 购自武汉赛维尔生物科技有限公司;CCK-8试剂盒 购自苏州优逸兰迪生物科技有限公司(批号:230310L02-02);一氧化氮检测试剂盒 购自上海碧云天生物技术有限公司(批号:120922230612);小鼠肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)酶联免疫吸附测定试剂盒(批号:M230803-102a)、小鼠白细胞介素6(Interleukin 6,IL-6)酶联免疫吸附测定试剂盒(批号:M230811-004a)、小鼠白细胞介素1β(Interleukin 1β,IL-1β)酶联免疫吸附测定试剂盒(批号:M221115-001a) 购自上海欣博盛生物公司;PE标记的抗小鼠CD206抗体(PE anti-mouse CD206)(批号:B369245)、FITC标记的抗小鼠CD86抗体(FITC anti-mouse CD86)(批号:B367026) 购自美国Biolegend公司。
Hfsafe-1200LC生物安全柜 上海力申科学仪器有限公司;Forma™ 直热式CO2培养箱 美国Thermo;Multiskan Fc酶标仪 美国Thermo;LSM900激光共聚焦显微镜 德国Carl Zeiss AG;FACSCelesta 3流式细胞仪 美国BD公司。
1.2 实验方法
1.2.1 细胞培养
小鼠巨噬细胞系RAW 264.7采用含有10%胎牛血清和1%青霉素-链霉素双抗的DMEM高糖培养基培养,培养条件为37 ℃,5% CO2。
1.2.2 CCK8法测定UMRG、UMAG对巨噬细胞活力的影响
取对数生长期的RAW 264.7细胞,以1×104个/孔的密度接种于96孔板中,每孔150 μL,每组设置3个复孔。培养24 h后分别加入终浓度为10、20、40、80、160、320 µg/mL的UMRG和UMAG多糖溶液处理,每孔150 μL。以不加多糖的空白培养基作为阴性对照(Negative control,NC),以不加细胞的空白培养基作为调零孔。LPS是一种常见的内毒素,预实验结果表明,0.1~1 μg/mL的LPS可显著激活巨噬细胞,而10 μg/mL的LPS对巨噬细胞具有显著的细胞毒性,因此本研究以终浓度为1 µg/mL的LPS作为阳性对照。继续培养48 h后每孔加入10 µL CCK8 溶液,培养箱中继续培养4 h,酶标仪测定450 nm处吸光度值(OD)。
细胞活力(%)=OD实验组−OD调零孔OD阴性对照组−OD调零孔×100 1.2.3 中性红实验测定UMRG、UMAG对巨噬细胞吞噬功能的影响
取对数生长期的RAW 264.7细胞,以1×104个/孔的密度接种于96孔板中,150 μL/孔,每组设置3个复孔。培养24 h后分别加入终浓度为3.125、12.5、50、100、200 µg/mL的UMRG和UMAG多糖溶液处理,每孔150 μL。以不加多糖的空白培养基作为阴性对照,以终浓度为1 µg/mL的LPS作为阳性对照,以不加细胞的空白培养基作为调零孔。继续培养24 h后每孔加入1 mg/mL的中性红溶液100 µL,继续培养30 min。弃去上清液,用预冷的PBS洗3遍,每孔加入100 µL细胞裂解液(乙醇:冰醋酸=1:1),室温下静置2 h,待细胞完全溶解后,酶标仪测定540 nm处吸光度值(OD)。吞噬率计算公式如下:
吞噬率(%)=OD实验组−OD调零孔OD阴性对照组−OD调零孔×100 1.2.4 流式细胞术测定UMRG、UMAG对巨噬细胞吞噬抗原的影响
本研究以FITC标记的鸡卵清白蛋白OVA作为模式抗原,通过流式细胞术测定UMRG和UMAG对RAW 264.7细胞吞噬抗原的影响。对数生长期的RAW 264.7细胞以1.5×104个/孔的密度接种于24孔板中,500 µL/孔,5% CO2,37 ℃培养箱中培养24 h。各组细胞分别进行以下处理:阴性对照组加入空白培养基;OVA组加入FITC-OVA溶液(40 µg/mL);UMRG组加入UMRG(100 µg/mL)+FITC-OVA(40 µg/mL);UMAG组加入UMAG(100 µg/mL)+FITC-OVA(40 µg/mL)。继续培养12 h后吸弃培养基,每孔加入500 µL预冷的PBS清洗细胞2次,收集细胞,离心(1500 r/min,5 min),弃上清,每管加500 µL PBS清洗细胞1次,离心(1500 r/min,5 min),弃上清,每管加400 µL PBS重悬细胞,流式细胞仪检测荧光强度。
1.2.5 激光共聚焦观察UMRG、UMAG对巨噬细胞吞噬抗原的影响
取对数生长期的RAW 264.7细胞,以1.5×104个/孔的密度接种于放有无菌细胞爬片的24孔板中,500 µL/孔,5% CO2,37 ℃培养箱中培养24 h。各组细胞分别进行以下处理:OVA组加入FITC-OVA溶液(40 µg/mL);UMRG组加入UMRG(100 µg/mL)+FITC-OVA(40 µg/mL);UMAG组加入UMAG(100 µg/mL)+FITC-OVA(40 µg/mL);阳性对照LPS组加入LPS(1 µg/mL)+FITC-OVA(40 µg/mL)。继续培养12 h后吸弃培养基,每孔加入500 µL预冷的PBS清洗细胞2次,每次5 min。每孔加入500 µL 4%多聚甲醛室温固定30 min,固定结束后弃去多聚甲醛,PBS洗涤2次,每次5 min。每孔加入300 µL DAPI染细胞核,室温孵育30 min,PBS 洗涤3次,每次5 min。加入200 µL PBS,注射器针头取出爬片置于载玻片上,激光显微镜观察细胞摄取FITC-OVA情况。
1.2.6 流式细胞术检测UMRG、UMAG对巨噬细胞极化的影响
RAW 264.7细胞以2×105个/孔的密度接种于12孔板中,每孔1 mL,5% CO2,37 ℃培养箱中培养24 h。分别加入终浓度为100 µg/mL的UMRG、UMAG多糖溶液进行处理,每孔1 mL。以终浓度为1 µg/mL的LPS为阳性对照,以不加多糖的空白培养基作为阴性对照。继续培养24 h后收集细胞,计数,以1×106个/管的细胞数量分装细胞,NC组分为4管(分别为PE anti-mouse CD206单染管、FITC anti-mouse CD86单染管、双染管、阴性对照管),其余各组均为PE anti-mouse CD206和FITC anti-mouse CD86双染管。收集的细胞1500 r/min离心5 min,弃去上清,根据上述分组分别加入含有PE anti-mouse CD206和/或FITC anti-mouse CD86抗体的PBS溶液重悬细胞,每管100 µL,FITC anti-mouse CD86抗体用量为2 µL(1 µg)/106个细胞,PE anti-mouse CD206抗体用量为2.5 µL(0.5 µg)/106个细胞。室温避光孵育30 min,孵育过程中用移液枪重悬细胞2次,防止细胞因下沉而导致染色不均。孵育结束,每管加1 mL PBS重悬细胞,离心(1500 r/min,5 min),弃上清,重复2次。400 µL PBS重悬细胞,过300目尼龙膜,流式细胞仪检测荧光强度。
1.2.7 ELISA和Griess法检测UMRG、UMAG对巨噬细胞分泌免疫因子的影响
取对数生长期的RAW 264.7细胞以2×105个/孔的密度接种于24孔板中,每孔500 µL,每组设置3个复孔。5% CO2,37 ℃培养箱中培养24 h后分别加入终浓度为50、100、200 µg/mL的UMRG和UMAG多糖溶液处理,每孔500 μL。以不加多糖的空白培养基作为阴性对照,以终浓度为1 µg/mL的LPS作为阳性对照。继续培养24 h后收集细胞培养上清,采用Griess试剂盒检测各组培养上清中NO浓度,ELISA试剂盒测定TNF-α、IL-6和IL-1β分泌水平。
1.3 数据处理
采用GraphPad Prism 8.0统计软件分析数据,实验数据表示为均数±标准差,采用单因素方差分析(one-way ANOVA)对符合正态分布满足方差齐性的组间两两比较,不符合的采用非参数(秩和)检验。
2. 结果与分析
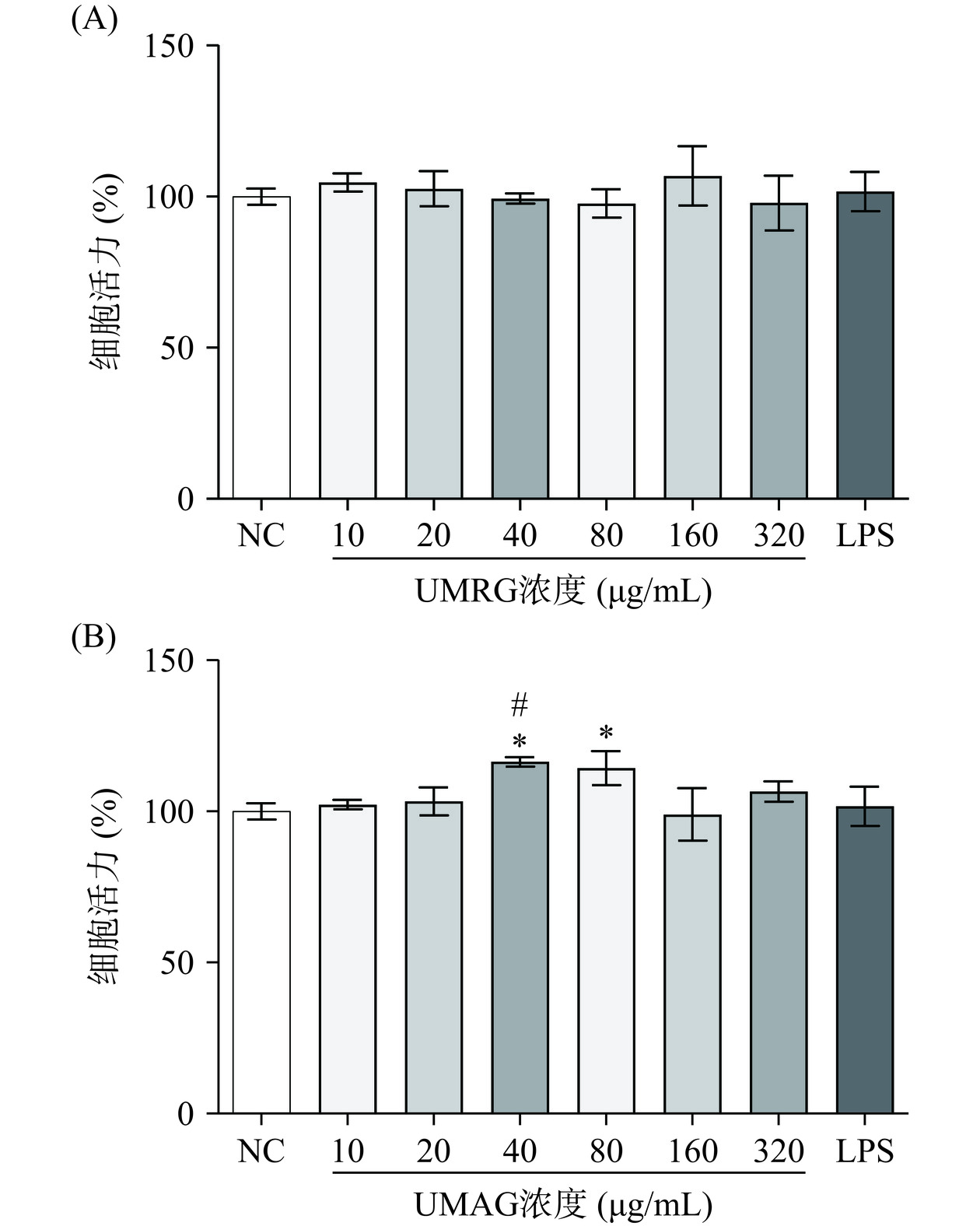
2.1 UMRG、UMAG对巨噬细胞活力的影响
安全性是免疫增强类食品和药品应用的前提,因此,本研究首先采用CCK8法测定了来自于粗根荨麻的两种均一多糖UMRG和UMAG对小鼠巨噬细胞RAW 264.7细胞活力的影响,结果如图1所示,10~320 µg/mL浓度范围内的UMRG处理RAW 264.7细胞后,细胞活力与阴性对照组无显著差异(P>0.05),与LPS组也无显著差异(P>0.05)。40、80 µg/mL的UMAG有轻微的促进巨噬细胞增殖的作用,细胞活力分别增长至116.39%±1.58%和114.28%±5.60%,显著高于阴性对照组(P<0.05),而10、20、160、320 µg/mL的UMAG处理巨噬细胞后,细胞活力与阴性对照组无显著差异(P>0.05),与LPS组也无显著差异(P>0.05)。多项研究表明,许多天然来源的多糖类物质具有良好的生物安全性[18−19],对机体正常细胞无显著的细胞毒性,来自于长裙竹荪的竹荪多糖、莴苣的葡聚糖还具有促进巨噬细胞增殖的效果[20−21]。本研究结果表明,在10~320 µg/mL浓度范围内,UMRG和UMAG对RAW 264.7细胞均无显著的细胞毒性。
2.2 UMRG、UMAG对巨噬细胞吞噬活性的影响
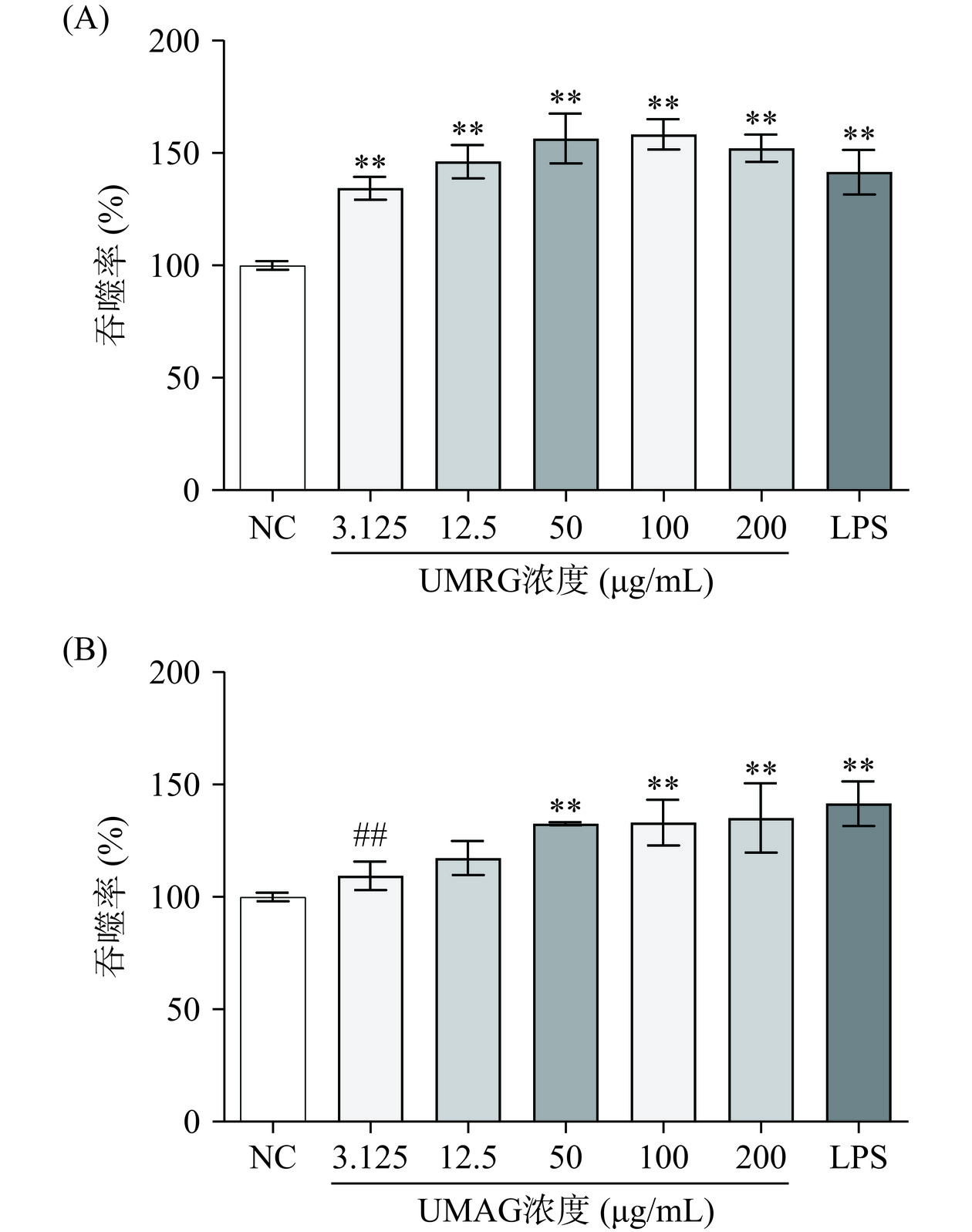
2.2.1 UMRG、UMAG对巨噬细胞吞噬中性红的影响
巨噬细胞作为先天免疫系统第一道防线的重要组成部分,通过吞噬清除病原体、细胞碎片等物质,吞噬功能是巨噬细胞发挥作用的重要功能[22−23]。本研究采用中性红吞噬实验测定不同浓度的粗根荨麻多糖UMRG、UMAG对RAW 264.7细胞吞噬活性的影响,结果如图2所示。UMRG在3.125~200 µg/mL范围内均能够刺激巨噬细胞吞噬中性红,吞噬率极显著高于阴性对照组(P<0.01),与阳性对照LPS组无显著差异(P>0.05),50~100 µg/mL的UMRG刺激巨噬细胞吞噬中性红的活性显著高于低浓度(3.125 µg/mL)的UMRG(P<0.05)。低浓度(3.125 µg/mL)的UMAG不能刺激RAW 264.7细胞吞噬中性红,随着UMAG浓度的增加,RAW 264.7细胞对中性红的吞噬能力逐渐增强,50~200 µg/mL的UMAG处理后,细胞吞噬率极显著高于阴性对照组(P<0.01),与LPS组相当(P>0.05),LPS组细胞吞噬率极显著高于低浓度(3.125 µg/mL)UMAG处理组(P<0.01)。
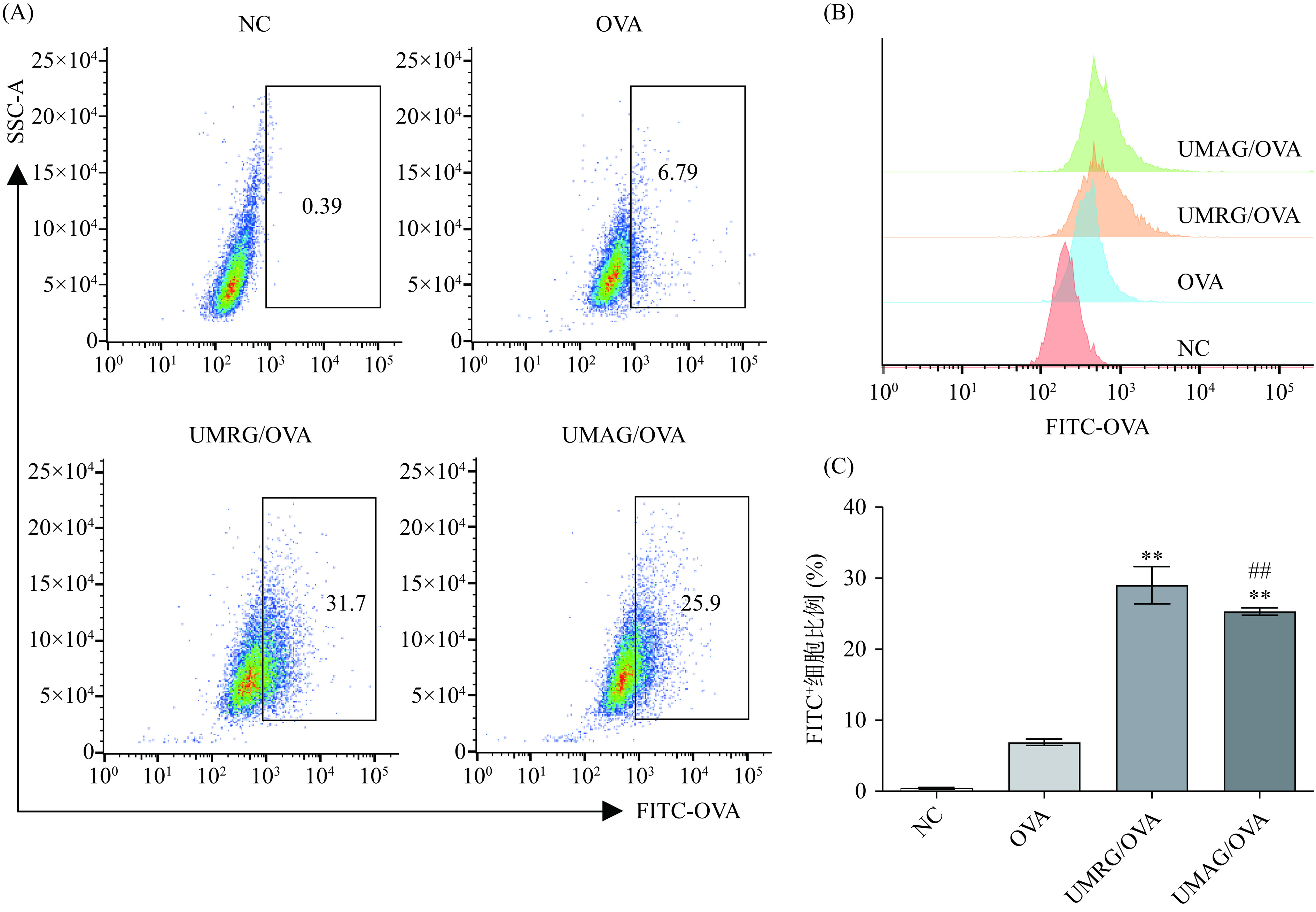
2.2.2 UMRG、UMAG对巨噬细胞吞噬抗原的影响
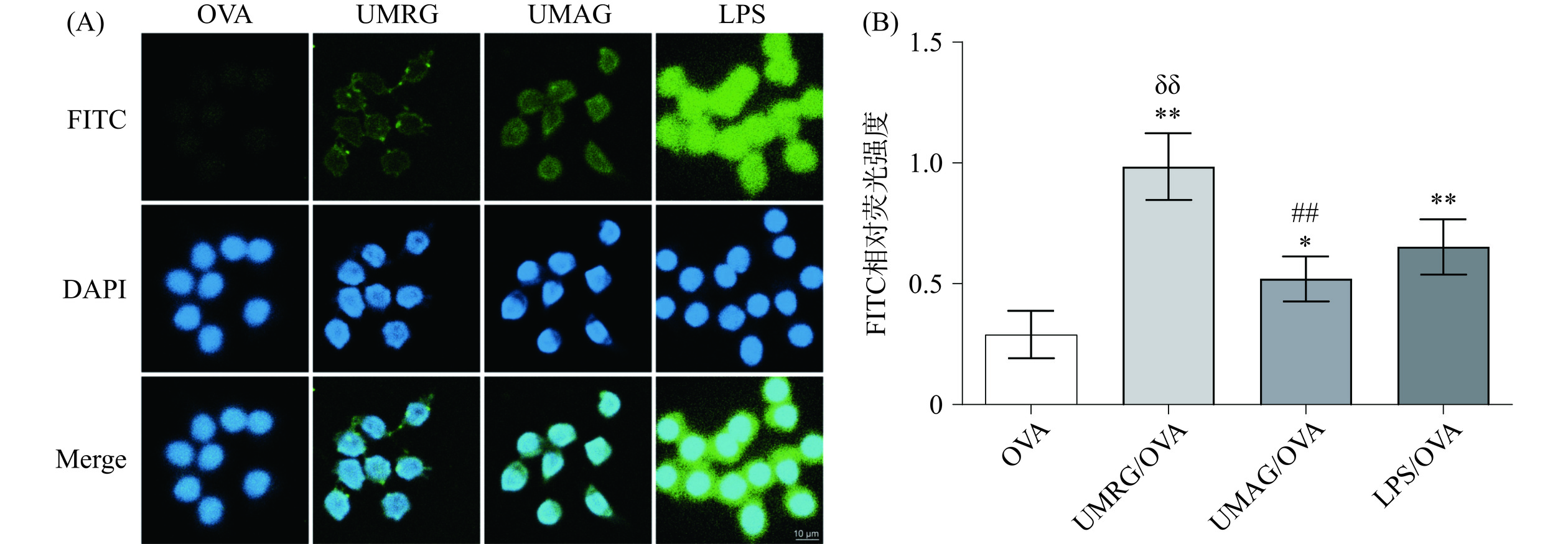
巨噬细胞的吞噬功能除了能够清除病原体和细胞碎片外,在激活适应性免疫应答中也具有重要作用,其通过吞噬抗原,并将其处理后呈递给幼稚T细胞和B细胞,激活适应性免疫[24−26]。因此,本研究进一步以荧光标记的OVA作为模式抗原,首先采用流式细胞术研究了UMRG、UMAG对RAW 264.7细胞吞噬抗原的影响,结果如图3所示,UMRG和UMAG组中,RAW 264.7细胞对FITC-OVA的吞噬率极显著高于OVA组(P<0.01)。其中,UMRG组的FITC-OVA吞噬率极显著高于UMAG组(P<0.01)。进一步采用激光共聚焦观察了UMRG、UMAG对RAW 264.7细胞吞噬抗原的影响,结果如图4所示,和流式实验结果一致,UMRG和UMAG组中,RAW 264.7细胞对FITC-OVA的吞噬率显著高于OVA组(P<0.05)。UMRG组的FITC-OVA吞噬率极显著高于UMAG组(P<0.01)。多糖可增强抗原递呈细胞的吞噬活性,促进细胞表面相关模式识别分子如MHCⅠ/MHCⅡ的表达,促进抗原递呈细胞的抗原递呈,激活适应性免疫应答[18,27]。因此,来自于粗根荨麻的两种均一多糖UMRG、UMAG可能通过促进巨噬细胞对抗原的吞噬作用进一步激活适应性免疫应答。
![]() 图 4 激光共聚焦观察粗根荨麻多糖UMRG、UMAG对巨噬细胞吞噬活性的影响注:(A)为代表性荧光图像,(B)为FITC荧光强度半定量分析。与OVA组比较,*P<0.05表示有显著性差异,**P<0.01表示有极显著性差异;与UMRG组比较,##P<0.01表示有极显著性差异;与LPS组比较,δδP<0.01表示有极显著性差异。Figure 4. Laser confocal microscopy observation of the effects of polysaccharides from Urtica macrorrhiza Hand.-Mazz. on macrophage phagocytosis of FITC-OVA
图 4 激光共聚焦观察粗根荨麻多糖UMRG、UMAG对巨噬细胞吞噬活性的影响注:(A)为代表性荧光图像,(B)为FITC荧光强度半定量分析。与OVA组比较,*P<0.05表示有显著性差异,**P<0.01表示有极显著性差异;与UMRG组比较,##P<0.01表示有极显著性差异;与LPS组比较,δδP<0.01表示有极显著性差异。Figure 4. Laser confocal microscopy observation of the effects of polysaccharides from Urtica macrorrhiza Hand.-Mazz. on macrophage phagocytosis of FITC-OVA2.3 UMRG、UMAG对巨噬细胞极化的影响
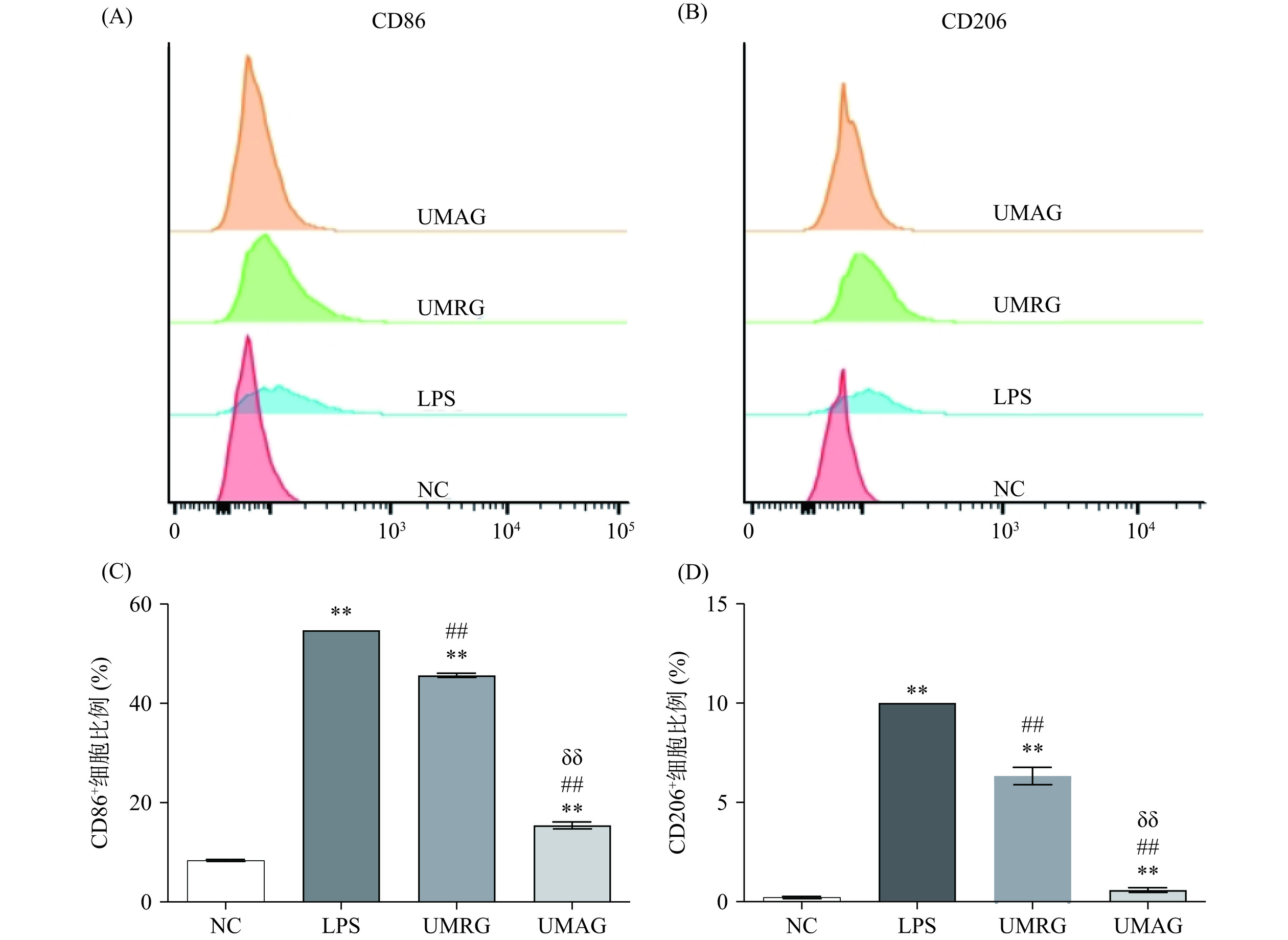
巨噬细胞极化在免疫调节、组织修复以及维持机体内环境稳态中具有十分重要的作用,分为经典活化的M1型巨噬细胞和替代激活的M2型巨噬细胞[28]。M1型巨噬细胞高表达CD86、MHC II、CD80等表面分子,M2型巨噬细胞高表达CD206、Arg-1等分子。为了研究粗根荨麻多糖对巨噬细胞极化的影响,本研究采用流式细胞术研究了UMRG、UMAG刺激后巨噬细胞表面分子CD86、CD206的表达情况,结果如图5所示。UMRG和UMAG处理后,RAW 264.7细胞CD86比例极显著高于阴性对照组(P<0.01),但极显著低于LPS组(P<0.01),UMRG组CD86+细胞比例极显著高于UMAG组(P<0.01)。这与目前的多项研究结果相符,如灵芝多糖、黄芪多糖可调节巨噬细胞向M1型极化促进巨噬细胞的免疫功能,抑制肝细胞癌的生长、改善血管内皮功能障碍,发挥免疫抗肿瘤作用[25−26]。本文的研究发现UMRG和UMAG处理后,RAW 264.7细胞CD206+比例也极显著高于阴性对照组(P<0.01),但极显著低于LPS组(P<0.01),UMRG组CD206+细胞比例显著高于UMAG组(P<0.01)。这表明,UMRG和UMAG激活巨噬细胞后,M1型巨噬细胞和M2型巨噬细胞均增加了,UMRG和UMAG刺激后,巨噬细胞CD86+细胞比例从8.40%±0.20%分别上调至45.65%±0.40%和15.43%±0.69%,CD206+细胞比例从0.21%±0.06%分别上调至6.33%±0.44%和0.58%±0.12%。因此,虽然UMRG和UMAG能够同时上调RAW 264.7细胞表面CD86和CD206的表达,但其主要促进CD86的表达,主要促进巨噬细胞向M1型极化。
2.4 粗根荨麻多糖UMRG、UMAG对巨噬细胞分泌免疫因子的影响
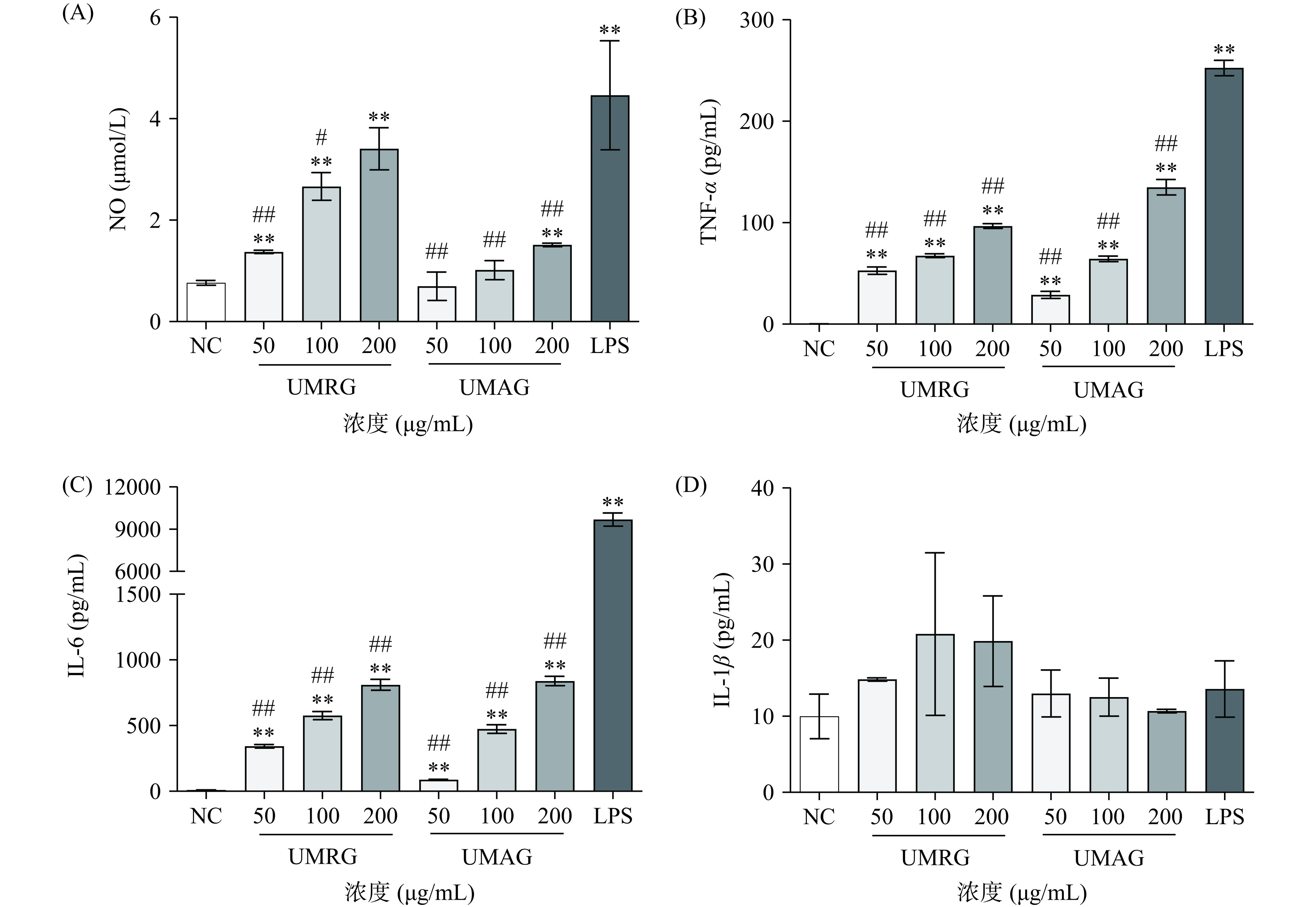
不同极化类型的巨噬细胞,分泌的细胞因子以及发挥的免疫调节功能不同。因此,本研究分别采用Griess法和ELISA检测了UMRG和UMAG处理巨噬细胞后NO、TNF-α、IL-6和IL-1β的分泌水平。结果如图6所示。50~200 µg/mL的UMRG处理后,巨噬细胞NO、TNF-α和IL-6的分泌水平均极显著高于阴性对照组(P<0.01),但TNF-α和IL-6的分泌水平极显著低于LPS(P<0.01)。UMAG促进巨噬细胞分泌NO的能力较UMRG弱,只有高浓度(200 µg/mL)的UMAG处理后,细胞NO分泌水平才较阴性对照极显著升高(P<0.01),但极显著低于阳性对照(P<0.01)。UMAG刺激巨噬细胞分泌TNF-α和IL-6的能力与UMRG相当,50~200 µg/mL的UMAG处理后,巨噬细胞TNF-α和IL-6的分泌水平均极显著高于阴性对照组(P<0.01),但极显著低于LPS(P<0.01)。50~200 µg/mL的UMRG和UMAG均不能显著刺激巨噬细胞分泌IL-1β(P>0.05)。TNF-α、IL-6和NO等促炎细胞因子主要由M1型巨噬细胞分泌,NO可通过氧化脱氨引起DNA损伤,破坏入侵的病原体[29];TNF-α与受体TNFR1结合,以细胞凋亡、坏死性凋亡或焦亡的形式诱导细胞死亡,垂死细胞释放细胞内成分,诱导邻近细胞中的促炎基因表达,促进和加剧炎症[30]。本研究中UMRG和UMAG能够促进巨噬细胞NO、TNF-α、IL-6分泌水平的增加,进一步表明了其主要促进巨噬细胞向M1型极化,与上述结果一致。
3. 结论
本研究探讨了从粗根荨麻叶中分离纯化获得的两种均一多糖鼠李半乳糖醛酸聚糖(UMRG)和阿拉伯半乳聚糖(UMAG)对巨噬细胞吞噬功能和极化的影响。发现UMRG和UMAG具有良好的生物安全性,能够促进巨噬细胞吞噬中性红和模式抗原,其中,UMRG促进巨噬细胞吞噬抗原的功能强于UMAG。UMRG和UMAG还能显著促进巨噬细胞向M1型极化,高表达表面分子CD86,促进免疫因子NO、TNF-α和IL-6的分泌水平,同样地,UMRG促进巨噬细胞向M1型极化的功能强于UMAG。本研究为明确从同一种粗根荨麻中提取分离的两种不同结构的多糖对巨噬细胞的调节作用及其在免疫调节制剂中的应用提供了实验基础,在后续研究中,需进一步明确粗根荨麻多糖激活巨噬细胞的分子机制,及其增强抗原吞噬后对抗原递呈及适应性免疫应答的调节作用。
-
图 4 激光共聚焦观察粗根荨麻多糖UMRG、UMAG对巨噬细胞吞噬活性的影响
注:(A)为代表性荧光图像,(B)为FITC荧光强度半定量分析。与OVA组比较,*P<0.05表示有显著性差异,**P<0.01表示有极显著性差异;与UMRG组比较,##P<0.01表示有极显著性差异;与LPS组比较,δδP<0.01表示有极显著性差异。
Figure 4. Laser confocal microscopy observation of the effects of polysaccharides from Urtica macrorrhiza Hand.-Mazz. on macrophage phagocytosis of FITC-OVA
-
[1] 杨倩, 何舒婷, 孟东, 等. 粗根荨麻不同部位多糖的提取及其对巨噬细胞的调节作用[J]. 食品工业科技,2023,44(15):392−400. [YANG Q, HE S T, MENG D, et al. Composition and immune regulatory effect of polysaccharides extracted from different parts of Urtica macrorrhiza Hand. -Mazz J]. Science and Technology of Food Industry,2023,44(15):392−400.
[2] 江苏省植物研究所. 新华本草纲要(第二册)[M]. 上海:上海科技出版社, 1991:42. [Jiangsu Institute of Botany. Xinhua Compendium of Materia Medica (Volume 2)[M]. Shanghai:Shanghai Science and Technology Press, 1991:42.] Jiangsu Institute of Botany. Xinhua Compendium of Materia Medica (Volume 2)[M]. Shanghai: Shanghai Science and Technology Press, 1991: 42.
[3] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社, 1995:21. [Editorial Committee of Chinese Flora, Chinese Academy of Sciences. Flora of China[M]. Beijing:Science Press, 1995:21.] Editorial Committee of Chinese Flora, Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1995: 21.
[4] BHUSAL K K, MAGAR S K, THAPA R, et al. Nutritional and pharmacological importance of stinging nettle (Urtica dioica L.):A review[J]. Heliyon,2022,8(6):e09717. doi: 10.1016/j.heliyon.2022.e09717
[5] DE VICO G, GUIDA V, CARELLA F. Urtica dioica (stinging nettle):A neglected plant with emerging growth promoter/immunostimulant properties for farmed fish[J]. Frontiers in Physiology,2018,9:285. doi: 10.3389/fphys.2018.00285
[6] SHAMSI M, GANJI A, MOSAYEBI G, et al. Chamomile and Urtica dioica extracts improve immunological and histological alterations associated with polycystic ovarian syndrome in DHEA-induced mice[J]. BMC Complementary Medicine and Therapies,2023,23(1):102. doi: 10.1186/s12906-023-03936-7
[7] TARASEVIČIENĖ Ž, VITKAUSKAITĖ M, PAULAUSKIENĖ A, et al. Wild stinging nettle (Urtica dioica L.) leaves and roots chemical composition and phenols extraction[J]. Plants (Basel),2023,12(2):309. doi: 10.3390/plants12020309
[8] DEVKOTA H P, PAUDEL K R, KHANAL S, et al. Stinging nettle (Urtica dioica L.):Nutritional composition, bioactive compounds, and food functional properties[J]. Molecules,2022,27(16):5219. doi: 10.3390/molecules27165219
[9] TAHERI Y, QUISPE C, HERRERA-BRAVO J, et al. Urtica dioica-derived phytochemicals for pharmacological and therapeutic applications[J]. Evidence-Based Complementary and Alternative Medicine,2022,2022:4024331.
[10] CEGLEDI E, REPAJIĆ M, BALBINO S, et al. Sterols and pentacyclic triterpenoids from nettle root:Content and composition as affected by pressurized liquid extraction[J]. Journal of the Science of Food and Agriculture,2023,103(8):4058−4067. doi: 10.1002/jsfa.12373
[11] SUDEEP H V, GOUTHAMCHANDRA K, RAMANAIAH I, et al. A standardized extract of echinacea purpurea containing higher chicoric acid content enhances immune function in murine macrophages and cyclophosphamide-induced immunosuppression mice[J]. Pharmaceutical Biology,2023,61(1):1211−1221. doi: 10.1080/13880209.2023.2244000
[12] SHAN J, MA W, GUO Y, et al. Unveiling the immunomodulatory mechanism of polysaccharides from Polygonum cyrtonema based on RNA-seq[J]. Food Research International,2024,175:113755. doi: 10.1016/j.foodres.2023.113755
[13] CHEN D, LI J, GAO Q, et al. Structural characterization of polysaccharide fractions in areca (Areca catechu L.) inflorescence and study of its immunological enhancement activity in vitro and in vivo[J]. Food Research International,2023,171:113006. doi: 10.1016/j.foodres.2023.113006
[14] YANG G, YANG Y, LIU Y, et al. Regulation of alveolar macrophage death in pulmonary fibrosis:A review[J]. Apoptosis,2023,28(11-12):1505−1519. doi: 10.1007/s10495-023-01888-4
[15] YUNNA C, MENGRU H, LEI W, et al. Macrophage M1/M2 polarization[J]. European Journal of Pharmacology,2020,877:173090. doi: 10.1016/j.ejphar.2020.173090
[16] 马晓颖, 肖军, 龚娜, 等. 基于LPS炎症模型探究鲍姆纤孔菌(Sanghuangporus baumi)菌丝多糖对巨噬细胞RAW264.7的免疫调节作用[J]. 食品工业科技,2023,44(20):407−413. [MA X Y, XIAO J, GONG N, et al. The immunomodulatory effect of polysaccharide extracted from Sanghuangporus baumi mycelia in LPS-induced RAW264.7 macrophages[J]. Science and Technology of Food Industry,2023,44(20):407−413.] MA X Y, XIAO J, GONG N, et al. The immunomodulatory effect of polysaccharide extracted from Sanghuangporus baumi mycelia in LPS-induced RAW264.7 macrophages[J]. Science and Technology of Food Industry, 2023, 44(20): 407−413.
[17] HUANG M Y, CHEN Y C, LYU W Y, et al. Ginsenoside Rh2 augmented anti-PD-L1 immunotherapy by reinvigorating CD8 T cells via increasing intratumoral CXCL10[J]. Pharmacological Research,2023,198:106988. doi: 10.1016/j.phrs.2023.106988
[18] PIFFERI C, FUENTES R, FERNÁNDEZ-TEJADA A. Natural and synthetic carbohydrate-based vaccine adjuvants and their mechanisms of action[J]. Nature Reviews. Chemistry,2021,5(3):197−216. doi: 10.1038/s41570-020-00244-3
[19] HULBERT S W, DESAI P, JEWETT M C, et al. Glycovaccinology:The design and engineering of carbohydrate-based vaccine components[J]. Biotechnology Advances,2023,68:108234. doi: 10.1016/j.biotechadv.2023.108234
[20] FU H, DENG C, TENG L, et al. Immunomodulatory activities on RAW 264.7 macrophages of a polysaccharide from veiled lady mushroom, Dictyophora indusiata (Higher Basidiomycetes)[J]. International Journal of Medicinal Mushrooms,2015,17(2):151−160. doi: 10.1615/IntJMedMushrooms.v17.i2.60
[21] ZOU X, SHEN M, LI J, et al. Isolation, structure characterization and in vitro immune-enhancing activity of a glucan from the peels of stem lettuce (Lactuca sativa)[J]. Journal of the Science of Food and Agriculture,2024,104(4):2097−2109. doi: 10.1002/jsfa.13166
[22] LI M, JIANG P, YANG Y, et al. The role of pyroptosis and gasdermin family in tumor progression and immune microenvironment[J]. Experimental Hematology & Oncology,2023,12(1):103.
[23] NA Y R, KIM S W, SEOK S H. A new era of macrophage-based cell therapy[J]. Experimental & Molecular Medicine,2023,55(9):1945−1954.
[24] ORECCHIONI M, GHOSHEH Y, PRAMOD A B, et al. Macrophage polarization:Different gene signatures in M1(LPS+) vs. classically and M2(LPS-) vs. alternatively activated macrophages[J]. Frontiers in Immunology,2019,10:1084. doi: 10.3389/fimmu.2019.01084
[25] WANG L X, ZHANG S X, WU H J, et al. M2b macrophage polarization and its roles in diseases[J]. Journal of Leukocyte Biology,2019,106(2):345−358. doi: 10.1002/JLB.3RU1018-378RR
[26] CHEN S, LAI S W T, BROWN C E, et al. Harnessing and enhancing macrophage phagocytosis for cancer therapy[J]. Frontiers in Immunology,2021,12:635173. doi: 10.3389/fimmu.2021.635173
[27] XU S, FENG Z, ZHANG Y, et al. pH-Responsive Astragalus polysaccharide-loaded PLGA nanoparticles as an adjuvant system to improve immune responses[J]. Journal of Leukocyte Biology,2022,222(Pt B):1936−1947.
[28] SHAPOURI-MOGHADDAM A, MOHAMMADIAN S, VAZINI H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. Journal of Cellular Physiology,2018,233(9):6425−6440. doi: 10.1002/jcp.26429
[29] CINELLI M A, DO H T, MILEY G P, et al. Inducible nitric oxide synthase:Regulation, structure, and inhibition[J]. Medicinal Research Reviews,2020,40(1):158−189. doi: 10.1002/med.21599
[30] VAN LOO G, BERTRAND M J M. Death by TNF:A road to inflammation[J]. Nature Reviews. Immunology,2023,23(5):289−303. doi: 10.1038/s41577-022-00792-3





 下载:
下载:
 下载:
下载:



