Effects of Ultrasound Pretreatment on Sodium Caseinate-EGCG Interactions and the Antioxidant Activity of Their Complexes
-
摘要: 采用荧光分光光度计、紫外分光光度计等研究了超声预处理对酪蛋白酸钠-表没食子儿茶素没食子酸酯((-)-epigallocatechin-3-gallate,EGCG)相互作用及其复合物抗氧化活性的影响,并从蛋白质结构变化上探究了其作用机理。结果表明:EGCG对酪蛋白酸钠内源荧光的淬灭形式为静态淬灭。超声预处理后酪蛋白酸钠同EGCG之间的结合常数由9.51×103 L·(mol/L)−1提高至7.48×104 L·(mol/L)−1,结合位点数由0.871提高至1.067,分别提高了7.87倍和22.50%,说明二者结合能力增强。同酪蛋白酸钠相比,超声预处理酪蛋白酸钠无规卷曲含量增加,内源荧光强度和表面疏水性指数增强,结构的改变促进了其同EGCG的结合。酪蛋白酸钠-EGCG复合物的形成可以抑制EGCG的降解、提高其抗氧化稳定性,而超声预处理能增强复合物的这一作用。
-
关键词:
- 酪蛋白酸钠 /
- 表没食子儿茶素没食子酸酯 /
- 超声 /
- 相互作用 /
- 抗氧化活性
Abstract: The interaction between sodium caseinate and (-)-epigallocatechin-3-gallate (EGCG) and the antioxidant activity of their complexes as influenced by ultrasound pretreatment were studied by a fluorescence spectrophotometer and an ultraviolet spectrophotometer, and its mechanism was also investigated base on the changes in protein structure. The results showed that the quenching of the endogenous fluorescence of sodium casein induced by EGCG was a static nature. With ultrasound pretreatment, the apparent binding constant between sodium caseinate and EGCG increased from 9.51×103 L·(mol/L)−1 to 7.48×104 L·(mol/L)−1 and the number of binding sites between sodium caseinate and EGCG increased from 0.871 to 1.067, indicating an increase of 7.87 times and 22.50%, respectively. The results revealed that ultrasound pretreatment could enhance the binding capacity of sodium caseinate for EGCG. Compared with sodium caseinate, ultrasound pretreated sodium caseinate showed higher random coil content, fluorescence intensity and surface hydrophobicity. These ultrasound-induced conformational changes promoted the binding between sodium casein and EGCG. Complexing with sodium caseinate could inhibit the degradation of EGCG and improve its antioxidant stability, and better protection was obtained by complexing EGCG with ultrasound pretreated sodium caseinate.-
Keywords:
- sodium caseinate /
- (-)-epigallocatechin-3-gallate /
- ultrasound /
- interaction /
- antioxidant activity
-
表没食子儿茶素没食子酸酯((-)-epigallocatechin-3-gallate,EGCG)是绿茶中的主要儿茶素,不仅具有广泛的抗菌活性[1],还是一种优良的抗氧化剂,其清除烷基过氧自由基的能力比L-抗坏血酸和β-胡萝卜素高一个数量级[2]。此外,大量研究发现EGCG对预防癌症[3]、心血管疾病[4]、阿尔茨海默病[5]、神经退行性疾病[6]、肥胖[7]、非酒精性脂肪肝[8]等均具有显著作用。因此,EGCG在食品和医药领域的应用潜力巨大。因其具有多种生物活性,EGCG不仅可以作为抗氧化剂和抗菌剂应用于食品中,以抑制脂质氧化并延长食品保质期,还可以作为功能性配料用于开发功能食品,为消费者的健康提供益处[9]。
EGCG虽然具有多种生理活性,但对pH、温度、氧浓度、光或金属离子等环境因素敏感[10]。水体系中的EGCG在pH小于4时非常稳定,而当pH大于6时非常不稳定[11]。Fe2+等金属离子能直接导致EGCG氧化或催化溶解氧对EGCG的氧化作用[12],而溶解氧浓度或温度升高、光照等因素也会加速EGCG的降解[13]。EGCG的氧化和聚合产物会导致原本无色的水溶液转变为黄棕色,从而对一些食品体系色泽产生不利影响[14]。此外,由于EGCG的稳定性和肠道吸收较差,其口服生物利用度低[15]。这些理化和生物学性质极大地限制了EGCG在食品中的应用。因此,采取有效措施克服EGCG的这些局限是推动其应用的关键。
采用食品递送体系对EGCG进行包埋或负载,是改善其稳定性和生物利用度的一种有效途径[16]。近年来,基于蛋白质-多酚非共价复合物的递送体系因其制作简单、效果好而受到广泛关注。据报道,将食物蛋白同EGCG结合可以显著提高其稳定性、生物可及性以及抗肿瘤活性[17]。蛋白质结构是影响其与多酚相互作用的重要因素,结构变化可能导致亲和力改变。研究发现,加热[14]、pH偏移[18]和超声[19]处理可以通过改变乳清蛋白结构来提高其同EGCG的结合能力,进而增强对EGCG的保护作用。酪蛋白无规卷曲含量达30%~35%,且脯氨酸含量高,是EGCG的优良载体材料[20]。但由于酪蛋白水溶性较差,实际食品生产中常使用水溶性更好的酪蛋白酸钠。作为一种经济、安全和生态友好的技术,超声是蛋白质改性常用的方法之一[21]。然而,超声预处理对酪蛋白酸钠和EGCG相互作用的影响仍未见报道。因此,本实验研究了超声预处理对酪蛋白酸钠与EGCG的结合能力和所形成复合物抗氧化活性的影响,并对其机理进行了探索。
1. 材料与方法
1.1 材料与仪器
酪蛋白酸钠(BR级)、2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ) 阿拉丁试剂有限公司;EGCG(90%) 上海源叶生物技术有限公司;2,2-二苯基-1-苦基肼基(DPPH)、8-苯胺基-1-萘磺酸(ANS) Sigma-Aldrich公司;甲醇(色谱级) Tedia公司;其他化学试剂(分析纯) 国药集团上海化学试剂有限公司。
JY92-IIDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;DC-1006低温恒温槽 宁波赛福实验仪器有限公司;J1500圆二色谱仪 日本JASCO公司;Cary Eclipse荧光分光光度计 美国瓦里安公司;UV-2550紫外可见分光光度计 日本岛津公司;e2695高效液相色谱 美国Waters公司。
1.2 实验方法
1.2.1 超声预处理
将酪蛋白酸钠溶于pH6.5的磷酸盐缓冲液(phosphate buffered saline,PBS,0.01 mol/L)中,搅拌2 h后制备得到浓度为10 mg/mL的溶液。将该溶液预热至60 ℃后,在超声功率200 W条件下处理30 min(预实验优化结果),然后迅速冷却至室温。采用的变幅杆直径为10 mm,占空比设置为50%。
1.2.2 荧光淬灭分析
以PBS(0.01 mol/L,pH6.5)将超声预处理和未处理的酪蛋白酸钠溶液稀释至0.2 mg/mL,然后与不同浓度的EGCG溶液(现配现用)等体积混合,混合液中EGCG浓度分别为0、2.5、5、7.5、10、15、20 μmol/L。采用荧光分光光度计获得混合液在280 nm激发波长下300~500 nm范围内的发射光谱。参考文献[22]的方法分析酪蛋白酸钠-EGCG之间的淬灭类型、结合位点数和结合常数。
1.2.3 超声预处理对酪蛋白酸钠结构的影响
1.2.3.1 圆二色谱分析
以PBS(0.01 mol/L,pH6.5)将超声预处理和未处理的酪蛋白酸钠溶液稀释至0.25 mg/mL,然后采用文献[18]所述方法测定分析样品的α-螺旋、β-折叠、β-转角和无规卷曲含量。
1.2.3.2 内源荧光光谱分析
以PBS(0.01 mol/L,pH6.5)将超声预处理和未处理的酪蛋白酸钠溶液稀释至0.2 mg/mL,然后采用荧光分光光度计测定样品在280 nm激发波长下300~500 nm范围内的发射光谱。
1.2.3.3 表面疏水性分析
以PBS(0.01 mol/L,pH 6.5)将超声预处理和未处理的酪蛋白酸钠溶液稀释至0.005、0.01、0.05、0.1、0.5 mg/mL。然后采用文献[23]所述ANS荧光探针法测定其表面疏水性指数。
1.2.4 酪蛋白酸钠-EGCG复合物的制备
将超声预处理和未处理的酪蛋白酸钠溶液(10 mg/mL)分别同EGCG溶液(0.5 mg/mL,现配现用)等体积混合,室温下搅拌均匀即为酪蛋白酸钠-EGCG复合物溶液。
1.2.5 复合物抗氧化活性测定
向EGCG溶液(0.25 mg/mL,现配现用)、酪蛋白酸钠溶液(5 mg/mL)、超声预处理酪蛋白酸钠溶液(5 mg/mL)、复合物溶液(蛋白质浓度5 mg/mL,EGCG浓度0.25 mg/mL)中加入0.02%叠氮化钠,然后在室温下放置7 d,每天取样分析其抗氧化活性。
DPPH自由基清除活性测定:以无水乙醇配制0.2 mol/L的DPPH溶液,取4.9 mL同0.1 mL样品溶液混合,室温下避光反应0.5 h,测定反应液在517 nm处的吸光值(A)。以0.1 mL PBS同4.9 mL DPPH溶液的混合液作为空白,测定其在517 nm处的吸光值(Ac)。按下式计算其DPPH自由基清除率(%):
清除率(%)=(1−AAc)×100 (1) 三价铁还原能力(FRAP)测定:将0.1 mL样品溶液同4.9 mL TPTZ工作液(现配现用,配制方法参考文献[23])混合后于37 ℃下振荡反应10 min,然后测定反应液在593 nm下的吸光度。
1.2.6 EGCG稳定性分析
向EGCG溶液(0.25 mg/mL)和复合物溶液(蛋白浓度5 mg/mL,EGCG浓度0.25 mg/mL)中加入0.02% 叠氮化钠,然后在室温下放置7 d,每天取样分析EGCG含量变化。样品溶液以无水乙醇稀释10倍,14000 r/min离心10 min,上清液过0.22 μm滤膜后采用文献[17]所述高效液相色谱法分析EGCG含量。
1.3 数据处理
所有处理均设置3组平行,采用SPSS软件以Duncan法进行显著性分析,显著水平为P<0.05。采用Origin 2018软件绘图。
2. 结果与分析
2.1 超声预处理对酪蛋白酸钠-EGCG相互作用的影响
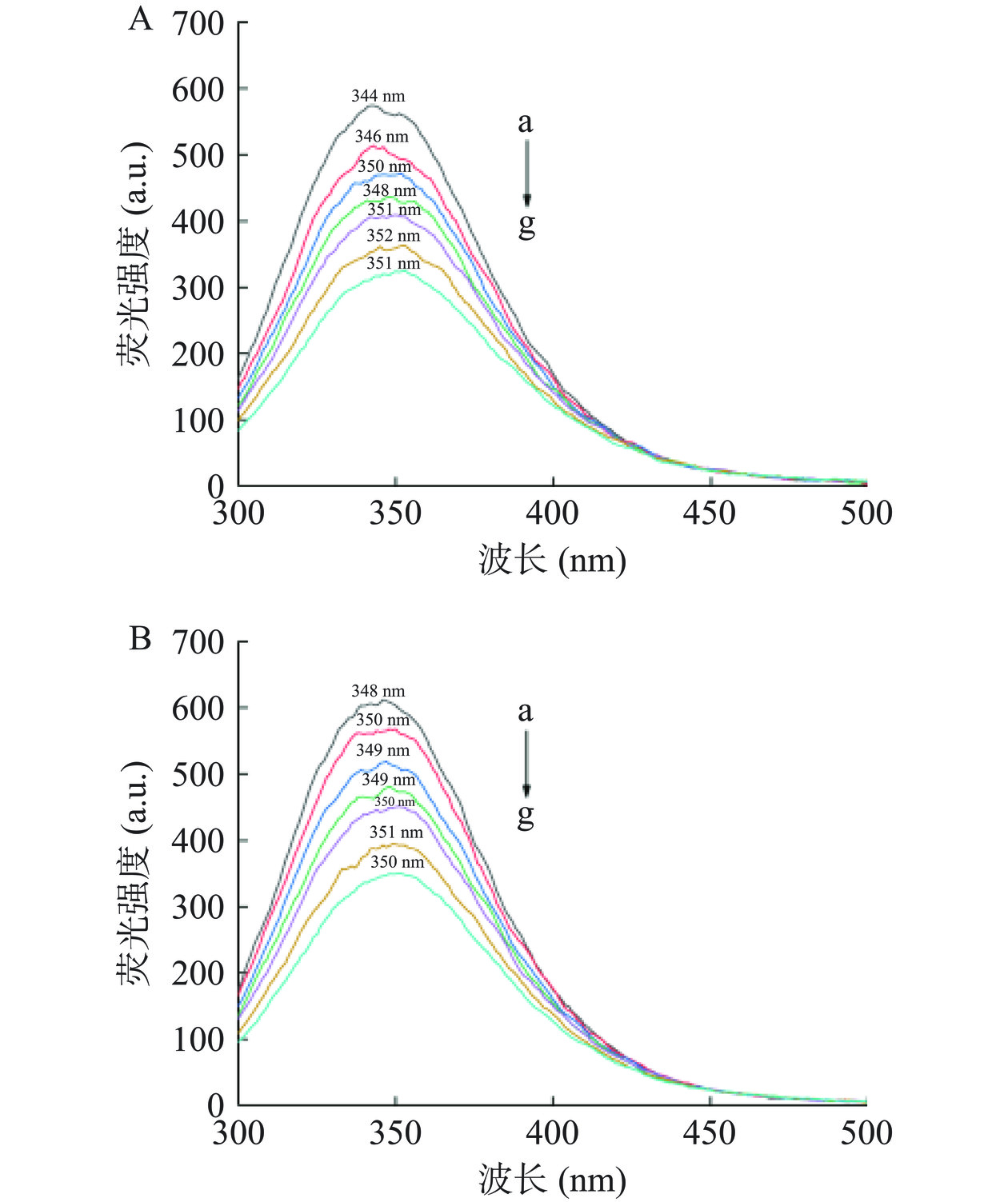
如图1所示,随着EGCG添加浓度的增加,酪蛋白酸钠和超声预处理酪蛋白酸钠的荧光强度均逐渐降低,说明二者之间发生了相互作用,对蛋白质的内源荧光产生了淬灭效应。这可能是因为EGCG的芳香环同蛋白质的酪氨酸残基结合所致[22]。从图1还可以看到,EGCG的添加使得酪蛋白酸钠和超声预处理酪蛋白酸钠的最大发射波长均发生了一定程度的红移,说明EGCG同荧光基团残基之间的相互作用使后者微环境的极性增加[22]。
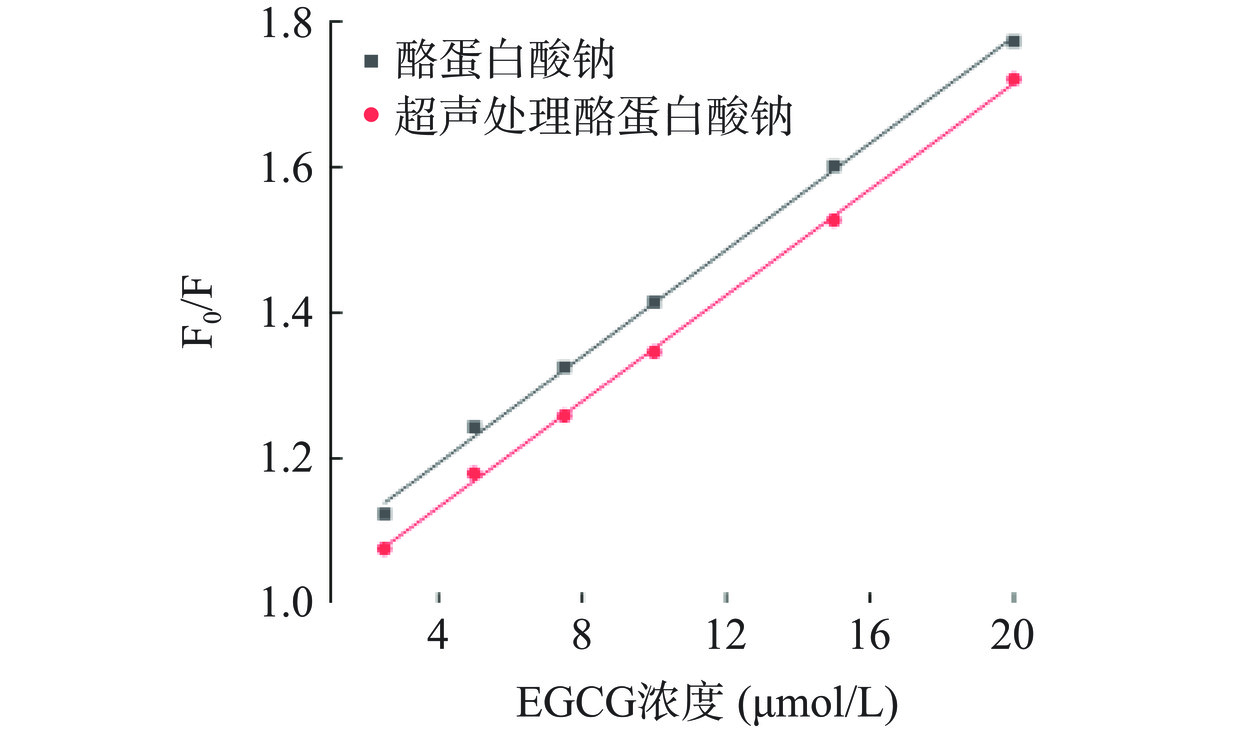
多酚对蛋白质内源荧光的淬灭作用既能通过形成配合物(静态猝灭)导致,也能通过发生碰撞(动态猝灭)来实现。采用Stern-Volmer方程(F0/F=1+Kq×τ0×[Q]=1+Ksv×[Q],F0和F为不添加和添加淬灭剂时的最大荧光强度;[Q]为淬灭剂浓度(μmol/L);Kq为荧光猝灭速率常数;τ0为没有猝灭剂时物质的荧光平均寿命(一般为10−8 s);Ksv为Stern-Volmer猝灭常数)分析其淬灭类型,所得拟合曲线及淬灭常数分别如图2和表1所示。两条曲线的决定系数R2分别为0.998和0.999,拟合度较好。对于酪蛋白酸钠和超声预处理酪蛋白酸钠,其荧光猝灭速率常数分别为3.64×1012和3.66×1012 L·(mol/L)−1·s−1,均大于最大动态猝灭速率常数(2×1010 L·(mol/L)−1·s−1),说明EGCG是以静态淬灭的方式对酪蛋白酸钠内源荧光产生淬灭作用[22],而超声预处理不会改变其淬灭方式。
表 1 EGCG对不同样品的淬灭速率常数和决定系数Table 1. Quenching rate constants and determination coefficients of EGCG for different samples样品 Stern-Volmer猝灭常数
(L·(mol/L)−1·s−1)荧光猝灭速率常数
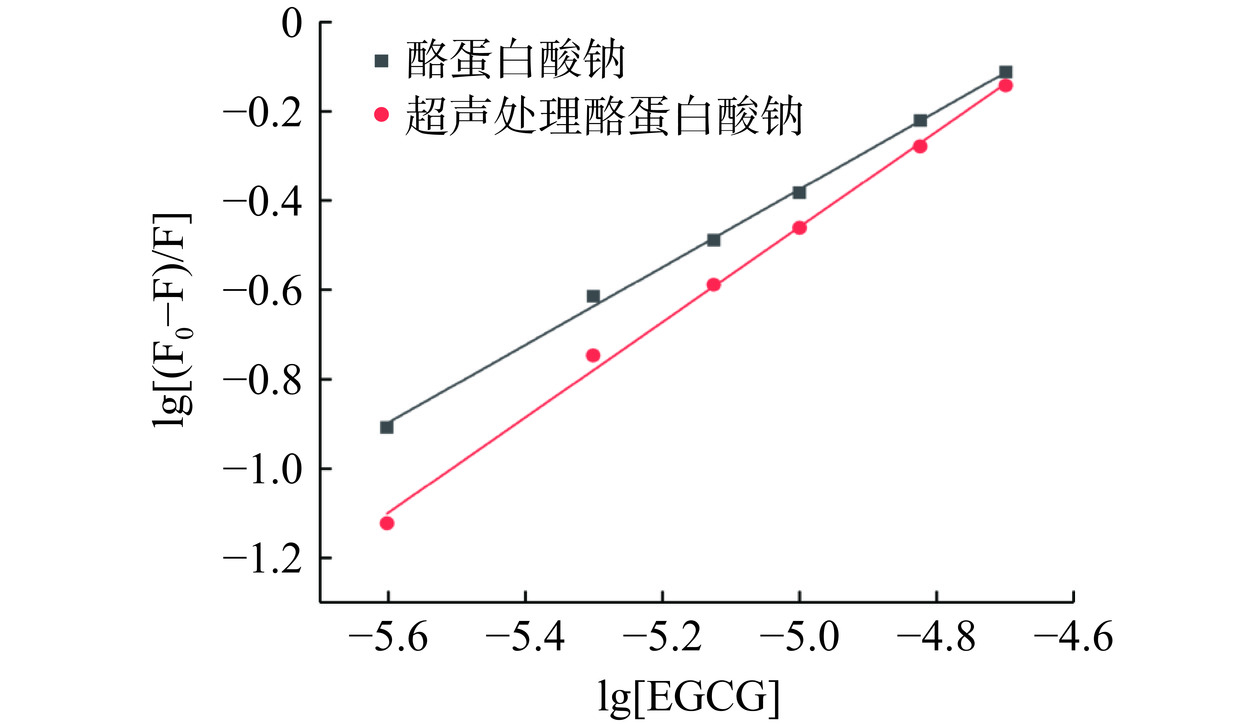
(L·(mol/L)−1·s−1)R2 酪蛋白酸钠 3.64×104 3.64×1012 0.998 超声处理酪蛋白酸钠 3.66×104 3.66×1012 0.999 根据双对数曲线方程(lg[(F0−F)/F]=nlg[Q]+lgKa)来计算静态猝灭的结合常数(Ka)和结合位点数(n),所得拟合曲线和结果如图3和表2所示。两条曲线的决定系数R2分别为0.998和0.997,线性拟合度高。超声预处理后,EGCG同酪蛋白酸钠的结合常数由9.51×103 L·(mol/L)−1提高至7.48×104 L·(mol/L)−1,结合位点数由0.871提高至1.067,分别提高了7.87倍和22.50%。说明超声预处理可以提高酪蛋白酸钠同EGCG之间的结合能力。Zhang等[24]研究也发现超声处理能够增强牛血清白蛋白对表儿茶素没食子酸酯的结合力,而Chen等[19]研究也证实超声处理后,乳清分离蛋白同EGCG之间的结合常数和结合位点数均显著提高。
表 2 EGCG对不同样品的表观结合常数(Ka)和结合位点数(n)Table 2. Apparent binding constant (Ka) and the number of binding sites (n) of EGCG for different samples样品 Ka (L·(mol/L)−1) n R2 酪蛋白酸钠 9.51×103 0.871 0.998 超声处理酪蛋白酸钠 7.48×104 1.067 0.997 2.2 超声预处理强化酪蛋白酸钠-EGCG相互作用的机理分析
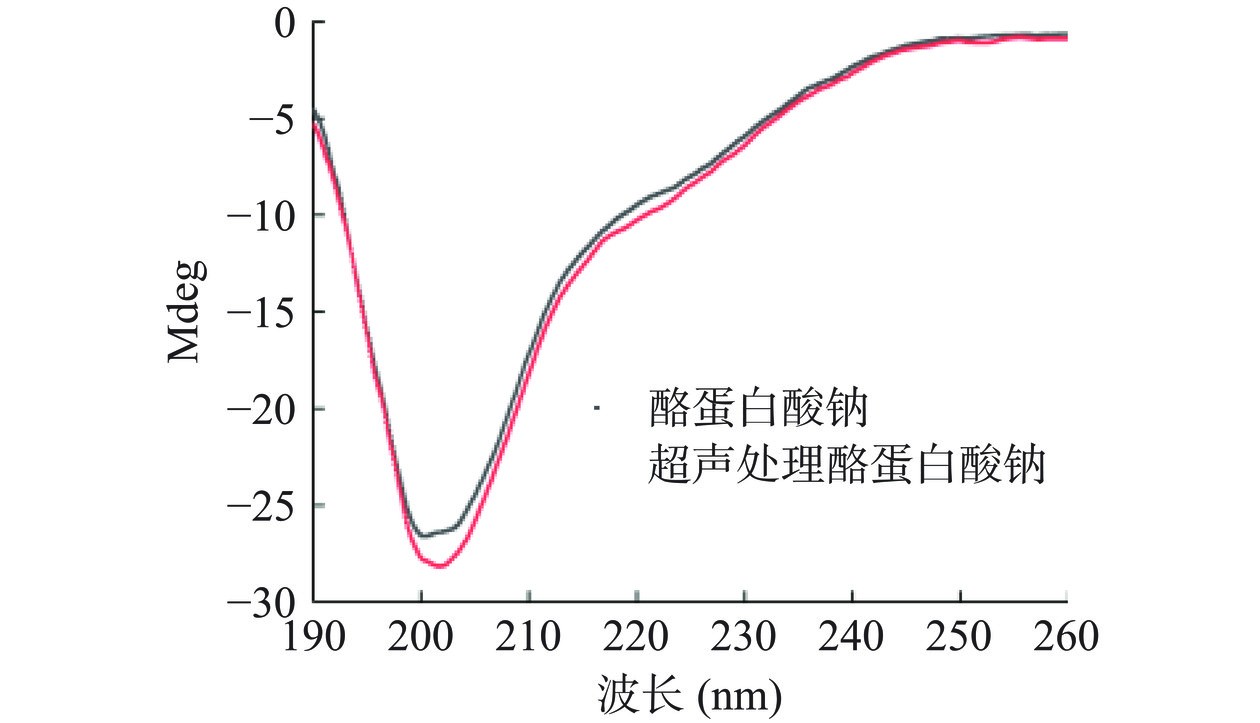
蛋白质结构是影响其同多酚相互作用的主要因素之一,相对疏水、具有开放构象和柔性结构的蛋白质,同多酚之间具有较强的结合[25]。为了揭示超声预处理强化酪蛋白酸钠-EGCG相互作用的机理,本实验分析了超声预处理对酪蛋白酸钠二级结构、三级结构和表面疏水性的影响。由图4可知,超声预处理后酪蛋白酸钠圆二色谱图负吸收峰明显降低,说明其二级结构发生了改变。采用Dichroweb在线数据库分析二级结构组成,发现超声预处理后酪蛋白酸钠的α-螺旋和β-转角含量分别降低了6.00%和2.77%,而无规卷曲含量增加了4.94%。说明酪蛋白酸钠分子刚性结构减弱,柔性结构增加[26]。据报道,蛋白质的柔性开放结构(存在于蛋白质的无规卷曲中)在其同EGCG的结合过程中发挥了重要作用[20]。因此,超声预处理后酪蛋白酸钠二级结构中无规卷曲含量增加,蛋白分子柔性结构增加、无序程度增强,有利于其同EGCG的结合。
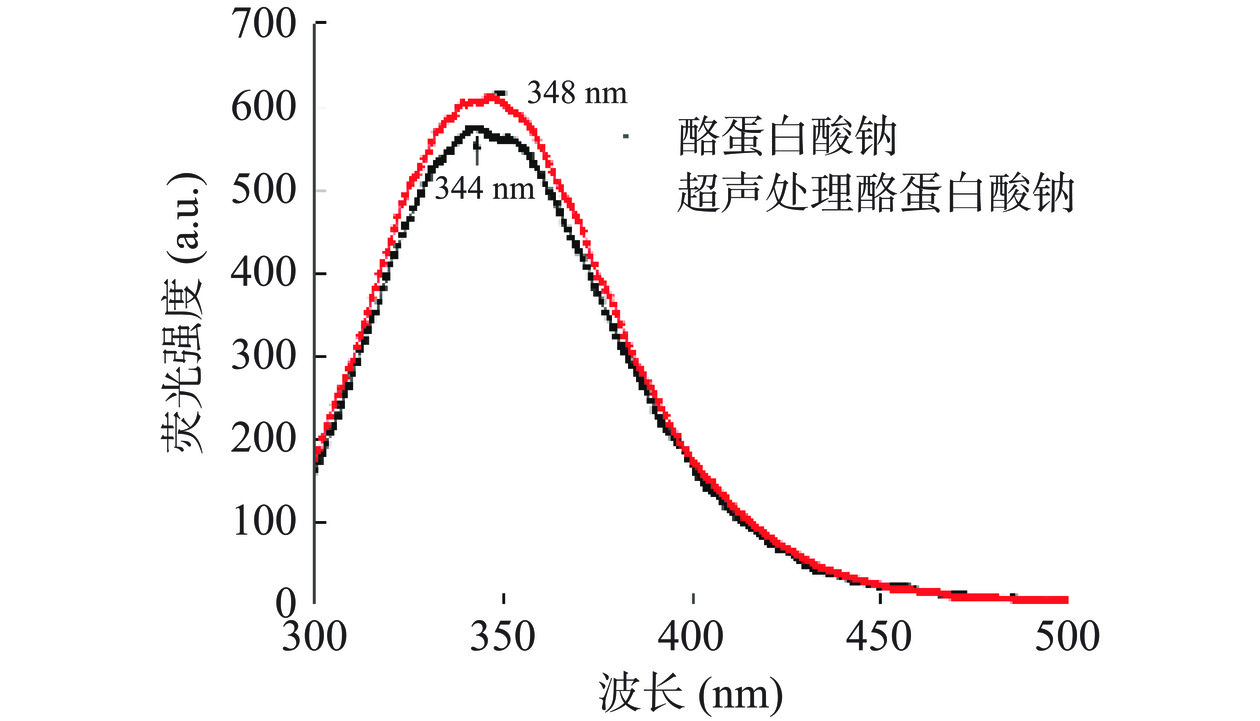
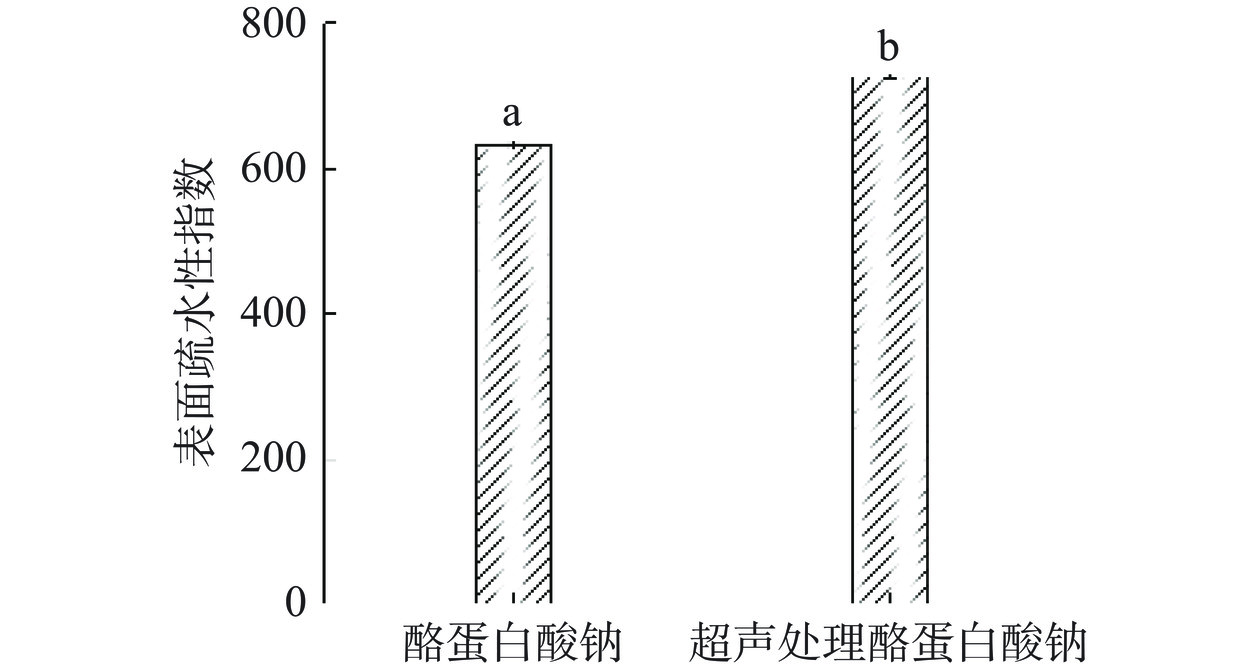
超声预处理对酪蛋白酸钠内源荧光光谱的影响如图5所示。相较于酪蛋白酸钠,超声预处理酪蛋白酸钠的荧光强度明显增强,且最大发射波长发生了4 nm的红移。说明超声预处理后,部分蛋白质分子内部的荧光基团暴露至表面,且荧光基团微环境极性增强[27]。这可能是因为超声处理破坏了部分蛋白质分子内部的疏水相互作用,导致蛋白质分子折叠展开所致[28]。超声预处理后酪蛋白酸钠表面疏水性的变化也证实了该推测。由图6可知,超声预处理后酪蛋白酸钠的表面疏水性指数由631.89显著(P<0.05)提高至726.31,说明有更多的疏水基团暴露至分子表面。Yildirim-Elikoglu等[29]指出,氢键和疏水相互作用是蛋白质和多酚之间的主要结合作用。因此,超声预处理后酪蛋白酸钠分子表面暴露有更多的疏水基团,不仅能增强其同EGCG的疏水相互作用,还有利于二者间氢键的形成[30],进而增强二者之间的结合。
蛋白质的大小、构象、二级结构、三级结构和氨基酸组成等特征是影响其同多酚结合的重要因素。据报道,碱性残基和脯氨酸含量较高、相对疏水、具有开放构象和柔性结构的蛋白质,同多酚之间具有较强的结合[25]。因此,超声预处理主要通过改变酪蛋白酸钠分子结构,使其柔性结构和表面疏水性增加,进而增强其同EGCG的相互作用。
2.3 超声预处理对酪蛋白酸钠-EGCG复合物抗氧化活性的影响
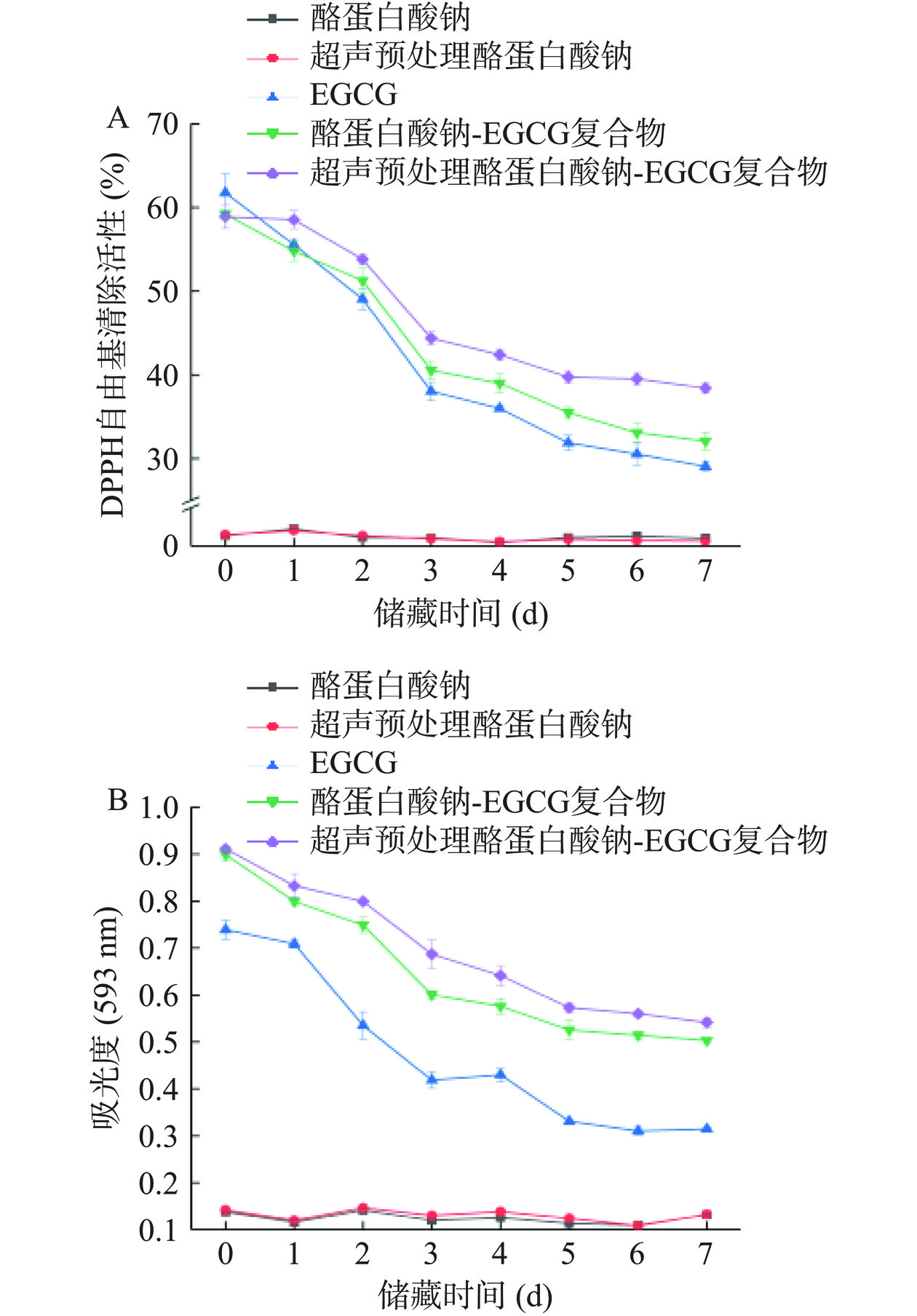
室温下储藏7 d过程中,酪蛋白酸钠、超声预处理酪蛋白酸钠、EGCG、酪蛋白酸钠-EGCG复合物和超声预处理酪蛋白酸钠-EGCG复合物的抗氧化活性变化如图7所示。从图中可以看到,酪蛋白酸钠的抗氧化活性很低,而超声预处理对其抗氧化活性没有明显影响。EGCG同酪蛋白酸钠形成复合物后,赋予其良好的抗氧化活性。由于EGCG的降解,EGCG溶液的抗氧化活性随着储藏时间的延长而快速降低。相较于EGCG溶液,复合物溶液抗氧化活性的下降速率明显变缓。该结果同相关文献报道[13]一致,说明蛋白质同多酚形成复合物后可以对后者的抗氧化活性提供保护作用。
从图7还可以看到,超声预处理酪蛋白酸钠-EGCG复合物抗氧化活性的降低速率要低于酪蛋白酸钠- EGCG复合物抗氧化活性的降低速率。储藏7 d后,酪蛋白酸钠-EGCG复合物的DPPH自由基清除活性和三价铁还原能力分别降低了45.78%±1.19%和44.01%±0.67%,而超声预处理酪蛋白酸钠-EGCG复合物仅降低了34.75%±0.74%和40.59%±1.05%。这可能是因为超声预处理后的蛋白质同EGCG的结合能力增强(2.1已证实)。据报道,采用热[14]、pH偏移[18]和超声[19]等方式改性蛋白质,均能赋予蛋白-EGCG复合物更好的抗氧化活性稳定性。
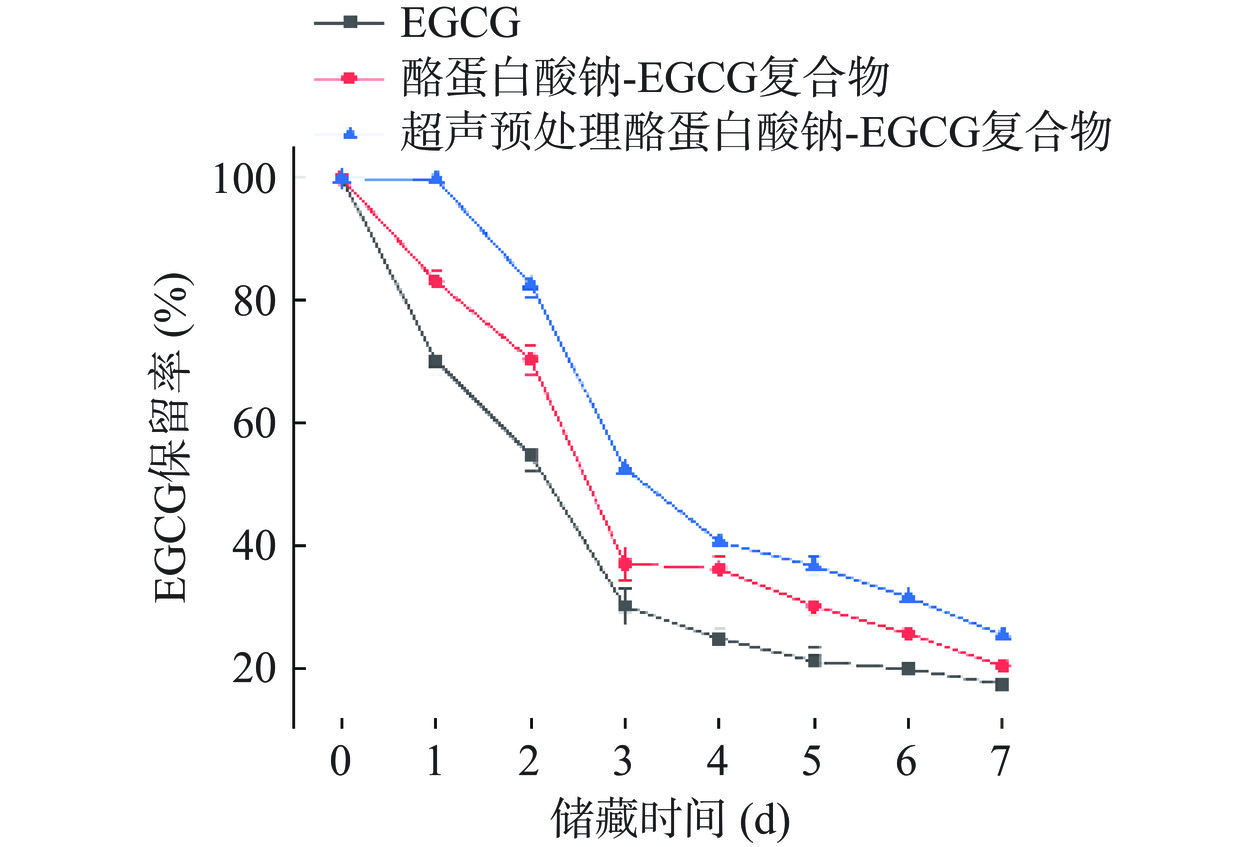
复合物的抗氧化活性主要源于EGCG,因此本研究进一步分析了储藏期间样品中EGCG含量的变化。如图8所示,EGCG在纯溶液中降解很快,7 d后保留率仅为17.41%±0.18%。相较于纯溶液,复合物溶液中EGCG的降解速率明显较低。该结果同抗氧化活性变化趋势一致。储藏7 d后,酪蛋白酸钠-EGCG复合物和超声预处理酪蛋白酸钠-EGCG复合物溶液中EGCG的保留率分别为20.40%±1.16%和25.45%±0.14%。说明超声预处理可以增强复合物对EGCG的保护作用。这可能是因为超声预处理酪蛋白酸钠能够结合更多的EGCG分子,进而对其产生更好的保护作用[21]。
3. 结论
本实验系统研究了超声预处理对酪蛋白酸钠-EGCG相互作用及其复合物抗氧化活性的影响,并对其机理进行了探索。结果表明超声预处理能增强酪蛋白酸钠同EGCG之间的相互作用。超声预处理使酪蛋白酸钠二级结构中α-螺旋降低、无规卷曲含量增加,内源荧光强度和表面疏水性指数增强,导致其分子柔性结构和表面疏水基团增加,从而增强其同EGCG的相互作用。酪蛋白酸钠同EGCG形成复合物后,可以对后者产生保护作用,抑制储藏过程中EGCG抗氧化活性的降低。而超声预处理后,酪蛋白酸钠同EGCG的结合能力更强,该作用进一步增强。本研究可为超声波在酪蛋白酸钠基EGCG及其他多酚传递体系的设计和强化提供新思路。
-
表 1 EGCG对不同样品的淬灭速率常数和决定系数
Table 1 Quenching rate constants and determination coefficients of EGCG for different samples
样品 Stern-Volmer猝灭常数
(L·(mol/L)−1·s−1)荧光猝灭速率常数
(L·(mol/L)−1·s−1)R2 酪蛋白酸钠 3.64×104 3.64×1012 0.998 超声处理酪蛋白酸钠 3.66×104 3.66×1012 0.999 表 2 EGCG对不同样品的表观结合常数(Ka)和结合位点数(n)
Table 2 Apparent binding constant (Ka) and the number of binding sites (n) of EGCG for different samples
样品 Ka (L·(mol/L)−1) n R2 酪蛋白酸钠 9.51×103 0.871 0.998 超声处理酪蛋白酸钠 7.48×104 1.067 0.997 -
[1] 季天晨. 生物基原料与EGCG接枝共聚物的合成及性能研究[D]. 无锡:江南大学, 2022. [JI T C. Study on the synthesis and properties of EGCG grafted Bio-based raw materials[D]. Wuxi:Jiangnan University, 2022.] JI T C. Study on the synthesis and properties of EGCG grafted Bio-based raw materials[D]. Wuxi: Jiangnan University, 2022.
[2] NAKAO M, TAKIO S, ONO K. Alkyl peroxyl radical-scavenging activity of catechins[J]. Phytochemistry,1998,49(8):2379−2382. doi: 10.1016/S0031-9422(98)00333-1
[3] GAN R Y, LI H B, SUI Z Q, et al. Absorption, metabolism, anti-cancer effect and molecular targets of epigallocatechin gallate(EGCG):An updated review[J]. Critical Reviews in Food Science and Nutrition,2018,58(6):924−941. doi: 10.1080/10408398.2016.1231168
[4] KON M, ISHIKAWA T, OHASHI Y, et al. Epigallocatechin gallate stimulated histamine production and downregulated histamine H1 receptor in oral cancer cell lines expressing histidine decarboxylase[J]. Journal of Oral Biosciences,2022,64(1):120−130. doi: 10.1016/j.job.2022.01.003
[5] FANG M, ZHANG Q, WANG X, et al. Inhibition mechanisms of (-)-epigallocatechin-3-gallate and genistein on amyloid-beta 42 peptide of alzheimer's disease via molecular simulations[J]. ACS Omega,2022,7(23):19665−19675. doi: 10.1021/acsomega.2c01412
[6] RAPOSO D, MORGADO C, PEREIRA-TERRA P, et al. Nociceptive spinal cord neurons laminae I-III exhibit oxidative stress damage during diabetic neuropathy which is prevented by early antioxidant treatment with epigallocatechin-gallate (EGCG)[J]. Brain Research Bulletin,2015,110:68−75. doi: 10.1016/j.brainresbull.2014.12.004
[7] ZHU M, ZHOU F, OUYANG J, et al. Combined use of epigallocatechin-3-gallate (EGCG) and caffeine in low doses exhibits marked anti-obesity synergy through regulation of gut microbiota and bile acid metabolism[J]. Food & Function,2021,12:4105−4116.
[8] CHEN C, LIU Q, LIU L, et al. Potential biological effects of (-)-epigallocatechin-3-gallate on the treatment of nonalcoholic fatty liver disease[J]. Molecular Nutrition & Food Research,2018,62(1):1700483.
[9] NIKOO M, REGENSTEIN J M, GAVLIGHI H A. Antioxidant and antimicrobial activities of (-)-epigallocatechin-3-gallate (EGCG) and its potential to preserve the quality and safety of foods[J]. Comprehensive Reviews in Food Science and Food Safety,2018,17(3):732−753. doi: 10.1111/1541-4337.12346
[10] RODRIGUES C F, ASCENCAO K, SILVA F A M, et al. Drug-delivery systems of green tea catechins for improved stability and bioavailability[J]. Current Medicinal Chemistry,2013,20(37):4744−4757. doi: 10.2174/09298673113209990158
[11] LI N, TAYLOR L S, FERRUZZI M G, et al. Kinetic study of catechin stability:Effects of pH, concentration, and temperature[J]. Journal of Agricultural and Food Chemistry,2012,60(51):12531−12539. doi: 10.1021/jf304116s
[12] YASUDA M, MATSUDA C, OHSHIRO A, et al. Effects of metal ions (Cu2+, Fe2+ and Fe3+) on HPLC analysis of catechins[J]. Food Chemistry,2012,133(2):518−525. doi: 10.1016/j.foodchem.2012.01.018
[13] CHEN W J, LÜ R L, MUHAMMAD A I, et al. Fabrication of (-)-epigallocatechin-3-gallate carrier based on glycosylated whey protein isolate obtained by ultrasound Maillard reaction[J]. Ultrasonics Sonochemistry,2019,58:104678. doi: 10.1016/j.ultsonch.2019.104678
[14] SHPIGELMAN A, COHEN Y, LIVNEY Y D. Thermally-induced beta-lactoglobulin-EGCG nanovehicles:Loading, stability, sensory and digestive-release study[J]. Food Hydrocolloids,2012,29(1):57−67. doi: 10.1016/j.foodhyd.2012.01.016
[15] SINGH B N, SHANKAR S, SRIVASTAVA R K. Green tea catechin, epigallocatechin-3-gallate (EGCG):Mechanisms, perspectives and clinical applications[J]. Biochemical Pharmacology,2011,82(12):1807−1821. doi: 10.1016/j.bcp.2011.07.093
[16] SAHADEVAN R, SINGH S, BINOY A, et al. Chemico-biological aspects of (-)-epigallocatechin-3-gallate (EGCG) to improve its stability, bioavailability and membrane permeability:Current status and future prospects[J]. Critical Reviews in Food Science and Nutrition,2023,63(30):10382−10411. doi: 10.1080/10408398.2022.2068500
[17] WU M, JIN J, JIN P, et al. Epigallocatechin gallate-beta-lactoglobulin nanoparticles improve the antitumor activity of EGCG for inducing cancer cell apoptosis[J]. Journal of Functional Foods,2017,39:257−263. doi: 10.1016/j.jff.2017.10.038
[18] CHEN W J, WANG W J, MA X B, et al. Effect of pH-shifting treatment on structural and functional properties of whey protein isolate and its interaction with (-)-epigallocatechin-3-gallate[J]. Food Chemistry,2019,274:234−241. doi: 10.1016/j.foodchem.2018.08.106
[19] CHEN W J, WANG H Y, WANG W J, et al. Binding affinity and antioxidant activity of the complex of (-)-epigallocatechin-3-gallate and whey protein isolate:Effect of ultrasound pretreatment[J]. Journal of Food Process Engineering,2020,43:e13081. doi: 10.1111/jfpe.13081
[20] BOHIN M C, VINCKEN J P, VAN DER HIJDEN H T W M, et al. Efficacy of food proteins as carriers for flavonoids[J]. Journal of Agricultural and Food Chemistry,2012,60(16):4136−4143. doi: 10.1021/jf205292r
[21] SHEN X, FANG T, GAO F, et al. Effects of ultrasound treatment on physicochemical and emulsifying properties of whey proteins pre- and post-thermal aggregation[J]. Food Hydrocolloids,2017,63:668−676. doi: 10.1016/j.foodhyd.2016.10.003
[22] 高瑾, 梁宏闪, 赵靖昀, 等. 玉米醇溶蛋白-多酚相互作用及复合物制备与表征[J]. 食品科学,2022,43(2):8−17. [GAO J, LIANG H S, ZHAO J Y, et al. Interactions between zein and polyphenols and characterization of their complexes[J]. Food Science,2022,43(2):8−17.] doi: 10.7506/spkx1002-6630-20201208-089 GAO J, LIANG H S, ZHAO J Y, et al. Interactions between zein and polyphenols and characterization of their complexes[J]. Food Science, 2022, 43(2): 8−17. doi: 10.7506/spkx1002-6630-20201208-089
[23] 陈卫军, 刘东红, 李云成, 等. 制备方法对乳清分离蛋白-绿原酸共价接枝物结构和功能性质的影响[J]. 食品科学,2021,42(13):43−50. [CHEN W J, LIU D H, LI Y C, et al. Effect of preparation methods on the structural and functional properties of whey protein isolate-chlorogenic acid conjugates[J]. Food Science,2021,42(13):43−50.] doi: 10.7506/spkx1002-6630-20200922-269 CHEN W J, LIU D H, LI Y C, et al. Effect of preparation methods on the structural and functional properties of whey protein isolate-chlorogenic acid conjugates[J]. Food Science, 2021, 42(13): 43−50. doi: 10.7506/spkx1002-6630-20200922-269
[24] ZHANG Q A, FU X Z, GARCIA MARTIN J F. Effect of ultrasound on the interaction between (-)-epicatechin gallate and bovine serum albumin in a model wine[J]. Ultrasonics Sonochemistry,2017,37:405−413. doi: 10.1016/j.ultsonch.2017.01.031
[25] BOURVELLEC C, RENARD C M G C. Interactions between poly-phenols and macromolecules:Quantification methods and mechanisms[J]. Critical Reviews in Food Science and Nutrition,2012,52(1-3):213−248.
[26] 涂宗财, 包中宇, 王辉, 等. 超声波对大豆分离蛋白结构及其形成谷氨酰胺转氨酶改性凝胶性质的影响[J]. 食品科学,2015,36(15):15−19. [TU Z C, BAO Z Y, WANG H, et al. Effect of ultrasonic treatment on structure and gel properties induced by transglutaminase of soybean protein isolate[J]. Food Science,2015,36(15):15−19.] doi: 10.7506/spkx1002-6630-201515004 TU Z C, BAO Z Y, WANG H, et al. Effect of ultrasonic treatment on structure and gel properties induced by transglutaminase of soybean protein isolate[J]. Food Science, 2015, 36(15): 15−19. doi: 10.7506/spkx1002-6630-201515004
[27] 熊文飞, 李亚, 王立峰. 卵白蛋白-壳聚糖静电相互作用对蛋白质结构和热特性的影响[J]. 食品工业科技,2021,42(24):55−59. [XIONG W F, LI Y, WANG L F. Electrostatic interaction of valbumin-chitosan on the effects of protein structure and thermal properties[J]. Science and Technology of Food Industry,2021,42(24):55−59.] XIONG W F, LI Y, WANG L F. Electrostatic interaction of valbumin-chitosan on the effects of protein structure and thermal properties[J]. Science and Technology of Food Industry, 2021, 42(24): 55−59.
[28] JIANG L, WANG J, LI Y, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J]. Food Research International,2014,62:595−601. doi: 10.1016/j.foodres.2014.04.022
[29] YILDIRIM-ELIKOGLU S, ERDEM Y K. Interactions between milk proteins and polyphenols:Binding mechanisms, related changes, and the future trends in the dairy industry[J]. Food Reviews International,2018,34(7):665−697. doi: 10.1080/87559129.2017.1377225
[30] SHPIGELMAN A, ISRAELI G, LIVNEY Y D. Thermally-induced protein-polyphenol co-assemblies:Beta lactoglobulin-based nanocomplexes as protective nanovehicles for EGCG[J]. Food Hydrocolloids,2010,24(8):735−743. doi: 10.1016/j.foodhyd.2010.03.015





 下载:
下载:
 下载:
下载:



