Comparison of Active Components, Antioxidant Activity and Pancreatic Lipase Inhibitory Activity in Different Solvent Extracts of Penthorum chinense Leaves
-
摘要: 赶黄草叶活性成分丰富,本文对赶黄草叶不同溶剂提取(80%丙酮、80%乙醇、80%甲醇、水)物中活性成分含量、体外抗氧化能力以及胰脂肪酶抑制能力进行对比研究。结果显示,80%丙酮提取物中总多酚含量最高(250.04 mg/g),而80%甲醇和80%乙醇提取物中总黄酮(176.96 mg/g和174.89 mg/g)和总原花青素含量(43.05 mg/g和42.87 mg/g)最高。除芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、乔松素-7-O-葡萄糖苷、乔松素-7-O-(3''-O-没食子酰基-4'',6''-六羟基联苯二甲酰基)-β-葡萄糖苷和赶黄草苷A外,三种有机溶剂提取物中9种多酚类化合物含量无显著性差异,均显著高于水提物(P<0.05)。80%甲醇提取物和80%乙醇提取物对1,1-二苯基-2-三硝基苯肼(DPPH)自由基(IC50=42.17 μg/mL和42.21 μg/mL,P>0.05)清除能力最强,80%丙酮提取物对2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+)自由基清除能力最强(IC50=48.92 μg/mL),铁离子还原能力最强为80%乙醇提取物。此外,80%丙酮对体外胰脂肪酶抑制能力最强 ( IC50=0.46 mg/mL)。相关性分析表明,赶黄草叶体外DPPH和ABTS+自由基清除能力以及胰脂肪酶抑制能力与11种多酚类化合物呈显著或极显著正相关(P<0.05,P<0.01)。综上,结合不同溶剂提取物中活性成分含量、体外活性以及溶剂毒性影响,本研究建议将80%乙醇作为赶黄草叶提取溶剂,为赶黄草叶进一步开发提取利用提供理论依据。Abstract: The Penthorum chinense Pursh leaves were rich in active ingredients. The active ingredient content, in vitro antioxidant capacity and pancreatic lipase inhibition ability of P. chinense leaves extracted by different solvents (80% acetone, 80% ethanol, 80% methanol, water) were compared in this study. The results showed that the total phenolic content (250.04 mg/g) extracted by 80% acetone was highest, while both the total flavonoid content (176.96 mg/g and 174.89 mg/g) and total proanthocyanidins content (43.05 mg/g and 42.87 mg/g) extracted by 80% methanol and 80% ethanol were highest. Except for rutin, isoquercitrin, kaempferol-3-O-rutinoside, pinocembrin 7-O-D-glucoside, pinocembrin 7-O-(3''-O-galloy-4'',6''-hexahydroxydiphenoyl)-β-glucoside and thonningianin A, the content of nine phenolic compounds showed insignificant differences among three organic solvent extracts, which were significantly higher than those in water extract (P<0.05). Both 80% ethanol extract and 80% methanol extract showed the strongest DPPH free radical scavenging ability (IC50=42.17 μg/mL and 42.21 μg/mL, P>0.05 ), while 80% acetone extract showed the strongest ABTS+ free radical scavenging ability (IC50=48.92 μg/mL) and 80% ethanol extract also showed the strongest ferric reducing antioxidant power. In addition, in vitro pancreatic lipase inhibitory activity of 80% acetone extract (IC50=0.46 mg/mL) was the strongest. Correlation analysis showed that DPPH and ABTS+ free radical scavenging ability and pancreatic lipase inhibition ability were significantly or extremely significantly positively correlated with 11 phenolic compounds (P<0.05, P<0.01). Above all, in view of the active ingredient content, in vitro biological activity and solvent toxicity, this study recommend 80% ethanol as the extract solvent of P. chinense leaves, which would provide the theoretical basis for the further development, extraction and utilization of P. chinense leaves.
-
赶黄草为虎耳草科扯根菜属的地上干燥部分,主要分布在西南地区,为四川古蔺道地药材,是治疗肝脏疾病的传统药物[1−2]。2020年赶黄草被列入新食品原料。赶黄草活性成分丰富,目前已分离出100多种化合物,主要包含黄酮类化合物、有机酸类、木脂素类、香豆素类、鞣质类和萜类等多种活性化合物。基于赶黄草活性成分,现代药理研究和临床报道赶黄草具抗氧化活性、抗炎、抗菌和保肝护肝等活性。Zeng等[3]研究发现赶黄草具有很强的抗氧化,能与抗坏血酸(VC)媲美。而覃俊媛等[4]研究发现赶黄草水煎液能抑制金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌生物膜的形成,同时减少胞外多糖和DNA的释放,使其生长受到抑制。Chen等[5]研究发现赶黄草中山奈酚能够抑制氧化应激和炎症,从而达到保肝作用。
天然植物提取物通常是较好的胰脂肪酶抑制剂,通过抑制胰脂肪酶活性,减缓脂肪水解成能被机体吸收的单酰基甘油和游离脂肪,从而达到治疗肥胖的目的[6]。目前市面上主要采用奥利司他作为治疗肥胖的药物,但长期使用奥利司他副作用较大,如腹泻、恶心、呕吐、加重肝脏代谢负担等[7]。因此,开发天然的胰脂肪酶抑制剂是非常必要的。大量研究发现天然产物减肥降脂的机制可能是通过清除活性氧(ROS),从而阻止NF-κB激活、降低相关靶基因的表达,起到减肥的效果[8−10]。Guo等[11]研究发现赶黄草中乔松素-7-O-葡萄糖苷和乔松素通过抗氧化活性,改善游离脂肪酸诱导形成肝脂肪变性。Li等[12]研究发现赶黄草提取物通过调节胆酸汁(Bile Acid,BA)代谢关键基因,减少肝脂质沉积,最终减轻因高脂饮食诱导的非酒精性脂肪肝病症。
本实验通过4种不同极性溶剂(80%丙酮、80%乙醇、80%甲醇和水)对赶黄草叶进行提取,测定总多酚、总黄酮、总原花青素和多酚类化合物含量,通过DPPH自由基清除率、ABTS+自由基清除率以及铁离子还原法(FRAP)对体外氧化活性进行评价,同时采用抑制胰脂肪酶活性实验评价赶黄草降血脂效果,并分析它们之间的相关性,为进一步开发利用赶黄草资源提供数据支持,促进天然胰脂肪酶抑制剂的开发和赶黄草产业的持续发展。
1. 材料与方法
1.1 材料与仪器
赶黄草 于2023年8月收集于四川省泸州市古蔺县,将新鲜的赶黄草叶冷冻干燥后粉碎并过60目筛,得到赶黄草粉,在−20 ℃冰箱中保存,备用;芦丁、无水乙醇、甲醇、丙酮、福林酚、碳酸钠、碳酸钠、硝酸铝、氢氧化钠、乙酸钠、盐酸、冰乙酸、异丙醇 分析纯,成都市科龙化工试剂厂;三羟甲基氨基甲烷、奎诺二甲基丙烯酸(分析纯)、2-2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐试剂、脂肪酶(猪胰30000 u/g)、曲拉通X-100、没食子酸、原儿茶素、儿茶素、表儿茶素、芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、紫云英苷、阿福豆苷、乔松素-7-O-葡萄糖苷、槲皮素、山奈酚、乔松素-7-O-(3''-O-没食子酰基-4'',6''-六羟基联苯二甲酰基)-β-葡萄糖苷、乔松素、赶黄草苷A 色谱纯,上海源叶生物科技有限公司;2,2-联苯基-1-苦基肼基、月桂酸4-硝基苯酯(4-Nitropheny Laurate) 色谱纯,上海麦克林生化科技股份有限公司。
1290超高效液相色谱仪 美国安捷伦科技有限公司;FDU-2110冷冻干燥机 东京理化器械株式会社;ST-10B多功能粉碎机 上海树立仪器仪表有限公司;FA2104电子天平 舜宇恒平仪器;KQ5200DE数控超声波清洗器 昆山市超声仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 郑州汇成科工贸有限公司;SK15医用离心机 曦玛离心机(扬州)有限公司;Synergy-HTX多功能酶标仪 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 赶黄草叶提取物的制备
参考邓俊琳等[13]方法,将1 g赶黄草叶粉分别与8 mL水、80%乙醇、80%甲醇、80%丙酮混合,摇晃均匀,置于40 ℃超声仪中提取30 min后,8000 r/min离心15 min,取上清液,对沉淀物再次提取2次。将3次上清液收集,最终定容至25 mL。
1.2.2 总多酚测定
总多酚测定采用福林-酚法[14]。取20 μL样品于96孔板中,加入20 μL福林酚,充分混匀后静置5 min,加入5% Na2CO3(160 μL)混合均匀,室温条件下避光反应60 min,在765 nm处检测样品的OD值。将没食子酸绘制成标准曲线y=0.0049x+0.0086(R2=0.9984),根据回归方程计算总酚含量(mg/g)。
1.2.3 总黄酮测定
采用NaNO2-Al(NO3)3-NaOH比色法[15]进行测定。取20 μL样品于96孔板中,加入5% NaNO2(15 μL),室温条件下充分混合均匀静置反应6 min后加入10% AlCl3∙6H2O(15 μL),摇晃均匀静置5 min后加入1 mol/L NaOH(100 μL),在510 nm处检测样品的OD值。将芦丁绘制成标准曲线y=0.4172x−0.0064(R2=0.9978),根据线性方程计算总黄酮(mg/g)。
1.2.4 总原花青素测定
参照王伟等[16]的方法并稍作修改。取1 mL样品和3 mL 40 g/L香草醛-甲醇,加入1.5 mL浓盐酸混合均匀,45 ℃避光反应30 min后摇晃均匀,在500 nm处检测OD值。将儿茶素制成标准曲线y=3.3802x+0.0175(R2=0.9915),根据线性方程计算总原花青素含量(mg/g)。
1.2.5 高效液相色谱分析
高效液相色谱色谱分析方法如下:色谱分析柱:PFP柱(4.6×100 nm,2.7 μm),流动相为A为0.1%甲酸-水溶液,B为乙腈;梯度洗脱条件为0~10 min,5%~10% B:10~20 min,10%~20% B:20~27.5 min,20%~30% B:27.5~30 min,30%~90% B:30~32 min,90% B;流速为0.8 mL/min;进样量:2 μL;柱温:35 ℃;检测波长:280 nm和350 nm。
1.2.6 抗氧化活性
1.2.6.1 DPPH自由基清除能力测定
参考Umar等[17]方法并做修改,将100 µL不同浓度样品与100 µL DPPH溶液充分混合均匀,避光条件下静置30 min,在517 nm处检测OD值,维生素E(VE)作阳性对照组。根据公式(1)计算DPPH自由基清除率。
DPPH自由基清除率(%)=(A0−A1)A1×100 (1) 式中:A0表示空白组吸光度;A1表示样品组吸光度。
1.2.6.2 ABTS+自由基清除能力测定
参考Awe等[18]的方法并做修改,将40 μL样品和160 μL ABTS溶液充分混合室温避光反应5 min,在734 nm波长处测定OD值,记为A1样品组,用溶剂代替样品,按上述方法测定OD值,VE作阳性对照组。根据公式(2)计算ABTS+自由基清除率。
ABTS+自由基清除率(%)=(A0−A1)A1×100 (2) 式中:A0表示空白组的吸光度;A1表示为样品组吸光度。
1.2.6.3 铁离子还原能力测定
参考Zhu等[19]方法并略做修改,将30 μL样品和265 µL FRAP工作液在37 ℃中反应30 min,593 nm波长处测定OD值,记为A1样品组,用溶剂代替样品,按上述方法测定OD值,记为A0为空白组,VE作阳性对照组。根据公式(3)计算铁离子还原力。
铁离子还原力(FRAP)=A1−A0 (3) 式中:A0表示空白组的吸光度;A1表示为样品组吸光度。
1.2.7 胰脂肪酶抑制活性测定
参考Wang等[20]方法并略做修改,将0.4% pNP月桂酸酯溶于5 mmol/L醋酸钠(pH=5.0)中,将50 µL样品与200 μL胰脂肪酶(5 mg/mL,100 mmol/L pH=8.2 Tris-HCl缓冲溶液溶解)混合。在37 ℃孵育15 min后加入50 μL pNP月桂酸酯,37 ℃孵育45 min后在405 nm波长下测定OD值,奥利司他作为阳性对照,用公式(4)计算抑制胰脂肪酶抑制率。
脂肪酶抑制率(%)=1−A样品−A样品空白A空白对照−A空白×100 (4) 式中:A样品:样品+胰脂肪酶+pNP月桂酸酯;A样品空白:样品+Tris-HCl缓冲液+pNP月桂酸酯;A空白对照:Tris-HCl缓冲液+胰脂肪酶+pNP月桂酸酯;A空白:Tris-HCl缓冲液+Tris-HCl缓冲液+pNP月桂酸酯。
1.3 数据处理
实验数据均为3次重复后的平均值,采用SPSS 22.0统计软件和Origin 9进行实验数据处理图表绘制,并采用SPSS22.0计算不同溶剂提取物的半抑制浓度(IC50值)、单因素方差分析及双变量相关性分析,P<0.05表示差异显著。
2. 结果与分析
2.1 赶黄草叶不同溶剂提取物总多酚、总黄酮和总原花青素含量比较
通常植物体内中存在大量的次生代谢产物,如酚酸、黄酮和原花青素等,能够帮助植物抵抗逆性条件。由表1可知,不同溶剂提取物中总多酚、总黄酮及总原花青素含量差异显著(P<0.05)。总多酚含量最高的是80%丙酮提取物(250.04 mg/g),略高于80%甲醇和80%乙醇(P>0.05),显著高于水提取物(P<0.05)。80%甲醇提取物总黄酮(176.96 mg/g)和总原花青素(43.05 mg/g)最高,但与80%乙醇提取物中无显著差异(P>0.05),并显著高于80%丙酮提取物(P<0.05),而水提物中总多酚、总黄酮和总原花青素含量均最低。研究发现酚类化合物在有机溶剂溶解度大于水,甲醇和乙醇溶液中含有羟基,多酚类化合物可能与羟基发生结合产生氢键,增强相互作用,促使多酚类化合物在有机溶剂中更容易溶解[21]。此外,多酚提取效果与溶剂极性有关,研究发现酚类化合物更易溶于极性较弱的有机溶剂中。张福娟等[22]发现丙酮提取的花红果渣中总多酚和总黄酮含量最高。
表 1 不同溶剂提取赶黄草叶中总多酚、总黄酮和总原花青素含量Table 1. Contents of total polyphenols, total flavonoids and total proanthocyanidins in P. chinense leaves extracted by different solvents活性成分 80%丙酮提取物 80%乙醇提取物 80%甲醇提取物 水提取物 总多酚(mg/g) 250.04±14.06b 239.26±8.32b 238.49±2.75b 156.03±1.05a 总黄酮(mg/g) 155.49±7.30b 174.89±10.33c 176.96±14.67c 115.17±15.81a 总原花青素(mg/g) 39.04±0.26b 42.87±0.96c 43.05±6.35c 23.14±3.09a 注:不同的小写字母表示同行差异显著(P<0.05)。 2.2 赶黄草叶不同溶剂提取物多酚类化合物比较
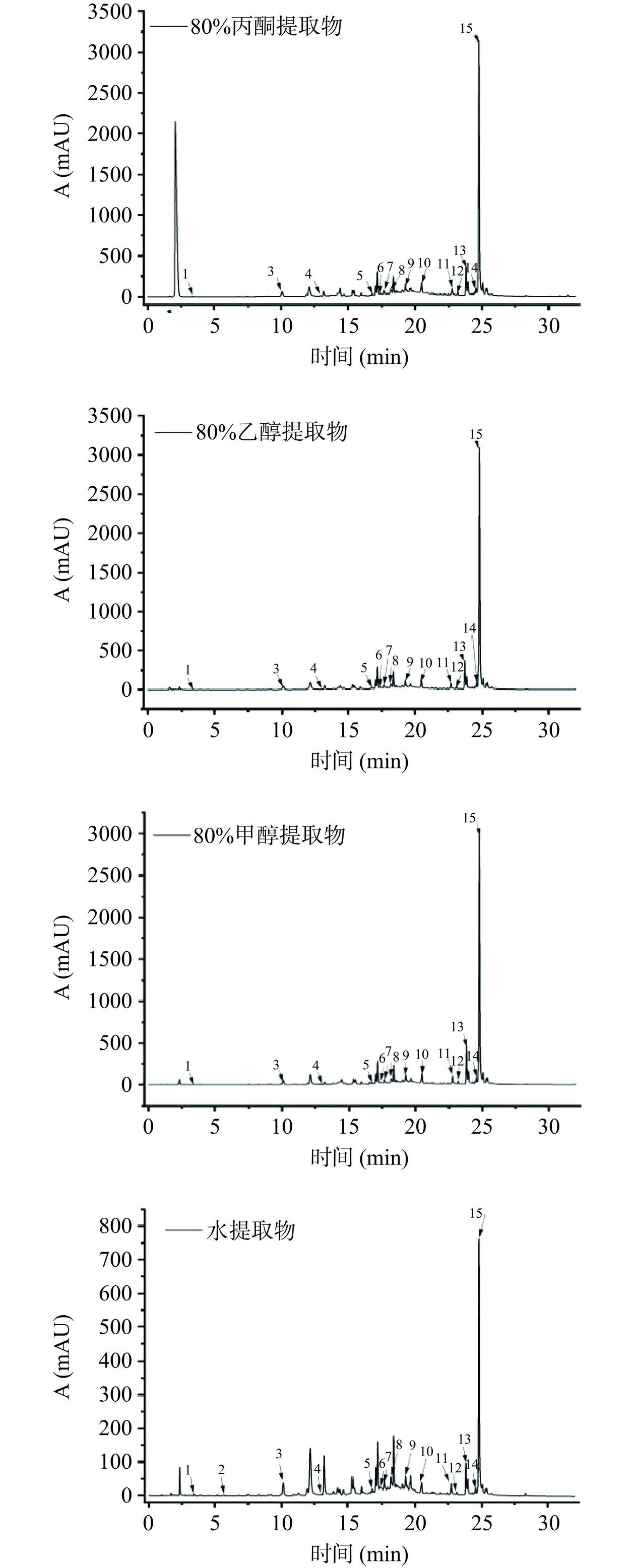
由表2和图1可知,赶黄草叶提取物中15种主要的多酚类化合物含量进行测定分析,包括10种黄酮醇类(异槲皮苷、槲皮素、芦丁、山奈酚、阿福豆苷、儿茶素、表儿茶素、紫云英苷、山奈酚-3-O-芸香糖苷、乔松素-7-O-(3''-O-没食子酰基-4'',6''-六羟基联苯二甲酰基)-β-葡萄糖苷、2种二氢黄酮类(乔松素-7-O-葡萄糖苷、乔松素)、1种二氢查耳酮类(赶黄草苷A)以及2种酚酸类(没食子酸、原儿茶酸)。结果表明,除赶黄草苷A、乔松乔松素-7-O-(3''-O-没食子酰基-4'',6''-六羟基联苯二甲酰基)-β-葡萄糖苷、芦丁、山奈酚-3-O-芸香糖苷、乔松素、异槲皮苷以外,80%乙醇、80%甲醇和80%丙酮提取物中9种酚类化合物含量均无显著性差异(P>0.05),而水提取物中15种多酚类化合物含量均最低。赶黄草作为四川道地中药材,《四川省中药材标准》中已将槲皮素作为评价赶黄草的质量标准[23],其含量在三种有机溶剂提取物均无显著差异。赶黄草苷A和乔松素-7-O-葡萄糖苷作为赶黄草叶含量较高的化合物,在80%丙酮提取物含量为99.13 mg/g和3.37 mg/g,显著(P<0.05)高于其它提取物。研究发现赶黄草苷A和乔松素-7-O-葡萄糖苷通过平衡脂质代谢紊乱的能力,从而达到降血脂和降血糖的双重功效[24−25]。
表 2 赶黄草叶不同溶剂提取物中酚类化合物含量(mg/g)Table 2. Contents of phenolic compounds in different solvent extracts of P. chinense leaves (mg/g)样品 没食子酸 原儿茶酸 儿茶素 表儿茶素 芦丁 异槲皮苷 山奈酚-3-O-
芸香糖苷紫云英苷 阿福豆苷 乔松素-7-O-
葡萄糖苷槲皮素 山奈酚 乔松素-7-O-
(3''-O-没食子酰基-
4'',6''-六羟基联
苯二甲酰基)-
β-葡萄糖苷乔松素 赶黄草苷A 80%丙酮 0.26±0.05a / 7.80±0.03b 0.49±0.01b 0.06±0.00b 0.28±0.00cb 0.19±0.00b 2.13±0.03b 0.89±0.01b 3.37±0.31c 0.39±0.02b 0.12±0.00b 9.69±0.24c 1.01±0.00b 99.13±0.43c 80%乙醇 0.23±0.00a / 7.74±0.27b 0.47±0.02b 0.11±0.00c 0.29±0.01c 0.24±0.01c 2.15±0.09b 0.90±0.03b 2.73±0.05b 0.36±0.00b 0.12±0.00b 4.52±0.19b 0.98±0.04b 95.88±2.12c 80%甲醇 0.22±0.00a / 7.48±0.05b 0.47±0.00b 0.06±0.00b 0.27±0.00b 0.23±0.00c 2.05±0.01b 0.87±0.01b 2.91±0.06cb 0.39±0.00b 0.11±0.00b 12.32±0.18d 0.94±0.00b 88.02±0.63b 水 0.29±0.01a 0.10±0.00 5.25±0.00a 0.17±0.01a 0.048±0.00a 0.20±0.00a 0.07±0.00a 1.46±0.00a 0.62±0.42a 1.02±0.00a 0.16±0.02a 0.07±0.00a 3.07±0.59a 0.22±0.05a 23.98±4.63a 注:不同小写字母表示同一列差异显著(P<0.05)。 2.3 赶黄草叶不同溶剂提取物抗氧化性比较
2.3.1 DPPH自由基清除能力
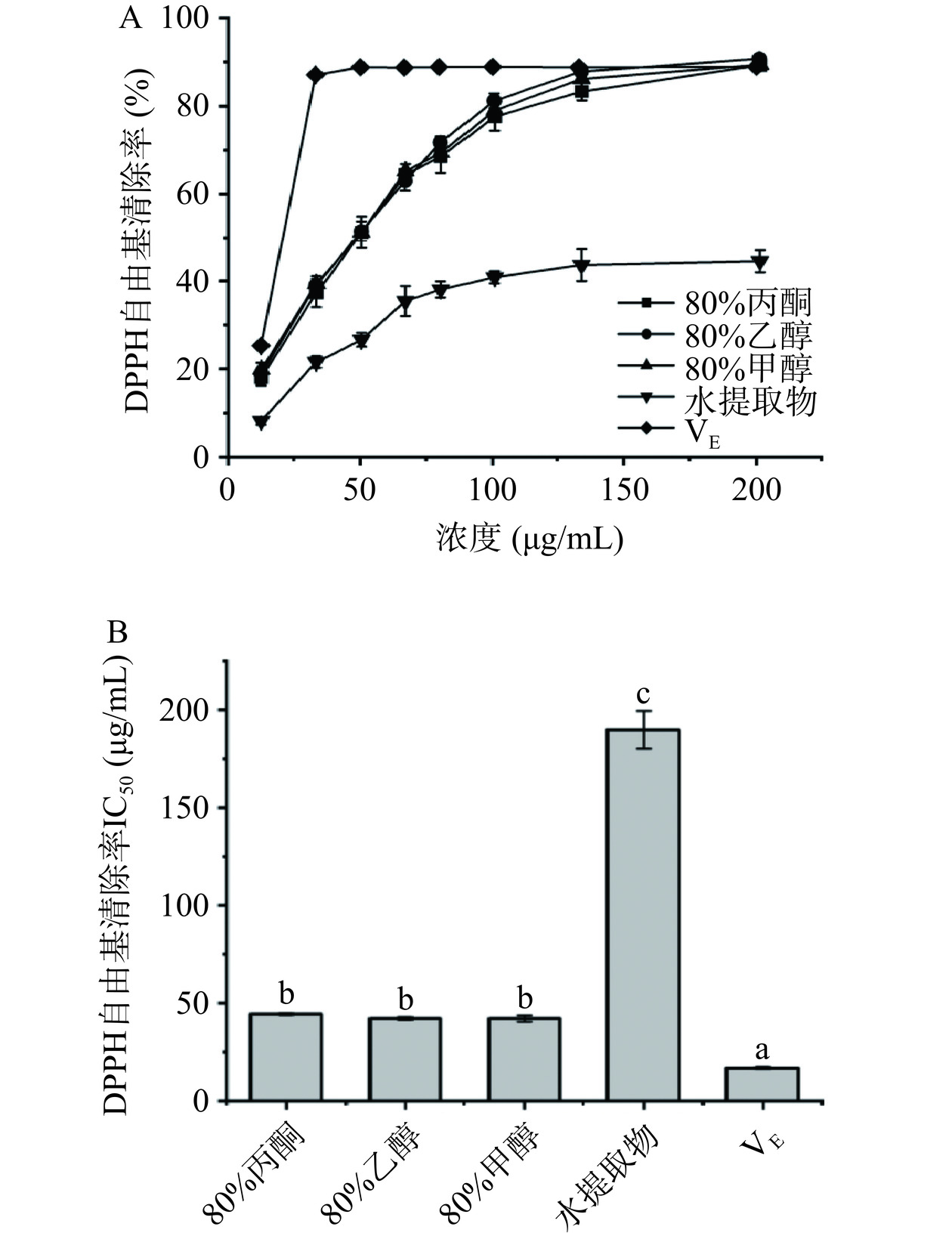
由图2可知,赶黄草叶不同溶剂提取物对DPPH自由基表现出不同的清除能力。在一定浓度范围内(12~201 µg/mL),不同溶剂提取物对DPPH自由基清除能力随着样品浓度增加而增强,随后趋于稳定。DPPH自由基清除能力表现为80%甲醇(IC50=42.17 µg/mL)≈80%乙醇(IC50=42.21 µg/mL)≈80%丙酮(IC50=44.40 µg/mL,P>0.05)>水(IC50=189.80 µg/mL)。较强DPPH自由基清除能力可能与较高含量总多酚、总黄酮与总原花青素有关。酚类化合物是抗氧化活性的主要贡献者[26],而有机溶剂提取酚类化合物含量均高于水提物。此外,DPPH自由基清除是通过抗氧化剂转移氢给自由基,一般只在强氢键溶剂(如甲醇)中电子转移才会占主导地位[27],所以甲醇清除DPPH的能力略强于其它溶剂。
2.3.2 ABTS+自由基清除能力
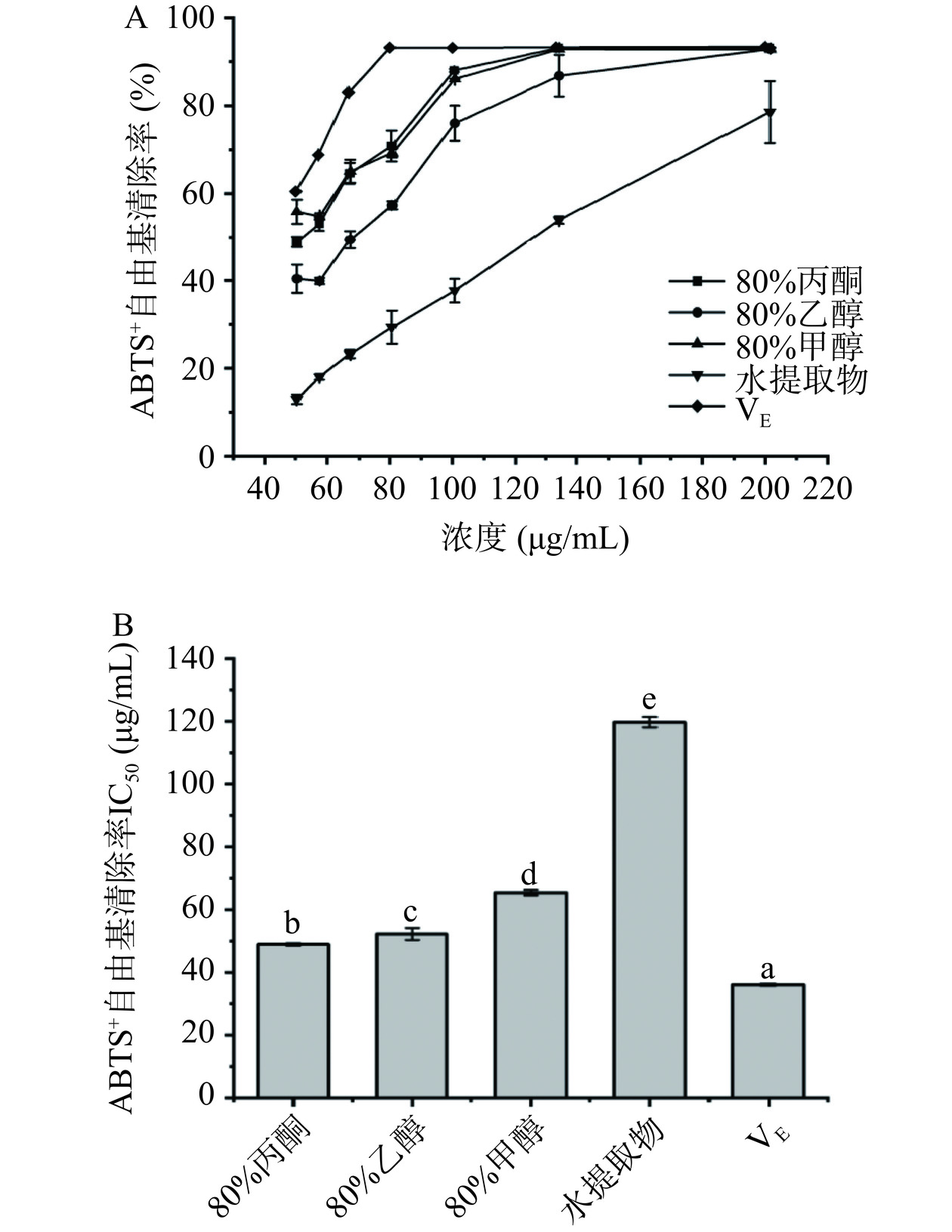
ABTS+是通过转移电子或氢离子使其结构稳定,从而起到抗氧化作用[28]。由图3可知,赶黄草叶不同溶剂提取物对ABTS+自由基具有不同程度的清除能力,在一定浓度范围内(50~201 µg/mL)呈现较好的量效关系,清除率与样品浓度呈正相关。ABTS+自由基清除能力表现为80%丙酮(IC50=48.92 µg/mL)>80%乙醇(IC50=52.24 µg/mL)>80%甲醇(IC50=65.38 µg/mL)>水(IC50=119.70 µg/mL)。研究发现具有多个酚羟基的赶黄草苷A和乔松素-7-O-葡萄糖苷通常表现出较强的抗氧化活性[29],而80%丙酮提取物中赶黄草苷A和乔松素-7-O-葡萄糖苷含量最高,这可能是其具有最强ABTS+自由基清除能力的原因。
2.3.3 FRAP
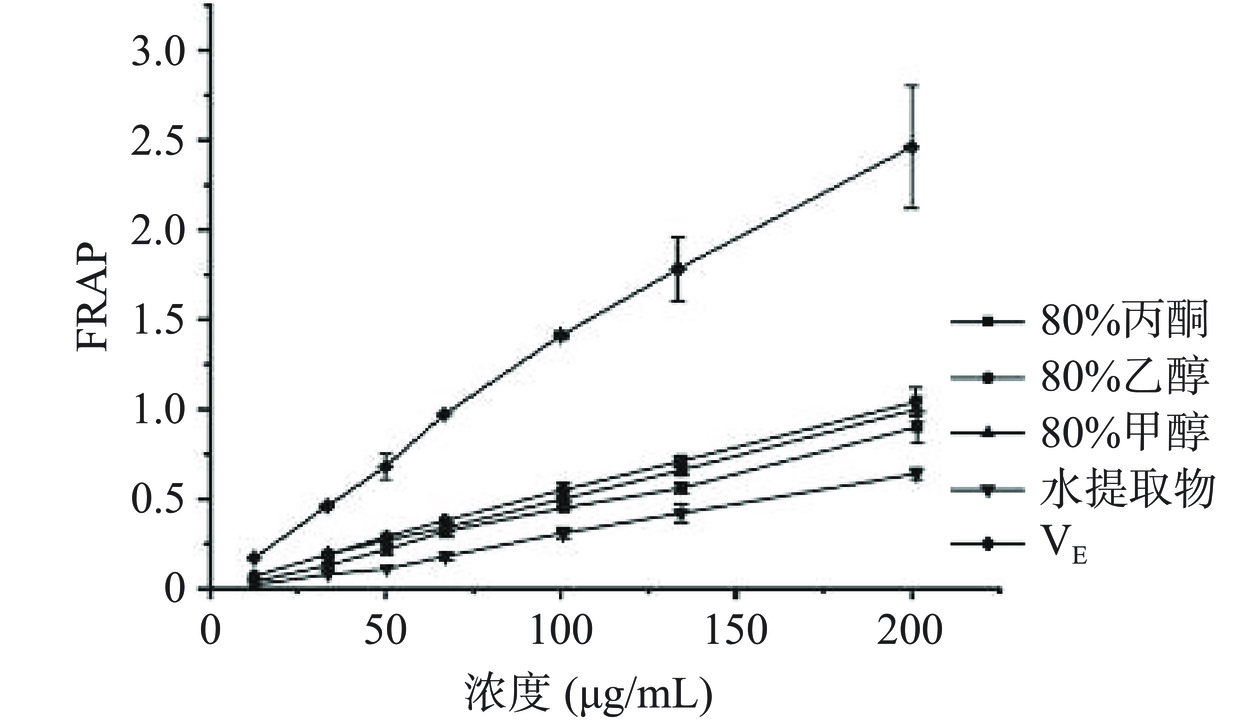
FRAP主要通过将三价铁复合物2,4,6-三吡啶基三嗪(TPTZ)还原成二价铁,产生蓝色络合物,一般认为吸光度越大,抗氧化能力就越强[30]。由图4可知,赶黄草叶不同溶剂提取物对铁离子还原能力在一定浓度范围(12~201 µg/mL)内呈现较好的量效关系,不同溶剂提取物浓度与铁离子还原能力呈正相关。相同浓度下,还原力大小为VE>80%乙醇>80%甲醇>80%丙酮>水提取物。研究发现赶黄草中黄酮类化合物具有较强的Fe2+螯合力[31],紫云英苷和芦丁作为天然的黄酮类化合物,在80%乙醇提取物中含量最高,这可能是80%乙醇提取物还原力最高的原因。
大量研究表明,有机溶剂提取可大大提高大多数植物的抗氧化能力[32−34]。测定体外抗氧化活性最常用的是DPPH自由基清除率、ABTS+自由基清除率和FRAP实验[35],三种方法作用机制不同,抗氧化能力结果也有所差异,但能更加全面评价不同溶剂提取效果。大量的研究结果证明抗氧化活性与酚类化合物含量有着显著的相关性[36−37]。
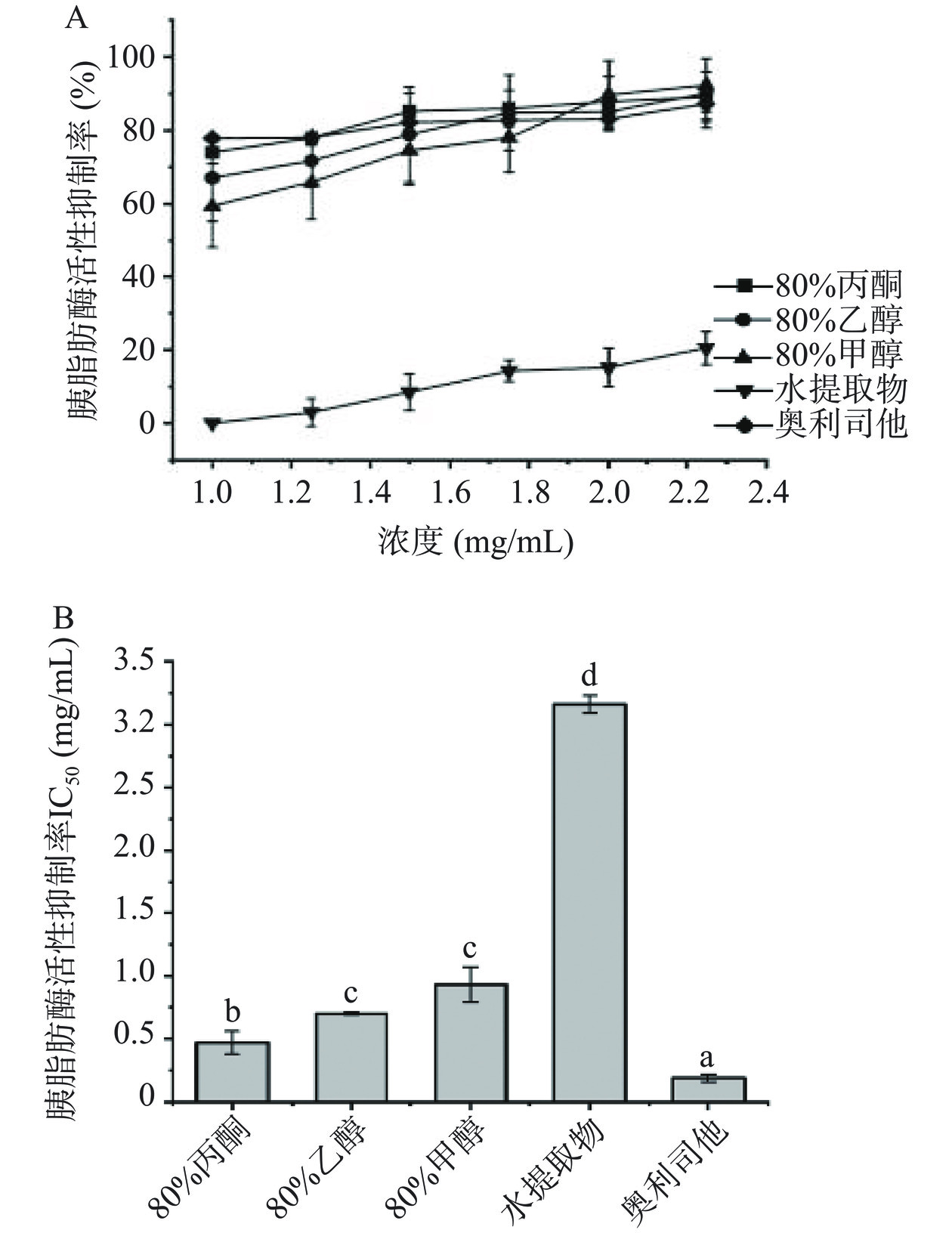
2.4 赶黄草叶不同溶剂提取物胰脂肪酶活性比较
通常富含多酚的天然原料(如绿茶、红茶、蓝莓等)能够表现出较好的胰脂肪酶活性抑制能力[38−40]。赶黄草叶不同溶剂提取物浓度对胰脂肪酶抑制效应呈正相关,见图5,随着不同溶剂提取物浓度的增加(1~2.25 µg/mL),其抑制胰脂肪酶能力逐渐增强。抑制胰脂肪酶能力表现为:奥利司他(IC50=0.19 mg/mL)>80%丙酮(IC50=0.47 mg/mL)>80%乙醇(IC50=0.70 mg/mL)>80%甲醇(IC50=0.91 mg/mL)>水(IC50=3.16 mg/mL)。已有研究表明多酚(如黄酮类化合物)可以抑制胰脂肪酶活性,从而抑制对脂肪吸收,降低老鼠的肥胖程度[41−44]。这可能是酚类化合物(如儿茶素衍生物)与胰脂肪酶活性位点具有更高的亲和力。而80%丙酮提取物中儿茶素、表儿茶素、乔松素-7-O-葡萄糖苷、槲皮素与山奈酚含量最高,这可能是80%丙酮对胰脂肪酶抑制能力最好的原因。
2.5 赶黄草叶相关性分析
采用SPSS 27.0软件对赶黄草叶中活性成分、抗氧化和胰脂肪酶抑制活性进行Person法相关性分析。由表3可知,三种体外抗氧化方法之间具有一定相关性,与反应机制相符。赶黄草叶中总多酚、总黄酮与DPPH自由基清除能力之间存在显著(P<0.05)相关性。DPPH自由基清除能力(IC50值)与儿茶素、表儿茶素、紫云英苷、阿福豆苷、槲皮素、乔松素、总多酚含量之间存在极显著性负相关(P<0.01),其中儿茶素、表儿茶素、阿福豆苷、槲皮素、紫云英苷都是典型的酚羟基化合物,酚羟基化合物有较好的清除DPPH自由基的能力[45]。ABTS+自由基清除能力(IC50值)与儿茶素、紫云英苷、山奈酚、赶黄草苷A之间存在极显著负相关(P<0.01)。这表明抗氧化活性与酚类化合物种类和含量有关。胰脂肪酶抑制能力(IC50值)与总多酚、儿茶素、表儿茶素、异槲皮素、紫云英苷、阿福豆苷、乔松素7-O-葡萄糖苷、槲皮素、山奈酚、乔松素和赶黄草苷A成显著(P<0.05)或极显著负相关(P<0.01)。此外,DPPH自由基和ABTS+自由基清除能力(IC50值)与胰脂肪酶活性抑制能力(IC50值)呈显著(P<0.05)和极显著(P<0.01)正相关。已有研究表明提取物抗氧化能力越强,其对胰脂肪酶活性抑制能力也最强[46]。
表 3 赶黄草叶中活性成分、抗氧化活性和胰脂肪酶抑制活性相关性分析Table 3. Correlation analysis of active components, antioxidant activity and pancreatic lipase inhibitory activity in P. chinense Pursh leaves指标 没食子酸 原儿茶酸 儿茶素 表儿茶素 芦丁 异槲皮苷 山奈酚-3-O-
芸香糖苷紫云英苷 阿福豆苷 乔松素-7-O-
葡萄糖苷槲皮素 山奈酚 乔松素-7-O-
(3''-O-没食子酰基-
4'',6''-六羟基联
苯二甲酰基)-
β-葡萄糖苷乔松素 赶黄草苷A 总多酚 总黄酮 总原
花青素DPPH· ABTS+· FRAP 胰脂肪酶
抑制活性没食子酸 1 原儿茶酸 0.843 1 儿茶素 −0.788 −0.993** 1 表儿茶素 −0.81 −0.998** 0.996** 1 芦丁 −0.566 −0.52 0.549 0.492 1 异槲皮苷 −0.8 −0.980* 0.991** 0.978* 0.657 1 山奈酚-3-O-
芸香糖苷−0.945 −0.961* 0.939 0.942 0.654 0.952* 1 紫云英苷 −0.797 −0.991** .999** 0.992** 0.589 0.996** 0.947 1 阿福豆苷 −0.832 −0.998** 0.989* 0.998** 0.464 0.967* 0.947 0.984* 1 乔松素-7-O-
葡萄糖苷−0.691 −0.965* 0.971* 0.979* 0.341 0.931 0.855 0.959* 0.975* 1 槲皮素 −0.817 −0.992** 0.980* 0.994** 0.406 0.95 0.93 0.972* 0.998** 0.981* 1 山奈酚 −0.753 −0.980* 0.996** 0.984* 0.594 0.995** 0.924 0.997** 0.972* 0.959* 0.960* 1 乔松素-7-O-
(3''-O-没食子酰基-
4'',6''-六羟基联
苯二甲酰基)-
β-葡萄糖苷−0.584 −0.665 0.607 0.672 −0.256 0.505 0.563 0.574 0.709 0.729 0.75 0.54 1 乔松素 −0.803 −0.997** 0.999** 0.999** 0.523 0.986* 0.944 0.996** 0.995** 0.975* 0.988* 0.991** 0.64 1 赶黄草苷A −0.775 −0.991** 1.000** 0.995** 0.541 0.989* 0.931 0.998** 0.987* 0.974* 0.979* 0.997** 0.606 0.998** 1 总多酚 −0.773 −0.993** .996** 0.998** 0.47 0.974* 0.921 0.990** 0.994** 0.988* 0.991** 0.986* 0.672 0.998** 0.996** 1 总黄酮 −0.973* −0.941 0.908 0.919 0.611 0.916 0.994** 0.915 0.93 0.826 0.915 0.884 0.601 0.916 0.898 0.894 1 总原花青素 −0.93 −0.981* 0.959* 0.967* 0.587 0.959* 0.995** 0.963* 0.973* 0.897 0.961* 0.94 0.631 0.965* 0.953* 0.95 0.989* 1 DPPH· 0.851 1.000** −0.992** −0.997** −0.525 −0.980* −0.965* −0.991** −0.997** −0.961* −0.991** −0.979* −0.663 −0.996** −0.990* −0.991** −0.946 −0.983* 1 ABTS+· 0.728 0.976* −0.995** −0.983* −0.567 −0.989* −0.908 −0.994** −0.970* −0.966* −0.959* −0.999** −0.549 −0.989* −0.996** −0.987* −0.867 −0.928 0.974* 1 FRAP −0.949 −0.945 0.924 0.924 0.692 0.944 0.998** 0.934 0.928 0.826 0.907 0.911 0.519 0.927 0.915 0.901 0.993** 0.987* −0.949 −0.893 1 胰脂肪酶
抑制活性0.759 0.990* −0.998** −0.995** −0.511 −0.983* −0.92 −0.995** −0.988* −0.982* −0.982* −0.994** −0.625 −0.998** −0.999** −0.998** −0.887 −0.945 0.988* 0.995** −0.901 1 注:*表示在P<0.05水平上相关性显著,**表示在P<0.01水平上相关性显著。 3. 结论
本研究通过利用不同溶剂对赶黄草叶进行提取,比较不同溶剂提取物中总多酚、总黄酮、总原花青素含量、体外抗氧化活性及胰脂肪酶抑制活性,发现80%丙酮提取物中总多酚含量最高,80%甲醇和80%乙醇提取物中总黄酮和总原花青素含量最高。除芦丁、异槲皮苷、山奈酚-3-O芸香糖苷、乔松素-7-O-葡萄糖苷、乔松素-7-O-(3''-O-没食子酰基-4'',6''-六羟基联苯二甲酰基)-β-葡萄糖苷和赶黄草苷A外,三种有机溶剂提取物中9种多酚类化合物含量均无显著差异,但显著高于水提物。对体外抗氧化活性而言,3种有机溶剂提取物体外抗氧化活性显著(P<0.05)高于水提物。体外胰脂肪酶抑制活性表现为:80%丙酮>80%乙醇>80%甲醇>水提取物。相关性分析表明体外抗氧化活性和胰脂肪酶抑制活性与11种多酚类化合物显或极显著正相关。因此,综合比较不同溶剂提取物活性成分含量、体外活性以及溶剂毒性,本研究建议将80%乙醇作为赶黄草叶提取溶剂,为开发利用赶黄草叶在食品、药品和保健品等方面应用提供理论基础和参考依据。
-
表 1 不同溶剂提取赶黄草叶中总多酚、总黄酮和总原花青素含量
Table 1 Contents of total polyphenols, total flavonoids and total proanthocyanidins in P. chinense leaves extracted by different solvents
活性成分 80%丙酮提取物 80%乙醇提取物 80%甲醇提取物 水提取物 总多酚(mg/g) 250.04±14.06b 239.26±8.32b 238.49±2.75b 156.03±1.05a 总黄酮(mg/g) 155.49±7.30b 174.89±10.33c 176.96±14.67c 115.17±15.81a 总原花青素(mg/g) 39.04±0.26b 42.87±0.96c 43.05±6.35c 23.14±3.09a 注:不同的小写字母表示同行差异显著(P<0.05)。 表 2 赶黄草叶不同溶剂提取物中酚类化合物含量(mg/g)
Table 2 Contents of phenolic compounds in different solvent extracts of P. chinense leaves (mg/g)
样品 没食子酸 原儿茶酸 儿茶素 表儿茶素 芦丁 异槲皮苷 山奈酚-3-O-
芸香糖苷紫云英苷 阿福豆苷 乔松素-7-O-
葡萄糖苷槲皮素 山奈酚 乔松素-7-O-
(3''-O-没食子酰基-
4'',6''-六羟基联
苯二甲酰基)-
β-葡萄糖苷乔松素 赶黄草苷A 80%丙酮 0.26±0.05a / 7.80±0.03b 0.49±0.01b 0.06±0.00b 0.28±0.00cb 0.19±0.00b 2.13±0.03b 0.89±0.01b 3.37±0.31c 0.39±0.02b 0.12±0.00b 9.69±0.24c 1.01±0.00b 99.13±0.43c 80%乙醇 0.23±0.00a / 7.74±0.27b 0.47±0.02b 0.11±0.00c 0.29±0.01c 0.24±0.01c 2.15±0.09b 0.90±0.03b 2.73±0.05b 0.36±0.00b 0.12±0.00b 4.52±0.19b 0.98±0.04b 95.88±2.12c 80%甲醇 0.22±0.00a / 7.48±0.05b 0.47±0.00b 0.06±0.00b 0.27±0.00b 0.23±0.00c 2.05±0.01b 0.87±0.01b 2.91±0.06cb 0.39±0.00b 0.11±0.00b 12.32±0.18d 0.94±0.00b 88.02±0.63b 水 0.29±0.01a 0.10±0.00 5.25±0.00a 0.17±0.01a 0.048±0.00a 0.20±0.00a 0.07±0.00a 1.46±0.00a 0.62±0.42a 1.02±0.00a 0.16±0.02a 0.07±0.00a 3.07±0.59a 0.22±0.05a 23.98±4.63a 注:不同小写字母表示同一列差异显著(P<0.05)。 表 3 赶黄草叶中活性成分、抗氧化活性和胰脂肪酶抑制活性相关性分析
Table 3 Correlation analysis of active components, antioxidant activity and pancreatic lipase inhibitory activity in P. chinense Pursh leaves
指标 没食子酸 原儿茶酸 儿茶素 表儿茶素 芦丁 异槲皮苷 山奈酚-3-O-
芸香糖苷紫云英苷 阿福豆苷 乔松素-7-O-
葡萄糖苷槲皮素 山奈酚 乔松素-7-O-
(3''-O-没食子酰基-
4'',6''-六羟基联
苯二甲酰基)-
β-葡萄糖苷乔松素 赶黄草苷A 总多酚 总黄酮 总原
花青素DPPH· ABTS+· FRAP 胰脂肪酶
抑制活性没食子酸 1 原儿茶酸 0.843 1 儿茶素 −0.788 −0.993** 1 表儿茶素 −0.81 −0.998** 0.996** 1 芦丁 −0.566 −0.52 0.549 0.492 1 异槲皮苷 −0.8 −0.980* 0.991** 0.978* 0.657 1 山奈酚-3-O-
芸香糖苷−0.945 −0.961* 0.939 0.942 0.654 0.952* 1 紫云英苷 −0.797 −0.991** .999** 0.992** 0.589 0.996** 0.947 1 阿福豆苷 −0.832 −0.998** 0.989* 0.998** 0.464 0.967* 0.947 0.984* 1 乔松素-7-O-
葡萄糖苷−0.691 −0.965* 0.971* 0.979* 0.341 0.931 0.855 0.959* 0.975* 1 槲皮素 −0.817 −0.992** 0.980* 0.994** 0.406 0.95 0.93 0.972* 0.998** 0.981* 1 山奈酚 −0.753 −0.980* 0.996** 0.984* 0.594 0.995** 0.924 0.997** 0.972* 0.959* 0.960* 1 乔松素-7-O-
(3''-O-没食子酰基-
4'',6''-六羟基联
苯二甲酰基)-
β-葡萄糖苷−0.584 −0.665 0.607 0.672 −0.256 0.505 0.563 0.574 0.709 0.729 0.75 0.54 1 乔松素 −0.803 −0.997** 0.999** 0.999** 0.523 0.986* 0.944 0.996** 0.995** 0.975* 0.988* 0.991** 0.64 1 赶黄草苷A −0.775 −0.991** 1.000** 0.995** 0.541 0.989* 0.931 0.998** 0.987* 0.974* 0.979* 0.997** 0.606 0.998** 1 总多酚 −0.773 −0.993** .996** 0.998** 0.47 0.974* 0.921 0.990** 0.994** 0.988* 0.991** 0.986* 0.672 0.998** 0.996** 1 总黄酮 −0.973* −0.941 0.908 0.919 0.611 0.916 0.994** 0.915 0.93 0.826 0.915 0.884 0.601 0.916 0.898 0.894 1 总原花青素 −0.93 −0.981* 0.959* 0.967* 0.587 0.959* 0.995** 0.963* 0.973* 0.897 0.961* 0.94 0.631 0.965* 0.953* 0.95 0.989* 1 DPPH· 0.851 1.000** −0.992** −0.997** −0.525 −0.980* −0.965* −0.991** −0.997** −0.961* −0.991** −0.979* −0.663 −0.996** −0.990* −0.991** −0.946 −0.983* 1 ABTS+· 0.728 0.976* −0.995** −0.983* −0.567 −0.989* −0.908 −0.994** −0.970* −0.966* −0.959* −0.999** −0.549 −0.989* −0.996** −0.987* −0.867 −0.928 0.974* 1 FRAP −0.949 −0.945 0.924 0.924 0.692 0.944 0.998** 0.934 0.928 0.826 0.907 0.911 0.519 0.927 0.915 0.901 0.993** 0.987* −0.949 −0.893 1 胰脂肪酶
抑制活性0.759 0.990* −0.998** −0.995** −0.511 −0.983* −0.92 −0.995** −0.988* −0.982* −0.982* −0.994** −0.625 −0.998** −0.999** −0.998** −0.887 −0.945 0.988* 0.995** −0.901 1 注:*表示在P<0.05水平上相关性显著,**表示在P<0.01水平上相关性显著。 -
[1] 中国科学院植物研究所. 中国高等植物科属检索表[M]. 北京:科学出版社, 1979:772−784. [Institute of Botany. Chinese academy of sciences[M]. Beijing:Science Press, 1979:772−784.] Institute of Botany. Chinese academy of sciences[M]. Beijing: Science Press, 1979: 772−784.
[2] 杜曦, 唐斌, 张青碧, 等. 赶黄草中没食子酸、槲皮素及β-谷甾醇的高效液相色谱测定法[J]. 环境与健康杂志,2011,28(4):358−359. [DU X, TANG B, ZHANG Q B, et al. Determination of gallic acid, quercetin and β-sitosterol in Penthorum chinense Pursh by high performance liquid chromatography[J]. Journal of Environment and Health,2011,28(4):358−359.] DU X, TANG B, ZHANG Q B, et al. Determination of gallic acid, quercetin and β-sitosterol in Penthorum chinense Pursh by high performance liquid chromatography[J]. Journal of Environment and Health, 2011, 28(4): 358−359.
[3] ZENG Q H, ZHANG X W, XU X L, et al. Antioxidant and anticomplement functions of flavonoids extracted from Penthorum chinense Pursh[J]. Food Function,2013,4(12):1811−1818. doi: 10.1039/c3fo60342c
[4] 覃俊媛, 孙晨, 彭成, 等. 赶黄草水煎液对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌生物膜形成的影响[J]. 中国抗生素杂志,2023,48(1):54−61. [QIN J Y, SUN C, PENG C, et al. Effect of Penthorum chinense Pursh decoction on biofilm formation of Staphylococcus aureus and methicillin-resistant Staphylococcus aureus[J]. Chinese Journal of Antibiotics,2023,48(1):54−61.] QIN J Y, SUN C, PENG C, et al. Effect of Penthorum chinense Pursh decoction on biofilm formation of Staphylococcus aureus and methicillin-resistant Staphylococcus aureus[J]. Chinese Journal of Antibiotics, 2023, 48(1): 54−61.
[5] CHEN Y F, LI T X, TAN P, et al. Kaempferol From Penthorum chinense Pursh attenuates hepatic ischemia/reperfusion injury by suppressing oxidative stress and inflammation through activation of the Nrf2/HO-1 signaling pathway[J]. Frontiers in Pharmacology,2022,13:857015. doi: 10.3389/fphar.2022.857015
[6] RAJAN L, PALANISWAMY D, MOHANKUMAR S K. Targeting obesity with plant-derived pancreatic lipase inhibitors:A comprehensive review[J]. Pharmacological Research,2020,155:104681. doi: 10.1016/j.phrs.2020.104681
[7] KUMAR A, CHAUHAN S. Pancreatic lipase inhibitors:The road voyaged and successes[J]. Life Sciences,2021,271:119115. doi: 10.1016/j.lfs.2021.119115
[8] ZIELINSKA-BLIZNIEWSKA H, SITAREK P, MERECZ-SADOWSKA A , et al. Plant extracts and reactive oxygen species as two counteracting agents with anti- and pro-obesity properties[J]. International Journal of Molecular Sciences, 2019, 20:4556.
[9] PÉREZRE-TORRES I, CASTREJÔN-TÉLLEZ V, SOTO M E, et al. Oxidative stress, plant natural antioxidants, and obesity[J]. International Journal of Molecular Sciences,2021,22:1786. doi: 10.3390/ijms22041786
[10] LI S, EGUCHI N, LAU H, et al. The Role of the Nrf2 signaling in obesity and insulin resistance[J]. International Journal of Molecular Sciences,2020,21(18):6973. doi: 10.3390/ijms21186973
[11] GUO W W, WANG X, CHEN X Q, et al. Flavonones from Penthorum chinense ameliorate hepatic steatosis by activating the SIRT1/AMPK pathway in HepG2 cells[J]. International Journal of Molecular Sciences,2018,19(9):2555. doi: 10.3390/ijms19092555
[12] LI X X, ZHAO W W, XIAO M, et al. Penthorum chinense Pursh extract attenuates non-alcholic fatty liver disease by regulating gut microbiota and bile acid metabolism in mice[J]. Journal of Ethnopharmacology,2022,294:115333. doi: 10.1016/j.jep.2022.115333
[13] 邓俊琳, 朱永清, 夏陈, 等. 绞股蓝中6种多酚化合物的HPLC检测及其醇提液的抗氧化活性[J]. 食品科学,2019,40(14):265−269. [DENG J L, ZHU Y Q, XIA C, et al. HPLC detection of six polyphenols in Gynostemma pentaphyllum and the antioxidant activity of its alcohol extract[J]. Food Science,2019,40(14):265−269.] DENG J L, ZHU Y Q, XIA C, et al. HPLC detection of six polyphenols in Gynostemma pentaphyllum and the antioxidant activity of its alcohol extract[J]. Food Science, 2019, 40(14): 265−269.
[14] 孙美玲, 冯晓光, 常希光, 等. 水晶冰菜总黄酮分级萃取及其抗氧化活性[J]. 北京农学院学报,2021,36(4):116−120. [SUN M L, FENG X G, CHANG X G, et al. Fractionated extraction and antioxidant activity of total flavonoids from Ice crystal[J]. Journal of Beijing University of Agriculture,2021,36(4):116−120.] SUN M L, FENG X G, CHANG X G, et al. Fractionated extraction and antioxidant activity of total flavonoids from Ice crystal[J]. Journal of Beijing University of Agriculture, 2021, 36(4): 116−120.
[15] JIA Z S, TANG M C, WU J M. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry,1999,64:555−559. doi: 10.1016/S0308-8146(98)00102-2
[16] 王伟, 布丽根·加冷别克, 胡晓东. 葡萄籽原花青素的提取工艺优化及其抗氧化活性研究[J]. 保鲜与加工,2020,20(6):101−108. [WANG W, BRIGAN GALENBECK, HU X D. Optimisation of extraction process of grape seed proanthocyanidins and its antioxidant activity[J]. Preservation and Processing,2020,20(6):101−108.] WANG W, BRIGAN GALENBECK, HU X D. Optimisation of extraction process of grape seed proanthocyanidins and its antioxidant activity[J]. Preservation and Processing, 2020, 20(6): 101−108.
[17] UMAR A. Antioxidant activities of ganotropic acid from Ganoderma tropicum in submerged culture[J]. Sydowia,2018,70:193−197.
[18] AWE F B, FAGBEMI T N, IFESAN, et al. Antioxidant properties of cold and hot water extracts of cocoa, Hibiscus flower extract, and ginger beverage blends[J]. Food Research Internationa,2013,52(1):490−495.
[19] ZHU J J, YANG J J, WU G J, et al. Comparative antioxidant, anticancer and antimicrobial activities of essential oils from Semen Platycladi by different extraction methods[J]. Industrial Crops and Products,2020,146:112206. doi: 10.1016/j.indcrop.2020.112206
[20] WANG R, WANG L, ZHANG L, et al. Solvents effect on phenolics, iridoids, antioxidant activity, antibacterial activity, and pancreatic lipase inhibition activity of noni (Morinda citrifolia L.) fruit extract[J]. Food Chemistry,2022,377:131989. doi: 10.1016/j.foodchem.2021.131989
[21] PAULA L A , EUGENIA P M , GALUCH M B, et al. Evaluation of effect of different solvent mixtures on the phenolic compound extraction and antioxidant capacity of bitter melon (Momordica charantia)[J]. Chemical Papers, 2018, 72:2945−2953.
[22] 张福娟, 苏靖昕, 王炜琪, 等. 花红果渣不同溶剂提取物的抗氧化成分及性能分析[J]. 粮食与油脂,2021,34(6):141−145. [ZHANG F J, SU J X, WANG W Q, et al. Antioxidant components and performance analysis of different solvent extracts from safflower pomace[J]. Grains and Oils,2021,34(6):141−145.] ZHANG F J, SU J X, WANG W Q, et al. Antioxidant components and performance analysis of different solvent extracts from safflower pomace[J]. Grains and Oils, 2021, 34(6): 141−145.
[23] 熊亮, 彭成. 基于中药质量标志物(Q-Marker)的基本条件研究益母草和赶黄草的Q-Marker[J]. 中草药,2016,47(13):9. [XIONG L, PENG C. Study on Q-Marker of Leonurus japonicus and Penthorum chinense Pursh Stems based on the basic conditions of quality marker (Q-Marker) of traditional Chinese medicine[J]. Chinese Herbal Medicine,2016,47(13):9.] XIONG L, PENG C. Study on Q-Marker of Leonurus japonicus and Penthorum chinense Pursh Stems based on the basic conditions of quality marker (Q-Marker) of traditional Chinese medicine[J]. Chinese Herbal Medicine, 2016, 47(13): 9.
[24] HUANG D D, JIANG Y, CHEN W S, et al. Evaluation of hypoglycemic effects of polyphenols and extracts from Penthorum chinense[J]. Journal of Ethnopharmacology,2015,163:256−263. doi: 10.1016/j.jep.2015.01.014
[25] DING Q C, JIN Z, DONG J H, et al. Bioactivity evaluation of pinocembrin derivatives from Penthorum chinense Pursh stems[J]. Natural Product Communications,2019,14(9):1934578−1987589.
[26] 贺晓华. 赶黄草抗氧化活性物质基础研究[D]. 长沙:湖南中医药大学, 2009. [HE X H. Study on material basis of antioxidant activity of Penthorum chinense Pursh[D]. Changsha:Hunan University of Traditional Chinese Medicine, 2009.] HE X H. Study on material basis of antioxidant activity of Penthorum chinense Pursh[D]. Changsha: Hunan University of Traditional Chinese Medicine, 2009.
[27] SCHAICH K M, TIAN X, XIE J. Hurdles and pitfalls in measuring antioxidant efficacy:A critical evaluation of ABTS, DPPH, and ORAC assays (Reprinted)[J]. Journal of Functional Foods,2015,18:782−796. doi: 10.1016/j.jff.2015.05.024
[28] GRANATO D, SHAHIDI F, WROLSTAD R, et al. Antioxidant activity, total phenolics and flavonoids contents:Should we ban in vitro screening methods?[J]. Food Chemistry,2018,264:471−475. doi: 10.1016/j.foodchem.2018.04.012
[29] LU Q, JIANG M H, JIANG J G. Isolation and identification of compounds from Penthorum chinense Pursh with antioxidant and antihepatocarcinoma properties[J]. Journal of Agricultural and Food Chemistry,2012,60(44):11097−103. doi: 10.1021/jf303755w
[30] MICHEL P, GRANICA S, ROSIŃSKA K, et al. Biological and chemical insight into Gaultheria procumbens fruits:A rich source of anti-inflammatory and antioxidant salicylate glycosides and procyanidins for food and functional application[J]. Food Function,2020,11(9):7532−7544. doi: 10.1039/D0FO01750G
[31] 王寒冬. 赶黄草总黄酮的提取纯化和抗氧化活性研究[D]. 成都:四川农业大学, 2018. [WANG H D. Extraction, purification and antioxidant activity of total flavonoids from Penthorum chinense Pursh[D]. Chengdu:Sichuan Agricultural University, 2018.] WANG H D. Extraction, purification and antioxidant activity of total flavonoids from Penthorum chinense Pursh[D]. Chengdu: Sichuan Agricultural University, 2018.
[32] ZHAO H F, DONG J J, LU J, et al. Effects of extraction solvent mixtures on antioxidant activity evaluation and their extraction capacity and selectivity for free phenolic compounds in barley (Hordeum vulgare L.)[J]. Journal of Agricultural and Food Chemistry,2006,54(19):7277−7286. doi: 10.1021/jf061087w
[33] MOKRANI A , MADANI K. Effect of solvent, time and temperature on the extraction of phenolic compounds and antioxidant capacity of peach (Prunus persica L.) fruit[J]. Separation & Purification Technology, 2016, 162:68−76.
[34] DAILEY A, VUONG Q V. Effect of extraction solvents on recovery of bioactive compounds and antioxidant properties from macadamia (Macadamia tetraphylla) skin waste[J]. Cogent Food & Agriculture,2015,1(1):1115646.
[35] 孙伟燕, 韩明丽. 中药抗氧化作用的研究进展[J]. 齐鲁药事,2010,29(3):161−163. [SUN W Y, HAN M L. Research progress on the antioxidant effects of traditional Chinese medicine[J]. Qilu Medicine,2010,29(3):161−163.] SUN W Y, HAN M L. Research progress on the antioxidant effects of traditional Chinese medicine[J]. Qilu Medicine, 2010, 29(3): 161−163.
[36] 吴红, 罗忠圣, 罗宗乾, 等. 贵州十七个产地刺梨抗氧化活性及抗氧化物质分析[J]. 北方园艺,2023(20):94−101. [WU H, LUO Z S, LUO Z Q, et al. Analysis of antioxidant activity and antioxidant substances of Rosa roxburghii Tratt from 17 producing areas in Guizhou[J]. North Horticulture,2023(20):94−101.] WU H, LUO Z S, LUO Z Q, et al. Analysis of antioxidant activity and antioxidant substances of Rosa roxburghii Tratt from 17 producing areas in Guizhou[J]. North Horticulture, 2023(20): 94−101.
[37] 黄莉莉, 巫永华, 徐朝渝, 等. 桑黄不同极性溶剂分步提取物功能成分与生物活性及相关性分析[J]. 粮食与油脂,2023,36(6):148−152. [HUANG L L, WU Y H, XU C Y, et al. Functional components, biological activity and correlation analysis of step-by-step extracts of different polar solvents from LIU Enqi. Sanghuang[J]. Grain and Oil,2023,36(6):148−152.] HUANG L L, WU Y H, XU C Y, et al. Functional components, biological activity and correlation analysis of step-by-step extracts of different polar solvents from LIU Enqi. Sanghuang[J]. Grain and Oil, 2023, 36(6): 148−152.
[38] SEO D B, JEONG H W, KIM Y J, et al. Fermented green tea extract exhibits hypolipidaemic effects through the inhibition of pancreatic lipase and promotion of energy expenditure[J]. British Journal of Nutrition,2017,117(2):177−186. doi: 10.1017/S0007114516004621
[39] GLISAN S L, GROVE K A, YENNAWER N H, et al. Inhibition of pancreatic lipase by black tea theaflavins:Comparative enzymology and in silico modeling studies[J]. Food Chemistry,2017,216:296−300. doi: 10.1016/j.foodchem.2016.08.052
[40] KIIMURA H, OGAWA S, AKIHIRO T, et al. Structural analysis of A-type or B-type highly polymeric proanthocyanidins by thiolytic degradation and the implication in their inhibitory effects on pancreatic lipase[J]. Journal of Chromatography A,2011,1218(42):7704−7712. doi: 10.1016/j.chroma.2011.07.024
[41] SUGIYAMA H, AKAZOME Y, SHOJI T, et al. Oligomeric procyanidins in apple polyphenol are main active components for inhibition of pancreatic lipase and triglyceride absorption[J]. Journal of Agricultural and Food Chemistry,2007,55(11):4604−4609. doi: 10.1021/jf070569k
[42] SUBANDI, UTAMIN P W, BROTOSUDARMO T H P. The activity of flavonoid isolates from Papaya (Carica papaya L.) seed as pancreatic lipase inhibitor[J]. IOP Conference Series:Materials Science and Engineering,2019,546(6):62031. doi: 10.1088/1757-899X/546/6/062031
[43] JAMAI K, DAOUDI N E, ELRHERABI A, et al. Medicinal plants and natural products to treat obesity through inhibiting pancreatic lipase:A review (2020-2022)[J]. Letters in Drug Design & Discovery,2023,20:1−20.
[44] SINGH M, THRIMAWITHANA T, SHUKLA R, et al. Inhibition of enzymes associated with obesity by the polyphenol-rich extracts of Hibiscus sabdariffa[J]. Food Bioscience,2022,50:101992. doi: 10.1016/j.fbio.2022.101992
[45] 陈季武, 胡斌, 赵实, 等. 天然黄酮类化合物清除DPPH·的构效关系[J]. 发光学报,2005(5):112−116. [CHEN J W, HU B, ZHAO S, et al. Constitutive relationship of natural flavonoids in scavenging DPPH·[J]. Journal of Luminescence,2005(5):112−116.] CHEN J W, HU B, ZHAO S, et al. Constitutive relationship of natural flavonoids in scavenging DPPH·[J]. Journal of Luminescence, 2005(5): 112−116.
[46] VANGOORI Y, DAKSHINAMOORTH A, KAVIMANI S. Prominent pancreatic lipase inhibition and free radical scavenging activity of a myristica fragrans ethanolic extract in vitro. Potential role in obesity treatment[J]. Medica,2019,14(3):254−259.
-
期刊类型引用(3)
1. 徐柠檬,董仕豪,秦粉,申开泽,李为兰,华燕,郭磊. 基于UPLC-Q-TOF-MS/MS和网络药理学探讨天麻抗炎的物质基础及其作用机制. 食品科学. 2025(04): 30-43 .  百度学术
百度学术
2. 刘聪,王吉力特,孙义,苏日古格,马捷,张凡,郭淑文. 蜜瓜籽不同溶剂提取物活性成分及抗氧化能力分析. 中国瓜菜. 2024(11): 101-106 .  百度学术
百度学术
3. 竹娟,王译晗,陈立莉,曲文鑫,刘荣. 芍药花提取物中黄酮的测定及其体外抗氧化和降脂活性研究. 天然产物研究与开发. 2024(11): 1838-1844+1899 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:
 下载:
下载:



