Immunomodulatory Function and Safety Evaluation of Compound Preparation Containing Ganoderma lucidum Polysaccharides
-
摘要: 目的:评价含灵芝多糖的复方制剂免疫调节功能及安全性。方法:参照保健食品检验与评价技术规范(2003版),通过测定正常小鼠淋巴细胞增殖能力、耳肿胀程度、溶血空斑数、吞噬百分率和吞噬指数、自然杀伤(NK)细胞活性,分别从细胞免疫、体液免疫及非特异性免疫综合评价含灵芝多糖的复方制剂免疫调节功能;通过小鼠急性经口毒性试验、细菌回复突变(Ames)试验和大鼠30 d喂养试验综合评价其安全性。结果:在细胞免疫试验中,受试物对刀豆蛋白A(ConA)诱导的淋巴细胞增殖能力和耳肿胀程度均无显著影响(P>0.05);在体液免疫试验中,受试物低剂量组(0.17 g/kg)、中剂量组(0.33 g/kg)、高剂量组(1.00 g/kg)分别使小鼠抗体生成细胞数目提高10.98%、12.08%、17.63%(P<0.05);在非特异性免疫试验中,受试物中剂量组、高剂量组能显著提高单核巨噬细胞的吞噬能力(P<0.05)和NK细胞活性(P<0.01)。受试物对雌雄小鼠急性经口剂量最大耐受量(MTD)均大于42.56 g/kg,属无毒级物质;Ames试验结果阴性,未见致突变作用;大鼠30 d喂养试验中,受试物各剂量组对大鼠体质量、周食物利用率、血常规指标、血液生化学指标及主要脏器系数均未产生显著影响(P>0.05),组织学检查未发现明显病理变化。结论:含灵芝多糖的复方制剂可以调节小鼠免疫功能,作为保健食品食用是安全的。Abstract: Objective: To evaluate the immunomodulatory function and safety of compound preparation containing Ganoderma lucidum polysaccharides. Methods: According to the Technical Standards for Testing and Assessment of Health Food (2003 Edition), the immunomodulatory function of compound preparation containing Ganoderma lucidum polysaccharides was evaluated comprehensively from cellular immunity, humoral immunity and non-specific immunity by measuring the ability of lymphocyte proliferation, degree of ear swelling, number of hemolytic plaques, phagocytic percentage, phagocytic index and natural killer (NK) cells activity in normal mice. Its safety was evaluated comprehensively by acute oral toxicity test in mice, Ames test and 30 d feeding test in rats. Results: In cellular immunity test, the tested substance had no significant effect on lymphocyte proliferation induced by concanavalin A and degree of ear swelling (P>0.05). In the humoral immunity test, the low dose group (0.17 g/kg), the middle dose group (0.33 g/kg) and the high dose group (1.00 g/kg) could increase the level of antibody-producing cells by 10.98%, 12.08%, 17.63% (P<0.05). In the non-specific immunity test, the middle dose group and the high dose group could significantly increase the phagocytosis ability of mononuclear macrophages (P<0.05) and the activity of NK cells (P<0.01). The maximum tolerance dose (MTD) of the tested substance to the acute oral dose of both male and female mice was more than 42.56 g/kg, which belonged to non-toxic substances. The results of Ames test were negative and no mutagenicity was found. In the 30 d feeding test, each dose group had no significant effect on body weight, weekly food utilization rate, blood routine index, blood biochemical index and main organ coefficient (P>0.05), and no obvious pathological changes were found by histological examination. Conclusion: Compound preparation containing Ganoderma lucidum polysaccharides had a positive effect on immunomodulatory function in mice, and it had a good safety as a health food.
-
随着社会的发展,我国人口老龄化、亚健康人群年轻化态势逐渐严峻[1],人们对于非疾病人群的预防保健愈加重视,而增强免疫力是预防疾病的关键[2]。据国际健康策略和管理咨询机构Lewin集团的一项循证研究显示,食用保健食品可以调节机体机能,提高人体抵御疾病的能力[3]。在中国及亚洲许多地区,天然中草药具有多年食用历史或药用历史。然而天然中草药存在口感差、携带和使用不便等缺点[4],为克服这些缺点,本课题组以中医理论为指导进行组方配比筛选,利用减压蒸馏、喷雾干燥等技术制备了一种含灵芝多糖及灵芝酸A的复方制剂,具有整体调理、相互协同的保健功效。研究表明,多糖能在免疫器官、免疫细胞、免疫因子多层次进行免疫调节[5],是一种较为公认的天然免疫调节剂。本方主材灵芝是药食同源的典型代表之一,《神农本草经》载:灵芝“保神,益精气,坚筋骨,好颜色,久服轻身不老延年。”其主要生物活性物质是多糖类和三萜类,2020版《中国药典》对灵芝成分的含量测定包括灵芝多糖、灵芝三萜及甾醇,日本则以灵芝酸的含量为质控标准,本制剂按保健食品产品技术要求制定总多糖和灵芝酸A为标志性成分。Jin等[6]研究表明灵芝多糖可以增强大鼠免疫力和抗氧化活性,Pan等[7]报道了灵芝酸A可通过JAK-STAT3信号通路显著抑制酪氨酸磷酸化,能有效缓解神经炎症和阿尔茨海默氏细胞衰老,在人体免疫中发挥重要的药理学作用。薏苡仁多糖是薏苡仁发挥药理活性的重要物质基础,它通过改善先天免疫细胞的募集并刺激准确有效的免疫反应以消除外部生物和受损细胞来缓解结肠炎[8−9]。茯苓多糖是是茯苓的主要药用活性成分,可以增强体液免疫、细胞免疫及黏膜免疫[10−11]。其他中草药如白术[12−13]、菟丝子[14−15]、黄精[16−17]、麦冬[18−19]、甘草[20−21]、枸杞子[22−23]、五味子[24−25]、菊花[26−27]等皆含有丰富的活性多糖,均被报道具有扶正固体、调节免疫的功效。
在大健康时代背景下,这些中草药作为保健食品原料得到广泛的开发和利用。由于复方制剂成分复杂,其如何发挥功效尚不明确,且预防保健是一个长期缓慢的过程,在长期使用过程中可能会出现一些不良反应或毒副作用,有时还会出现危及生命的并发症[28]。因此本研究根据《保健食品检验与评价技术规范》(2003版)[29]有关要求,进行较为系统的评价含灵芝多糖的复方制剂的免疫调节功能及安全性,以期为其合理安全应用提供科学数据支持。
1. 材料与方法
1.1 材料与仪器
灵芝、薏苡仁、茯苓、白术、菟丝子、黄精、麦冬、甘草、枸杞子、五味子、菊粉 天方健(中国)药业有限公司;无特定病原体(SPF)级昆明小鼠 雌雄各10只,体质量18~20 g,购自湖南斯莱克景达试验动物有限公司,试验动物生产许可证号:SCXK(湘)2016-0002;SPF级SD大鼠 雌雄各44只,体质量75~90 g,购自北京维通利华试验动物技术有限公司,试验动物生产许可证号:SCXK(京)2016-0006;SPF级Balb/C小鼠 雄性120只,体质量18~20 g,购自南方医科大学实验动物中心,试验动物生产许可证号:SCXK(粤)2016-0041;试验动物环境 温度20~24 ℃,相对湿度40%~70%,12 h的明暗周期的屏障系统(使用许可证号:SYXK(鄂)2014-0077,使用证明号:00270498),动物试验经武汉药品医疗器械检验所试验动物伦理委员会审批,符合试验动物伦理学要求;Ames试验标准菌株 鼠伤寒沙门氏菌组氨酸缺陷型TA97、TA98、TA100、TA102,购自上海康成生物科技有限公司,批号分别为5281D、5282D、5249D、5280D;小鼠淋巴瘤细胞(YAC-1) 广州暨南生物医药研究开发基地有限公司自传代;哺乳动物肝微粒体酶系统(肝S9) Moltox公司;叠氮化钠 Amresco公司;2-氨基笏、敌克松、二甲基亚砜 Sigma公司;1,8-二羟基蔥醌 Aladdin公司;2,4-二硝基氟苯(DNFB) 上海麦克林生化科技有限公司;刀豆蛋白A、补体、吉姆萨染液、4%多聚甲醛、鸡红细胞、绵羊红细胞 北京索莱宝科技有限公司;SA缓冲液 上海源叶生物科技有限公司;胎牛血清、乳酸脱氢酶(LDH)细胞毒性检测试剂盒 碧云天生物技术有限公司。
BS-820型全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;XT-2000i型全自动动物血液细胞分析仪 日本希森美康公司;DM2500型显微照相仪、EG1150型包埋机、RM2265型全自动切片机、HI1220型烤片机、ASP200S型真空组织脱水机、EG1150C型包埋冷冻台、HI1210型摊片机 Leica公司;Elx800型酶标仪 Bio-Tek公司;BS 110S型电子天平 北京赛多利斯天平有限公司;PB 302型电子天平 瑞士梅特勒公司;UV-2600型分光光度计 Shimadzu公司;PHS-3C型pH计 成都世纪方舟科技有限公司;LT-BIX300L型低温生化培养箱 立德泰勀(上海)科学仪器有限公司;IM1200型全自动细胞计数仪 艾力特生物科技(上海)有限公司;ECLIPSE-TI2型倒置显微镜 尼康仪器有限公司;SW-CJ-1F型标准型净化工作台 苏州吴江华夏空调净化设备厂;YA28X6T/8型高压灭菌锅 宁波甬安医疗器械制造有限公司;DHG-9053A型鼓风干燥箱、DK-24型恒温水浴锅 上海精宏试验设备有限公司;TS-110X50型恒温摇床 上海天呈科技有限公司;H-1850R型台式高速冷冻离心机 湖南湘仪试验仪器开发有限公司。
1.2 实验方法
1.2.1 含灵芝多糖的复方制剂的制备
将检验合格的灵芝、薏苡仁、茯苓、白术、菟丝子、黄精、麦冬、甘草、枸杞子、五味子按质量比16:8:8:5:5:5:1:0.5:0.5:0.5称量并投入提取罐内,加入10倍的水煎煮提取2 h,滤网过滤后收集滤液,滤渣重新加15倍的水煎煮4 h,收集滤液,合并两次滤液,旋转蒸发真空浓缩至固形物质量浓度为(35±5)%。浓缩液加入50倍质量的菊粉,搅拌均匀后投入真空带式干燥机,干燥物料经粉碎后过80目筛,即得含灵芝多糖的复方制剂。主要功效成分及含量:采用苯酚-硫酸法[30]测得总多糖含量≥14.00 mg/g,采用液质联用质谱分析(LC-MS/MS)[31]测得灵芝酸A含量≥0.25 mg/g。
1.2.2 急性经口毒性试验(最大耐受量试验)
称取受试物28.37 g,用蒸馏水溶解至40.00 mL,得到最大使用质量浓度为0.71 g/mL的供试液。取SPF级昆明种小鼠雌雄各10只,适应性饲养一周后,灌胃前禁食过夜但不禁水,次日按20 mL/kg体积分三次灌胃给予上述供试液,每次间隔4 h,一日内总剂量为42.56 g/kg,相当于人摄入量的1290倍(以每日口服2 g、体质量60 kg计,折算剂量则为0.03 g/kg)。给药后雌雄小鼠分笼饲养,连续观察14 d,记录小鼠的一般状况、中毒症状、死亡状况等[32]。
1.2.3 Ames试验(平板渗入法)
根据受试物毒性测定结果,设5000.00、1000.00、200.00、40.00、8.00 μg/皿5个剂量组,同时设置溶剂对照(DMSO)、自发回变对照(阴性对照)和阳性对照。阳性对照采用敌克松、叠氮化钠、2-氨基芴、1-8二羟基蒽醌,剂量分别为50.00、2.50、10.00、50.00 μg/皿。用经过生物学鉴定合格的Ames试验标准菌株TA97、TA98、TA100、TA102,在加和不加肝S9活化系统条件下,分别对受试物做平板渗入法Ames试验。各菌株每个剂量组做3个平行皿,37 ℃培养48 h,计算平均回变菌落数。在加或不加S9活化系统条件下,若受试物的回变菌落数是自发回变菌落数的2倍以上并有剂量-反应关系者则定为阳性。阴性结果需至少做2次测试,阳性结果至少做3次测试[33]。
1.2.4 30 d喂养试验
选取SPF级SD大鼠88只,雌雄各半,按体质量随机分为4组,每组22只。根据人体日推荐量的100、50、25倍,受试物设3个剂量组,分别为3.30、1.65、0.83 g/kg,另设阴性对照组,给予等量蒸馏水。各组每天按10 mL/kg体积灌胃1次,连续30 d。动物自由饮食和饮水,每天观察并记录大鼠的一般表现,每周称体质量及进食量,通过公式(1)计算每周食物利用率。试验末期,将大鼠禁食不禁水16 h,腹主动脉采血测定血常规指标血红蛋白(Hb)、红细胞计数(RBC)、白细胞计数(WBC)、白细胞分类计数(DC)及血生化指标丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALB)、总蛋白(TP)、尿素氮(BUN)、肌酐(Cr)、三酰甘油(TG)、总胆固醇(TCHO)、血糖(GLU),计算白蛋白/球蛋白比值(ALB/GIO)。腹主动脉放血处死,进行大体解剖,肉眼观察有无异常,取肝、肾、脾、睾丸(卵巢)等脏器进行称量,计算脏体比值,并对肝、肾、脾、胃、肠、睾丸(卵巢)等脏器固定保存,进行组织病理学检查[34]。
A(%)=mM×100 (1) 式中:A表示周食物利用率,%;m表示每周体质量增量,g;M表示每周饲料摄入量,g。
1.2.5 免疫功能评价试验
1.2.5.1 试验分组与处理
选用SPF级雄性Balb/c小鼠120只,适应性饲养一周后,按体质量随机分为12组,每组10只。其中4组小鼠用于迟发型变态反应试验,测定耳肿胀程度;4组用于抗体生成细胞检测试验和腹腔巨噬细胞吞噬鸡红细胞试验,分别测定溶血空斑数和吞噬百分率及吞噬指数;4组小鼠用于脾淋巴细胞转化试验和NK细胞活性测定试验,分别测定淋巴细胞增殖能力和NK细胞杀伤活性。根据人体日推荐量的5、10、30倍,受试物设3个剂量组,分别为0.17、0.33、1.00 g/kg,另设阴性对照组,给予等量蒸馏水。受试物每日经口一次给予,灌胃体积为10 mL/kg,连续给药30 d后检测各项指标。动物自由饮食和饮水,每周根据体质量变化调整给药量。
1.2.5.2 脾淋巴细胞转化试验
末次给药后1 h,颈椎脱臼处死小鼠,无菌取脾脏,研磨制备单细胞悬液,调整细胞密度为3×106个/mL。将细胞悬液分为2组,一组加入ConA溶液(终质量浓度为7.50 μg/mL)作为试验孔,另一组作为对照,每组2个重复。于恒温培养箱内5% CO2、37 ℃孵育培养72 h。噻唑蓝(MTT)法在波长570 nm处酶标仪检测每孔的吸光度(A),脾淋巴细胞的增殖能力为ConA组与对照组吸光度差值[35]。
1.2.5.3 迟发型变态反应(DTH)
小鼠给予受试物30 d后,腹部脱毛约3 cm×3 cm,均匀涂抹50.00 μL 2,4-二硝基氟苯(DNFB)溶液(质量浓度10.00 mg/mL)致敏。致敏后第5 d,用DNFB溶液10.00 μL均匀涂抹于小鼠右耳的两面进行攻击,攻击后24 h颈椎脱臼处死小鼠,剪下左右耳壳,用打孔器取下直径8.00 mm的耳片,称重。用左右耳质量之差表示DTH的程度[36]。
1.2.5.4 抗体生成细胞检测(改良法)
小鼠给予受试物30 d后,腹腔注射2.00%体积分数的压积绵羊红细胞(SRBC)悬液0.20 mL,免疫4 d后颈椎脱臼处死小鼠,取脾脏并研磨制备成单细胞悬液,调整细胞密度为5×106个/mL。将10.00%体积分数的SRBC 50.00 μL、脾细胞悬液20.00 μL与0.50%质量分数的琼脂糖溶液500.00 μL混匀,倾倒于琼脂糖玻片上,待凝固后放入恒温培养箱中孵育1.5 h,加入SA缓冲液稀释十倍的补体500.00 μL,继续孵育1.5 h,计数溶血空斑数。结果用空斑数/106脾细胞表示[37]。
1.2.5.5 小鼠腹腔巨噬细胞吞噬鸡红细胞试验
小鼠给予受试物30 d后,腹腔注射2.00%体积分数的压积SRBC悬液0.20 mL,免疫4 d后颈椎脱臼处死小鼠,每只腹腔注射4.00 mL Hank’s溶液,揉按腹腔20次,腹腔壁开口后吸取0.50 mL腹腔洗液与等体积1.00%体积分数鸡血红细胞悬液混匀。吸取混合液0.50 mL滴入玻片的琼脂圈内,置于恒温培养箱中孵育20 min,用生理盐水将未贴壁的细胞洗掉,4.00%体积分数的多聚甲醛溶液固定1 min,吉姆萨液染色15 min。蒸馏水冲洗、晾干,用40×显微镜计数巨噬细胞和被吞噬的鸡血红细胞数,按照公式(2)和(3)计算吞噬百分率和吞噬指数[38]。
W(%)=n1n0×100 (2) T=n2n0 (3) 式中:W表示吞噬百分率,%;T表示吞噬指数;n1表示吞噬鸡血红细胞的巨噬细胞数;n2表示被吞噬的鸡红细胞总数;n0表示计数的巨噬细胞数。
1.2.5.6 NK细胞活性测定(乳酸脱氢酶测定法)
将对数生长期的靶细胞YAC-1消化,调整细胞密度为4×105个/mL。小鼠给予受试物30 d后,颈椎脱臼处死小鼠,无菌取脾脏,研磨制备单细胞悬液,调整细胞密度为2×107个/mL。取靶细胞和效应细胞(脾细胞)各100.00 μL加入到96孔培养板内,作为反应孔。靶细胞自然释放孔加靶细胞和培养液各100.00 μL,靶细胞最大释放孔加靶细胞和1.00%体积分数的NP40各100.00 μL。上述各试验组均设置3个平行孔,恒温培养箱培养4 h,培养板低速离心5 min(1000 r/min,离心半径6 cm),每孔吸取上清100.00 μL转至平底的96孔培养板内。利用LDH检测试剂盒,490 nm检测每孔的A。按照公式(4)计算NK细胞活性[39]。
S(%)=A1−A0A−A0×100 (4) 式中:S表示细胞活性,%;A1表示反应孔吸光度;A0表示自然释放孔吸光度;A表示最大释放孔吸光度。
1.3 数据处理
采用SPSS 19.0进行统计分析,计量数据用平均值±标准差(¯x±s)表示,若方差齐,组间比较采用单因素方差分析;若方差不齐,采用秩和检验进行统计分析。P<0.05为差异有统计学意义。
2. 结果与分析
2.1 急性经口毒性试验
受试物给予小鼠灌胃后,14 d观察期内小鼠饮食活动和大小便正常,生长良好,未发现明显中毒症状和死亡,体重增加,体重变化见表1。试验结束后解剖小鼠进行大体观察,心、肝、肾、脾、肺、肠、胃、性腺等主要脏器未见明显异常。结果表明,受试物对雌雄小鼠最大耐受剂量(MTD)超过42.56 g/kg,其剂量相当于人体推荐用量的1290倍。根据《保健食品检验与评价技术规范》急性毒性剂量分级标准,含灵芝多糖的复方制剂属于无毒物质。
表 1 含灵芝多糖的复方制剂急性经口毒性试验(n=10)Table 1. Acute oral toxicity test results of compound preparation containing Ganoderma lucidum polysaccharides in mice (n=10)性别 初体重(g) 一周体重(g) 末体重(g) 死亡数(只) MTD(g/kg) 雄 20.96±0.80 30.71±2.96 35.85±4.98 0 >42.56 雌 22.06±0.97 29.06±1.15 33.14±2.45 0 >42.56 2.2 Ames试验
Ames试验是利用营养缺陷型鼠伤寒沙门氏菌来检测受试物的致突变作用。营养缺陷型菌株自身不能合成组氨酸,若在无组氨酸培养基上不能生长,仅有少数自发回复突变的细菌生长,而致突变物可使营养缺陷型菌株诱导突变为野生型菌株,野生型菌株可自身合成组氨酸,因此在无组氨酸培养基上可见大量细菌生长。许多外源性物质是间接诱变剂,需要经过代谢活化作用才转变为致突变物,因此在试验中加入哺乳动物肝微粒体酶系统(肝S9)来模拟体内环境,提高检测的灵敏度[33]。表2结果显示,在未加肝S9活化系统条件下,TA97、TA98、TA100、TA102自发回变组(阴性对照)的回变菌落数分别157、42、149、263 CFU/皿,受试物各剂量组均未引起四种测试菌株的回变菌落数明显增加,也没有剂量-反应关系;溶剂对照组也未发现回变菌落数明显改变,表明溶剂是安全的;而四种菌株的阳性诱变剂组的回变菌落数分别对应为1620、1160、2469、885 CFU/皿,远大于自发回变组的回变菌落数,表明试验系统有效;在添加肝S9活化系统条件下试验结果与未添加肝S9活化系统试验结果一致。表3的重复试验结果与表2的试验结果一致。因此,根据Ames试验结果判断标准,含灵芝多糖的复方制剂没有致突变作用。
表 2 含灵芝多糖的复方制剂第一次Ames试验回变菌落数(n=3)Table 2. Number of revertant colonies in the first Ames test of compound preparation containing Ganoderma lucidum polysaccharides (n=3)组别 剂量
(μg/皿)TA97(CFU/皿) TA98(CFU/皿) TA100(CFU/皿) TA102(CFU/皿) −S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 含灵芝多糖的复方制剂 5000 154±6 150±13 41±11 43±5 155±5 145±7 258±14 271±16 1000 155±7 161±4 42±7 46±3 143±7 142±10 273±16 266±7 200 161±7 145±16 42±2 46±1 140±2 149±5 258±17 265±15 40 160±7 165±16 43±3 46±2 146±6 144±6 263±5 263±13 8 146±6 145±5 42±6 44±1 148±8 151±9 261±19 264±5 自发回变 157±8 150±22 42±9 42±5 149±12 142±10 263±13 264±9 溶剂对照 142±12 148±19 42±3 42±6 152±8 154±8 266±13 276±11 叠氮化钠 2.5 2469±63 2-氨基芴 10 1600±51 1140±46 2310±84 敌克松 50 1620±33 1160±95 885±28 1-8二羟基蒽醌 50 1150±90 表 3 含灵芝多糖的复方制剂第二次Ames试验回变菌落数(n=3)Table 3. Number of revertant colonies in the second Ames test of compound preparation containing Ganoderma lucidum polysaccharides (n=3)组别 剂量
(μg/皿)TA97(CFU/皿) TA98(CFU/皿) TA100(CFU/皿) TA102(CFU/皿) −S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 含灵芝多糖的复方制剂 5000 146±16 169±12 37±7 38±3 135±8 140±12 239±11 250±27 1000 161±8 155±5 41±4 37±4 155±4 142±14 255±28 263±33 200 155±12 152±18 37±8 40±10 139±10 137±10 254±6 265±5 40 154±11 161±13 43±4 39±6 143±11 152±15 263±7 251±3 8 161±8 155±9 37±4 43±6 141±2 141±5 263±10 253±16 自发回变 150±15 163±8 41±6 38±2 146±8 142±13 272±10 246±8 溶剂对照 153±5 157±9 36±9 37±5 154±9 145±13 264±14 269±19 叠氮化钠 2.5 2426±80 2-氨基芴 10 1569±53 1055±90 2463±36 敌克松 50 1622±69 1063±59 843±56 1-8二羟基蒽醌 50 989±86 2.3 30 d喂养试验
2.3.1 一般状况观察
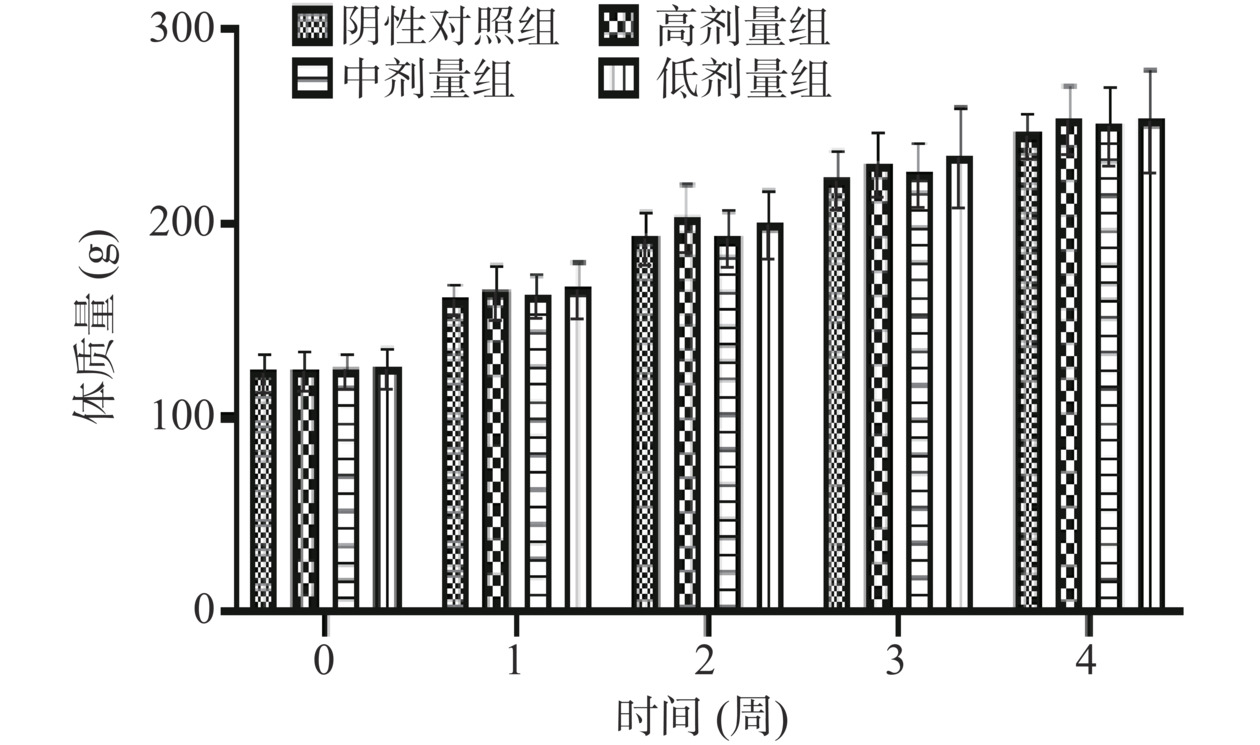
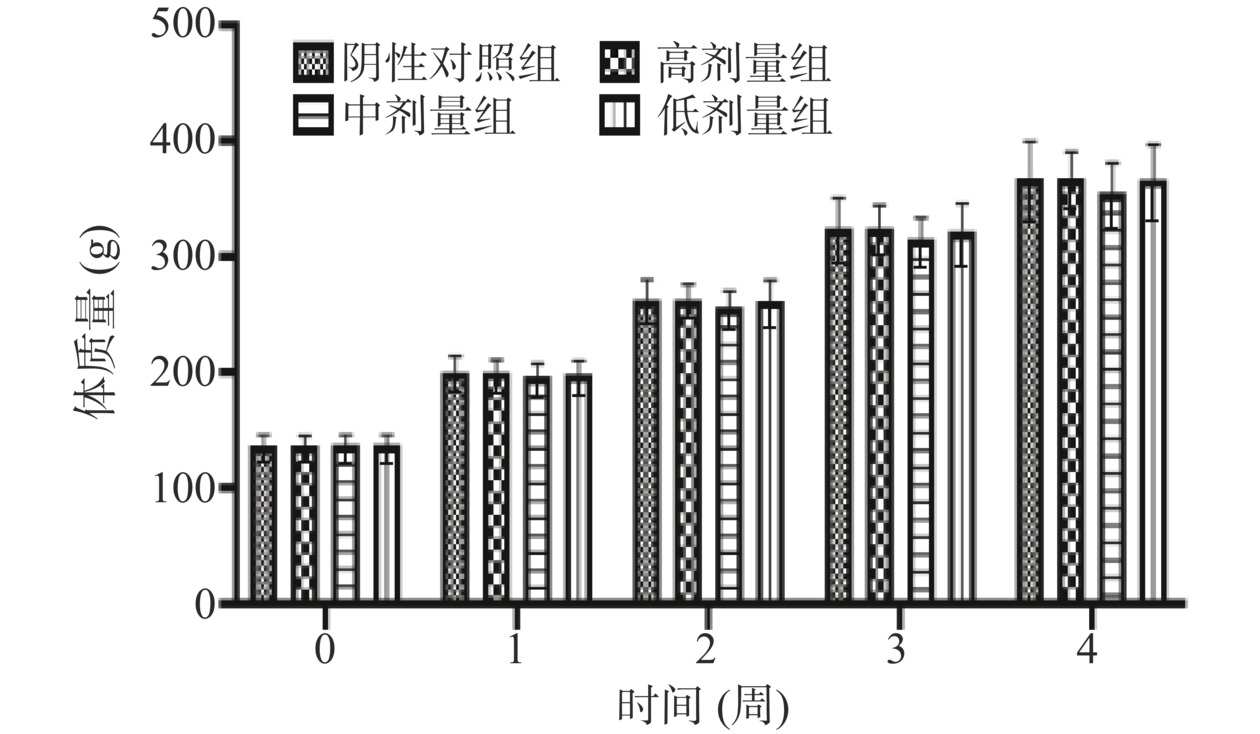
在30 d喂养期间,各剂量组动物健康状况良好,饮食排泄正常,未观察到中毒症状,无死亡。如图1~图2所示,受试物各剂量组大鼠每周体质量与阴性对照组相比,差异均无统计学意义(P>0.05)。周食物利用率结果见表4,受试物各剂量组的雌性及雄性大鼠周食物利用率与阴性对照组对应性别大鼠的周食物利用率相比,差异亦无统计学意义(P>0.05)。上述结果表明含灵芝多糖的复方制剂对大鼠体质量、周食物利用率及一般状况方面没有显著影响。
表 4 含灵芝多糖的复方制剂对大鼠周食物利用率的影响(n=11,%)Table 4. Effect of compound preparation containing Ganoderma lucidum polysaccharides on weekly food utilization rate in rats (n=11, %)性别 时间 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 第1周 34.00±2.10 37.30±6.30 35.30±3.30 37.50±5.70 第2周 27.90±8.10 30.70±9.40 25.80±8.20 27.00±10.40 第3周 21.50±12.30 21.20±10.10 25.30±8.70 25.60±14.70 第4周 17.00±6.40 16.60±7.00 18.60±4.00 13.30±3.60 雄性 第1周 52.00±4.20 50.80±3.10 49.90±1.90 50.70±3.50 第2周 37.40±5.30 39.40±2.60 36.90±4.40 38.80±6.70 第3周 36.10±10.20 37.90±6.40 34.70±7.80 36.40±4.00 第4周 25.00±3.30 25.30±8.60 23.40±4.10 25.60±6.10 2.3.2 血常规指标
试验末期,采抗凝血检测白细胞计数(WBC)及白细胞分类(中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞计数(RBC)、血红蛋白浓度(Hb)等血常规指标。由于大鼠血液学(血常规和血液生化)指标受到动物品系、年龄、来源、饲养环境、取样方法、取样部位、检测仪器与方法、麻醉剂使用等众多因素影响,不同实验室之间动物的相关生物学指标都会有所差异。如表5所示,受试物中剂量组雌性大鼠WBC为2.04×109/L,中剂量组雌性大鼠单核细胞比例为3.87%,高剂量组雌性大鼠Hb为128.50 g/L,虽然与阴性对照组雌性大鼠对应的指标相比均有统计学差异(P<0.05),但这些差异的剂量效应关系不明显,且数值仍处于SD大鼠正常参考区间内(雌性WBC:0.80×109/L~10.60×109/L;单核细胞比例:0.90%~18.00%;Hb:110.00~165.00 g/L)[40],可以认为这种统计学差异没有临床意义。因此各实验室应该建立本实验室的参考值区间,为结果评判提供参考。其余指标的差异均无统计学意义(P>0.05)。
表 5 含灵芝多糖的复方制剂对大鼠血常规指标的影响(n=11)Table 5. Effect of compound preparation containing Ganoderma lucidum polysaccharides on hematological indexes in rats (n=11)性别 血常规指标 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 WBC(109/L) 3.06±0.88 2.61±0.68 2.04±0.64** 3.41±1.19 中性粒细胞(%) 22.18±9.59 21.90±5.57 22.03±7.80 21.16±7.92 淋巴细胞(%) 73.31±9.53 72.92±4.24 71.29±7.14 73.61±8.48 单核细胞(%) 2.44±1.02 2.94±1.15 3.87±2.03* 2.95±1.09 嗜酸性粒细胞(%) 2.07±0.82 2.25±1.19 2.51±1.20 2.28±0.68 嗜碱性粒细胞(%) 0.00±0.00 0.00±0.00 3.13±10.24 0.00±0.00 RBC(1012/L) 6.98±0.22 6.73±0.36 7.02±0.38 6.95±0.37 Hb(g/L) 133.50±2.90 128.50±4.10* 131.50±6.40 133.10±4.00 雄性 WBC(109/L) 4.36±1.18 4.77±1.52 4.29±1.15 4.89±1.57 中性粒细胞(%) 19.26±5.10 20.05±7.37 19.43±6.17 18.02±6.04 淋巴细胞(%) 76.26±5.35 74.74±7.28 75.43±5.48 76.92±5.67 单核细胞(%) 2.68±1.01 3.38±1.37 3.60±1.31 3.50±1.40 嗜酸性粒细胞(%) 1.79±0.60 1.84±0.89 1.55±0.49 1.56±0.43 嗜碱性粒细胞(%) 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 RBC(1012/L) 7.10±0.35 7.06±0.29 7.12±0.42 7.21±0.29 Hb(g/L) 135.40±4.70 136.30±5.00 134.90±5.50 136.80±5.10 注:与阴性对照组比较,*P<0.05,**P<0.01;表6同。 2.3.3 血液生化学指标
上文提到,不同实验室之间的血液生化学指标也受各种因素影响而有所差异。表6所示,受试物各剂量组与阴性对照组相比,雌性大鼠高剂量和中剂量组ALT分别下降5.53、4.70 U/L,高、中、低三个剂量组AST分别下降27.97、20.85、24.25 U/L,高剂量组ALB下降1.40 g/L,高剂量和中剂量组TP分别下降3.77、3.61 g/L;雄性大鼠中、低剂量组BUN分别上升0.83、1.11 mmol/L。虽然与阴性对照组大鼠对应的指标相比均有统计学差异(P<0.05),但这些差异的剂量效应关系不明显,且数值仍处于SD大鼠正常参考区间内(雌性ALT:6.00~114.00 U/L;AST:37.00~205.00 U/L;ALB:29.00~48.00 g/L;TP:54.00~85.00 g/L。雄性BUN:4.63~10.32 mmol/L)[40],可以认为这种统计学差异没有临床意义。其余指标的差异均无统计学意义(P>0.05)。
表 6 含灵芝多糖的复方制剂对大鼠血液生化学指标的影响(n=11)Table 6. Effect of compound preparation containing Ganoderma lucidum polysaccharides on blood biochemical indexes in rats (n=11)性别 生化学指标 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 ALT(U/L) 31.93±4.62 26.40±2.45** 27.23±4.81* 31.09±5.72 AST(U/L) 143.12±21.55 115.15±11.92** 122.27±28.62* 118.87±11.58** ALB(g/L) 31.47±1.66 30.07±1.29* 30.18±1.60 30.88±1.77 TP(g/L) 58.24±3.93 54.47±1.79** 54.63±2.25* 57.33±3.94 BUN(mmol/L) 5.98±0.79 6.58±1.18 6.27±1.07 5.89±0.37 Cr(μmol/L) 29.89±3.01 29.02±3.01 28.33±2.35 29.00±3.07 TG(mmol/L) 0.54±0.33 0.71±0.45 0.50±0.18 0.80±0.28 TCHO(mmol/L) 2.04±0.54 2.01±0.20 1.90±0.28 2.10±0.36 GLU(mmol/L) 5.52±0.79 5.86±0.60 5.55±0.67 6.81±1.53 ALB/GIO 1.18±0.07 1.23±0.05 1.24±0.07 1.17±0.08 雄性 ALT(U/L) 31.35±4.21 32.82±6.83 32.10±3.61 32.04±4.80 AST(U/L) 119.19±22.90 124.36±24.51 114.66±18.91 125.14±22.51 ALB(g/L) 30.07±1.46 30.77±1.94 30.40±2.07 30.39±2.03 TP(g/L) 58.95±3.03 61.09±5.72 60.08±5.52 59.78±4.82 BUN(mmol/L) 5.22±0.80 5.34±0.98 6.05±0.97* 6.33±0.91** Cr(μmol/L) 25.89±2.91 26.24±2.67 25.64±2.87 26.98±2.93 TG(mmol/L) 0.82±0.37 0.90±0.33 0.77±0.26 0.80±0.36 TCHO(mmol/L) 2.20±0.29 2.11±0.32 1.95±0.42 2.07±0.37 GLU(mmol/L) 5.59±0.94 4.84±0.77 5.46±0.63 5.13±0.82 ALB/GIO 1.05±0.06 1.02±0.07 1.03±0.06 1.04±0.05 2.3.4 脏器质量和脏体比值
由表7可得,受试物各剂量组大鼠肝脏、肾脏、脾脏、卵巢(雌性)、睾丸(雄性)的脏器的绝对质量和相对质量(脏体比值)与阴性对照组比较,差异均无统计学意义(P>0.05)。
表 7 含灵芝多糖的复方制剂对大鼠脏器质量及脏体比值的影响(n=11)Table 7. Effect of compound preparation containing Ganoderma lucidum polysaccharides on organ mass and organ-body ratio in rats (n=11)性别 脏器指标 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 肝脏 质量(g) 7.79±0.79 7.82±0.74 7.79±1.02 9.08±2.28 脏体比值(%) 3.27±0.22 3.20±0.18 3.27±0.55 3.68±1.04 肾脏 质量(g) 1.85±0.13 1.80±0.17 1.80±0.15 1.87±0.20 脏体比值(%) 0.78±0.04 0.74±0.03 0.75±0.08 0.76±0.13 脾脏 质量(g) 0.65±0.07 0.68±0.13 0.61±0.07 0.72±0.14 脏体比值(%) 0.27±0.03 0.28±0.05 0.26±0.03 0.30±0.07 卵巢 质量(g) 0.15±0.02 0.15±0.02 0.15±0.02 0.14±0.02 脏体比值(%) 0.06±0.01 0.06±0.01 0.06±0.01 0.06±0.01 雄性 肝脏 质量(g) 12.38±2.05 11.93±1.48 12.21±1.42 11.69±1.48 脏体比值(%) 3.47±0.42 3.32±0.27 3.53±0.21 3.34±0.24 肾脏 质量(g) 2.78±0.38 2.66±0.32 2.56±0.32 2.67±0.31 脏体比值(%) 0.78±0.07 0.74±0.05 0.74±0.06 0.76±0.05 脾脏 质量(g) 1.04±0.14 1.00±0.10 0.97±0.16 0.93±0.14 脏体比值(%) 0.29±0.04 0.28±0.03 0.28±0.05 0.27±0.04 睾丸 质量(g) 3.39±0.34 3.35±0.23 3.23±0.18 3.17±0.21 脏体比值(%) 0.96±0.08 0.94±0.06 0.94±0.05 0.91±0.06 2.3.5 大体解剖及组织病理学检查
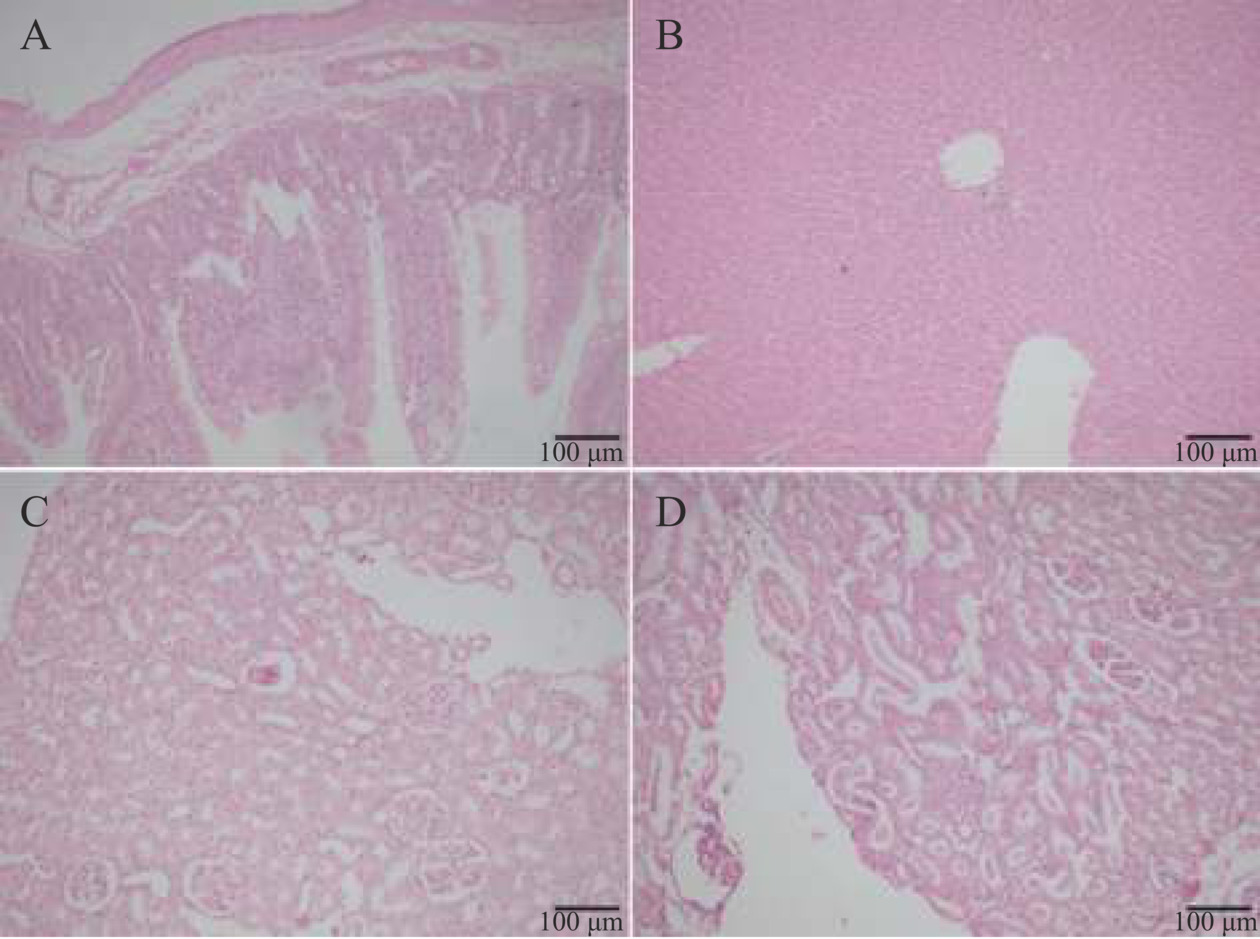
各组动物大体解剖心脏、肝脏、脾脏、肺脏、肾脏、胃肠等主要脏器未见肉眼可见的中毒症状,脏器外观颜色和大小正常,均未出现明显渗出、增生、水肿、萎缩等病变。通过对各组动物脏器组织病理学检查发现,阴性对照组仅一只雄性大鼠肠粘膜下层出现轻度水肿(图3A),未见炎性细胞浸润,其他脏器均未见异常病理变化;受试物高剂量组一只雄性大鼠肝脏局部淋巴细胞轻度增生(图3B);高剂量组两只雌性大鼠肾小球萎缩(图3C),肾小管内管型增多(图3D),肾结构正常,肾小管、肾小球及间质均未见异常病理变化;其余大鼠各脏器未见异常病理变化。
各组动物中仅有个别大鼠出现轻度病理改变,且病变性质和程度无明显差异,所有病变类型在大鼠中为常见的自发性病理改变,无明显生物学意义。
综上,大鼠30 d喂养试验中通过对大鼠体质量、周食物利用率、血常规指标、血液生化学指标、主要脏器系数、组织病理学检查、一般状况等指标的检测,均未发现含灵芝多糖的复方制剂对大鼠有明显的毒性作用。
2.4 免疫功能评价试验
2.4.1 脾淋巴细胞转化试验
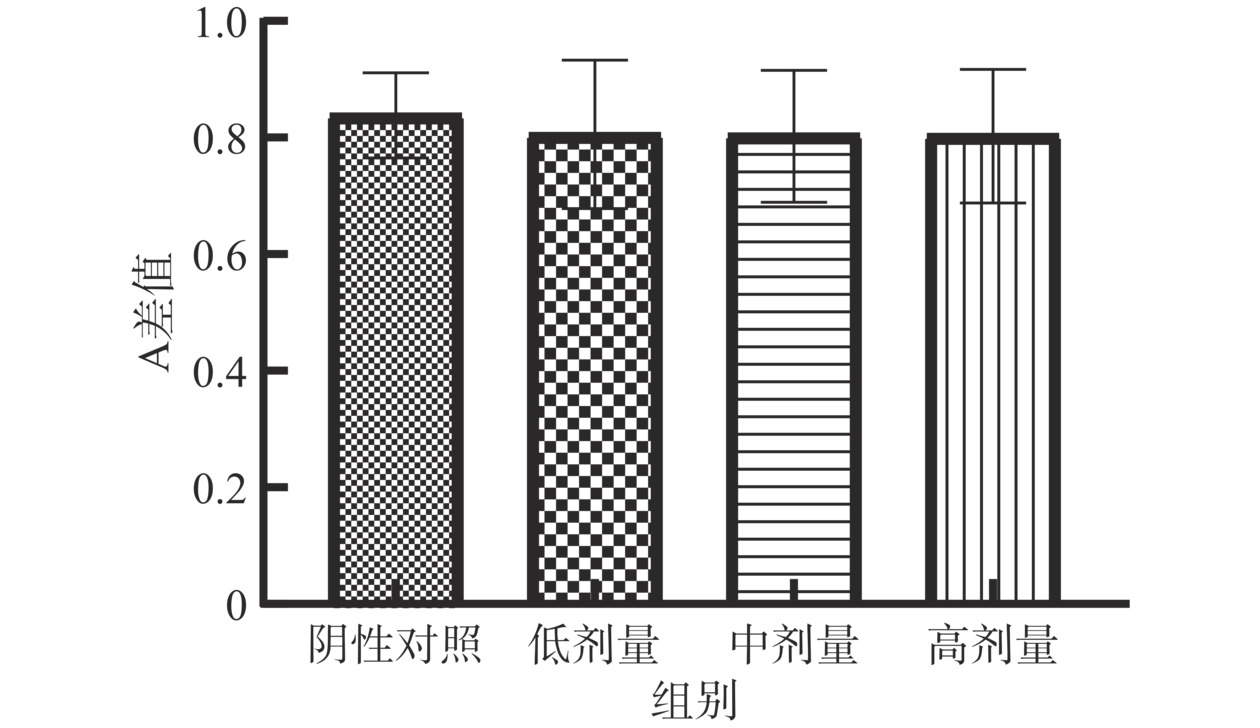
当脾淋巴细胞受到ConA刺激后,可出现细胞体积增大、代谢旺盛、蛋白质及核酸合成增加等生物学现象,部分小淋巴细胞可转化为淋巴母细胞并进行有丝分裂,淋巴母细胞中的线粒体水解酶可将MTT分解为紫色结晶,其光密度差值能反映机体细胞免疫水平。如图4所示,受试物高、中、低三个剂量组ConA孔吸光度差值分别0.81、0.81、0.80,与阴性对照孔的吸光度差值(0.84)相比,差异均无统计学意义(P>0.05)。表明含灵芝多糖的复方制剂不能促进脾淋巴细胞转化为淋巴母细胞,不能提升细胞免疫功能。
2.4.2 迟发型变态反应
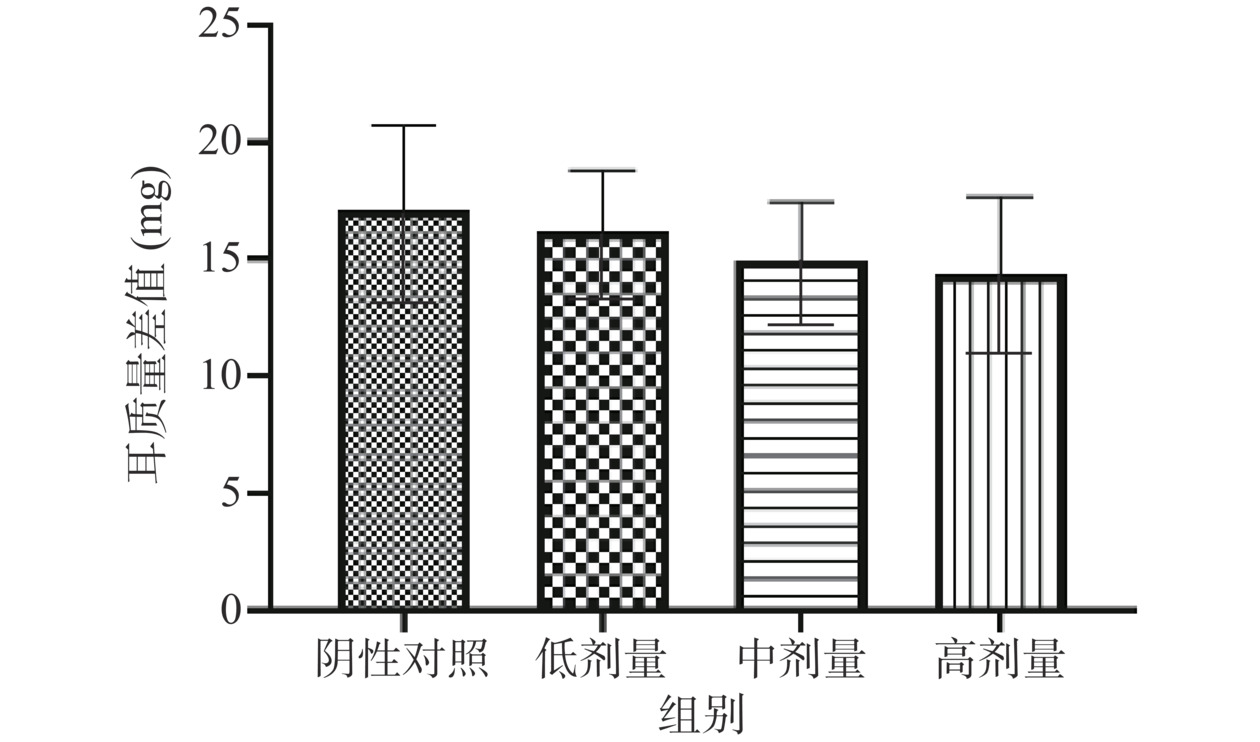
T淋巴细胞经抗原DNFB刺激后形成致敏淋巴细胞,当再次接触抗原后,主要造成单核细胞浸润及细胞变性坏死为特征的局部变态反应性炎症,具体表现为局部迟发型肿胀,通过检测耳重量差值可以反映迟发型变态反应程度。如图5所示,受试物高、中、低三个剂量组左右耳质量差值分别为14.37、14.96、16.19 mg,与阴性对照组差值(17.09 mg)相比,差异均无统计学意义(P>0.05)。表明含灵芝多糖的复方制剂不能增强迟发型变态反应,不能提升细胞免疫功能。
2.4.3 抗体生成细胞检测
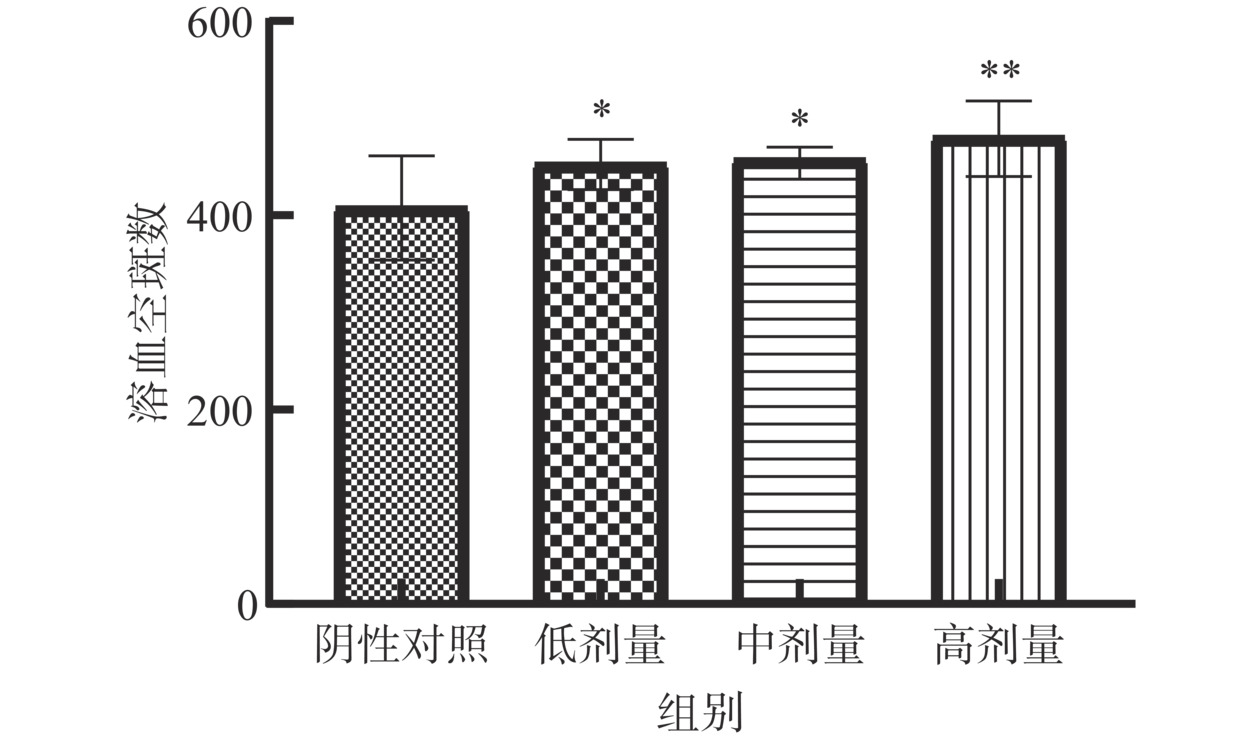
当脾淋巴细胞接触绵羊红细胞(抗原)后,刺激B细胞活化分泌特异性抗体,抗原抗体复合物在补体的参与下使红细胞溶解,在琼脂糖玻片形成一个肉眼可见的溶血空斑,一个空斑即代表一个抗体生成细胞(浆细胞),因此溶血空斑数可反映体液免疫强弱[29]。如图6所示,受试物低、中、高剂量组溶血空斑数分别为453.80、458.30、481.00,与阴性对照组(408.90)相比分别提高10.98%、12.08%、17.63%,差异均具有统计学意义(P<0.05)。表明含灵芝多糖的复方制剂能增加抗体生成细胞数,具有增强体液免疫的潜力。
2.4.4 小鼠腹腔巨噬细胞吞噬鸡红细胞试验
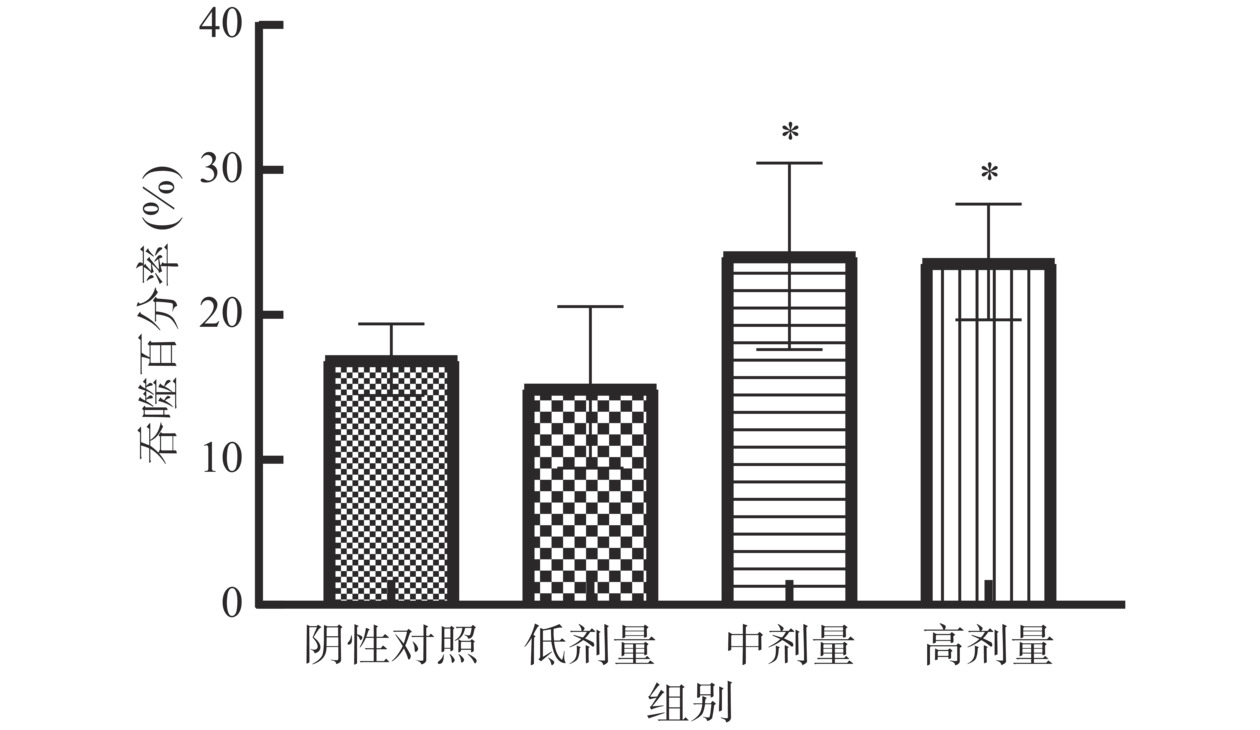
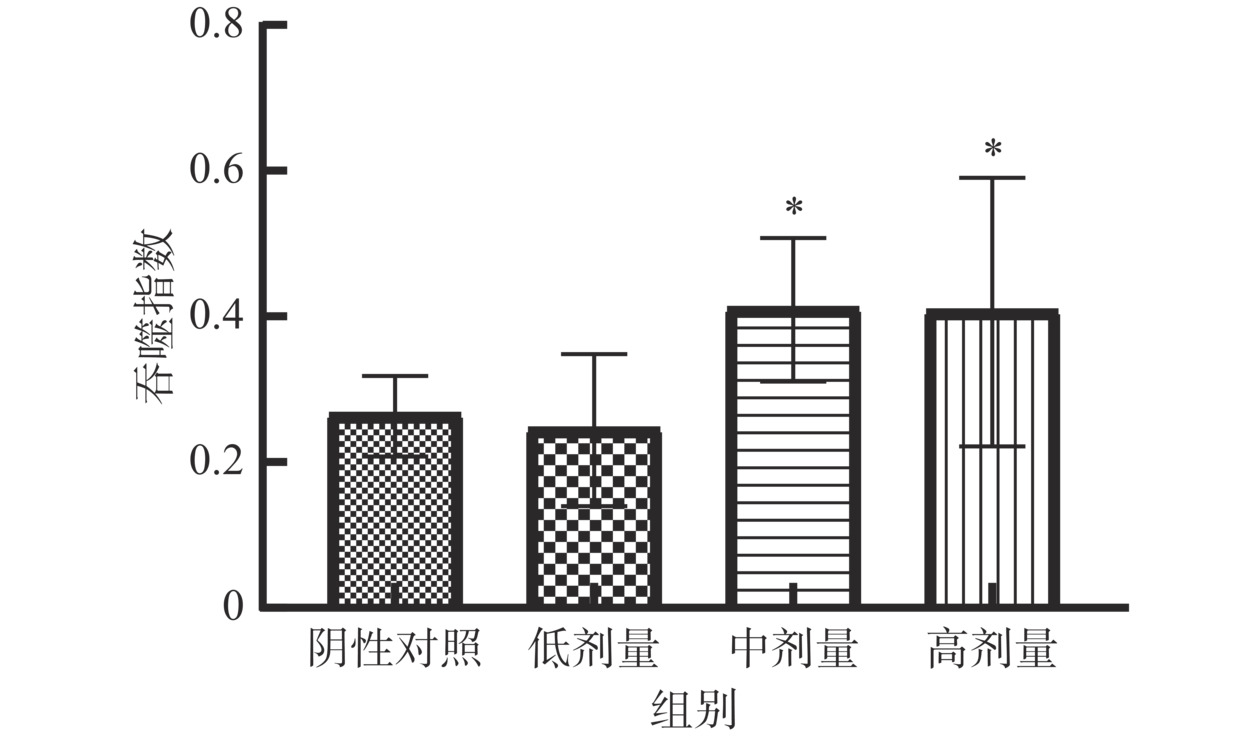
当绵羊红细胞注射入小鼠腹腔,机体固有免疫功能首先发挥作用,静息状态下的巨噬细胞被激活,当再次接触到异物(鸡红细胞)入侵,活化的巨噬细胞将鸡红细胞吞入,经染色后显微镜下可观察并计数巨噬细胞和被吞噬的鸡血红细胞数,通过公式计算吞噬百分率和吞噬指数可评估巨噬细胞的吞噬能力。如图7所示,受试物中、高剂量组吞噬百分率分别为24.28%、23.81%,与阴性对照组(17.11%)相比分别提高7.17%、6.70%,差异具有统计学意义(P<0.05)。如图8所示,受试物中、高剂量组吞噬指数均为0.41,与阴性对照组(0.27)相比均提高0.14,差异具有统计学意义(P<0.05)。表明含灵芝多糖的复方制剂能提高巨噬细胞吞噬能力,具有增强非特异性免疫的潜力。
2.4.5 NK细胞活性测定
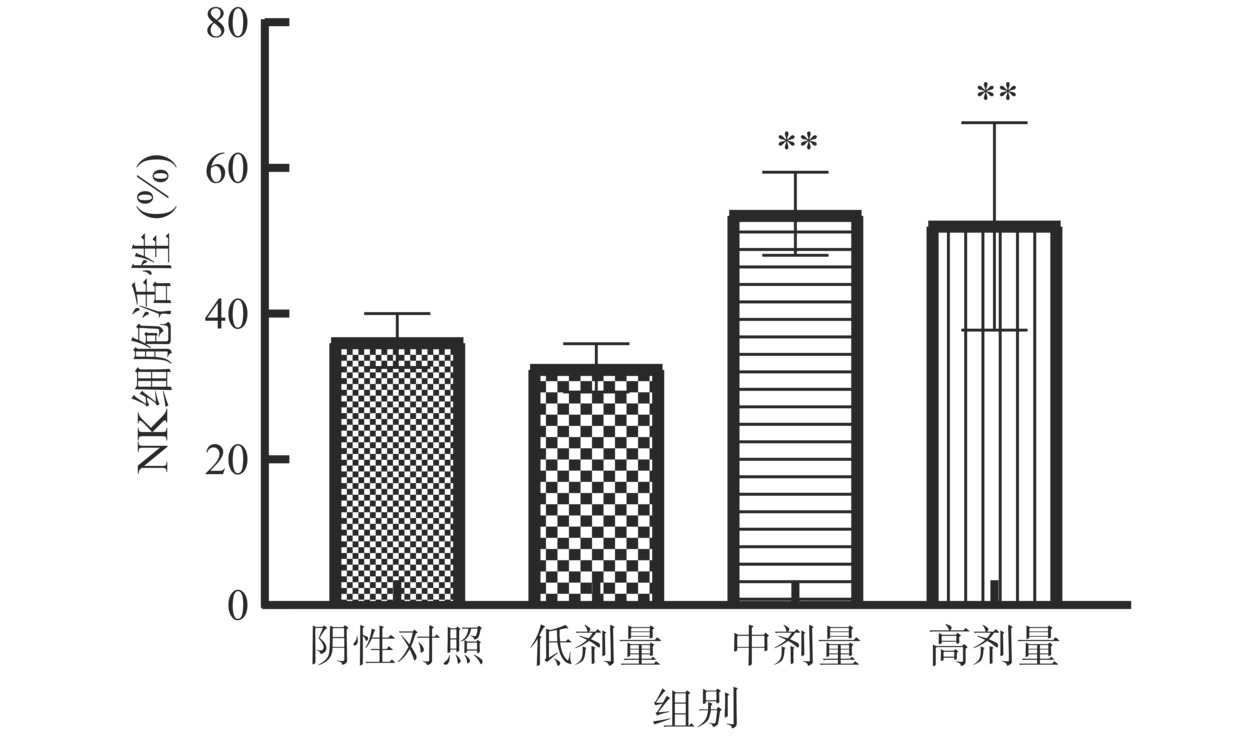
正常情况下,靶细胞YAC-1胞浆内的乳酸脱氢酶(LDH)不能透过细胞膜,当细胞受到NK细胞杀伤后,LDH释放到胞外,经过一系列反应后生成紫红色甲臜化合物,其光密度值可反映NK细胞杀伤活性[29]。如图9所示,受试物中、高剂量组NK细胞活性分别为54.01%、52.57%,与阴性对照组(36.57%)相比分别提高17.44%、16.00%,差异具有统计学意义(P<0.01)。表明含灵芝多糖的复方制剂能提高NK细胞活性,具有增强非特异性免疫的潜力。
3. 讨论与结论
现代医学认为,人的免疫系统由免疫器官、免疫细胞及免疫分子构成,根据防御反应类型可分为非特异性免疫和特异性免疫,具有识别、清除外来病原微生物及体内突变细胞,维持机体内环境平衡稳定的功能[41−43]。免疫力低下时容易受到外界病原微生物入侵或导致过敏反应,患病风险极大增加。传统医学认为“正气存内,邪不可干”和“邪之所凑,其气必虚”,免疫反应本质是正邪相争,正气充实能够祛除外邪,邪气亢盛则导致免疫自稳失调[44],中医从整体观念出发,通过“扶正祛邪”,调节机体阴阳平衡,增强免疫自稳[45]。故此,从现代医学和传统医学的角度均揭示了免疫功能的可调节性质。
体液免疫是特异性免疫的重要组成部分,体液免疫主要是通过浆细胞分泌抗体从而发挥免疫应答作用的。通过对溶血空斑数目或吸光度值的检测,可以反映抗体生成细胞的多少,提示体液免疫的强弱。桑卡娜等[46]研究表明五加芪粉显著提高了小鼠抗体形成细胞水平,具有提升动物体液免疫能力的作用。王溪竹[47]研究发现人参原三醇组皂苷酶解产物能诱导B淋巴细胞分化形成抗体生成细胞,发挥免疫调节作用。本研究表明含灵芝多糖的复方制剂低、中、高剂量组分别使小鼠抗体生成细胞数目提高10.98%、12.08%、17.63%,具有正向调节体液免疫应答的潜力。
非特异性免疫是机体先天具有的免疫功能,是特异性免疫的基础。对病原体入侵最先产生免疫应答的细胞是巨噬细胞,它们是执行非特异性免疫的主要效应细胞[48]。单核-巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的标志之一,当病原体、异物等抗原物质进入机体后,其通过趋化、吞噬、杀灭作用迅速清除,因而对巨噬细胞吞噬鸡红细胞试验的吞噬指数和吞噬百分率检测,可反映吞噬功能的强弱[49]。本研究表明含灵芝多糖的复方制剂中、高剂量组能分别提高吞噬百分率7.17%、6.70%,吞噬指数均提高0.14,即可增强吞噬细胞的吞噬能力。NK细胞不同于T、B两类淋巴细胞,它没有主要组织相容复合体(MHC)限制,不依赖补体和抗体就能够发挥调节免疫及直接杀伤靶细胞的作用,是机体非特异性免疫的重要组成部分。NK细胞活化后,还能分泌细胞因子发挥免疫调节作用[50]。当靶细胞YAC-1受到NK细胞杀伤后,胞内乳酸脱氢酶被释放到细胞外,进一步通过氧化还原反应生成有色的甲臜类化合物,检测其吸光度值可反映NK细胞活性[29]。本研究表明含灵芝多糖的复方制剂中、高剂量组能使小鼠NK细胞活性分别提高17.44%、16.00%。两项试验结果均表明含灵芝多糖的复方制剂具有增强非特异性免疫的潜力。
此外,为考察含灵芝多糖的复方制剂的食用安全性,本研究采用了小鼠急性经口毒性试验、Ames试验和大鼠30 d喂养试验。结果表明受试物对雌雄小鼠最大耐受剂量(MTD)超过42.56 g/kg,其剂量相当于人体推荐用量的1290倍,急性毒性分级属于无毒物质;受试物Ames试验结果阴性,未显示出致突变作用;30 d喂养试验中,受试物对大鼠体质量、周食物利用率、血常规指标、血液生化学指标及主要脏器系数均未产生显著影响(P>0.05),组织学检查未发现明显病理变化。
综上所述,本研究从细胞免疫、体液免疫及非特异性免疫的角度,较为系统全面地评价了含灵芝多糖的复方制剂免疫调节功能,结果表明了含灵芝多糖的复方制剂是通过增强体液免疫功能和非特异性免疫功能来发挥免疫调节作用的。在毒理学研究中未发现不良反应或毒副作用。因此,含灵芝多糖的复方制剂是一种可以调节机体免疫功能且安全性良好的保健食品。
-
表 1 含灵芝多糖的复方制剂急性经口毒性试验(n=10)
Table 1 Acute oral toxicity test results of compound preparation containing Ganoderma lucidum polysaccharides in mice (n=10)
性别 初体重(g) 一周体重(g) 末体重(g) 死亡数(只) MTD(g/kg) 雄 20.96±0.80 30.71±2.96 35.85±4.98 0 >42.56 雌 22.06±0.97 29.06±1.15 33.14±2.45 0 >42.56 表 2 含灵芝多糖的复方制剂第一次Ames试验回变菌落数(n=3)
Table 2 Number of revertant colonies in the first Ames test of compound preparation containing Ganoderma lucidum polysaccharides (n=3)
组别 剂量
(μg/皿)TA97(CFU/皿) TA98(CFU/皿) TA100(CFU/皿) TA102(CFU/皿) −S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 含灵芝多糖的复方制剂 5000 154±6 150±13 41±11 43±5 155±5 145±7 258±14 271±16 1000 155±7 161±4 42±7 46±3 143±7 142±10 273±16 266±7 200 161±7 145±16 42±2 46±1 140±2 149±5 258±17 265±15 40 160±7 165±16 43±3 46±2 146±6 144±6 263±5 263±13 8 146±6 145±5 42±6 44±1 148±8 151±9 261±19 264±5 自发回变 157±8 150±22 42±9 42±5 149±12 142±10 263±13 264±9 溶剂对照 142±12 148±19 42±3 42±6 152±8 154±8 266±13 276±11 叠氮化钠 2.5 2469±63 2-氨基芴 10 1600±51 1140±46 2310±84 敌克松 50 1620±33 1160±95 885±28 1-8二羟基蒽醌 50 1150±90 表 3 含灵芝多糖的复方制剂第二次Ames试验回变菌落数(n=3)
Table 3 Number of revertant colonies in the second Ames test of compound preparation containing Ganoderma lucidum polysaccharides (n=3)
组别 剂量
(μg/皿)TA97(CFU/皿) TA98(CFU/皿) TA100(CFU/皿) TA102(CFU/皿) −S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 含灵芝多糖的复方制剂 5000 146±16 169±12 37±7 38±3 135±8 140±12 239±11 250±27 1000 161±8 155±5 41±4 37±4 155±4 142±14 255±28 263±33 200 155±12 152±18 37±8 40±10 139±10 137±10 254±6 265±5 40 154±11 161±13 43±4 39±6 143±11 152±15 263±7 251±3 8 161±8 155±9 37±4 43±6 141±2 141±5 263±10 253±16 自发回变 150±15 163±8 41±6 38±2 146±8 142±13 272±10 246±8 溶剂对照 153±5 157±9 36±9 37±5 154±9 145±13 264±14 269±19 叠氮化钠 2.5 2426±80 2-氨基芴 10 1569±53 1055±90 2463±36 敌克松 50 1622±69 1063±59 843±56 1-8二羟基蒽醌 50 989±86 表 4 含灵芝多糖的复方制剂对大鼠周食物利用率的影响(n=11,%)
Table 4 Effect of compound preparation containing Ganoderma lucidum polysaccharides on weekly food utilization rate in rats (n=11, %)
性别 时间 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 第1周 34.00±2.10 37.30±6.30 35.30±3.30 37.50±5.70 第2周 27.90±8.10 30.70±9.40 25.80±8.20 27.00±10.40 第3周 21.50±12.30 21.20±10.10 25.30±8.70 25.60±14.70 第4周 17.00±6.40 16.60±7.00 18.60±4.00 13.30±3.60 雄性 第1周 52.00±4.20 50.80±3.10 49.90±1.90 50.70±3.50 第2周 37.40±5.30 39.40±2.60 36.90±4.40 38.80±6.70 第3周 36.10±10.20 37.90±6.40 34.70±7.80 36.40±4.00 第4周 25.00±3.30 25.30±8.60 23.40±4.10 25.60±6.10 表 5 含灵芝多糖的复方制剂对大鼠血常规指标的影响(n=11)
Table 5 Effect of compound preparation containing Ganoderma lucidum polysaccharides on hematological indexes in rats (n=11)
性别 血常规指标 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 WBC(109/L) 3.06±0.88 2.61±0.68 2.04±0.64** 3.41±1.19 中性粒细胞(%) 22.18±9.59 21.90±5.57 22.03±7.80 21.16±7.92 淋巴细胞(%) 73.31±9.53 72.92±4.24 71.29±7.14 73.61±8.48 单核细胞(%) 2.44±1.02 2.94±1.15 3.87±2.03* 2.95±1.09 嗜酸性粒细胞(%) 2.07±0.82 2.25±1.19 2.51±1.20 2.28±0.68 嗜碱性粒细胞(%) 0.00±0.00 0.00±0.00 3.13±10.24 0.00±0.00 RBC(1012/L) 6.98±0.22 6.73±0.36 7.02±0.38 6.95±0.37 Hb(g/L) 133.50±2.90 128.50±4.10* 131.50±6.40 133.10±4.00 雄性 WBC(109/L) 4.36±1.18 4.77±1.52 4.29±1.15 4.89±1.57 中性粒细胞(%) 19.26±5.10 20.05±7.37 19.43±6.17 18.02±6.04 淋巴细胞(%) 76.26±5.35 74.74±7.28 75.43±5.48 76.92±5.67 单核细胞(%) 2.68±1.01 3.38±1.37 3.60±1.31 3.50±1.40 嗜酸性粒细胞(%) 1.79±0.60 1.84±0.89 1.55±0.49 1.56±0.43 嗜碱性粒细胞(%) 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 RBC(1012/L) 7.10±0.35 7.06±0.29 7.12±0.42 7.21±0.29 Hb(g/L) 135.40±4.70 136.30±5.00 134.90±5.50 136.80±5.10 注:与阴性对照组比较,*P<0.05,**P<0.01;表6同。 表 6 含灵芝多糖的复方制剂对大鼠血液生化学指标的影响(n=11)
Table 6 Effect of compound preparation containing Ganoderma lucidum polysaccharides on blood biochemical indexes in rats (n=11)
性别 生化学指标 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 ALT(U/L) 31.93±4.62 26.40±2.45** 27.23±4.81* 31.09±5.72 AST(U/L) 143.12±21.55 115.15±11.92** 122.27±28.62* 118.87±11.58** ALB(g/L) 31.47±1.66 30.07±1.29* 30.18±1.60 30.88±1.77 TP(g/L) 58.24±3.93 54.47±1.79** 54.63±2.25* 57.33±3.94 BUN(mmol/L) 5.98±0.79 6.58±1.18 6.27±1.07 5.89±0.37 Cr(μmol/L) 29.89±3.01 29.02±3.01 28.33±2.35 29.00±3.07 TG(mmol/L) 0.54±0.33 0.71±0.45 0.50±0.18 0.80±0.28 TCHO(mmol/L) 2.04±0.54 2.01±0.20 1.90±0.28 2.10±0.36 GLU(mmol/L) 5.52±0.79 5.86±0.60 5.55±0.67 6.81±1.53 ALB/GIO 1.18±0.07 1.23±0.05 1.24±0.07 1.17±0.08 雄性 ALT(U/L) 31.35±4.21 32.82±6.83 32.10±3.61 32.04±4.80 AST(U/L) 119.19±22.90 124.36±24.51 114.66±18.91 125.14±22.51 ALB(g/L) 30.07±1.46 30.77±1.94 30.40±2.07 30.39±2.03 TP(g/L) 58.95±3.03 61.09±5.72 60.08±5.52 59.78±4.82 BUN(mmol/L) 5.22±0.80 5.34±0.98 6.05±0.97* 6.33±0.91** Cr(μmol/L) 25.89±2.91 26.24±2.67 25.64±2.87 26.98±2.93 TG(mmol/L) 0.82±0.37 0.90±0.33 0.77±0.26 0.80±0.36 TCHO(mmol/L) 2.20±0.29 2.11±0.32 1.95±0.42 2.07±0.37 GLU(mmol/L) 5.59±0.94 4.84±0.77 5.46±0.63 5.13±0.82 ALB/GIO 1.05±0.06 1.02±0.07 1.03±0.06 1.04±0.05 表 7 含灵芝多糖的复方制剂对大鼠脏器质量及脏体比值的影响(n=11)
Table 7 Effect of compound preparation containing Ganoderma lucidum polysaccharides on organ mass and organ-body ratio in rats (n=11)
性别 脏器指标 阴性对照组 高剂量组 中剂量组 低剂量组 雌性 肝脏 质量(g) 7.79±0.79 7.82±0.74 7.79±1.02 9.08±2.28 脏体比值(%) 3.27±0.22 3.20±0.18 3.27±0.55 3.68±1.04 肾脏 质量(g) 1.85±0.13 1.80±0.17 1.80±0.15 1.87±0.20 脏体比值(%) 0.78±0.04 0.74±0.03 0.75±0.08 0.76±0.13 脾脏 质量(g) 0.65±0.07 0.68±0.13 0.61±0.07 0.72±0.14 脏体比值(%) 0.27±0.03 0.28±0.05 0.26±0.03 0.30±0.07 卵巢 质量(g) 0.15±0.02 0.15±0.02 0.15±0.02 0.14±0.02 脏体比值(%) 0.06±0.01 0.06±0.01 0.06±0.01 0.06±0.01 雄性 肝脏 质量(g) 12.38±2.05 11.93±1.48 12.21±1.42 11.69±1.48 脏体比值(%) 3.47±0.42 3.32±0.27 3.53±0.21 3.34±0.24 肾脏 质量(g) 2.78±0.38 2.66±0.32 2.56±0.32 2.67±0.31 脏体比值(%) 0.78±0.07 0.74±0.05 0.74±0.06 0.76±0.05 脾脏 质量(g) 1.04±0.14 1.00±0.10 0.97±0.16 0.93±0.14 脏体比值(%) 0.29±0.04 0.28±0.03 0.28±0.05 0.27±0.04 睾丸 质量(g) 3.39±0.34 3.35±0.23 3.23±0.18 3.17±0.21 脏体比值(%) 0.96±0.08 0.94±0.06 0.94±0.05 0.91±0.06 -
[1] 夏淑洁, 李灿东. 基于“治未病”理论的中国特色健康管理模式探讨[J]. 中医药导报,2019,25(6):15−17,23. [XIA S J, LI C D. Discussion on health management model with Chinese characteristics based on the theory of "preventive treatment of diseases"[J]. Guid J Tradit Chin Med Pharm,2019,25(6):15−17,23.] XIA S J, LI C D. Discussion on health management model with Chinese characteristics based on the theory of "preventive treatment of diseases"[J]. Guid J Tradit Chin Med Pharm, 2019, 25(6): 15−17,23.
[2] ABABNEH M A, HALLOUSH S, ALTAWALBEH S, et al. Knowledge and attitudes towards herbal and dietary products use during the COVID-19 pandemic[J]. Clinical Nutrition Open Science,2023,49:118−129. doi: 10.1016/j.nutos.2023.05.003
[3] 马征. 冬凌草免疫调节作用研究及安全性评价[D]. 长沙:中南大学, 2010. [MA Z. Study on immune regulation of Rabdosia rubescens and its safety assessment[D]. Changsha:Central South University, 2010.] MA Z. Study on immune regulation of Rabdosia rubescens and its safety assessment[D]. Changsha: Central South University, 2010.
[4] 乔海博. 高纯中药复方多糖免疫调节作用及其安全性评价[D]. 石河子:石河子大学, 2013. [QIAO H B. The immunomodulatory function and safety evaluation of the high-purity Chinese compound polysaccharide[D]. Shihezi:Shihezi University, 2013.] QIAO H B. The immunomodulatory function and safety evaluation of the high-purity Chinese compound polysaccharide[D]. Shihezi: Shihezi University, 2013.
[5] 孙帆. 桦褐孔菌多糖提高免疫力活性研究与系列产品开发[D]. 长春:吉林农业大学, 2018. [SUN F. Study on the enhancement of immune activity of Inonotus obliquus polysaccharides and development of series products[D]. Changchun:Jilin Agricultural University, 2018.] SUN F. Study on the enhancement of immune activity of Inonotus obliquus polysaccharides and development of series products[D]. Changchun: Jilin Agricultural University, 2018.
[6] JIN X, RUIZ BEGUERIE J, SZE D M, et al. Ganoderma lucidum (Reishi mushroom) for cancer treatment[J]. The Cochrane Database of Systematic Reviews,2016,4(4):Cd007731.
[7] PAN K, JIANG Q, LIU G, et al. Optimization extraction of Ganoderma lucidum polysaccharides and its immunity and antioxidant activities[J]. International Journal of Biological Macromolecules,2013,55:301−306. doi: 10.1016/j.ijbiomac.2013.01.022
[8] ZHOU Q, YU R, LIU T, et al. Coix seed diet ameliorates immune function disorders in experimental colitis mice[J]. Nutrients,2021,14(1):123. doi: 10.3390/nu14010123
[9] 王彦芳, 杨彬彬, 陈倩, 等. 薏苡仁多糖通过调控JAK3/STAT5通路改善细胞免疫功能的体内外研究[J]. 中华中医药杂志,2021,36(11):6414−6417. [WANG Y F, YANG B B, CHEN Q, et al. In vitro and in vivo study of coixan improving cellular immune function by regulating the JAK3/STAT5 pathway[J]. Chin J Tradit Chin Med Pharm,2021,36(11):6414−6417.] WANG Y F, YANG B B, CHEN Q, et al. In vitro and in vivo study of coixan improving cellular immune function by regulating the JAK3/STAT5 pathway[J]. Chin J Tradit Chin Med Pharm, 2021, 36(11): 6414−6417.
[10] 王萍, 王玉堃, 王尚明, 等. 茯苓多糖对大鼠免疫功能的影响[J]. 山东畜牧兽医,2022,43(8):11−14,17. [WANG P, WANG Y K, WANG S M, et al. Effects of Poria cocos polysaccharide on the immune function of rats[J]. Shangdong Journal of Animal Science and Veterinary Medicine,2022,43(8):11−14,17.] doi: 10.3969/j.issn.1007-1733.2022.08.003 WANG P, WANG Y K, WANG S M, et al. Effects of Poria cocos polysaccharide on the immune function of rats[J]. Shangdong Journal of Animal Science and Veterinary Medicine, 2022, 43(8): 11−14,17. doi: 10.3969/j.issn.1007-1733.2022.08.003
[11] TIAN H, LIU Z J, PU Y W, et al. Immunomodulatory effects exerted by Poria cocos polysaccharides via TLR4/TRAF6/NF-κB signaling in vitro and in vivo[J]. Biomedicine & Pharmacotherapy,2019,112:108709.
[12] LIU C, WANG S, XIANG Z, et al. The chemistry and efficacy benefits of polysaccharides from Atractylodes macrocephala Koidz[J]. Frontiers in Pharmacology,2022,13:952061. doi: 10.3389/fphar.2022.952061
[13] XIANG X, CAO N, CHEN F, et al. Polysaccharide of Atractylodes macrocephala Koidz (PAMK) alleviates cyclophosphamide-induced immunosuppression in mice by upregulating CD28/IP3R/PLCγ-1/AP-1/NFAT signal pathway[J]. Frontiers in Pharmacology,2020,11:529657. doi: 10.3389/fphar.2020.529657
[14] WANG Z, FANG J N, GE D L, et al. Chemical characterization and immunological activities of an acidic polysaccharide isolated from the seeds of Cuscuta chinensis Lam[J]. Acta Pharmacologica Sinica,2000,21(12):1136−1140.
[15] 张庆平, 石森林. 菟丝子对小鼠免疫功能影响的实验研究[J]. 浙江临床医学,2006(6):568−569. [ZHANG Q P, SHI S L. Study on immunity functions of Cuscuta chinensis Lam in mice[J]. Zhejiang Clinical Medical Journal,2006(6):568−569.] doi: 10.3969/j.issn.1008-7664.2006.06.005 ZHANG Q P, SHI S L. Study on immunity functions of Cuscuta chinensis Lam in mice[J]. Zhejiang Clinical Medical Journal, 2006(6): 568−569. doi: 10.3969/j.issn.1008-7664.2006.06.005
[16] ZHAO L, XU C, ZHOU W, et al. Polygonati rhizoma with the homology of medicine and food:A review of ethnopharmacology, botany, phytochemistry, pharmacology and applications[J]. Journal of Ethnopharmacology,2023,309:116296. doi: 10.1016/j.jep.2023.116296
[17] SU L L, LI X, GUO Z J, et al. Effects of different steaming times on the composition, structure and immune activity of Polygonatum polysaccharide[J]. Journal of Ethnopharmacology,2023,310:116351. doi: 10.1016/j.jep.2023.116351
[18] FAN Y, MA X, MA L, et al. Antioxidative and immunological activities of ophiopogon polysaccharide liposome from the root of Ophiopogon japonicus[J]. Carbohydrate Polymers,2016,135:110−120. doi: 10.1016/j.carbpol.2015.08.089
[19] FAN Y, MA X, ZHANG J, et al. Ophiopogon polysaccharide liposome can enhance the non-specific and specific immune response in chickens[J]. Carbohydrate Polymers,2015,119:219−227. doi: 10.1016/j.carbpol.2014.11.048
[20] AYEKA P A, BIAN Y, MWITARI P G, et al. Immunomodulatory and anticancer potential of Gan Cao (Glycyrrhiza uralensis Fisch.) polysaccharides by CT-26 colon carcinoma cell growth inhibition and cytokine IL-7 upregulation in vitro[J]. BMC Complementary and Alternative Medicine,2016,16:206. doi: 10.1186/s12906-016-1171-4
[21] AYEKA P A, BIAN Y, GITHAIGA P M, et al. The immunomodulatory activities of licorice polysaccharides (Glycyrrhiza uralensis Fisch.) in CT 26 tumor-bearing mice[J]. BMC Complementary and Alternative Medicine,2017,17(1):536. doi: 10.1186/s12906-017-2030-7
[22] TIAN X, LIANG T. Extraction, structural characterization, and biological functions of Lycium barbarum polysaccharides:A review[J]. Biomolecules,2019,9(9):389. doi: 10.3390/biom9090389
[23] 田阳, 龚桂萍, 路宇, 等. 枸杞子多糖不同组分的双向免疫调节机制研究进展[J]. 食品科学,2022,43(23):356−366. [TIAN Y, GONG G P, LU Y, et al. Research progress on the dual-directional immunoregulatory effect of different polysaccharide fractions from Lycium barbarum fruit[J]. Food Science,2022,43(23):356−366.] doi: 10.7506/spkx1002-6630-20211126-327 TIAN Y, GONG G P, LU Y, et al. Research progress on the dual-directional immunoregulatory effect of different polysaccharide fractions from Lycium barbarum fruit[J]. Food Science, 2022, 43(23): 356−366. doi: 10.7506/spkx1002-6630-20211126-327
[24] ZHAO T, MAO G, MAO R, et al. Antitumor and immunomodulatory activity of a water-soluble low molecular weight polysaccharide from Schisandra chinensis (Turcz.) Baill[J]. Food and Chemical Toxicology:An International Journal Published for the British Industrial Biological Research Association,2013,55:609−616.
[25] ZHAO T, FENG Y, LI J, et al. Schisandra polysaccharide evokes immunomodulatory activity through TLR 4-mediated activation of macrophages[J]. International Journal of Biological Macromolecules,2014,65:33−40. doi: 10.1016/j.ijbiomac.2014.01.018
[26] TAO J H, DUAN J A, JIANG S, et al. Polysaccharides from Chrysanthemum morifolium Ramat ameliorate colitis rats by modulating the intestinal microbiota community[J]. Oncotarget,2017,8(46):80790−80803. doi: 10.18632/oncotarget.20477
[27] 郑昌平. 菊花多糖的分离纯化、结构鉴定及其生物活性研究[D]. 南昌:南昌大学, 2015. [ZHENG C P. Studies on purification, structural elucidation and bioactivities of polysaccharides from Chrysanthemum morifolium flowers[D]. Nanchang:Nanchang University, 2015.] ZHENG C P. Studies on purification, structural elucidation and bioactivities of polysaccharides from Chrysanthemum morifolium flowers[D]. Nanchang: Nanchang University, 2015.
[28] ALOTIBY A, ALSHAREEF M. Comparison between healthcare professionals and the general population on parameters related to natural remedies used during the COVID-19 pandemic[J]. Journal of Multidisciplinary Healthcare,2021,14:3523−3532. doi: 10.2147/JMDH.S343140
[29] 中华人民共和国卫生部. 保健食品功能学评价程序和检验方法规范(2003版)[M]. 北京:中国标准出版社, 2003. [Ministry of Health of the People's Republic of China. Technical standards for testing assessment of health food (2003 edition)[M]. Beijing:Standards Press of China, 2003.] Ministry of Health of the People's Republic of China. Technical standards for testing assessment of health food (2003 edition)[M]. Beijing: Standards Press of China, 2003.
[30] 肖志伟, 乐智勇, 朱国雪, 等. 人参多糖检测方法及提取工艺优选[J]. 中国现代中药,2016,18(1):106−109. [XIAO Z W, LE Z Y, ZHU G X, et al. Optimization of detection method and extraction technology of ginseng polysaccharides[J]. Modern Chinese Medicine,2016,18(1):106−109.] XIAO Z W, LE Z Y, ZHU G X, et al. Optimization of detection method and extraction technology of ginseng polysaccharides[J]. Modern Chinese Medicine, 2016, 18(1): 106−109.
[31] 张佳莉, 李莉. LC-MS/MS同时测定灵芝胶囊中7种三萜酸的含量[J]. 中国现代应用药学,2021,38(22):2852−2857. [ZHANG J L, LI L. Simultaneous determination of contents of 7 triterpenoid acids in Lingzhi capsule by LC-MS/MS[J]. Chin J Mod Appl Pharm,2021,38(22):2852−2857.] ZHANG J L, LI L. Simultaneous determination of contents of 7 triterpenoid acids in Lingzhi capsule by LC-MS/MS[J]. Chin J Mod Appl Pharm, 2021, 38(22): 2852−2857.
[32] 廖桢, 温艳, 王利芳, 等. 芯之康牌红曲丹参胶囊动物毒理学安全性评价研究[J]. 食品安全质量检测学报,2018,9(15):4112−4118. [LIAO Z, WEN Y, WANG L F, et al. Toxicological safety evaluation of XinZhiKang brand monascus and Radix Salviae Miltiorrhiae combination capsule[J]. Journal of Food Safety and Quality,2018,9(15):4112−4118.] doi: 10.3969/j.issn.2095-0381.2018.15.038 LIAO Z, WEN Y, WANG L F, et al. Toxicological safety evaluation of XinZhiKang brand monascus and Radix Salviae Miltiorrhiae combination capsule[J]. Journal of Food Safety and Quality, 2018, 9(15): 4112−4118. doi: 10.3969/j.issn.2095-0381.2018.15.038
[33] ZHANG Y, CHEN Q, LUO X, et al. Mutagenicity and safety evaluation of the water extract of Camellia oleifera Abel[J]. Journal of Food Science,2011,76(3):T84−89.
[34] LU K H, OU G L, CHANG H P, et al. Safety evaluation of water extract of Gastrodia elata Blume:Genotoxicity and 28-day oral toxicity studies[J]. Regulatory Toxicology and Pharmacology,2020,114:104657. doi: 10.1016/j.yrtph.2020.104657
[35] 李清光, 李世芬, 胡奇, 等. 蝙蝠蛾被毛孢菌丝体的活性成分分析及对小鼠免疫功能的调节作用[J]. 食品科技,2020,45(8):28−32. [LI Q G, LI S F, HU Q, et al. Analysis of active component of Hirsutella sinensis andits effect on immune function in mice[J]. Food Science and Technology,2020,45(8):28−32.] LI Q G, LI S F, HU Q, et al. Analysis of active component of Hirsutella sinensis andits effect on immune function in mice[J]. Food Science and Technology, 2020, 45(8): 28−32.
[36] 李雪梅. 石参胶囊对免疫功能的影响研究及毒理学研究[D]. 北京:北京中医药大学, 2015. [LI X M. Study on immunity functions and toxicology of Shi-shen capsule[D]. Beijing:Beijing University of Chinese Medicine, 2015.] LI X M. Study on immunity functions and toxicology of Shi-shen capsule[D]. Beijing: Beijing University of Chinese Medicine, 2015.
[37] 贾秀秀. 人参林蛙油软胶囊的安全性评价及增强免疫功能研究[D]. 长春:吉林大学, 2017. [JIA X X. Study on safety evaluation and enhancement of immune function of ginseng forest frog oil soft capsule[D]. Changchun:Jilin University, 2017.] JIA X X. Study on safety evaluation and enhancement of immune function of ginseng forest frog oil soft capsule[D]. Changchun: Jilin University, 2017.
[38] 王权, 杨婉纯, 凌莉, 等. 灵芝蝙蝠蛾拟青霉菌丝体复合物增强免疫作用研究[J]. 中药材,2022,45(5):1247−1252. [WANG Q, YANG W C, LING L, et al. Study on imunity-enhancing of a compound of Ganoderma lucidum and Paecilomyces hepiali[J]. Journal of Chinese Medicinal Materials,2022,45(5):1247−1252.] WANG Q, YANG W C, LING L, et al. Study on imunity-enhancing of a compound of Ganoderma lucidum and Paecilomyces hepiali[J]. Journal of Chinese Medicinal Materials, 2022, 45(5): 1247−1252.
[39] 张婷婷, 叶子, 王萌, 等. 参贝咀嚼片的免疫调节活性及其安全性评价[J]. 现代食品科技,2022,38(9):80−91. [ZHANG T T, YE Z, WANG M, et al. Study on immune regulation of ginseng-fritillaria bulb tablet and its safety assessment[J]. Modern Food Science & Technology,2022,38(9):80−91.] ZHANG T T, YE Z, WANG M, et al. Study on immune regulation of ginseng-fritillaria bulb tablet and its safety assessment[J]. Modern Food Science & Technology, 2022, 38(9): 80−91.
[40] 魏伟, 吴希美, 李元建. 药理实验方法学[M]. 北京:人民卫生出版社, 2010. [WEI W, WU X M, LI Y J. Experimental methodology of pharmacology[M]. Beijing:People's Medical Publishing House, 2010.] WEI W, WU X M, LI Y J. Experimental methodology of pharmacology[M]. Beijing: People's Medical Publishing House, 2010.
[41] 史顶聪. 红景天蛹虫草片增强机体免疫力研究[D]. 长春:长春工业大学, 2020. [SHI D C. Study on enhancing immunity of cordyceps militaris tablet of Rhodiola rosea[D]. Changchun:Changchun University of Technology, 2020.] SHI D C. Study on enhancing immunity of cordyceps militaris tablet of Rhodiola rosea[D]. Changchun: Changchun University of Technology, 2020.
[42] 朱薇薇. 三栋健酒毒理学安全性评价及抗疲劳、调节免疫作用研究[D]. 南京:南京农业大学, 2010. [ZHU W W. Study on toxicological safety evaluation and anti-fatigue effect and immune functions of Sam Tung God of wine[D]. Nanjing:Nanjing Agricultural University, 2010.] ZHU W W. Study on toxicological safety evaluation and anti-fatigue effect and immune functions of Sam Tung God of wine[D]. Nanjing: Nanjing Agricultural University, 2010.
[43] 焦春伟, 梁慧嘉, 随晶晶, 等. 蝙蝠蛾拟青霉-蛹虫草复方的安全性评价及调节免疫活性研究[J]. 食品安全导刊,2022(14):76−80. [JIAO C W, LIANG H J, SUI J J, et al. Safety evaluation and immunomodulatory activity of a combination of Paecilomyces hepiali and Cordyceps militaris[J]. China Food Safety Magazine,2022(14):76−80.] doi: 10.3969/j.issn.1674-0270.2022.14.spaqdk202214035 JIAO C W, LIANG H J, SUI J J, et al. Safety evaluation and immunomodulatory activity of a combination of Paecilomyces hepiali and Cordyceps militaris[J]. China Food Safety Magazine, 2022(14): 76−80. doi: 10.3969/j.issn.1674-0270.2022.14.spaqdk202214035
[44] 徐晓楠, 方钰发, 王妍. 中医阴阳与免疫的关系初探[J]. 四川中医,2019,37(2):25−27. [XU X N, FANG Y F, WANG Y. Discussing on the relationship between Yin and Yang of traditional Chinese medicine and immunity[J]. Journal of Sichuan of Traditional Chinese Medicine,2019,37(2):25−27.] XU X N, FANG Y F, WANG Y. Discussing on the relationship between Yin and Yang of traditional Chinese medicine and immunity[J]. Journal of Sichuan of Traditional Chinese Medicine, 2019, 37(2): 25−27.
[45] 刘维庆, 陈书保, 沙涛. 中医学与免疫学关系探析[J]. 辽宁中医杂志,2005(12):1257−1258. [LIU W Q, CHEN S B, SHA T. Analysis of the relationship between traditional Chinese medicine and immunology[J]. Liaoning Journal of Traditional Chinese Medic-ine,2005(12):1257−1258.] doi: 10.3969/j.issn.1000-1719.2005.12.020 LIU W Q, CHEN S B, SHA T. Analysis of the relationship between traditional Chinese medicine and immunology[J]. Liaoning Journal of Traditional Chinese Medic-ine, 2005(12): 1257−1258. doi: 10.3969/j.issn.1000-1719.2005.12.020
[46] 桑卡娜, 高艳艳, 周德刚. 五加芪粉对小鼠淋巴细胞增殖功能和抗体形成细胞的影响[J]. 中国兽药杂志,2017,51(3):44−47. [SANG K N, GAO Y Y, ZHOU D G. Influence of Wujiaqi powder on lymphocyte proliferation and antibody-forming cells of mice[J]. Chin J Vet Drug,2017,51(3):44−47.] SANG K N, GAO Y Y, ZHOU D G. Influence of Wujiaqi powder on lymphocyte proliferation and antibody-forming cells of mice[J]. Chin J Vet Drug, 2017, 51(3): 44−47.
[47] 王溪竹. 人参原三醇组皂苷酶解产物改善记忆及提高免疫力研究[D]. 长春:吉林农业大学, 2019. [WANG X Z. Improvement of memory and immunity by enzymatic hydrolysates of protopanaxatriol[D]. Changchun:Jilin Agricultural University, 2019.] WANG X Z. Improvement of memory and immunity by enzymatic hydrolysates of protopanaxatriol[D]. Changchun: Jilin Agricultural University, 2019.
[48] UTHAISANGSOOK S, DAY N K, BAHNA S L, et al. Innate immunity and its role against infections[J]. Ann Allergy Asthma Immunol,2002,88(3):253−265.
[49] 宫晓燕, 曲晓波, 王泽玉. 扶正除疫颗粒对免疫功能低下动物免疫调节的影响[J]. 中国临床药理学与治疗学,2005(8):929−931. [GONG X Y, QU X B, WANG Z Y. Influence on immunological regulation of Fuzhengchuyi granule in mice with immune hypofunction[J]. Chin J Clin Pharm Therap,2005(8):929−931.] doi: 10.3969/j.issn.1009-2501.2005.08.020 GONG X Y, QU X B, WANG Z Y. Influence on immunological regulation of Fuzhengchuyi granule in mice with immune hypofunction[J]. Chin J Clin Pharm Therap, 2005(8): 929−931. doi: 10.3969/j.issn.1009-2501.2005.08.020
[50] 李博, 王春凤, 杨桂连. 自然杀伤细胞在机体免疫中的作用及机制研究进展[J]. 中国免疫学杂志,2015,31(5):719−721. [LI B, WANG C F, YANG G L. Research progress on the role and mechanism of natural killer cells in immunity[J]. Chinese Journal of Immunology,2015,31(5):719−721.] LI B, WANG C F, YANG G L. Research progress on the role and mechanism of natural killer cells in immunity[J]. Chinese Journal of Immunology, 2015, 31(5): 719−721.
-
期刊类型引用(4)
1. 茹晨雷,熊晖,潘在晨,杨继鸿,徐靖,李振皓. 灵芝子实体三维表型参数提取方法. 菌物学报. 2025(02): 152-162 .  百度学术
百度学术
2. 王艳莉,张国兴. 灵芝提取物中灵芝多糖质量控制方法研究. 食品安全质量检测学报. 2025(05): 155-161 .  百度学术
百度学术
3. 向毅芳,朱鹏,李瑛玉,李安琪,吴琼,覃铱帆. 桂林产“金桂”桂花安全性评价. 食品工业. 2024(11): 341-346 .  百度学术
百度学术
4. 黄柯翔,谭妃彤,潘堂鑫,邢栋,肖如雁,侯娟,贾薇. 赤灵芝多糖对ETEC所致肠炎的影响及机制研究. 中国现代医生. 2024(35): 68-71+93 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



