Immobilization of Papain Based on Polyethyleneimine Modified Nano-magnetic Spheres
-
摘要: 为实现木瓜蛋白酶(Papain,PAP)的高效固定化,本文构建了易于磁分离的亲水性三维立体结构的固定化载体,采用单因素和响应面法优化了固定条件。在磁性Fe3O4表面包覆聚甲基丙烯酸甲酯(PMMA)制备核-壳结构的纳米磁球Fe3O4@PMMA,接枝不同分子量聚乙烯亚胺(Polyethyleneimide,PEI),将PAP物理吸附在PEI上,以戊二醛(Glutaraldehyde,GA)为交联剂,构筑易于磁分离的亲水性三维立体结构的固定化载体Fe3O4@PMMA-PEI,对PAP交联封装并对其微观结构和理化性质进行表征。以纳米磁球的固定化能力为评价指标,探究其固定PAP的最佳交联时间、戊二醛浓度、交联温度、交联转速等。结果表明,磁球表面PMMA酯解后形成的羧基含量为0.95 mmol/g,接枝不同分子量PEI后,磁球表面氨基含量为0.16~0.48 mmol/g;纳米磁球对PAP的固载量可通过接枝PEI的分子量进行调控,当PEI分子量为1800时,固载量达到120.71 mg/g,选择PEI 1800为接枝空间臂。纳米磁球微观形貌较规整,单体分散性良好,粒径约150~200 nm。通过响应面试验优化得到最佳条件:当交联时间为32 min、戊二醛浓度为0.02%、交联温度为25 ℃、交联转速为90 r/min时,Fe3O4@PMMA-PEI 1800对PAP的固载量达139.80 mg/g。Fe3O4@PMMA-PEI 1800-PAP在重复使用5次之后,相对酶活力能保持80.35%。本研究设计合成纳米结构的磁性微球,实现PAP在纳米磁球表面的高效固定,为固定化PAP的研究和应用提供实验依据。
-
关键词:
- 纳米磁球 /
- 木瓜蛋白酶(PAP) /
- 聚乙烯亚胺(PEI) /
- 固定化 /
- 固载量
Abstract: To achieve efficient immobilization of papain (PAP), this study constructed a hydrophilic three-dimensional matrix for easy magnetic separation of the immobilized enzyme. The immobilization conditions were optimized using single-factor and response methodology. A core-shell structured nano-magnetic bead Fe3O4@PMMA was prepared by coating the magnetic Fe3O4 with poly(methyl methacrylate) (PMMA), followed by grafting polyethyleneimine (PEI) of different molecular weights. PAP was physically adsorbed onto the PEI, and then cross-linked using glutaraldehyde (GA) to construct an easily magnetically separable hydrophilic three-dimensional immobilization matrix Fe3O4@PMMA-PEI. The cross-linked encapsulation of PAP and its microstructure and physicochemical properties were characterized. Using the immobilization capacity of the nano-magnetic beads as the evaluation criterion, the optimal cross-linking time, glutaraldehyde concentration, cross-linking temperature, and cross-linking speed for immobilizing PAP were investigated. The results indicated that the carboxyl group content formed after the ester hydrolysis of the PMMA on the surface of the magnetic beads was 0.95 mmol/g. Following the grafting of PEI with different molecular weights, the amino group content on the surface of the magnetic beads was 0.16~0.48 mmol/g. The loading capacity of PAP on the nano-magnetic beads could be modulated by the molecular weight of the grafted PEI. When the molecular weight of PEI was 1800, the loading capacity reached 120.71 mg/g. PEI 1800 was selected as the grafting spacer arms. The nanomagnetic spheres exhibited well-defined morphology, uniform particle size distribution in the range of approximately 150~200 nm. Through response surface experiments, the best conditions were optimized: Cross-linking time of 32 minutes, glutaraldehyde concentration of 0.02%, cross-linking temperature of 25 ℃, and cross-linking speed of 90 revolutions per minute. Under these conditions, Fe3O4@PMMA-PEI 1800 achieved a PAP loading capacity of 139.80 mg/g. Importantly, even after five cycles of reuse, Fe3O4@PMMA-PEI 1800-PAP retained 80.35% of its relative enzyme activity. This study presents the design and synthesis of a nanomagnetic sphere structure tailored for the efficient immobilization of PAP, providing experimental evidence for the research and application of immobilized PAP. -
木瓜蛋白酶(Papain,PAP)是从番木瓜的胶乳中提取到的生物酶,广泛应用于食品加工、生物传感器、化妆品、纺织等生产领域。游离PAP由于重复使用受限制,酸、碱、热及储存稳定性较差,需要借助酶的固定化技术来解决其使用缺陷[1−3]。新型的固定化酶技术,主要分为固定化载体和制备技术两类[4],新型的载体主要指纳米载体和磁性载体[5]。磁性纳米材料(Magnetic nanoparticles,MNPs)是伴随纳米技术发展应运而生的载体材料,兼具磁性能和纳米科技,广泛应用于固定化酶、药物载体、吸附金属离子和放射性元素、磁共振成像、有机合成工业、化学分析等研究领域[6−9]。MNPs主要分为金属氧化物(如Fe3O4、Fe2O3)、磁性合金、磁性化合物、纯金属等四类[10]。Fe3O4磁性纳米粒子拥有高比表面积、高顺磁性、生物相容性良好、制作成本低、制备工艺简单等优点。裸露的Fe3O4纳米粒子易产生团聚现象,化学性质活泼而易于被氧化,一般使用功能化修饰或化学改性等技术在其表面包裹聚合物,能提供更多的活性功能和结合位点[11−13]。聚乙烯亚胺(Polyethyleneimine,PEI)是乙烯亚胺聚合产生的具有活性功能和水溶性的高分子聚合物,带有丰富的正电基团而具有高吸附性,兼具良好的生物相容性,有研究报道称,PEI可显著提高酶的活性和稳定性,以上特点使得PEI作为固定化酶的载体材料被研究人员关注[14−18]。
本研究拟设计一种以Fe3O4为磁核中心的核-壳结构的纳米磁球,通过接枝不同分子量PEI作为空间臂,PEI柔软的长链结构能提供较多的活性位点,将蛋白酶吸附在PEI长链上并通过戊二醛对PEI化学交联,构筑亲水性三维立体空间结构的固定化载体,该纳米磁球一方面最大限度保护酶催化过程中构象动态变化,同时又能将蛋白酶牢固的封装在PEI分子链形成的空间结构之中,实现对酶的交联封装固定化。以纳米磁球的固定化能力为评价指标,通过响应面试验优化PAP的固定化条件,为开发新型的固定化PAP载体提供实验基础和理论依据。
1. 材料与方法
1.1 材料与仪器
七水合硫酸亚铁(FeSO4·7H2O)、偶氮二异丁腈(AIBN)、戊二醛、氯化钠、85%磷酸 上海麦克林生化科技有限公司;六水合三氯化铁(FeCl3·6H2O)、油酸、无水乙醇、甲基丙烯酸甲酯(MMA)、聚乙烯醇(PVA,醇解度:98%~99% mol/mol)、酚酞、N-羟基琥珀酰亚胺(NHS)、聚乙烯亚胺(PEI,分子量分别为600、1800、70000)、牛血清蛋白(BSA)、木瓜蛋白酶(≥2000 U/mg,Papain) 阿拉丁试剂有限公司;氨水、盐酸、二乙烯基苯(DVB)、磷酸二氢钠、磷酸氢二钠 国药集团化学试剂有限公司;以上试剂均为国产分析纯。
SU8010型扫描电子显微镜(SEM) 日本株式会社日立制作所(HITACHI);TESNSORⅡ型傅里叶变换红外光谱仪(FTIR) 德国Bruker公司;ASAP 2420型快速比表面积和孔隙率仪(BET) 美国麦克默瑞提克(Micromeritics);D2F-6050型真空干燥箱 上海精宏实验设备有限公司;HZ9310K型摇床 华利达实验设备有限公司;UV5500PC型紫外可见光光度计 上海元析仪器有限公司;KQ-600KDE型超声波清洗器 昆山市超声仪器有限公司;WP-UP-GX-80型超纯水机 四川沃尔科技有限责任公司;DF-101S型恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;BSA124S型电子天平 赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1 纳米磁球的制备
1.2.1.1 Fe3O4@PMMA磁性微球的制备
参考文献[19]的方法,先通过化学沉淀法制得油酸修饰的Fe3O4磁性粒子,后通过悬浮聚合法制备以Fe3O4为磁核心的纳米磁球Fe3O4@PMMA。将磁性Fe3O4纳米粒子与MMA、DVB溶胀反应,加入AIBN超声30 min,反应物置于60 ℃、转速320 r/min下反应60 min,95%的乙醇和去离子水反复冲洗至上清液澄清,磁铁聚集沉淀,即得Fe3O4@PMMA。
1.2.1.2 Fe3O4@PMMA磁性微球表面接枝PEI
取1.2.1.1制备的Fe3O4@PMMA纳米磁球,进行以下操作:微球表面PMMA酯解和活化[19]:取适量Fe3O4@PMMA在NaOH中振荡反应,反应结束洗涤至中性加入盐酸使其酸化,真空干燥后加入NHS置于摇床中活化,25 ℃下转速160 r/min活化时间1 h,多次洗涤后干燥,样品备用;
微球表面接枝PEI(600/1800/70000)长链:称取40 mg酯解活化后的磁性微球,向其中加入1%(1 g/100 mL)不同分子量的PEI水溶液2 mL,在摇床中设置温度25 ℃、转速160 r/min的条件下反应4 h,反应结束用磁铁使沉淀析出,蒸馏水反复洗涤,50 ℃真空干燥备用,根据PEI分子量分别标记为:Fe3O4@PMMA-PEI 600、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 70000。
1.2.1.3 PEI分子量筛选及确定
a.化学性质:采用化学滴定法测定纳米磁球表面的羧基和氨基含量[20]。分别取20 mg活化后的纳米磁球(Fe3O4@PMMA-PEI 600、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 70000)置于锥形瓶中,加入15 mL的甲醇和0.2 mL 0.1%的酚酞溶液,用0.05 mol/L NaOH标准溶液滴定,当滴定到达终点时,记录滴定管中溶液体积V,方法不变,滴定空白,记录数据V0,以此作为对照,根据公式(1)计算羧(氨)基的含量。
羧(氨)基含量A=(V−V0)×C/m (1) 式中:A为磁性微球表面羧(氨)基含量(mmol/g);C为NaOH浓度(mol/L);V为样品消耗NaOH体积(mL);V0为空白消耗NaOH体积(mL);m为磁性微球的质量(mg)。
b.纳米磁球对BSA的吸附性能:称取20 mg的Fe3O4@PMMA-PEI 600、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 70000,分别加入2 mL 1.5 mg/mL的BSA(pH7.0,20 mmol/L磷酸缓冲液配制)溶液中,在温度为30 ℃、转速为110 r/min下于摇床中反应4 h,完成反应后用磁铁分离上清液和沉淀,用缓冲液洗涤沉淀3次,收集上清液和洗涤液,采用Bradford法测定上清液和洗涤液中BSA含量,反应前后BSA质量差值,即为固定在磁性纳米微球上的蛋白质含量。采用Bradford法测定微球对BSA的固定化率,x为蛋白浓度(mg/mL),y为吸光度值,得到回归方程:y=0.536x+0.0163,R2=0.9978。
固定化率和固载量的测定:取适量上清液和洗涤液,将其稀释适当倍数后,取50 μL与3 mL考马斯亮蓝G-250进行混合,摇匀,放置5 min,于595 nm处测定吸光值,并根据上述回归方程求得BSA浓度。通过以下公式算出固定化率和固载量。
固定化率C(%)=(A−B)/A×100 (2) 固载量Q(mg/g)=C×M0/M (3) 式中:A为BSA起始浓度(mg/mL);B为上清液和洗涤缓冲液中BSA浓度(mg/mL);C为固定化率(%);M0为BSA的起始质量(mg);M为微球质量(g)。
c.纳米磁球对PAP的固定与解吸:纳米磁球对PAP的固定:称取20 mg的Fe3O4@PMMA-PEI 600、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 70000,分别添加2 mL 1.5 mg/mL PAP(pH7.0,0.1 mol/L的PBS缓冲液配制),置于摇床中110 r/min、30 ℃下振荡4 h至吸附平衡,随后向试管中加入2 mL戊二醛溶液(移取4 mL 25%的戊二醛,加入96 mL pH7.0的0.20 mmol/L磷酸盐缓冲液,将戊二醛配制为浓度为1%的溶液,稀释至所需的浓度条件备用),放入摇床,110 r/min下交联反应30 min,反应结束后利用磁铁分离将上清液和固定化酶分开,用缓冲液洗涤沉淀3次,收集上清液和洗涤的缓冲液。将上清液和洗涤液按一定比例稀释后,用Bradford法测定上清液和洗涤液中PAP浓度,计算PAP固载量。
纳米磁球对PAP的解吸:称取交联封装了PAP的纳米磁球(记为Fe3O4@PMMA-PEI 600-PAP、Fe3O4@PMMA-PEI 1800-PAP、Fe3O4@PMMA-PEI 70000-PAP)各20 mg于不同试管中,加入洗脱液(1 mol/L的NaCl,以pH7.0的20 mmol/L磷酸缓冲剂制备洗脱液)3 mL,将反应体系置于摇床并设置温度35 ℃、转速110 r/min充分反应4 h,结束后,收集上清液和洗涤的缓冲液并测定蛋白酶浓度,计算吸附前后PAP的浓度差并根据公式(4)计算出固载量,根据公式(5)计算解吸率。
Qt=(C0−Ct)×V/m (4) 解吸率(%)=解吸的蛋白质/吸附的蛋白质×100 (5) 固定化率C(%)=(X−Y)/X×100 (6) 固载量Q(mg/g)=C×N0/N (7) 式中:Qt为t时刻纳米磁球的固载量(mg/g);C0为PAP初始浓度(mg/mL);Ct为t时刻溶液中PAP浓度(mg/mL);V为溶液总体积(mL);m为纳米磁球的质量(g);X为反应前PAP原浓度(mg/mL);Y为反应后溶液中PAP浓度(mg/mL);C为固定化率(%);N0为PAP的起始质量(mg);N为微球质量(g)。
1.2.2 纳米磁球的表征
1.2.2.1 扫描电镜(SEM)分析
采用SU8010型发射扫描电子显微镜观察纳米磁球微观形貌。取适量样品(Fe3O4、Fe3O4@PMMA、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 1800-PAP)均匀涂抹于导电胶上,喷金150 s。测试参数为扫描加速电压10~13 kV,加速电流10 μA,观察倍率70000~110000倍。
1.2.2.2 红外表征
利用傅里叶变换红外光谱仪,对磁性微球进行表征,扫描范围:4000~400 cm−1;样品扫描时间22 s;分辨率15 cm−1。
1.2.3 单因素实验
在预实验基础上,以纳米磁球对PAP的固载量和解吸率为评价指标,采用1.2.1.3的实验方法,对交联时间、戊二醛浓度、交联温度及交联转速这4个条件进行单因素实验。设定交联封装时间为15、30、45、60、90、120 min;戊二醛浓度为0.01%、0.02%、0.03%、0.06%、0.09%、0.12%、0.15%、0.18%;交联温度为0、10、20、25、30、35、40 ℃;交联转速为70、90、110、130、150、170 r/min。设置初始反应条件为:交联时间30 min,戊二醛浓度0.02%,交联温度30 ℃,交联转速110 r/min。
1.2.4 响应面试验设计
在单因素实验的基础上,以Fe3O4@PMMA-PEI 1800对PAP的固载量为响应值(Y),选取交联时间(A)、戊二醛浓度(B)、交联转速(C)这3个自变量采用Box-Behnken试验设计开展三因素三水平响应面优化试验,条件范围的选择参照单因素最大值相邻的参数作为优化参数。因素水平表见表1。
表 1 因素及编码水平Table 1. Factor and coding level水平 因素 A交联时间(min) B戊二醛浓度(%) C交联转速(r/min) −1 15 0.01 90 0 30 0.02 110 1 45 0.03 130 1.2.5 固定化酶的操作稳定性
实验方法及酶活力单位定义参考文献[21−22],测定L-酪氨酸标准曲线,得到:y=0.0074x+0.002,相关系数R2为0.9993。称取20 mg Fe3O4@PMMA-PEI 1800-PAP,根据固载量计算酶当量,测定酶活力。将Fe3O4@PMMA-PEI 1800-PAP样品与酪蛋白溶液在37 ℃温水浴中振荡反应10 min,反应结束后,加入三氯乙酸(TCA)溶液于37 ℃水浴中放置10 min 使酶促反应结束,在275 nm处测定吸光值。反应结束后在磁场下分离Fe3O4@PMMA-PEI 1800-PAP,并用PBS缓冲液进行洗涤,取洗涤后上清液加入福林酚试剂显色,上清液不变色即为洗涤洁净,真空干燥回收。重复7次上述反应,每次洗涤后测定固定化酶活力。将第一次测定的Fe3O4@PMMA-PEI 1800-PAP酶活力设为100%,以每次测得的固定化酶活力与第一次测定的Fe3O4@PMMA-PEI 1800-PAP酶活力比值来表示相对酶活力。
1.3 数据处理
实验数据使用Excel 2013、Design Expert 8.0、SPSS 23计算差异显著性和相关性并绘图。使用单因素方差中的Duncan检验进行显著性分析,P<0.05表示差异显著,实验结果表示为平均值±标准差。
2. 结果与分析
2.1 PEI分子量的筛选
2.1.1 纳米磁球的化学性质
利用化学滴定法得到羧基功能化的磁性微球表面羧基含量为0.95 mmol/g,表明磁性微球表面具有丰富的羧基基团位点,为下一步的交联反应奠定基础。不同纳米磁球表面氨基含量如表2所示,随着PEI分子量的增加,磁性微球表面的氨基含量也逐渐增加,PEI链越长,发生卷曲缠绕的现象越明显,不利于酶的负载。
表 2 纳米磁球氨基含量Table 2. Amino content of nanomagnetic spheres微球类型 氨基含量(mmol/g) Fe3O4@PMMA-PEI 600 0.16±0.09 Fe3O4@PMMA-PEI 1800 0.33±0.07 Fe3O4@PMMA-PEI 70000 0.48±0.04 2.1.2 PEI分子量对固定化效果的影响
如表3所示,Fe3O4@PMMA-PEI对蛋白质的固载量与Fe3O4@PMMA相比较有明显的增加。PEI是富含氨基的阳离子聚合物,其柔软的长链结构和良好的亲水性将蛋白酶吸附并包裹在聚合链中,交联剂戊二醛的醛基与PEI的氨基反应进一步促使交联网状立体结构的形成,使得生物酶完整的结构以立体的结构包裹连接在三维立体聚合链的空间中,不但大大增加了固定化酶的固载量,同时也能维持生物酶舒展的空间结构,赋予酶的最大的催化活性;由于该立体网状结构PEI聚合链位于纳米磁球的外表面,牢固的将蛋白酶包裹起来防止脱落的同时也可有效预防空间位阻对酶活力的影响[20]。Fe3O4@PMMA-PEI 1800对PAP的接枝的固载量最大,过长的分子链容易发生缠绕而使得链上的氨基无法完全暴露,影响酶的固定化效果。磁性微球对PAP的固载量可通过接枝PEI的分子量进行调控,后续实验筛选Fe3O4@PMMA-PEI 1800进一步深入研究。
表 3 磁性微球对BSA、PAP的固定化情况Table 3. Immobilization of magnetic microspheres on BSA and PAP样品 微球类型 固载量(mg/g) BSA Fe3O4@PMMA 44.84±0.23d Fe3O4@PMMA-PEI 600 49.19±0.46c Fe3O4@PMMA-PEI 1800 95.83±0.16b Fe3O4@PMMA-PEI 70000 98.94±0.22a PAP Fe3O4@PMMA 31.65±0.09d Fe3O4@PMMA-PEI 600 107.46±0.30b Fe3O4@PMMA-PEI 1800 120.71±0.34a Fe3O4@PMMA-PEI 70000 100.19±0.34c 注:不同小写字母表示组间数据差异显著(P<0.05)。 2.2 纳米磁球的结构表征
2.2.1 微观结构—扫描电镜(SEM)分析
图1(a)为Fe3O4微球的SEM照片,Fe3O4微球形状规则,球体大小基本均匀,球体粒径大约在150~200 nm之间,外表较为光滑,由于Fe3O4本身性质的缘故有一些团聚的现象。图1(b)为Fe3O4@PMMA粒子,从图1(b)看出,油酸改性后的Fe3O4@PMMA粒子的磁吸团聚现象有改善,Fe3O4@PMMA微球呈较为均匀的分散状,球体粒径约200 nm,但其微球表面并非光滑而是呈现明显的凹凸粗糙状,这是对Fe3O4酯解和活化等一系列反应造成的。图1(c)为Fe3O4@PMMA-PEI 1800,从图中可看出微球表面较为平整且有明显的PEI包覆层。图1(d)为Fe3O4@PMMA-PEI 1800-PAP微粒,可以清晰看到PAP规整且均匀地包覆在Fe3O4@PMMA-PEI 1800表面,PAP固载量较多且轮廓清晰,微球粒子分散性能较好,球体粒径约250 nm,局部未见有明显的团聚现象,载体Fe3O4@PMMA-PEI 1800与Fe3O4@PMMA-PEI 1800-PAP的形状均为大小均匀的圆球型。与韦美苹等[23]制备的d-Fe3O4@SiO2-GLYMO-IDA-Gu2+固定化木瓜蛋白酶相比较,本文将Fe3O4@PMMA接枝PEI长链为空间臂制备的Fe3O4@PMMA-PEI 1800-PAP固定化酶分散性更好,基本没有团聚的现象,这与选用PEI作为空间臂有关。电镜扫描结果表征了纳米磁球各阶段的形貌,充分证明纳米磁球Fe3O4@PMMA-PEI 1800-PAP固定化酶设计和制备的可行性。
本研究制备的Fe3O4@PMMA-PEI 1800与其他纳米磁球相比(如表4所示),操作简易,反应条件温和,粒径在200 nm左右,分布较为均匀,球体表面光滑,具有良好的可操控性。
表 4 不同纳米磁球的性质特点Table 4. Characteristics of different nanomagnetic spheres2.2.2 纳米磁球的红外扫描图谱—FTIR分析
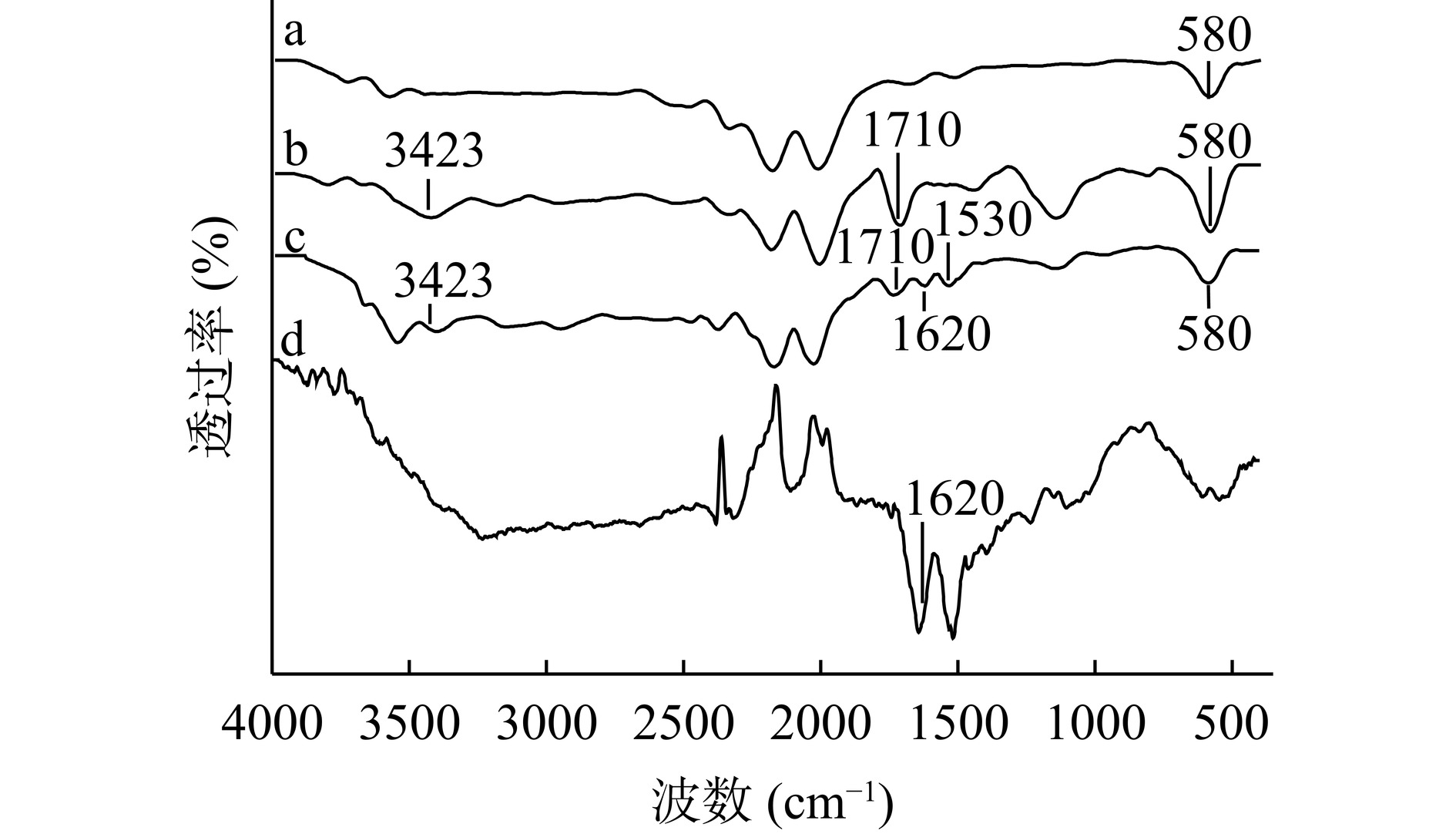
对Fe3O4@PMMA、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 1800-PAP磁球载体以及游离PAP进行傅里叶红外光谱扫描(图2),图2中a~c的红外光谱均有Fe-O的特征吸收峰,其吸收峰值约为580 cm−1,该吸收峰的出现与Fe-O键弯曲振动有关,是Fe3O4的特征峰,磁性微球具有Fe3O4磁性核心[27]。PEI 1800长链上富含氨基,因此以氨基的存在证明PEI成功接枝到载体微球上。在谱线b、c中,1710 cm−1处出现明显的羧基的C=O特征吸收峰;在3423 cm−1处的吸收峰为羧基的-OH和氨基的-NH特征吸收重叠峰[28],表明微球经水解后已产生羧基,经接枝后产生了氨基,说明PEI 1800已被成功接枝到具有磁性的微球上。蛋白质的酰胺带通常被用于分析其二级结构,也是验证其具有生物活性的有利证明。在谱线c中,在1530 cm−1处出现N-H弯曲振动和C-N伸缩振动,为蛋白质酰胺Ⅱ带的特征吸收峰;1620 cm−1处出现蛋白酰胺Ⅰ带的特征吸收峰[29],与谱线d中PAP酰胺带吸收峰位置相似,谱线c这两处吸收峰不明显,除与PAP物质浓度有关以外,由于样品c中PEI氨基基团和PAP的吸收峰相近,也可能导致信号被掩盖或波峰被拉宽。
2.3 单因素实验
2.3.1 交联时间的影响
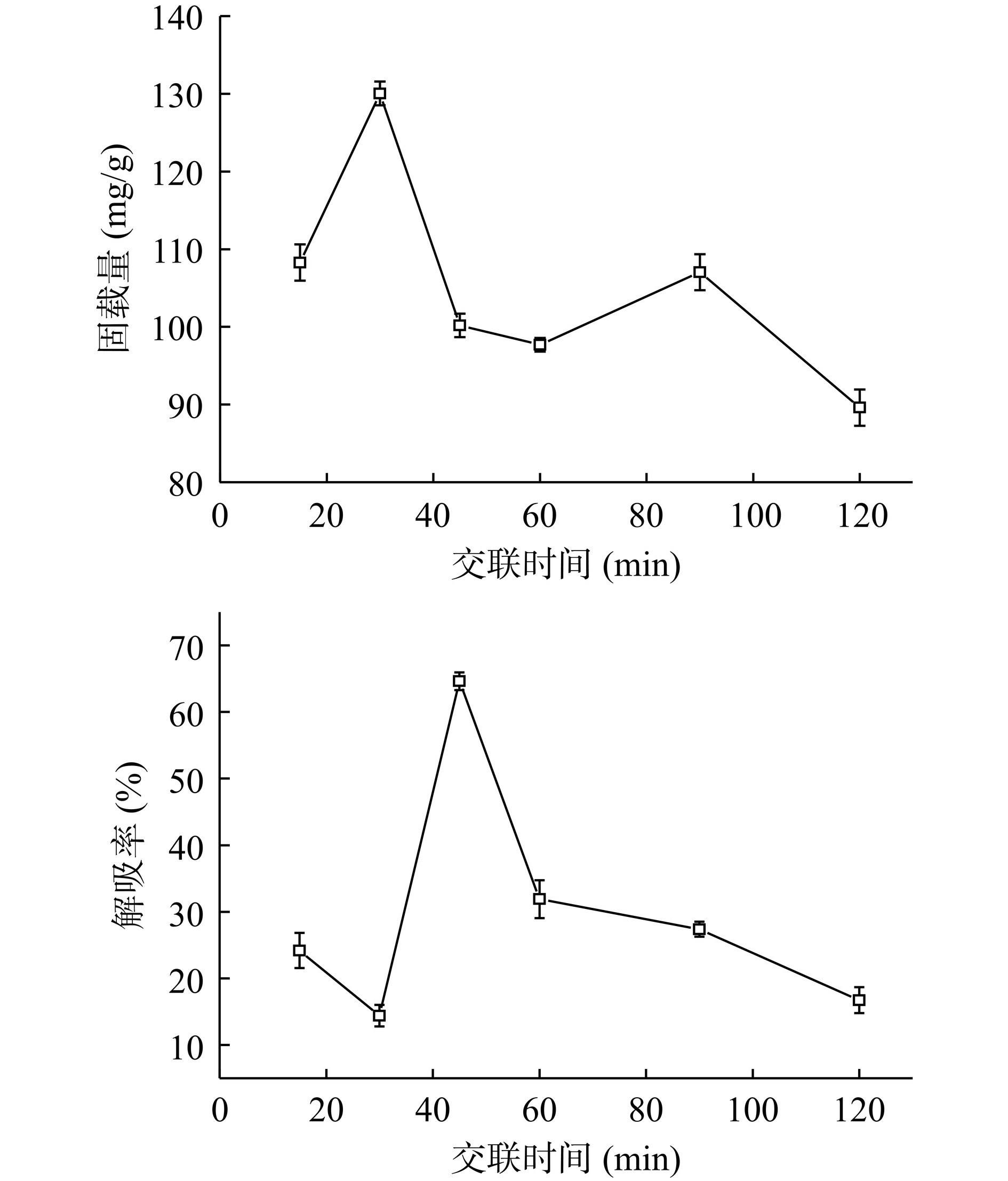
由图3可知,交联时间对Fe3O4@PMMA-PEI 1800-PAP的固载量和解吸率均有较为显著的影响。当交联反应时间为30 min时,Fe3O4@PMMA-PEI 1800-PAP的固载量达到最高126.04 mg/g,此时Fe3O4@PMMA-PEI 1800-PAP的解吸率为14.40%。戊二醛是小分子化合物,能与Fe3O4@PMMA-PEI 1800微球表面的PEI快速地完成交联反应形成稳定的席夫碱结构在载体表面形成保护膜加强了PAP在微球上的稳固程度;戊二醛分子两侧的醛基一方面与PEI长链上的氨基连接,另一侧的醛基与PAP分子的氨基酸残基结合,这一侧醛基的量对PAP的固载量起到决定作用[30]。反应刚开始,戊二醛的活化状态随着时间增加迅速提升,其分子表面的醛基含量也急速积累增加,此时一部分酶尚未交联封装于立体网状结构的微球表面,固载量较低,在反应进行30 min时交联的醛基也达到饱和状态,此时PAP固载量达到最大值而解吸率最低;当超过最佳交联反应时间继续反应,过度的交联反应使得席夫碱结构过于紧密,而酶的生物活性状态良好时酶分子应处于舒展的空间结构状态,过于紧密的交联网状结构给酶分子舒展的空间结构造成限制[5],伴随戊二醛活化时间延长,积累的醛基会对PAP的正常生理功能产生一定影响[20],可能造成酶的变性失活。因此,选择最佳交联时间为30 min。
2.3.2 戊二醛浓度的影响
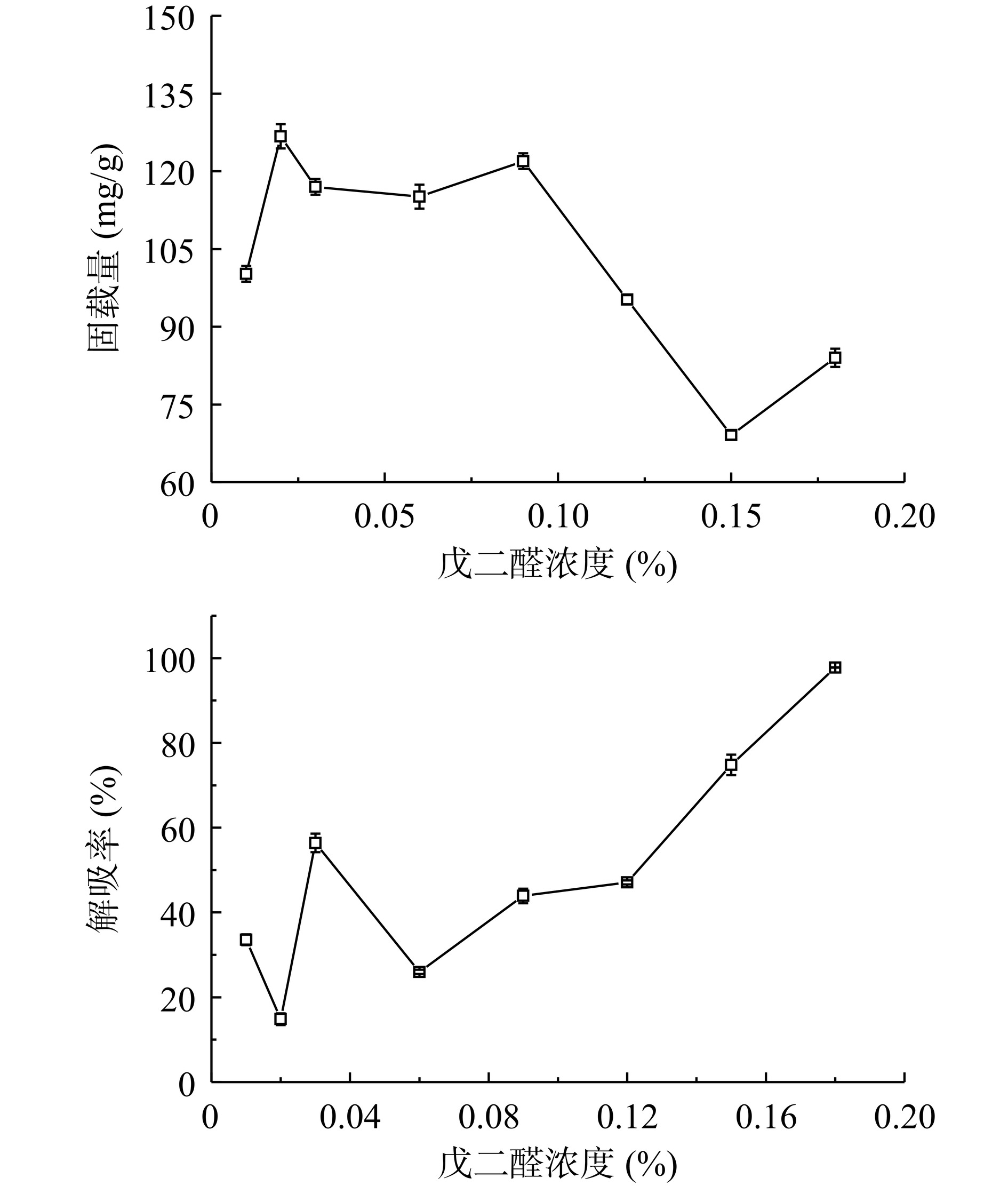
如图4所示,当戊二醛浓度逐渐增加,Fe3O4@PMMA-PEI 1800-PAP的固载量及解吸率也相应的增加,当戊二醛浓度为0.02%,固载量为最大126.74 mg/g,戊二醛浓度继续增大,Fe3O4@PMMA-PEI 1800-PAP的固载量呈下降趋势,戊二醛浓度增加到0.18%时,固载量只有84.02 mg/g。当戊二醛浓度为0.02%时,Fe3O4@PMMA-PEI 1800-PAP的解吸率为17.84%。戊二醛浓度较低时,戊二醛分子不能充分与Fe3O4@PMMA-PEI 1800微球上氨基进行交联,立体网状结构尚未形成而导致微球不能较好地封装固定PAP;戊二醛浓度增加,一方面过多的戊二醛上的醛基形成过于致密的网状结构,另一方面醛基浓度过高自身也会发生羟醛反应,可能会导致PAP构像发生改变而导致酶失活[19];另外,戊二醛本身具有一定的毒性,若浓度过高,也会给酶活造成负面影响[31],因此,选择最佳戊二醛浓度为0.02%。
2.3.3 温度的影响
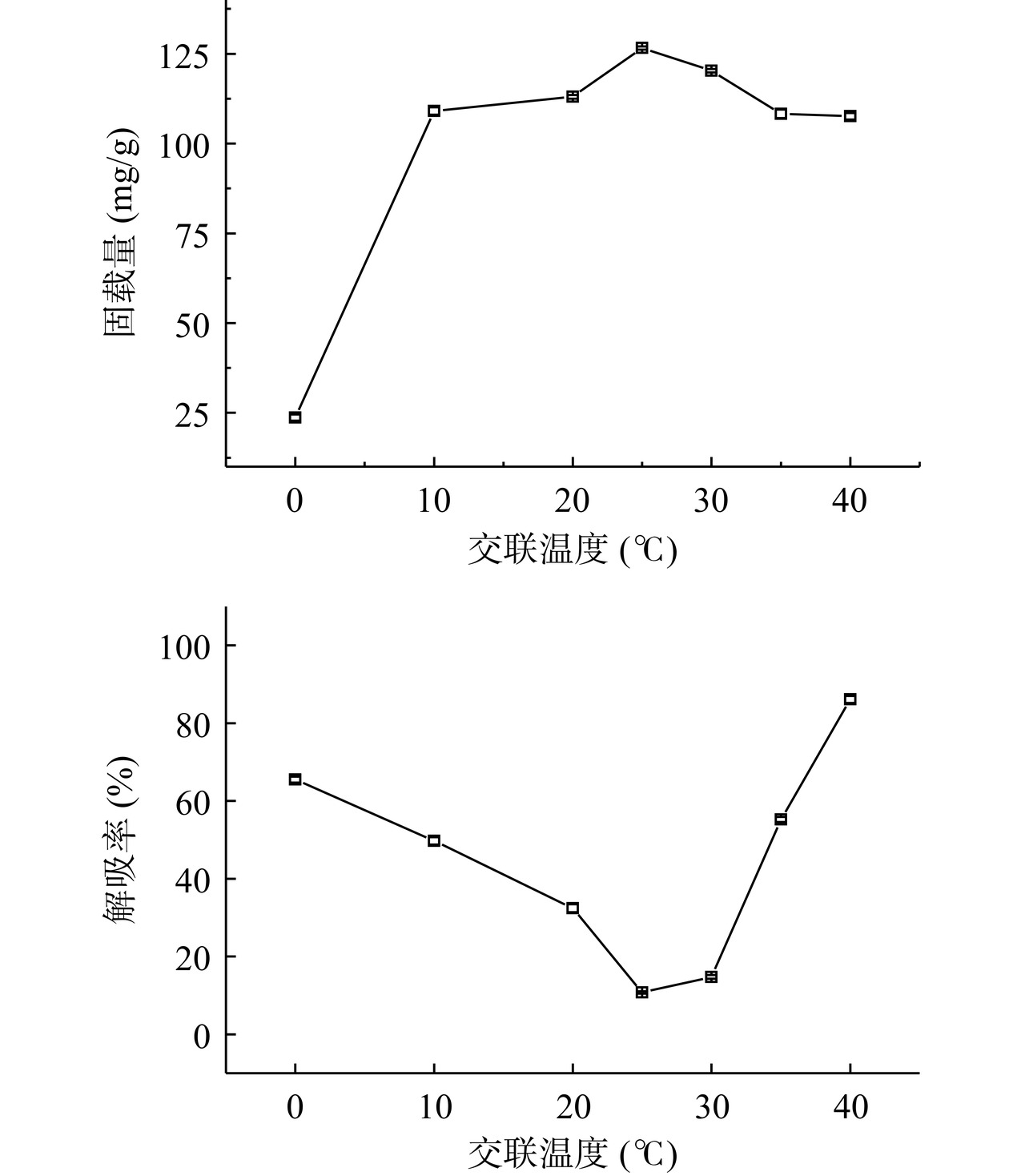
考查交联温度在0~40 ℃的范围内对Fe3O4@PMMA-PEI 1800封装能力是否有影响,由图5看出,当交联温度不断升高,Fe3O4@PMMA-PEI 1800-PAP的固载量先增大后减小并趋于稳定,当温度处于25 ℃,此时Fe3O4@PMMA-PEI 1800-PAP的固载量可达到126.61 mg/g;固定化温度为25 ℃,解吸率最低为10.76%;交联温度升高到30 ℃,固载量下降至120.27 mg/g,解吸率上升,原因可能为:随着温度升高戊二醛的有效成分容易跟氧气发生氧化和自聚反应,温度越高,氧化和自聚反应加快,破坏了戊二醛与PEI上的氨基形成席夫碱进而影响立体空间网状结构的形成,降低PAP的交联封装与固定化[32];此外,温度升高可能造成PAP的热力学运动频率加剧,PAP更易发生解吸作用,当加入1 mol/L NaCl的洗脱液,PAP就容易从载体上脱落,造成Fe3O4@PMMA-PEI 1800-PAP的解吸率升高。这与李有花[33]的研究略有不同,通过计算机虚拟筛选的分子对接技术从分子数据库中筛选并设计出固定化分子配基9,9-(2,3-环氧丙基)芴(DDI),以聚乙二醇长链(PEG)为间隔臂将DDI接枝到聚苯乙烯微球上,制备了Ⅰ、Ⅱ、Ⅲ三种类型的载体(PS-PEG-DDI),选择PS-PEG-DDI(Ⅱ)型载体作为PAP的定向固定化载体,其最佳固定化温度为40 ℃,此时PAP的固载量为120.95 mg/g。李有花[33]对PAP的定向固定化温度为40 ℃时固载量为120.95 mg/g,而本研究在使用Fe3O4@PMMA-PEI 1800固定化PAP时在温度25 ℃时酶的固载量可达126.61 mg/g,这与制备的固定化载体有关,在一定范围内反应温度越低越能节省时间和经济成本。当交联温度达到40 ℃时,PAP在载体上出现了较为严重的解吸现象,因此,选择25 ℃作为最佳交联反应的温度。
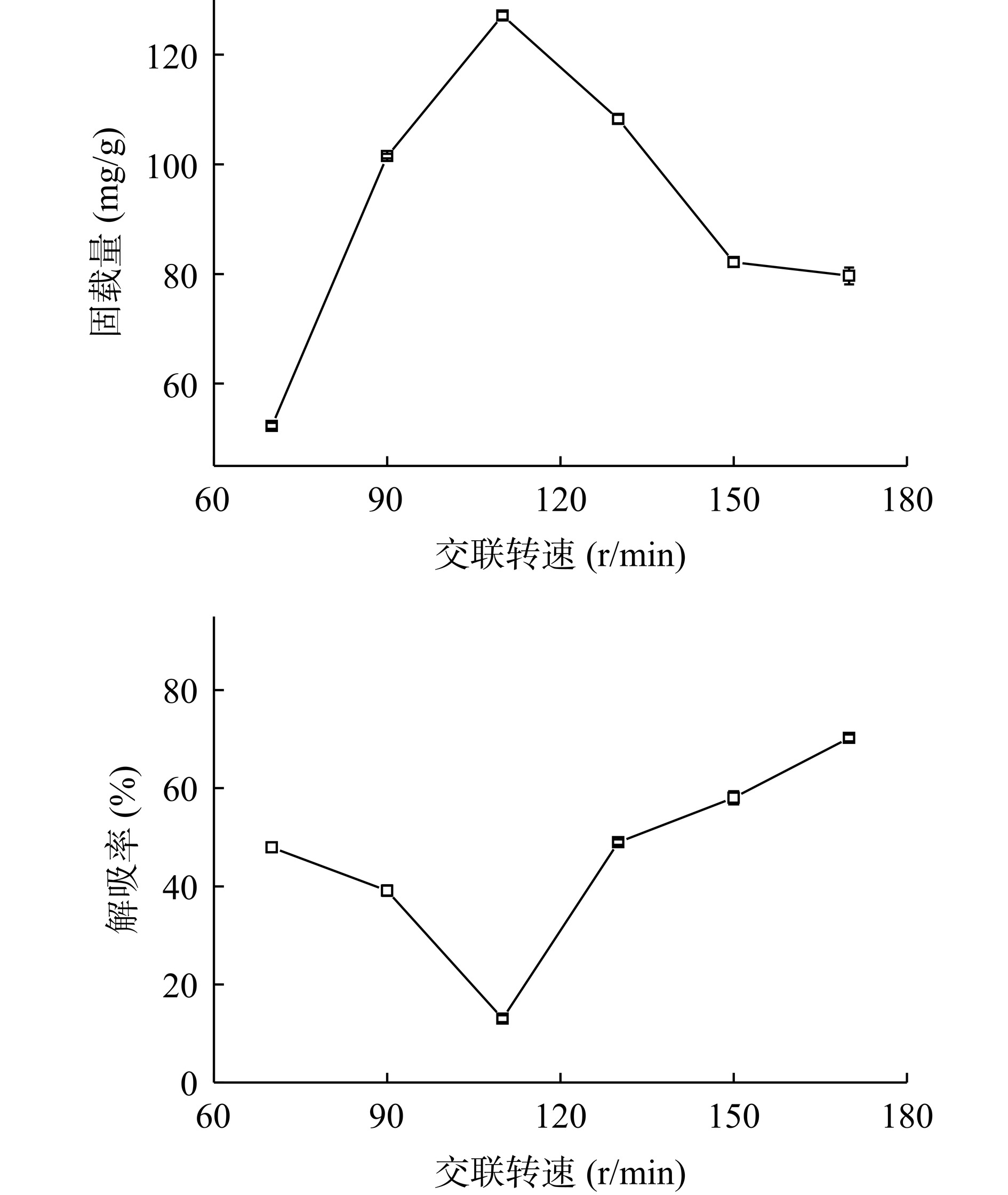
2.3.4 转速的影响
由图6中可以看出,摇床转速在70~170 r/min范围内增加,随着交联反应时摇床转速增加,Fe3O4@PMMA-PEI 1800对PAP的固载量呈现先升后降,解吸率先降后升的趋势。当交联转速为110 r/min时,固载量达到127.15 mg/g,此时解吸率为13.01%;当交联反应转速较低时,反应尚未充分进行,适宜的转速能够提高反应体系中分子的运动,增加反应物之间的接触机会,过度的转速造成反应体系处于剧烈振荡的状态,影响蛋白酶的空间结构保持稳定的状态而导致酶活力下降,也不利于交联封装反应的进行,因此,选择最佳转速为110 r/min作为后续实验的条件。
2.4 响应面试验结果分析
2.4.1 响应面试验结果及模型分析
选择交联时间(A)、戊二醛浓度(B)、交联转速(C)作为自变量,以Fe3O4@PMMA-PEI 1800对PAP的固载量为响应值(Y)进行响应面试验,结果如表5所示。
表 5 响应面试验设计及结果Table 5. Response surface experimental design and results试验号 A B C Y(mg/g) 1 −1 −1 0 77.80 2 −1 1 0 103.30 3 0 0 0 120.71 4 0 −1 −1 116.36 5 0 0 0 121.33 6 0 −1 1 99.56 7 1 −1 0 94.59 8 1 0 −1 116.98 9 1 1 0 84.64 10 0 0 0 126.31 11 −1 0 1 105.78 12 0 0 0 128.17 13 0 0 0 124.44 14 1 0 1 108.27 15 0 1 −1 110.76 16 −1 0 −1 107.65 17 0 1 1 116.98 使用Desigh-Expert软件进行多变量非线性回归拟合,得到Fe3O4@PMMA-PEI 1800对PAP固载量对交联时间(A)、戊二醛浓度(B)、交联转速(C)的二次项回归方程:Y=124.19+1.24A+3.42B−2.65C−8.86AB−1.71AC+5.75BC−17.68A2−16.43B2+3.16C2。
回归方程模型P值<0.0001,模型差异性极显著,具有统计学意义;模型决定系数R2=0.9799,调整决定系数R2adj=0.9541,表示该模型可以预测95.41%响应值的变化情况,该模型能较好地分析预测Fe3O4@PMMA-PEI 1800对PAP的固定化情况。模型方差分析结果如表6所示。模型失拟项为P=0.5448>0.05,失拟项不显著,模型误差小,表明不确定因素对本试验的影响不大。三个因素中,Fe3O4@PMMA-PEI 1800磁性微球对PAP固载量产生影响的主次顺序为:戊二醛浓度(B)>交联转速(C)>交联时间(A)。从表6中可看出,一次项戊二醛浓度(B)、交联转速(C)对固载量的影响为显著(P<0.05),二次项AB、BC交互作用对固载量的影响为较显著(P<0.01),二次项交联时间与交联转速AC之间的交互作用影响为不显著(P>0.05),平方项A²、B2对固载量产生极显著的影响(P<0.0001)。
表 6 响应面回归模型方差分析Table 6. Analysis of variance in response surface regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型项 3215.62 9 3215.62 37.98 <0.0001 *** A 12.38 1 12.38 1.32 0.2891 B 93.64 1 93.64 9.95 0.0160 * C 55.97 1 55.97 5.95 0.0448 * AB 314.18 1 314.18 33.40 0.0007 ** AC 11.70 1 11.70 1.24 0.3017 BC 132.48 1 132.48 14.08 0.0071 ** A² 1315.73 1 1315.73 139.86 <0.0001 *** B² 1136.92 1 1136.92 120.85 <0.0001 *** C² 41.92 1 41.92 4.46 0.0727 残差 65.85 7 9.41 失拟项 25.17 3 8.39 0.82 0.5448 不显著 纯误差 40.69 4 10.17 总差 3281.48 16 注:***代表差异极显著(P<0.0001),**代表差异较显著(P<0.01),*代表差异显著(P<0.05)。 2.4.2 验证实验
Design Expert软件分析,Fe3O4@PMMA-PEI 1800- PAP的最佳固定化条件为:交联时间为31.63 min、戊二醛浓度为0.02%、交联温度为25 ℃、交联转速为90 r/min。根据实际情况设置实验条件:交联时间32 min,戊二醛浓度0.02%、交联温度25 ℃、交联转速90 r/min,该条件下实验重复三次,Fe3O4@PMMA-PEI 1800对PAP的固载量为139.80 mg/g,预测值为130.27 mg/g。
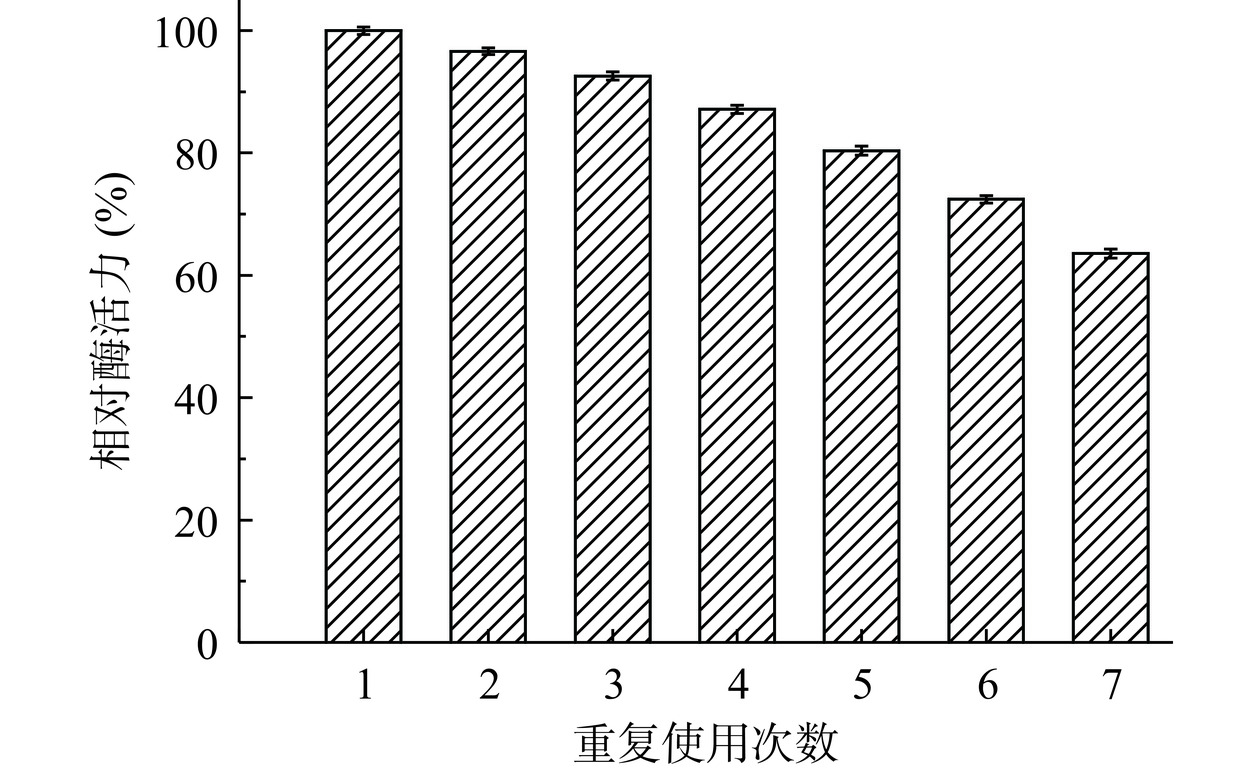
2.5 固定化酶的重复使用性
考察Fe3O4@PMMA-PEI 1800-PAP的重复使用性,由图7可知,Fe3O4@PMMA-PEI 1800-PAP经过多次使用后,酶活力随使用次数的增加而下降,重复使用5次后,相对酶活力还能保持(80.35±0.74)%,重复使用7次后,相对酶活力保留(63.54±0.76)%。与其他同类研究相比,汤燕明等[34]研究的氮掺杂多孔碳材料,其固定化PAP重复使用5次后,相对酶活力保留至原来的46.70%。对比发现经Fe3O4@PMMA-PEI 1800固定化的PAP在重复使用性上有较大的改善提高,其原因可能是Fe3O4@PMMA-PEI 1800的比表面积较大,PAP在经过固定化后能更多进入载体孔隙内并被保留,多次使用后仍保持较高的相对酶活。
3. 结论
对Fe3O4@PMMA微球表面PMMA酯解使其形成羧基,测得Fe3O4@PMMA表面的羧基含量为0.95 mmol/g;Fe3O4@PMMA-PEI对PAP的固定化能力可通过接枝PEI的分子量进行调控,接枝不同分子量PEI(600/1800/70000)作为空间臂,Fe3O4@PMMA-PEI 600、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 70000的氨基含量分别为:0.16、0.33、0.48 mmol/g,分子量越大,PEI链越长,发生卷曲缠绕的可能性也越大,不利于酶在长链上的固定。化学滴定法、SEM微观结构、FTIR图谱分析的实验结果都表明PEI成功接枝在Fe3O4@PMMA表面。制备核-壳结构的纳米磁球Fe3O4@PMMA,球体大小基本均匀且外表光滑,粒径约为150~200 nm。Fe3O4@PMMA-PEI 1800对PAP的最佳固载量的工艺条件:交联时间为32 min、戊二醛浓度为0.02%、交联温度为25 ℃、交联转速为90 r/min,该条件下Fe3O4@PMMA-PEI 1800对PAP的固载量为139.80 mg/g。固定化酶Fe3O4@PMMA-PEI 1800-PAP经过5次重复使用之后,相对酶活力能保持80.35%,重复使用7次之后,其相对酶活力仍然保留63.54%。
本研究从制备核-壳结构的纳米磁球Fe3O4@PMMA入手,制备了具有磁响应性、粒径均一、低毒性、良好的生物相容性的固定化酶载体,并对木瓜蛋白酶起到较好的固定化作用,表明该纳米磁球具有良好的装载蛋白的能力,不但为固定其它种类的蛋白酶提供借鉴方法和参考依据,对于开发新型的复合纳米载药系统也提供了探索的思路。
-
表 1 因素及编码水平
Table 1 Factor and coding level
水平 因素 A交联时间(min) B戊二醛浓度(%) C交联转速(r/min) −1 15 0.01 90 0 30 0.02 110 1 45 0.03 130 表 2 纳米磁球氨基含量
Table 2 Amino content of nanomagnetic spheres
微球类型 氨基含量(mmol/g) Fe3O4@PMMA-PEI 600 0.16±0.09 Fe3O4@PMMA-PEI 1800 0.33±0.07 Fe3O4@PMMA-PEI 70000 0.48±0.04 表 3 磁性微球对BSA、PAP的固定化情况
Table 3 Immobilization of magnetic microspheres on BSA and PAP
样品 微球类型 固载量(mg/g) BSA Fe3O4@PMMA 44.84±0.23d Fe3O4@PMMA-PEI 600 49.19±0.46c Fe3O4@PMMA-PEI 1800 95.83±0.16b Fe3O4@PMMA-PEI 70000 98.94±0.22a PAP Fe3O4@PMMA 31.65±0.09d Fe3O4@PMMA-PEI 600 107.46±0.30b Fe3O4@PMMA-PEI 1800 120.71±0.34a Fe3O4@PMMA-PEI 70000 100.19±0.34c 注:不同小写字母表示组间数据差异显著(P<0.05)。 表 4 不同纳米磁球的性质特点
Table 4 Characteristics of different nanomagnetic spheres
表 5 响应面试验设计及结果
Table 5 Response surface experimental design and results
试验号 A B C Y(mg/g) 1 −1 −1 0 77.80 2 −1 1 0 103.30 3 0 0 0 120.71 4 0 −1 −1 116.36 5 0 0 0 121.33 6 0 −1 1 99.56 7 1 −1 0 94.59 8 1 0 −1 116.98 9 1 1 0 84.64 10 0 0 0 126.31 11 −1 0 1 105.78 12 0 0 0 128.17 13 0 0 0 124.44 14 1 0 1 108.27 15 0 1 −1 110.76 16 −1 0 −1 107.65 17 0 1 1 116.98 表 6 响应面回归模型方差分析
Table 6 Analysis of variance in response surface regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型项 3215.62 9 3215.62 37.98 <0.0001 *** A 12.38 1 12.38 1.32 0.2891 B 93.64 1 93.64 9.95 0.0160 * C 55.97 1 55.97 5.95 0.0448 * AB 314.18 1 314.18 33.40 0.0007 ** AC 11.70 1 11.70 1.24 0.3017 BC 132.48 1 132.48 14.08 0.0071 ** A² 1315.73 1 1315.73 139.86 <0.0001 *** B² 1136.92 1 1136.92 120.85 <0.0001 *** C² 41.92 1 41.92 4.46 0.0727 残差 65.85 7 9.41 失拟项 25.17 3 8.39 0.82 0.5448 不显著 纯误差 40.69 4 10.17 总差 3281.48 16 注:***代表差异极显著(P<0.0001),**代表差异较显著(P<0.01),*代表差异显著(P<0.05)。 -
[1] YANG O Y, PU S J, WANG J Z, et al. Enzymatic hydrolysate of geniposide directly acts as cross-linking agent for enzyme immobilization[J]. Process Biochemistry,2020,99:187−195. doi: 10.1016/j.procbio.2020.09.006
[2] MAGHRABY Y R, EL-SHABASY R M, IBRAHIM A H, et al. Enzyme immobilization technologies and industrial applications[J]. ACS Omega,2023,8(6):5184−5196. doi: 10.1021/acsomega.2c07560
[3] LU J W, NIE M F, LI Y R, et al. Design of composite nanosupports and applications thereof in enzyme immobilization:A review[J]. Colloids and Surfaces B,2022,217:112602. doi: 10.1016/j.colsurfb.2022.112602
[4] 岳艺. 纳米磁球定序可控固定化蛋白的研究[D]. 北京:北京化工大学, 2017. [YUE Yi. Co-Localization of proteins with defined sequential order and controlled stoichiometric ratio on magnetic nanoparticles[D]. Beijing:Beijing University of Chemical Technology, 2017.] YUE Yi. Co-Localization of proteins with defined sequential order and controlled stoichiometric ratio on magnetic nanoparticles[D]. Beijing: Beijing University of Chemical Technology, 2017.
[5] 肖云燕. PVAC磁性微球表面构建分子笼封装固定化酶及应用[D]. 保定:河北大学, 2022. [XIAO Yunyan. Molecular cage encapsulation of enzyme on PVAC magnetic microspheres and its application[D]. Baoding:Hebei University, 2022.] XIAO Yunyan. Molecular cage encapsulation of enzyme on PVAC magnetic microspheres and its application[D]. Baoding: Hebei University, 2022.
[6] AYOLIO M, GUERRINI A, BRERO F, et al. In-gel study of the effect of magnetic nanoparticles immobilization on their heating efficiency for application in magnetic fluid hyperthermia[J]. Journal of Magnetism and Magnetic Material, 2019, 471: 504-512.
[7] LIN Y L, LIN Y C, WANG L J, et al. Renal perfusion assessment using magnetic nanoparticles with 7T dynamic susceptibility contrast MRI in rats[J]. Journal of Magnetism and Magnetic Materials,2019,475:76−82. doi: 10.1016/j.jmmm.2018.11.041
[8] 郭姣梅, 郝建华, 李晓涵, 等. 磁性纳米粒子的制备及环糊精葡萄糖基转移酶的固定化[J]. 功能材料,2020,51(7):7190−7195. [GUO Jiaomei, HAO Jianhua, LI Xiaohan, et al. Preparation of aminosilanized magnetic nanparticles and immobilization of cyclodextrin glucosyltransferase[J]. Journal of Functional Materials,2020,51(7):7190−7195.] doi: 10.3969/j.issn.1001-9731.2020.07.030 GUO Jiaomei, HAO Jianhua, LI Xiaohan, et al. Preparation of aminosilanized magnetic nanparticles and immobilization of cyclodextrin glucosyltransferase[J]. Journal of Functional Materials, 2020, 51(7): 7190−7195. doi: 10.3969/j.issn.1001-9731.2020.07.030
[9] ZHANG L, WANG C, WU Y, et al. Microwave irradiation-assisted high-efficiency N-glycan release using oriented immobilization of PNGase F on magnetic particles[J]. Journal of Chromatography A,2020,1619:460934. doi: 10.1016/j.chroma.2020.460934
[10] 李婧涵, 董玲. 磁性纳米课题在DNA分离纯化中的应用[J]. 中国农业大学学报,2022,27(9):43−53. [LI Jinghan, DONG Ling. Application of magnetic nanoparticles in DNA separation and purification[J]. Journal of China Agricultural University,2022,27(9):43−53.] doi: 10.11841/j.issn.1007-4333.2022.09.04 LI Jinghan, DONG Ling. Application of magnetic nanoparticles in DNA separation and purification[J]. Journal of China Agricultural University, 2022, 27(9): 43−53. doi: 10.11841/j.issn.1007-4333.2022.09.04
[11] ZHANG K, YANG W Z, LIU Y, et al. Laccase immobilized on chitosan-coated Fe3O4 nanoparticles as reusable biocatalyst for degradation of chlorophenol[J]. Journal of Molecular Structure,2020,1220:128769. doi: 10.1016/j.molstruc.2020.128769
[12] ZHAO J Y, WEI F, XU W L, et al. Enhanced antibacterial performance of gelatin/chitosan film containing capsaicin loaded MOFs for food packaging[J]. Applied Surface Science,2020,510:145418. doi: 10.1016/j.apsusc.2020.145418
[13] XIA G, ZHAI G G, HU M C, et al. Hierarchically porous magnetic Fe3O4/Fe-MOF used as an effective platform for enzyme immobilization:A kinetic and thermodynamic study of structure-activity[J]. Catalysis Science& Technology,2021,11(7):2446−2455.
[14] ZAAK H, KORNECKI J F, SIAR E H, et al. Coimmobilization of enzymes in bilayers using PEI as a glue to reuse the most stable enzyme:Preventing PEI release duringinactivated enzyme desorption[J]. Process Biochemistry,2017,61:95−101. doi: 10.1016/j.procbio.2017.06.014
[15] VIRGEN-ORTIZ J J, DOS S J C S, MURCIA Á B, et al. Polyethylenimine:A very useful ionic polymer in the design of immobilized enzyme biocatalysts[J]. Journal of Materials Chemistry B,2017,5(36):7461−7749. doi: 10.1039/C7TB01639E
[16] 白姝, 朱云风, 孙彦, 等. 聚乙烯亚胺诱导的仿生硅化提高固定化酶的稳定性[J]. 天津大学学报,2021,54(1):10−18. [BAI Shu, ZHU Yunfeng, SUN Yan, et al. Improvement in the stability of immobilized enzyme by polyethylenimine-induced biomimetic silicification[J]. Journal of Tianjin University (Science and Technology),2021,54(1):10−18.] BAI Shu, ZHU Yunfeng, SUN Yan, et al. Improvement in the stability of immobilized enzyme by polyethylenimine-induced biomimetic silicification[J]. Journal of Tianjin University (Science and Technology), 2021, 54(1): 10−18.
[17] ZHANG D H, CHEN N, YANG M N, et al. Effects of different spacer armson cibacron blue modification and protein affinityadsorption on magnetic microspheres[J]. Joumal of Molecular Catalysis B Enzymatic,2016,133:136−143. doi: 10.1016/j.molcatb.2016.08.007
[18] 彭俊标, 马晓国, 陈圆. 聚乙烯亚胺修饰磁性纳米材料固相萃取-火焰原子吸收光谱法测定水样中痕量Mo(VI)[J]. 分析测试学报,2021,40(6):960−964. [PENG Junbiao, MA Xiaoguo, CHEN Yuan. Determination of trace Mo(VI) in water samples by flame atomic absorption spectrometry with polythyleneimine modified magnetic nanomaterials based solid phase extraction[J]. Journal of Instrumental Analysis,2021,40(6):960−964.] doi: 10.3969/j.issn.1004-4957.2021.06.024 PENG Junbiao, MA Xiaoguo, CHEN Yuan. Determination of trace Mo(VI) in water samples by flame atomic absorption spectrometry with polythyleneimine modified magnetic nanomaterials based solid phase extraction[J]. Journal of Instrumental Analysis, 2021, 40(6): 960−964. doi: 10.3969/j.issn.1004-4957.2021.06.024
[19] 豆艺芳. 聚甲基丙烯酸甲酯磁性微球的接枝与修饰及其固载蛋白质的研究[D]. 保定:河北大学, 2018. [DOU Yifang. Graft and modification of poly(methylmethacrylate) magnetic microspheres and the protein immobilization[D]. Baoding:Hebei University, 2018.] DOU Yifang. Graft and modification of poly(methylmethacrylate) magnetic microspheres and the protein immobilization[D]. Baoding: Hebei University, 2018.
[20] 夏玉佩. 磁性微球表面交联封装固定化酶及其催化性能研究[D]. 保定:河北大学, 2019. [XIA Yupei. Cross-linked encapsulation for enayme immobilization and catalytic performance on magnetic microspheres[D]. Baoding:Hebei University, 2019.] XIA Yupei. Cross-linked encapsulation for enayme immobilization and catalytic performance on magnetic microspheres[D]. Baoding: Hebei University, 2019.
[21] 高进. 木瓜蛋白酶加工过程中的性质及结构研究[D]. 天津:天津科技大学, 2018. [GAO Jin. Study on the properties and structure of papain in processing[D]. Tianjin:Tianjin University of Science and Technology, 2018.] GAO Jin. Study on the properties and structure of papain in processing[D]. Tianjin: Tianjin University of Science and Technology, 2018.
[22] 李艳群, 孙路遥, 韩寿德, 等. 分级介孔SiO2空心微球氨基修饰及木瓜蛋白酶固定化[J]. 高校化学工程学报,2022,36(5):708−714. [LI Yanqun, SUN Luyao, HAN Shoude, et al. Amino modification of hierarchical mesoporous SiO2 hollow microspheres and their application in papain immobilization[J]. Journal of Chemical Engineering of Chinese Universities,2022,36(5):708−714.] LI Yanqun, SUN Luyao, HAN Shoude, et al. Amino modification of hierarchical mesoporous SiO2 hollow microspheres and their application in papain immobilization[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(5): 708−714.
[23] 韦美苹, 庞玉凤, 陈正毅, 等. 磁性可再生性固定化酶制备及其在微波辅助蛋白酶解中的应用[J]. 桂林理工大学学报,2014,34(4):748−754. [WEI Meiping, PANG Yufeng, CHEN Zhengyi, et al. Preparation of regenerated immobilized enzyme reactor and application in microwave assisted digestion[J]. Journal of Guilin University of Technology,2014,34(4):748−754.] doi: 10.3969/j.issn.1674-9057.2014.04.025 WEI Meiping, PANG Yufeng, CHEN Zhengyi, et al. Preparation of regenerated immobilized enzyme reactor and application in microwave assisted digestion[J]. Journal of Guilin University of Technology, 2014, 34(4): 748−754. doi: 10.3969/j.issn.1674-9057.2014.04.025
[24] 王胜男, 张莹雪, 林志勇, 等. 纳米磁性微球对人血浆抗体的特异性分离过程[J]. 材料导报,2011,25(8):12−15. [WANG Shengnan, ZHANG Yingxue, LIN Zhiyong, et al. Specific isolation of immunoglobulin G from human plasma with magnetic nanobeads[J]. Materials Reports,2011,25(8):12−15.] WANG Shengnan, ZHANG Yingxue, LIN Zhiyong, et al. Specific isolation of immunoglobulin G from human plasma with magnetic nanobeads[J]. Materials Reports, 2011, 25(8): 12−15.
[25] 李婷婷, 李瑞雪, 冯馨心, 等. 中空多孔磁性Fe3O4/纤维素/海泡石微球异相Fenton催化降解亚甲基蓝[J]. 精细化工,2022,39(9):1858−1865. [LI Tingting, LI Ruixue, FENG Xinxin, et al. Magnetic hollow porous Fe3O4/cellulose/sepiolite microspheres as heterogeneous fenton catalysts for degradation of methylene blue[J]. Fine Chemicals,2022,39(9):1858−1865.] LI Tingting, LI Ruixue, FENG Xinxin, et al. Magnetic hollow porous Fe3O4/cellulose/sepiolite microspheres as heterogeneous fenton catalysts for degradation of methylene blue[J]. Fine Chemicals, 2022, 39(9): 1858−1865.
[26] 江维婷, 李翠苹, 姜晓辉, 等. Fe/Fe3C4/Fe3O4@C磁性微球的制备及吸波性能研究[J]. 材料工程,2022,50(11):81−91. [JIANG Weiting, LI Cuiping, JIANG Xiaohui, et al. Preparation and absorbing properties of Fe/Fe3C4/Fe3O4@C magnetic microspheres[J]. Journal of Materials Engineering,2022,50(11):81−91.] JIANG Weiting, LI Cuiping, JIANG Xiaohui, et al. Preparation and absorbing properties of Fe/Fe3C4/Fe3O4@C magnetic microspheres[J]. Journal of Materials Engineering, 2022, 50(11): 81−91.
[27] 樊建新, 秦亮, 段婷, 等. Fe3O4改性生物质炭对As的吸附特征研究[J]. 重庆交通大学学报,2021,40(10):111−118. [FAN Jianxin, QIN Liang, DUAN Ting, et al. Sorption characteristics of Fe3O4 modifieds biochar on arsenic[J]. Journal of Chongqing Jiaotong University,2021,40(10):111−118.] FAN Jianxin, QIN Liang, DUAN Ting, et al. Sorption characteristics of Fe3O4 modifieds biochar on arsenic[J]. Journal of Chongqing Jiaotong University, 2021, 40(10): 111−118.
[28] 李艳莉. 新型金属螯合载体的制备及对木瓜蛋白酶固定化的应用研究[D]. 杭州:浙江工商大学, 2016. [LI Yanli. Study on the peparation of novel metal chelating carries and their application in immobilizing papain[D]. Hangzhou:Zhejiang Gongshang University, 2016.] LI Yanli. Study on the peparation of novel metal chelating carries and their application in immobilizing papain[D]. Hangzhou: Zhejiang Gongshang University, 2016.
[29] 周冉, 常明, 王飞, 等. 仿生硅化-磁性Fe3O4固定化木瓜蛋白酶的性质[J]. 食品工业科技,2014,35(12):180−183,187. [ZHOU Ran, CHANG Ming, WANG Fei, et al. Property of papain immobilized on magnetic ferroferric oxide by biosilicification[J]. Science and Technology of Food Industry,2014,35(12):180−183,187.] ZHOU Ran, CHANG Ming, WANG Fei, et al. Property of papain immobilized on magnetic ferroferric oxide by biosilicification[J]. Science and Technology of Food Industry, 2014, 35(12): 180−183,187.
[30] 付林俊. 磁性纳米材料固定化漆酶及其属性与性能研究[D]. 武汉:武汉科技大学, 2020. [FU Linjun. Study on the properties of laccase immobilized on magnetic nanomaterials[D]. Wuhan:Wuhan university and Technology, 2020.] FU Linjun. Study on the properties of laccase immobilized on magnetic nanomaterials[D]. Wuhan: Wuhan university and Technology, 2020.
[31] 段秉怡, 王宇, 郭宁宁, 等. 蛋黄-壳结构Fe3O4@ SiO2@ PMO磁性微球的制备及对漆酶的固定化[J]. 高等学校化学学报,2019,40(2):210−215. [DUAN Bingyi, WANG Yu, GUO Ningning, et al. Preparation of yolk-shell Fe3O4@SiO2@PMO magnetic microspheres for laccase immobilization preparation of yolk-shell Fe3O4@SiO2@PMO magnetic microspheres for laccase immobilization[J]. Chemical Journal of Chinese Universities,2019,40(2):210−215.] doi: 10.7503/cjcu20180517 DUAN Bingyi, WANG Yu, GUO Ningning, et al. Preparation of yolk-shell Fe3O4@SiO2@PMO magnetic microspheres for laccase immobilization preparation of yolk-shell Fe3O4@SiO2@PMO magnetic microspheres for laccase immobilization[J]. Chemical Journal of Chinese Universities, 2019, 40(2): 210−215. doi: 10.7503/cjcu20180517
[32] 王露洁, 莫创荣, 陆祖毅, 等. 氨基硅烷功能化磁性材料固定化琼胶酶的性能[J]. 精细化工,2023,40(8):1720−1726. [WANG Lujie, MO Chuangrong, LU Zuyi, et al. Agarase immobilization performance of aminosilane-functionalized magnetic materials[J]. Fine Chemicals,2023,40(8):1720−1726.] WANG Lujie, MO Chuangrong, LU Zuyi, et al. Agarase immobilization performance of aminosilane-functionalized magnetic materials[J]. Fine Chemicals, 2023, 40(8): 1720−1726.
[33] 李有花. 木瓜蛋白酶的定向固定化研究[D]. 无锡:江南大学, 2021. [LI Youhua. Study on the directional immobilization of papain[D]. Wuxi:Jiangnan University, 2021.] LI Youhua. Study on the directional immobilization of papain[D]. Wuxi: Jiangnan University, 2021.
[34] 汤燕明, 孙丽霞, 郑燕宁, 等. 氮掺杂多孔碳材料固定化木瓜蛋白酶研究[J]. 食品科技,2019,44(8):261−267. [TANG Yanming, SUN Lixia, ZHENG Yanning, et al. Study on immobilized papain by N-doped porous carbon material[J]. Food Science and Technology,2019,44(8):261−267.] TANG Yanming, SUN Lixia, ZHENG Yanning, et al. Study on immobilized papain by N-doped porous carbon material[J]. Food Science and Technology, 2019, 44(8): 261−267.
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:

 下载:
下载:



