Preparation of Proanthocyanidins Microcapsules Using Maillard Reaction Products of Whey Protein Isolate-D-Xylose and Study on Their Properties
-
摘要: 本研究选用乳清分离蛋白-D-木糖的混合物,以及二者的美拉德反应产物为原料,分别与海藻酸钠混合制备复合壁材,用于包埋原花青素,制备原花青素微胶囊。通过对不同原花青素微胶囊进行形态表征观察、稳定性研究及体外抗氧化活性评价,阐明微囊化原花青素的优点及美拉德反应产物作为壁材的优势。结果表明,经美拉德反应产物包埋后形成的微胶囊,其包埋率可达98.60%±0.09%,原花青素含量为49.97±0.87 mg/g,粒径大小为1219.61±388.24 μm,且呈现良好的颗粒状形态;相较于壁材未发生美拉德反应的原花青素微胶囊,当环境温度为90 ℃时、或环境pH≤4及pH=10时、或在胃消化液中,均表现更好的稳定性;并且当芯材原花青素浓度达到30 μg/mL时,经美拉德反应产物包埋后形成的微胶囊具有更强的体外抗氧化能力。本研究为原花青素微胶囊的进一步开发利用奠定了基础,为促进原花青素微胶囊食品的开发和发展提供了新思路。Abstract: In this study, a composite wall material was prepared by blending whey protein isolate-D-xylose mixture and their Maillard reaction product with sodium alginate, which were then used for encapsulating proanthocyanidin to fabricate proanthocyanidin microcapsules. By characterizing the morphology, investigating stability, and assessing the in vitro antioxidant activity of different proanthocyanidin microcapsules, the advantages of microencapsulation of proanthocyanidin and the superiority of using Maillard reaction product as a wall material were elucidated. The results indicated that the microcapsules formed using the Maillard reaction product achieved an encapsulation efficiency of 98.60%±0.09%, with a proanthocyanidin content of 49.97±0.87 mg/g and a particle size of 1219.61±388.24 μm, exhibiting good granular morphology. Compared to microcapsules without the Maillard reaction, those formed with it demonstrated enhanced stability under conditions of 90 ℃, pH≤4, pH=10, and in gastric digestion fluid. Furthermore, when the proanthocyanidin concentration reached 30 μg/mL, the microcapsules formed with the Maillard reaction product exhibited stronger in vitro antioxidant activity. This study lays the groundwork for further development and utilization of proanthocyanidin microcapsules, offering new insights into the development and advancement of proanthocyanidin microcapsule food products.
-
Keywords:
- proanthocyanidin /
- Maillard reaction product /
- microcapsules /
- in vitro antioxidation
-
我国葡萄资源十分丰富,其产量位居世界前列,90%的葡萄用于酿酒和葡萄汁的制作,会产生大量副产物(如葡萄皮、葡萄籽),压榨后的葡萄渣中葡萄籽占52%[1−3]。葡萄籽只作为肥料或者废弃物而不能得到充分利用,资源利用率从而下降。葡萄籽中含有丰富的原花青素(Proanthocyanidin,PC),是一种黄烷-3-醇单体构成的多酚化合物,也称缩合单宁,被称为天然抗氧化剂,具有清除自由基、缓解疲劳以及抑菌消炎等多种生理功效[4],现主要应用于食品、药品及化妆品行业[5-8]。由于原花青素酚羟基结构不稳定,易受外界因素影响,发生降解,从而降低葡萄原花青素所具有的功效[9−10]。为扩大原花青素在食品中的应用,并针对原花青素不稳定的弊端,本文选择利用微胶囊这一技术对原花青素进行包埋。
微胶囊是一种微型“容器”或“包装物”,具有半透性或密封性,能够包裹和保护一些不稳定物质[11−12]。微胶囊技术能有效隔绝外界环境,被广泛应用于保护多酚类等易受外界环境影响的物质。在生物聚合物中,乳清分离蛋白因其卓越的氧气阻隔性能和成本优势而备受瞩目;然而,乳清分离蛋白在成膜过程中存在固有的低刚度和防水性能差等缺点,限制了其在食品领域的应用[13]。为克服这些问题,将乳清分离蛋白与多糖结合是一种有效策略,多糖的添加有助于减轻蛋白质粒的聚集问题,从而改善乳清分离蛋白的溶解性和流动性[14]。并且蛋白质的氨基基团与糖的还原端羰基在高温下所得的美拉德反应产物,具有显著的抗氧化效果,该产物被认为是一种新型功能性生物聚合物。同时,由β-D-甘露糖醛酸和α-L-古罗糖醛酸组成的天然无毒高分子物质海藻酸钠,是制备微胶囊的常见包封材料[15]。利用海藻酸钠包埋活性物质,微胶囊可获得良好的稳定性、肠溶性和缓释效果[16−18]。这一技术在食品科学和药物传递领域展现了广阔的应用前景。
本研究以乳清分离蛋白和木糖的混合物,以及它们的美拉德反应产物为原料,分别与海藻酸钠混合制备复合壁材,对芯材原花青素进行包埋,构建两种不同类型的原花青素微胶囊。通过对不同原花青素微胶囊的形貌表征、稳定性及体外抗氧化活性的对比分析,选择出对原花青素有保护作用的优势壁材。本研究可为原花青素微胶囊进一步开发利用奠定基础,在丰富原花青素产品类型上提供新思路。
1. 材料与方法
1.1 材料与仪器
葡萄籽提取物(PC,原花青素≥95%) 陕西新耀生物技术有限公司;乳清分离蛋白(WPI 90) 济南德润食品配料有限公司;木糖(食品级) 郑州三禾食品添加剂有限公司;海藻酸钠、氯化钙 食品级,上海鑫泰实业有限公司;正丁醇、硫酸铁铵、甲醇、盐酸、柠檬酸钠 分析纯,天津市致远化学试剂有限公司;人工胃液(SGF)、人工肠液(SIF) 福州飞净生物科技有限公司;DPPH自由基清除能力(G0128F)、羟自由基清除能力(G0125F)、ABTS+自由基清除能力(G0127F)、超氧阴离子自由基清除能力(G0129F)、总抗氧化能力(G0115F)检测试剂盒 苏州格锐思生物科技有限公司。
D-8紫外可见分光光度计 让奇(上海)仪器科技有限公司;HH-8数显恒温水浴锅 江阴市保利科研器械有限公司;AE2000-T倒置显微镜 麦克迪奥实业集团有限公司;LGJ-12真空冷冻干燥机 上海腾方仪器设备有限公司;F2004N电子天平 上海菁海仪器有限公司;101-E电热鼓风干燥箱 北京市永光明医疗仪器有限公司;KQ2200超声波清洗机 昆山市超声仪器有限公司;ZWY-200D智城恒温培养振荡器 上海智城分析仪器制造有限公司;ZEISS Sigma 300扫描电子显微镜(SEM) 卡尔蔡司光学有限公司;Thermo Scientific Nicolet iS20傅里叶红外光谱(FTIR) 赛默飞世尔科技公司。
1.2 实验方法
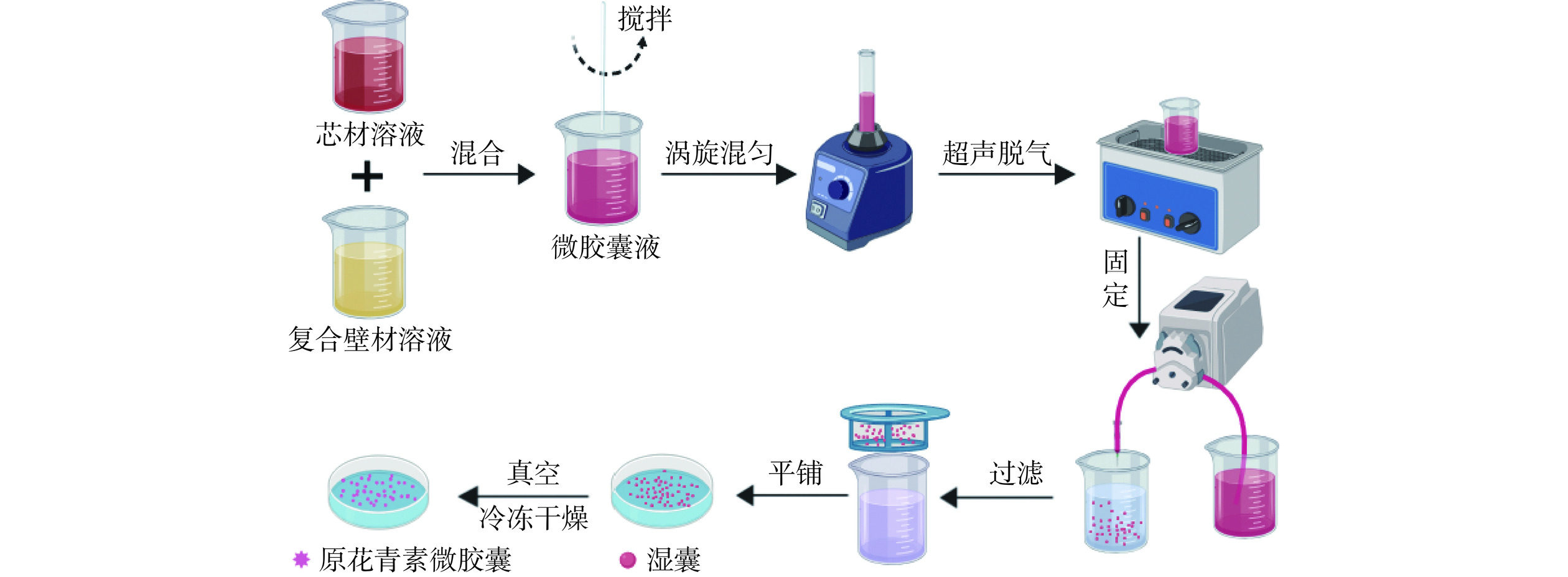
1.2.1 原花青素微胶囊工艺流程
根据王道滇等[19]和张欢等[20]的方法稍作修改,工艺流程如图1所示。
1.2.2 溶液的配制
壁材溶液Ⅰ:乳清分离蛋白与D-木糖按2:1(m:m)混合后,用蒸馏水充分溶解,为壁材溶液Ⅰ;
壁材溶液Ⅱ:乳清分离蛋白与D-木糖的比例为2:1(m:m),用蒸馏水充分溶解,在70 ℃条件下,加热1 h,制备美拉德反应产物(MRPs)为壁材溶液Ⅱ[21];
微胶囊固定液:2.0wt%的氯化钙溶液;
微胶囊解囊液:2.0wt%的柠檬酸钠溶液;
正丁醇-盐酸溶液:将正丁醇与盐酸按95:5(v:v)的比例混合;
硫酸铁铵溶液:用浓度为2 mol/L盐酸配制成2%的硫酸铁铵溶液。
1.2.3 原花青素微胶囊的制备
原花青素微胶囊Ⅰ(ME-WPI-X-PC):海藻酸钠溶胀过夜后与壁材溶液Ⅰ混合,制备复合壁材溶液Ⅰ,其中海藻酸钠2wt%,壁材溶液10wt%;PC用蒸馏水配制成25 mg/mL,作为芯材溶液;按照4:6(m:m)的芯壁比,向复合壁材溶液Ⅰ中加入芯材溶液,混合均匀后,超声脱气,得到微胶囊液;利用蠕动泵在流速20 mL/min的条件下,将微胶囊液滴加至微胶囊固定液中,固定30 min后,抽滤并用蒸馏水冲洗2~3次至滤液澄清,制得湿囊,经真空冷冻干燥,得到ME-WPI-X-PC;
原花青素微胶囊Ⅱ(ME-MRPs-PC):海藻酸钠溶胀过夜后与壁材溶液Ⅱ混合,制备复合壁材溶液Ⅱ;后续同“ME-WPI-X-PC”,得到ME-MRPs-PC;
空微胶囊Ⅰ(ME-WPI-X):将复合壁材溶液Ⅰ,混合均匀超声脱气后,利用蠕动泵直接滴加至微胶囊固定液中,方法同上,得到ME-WPI-X;
空微胶囊Ⅱ(ME-MRPs):利用复合壁材溶液Ⅱ,方法同上,得到ME-MRPs。
1.2.4 傅里叶红外光谱(FTIR)
在干燥的环境中,取适量干燥的样品和溴化钾粉末加入研钵中,充分研磨多次,放入压片机上压片,测试时先采集背景,然后采集样品的红外光谱,分辨率4 cm−1,扫描次数为32次,测试波数范围为500~4000 cm−1。
1.2.5 原花青素波长扫描及标曲建立
铁盐催化比色法测定原花青素含量[22−23]。称取恒重原花青素标准品用甲醇溶解,配制成浓度为0、10、25、50、75、100 μg/mL的标准待测溶液。将6 mL正丁醇-盐酸溶液、0.2 mL硫酸铁铵溶液、1 mL待测液依次加入20 mL顶空瓶中,加盖密封,轻微振荡混匀,在100 ℃烘箱内,加热40 min,加热显色后立即放置在冰水中冷却15 min,显色在1 h内稳定。以0 μg/mL为空白对照,在紫外400~800 nm波长间进行扫描,扫描间隔1.0 nm,绘制紫外吸收光谱图,并选择最适吸收峰,拟合标准曲线。
1.2.6 原花青素微胶囊包埋率测定
准确向固定液中滴加1:1(m:m)的原花青素微囊液进行固定,待30 min后取其上清液1 mL,溶于1 mL 60%乙醇待测。测定方法同“1.2.5”,测得吸光度代入标曲得原花青素浓度,同样方法测定原花青素微囊液中原花青素浓度,按公式(1)计算微胶囊包埋率。
微胶囊包埋率(%)=C1−C2C1×100 (1) 式中:C1为微胶囊液中原花青素浓度,μg/mL;C2为固定后上清液中原花青素浓度,μg/mL;
1.2.7 原花青素微胶囊含量测定
称取适量微囊,加入10 mL解囊液,超声辅助溶解30 min,完全溶解后,吸取0.2 mL用60%乙醇定容至5 mL待测,测定方法同“1.2.5”,按公式(2)计算微胶囊中原花青素含量。
原花青素含量(mg/g)=C×V×D×10−3W (2) 式中:C为微胶囊液中原花青素浓度,μg/mL;V为加入解囊液体积,mL;D为用60%乙醇稀释倍数;W为样品质量,g。
1.2.8 微胶囊形态表征
显微镜观察:将微胶囊平铺于载玻片,进行形貌观察;利用显微镜成像系统的三点法圆度测量,随机测定50个微胶囊,进行平均粒径的计算。
扫描电镜观察(SEM):取适量干燥后的微胶囊样品粘在导电胶上,并使用Quorum SC 7620溅射镀膜仪喷金45 s,喷金为5 mA;随后使用ZEISS GeminiSEM 300扫描电子显微镜拍摄样品形貌,形貌拍摄时加速电压为3 kV。
1.2.9 原花青素微胶囊热重分析
称取适量样品于坩埚中,分别以空气和氮气为气体氛围,升温区间为40~800 ℃,升温速度为10 ℃/min,在温度不断上升的过程中,测定样品在不同气体氛围下的质量损失。
1.2.10 原花青素微胶囊化稳定性分析
1.2.10.1 热稳定性分析
称取适量样品,加入蒸馏水,分别在10、30、50、70、90 ℃条件下,反应3 h,反应前后测定原花青素含量,方法同“1.2.7”,按公式(3)计算原花青素保留率[24]。
原花青素保留率(%)=反应后原花青素含量反应前原花青素含量×100 (3) 1.2.10.2 pH稳定性分析
称取适量样品,分别加入适量pH为2、4、6、8、10的水溶液,反应3 h,反应前后测定原花青素含量,方法同“1.2.7”,并计算原花青素保留率。
1.2.10.3 体外消化稳定性
胃消化稳定性:称取适量样品,加入人工胃液,在37 ℃恒温振荡培养箱内,180 r/min振荡消化2.5 h,每隔30 min测定原花青素含量,方法同“1.2.7”,并计算原花青素保留率,每次取样后用等体积人工胃液补足。
肠消化稳定性:称取适量样品,加入适量人工肠液,在37 ℃恒温振荡培养箱内,180 r/min振荡消化5 h,每隔1 h测定原花青素含量,方法同“1.2.7”,并计算原花青素保留率,每次取样后用等体积人工肠液补足[25−26]。
1.2.11 原花青素微胶囊体外抗氧化活性测定
称取适量样品,加入解囊液,辅助超声破碎30 min,得到相同原花青素浓度的待测液体。按照试剂盒方法对样品进行DPPH自由基清除能力、ABTS+自由基清除能力、羟自由基清除能力、超氧阴离子清除能力及总抗氧化能力(T-AOC)测定[27−28]。
1.3 数据处理
所有测量至少重复3次,所有结果均显示为平均值±标准差。本实验使用Origin 2021和GraphPad Prism 9软件对数据进行处理及作图分析,P<0.05作为差异显著的界值,P<0.01作为差异极显著的界值。
2. 结果与分析
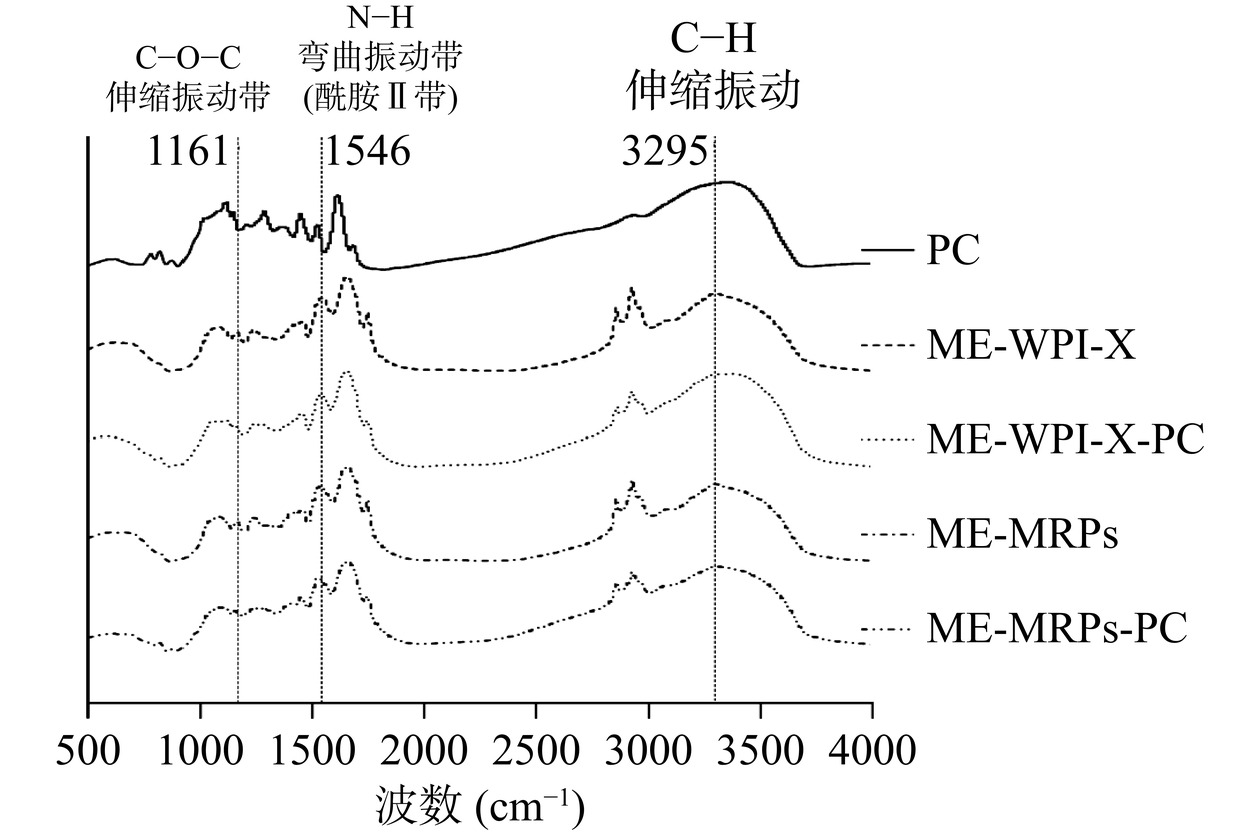
2.1 不同壁材原花青素微胶囊的傅里叶红外光谱图
由图2可知,PC在波数3349 cm−1处有一个强且宽的−OH伸缩振动带,1520、1610 cm−1是多酚化合物的苯环骨架振动吸收峰,出现在2000~1666 cm−1内的1681 cm−1是强度很弱的泛频峰,1369 cm−1处中等强度的宽峰都是由=CH的弯曲振动引起;在低频指纹区1300~400 cm−1内,1284、1143、1111 cm−1是C-O-C的伸缩振动带,剩余1000~400 cm−1内的弱峰是由一些C-O单键的伸缩振动及C-H、O-H等含氢基团的弯曲振动产生。
ME-WPI-X光谱图中,在3295 cm−1处为N-H伸缩振动,2924、2852 cm−1处的特征峰与C-H伸缩振动有关,主要的峰值有1654、1546和1454 cm−1分别是由C=O伸缩振动(酰胺Ⅰ带)、N-H弯曲振动(酰胺Ⅱ带)、C-H(酰胺Ⅲ带)引起的;ME-MRPs与ME-WPI-X的酰胺Ⅱ带吸收峰相比,发生了11 cm−1的红移,且峰强增加,产生这一现象的原因是乳清分离蛋白的氨基与D-木糖发生共价结合,使蛋白质空间结构发生变化[21,29]。PC的搭载使得ME-WPI-X与ME-MRPs在3295 cm−1处C-H伸缩振动带分别向3367、3297 cm−1处发生不同程度的蓝移;同时二者在低频率指纹区1300~400 cm−1的吸收峰均发生红移,且1161、1162 cm−1处的吸收峰受PC的C-O-C伸缩振动带的影响,导致ME-WPI-X-PC与ME-MRPs-PC在该处的吸收峰被覆盖。
综上所述,乳清分离蛋白与D-木糖经高温处理后发生共价结合,产生MRPs,且PC可能被包埋。
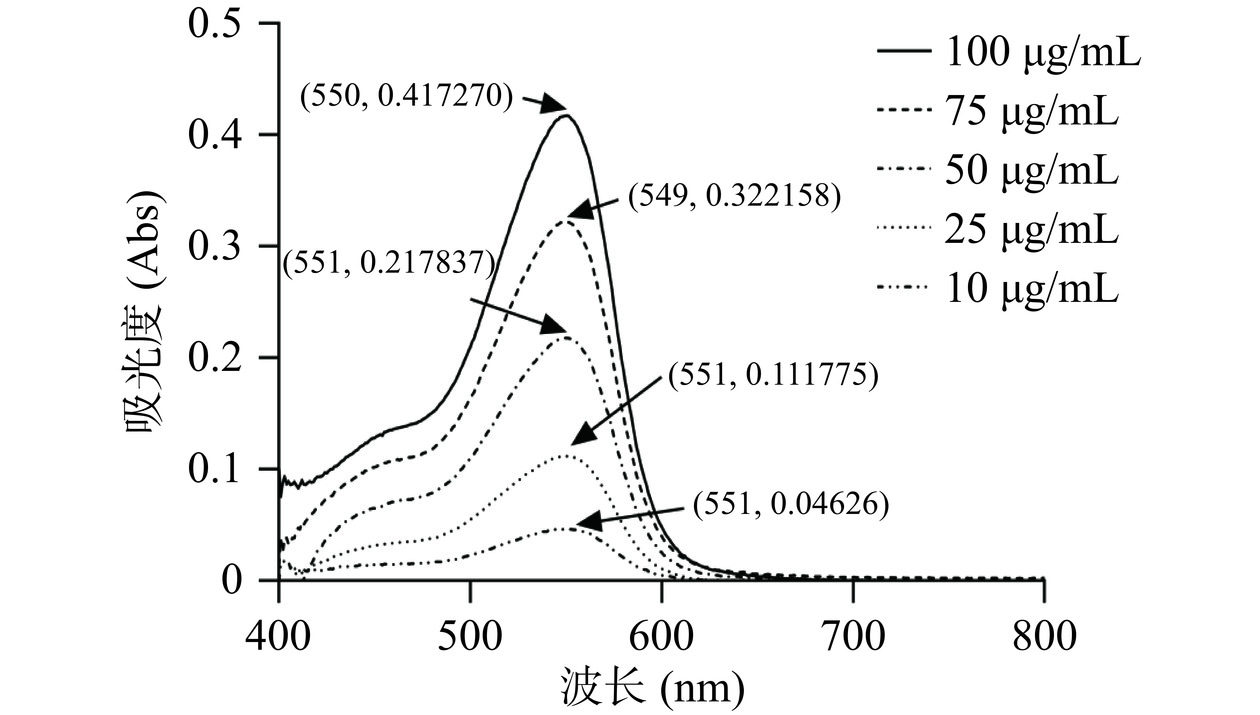
2.2 原花青素波长扫描及标准曲线建立
取浓度为10、25、50、75、100 μg/mL的原花青素标准待测溶液,在400~800 nm可见光波长范围内进行扫描,扫描图谱见图3。
由紫外吸收光谱可知原花青素标准溶液在549、550、551 nm处有最大吸收峰,是因原花青素在酸性条件下加热,会发生氧化还原反应,转变为红色的花青素,花青素再与硫酸铁铵反应可生成较深颜色的化合物,该化合物在550 nm处有最大吸收峰[22]。经拟合,550 nm处回归方程为Y=0.0042X+0.0046,R2=0.9993,表明0~100 μg/mL浓度范围内原花青素在550 nm处有良好的线性关系。
2.3 原花青素微胶囊理化性质
如表1所示,ME-WPI-X-PC和ME-MRPs-PC包埋率分别为98.57%±0.10%、98.60%±0.09%;原花青素含量分别为49.90±0.80 mg/g、49.97±0.87 mg/g;且二者粒径大小也相对接近,分别为1238.74±385.26 μm和1219.61±388.24 μm。这种现象可能是因为乳清分离蛋白、D-木糖和海藻酸钠之间的相互作用,包括物理上的包裹、离子间的相互吸引和氢键的作用力等[21],使得微囊中原花青素的包埋率没有较大区别,有助于形成稳定的微胶囊颗粒。
表 1 原花青素微胶囊理化性质Table 1. Physicochemical properties of proanthocyanidin microcapsules原花青素微胶囊 包埋率(%) 原花青素含量(mg/g) 粒径(μm) ME-WPI-X-PC 98.57±0.10 49.90±0.80 1238.74±385.26 ME-MRPs-PC 98.60±0.09 49.97±0.87 1219.61±388.24 2.4 原花青素微胶囊形貌表征观察
2.4.1 显微镜观察
由图4可知,两种湿囊均呈现良好颗粒状,这是由于氯化钙固定液为复合壁材溶液提供钙源,钙离子嵌入壁材中,形成不溶于水的“蛋盒”结构[30],均匀地分布在凝胶表面,包埋原花青素形成微胶囊。ME-WPI-X-PC湿囊呈现近似椭球状,有些许条状拖尾且大小较为均一,干燥后有大量微囊碎片存在,如图4C所示,可能是条状微囊在真空高压的情况下受力不均匀导致;ME-MRPs-PC湿囊呈现出明显圆球状,大小均一,呈红棕色,干燥后分布均匀,如图4D所示。该现象表明MRPs作为微胶囊壁材使微胶囊颜色加深且与海藻酸钠复配具有良好的凝胶性。
2.4.2 扫描电镜观察
由图5可知,ME-WPI-X-PC与ME-MRPs-PC两种原花青素微胶囊,结构均因冷冻干燥过程中水分快速蒸发、大气压力下降,导致微胶囊表面呈现皱缩、凹陷等现象。如图5A所示,其中ME-WPI-X-PC表面皱缩程度较为明显,表面存在大量细小残片,详见图5B。由MRPs作为壁材的ME-MRPs-PC受冷冻干燥的影响后,微囊皱缩程度较轻,表面相对光滑,整体较为规则,存在少许细小颗粒,如图5D所示。该现象可能是因为乳清分离蛋白和木糖经过高温处理,有利于物质间的疏水相互作用,并降低了复合壁材的黏性,可以更加稳定地附着在海藻酸钙“蛋盒”结构之间的连接区,形成致密的网络结构[31]。结果表明MRPs作为壁材有较强的机械性能。
2.5 原花青素微胶囊化稳定性研究
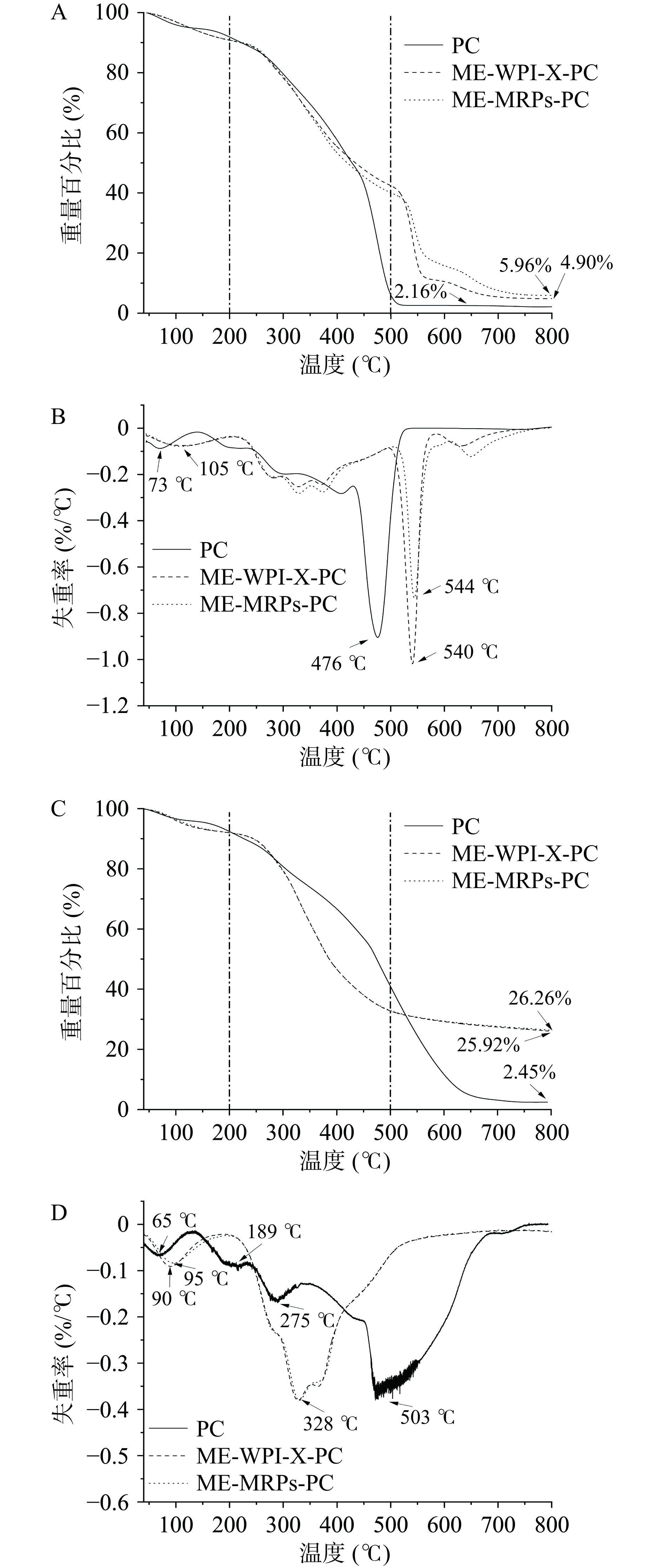
2.5.1 热重分析
根据热重分析,如图6所示,可将PC、ME-WPI-X-PC和ME-MRPs-PC在两种气体氛围下的失重均可分为三个阶段。
第一阶段为低于200 ℃时,该阶段的质量损失与水分的蒸发以及小分子的酚酸降解有关;如图6B所示,空气氛围下PC首次降解峰值在73 ℃附近,两种微胶囊在105 ℃时达到第一阶段降解峰值;同时图6D所示,氮气氛围下PC首次降解峰值在65 ℃附近,并在该阶段189 ℃附近达到第二次降解峰值,而ME-WPI-X-PC和ME-MRPs-PC首次降解峰值分别是在90 ℃、95 ℃。
第二阶段为200~500 ℃时,该阶段是由化学键的断裂引起失重;PC在该阶段低聚原花青素大量降解,在空气氛围下于476 ℃达到降解峰值,PC发生脱水、分解甚至碳化几乎损失所有重量,在氮气氛围下持续降解,于275 ℃达到该阶段降解峰值;而ME-WPI-X-PC和ME-MRPs-PC的失重源自N-H键以及共价肽键的断裂[26],在两种气体氛围下均持续降解。
第三阶段为高于500 ℃,在空气氛围下,PC进入该阶段时发生解聚,在510 ℃附近PC完全损失,降解至2.16 %,ME-WPI-X-PC和ME-MRPs-P分别于540 ℃、544 ℃达到降解速率峰值,均明显高于PC;在氮气氛围下,PC持续损失,于503 ℃达到降解峰值,且于650 ℃附近完全损失,降解至2.45 %,而两种微囊,在该阶段质量损失小,相对稳定,维持在69.00 %附近,即壁材对芯材起到保护作用,提高了芯材的稳定性。且两种氛围下ME-WPI-X-PC和ME-MRPs-PC在第一阶段的首次降解峰值对应的温度在90~105 ℃,可以满足大多数食品的加工需求。综上结果表明,微胶囊化对PC的高温分解能起到缓解作用,而提高原花青素的热稳定性。
2.5.2 热稳定性分析
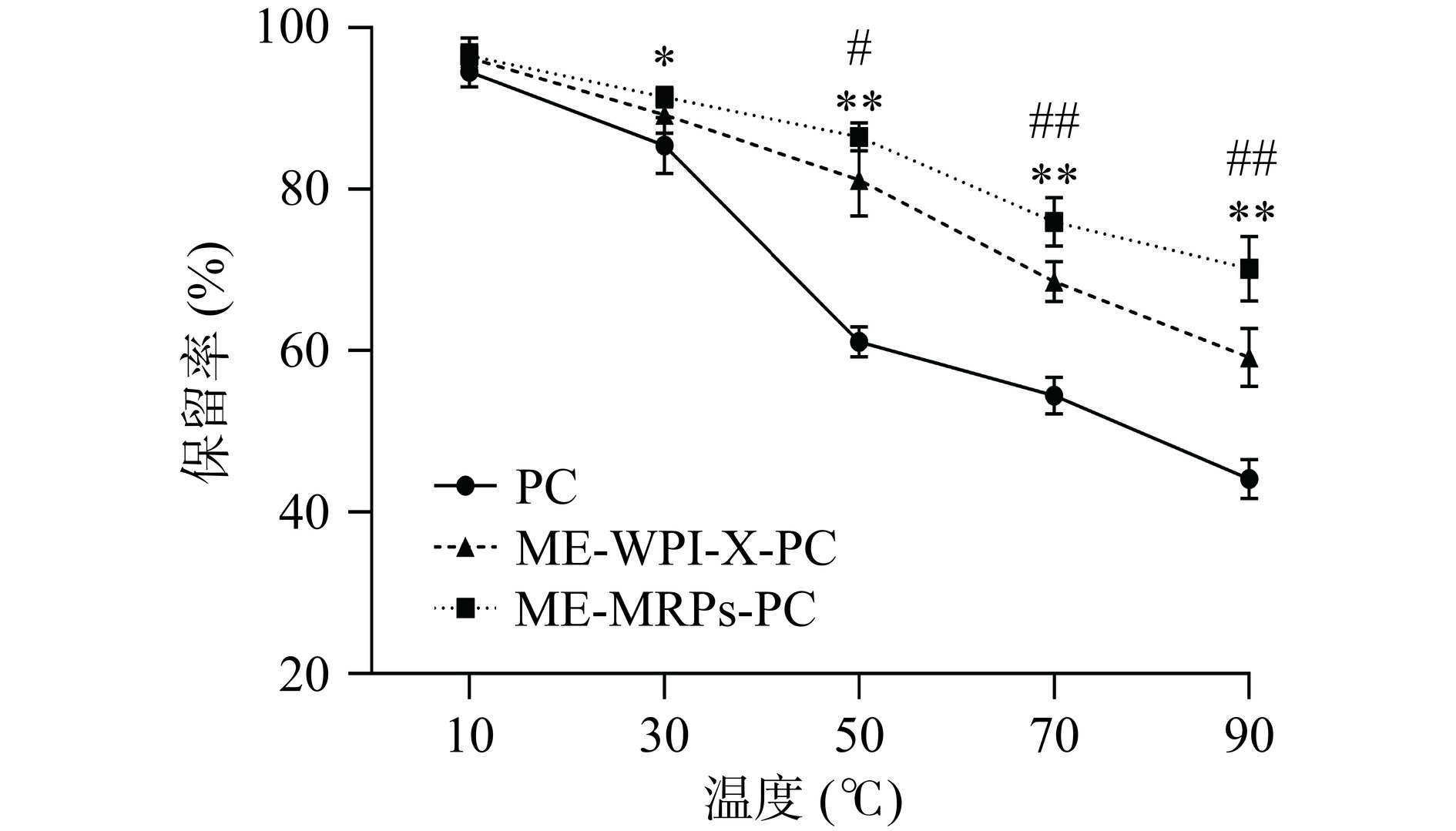
温度对原花青素微胶囊保留率的影响如图7所示,在10~90 ℃内,PC、ME-WPI-X-PC及ME-MRPs-PC的保留率均呈现下降趋势,当温度≥50℃时ME-MRPs-PC的原花青素保留率显著高于ME-WPI-X-PC(P<0.05)和未包埋的PC(P<0.01);达到90 ℃时,PC、ME-WPI-X-PC和ME-MRPs-PC的保留率分别为44.11±2.41%、59.19±3.61%和70.18±3.99%。产生这种现象是因为PC直接暴露于高温下,随着温度的升高发生降解,而囊壁能够在高温条件下保持结构的完整性,有效地抵御高温对原花青素的破坏作用,确保原花青素在微胶囊内部保持其原有的结构,提高原花青素的热稳定性;而ME-WPI-X-PC表面粗糙,孔隙程度高,增加了芯材与外环境的接触,导致原花青素在高温下被破坏,不利于在高温环境下的储存。
2.5.3 pH稳定性分析
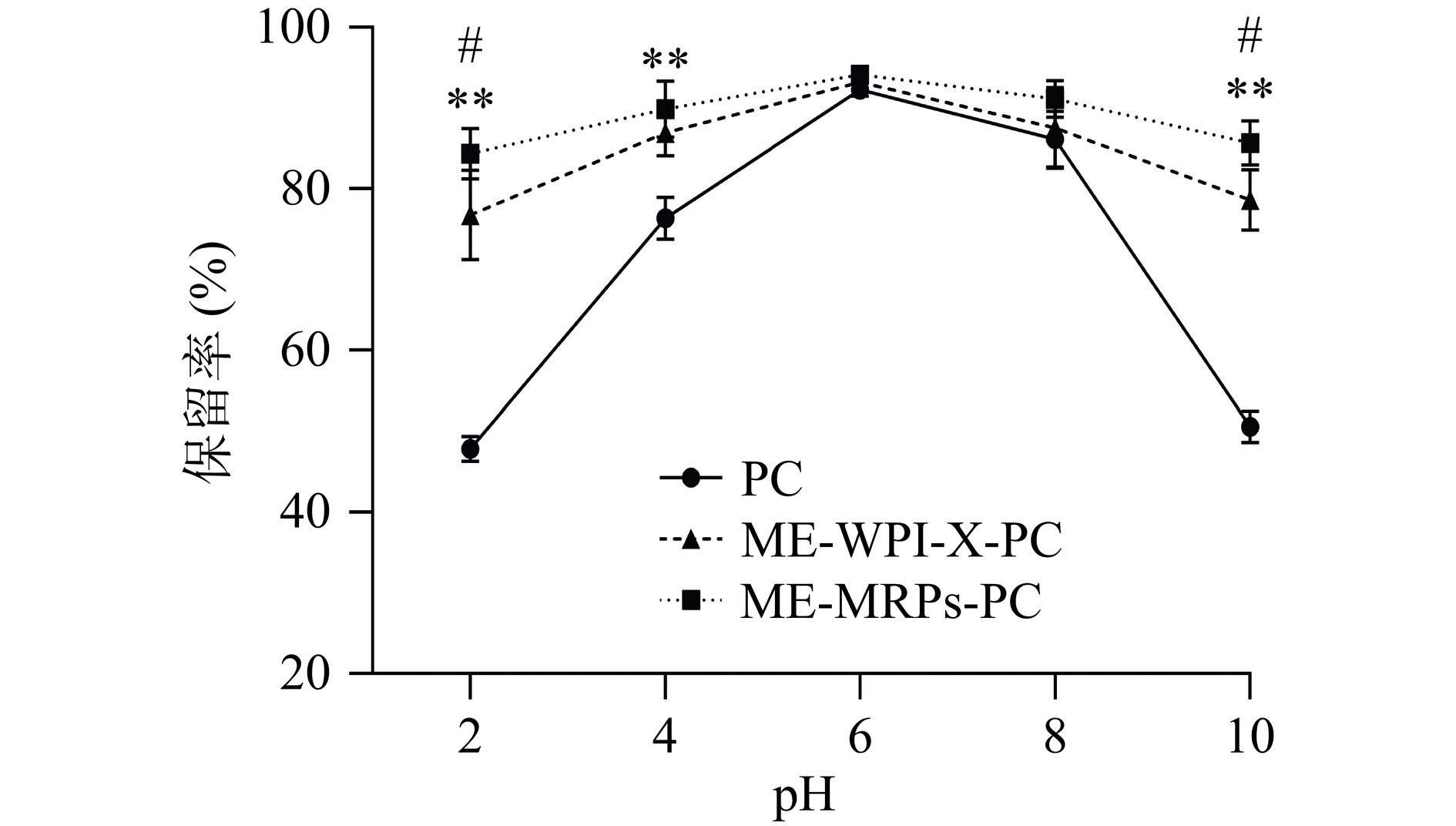
pH对原花青素微胶囊保留率的影响如图8所示,在pH2~10内,PC、ME-WPI-X-PC及ME-MRPs-PC保留率均呈现先上升后下降趋势,当pH≤4及pH=10时,ME-MRPs-PC中原花青素保留率极显著高于未包埋的PC(P<0.01),是因为PC在中性或近中性时有较好的稳定性,而在强酸强碱环境下结构容易被破坏分解,被包埋的原花青素避免直接暴露于强酸强碱环境中,从而提高了原花青素的pH稳定性;同时在强酸强碱环境下,ME-MRPs-PC比ME-WPI-X-PC具有更好的pH稳定性(P<0.05)。
2.5.4 体外消化稳定性分析
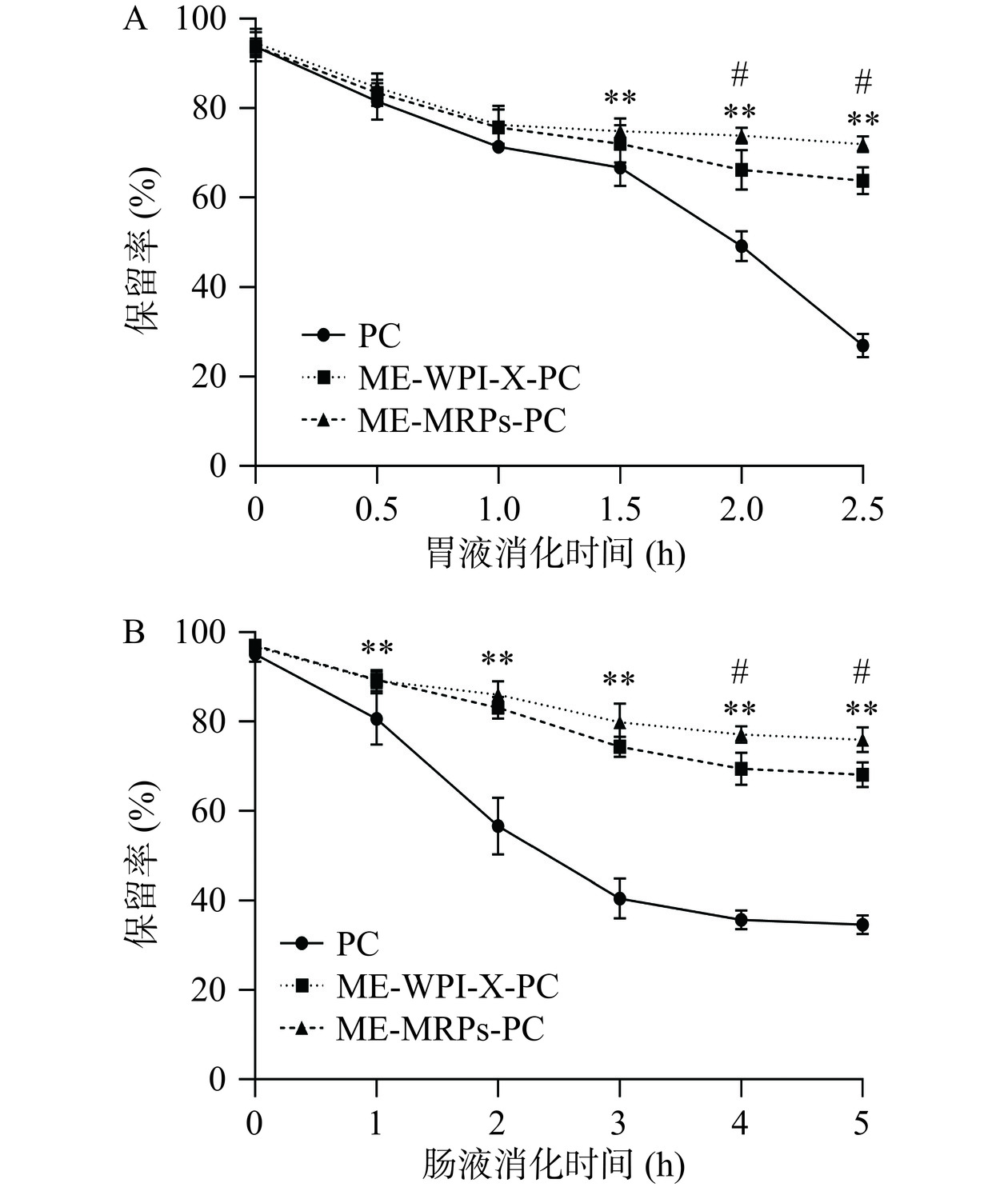
消化分析试验可分为两个阶段,即胃消化分析图9A和肠消化分析图9B所示。由图9A可知,在胃消化时,胃蛋白酶可将壁材初步水解,释放原花青素,同时降解原花青素;PC在消化2.5 h后,原花青素保留率为26.99%±2.59%并有继续降解的趋势,而ME-WPI-X-PC和ME-MRPs-PC的保留率分别维持在63.83%±3.03%和71.99%±1.78%,同时ME-MRPs-PC的原花青素保留率极显著高于未包埋的PC(P<0.01),与pH稳定性试验结果相一致,并且在整个消化过程中,两种微胶囊未发生破裂现象。由图9B可知,在肠消化时,在消化液中胰蛋白酶、脂肪酶和胆盐的作用下,蛋白质与糖之间的相互作用被破坏,其中ME-WPI-X-PC在肠消化1.0 h时开始出现微胶囊破裂现象,消化3.0 h后微胶囊完全溶解在消化液中,ME-MRPs-PC在肠消化2.0 h才开始出现微胶囊破碎的情况,4.0 h后完全溶解;在肠消化5 h后PC保留率为34.60%±2.08%,而ME-WPI-X-PC和ME-MRPs-PC的保留率分别为68.13%±2.72%、75.96%±2.74%。综上结果表明,微胶囊包埋原花青素能提高原花青素的消化稳定性,且微胶囊还具有肠溶的特点。
2.6 原花青素微胶囊化体外抗氧化研究
2.6.1 DPPH自由基清除实验
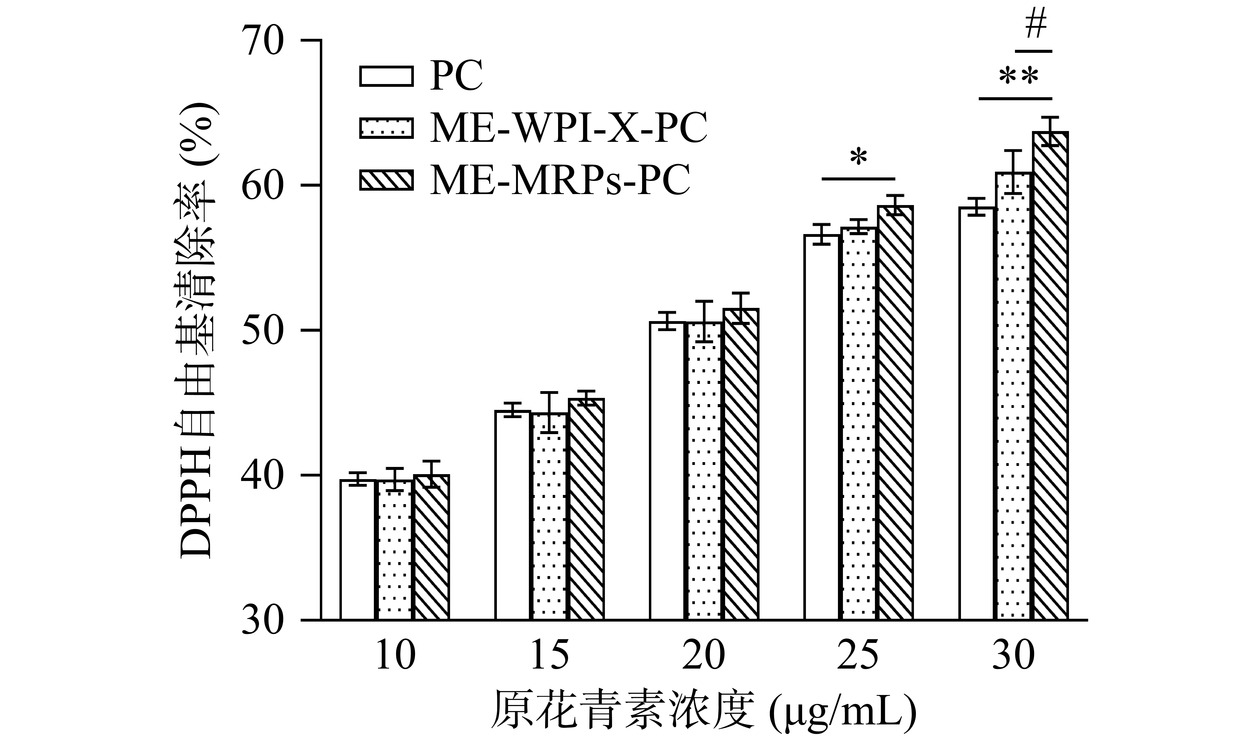
样品对DPPH自由基清除率的测定结果如图10所示。在原花青素浓度为10~30 μg/mL的范围内,对DPPH自由基清除率均随浓度的增加而升高。PC、ME-WPI-X-PC与ME-MRPs-PC对DPPH自由基清除率的IC50值分别为18.65、18.17和17.14 μg/mL。结果表明,当芯材原花青素浓度达到25 μg/mL时,ME-MRPs-PC比未包埋的PC具有更显著的DPPH自由基清除能力(P<0.05),在等原花青素浓度的前提下,这可能是因为乳清分离蛋白糖基化产生的MRPs是良好的电子供体,其供应的电子能与DPPH自由基反应,使自由基成为较为稳定的物质,中断自由基连锁反应,从而起到清除DPPH自由基的作用。
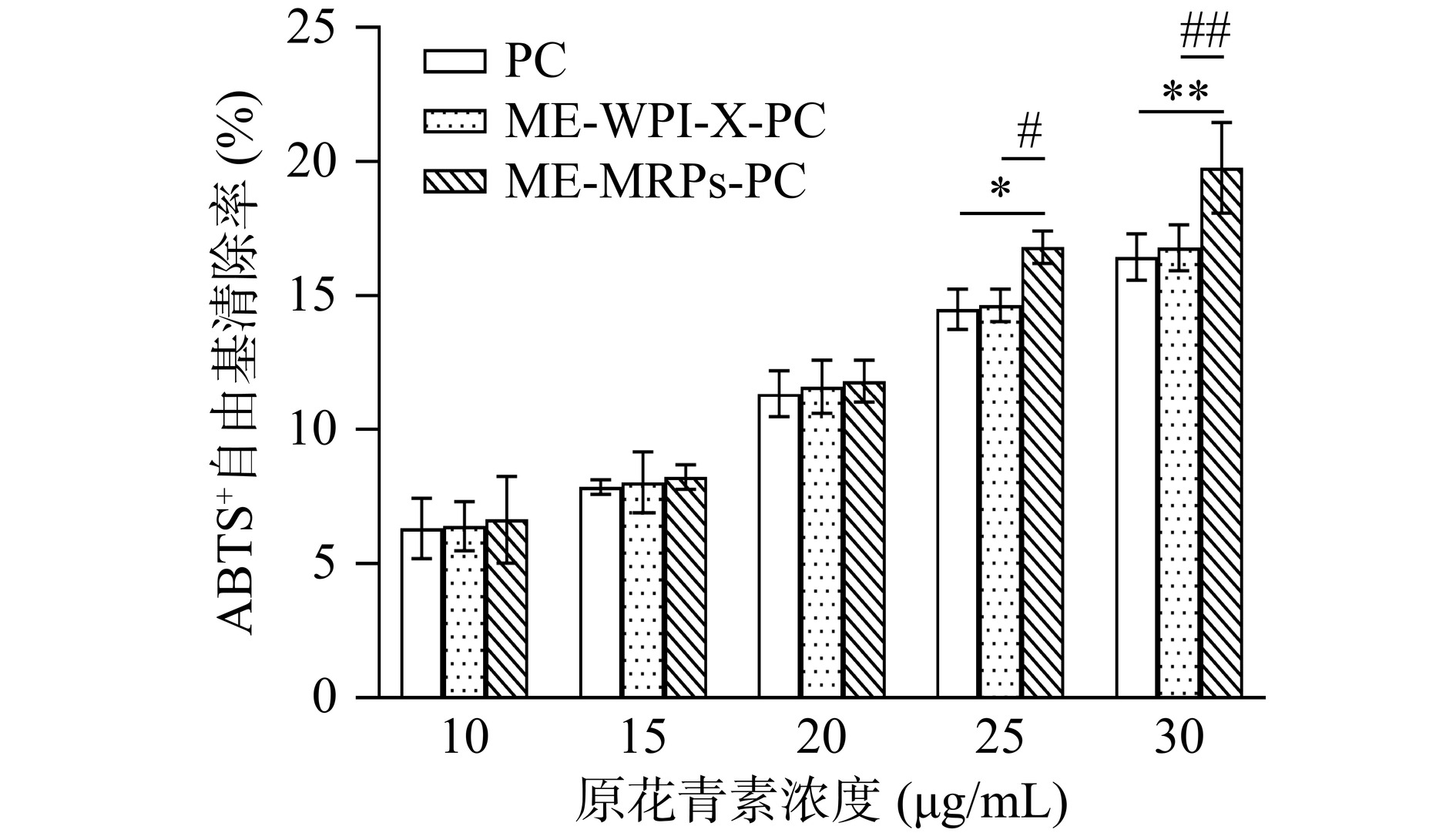
2.6.2 ABTS+自由基清除实验
样品对ABTS+自由基清除率的测定结果图11所示。在原花青素浓度为10~30 μg/mL范围内,对ABTS+自由基清除能力均随浓度的增加而升高,PC、ME-WPI-X-PC与ME-MRPs-PC对ABTS+自由基清除率的IC50值分别为134.6、131.5和87.69 μg/mL。当芯材原花青素浓度达到25 μg/mL时,ME-MRPs-PC对ABTS+自由基的消除效果显著高于未被包埋的PC(P<0.05),这一现象可能归因于MRPs中含有挥发性杂环化合物[32],这些化合物因其独特的化学结构,具有一定的抗氧化作用,进而提升ME-MRPs-PC对ABTS+自由基的清除能力。
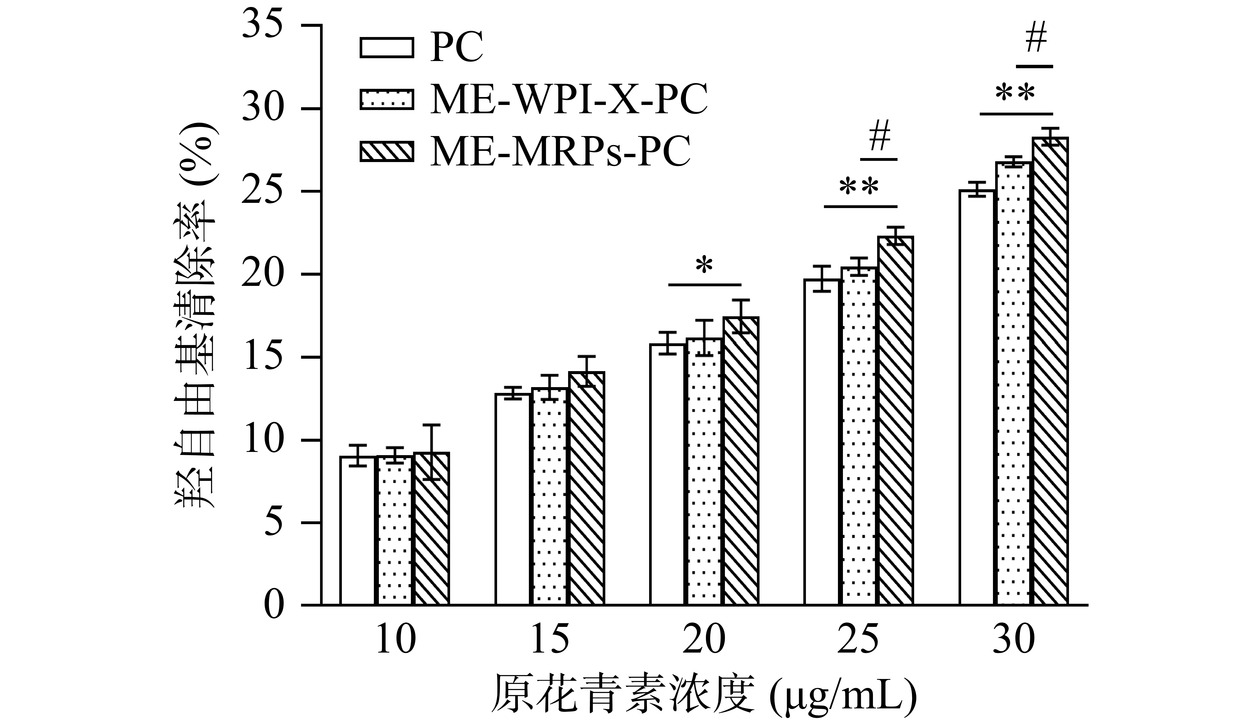
2.6.3 羟自由基清除实验
样品对羟自由基清除率的测定结果图12所示。在原花青素浓度为10~30 μg/mL范围内,对羟自由基清除能力均随浓度的增加而升高,PC、ME-WPI-X-PC和ME-MRPs-PC对羟自由基清除率的IC50值分别为82.12、72.06和65.53 μg/mL。结果表明,微胶囊化后的原花青素具有更强的羟自由基清除能力,尤其是当ME-MRPs-PC的原花青素浓度≥20 μg/mL时,可能是乳清分离蛋白质分子糖基化以后,分子质量增加,螯合Fe2+能力增强,使其清除能力得到提升[21]。
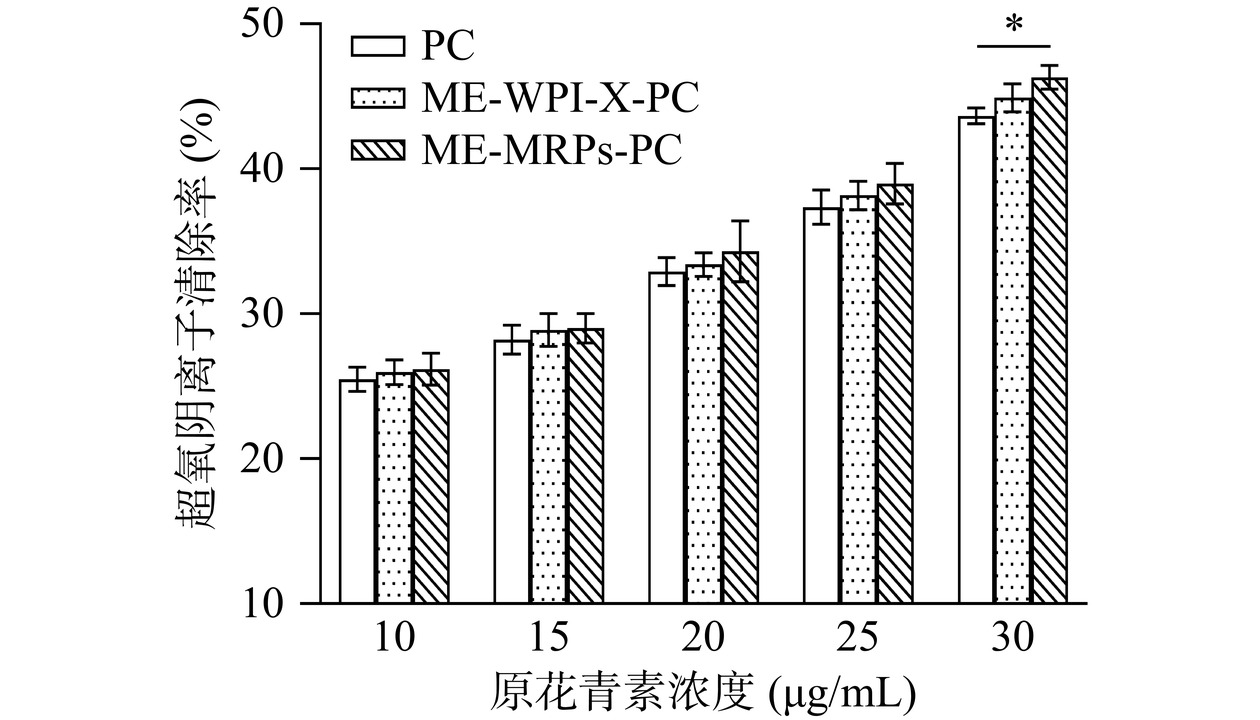
2.6.4 超氧阴离子清除实验
样品对超氧阴离子清除率的测定结果如图13所示。在原花青素浓度为10~30 μg/mL范围内,对超氧阴离子的清除能力均随浓度的增加而逐渐升高。PC、ME-WPI-X-PC和ME-MRPs-PC对超氧阴离子清除率的IC50值分别为46.81、43.87和40.40 μg/mL。结果表明,ME-MRPs-PC比ME-WPI-X-PC具有更强的超氧阴离子清除能力,当芯材原花青素浓度达到30 μg/mL时,对超氧阴离子的清除能力显著高于未被包埋的PC(P<0.05)。产生这种现象可能是由于美拉德反应产物中芳香环或其他共轭结构与超氧阴离子发生反应,起到清除超氧阴离子的作用。
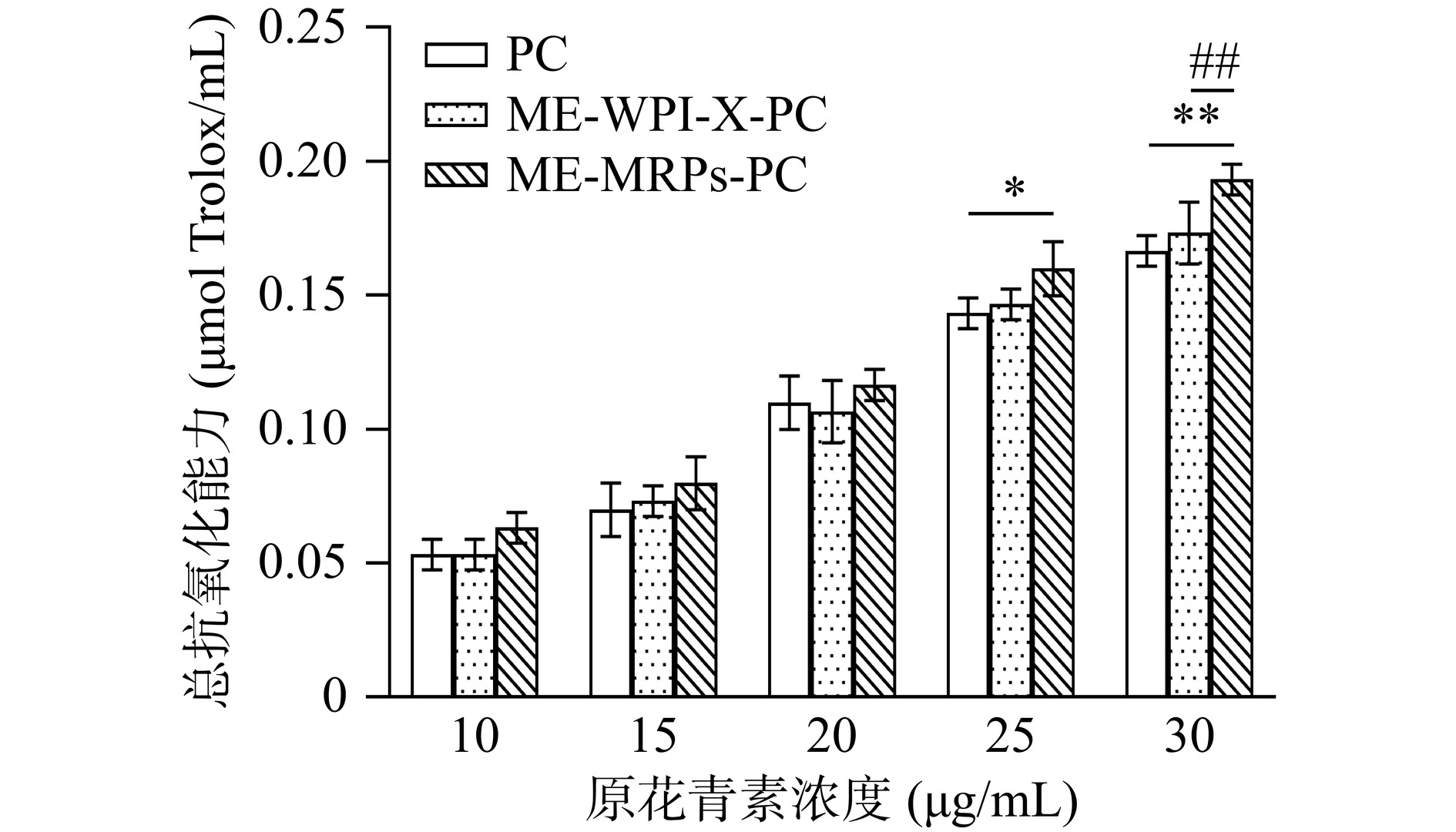
2.6.5 总抗氧化能力(T-AOC)测定实验
样品的总抗氧化能力测定结果如图14所示。在原花青素浓度为10~30 μg/mL范围内,样品的总抗氧化能力均随浓度的增加而逐渐升高。当浓度达到30 μg/mL时,PC、ME-WPI-X-PC和ME-MRPs-PC的总抗氧化能力分别为0.17±0.01、0.17±0.01和0.19±0.01 μmol Trolox/mL。结果表明,随着原花青素浓度的递增,浓度为30 μg/mL时ME-MRPs-PC的总抗氧化能力极显著高于PC和ME-WPI-X-PC(P<0.01)。
3. 结论
本研究以乳清分离蛋白-D-木糖和乳清分离蛋白-D-木糖的美拉德反应产物为原料,分别与海藻酸钠进行复配,作为复合壁材,以原花青素为芯材进行包埋,形成原花青素微胶囊。实验结果表明,乳清分离蛋白-D-木糖的美拉德反应产物经历了化学反应,形成新的共价结构,使得D-木糖更牢固地与乳清分离蛋白结合,二者的美拉德反应产物作为原花青素微胶囊的壁材,增加了芯材原花青素的热稳定性、pH稳定性和消化稳定性,能够有效防止原花青素在外部环境因素的影响下发生降解;海藻酸钠的添加赋予了微胶囊肠溶的特点,在体外模拟胃消化时,可以有效防止芯材原花青素的损失,保留其生物活性,以便在肠消化时溶解吸收,这一特点在应用过程中可能会改善原花青素的生物利用度,更好地发挥其生物活性功效;同时二者的美拉德反应产物还具备一定的抗氧化作用,在保护芯材原花青素的同时起到一定的增效作用,在体外抗氧化实验中,当芯材原花青素浓度≥30 μg/mL时,ME-MRPs-PC的抗氧化性显著高于未包埋的原花青素。以上结论表明,乳清分离蛋白和D-木糖的美拉德反应产物作为微胶囊的壁材具有显著的优势,为进一步的研究和应用奠定了基础,原花青素微胶囊的制备也为原花青素产品的开发提供了新的原料途径。
-
表 1 原花青素微胶囊理化性质
Table 1 Physicochemical properties of proanthocyanidin microcapsules
原花青素微胶囊 包埋率(%) 原花青素含量(mg/g) 粒径(μm) ME-WPI-X-PC 98.57±0.10 49.90±0.80 1238.74±385.26 ME-MRPs-PC 98.60±0.09 49.97±0.87 1219.61±388.24 -
[1] MASSIMO L, ALESSANDRA D, ANNALISA R, et al. Bio-Based compounds from grape seeds:A biorefinery approach[J]. Molecules,2018,23(8):1888. doi: 10.3390/molecules23081888
[2] ZHANG L L, ZHU M T, SHI T, et al. Recovery of dietary fiber and polyphenol from grape juice pomace and evaluation of their functional properties and polyphenol compositions[J]. Food & Function,2017,8(1):341−351.
[3] FEDERICA P, FABIO C, MARIA F C, et al. Recovery of oligomeric proanthocyanidins and other phenolic compounds with established bioactivity from grape seed by-products[J]. Molecules,2019,24(4):677. doi: 10.3390/molecules24040677
[4] 熊川, 王玥, 金鑫, 等. 玉米须原花青素的提取及其抗肿瘤活性[J]. 现代食品科技,2020,36(9):195−201. [XIONG C, WANG Y, JIN X, et al. Extraction and antitumor activity of proanthocyanidins from corn silk[J]. Modern Food Science and Technology,2020,36(9):195−201.] XIONG C, WANG Y, JIN X, et al. Extraction and antitumor activity of proanthocyanidins from corn silk[J]. Modern Food Science and Technology, 2020, 36(9): 195−201.
[5] 张丽翠. 原花青素眼用剂型联合双酚氯酸钠治疗干眼症的效果及对自觉症状的影响[J]. 当代医学,2021,27(17):115−116. [ZHANG L C. Effect of proanthocyanidin ophthalmic preparation combined with sodium bisphenol chlorate in the treatment of dry eye and its influence on conscious symptoms[J]. Contemporary Medicine,2021,27(17):115−116.] doi: 10.3969/j.issn.1009-4393.2021.17.046 ZHANG L C. Effect of proanthocyanidin ophthalmic preparation combined with sodium bisphenol chlorate in the treatment of dry eye and its influence on conscious symptoms[J]. Contemporary Medicine, 2021, 27(17): 115−116. doi: 10.3969/j.issn.1009-4393.2021.17.046
[6] SIERRA C M, MIGUÉNS G A, GRAU B C, et al. Grape-seed proanthocyanidin extract reverts obesity-related metabolic derangements in aged female rats[J]. Nutrients,2021,13(6):2059−2059. doi: 10.3390/nu13062059
[7] TELMA B L B, DENISE P S, DANIEL G. Green tea polyphenol epigallocatechin-3-gallate and cranberry proanthocyanidins act in synergy with cathelicidin (LL-37) to reduce the LPS-induced inflammatory response in a three-dimensional co-culture model of gingival epithelial cells and fibroblasts[J]. Archives of Oral Biology,2015,60(6):845−853. doi: 10.1016/j.archoralbio.2015.02.021
[8] 杨舒乔, 王迪, 高彦祥. 黑果腺肋花楸功能性研究进展及其应用[J]. 食品研究与开发,2021,42(13):206−213. [YANG S Q, WANG D, GAO Y X. Advances in studies on the function and application of Aronia melanocarpa[J]. Food Research and Development,2021,42(13):206−213.] doi: 10.12161/j.issn.1005-6521.2021.13.030 YANG S Q, WANG D, GAO Y X. Advances in studies on the function and application of Aronia melanocarpa[J]. Food Research and Development, 2021, 42(13): 206−213. doi: 10.12161/j.issn.1005-6521.2021.13.030
[9] 张睿, 宋璇, 于建丽, 等. 花生红衣中原花青素的研究进展[J]. 食品研究与开发,2020,41(12):202−210. [ZHANG R, SONG X, YU J L, et al. The research progress of the procyanidins from peanut skin coat[J]. Food Research and Development,2020,41(12):202−210.] doi: 10.12161/j.issn.1005-6521.2020.12.034 ZHANG R, SONG X, YU J L, et al. The research progress of the procyanidins from peanut skin coat[J]. Food Research and Development, 2020, 41(12): 202−210. doi: 10.12161/j.issn.1005-6521.2020.12.034
[10] 高冠勇, 陈文娜, 武玉波, 等. 花生红衣原花青素稳定性分析及其抗氧化性研究[J]. 食品工业,2018,39(8):209−212. [GAO G Y, CHEN W N, WU Y B, et al. The stability and antioxidant activity of the proanthocyanidins from peanut skin[J]. The Food Industry,2018,39(8):209−212.] GAO G Y, CHEN W N, WU Y B, et al. The stability and antioxidant activity of the proanthocyanidins from peanut skin[J]. The Food Industry, 2018, 39(8): 209−212.
[11] PRIOR R L, WU X. Anthocyanins:Structural characteristics that result in unique metabolic patterns and biological activities[J]. Free Radical Research,2006,40(10):1014−1028. doi: 10.1080/10715760600758522
[12] 唐璐, 李延辉, 薛晓丽. 黑果腺肋花楸花色苷微胶囊化的研究[J]. 食品研究与开发,2020,41(5):121−126. [TANG L, LI Y H, XUE X L. Study on Microencapsulation of anthocyanins from Aronia melanocarpa[J]. Food Research and Development,2020,41(5):121−126.] doi: 10.12161/j.issn.1005-6521.2020.05.020 TANG L, LI Y H, XUE X L. Study on Microencapsulation of anthocyanins from Aronia melanocarpa[J]. Food Research and Development, 2020, 41(5): 121−126. doi: 10.12161/j.issn.1005-6521.2020.05.020
[13] GÉRALDINE H, STÉPHANIE B, ERIC B, et al. Use of whey protein beads as a new carrier system for recombinant yeasts in human digestive tract[J]. Journal of Biotechnology,2006,127(1):151−160. doi: 10.1016/j.jbiotec.2006.06.012
[14] CHRISTOPHE S, SYLVIE L T. Protein/polysaccharide complexes and coacervates in food systems[J]. Advances in Colloid and Interface Science,2010,167(1):63−70.
[15] 袁晓露, 李宝霞, 黄雅燕, 等. 海藻酸钠微囊的制备及应用进展[J]. 化工进展,2022,41(6):3103−3112. [YUAN X L, LI B X, HUANG Y Y, et al. Progress in preparation and application of sodium alginate microcapsules[J]. Chemical Industry and Engineering Progress,2022,41(6):3103−3112.] YUAN X L, LI B X, HUANG Y Y, et al. Progress in preparation and application of sodium alginate microcapsules[J]. Chemical Industry and Engineering Progress, 2022, 41(6): 3103−3112.
[16] 郭娜, 朱桂兰, 刘兴运, 等. 蓝莓花青素微胶囊制备及其性质分析[J]. 食品与发酵工业,2019,45(23):109−114. [GUO N, ZHU G L, LIU X Y, et al. Preparation and characterization of blueberry anthocyanin microcapsules[J]. Food and Fermentation Industries,2019,45(23):109−114.] GUO N, ZHU G L, LIU X Y, et al. Preparation and characterization of blueberry anthocyanin microcapsules[J]. Food and Fermentation Industries, 2019, 45(23): 109−114.
[17] 王学瑛, 王子迎, 汪甜莉, 等. 蓝莓花青素微胶囊的制备及在卷烟中的应用[J]. 合肥师范学院学报,2021,39(6):30−34. [WANG X Y, WANG Z Y, WANG T L, et al. Preparation of blueberry anthocyanin microcapsules and its application in cigarettes[J]. Journal of Hefei Normal University,2021,39(6):30−34.] doi: 10.3969/j.issn.1674-2273.2021.06.009 WANG X Y, WANG Z Y, WANG T L, et al. Preparation of blueberry anthocyanin microcapsules and its application in cigarettes[J]. Journal of Hefei Normal University, 2021, 39(6): 30−34. doi: 10.3969/j.issn.1674-2273.2021.06.009
[18] 杨易俗, 张讯, 胡楚桓, 等. 玉米醇溶蛋白核壳结构微粒的制备及应用研究进展[J]. 食品科学,2022,43(7):349−355. [YANG Y S, ZHANG X, HU C H, et al. Progress in preparation and application of zein core-shell microparticles[J]. Food Science,2022,43(7):349−355.] doi: 10.7506/spkx1002-6630-20210228-306 YANG Y S, ZHANG X, HU C H, et al. Progress in preparation and application of zein core-shell microparticles[J]. Food Science, 2022, 43(7): 349−355. doi: 10.7506/spkx1002-6630-20210228-306
[19] 王道滇, 马月星, 魏光强, 等. 海藻酸钠-乳铁蛋白复合益生菌微胶囊的制备及性能研究[J]. 中国奶牛,2023(2):43−51. [WANG D D, MA Y X, WEI G Q, et al. Preparation and performance study of sodium alginate-lactoferrin composite probiotic microcapsules[J]. China Dairy Cattle,2023(2):43−51.] WANG D D, MA Y X, WEI G Q, et al. Preparation and performance study of sodium alginate-lactoferrin composite probiotic microcapsules[J]. China Dairy Cattle, 2023(2): 43−51.
[20] 张欢, 赵妍. 原花青素微胶囊制备工艺优化及性质分析[J]. 食品科技,2022,47(11):220−227. [ZHANG H, ZHAO Y. Preparation process optimization and property analysis of proanthocyanidin microcapsules[J]. Food Science and Technology,2022,47(11):220−227.] ZHANG H, ZHAO Y. Preparation process optimization and property analysis of proanthocyanidin microcapsules[J]. Food Science and Technology, 2022, 47(11): 220−227.
[21] WANG Wenqiong, BAO Yihong, CHEN Ying. Characteristics and antioxidant activity of water-soluble Maillard reaction products from interactions in a whey protein isolate and sugars system[J]. Food Chemistry, 2013, 139(1-4): 355-361.
[22] 李华, 肖付才, 袁春龙, 等. 铁盐催化比色法测定葡萄籽超微粉中的原花青素[J]. 食品研究与开发,2007(9):114−117. [LI H, XIAO F C, YUAN C L, et al. Determination of the proanthocyanidin in the ultrafine powder of grape seeds by catalytic colorimetry with ferric ions[J]. Food Research and Development,2007(9):114−117.] doi: 10.3969/j.issn.1005-6521.2007.09.036 LI H, XIAO F C, YUAN C L, et al. Determination of the proanthocyanidin in the ultrafine powder of grape seeds by catalytic colorimetry with ferric ions[J]. Food Research and Development, 2007(9): 114−117. doi: 10.3969/j.issn.1005-6521.2007.09.036
[23] 杜利君, 姚亚婷, 王静慧, 等. 改进铁盐催化比色法测定保健食品中原花青素[J]. 检验检疫学刊,2013,23(5):50−52. [DU L J, YAO Y T, WANG J H, et al. An improved colorimetrical method of procyanidins in health foods using ferric ions as catalyst[J]. Quality Safety Inspection and Testing,2013,23(5):50−52.] doi: 10.3969/j.issn.1674-5354.2013.05.014 DU L J, YAO Y T, WANG J H, et al. An improved colorimetrical method of procyanidins in health foods using ferric ions as catalyst[J]. Quality Safety Inspection and Testing, 2013, 23(5): 50−52. doi: 10.3969/j.issn.1674-5354.2013.05.014
[24] 张欢. 原花青素微胶囊的制备及其性能研究[D]. 郑州:河南工业大学, 2023. [ZHANG H. Preparation of proanthocyanidin microcapsules and its performance study[D]. Zhengzhou: Henan University of Technology, 2023.] ZHANG H. Preparation of proanthocyanidin microcapsules and its performance study[D]. Zhengzhou: Henan University of Technology, 2023.
[25] 纪秀凤, 吕长鑫, 芦宇, 等. 红树莓籽黄酮微胶囊工艺优化及其体外模拟胃肠消化[J]. 食品工业科技,2019,40(5):182−187. [JI X F, LÜ C X, LU Y, et al. Optimization of microencapsulation of flavonoids from red raspberry seeds and its simulated gastrointestinal digestion in vitro[J]. Science and Technology of Food Industry,2019,40(5):182−187.] JI X F, LÜ C X, LU Y, et al. Optimization of microencapsulation of flavonoids from red raspberry seeds and its simulated gastrointestinal digestion in vitro[J]. Science and Technology of Food Industry, 2019, 40(5): 182−187.
[26] 毕玉蕾, 李言, 王立, 等. 生酮椰子油微胶囊的制备及其加工适用性探究[J]. 食品与发酵工业,2024,50(11):110−120. [BI Y L, LI Y, WANG L, et al. Preparation and processing applicability of ketogenic coconut oil microcapsules[J]. Food and Fermentation Industries,2024,50(11):110−120.] BI Y L, LI Y, WANG L, et al. Preparation and processing applicability of ketogenic coconut oil microcapsules[J]. Food and Fermentation Industries, 2024, 50(11): 110−120.
[27] 冉莎, 张甫生, 李彬, 等. 竹笋膳食纤维中结合多酚的提取工艺优化及抗氧化活性分析[J]. 食品工业科技,2023,44(13):233−241. [RAN S, ZHANG F S, LI B, et al. Extraction optimization and antioxidant activity of bound polyphenols in bamboo shoot dietary fiber[J]. Science and Technology of Food Industry,2023,44(13):233−241.] RAN S, ZHANG F S, LI B, et al. Extraction optimization and antioxidant activity of bound polyphenols in bamboo shoot dietary fiber[J]. Science and Technology of Food Industry, 2023, 44(13): 233−241.
[28] 师梦楠, 彭云, 张杰, 等. 云南大叶种茶树花生化成分及体外抗氧化活性研究[J]. 食品工业科技,2022,43(16):298−306. [SHI M N, PENG Y, ZHANG J, et al. Biochemical components and in vitro antioxidant activities of large-leaf species tea flowers in Yunnan[J]. Science and Technology of Food Industry,2022,43(16):298−306.] SHI M N, PENG Y, ZHANG J, et al. Biochemical components and in vitro antioxidant activities of large-leaf species tea flowers in Yunnan[J]. Science and Technology of Food Industry, 2022, 43(16): 298−306.
[29] 汪姣玲. 乳清蛋白美拉德改性及其产物功能特性研究[D]. 无锡:江南大学, 2015. [WANG J L. Study on characteristics and functional properties of Maillard reaction products from whey protein[D]. Wuxi:Jiangnan University, 2015.] WANG J L. Study on characteristics and functional properties of Maillard reaction products from whey protein[D]. Wuxi: Jiangnan University, 2015.
[30] 常诗晗, 武俊瑞, 李紫晶, 等. 复合海藻酸钠益生菌微胶囊研究进展[J]. 食品工业科技,2024,45(3):372−377. [CHANG S H, WU J R, LI Z J, et al. Research progress on probiotic microcapsules by compound sodium alginate[J]. Science and Technology of Food Industry,2024,45(3):372−377.] CHANG S H, WU J R, LI Z J, et al. Research progress on probiotic microcapsules by compound sodium alginate[J]. Science and Technology of Food Industry, 2024, 45(3): 372−377.
[31] 宋江流, 杨静怡, 高彦祥, 等. 包埋花色苷的海藻酸钙-乳清分离蛋白复配凝胶的制备与表征[J]. 食品科学,2023,44(14):1−7. [SONG J L, YANG J Y, GAO Y X, et al. Preparation and characterization of calcium alginate-whey protein isolate composite gel embedded with anthocyan[J]. Food Science,2023,44(14):1−7.] doi: 10.7506/spkx1002-6630-20221103-040 SONG J L, YANG J Y, GAO Y X, et al. Preparation and characterization of calcium alginate-whey protein isolate composite gel embedded with anthocyan[J]. Food Science, 2023, 44(14): 1−7. doi: 10.7506/spkx1002-6630-20221103-040
[32] 孙常雁, 李德海, 刘骞, 等. 乳清蛋白肽美拉德反应产物的抗氧化活性与稳定性[J]. 食品科学,2014,35(1):104−109. [SUN C Y, LI D H, LIU Q, et al. Antioxidant activity and stability of maillard reaction products from whey protein-derived peptide[J]. Food Science,2014,35(1):104−109.] doi: 10.7506/spkx1002-6630-201401020 SUN C Y, LI D H, LIU Q, et al. Antioxidant activity and stability of maillard reaction products from whey protein-derived peptide[J]. Food Science, 2014, 35(1): 104−109. doi: 10.7506/spkx1002-6630-201401020





 下载:
下载:


 下载:
下载:



