Effect to Intestinal Microbiota Regulation and Laxative Function to Lactobacillus paracasei
-
摘要: 本文主要研究了西藏来源副干酪乳杆菌对小鼠便秘的润肠通便作用及其对肠道菌群的影响。首先将160只雄性昆明鼠随机分为A、B两大组,每组又随机分为空白组、模型组、5株实验菌株(T1-5、T1-7、T1-9、T1-d、5B-1)组和6108对照菌株组做润肠通便实验,每组10只,其中A组80只用于测定小鼠小肠推进率,B组80只用于排便情况测定。然后挑选润肠通便效果好的菌株T1-5、T1-9、5B-1进行肠道菌群调节的检测,实验小鼠为雄性BALB/c小鼠共24只,分为空白组、T1-5组、T1-9组和5B-1组,每组6只。润肠通便实验结果表明:与模型组相比,T1-9和5B-1组小鼠小肠推进率显著高于模型组(P<0.01);T1-9组和5B-1组首次红便时间显著缩短(P<0.01); T1-9组、5B-1组以及对照菌株6108组6 h的排便颗粒数显著增加(P<0.05); T1-9组和6108组的粪便湿重显著提高(P<0.01、P<0.05)。肠道菌群调节实验的测序结果显示,与空白组相比,三组益生菌组T1-5、T1-9、5B-1有益菌乳杆菌科、理研菌科丰度明显增加,其中5B-1组有益菌普雷沃氏菌科丰度也明显增加。因此菌株T1-5、T1-9、5B-1能够促进肠道蠕动,也具有调节肠道菌群结构发挥缓解小鼠便秘的作用。Abstract: The effects of five strains of Lactobacillus paracasei from Tibet on constipation and gut microbiota of mice were studied. One hundred and sixty male Kunming mice were randomly divided into two groups: A and B. Each group was randomly divided into a blank subgroup, a model subgroup, five experimental strain (including T1-5, T1-7, T1-9, T1-d, and 5B-1) subgroup and a control strain 6108 subgroup for the laxative function test, with 10 mice in each subgroup. Among them, 80 mice in group A were used to measure the small intestine propulsion rate of mice, and 80 mice in group B were used to measure defecation status. Strains T1-5, T1-9, and 5B-1 with good performance in laxative function test were then selected to detect the regulation of intestinal microbiota and total 24 male BALB/c mice were selected for this experiment, and were divided into a blank subgroup, a T1-5 subgroup, T1-9 subgroup, and 5B-1 subgroup, with 6 mice in each subgroup. The experimental results of the laxative function test showed that: Compared with the model group, the small intestine propulsion rate of mice in T1-9 and 5B-1 groups was significantly higher than that of the model group (P<0.01). The first red stool time was significantly shortened in the T1-9 and 5B-1 groups (P<0.01). The number of fecal particles in the T1-9 group, 5B-1 group, and control strain 6108 group increased significantly at 6 h (P<0.05). The wet weight of feces in the T1-9 and 6108 groups increased significantly (P<0.01, P<0.05). The experimental results of the microbial community sequencing test showed that: compared with the blank group, the abundance of probiotics in the three strain groups T1-5, T1-9, and 5B-1 Lactobacillaceae and Rikenellaceae was significantly increased, including Prevotellaceae in the 5B-1 group. So, the conclusion are as follows: strains T1-5, T1-9 and 5B-1 can promote intestinal peristalsis, regulate the structure of intestinal microbiota, and alleviate constipation in mice.
-
Keywords:
- Lactobacillus paracasei /
- constipation /
- laxative function /
- intestinal microbiota /
- 16S rDNA
-
便秘是临床上最常见的功能性胃肠疾病之一,主要表现为:大便结块或硬结,排便不畅,排便次数减少[1]。随着人们生活水平的改善,不健康的生活方式及不良饮食习惯导致便秘的发生率逐年上升。据统计,全世界不同年龄段便秘的患病率从0.5%到44.5%不等[2]。长期便秘,不仅会导致肛肠类疾病,还会对患者造成精神障碍,严重影响人们的生活质量和身心健康。现代医学治疗便秘的手段有限,主要包括食疗、内服药物治疗、外用润滑剂、灌肠以及手术治疗等,药物治疗往往会产生一系列不良反应,而手术疗法却并不适用于普通便秘患者[3−4],因此,寻找疗效好且不良反应小的治疗方式极为重要。
副干酪乳杆菌作为益生菌的一种,具有改善宿主的肠道环境、维持菌群结构平衡、提高机体免疫力及抗氧化水平、保护调节肠道黏膜屏障等优点[5]。同时,副干酪乳杆菌在2010年就被纳入可食用菌种名单,目前国内外市场对乳杆菌的需求量每年都在稳步增长,对其应用而言具有更强的研发价值。近年来国内外关于副干酪乳杆菌的研究主要集中在调节肠道菌群及缓解便秘[6−14]。其他功效如副干酪乳杆菌NTU101乙醇提取物可抵抗牙周炎[15] ,PS23延缓衰老小鼠认知下降[16]已有相关报道。目前,副干酪乳杆菌部分菌株联合其它益生菌临床已有使用[17−22],食品中应用主要集中在功能乳制品的添加[23−24]。
乳制品作为益生菌的优良载体,已有上百年历史,有研究表明发酵乳制品中含有一些微生物,可以在人体胃肠道消化过程中存活并定植,发挥改善人体肠道功能的作用[25−29]。从发酵乳中筛选具有优良益生特性的益生菌菌株不仅安全,而且简单易行,具有十分重要的意义。本研究以新分离鉴定于西藏山南市传统发酵乳制品中的副干酪乳杆菌菌株T1-5、T1-7、T1-9、T1-d、5B-1为研究对象,西藏地区具有严寒、强紫外和缺氧的特点,在这种环境下有利于筛出抗逆性能较好的菌株。前期研究表明5株菌株均具有良好的耐酸、耐胆碱盐、耐人工胃液特性[30],故本研究参考《允许保健食品声称的保健功能目录非营养素补充剂》(2020年版)中的检验方法,通过小肠推进率实验、排便颗粒数实验探讨5株西藏来源的副干酪乳杆菌对便秘小鼠的润肠通便作用,选取润肠通便效果好的菌株进行肠道菌群调节实验,进一步评价5株菌株的促进肠道蠕动、调节肠道菌群能力,寻找更有效的预防便秘菌种,为开发有益人体健康的益生菌提供基础数据。
1. 材料与方法
1.1 材料与仪器
本研究实验组为5株副干酪乳杆菌,其编号分别为T1-5、T1-7、T1-9、T1-d、5B-1 由安琪生物科技有限公司提供,5株实验菌株分离自西藏山南市传统发酵乳制品;6108对照菌株 购于中国工业微生物菌种保藏中心CICC;雄性SPF级昆明鼠,体重(20±2 g),雄性SPF级BALB/c小鼠,体重(20±2 g),许可证号:SCXK(鄂)2022-0021 均购于湖北省宜昌市三峡大学动物中心,饲养于三峡大学动物实验中心的屏障环境中,饲养环境温度保持在(22±1)℃,相对湿度保持在(55±15)%;盐酸洛哌丁胺胶囊 西安杨森制药有限公司;胭脂红、阿拉伯树胶 上海麦克林生化科技公司;活性炭粉、MRS肉汤培养基、MRS改良固体培养基 广东环凯生物科技有限公司。
AL204-IC电子天平 上海梅特勒-托利多仪器有限公司;ZQLY-180V电热恒温培养箱 上海知楚仪器有限公司;BCM-1000A生物洁净工作台 天津市泰斯特仪器有限公司;H1850R高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;SQ510C高压蒸汽灭菌锅 重庆雅马拓科技有限公司;MX-F固定式混匀仪 大龙兴创实验仪器股份公司;Lab-1B-50E真空冷冻干燥机 北京博医康实验仪器有限公司;Mi Seq高通量测序系统 美国Illumina公司。
1.2 实验方法
1.2.1 实验分组
将雄性昆明鼠分为空白组、模型组、T1-5组、T1-7组、T1-9组、T1-d组、5B-1组、6108组。每组20只,共160只。实验共分两批次进行,每组10只,进行小肠推进率实验和排便颗粒数实验。
将雄性BALB/c小鼠随机分为空白组、T1-5组、T1-9组和5B-1组,每组6只,共24只,进行肠道菌群调节实验,动物实验伦理批号:20220508C。
菌悬液制备:将活化好的副干酪乳杆菌在37 ℃条件下于MRS肉汤培养基中培养20 h, 4 ℃ 8000 r/min的条件离心5 min,除去上清液,使用无菌水清洗菌体沉淀,以相同的条件离心,弃去上清液,重复清洗2次,菌体沉淀重悬于无菌水中,使菌液浓度达到1×109 CFU/mL,混合均匀后备用。
造模药物制备:盐酸洛哌丁胺胶囊使用无菌水配制药物浓度为0.4 mg/mL和0.7 mg/mL的盐酸洛哌丁胺混悬液。
1.2.2 小肠推进率实验
小肠推进率实验按照《允许保健食品声称的保健功能目录非营养素补充剂》(2020年版)中的通便功能检验方法进行检测。小鼠进驻动物房后适应性饲养5 d,再随机分成空白组、模型组和实验组。每天测定小鼠的体重调整灌胃量,空白组和模型组给予1 mL/10 g的无菌水,实验组分别给予0.1 mL/10 g·bw的相应菌悬液。灌胃干预15 d后,禁食不禁水24 h,对小鼠小肠推进率进行测定,模型组小鼠和实验组小鼠灌胃洛哌丁胺混悬液,给药剂量为4 mg/kg,给药体积为0.1 mL/10 g·bw,空白组小鼠灌胃无菌水,30 min后,按照相应的顺序给每只小鼠灌胃0.5 mL活性炭溶液,25 min后断颈牺牲。轻轻剪开小鼠腹腔,取出从幽门至盲肠段,用镊子将其拉直,测量并记录小肠全长和活性炭推进最前端长度,计算每只小鼠的小肠推进率。
小肠推进率(%)=活性炭推进长度/小肠总长度×100
1.2.3 排便颗粒数实验
排便颗粒数实验按照《允许保健食品声称的保健功能目录非营养素补充剂》(2020年版)中的通便功能检验方法进行检测。具体方法同1.2.2,与其不同之处是给药剂量为7 mg/kg,实验第16 d各组小鼠每只灌胃0.5 mL洋红溶液,记录每只小鼠灌胃洋红溶液的时间,并将其放入干净且垫有吸水纸的笼盒中,小鼠单笼饲养,正常饮水进食,从灌胃洋红开始计时,记录小鼠首粒红便排出的时间、6 h内排便粒数和排便重量及粪便含水量。
1.2.4 肠道菌群调节实验
肠道菌群调节实验按照《允许保健食品声称的保健功能目录非营养素补充剂》(2020年版)中保健食品对肠道菌群调节作用的检测方法,小鼠进驻动物房后先适应性饲养5 d,随机抽取6只小鼠无菌采集粪便3~5颗,封装冻存于−80 ℃冰箱,作为自身前后对照空白组(A),再将所有小鼠随机分成空白组(B)、T1-5组(C)、T1-9组(D)、5B-1组(E)。每天测定小鼠的体重调整灌胃量,实验组以0.1 mL/10 g·bw的灌胃体积连续灌胃相应菌悬液15 d,空白组给予蒸馏水。末次灌胃后,同样方法采集各组小鼠粪便,封装后置于−80 ℃冰箱。采样结束后干冰存放转送至北京诺禾致源科技股份有限公司进行测序,使用DNA提取试剂盒提取小鼠粪便的总DNA,并对 DNA纯度、浓度和完整性进行检测。以稀释后的基因组DNA为模板,采用16S rDNA扩增选择区域为基因V3-V4区特异性序列,根据PCR产物浓度进行等量混样,充分混匀后使用1.8%浓度的琼脂糖凝胶电泳纯化PCR产物。使用NEB Next® Ultra™ II DNA Library Prep Kit建库试剂盒进行文库构建,将构建好的文库使用Qubit/Agilent Bioanalyzer2100 System/Q-PCR定量;待文库合格后,使用NovaSeq6000进行上机测序。
1.3 数据处理
本论文中实验数据均使用Microsoft Excel 2019通过“均数±标准差”(¯X±SD)来表示,并使用GraphPad Prism 8分析并绘制图表,组间采用单因素方差分析(one-way ANOVA),P<0.05表示差异有统计学意义。
2. 结果与分析
2.1 小肠推进率实验结果
由表1可知,与空白组相比,模型组小肠推进率显著降低(P<0.01),说明造模成功。灌胃6种副干酪乳杆菌后,各组小肠推进率皆高于模型组,其中菌株T1-9、5B-1的小肠推进率显著高于模型组(P<0.01),说明灌胃菌株T1-9、5B-1能促进便秘小鼠的肠道蠕动。
表 1 副干酪乳杆菌对小鼠肠道推进的影响Table 1. Effect of Lactobacillus paracasei on intestinal propulsion in mice组别 小肠全长(cm) 活性炭推进长度(cm) 推进率(%) 空白组 54.76±5.06 35.52±7.11# 65.10±13.18## 模型组 54.41±4.09 16.02±1.52 29.60±3.67 T1-5 55.57±4.50 23.10±7.28 41.56±12.95 T1-7 52.76±6.42 18.60±5.00 36.01±11.40 T1-9 54.48±6.63 24.77±3.93 45.96±8.07## T1-d 48.91±4.75 21.38±8.28 41.14±15.18 5B-1 52.76±3.97 22.57±4.69 43.12±9.98## 6108 52.19±4.52 18.80±6.19 35.86±10.21 注:#表示与模型组相比差异有显著性,P<0.05;##表示与模型组相比差异有显著性,P<0.01;表2同。 2.2 排便颗粒数实验结果
由表2可知,模型组首次排红便时间与空白组小鼠相比显著升高、6 h排便颗粒数和粪便湿重与空白组小鼠相比显著降低(P<0.01),表明便秘模型小鼠造模成功。与模型组相比, T1-9组和5B-1组首粒红便时间显著缩短(P<0.01); T1-9组、5B-1组以及对照菌株6108组6 h排便颗粒数显著增多(P<0.05); T1-9组和对照菌株6108组的粪便湿重显著增加(P<0.01、P<0.05);将各组小鼠粪便冻干后称量其粪便干重计算其含水率,各组小鼠粪便含水率与模型组比较无显著性差异(P>0.05)。
表 2 副干酪乳杆菌对小鼠排便情况的影响Table 2. Effect of Lactobacillus paracasei on defecation in mice组别 首粒红便时间
(min)6 h粪便
颗粒数粪便湿重
(g)含水率
(%)空白组 73.20±26.19## 41.00±13.74## 0.71±0.22## 0.58±0.11 模型组 200.70±64.02 12.60±4.86 0.24±0.13 0.49±0.06 T1-5 195.90±58.56 16.60±12.89 0.31±0.23 0.53±0.09 T1-7 167.44±56.42 19.60±10.28 0.30±0.15 0.55±0.09 T1-9 111.90±31.69## 27.30±11.61# 0.51±0.20## 0.56±0.11 T1-d 181.20±28.00 19.90±5.93 0.32±0.09 0.46±0.02 5B-1 130.90±54.52## 27.10±16.41# 0.39±0.19 0.48±0.11 6108 171.70±57.75 27.80±13.41# 0.48±0.16# 0.46±0.08 《允许保健食品声称的保健功能目录非营养素补充剂》(2020年版)中的通便功能检验方法中的结果判定表明,6 h内排粪便重量和粪便颗粒数任一结果阳性,同时小肠运动实验和排首便时间任一结果阳性,可判定该实验结果阳性。小肠推进率实验和排便颗粒数实验结果表明,菌株T1-9和5B-1能一定程度改善小鼠的便秘症状,促进便秘小鼠的肠道运动,起到一定的润肠通便效果。结合小肠推进率实验,菌株T1-5组活性炭推进长度高于5B-1组,小肠全长高于T1-9和5B-1组,推测可能是个体差异性导致T1-5组小肠推进率略小于T1-9和5B-1组。综合分析,选择菌株T1-5、T1-9和5B-1进行肠道菌群实验。
2.3 肠道菌群实验结果
2.3.1 副干酪乳杆菌对小鼠肠道菌群多样性的影响
2.3.1.1 OUT组成与分析
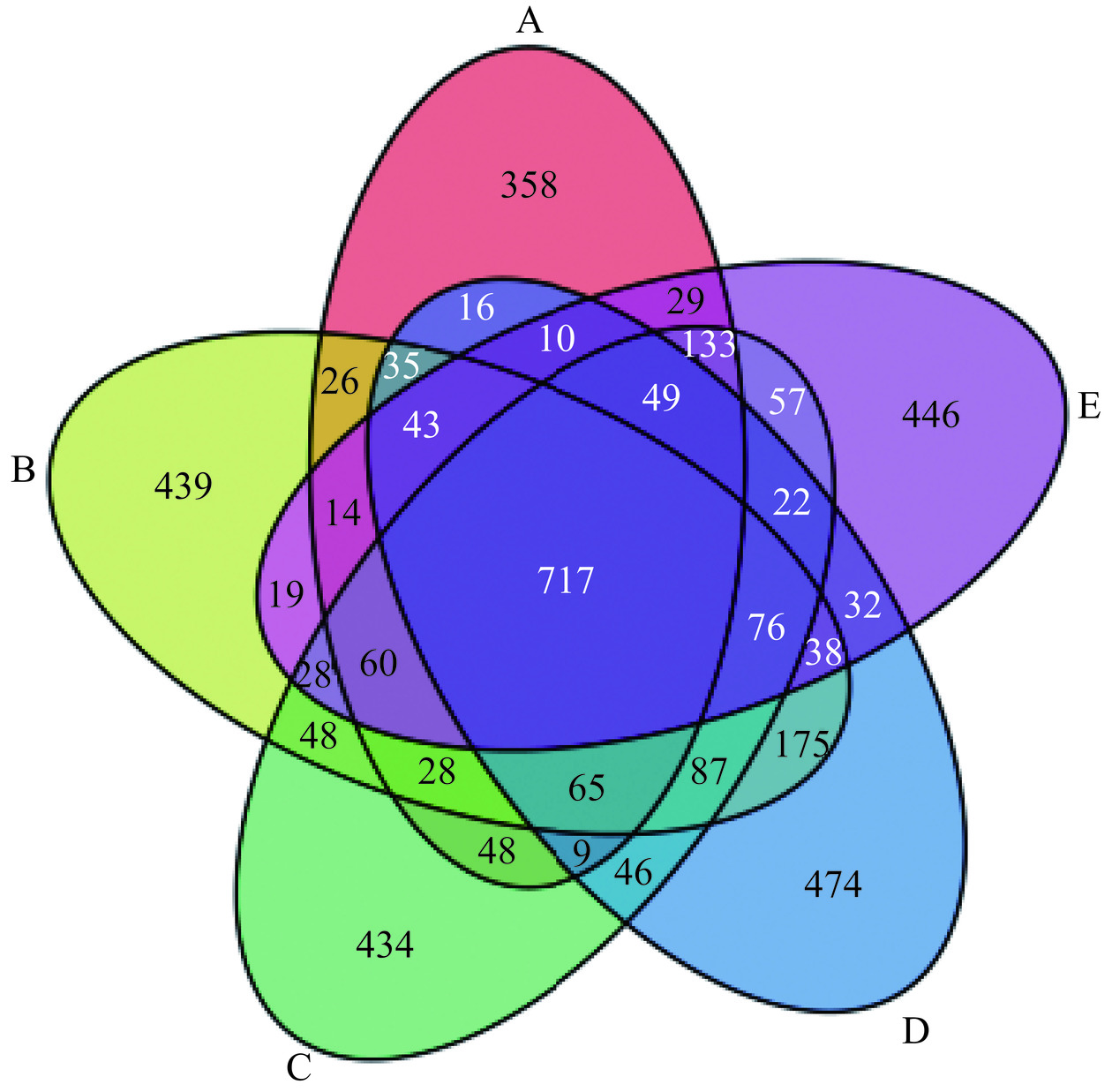
Venn图是根据降噪得到的扩增子序列变体(Amplicon Sequence Variants,ASVs)结果,分析不同组之间共有、特有的ASVs,图中每个圈代表一个组,圈和圈重叠部分的数字代表组之间共有的ASVs个数,没有重叠部分的数字代表每个组的特有ASVs个数。由图1可知,共检测到4061个ASVs,5个组之间共有的ASVs为717个,自身前后对照空白组、空白组、T1-5组、T1-9组和5B-1组独有的ASVs数目分别为358、439、434、474、446。上述数据表明与自身前后对照空白组相比,在灌胃蒸馏水、副干酪乳杆菌T1-5、T1-9以及5B-1后,各组独有的ASVs数目都有了一定的提高。同时,菌株T1-9以及5B-1独有的ASVs数目高于经蒸馏水干预的空白组。
2.3.1.2 Alpha多样性
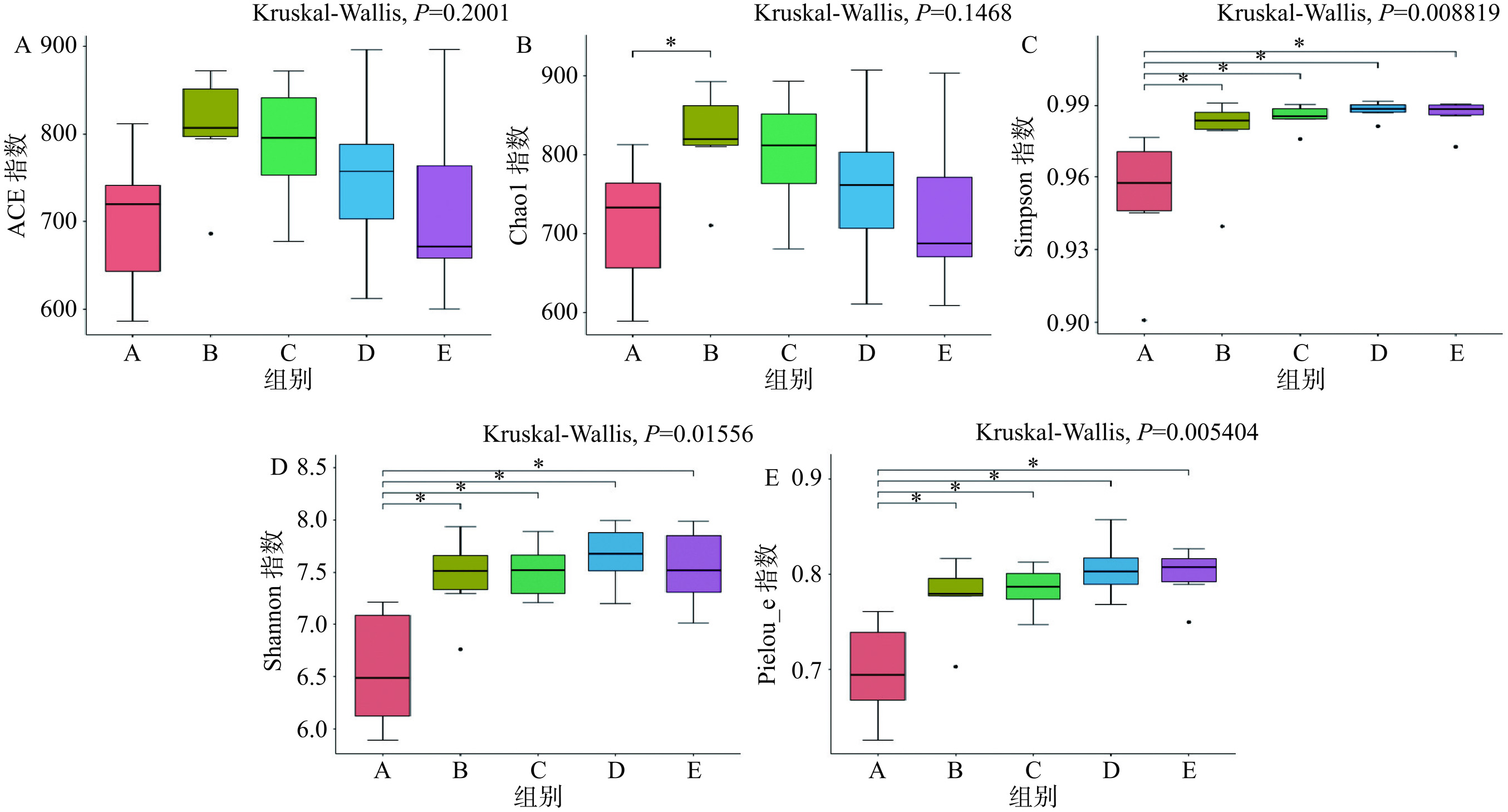
Alpha多样性(Alpha Diversity)反映的是样本内的微生物群落多样性,通过对单个样品的多样性分析可以反映样本内的物种丰度(Richness)及物种多样性(Diversity)。Alpha多样性有多种衡量指标:Chao1、ACE、Shannon、Simpson、Pielou_e、Coverage。Coverage指数可以反映群落覆盖率,由表3可知Coverage指数趋近于1,表明本研究中样本序列基本被测出。ACE指数和Chao1指数能反映出样本中群落种类的丰度,常被用于估计物种总数,由图2A、图2B可知,与自身前后对照空白组相比,空白组和T1-5组、T1-9组、5B-1组ACE指数和 Chao1指数均呈现升高趋势,说明蒸馏水和益生菌干预的小鼠肠道微生物丰富度都有增加的趋势。Simpson指数、Shannon指数和Pielou_e指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响。Simpson指数和Shannon指数值越大,说明样品的物种多样性越高,Pielou_e指数越大,说明物种的均匀度越高。
表 3 各组小鼠肠道菌群Alpha多样性指数Table 3. Alpha diversity index of intestinal microbiota in each group of mice组别 ACE Chao1 Simpson Shannon Pielou_e Coverage A 700.52±83.00 712.17±84.42 0.95±0.03 6.56±0.58 0.70±0.05 0.9986 B 805.46±67.00 821.42±64.00* 0.98±0.02* 7.45±0.40* 0.78±0.04* 0.9984 C 789.24±72.01 801.62±77.10 0.99±0.01* 7.51±0.27* 0.78±0.02* 0.9985 D 751.06±96.46 757.83±101.56 0.99±0.00* 7.66±0.30* 0.81±0.03* 0.9987 E 714.66±108.80 725.33±106.34 0.99±0.01* 7.54±0.38* 0.80±0.03* 0.9988 注:*表示与自身前后对照空白组(A)相比差异有显著性,P<0.05。 由表3和图2的结果可知,与自身前后对照空白组比较,4组Simpson指数、Shannon指数和Pielou_e指数均显著升高(P<0.05),说明空白组和T1-5组、T1-9组、5B-1组菌落多样性均显著增加,其中3组益生菌组Pielou_e指数均高于空白组,表明菌株T1-5、T1-9、5B-1干预的小鼠肠道菌群多样性高于蒸馏水干预的同时,经3种副干酪乳杆菌干预的小鼠菌群均匀度更大,改善小鼠的肠道菌群效果更显著。
2.3.1.3 Beta多样性
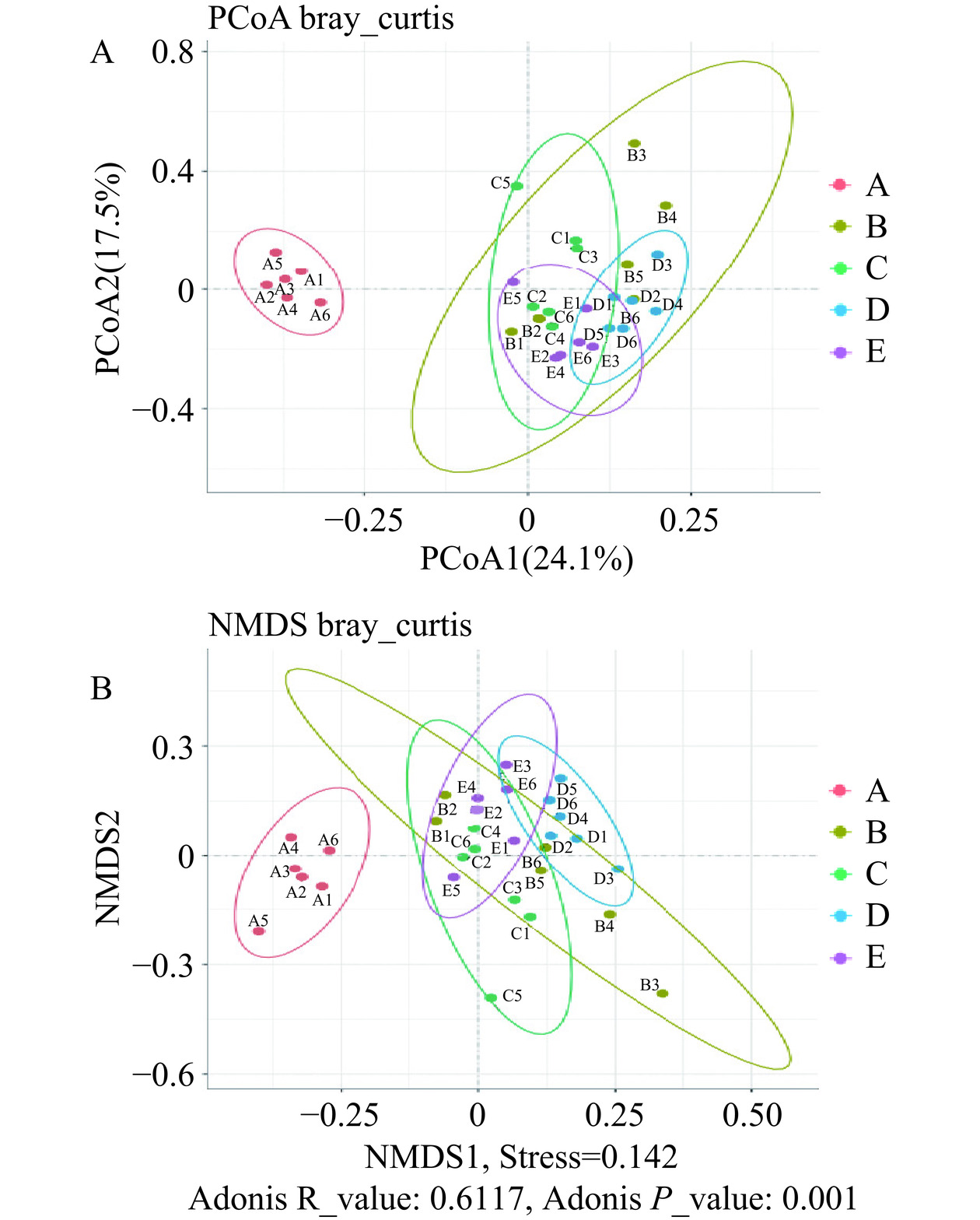
Beta多样性是指沿着环境梯度变化的不同群落之间,物种组成的相异性或物种沿环境梯度的更替速率,因此也被称为生境间多样性(Between-Habitat Diversity)。坐标分析(Principal Co-ordinates Analysis,PCoA)可以用于判断物种的组成相似程度,物种组成越相似的样本,其距离越接近。非度量多维尺度分析(Non-metric Multi-Dimensional Scaling,NMDS)能更好地反映生态学数据中的非线性结构,倾向于比对各样本组之间的差异性。由图3可知,不同颜色代表不同的样本,其离散程度代表不同样本间的差异性。PCoA分析结果表明,与自身前后对照空白组相比,空白组和益生菌组的样本明显分离,表明菌群结构出现了一定的差异,说明蒸馏水和3种副干酪乳杆菌均能改善小鼠的肠道菌群。同时益生菌各组内的样本离散程度比空白组更小,说明其物种丰度更加均匀;图3B中,NMDS分析结果表明自身前后对照空白组的菌群与其余各组分离,与其他组距离较远,和其他各组间相比具有显著性差异(P<0.001),Stress<0.2表明可以准确反映样本间差异程度。
2.3.2 各组小鼠肠道菌群物种组成及差异分析
2.3.2.1 门水平物种组成及差异分析
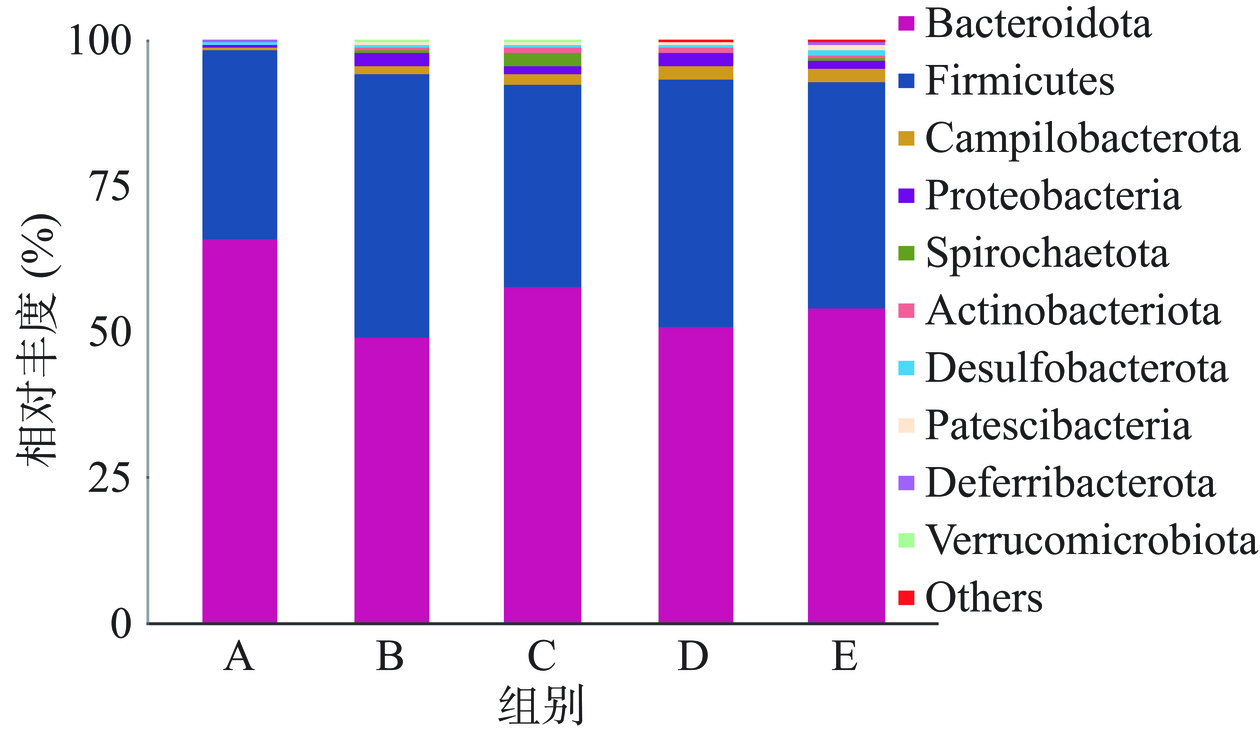
群落柱形图可以解释各组样本的优势物种及其相对丰度, 图4为小鼠门水平前10菌群相对丰度柱状图,并将其他物种合并为Others在图中显示,不同颜色代表不同物种,色块长度表示物种所占相对丰度比例。在门水平上,拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)是各组的优势物种,其次还有弯曲杆菌门(Campilobacterota)和变形菌门(Proteobacteria)。与自身前后对照空白组相比,空白组拟杆菌门相对丰度显著下降,益生菌组干预后拟杆菌门出现上升趋势,而厚壁菌门相对丰度下降,见图4。
表4中关于各组小鼠肠道菌群在各级水平上的差异,在门水平上,与自身前后对照空白组相比,空白组和T1-9组厚壁菌门、弯曲杆菌门和变形菌门丰度显著提高,差异具有统计学意义(P<0.01),T1-5组和5B-1组弯曲杆菌门和变形菌门丰度显著增加(P<0.01),同时4组拟杆菌门丰度都显著减小(P<0.01),其中益生菌组较空白组减少程度较轻,说明3株菌株均具有提高菌群的菌落丰度、调节肠道菌群结构的作用。
表 4 小鼠粪便中不同微生物级别菌群的影响Table 4. Effects of different microbial grades on microbial communities in mouse feces外文名 中文名 A B C D E Bacteroidota 拟杆菌门 659121.16±99503.54 489399.13±102819.01** 575692.75±129712.65** ## 509555.05±93801.80** 541141.59±81185.53** Firmicutes 厚壁菌门 324733.36±93884.28 451969.78±86907.48** 348774.40±101775.01## 422954.59±92146.00** 388632.47±78387.66 Campilobacterota 弯曲杆菌门 4083.91±1617.43 15291.97±4088.84** 21132.60±7395.43** 24736.82±5573.87**# 17612.67±5511.09** Proteobacteria 变形菌门 3720.89±515.78 27433±8626.38** 20134.32±7074.97** 27115.86±14345.58**# 16108.75±5448.03**## Lactobacillaceae 乳杆菌科 29283.13±10896.18 78691.94±24928.98** 77520.79±31570.32** 81941.78±21313.17** 95170.18±63149.44** Rikenellaceae 理研菌科 23745.01±4593.56 48164.19±7726.44** 50692.32±13548.76** 43678.37±4876.25* 68888.40±12439.32**# Prevotellaceae 普雷沃氏菌科 10060.68±2557.40 35947.03±14441.36 23513.80±7134.42 36716.28±11917.00 45649.02±25458.17* Bifidobacteriaceae 双歧杆菌科 198.79±79.22 1305.12±633.73** 968.04±211.18* 2359.59±963.59**## 267.94±53.98## Enterobacteriaceae 肠杆菌科 129.65±25.93 207.44±144.37 146.93±65.26 69.15±53.98 164.22±91.06 Muribaculaceae 细菌属 598407.06±100995.26 366994.24±85330.09** 452734.71±107876.25** ## 352737.30±71974.74** 345749.28±74746.87** Lactobacillus 乳杆菌属 29283.13±10896.18 78691.94±24928.98** 77520.79±31570.32** 81941.78±21213.17** 95170.18±63149.32** Alistipes 别样杆菌属 17787.69±3982.40 29940.02±13576.73 43254.85±13009.33 33604.73±13529.61 51089.91±12232.15* Bacteroides 拟杆菌属 14235.34±4813.61 27502.64±10834.69 25726.46±9702.80 45830.52±16065.20 53051.91±16794.85** 注:*表示与自身前后对照空白组(A)相比差异有显著性,P<0.05;**表示与自身前后对照空白组(A)相比差异有显著性,P<0.01;#表示与空白组(B)相比差异有显著性,P<0.05;##表示与空白组(B)相比差异有显著性,P<0.01。 2.3.2.2 科水平物种组成及差异分析
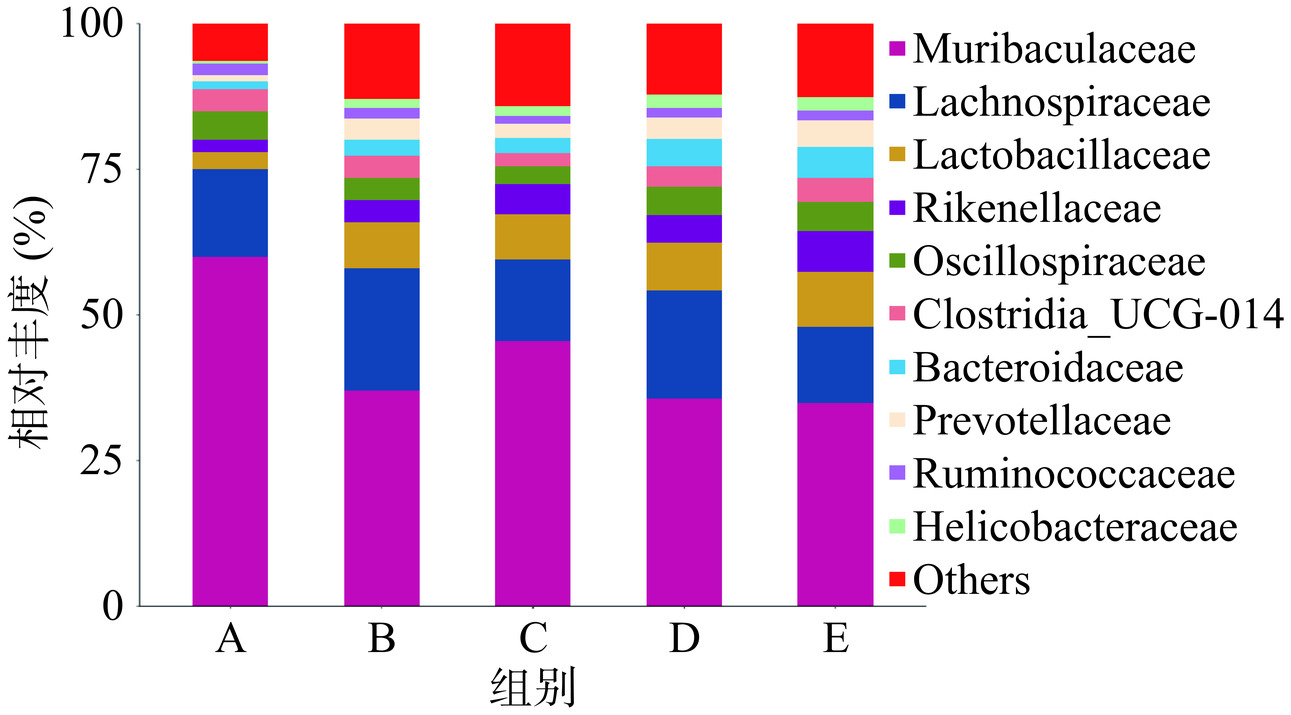
在科水平上,各组小鼠优势菌群主要是Muribaculaceae属于拟杆菌科[31]、毛螺菌科(Lachnospiraceae)、乳杆菌科(Lactobacillaceae)、理研菌科(Rikenellaceae)、颤螺旋菌科(Oscillospiraceae)等,与自身前后对照空白组相比,空白组和益生菌组毛螺菌科、乳杆菌科、拟杆菌科(Bacteroidaceae)、螺旋菌科(Helicobacteraceae)、理研菌科、普雷沃氏菌科(Prevotellaceae)等菌群丰度都明显升高,分布情况见图5。
根据《允许保健食品声称的保健功能目录非营养素补充剂》(2020年版)中调节肠道菌群功能检验方法中的结果判定表明,粪便中双歧杆菌和(或)乳杆菌明显增加,产气荚膜梭菌减少或不增加,肠杆菌、肠球菌无明显变化或肠杆菌和(或)肠球菌明显增加,但增加的幅度低于双歧杆菌或乳杆菌增加的幅度,则判定为实验结果阳性。由表4可知,与自身前后对照空白组比较,空白组和3组益生菌乳杆菌科丰度显著增加(P<0.01),同时空白组、T1-5组和T1-9组双歧杆菌科丰度显著增加(PB、D<0.01、PC<0.05),5B-1组双歧杆菌科丰度基本不变。与空白组相比,3组益生菌组肠杆菌科(Enterobacteriaceae)丰度有一定程度的减小。另外研究发现,与自身前后对照空白组比较,空白组和3组益生菌组干预后,有益菌理研菌科丰度显著增加(PD<0.05、PB、C、E<0.01),其中5B-1组有益菌普雷沃氏菌科丰度也显著增加(P<0.05),普雷沃氏菌科具有多种作用,包括减轻炎症、消化纤维素、产生短链脂肪酸如乙酸、丁酸等[32];理研菌科对调节肠道健康有重要作用[33]。综上,3组益生菌组实验结果均为阳性,能增加有益菌理研菌和普雷沃氏菌丰度,减少有害菌肠杆菌等丰度,表明3种菌株均有调节肠道菌群的作用,具有一定开发为有益人体健康益生菌的价值。
2.3.2.3 属水平物种组成及差异分析
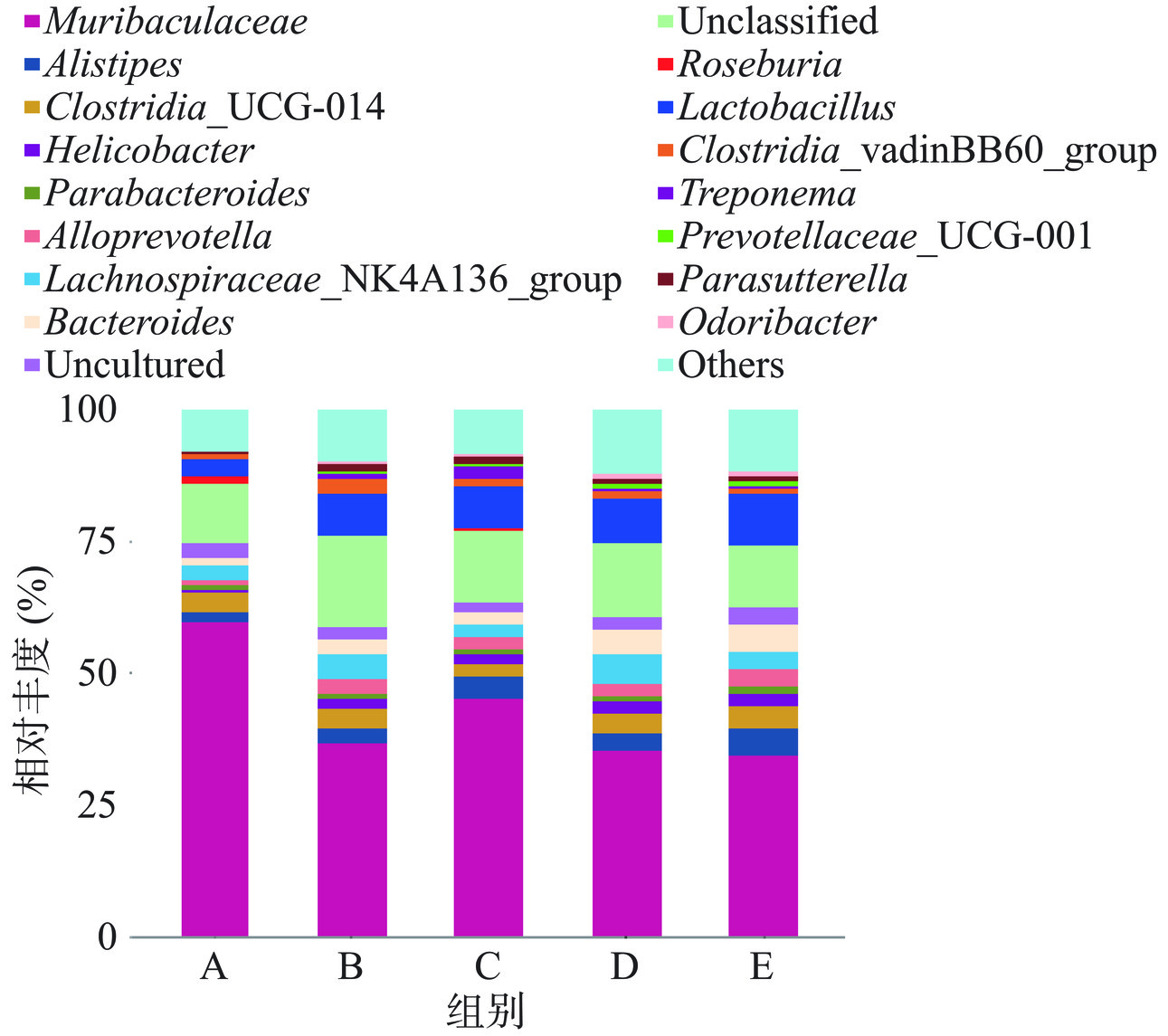
在属水平上,各组小鼠优势菌群主要是Muribaculaceae、乳杆菌属(Lactobacillus)、毛螺菌属(Lachnospira)、另枝菌属(Alistipes)、梭菌属(Clostridia)、拟杆菌属(Bacteroides)、普雷沃菌属(Prevotella)、螺杆菌属(Helicobacter)等,分布情况见图6。与自身前后对照空白组相比,空白组和益生菌组另枝菌属、乳杆菌属、拟杆菌属、梭菌科vadinBB60属Clostridia、毛螺菌科NK4A136属Lachnospiraceae 等菌群丰度显著升高,表明益生菌可以提高各菌群的群落丰度,其中T1-9组和5B-1组干预后各菌群丰度增加幅度较大。
表4中关于各组小鼠肠道菌群在各级水平上的差异,在属水平上,与自身前后对照空白组相比,空白组和3组益生菌组乳杆菌属丰度显著增加(P<0.01),Muribaculaceae属丰度显著降低(P<0.01),对应所属门水平拟杆菌门丰度显著降低(P<0.01),推测3株副干酪乳杆菌对拟杆菌门菌种有一定的抑制作用。在3组益生菌组中,5B-1组拟杆菌属和别样杆菌属(Alistipes)丰度显著增加(P<0.01、P<0.05)。
综合门水平和科水平分析,益生菌干预后各组小鼠肠道菌群均发生改变,提示3株副干酪乳杆菌可以调整肠道内菌群结构,增加有益菌丰度,减少有害菌梭菌UCG-014属Clostridia和肠杆菌等丰度,其中菌株5B-1调整菌群结构幅度最大,效果更显著。
3. 结论
在小肠推进实验中,盐酸洛哌丁胺诱导的便秘模型小鼠体重无明显差别,因此实验对肠动力水平进行检测,发现与模型组相比,菌株T1-9、5B-1干预后,首粒红便时间显著减少(P<0.01),6 h排便颗粒数显著提高(P<0.05);其中T1-9组粪便湿重显著增大(P<0.01)。在小肠推进实验中, 6种副干酪乳杆菌组小肠推进率皆高于模型组,其中菌株T1-9、5B-1的小肠活性炭推进效果较好,综上表明菌株T1-9、5B-1对促进肠胃蠕动、改善便秘小鼠粪便状态有较为明显的作用。基于此,后续肠道菌群调节实验选择作用明显的菌株T1-9、5B-1以及活性炭推进长度较长的菌株T1-5。
在肠道菌群实验中,门水平、科水平和属水平结果表明3株益生菌都能够调节肠道菌群结构,增加有益菌理研菌和普雷沃氏菌等丰度,有害菌梭菌和肠杆菌丰度都有一定程度减少,其中菌株5B-1调整菌群结构幅度最大。综上所述,菌株T1-5、T1-9、5B-1具有促进肠蠕动、调整肠道菌群结构从而改善便秘的功能。在后续实验中,将对3株菌株功效及安全性进行系统研究,为其在食品中及更广泛的应用提供科学支持。
-
表 1 副干酪乳杆菌对小鼠肠道推进的影响
Table 1 Effect of Lactobacillus paracasei on intestinal propulsion in mice
组别 小肠全长(cm) 活性炭推进长度(cm) 推进率(%) 空白组 54.76±5.06 35.52±7.11# 65.10±13.18## 模型组 54.41±4.09 16.02±1.52 29.60±3.67 T1-5 55.57±4.50 23.10±7.28 41.56±12.95 T1-7 52.76±6.42 18.60±5.00 36.01±11.40 T1-9 54.48±6.63 24.77±3.93 45.96±8.07## T1-d 48.91±4.75 21.38±8.28 41.14±15.18 5B-1 52.76±3.97 22.57±4.69 43.12±9.98## 6108 52.19±4.52 18.80±6.19 35.86±10.21 注:#表示与模型组相比差异有显著性,P<0.05;##表示与模型组相比差异有显著性,P<0.01;表2同。 表 2 副干酪乳杆菌对小鼠排便情况的影响
Table 2 Effect of Lactobacillus paracasei on defecation in mice
组别 首粒红便时间
(min)6 h粪便
颗粒数粪便湿重
(g)含水率
(%)空白组 73.20±26.19## 41.00±13.74## 0.71±0.22## 0.58±0.11 模型组 200.70±64.02 12.60±4.86 0.24±0.13 0.49±0.06 T1-5 195.90±58.56 16.60±12.89 0.31±0.23 0.53±0.09 T1-7 167.44±56.42 19.60±10.28 0.30±0.15 0.55±0.09 T1-9 111.90±31.69## 27.30±11.61# 0.51±0.20## 0.56±0.11 T1-d 181.20±28.00 19.90±5.93 0.32±0.09 0.46±0.02 5B-1 130.90±54.52## 27.10±16.41# 0.39±0.19 0.48±0.11 6108 171.70±57.75 27.80±13.41# 0.48±0.16# 0.46±0.08 表 3 各组小鼠肠道菌群Alpha多样性指数
Table 3 Alpha diversity index of intestinal microbiota in each group of mice
组别 ACE Chao1 Simpson Shannon Pielou_e Coverage A 700.52±83.00 712.17±84.42 0.95±0.03 6.56±0.58 0.70±0.05 0.9986 B 805.46±67.00 821.42±64.00* 0.98±0.02* 7.45±0.40* 0.78±0.04* 0.9984 C 789.24±72.01 801.62±77.10 0.99±0.01* 7.51±0.27* 0.78±0.02* 0.9985 D 751.06±96.46 757.83±101.56 0.99±0.00* 7.66±0.30* 0.81±0.03* 0.9987 E 714.66±108.80 725.33±106.34 0.99±0.01* 7.54±0.38* 0.80±0.03* 0.9988 注:*表示与自身前后对照空白组(A)相比差异有显著性,P<0.05。 表 4 小鼠粪便中不同微生物级别菌群的影响
Table 4 Effects of different microbial grades on microbial communities in mouse feces
外文名 中文名 A B C D E Bacteroidota 拟杆菌门 659121.16±99503.54 489399.13±102819.01** 575692.75±129712.65** ## 509555.05±93801.80** 541141.59±81185.53** Firmicutes 厚壁菌门 324733.36±93884.28 451969.78±86907.48** 348774.40±101775.01## 422954.59±92146.00** 388632.47±78387.66 Campilobacterota 弯曲杆菌门 4083.91±1617.43 15291.97±4088.84** 21132.60±7395.43** 24736.82±5573.87**# 17612.67±5511.09** Proteobacteria 变形菌门 3720.89±515.78 27433±8626.38** 20134.32±7074.97** 27115.86±14345.58**# 16108.75±5448.03**## Lactobacillaceae 乳杆菌科 29283.13±10896.18 78691.94±24928.98** 77520.79±31570.32** 81941.78±21313.17** 95170.18±63149.44** Rikenellaceae 理研菌科 23745.01±4593.56 48164.19±7726.44** 50692.32±13548.76** 43678.37±4876.25* 68888.40±12439.32**# Prevotellaceae 普雷沃氏菌科 10060.68±2557.40 35947.03±14441.36 23513.80±7134.42 36716.28±11917.00 45649.02±25458.17* Bifidobacteriaceae 双歧杆菌科 198.79±79.22 1305.12±633.73** 968.04±211.18* 2359.59±963.59**## 267.94±53.98## Enterobacteriaceae 肠杆菌科 129.65±25.93 207.44±144.37 146.93±65.26 69.15±53.98 164.22±91.06 Muribaculaceae 细菌属 598407.06±100995.26 366994.24±85330.09** 452734.71±107876.25** ## 352737.30±71974.74** 345749.28±74746.87** Lactobacillus 乳杆菌属 29283.13±10896.18 78691.94±24928.98** 77520.79±31570.32** 81941.78±21213.17** 95170.18±63149.32** Alistipes 别样杆菌属 17787.69±3982.40 29940.02±13576.73 43254.85±13009.33 33604.73±13529.61 51089.91±12232.15* Bacteroides 拟杆菌属 14235.34±4813.61 27502.64±10834.69 25726.46±9702.80 45830.52±16065.20 53051.91±16794.85** 注:*表示与自身前后对照空白组(A)相比差异有显著性,P<0.05;**表示与自身前后对照空白组(A)相比差异有显著性,P<0.01;#表示与空白组(B)相比差异有显著性,P<0.05;##表示与空白组(B)相比差异有显著性,P<0.01。 -
[1] LACY B E, MEARIN F, CHANG L, et al. Bowel disorders[J]. Gastroenterology,2016,150(6):1393−1407. doi: 10.1053/j.gastro.2016.02.031
[2] WERTH B. Epidemiology of constipation in adults:Why estimates of prevalence differ[J]. Journal of Epidemiological Research,2019,5(1):37−49. doi: 10.5430/jer.v5n1p37
[3] 张升彦, 张磊, 朱良如, 等. 基于肠道菌群的慢性便秘治疗进展[J]. 临床消化病杂志,2022,34(2):149−152. [ZHANG Shengyan, ZHANG Lei, ZHU Liangru, et al. Progress in the treatment of chronic constipation based on gut microbiota[J]. Chinese Journal of Clinical Gastroenterology,2022,34(2):149−152.] ZHANG Shengyan, ZHANG Lei, ZHU Liangru, et al. Progress in the treatment of chronic constipation based on gut microbiota[J]. Chinese Journal of Clinical Gastroenterology, 2022, 34(2): 149−152.
[4] 于淑俊, 张连中, 刘振权. 复合益生菌粉对功能性便秘小鼠润肠通便的作用[J]. 中国微生态学杂志,2023,35(2):142−151. [YU Shujun, ZHANG Lianzhong, LIU Zhenquan. The effect of compound probiotic powder on moistening the intestines and relieving constipation in mice with functional constipation[J]. Chinese Journal of Microbiology,2023,35(2):142−151.] YU Shujun, ZHANG Lianzhong, LIU Zhenquan. The effect of compound probiotic powder on moistening the intestines and relieving constipation in mice with functional constipation[J]. Chinese Journal of Microbiology, 2023, 35(2): 142−151.
[5] 张俊, 赵保堂, 杨富民. 副干酪乳杆菌的益生特性及其应用研究进展[J]. 包装与食品机械,2019,37(4):47−52. [ZHANG Jun, ZHAO Baotang, YANG Fumin. Research progress on the probiotic characteristics and application of Lactobacillus paracasei[J]. Packaging and Food Machinery,2019,37(4):47−52.] ZHANG Jun, ZHAO Baotang, YANG Fumin. Research progress on the probiotic characteristics and application of Lactobacillus paracasei[J]. Packaging and Food Machinery, 2019, 37(4): 47−52.
[6] 和明涓, 鲍悦悦, 倪敏. 干酪乳杆菌治疗功能性便秘的研究进展[J]. 临床医学研究与实践,2023,8(23):191−194. [HE Mingjuan, BAO Yueyue, NI Min, et al. Research progress on the treatment of functional constipation with Lactobacillus casei[J]. Clinical Medical Research and Practice,2023,8(23):191−194.] HE Mingjuan, BAO Yueyue, NI Min, et al. Research progress on the treatment of functional constipation with Lactobacillus casei[J]. Clinical Medical Research and Practice, 2023, 8(23): 191−194.
[7] LU Y, ZHANG J, ZHANG Z, et al. Konjac glucomannan with probiotics acts as a combination laxative to relieve constipation in mice by increasing short-chain fatty acid metabolism and 5-hydroxytryptamine hormone release[J]. Nutrition,2021,84(1):1−13.
[8] 陈建国, 李周勇, 李桂花, 等. 热灭活副干酪乳杆菌Lc19对小鼠便秘的缓解作用研究[J]. 中国奶牛,2019(9):12−15. [CHEN Jianguo, LI Zhouyong, LI Guihua, et al. Study on the relieving effect of heat-killed Lactobacillus paracasei Lc19 on constipated mice[J]. China Dairy Cattle,2019(9):12−15.] CHEN Jianguo, LI Zhouyong, LI Guihua, et al. Study on the relieving effect of heat-killed Lactobacillus paracasei Lc19 on constipated mice[J]. China Dairy Cattle, 2019(9): 12−15.
[9] 曹永强, 张健, 郑喆, 等. 副干酪乳杆菌N1115发酵乳对小鼠便秘的改善作用[J]. 食品科学,2018,39(1):185−191. [CAO Yongqiang, ZHANG Jian, ZHENG Zhe, et al. Improvement effect of fermented milk from Lactobacillus paracasei N1115 on constipation in mice[J]. Food Science,2018,39(1):185−191.] CAO Yongqiang, ZHANG Jian, ZHENG Zhe, et al. Improvement effect of fermented milk from Lactobacillus paracasei N1115 on constipation in mice[J]. Food Science, 2018, 39(1): 185−191.
[10] 王晓成, 张明, 陈善斌, 等. 副干酪乳杆菌L9对小鼠肠道短链脂肪酸含量的影响[J]. 食品科学,2017,38(13):238−243. [WANG Xiaocheng, ZHANG Ming, CHEN Shanbin, et al. The effect of Lactobacillus paracasei L9 on the content of intestinal short chain fatty acids in healthy mice[J]. Food Science,2017,38(13):238−243.] WANG Xiaocheng, ZHANG Ming, CHEN Shanbin, et al. The effect of Lactobacillus paracasei L9 on the content of intestinal short chain fatty acids in healthy mice[J]. Food Science, 2017, 38(13): 238−243.
[11] 周晓丹, 刘爱萍, 张明, 等. 副干酪乳杆菌LC-01对便秘小鼠的通便作用[J]. 乳业科学与技术,2012,35(5):7−11. [ZHOU Xiaodan, LIU Aiping, ZHANG Ming, et al. The laxative effect of Lactobacillus paracasei LC-01 in constipated mice[J]. Journal of Dairy Science and Technology,2012,35(5):7−11.] ZHOU Xiaodan, LIU Aiping, ZHANG Ming, et al. The laxative effect of Lactobacillus paracasei LC-01 in constipated mice[J]. Journal of Dairy Science and Technology, 2012, 35(5): 7−11.
[12] BOSNEA L A, KOPSAHELIS N, KOKKALI V, et al. Production of a novel probiotic yogurt by incorporation of L. casei enriched fresh apple pieces, dried raisins and wheat grains[J]. Food and Bioproducts Processing,2017,102:62−71. doi: 10.1016/j.fbp.2016.11.010
[13] 田丰伟, 杨震南, 丁历伟, 等. 副干酪乳杆菌LC01对人体肠道菌群的调节作用[J]. 中国食品学报,2018,18(10):24−30. [TIAN Fengwei, YANG Zhennan, DING Liwei, et al. The regulatory effect of Lactobacillus paracasei LC01 on human intestinal microbiota[J]. Chinese Journal of Food Science,2018,18(10):24−30.] TIAN Fengwei, YANG Zhennan, DING Liwei, et al. The regulatory effect of Lactobacillus paracasei LC01 on human intestinal microbiota[J]. Chinese Journal of Food Science, 2018, 18(10): 24−30.
[14] 陆文伟, 胡文兵, 曹文金, 等. 干酪乳杆菌LC01对小鼠肠道菌群和肠道转运调节作用的剂量效应[J]. 食品科学,2019,40(15):211−217. [LU Wenwei, HU Wenbing, CAO Wenjin, et al. Dose effect of Lactobacillus casei LC01 on intestinal microbiota and intestinal transport regulation in mice[J]. Food Science,2019,40(15):211−217.] LU Wenwei, HU Wenbing, CAO Wenjin, et al. Dose effect of Lactobacillus casei LC01 on intestinal microbiota and intestinal transport regulation in mice[J]. Food Science, 2019, 40(15): 211−217.
[15] LIU T H, TSAI T Y, PAN T M. The anti-periodontitis effects of ethanol extract prepared using Lactobacillus paracasei subsp. paracasei NTU 101[J]. Nutrients,2018,10(4):472. doi: 10.3390/nu10040472
[16] HUANG S Y, CHEN L H, WANG M F, et al. Lactobacillus paracasei PS23 delays progression of age-related cognitive decline in senescence accelerated mouse prone 8 (SAMP8) mice[J]. Nutrients,2018,10(7):894. doi: 10.3390/nu10070894
[17] 胡艳杰, 李卡, 杨家印, 等. 肝移植患者术后益生菌强化的早期肠内营养使用的最佳证据总结[J]. 中国普外基础与临床杂志,2020,27(1):63−68. [HU Yanjie, LI Ka, YANG Jiayin, et al. Summary of best evidence for early enteral nutrition use enhanced with probiotics in liver transplant patients after surgery[J]. Chinese Journal of Bases and Clinics in General Surgery,2020,27(1):63−68.] HU Yanjie, LI Ka, YANG Jiayin, et al. Summary of best evidence for early enteral nutrition use enhanced with probiotics in liver transplant patients after surgery[J]. Chinese Journal of Bases and Clinics in General Surgery, 2020, 27(1): 63−68.
[18] 朴善英, 徐小达. 肠道益生菌辅治对非酒精性脂肪性肝硬化患者糖脂代谢、氧化损伤和肝功能的影响[J]. 中国医学工程,2019,27(10):102−104. [PIAO Shanying, XU Xiaoda. The effect of gut probiotic adjuvant therapy on glucose and lipid metabolism, oxidative damage, and liver function in patients with non-alcoholic fatty liver cirrhosis[J]. China Medical Engineering,2019,27(10):102−104.] PIAO Shanying, XU Xiaoda. The effect of gut probiotic adjuvant therapy on glucose and lipid metabolism, oxidative damage, and liver function in patients with non-alcoholic fatty liver cirrhosis[J]. China Medical Engineering, 2019, 27(10): 102−104.
[19] 李萍, 张丽, 黄柳琴. 糜烂性胃炎幽门螺杆菌阳性患者益生菌联合四联疗法治疗后胃肠道微生态变化观察[J]. 现代消化及介入诊疗,2019,24(9):961−964,968. [LI Ping, ZHANG Li, HUANG Liuqin. Observation of changes in gastrointestinal microbiota after probiotic combined with quadruple therapy in Helicobacter pylori positive patients with erosive gastritis[J]. Modern Digestion & Intervention,2019,24(9):961−964,968.] LI Ping, ZHANG Li, HUANG Liuqin. Observation of changes in gastrointestinal microbiota after probiotic combined with quadruple therapy in Helicobacter pylori positive patients with erosive gastritis[J]. Modern Digestion & Intervention, 2019, 24(9): 961−964,968.
[20] NES I F, JOHNSBORG O. Exploration of antimicrobial potential in LAB by genomics[J]. Current Opinion in Biotechnology,2004,15(2):100−104. doi: 10.1016/j.copbio.2004.02.001
[21] 应再军. 术前补充益生菌对肠道手术患者术后肠道菌群及肠黏膜屏障功能的影响[J]. 中国微生态学杂志,2019,31(9):1052−1055. [[YING Zaijun. The effect of preoperative supplementation of probiotics on postoperative gut microbiota and intestinal mucosal barrier function in patients undergoing intestinal surgery[J]. Chinese Journal of Microbiology,2019,31(9):1052−1055.] [YING Zaijun. The effect of preoperative supplementation of probiotics on postoperative gut microbiota and intestinal mucosal barrier function in patients undergoing intestinal surgery[J]. Chinese Journal of Microbiology, 2019, 31(9): 1052−1055.
[22] 王晓光, 石振东, 王国江. 益生菌联合益生元治疗老年慢性功能性便秘临床分析[J]. 中国临床新医学,2014,7(12):1150−1152. [WANG Xiaoguang, SHI Zhendong, WANG Guojiang. Clinical analysis of probiotics combined with prebiotics in the treatment of elderly chronic functional constipation[J]. Chinese Journal of New Clinical Medicine,2014,7(12):1150−1152.] WANG Xiaoguang, SHI Zhendong, WANG Guojiang. Clinical analysis of probiotics combined with prebiotics in the treatment of elderly chronic functional constipation[J]. Chinese Journal of New Clinical Medicine, 2014, 7(12): 1150−1152.
[23] SÁNCHEZ E, NIETO J C, VIDAL S, et al. P0088:Fermented milk containing Lactobacillus paracasei subsp. paracasei CNCM I-1518 reduces bacterial translocation in rats treated with carbon tetrachloride[J]. Scientific Reports,2017,7:45712. doi: 10.1038/srep45712
[24] CHIANG S S, LIAO J W, PAN T M. Effect of bioactive compounds in Lactobacilli-fermented soy skim milk on femoral bone microstructure of aging mice[J]. J Sci Food Agric,2012,92(2):328−335. doi: 10.1002/jsfa.4579
[25] YILMAZ I, DOLAR M E, OZPINAR H. Effect of administering kefir on the changes in fecal microbiota and symptoms of inflammatory bowel disease:A randomized controlled trial[J]. The Turkish Journal of Gastroenterology,2019,30(3):242−253.
[26] ESLAMI M, YOUSEFI B, KOKHAEI P, et al. Are probiotics useful for therapy of Helicobacter pylori diseases?[J]. Comparative Immunology, Microbiology and Infectious Diseases,2019,64:1−30. doi: 10.1016/j.cimid.2019.01.022
[27] LIU C J, TANG X D, YU J, et al. Gut microbiota alterations from different Lactobacillus probiotic-fermented yoghurt treatments in slow-transit constipation[J]. Journal of Functional Foods,2017,38:110−118. doi: 10.1016/j.jff.2017.08.037
[28] GOMI A, YAMAJI K, WATANABE O, et al. Bifidobacterium bifidum YIT 10347 fermented milk exerts beneficial effects on gastrointestinal discomfort and symptoms in healthy adults:A double-blind, randomized, placebo-controlled study[J]. Journal of Dairy Science,2018,101(6):4830−4841. doi: 10.3168/jds.2017-13803
[29] BARROS C P, GUIMARES J T, ESMERINO E A, et al. Paraprobiotics and postbiotics:Concepts and potential applications in dairy products[J]. Current Opinion in Food Science,2020,32:1−8. doi: 10.1016/j.cofs.2019.12.003
[30] 王帅静, 李啸, 刘玲彦, 等. 西藏牦牛粪和乳源中益生菌的筛选与鉴定[J]. 中国酿造,2021,40(7):43−48. [WANG Shuaijing, LI Xiao, LIU Lingyan, et al. Screening and identification of probiotics in Tibetan yak manure and milk source[J]. Chinese Brewing,2021,40(7):43−48.] WANG Shuaijing, LI Xiao, LIU Lingyan, et al. Screening and identification of probiotics in Tibetan yak manure and milk source[J]. Chinese Brewing, 2021, 40(7): 43−48.
[31] 韩明明, 詹炜, 黄福勇, 等. 砂滤模式下马口鱼消化道细菌的组成、分类与相关性[J]. 浙江农业学报,2023,35(10):2286−2298. [HAN Mingming, ZHAN Wei, HUANG Fuyong, et al. Composition, classification, and correlation of bacteria in the digestive tract of zebrafish under sand filtration mode[J]. Acta Agriculturae Zhejiangensis,2023,35(10):2286−2298.] HAN Mingming, ZHAN Wei, HUANG Fuyong, et al. Composition, classification, and correlation of bacteria in the digestive tract of zebrafish under sand filtration mode[J]. Acta Agriculturae Zhejiangensis, 2023, 35(10): 2286−2298.
[32] COX L M, YAMANISHI S, SOHN J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences[J]. Cell,2014,158(4):705−721. doi: 10.1016/j.cell.2014.05.052
[33] CUEVAS-SIERRA A, RIEZU-BOJ J I, GURUCEAGA E, et al. Sex-specific associations between gut Prevotellaceae and host genetics on adiposity[J]. Microorganisms,2020,8(6):938. doi: 10.3390/microorganisms8060938





 下载:
下载:
 下载:
下载:



