Determination of Content of 6 Triterpenic Acids in Malusdoumeri Fruit by High-performance Liquid Chromatography
-
摘要: 建立同时测定大果山楂果实中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、山楂酸、科罗索酸、齐墩果酸和熊果酸的高效液相色谱法(high performance liquid chromatography,HPLC),并对这6种三萜酸在广西6个产地大果山楂果实中的分布及含量进行分析。采用Diamonsil C18(2)色谱柱,以0.1%甲酸水溶液/甲醇(v/v)为流动相,梯度洗脱,流速0.8 mL/min,检测波长210 nm,柱温30 ℃。结果表明:6种三萜酸在线性范围内质量浓度与色谱峰峰面积具有良好的线性关系,相关系数均>0.9990,检出限0.46~2.00 μg/mL,定量下限1.53~6.67 μg/mL,变异系数均<5.0%,加标回收率99.2%~101.3%;6个产地的大果山楂果实中三萜酸含量丰富,均检出蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、山楂酸、科罗索酸、齐墩果酸和熊果酸6种三萜酸,均为五环三萜酸化合物,其中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸首次检出,以熊果酸、蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸为主,三者含量之和占总三萜酸的71.82%~81.38%,总三萜酸含量在808.74~1090.75 μg/g FM之间,其中柳州柳江区和桂林平乐县的果实总三萜酸含量相对较高,分别达到1090.75 μg/g FM和1045.20 μg/g FM。本研究的HPLC法可作为大果山楂果实中三萜酸含量的检测方法,为大果山楂果原料和产品的品质评估提供科学参考。Abstract: A HPLC method was developed for the simultaneous determination of euscaphic acid, 2α,19α-dihydroxy-3-oxo-urs-12-en-28-oic acid, maslinic acid, corosolic acid, oleanic acid, and ursolic acid in Malus doumeri fruits. Analyses were conducted on the distribution and content of these six triterpenic acids in Malus doumeri fruits from six producing areas in Guangxi. Using gradient elution at a flow rate of 0.8 mL/min, a Diamonsil C18 (2) column was used with a mobile phase of 0.1% formic acid aqueous solution/methanol (v/v). The detection wavelength was 210 nm and the column temperature was 30 ℃. The results showed that the mass concentrations of the six triterpenic acids had a good linear relationship with the chromatographic peak areas in the linear range. The correlation coefficients were greater than 0.9990, the detection limits were within 0.46~2.00 μg/mL, the lower quantitation limits were within 1.53~6.67 μg/mL, the coefficients of variation were less than 5.0%, and the recovery percentages were within 99.2%~101.3%. Six samples from different production areas contained six triterpenic acids (euscaphic acid, 2α,19α-dihydroxy-3-oxo-urs-12-en-28-oic acid, maslinic acid, corosolic acid, oleanic acid, and ursolic acid). Each of the six triterpenic acids was a pentacyclic triterpenic acid. Among the six triterpenic acids, euscaphic acid and 2α,19α-dihydroxy-3-oxo-urs-12-en-28-oic acid were first detected in Malus doumeri fruits. Ursolic acid, euscaphic acid, and 2α,19α-dihydroxy-3-oxo-urs-12-en-28-oic acid were predominant, accounting for 71.82%~81.38% of the total triterpenic acids. The total triterpenic acids content ranged from 808.74 to 1090.75 μg/g FM. The total triterpenic acids content of fruits from Liujiang district of Liuzhou and Pingle of Guilin were relatively high, reaching 1090.75 μg/g FM and 1045.20 μg/g FM, respectively. Overall, this study's HPLC method can detect the triterpenic acids content of Malus doumeri fruits and provide scientific references for the quality evaluation of Malus doumeri fruit's raw materials and products.
-
Keywords:
- HPLC /
- Malus doumeri /
- fruits /
- triterpenic acids /
- content
-
大果山楂系蔷薇科苹果属台湾林檎(Malus doumeri (Bois) Chevalier.)或光萼林檎(Malus leiocalyca S. Z. Huang)的果实,主要分布于中国南部桂、闽、台等地,其中广西的人工种植规模较大,种植品种均为台湾林檎[1−3]。大果山楂药食两用,在两广地区被当作山楂食用已有相当长的历史[4],既是广西道地药材,也是广西民间制作果糕、果酱、果酒等地方特色食品的原料[1],具有很高的食用和药用价值[5−7],可治疗食滞、胃痛、高血脂等症[8−9],因此产品倍受消费者青睐,颇具市场前景[10−11]。大果山楂含有大量的氨基酸、三萜酸、多酚等成分,其中三萜酸具有显著的抗肿瘤、护肝、抗病毒作用,是果实中重要的功能成分[4,12−13],定性定量分析大果山楂果实中三萜酸的组成及含量对果实及其相关产品的品质评估及进一步开发利用意义重大。三萜酸类成分组成和含量的常用分析方法有薄层色谱法、HPLC法,其中HPLC法因具有分离效果好、重现性好、准确度高等优点倍受检测人员青睐[14−16]。
尽管已有学者分析了大果山楂果实中三萜酸类成分,但是相关研究非常薄弱,陈秋虹等[17]通过超高效液相色谱法检测了果实中山楂酸的含量,但测定组分单一;Wen等[12]采用HPLC法测定了4个产地的果实中山楂酸、科罗索酸、齐墩果酸、熊果酸4种三萜酸的含量,但未对这4种三萜酸进行方法学考察,该方法所分析的色谱图存在基线漂移、三萜酸之间分离效果不佳等缺陷,色谱条件有待进一步优化,该研究结果也表明4个产地果实中三萜酸均以熊果酸含量最高,占总三萜酸的67%以上,为果实中三萜酸主成分,山楂酸、齐墩果酸、科罗索酸的含量均较低。而本实验室在前期研究中从大果山楂果实中分离得到另外2种含量相对较高的三萜酸化合物,推测以往对三萜酸的组成和含量分析可能存在偏差,无法准确反映果实中三萜酸的组成及结构占比,有必要重新建立能更为全面分析大果山楂果实中三萜酸的组成和含量的方法。因此,本研究建立HPLC同时测定大果山楂果实中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、山楂酸、科罗索酸、齐墩果酸、熊果酸的方法,并比较分析广西6个产地大果山楂果实中这6种三萜酸的分布和含量,旨在为大果山楂原料及产品的品质评估以及深度开发利用提供科学依据。
1. 材料与方法
1.1 材料与仪器
新鲜、成熟的大果山楂果实样品 于2022年10月采自广西6个不同产地:贺州市昭平县(D1)、贺州市富川县(D2)、梧州市苍梧县(D3)、靖西市(D4)、桂林市平乐县(D5)、柳州市柳江区(D6)。挑选表面完好且成熟度大体相同的果实,在温度4 ℃、湿度78%左右的冷库中保存;蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸 对照品,从大果山楂果实中分离得到,通过质谱、核磁共振波谱数据共同鉴定这两种三萜酸的结构,经HPLC检测纯度均大于98%;科罗索酸、山楂酸、齐墩果酸、熊果酸 对照品,购自合肥博美生物科技有限公司;乙腈、甲醇 色谱纯,购自安徽天地高纯溶剂有限公司;三氟乙酸(AR)、甲酸(AR)、磷酸(优级纯) 购自国药集团化学试剂有限公司;95%乙醇(AR) 购自天津市大茂化学试剂厂;水为超纯水。
Shimadzu LC-2030C高效液相色谱仪(配有Prominence SPD-M20A PDA检测器) 日本岛津公司;高速冷冻离心机 德国Eppendorf公司;RIOS 8超纯水系统 美国Millipore公司;XS205DU电子分析天平 梅特勒-托利多国际贸易(上海)有限公司;KQ300DE数控超声波清洗机 昆山舒美仪器有限公司;N-1100旋转蒸发仪 日本东京理化器械株式会社;BCD-213D11D冰箱 广东容声电器股份有限公司。
1.2 实验方法
1.2.1 溶液配制
1.2.1.1 0.1%甲酸水溶液的配制
移取1.0 mL甲酸于1.0 L棕色容量瓶,注入超纯水定容至刻度,摇匀,经0.45 μm水系微孔膜抽滤,超声15 min进行脱气,当天使用。
1.2.1.2 样品稀释液的配制
分别准确量取0.1%甲酸水溶液21.0 mL、色谱甲醇79.0 mL,混合摇匀,现配现用。
1.2.1.3 对照品溶液的配制
分别精确称取20.0 mg的蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、科罗索酸、山楂酸、齐墩果酸、熊果酸对照品,置于5.0 mL棕色容量瓶中,并用色谱甲醇溶解后定容至刻度,得到4000.0 μg/mL的单一对照品母液,再根据需要分别移取适量的6种对照品母液,充分混合后,将溶液中的各对照品浓度稀释至以下范围:蔷薇酸1.00~156.00 μg/mL、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸1.00~90.54 μg/mL、科罗索酸1.00~500.00 μg/mL、山楂酸1.00~500.00 μg/mL、齐墩果酸1.00~500.00 μg/mL、熊果酸1.00~1000.00 μg/mL,12000 r/min高速离心10 min,取上清液,得到系列浓度的混合对照品溶液。
1.2.2 大果山楂果实总三萜酸的提取及分析前样品预处理
1.2.2.1 总三萜酸的提取
参考文献方法[14,18],稍作改进。将大果山楂鲜果切成丁,并匀浆。准确称取各个样品匀浆30.0 g,提取溶剂为95%乙醇,料液比1:7(g/mL),提取温度70 ℃,回流提取4 h,趁热超声20 min,功率300 W,过滤,滤液用95%乙醇定容至250 mL,即得到大果山楂果实总三萜酸的提取液。
1.2.2.2 分析前样品预处理
将1.2.2.1得到的总三萜酸提取液50 ℃减压浓缩干燥,色谱甲醇超声溶解并转移至25.0 mL容量瓶中定容,进样前再用样品稀释液稀释至标准曲线线性范围内的浓度,12000 r/min高速离心10 min,取上清液密封备用。
1.2.3 色谱条件优化及系统适应性试验
检测波长的选择:分别取适量6种三萜酸对照品母液,用色谱甲醇稀释成75.0 μg/mL,在190~400 nm紫外光谱区间对浓度均为75.0 μg/mL的6种三萜酸进行扫描,检测波长选取溶剂干扰之外的较大吸收波长。色谱柱的选择:对Symmetry C18、ZORBAX SB-C18、BEH C18和Diamonsil C18(2)4种不同品牌及型号的反相色谱柱分析6种三萜酸的分离效果进行考察,峰型和分离度均较好的色谱柱为优选。流动相及检测条件的优化:对流动相中的有机相、水溶液的酸种类和浓度、梯度洗脱程序、柱温和流速进行优化,得到优化后的色谱条件,并以各三萜酸对照品色谱峰之间的分离度、理论塔板数和干扰组分与目标组成的分离效果为指标考察系统适应性。
1.2.4 方法学验证
1.2.4.1 线性关系和灵敏度试验
按1.2.3优化后得到的色谱条件对混合三萜酸对照品溶液进行检测,以峰面积为纵坐标,浓度(μg/mL)为横坐标绘制6个三萜酸的标准曲线得到线性方程和线性范围,再将混合三萜酸对照品稀释至信噪比(signal to noise,S/N)分别为3和10时,确定各三萜酸的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)[19],重复6次。
1.2.4.2 精密度试验
连续6次对75.0 μg/mL混合三萜酸对照品溶液进行分析,所有三萜酸的变异系数(relative standard deviation,RSD)均以峰面积计算。
1.2.4.3 稳定性试验
移取3份混合三萜酸对照品溶液,第一份溶液中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸浓度为30.00 μg/mL,山楂酸、科罗索酸、齐墩果酸、熊果酸浓度为62.50 μg/mL;第二份溶液中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸浓度为62.5 μg/mL,山楂酸、科罗索酸、齐墩果酸、熊果酸浓度为250.00 μg/mL;第三份溶液中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸浓度为90.00 μg/mL,山楂酸、科罗索酸、齐墩果酸、熊果酸浓度为400.00 μg/mL;处理方法同1.2.4.1,在1 d内每4 h检测1次,累计6次;在6 d内,每隔24 h检测1次;分别计算每个三萜酸日内和日间峰面积的RSD值。
1.2.4.4 重复性试验
精密称取1.2.2.1中的大果山楂匀浆6.0 g,共6份,分别按1.2.2的方法对大果山楂果实中的总三萜酸进行提取及样品预处理,进样检测,分别计算每个三萜酸峰面积的RSD值。
1.2.4.5 加标回收率的测定
精密称取1.2.2.1中的大果山楂匀浆6.0 g,以原有目标化合物量的1.5倍、1倍、0.5倍加入6个三萜酸对照品溶液,按照1.2.2的方法对大果山楂果实中的总三萜酸进行提取及样品预处理,进样检测,重复3次,记录峰面积,根据线性方程计算样品和加标样品中各个三萜酸的浓度,进一步计算得到各个三萜酸的加标回收率和RSD值。
1.2.4.6 样品色谱图分析及含量测定
移取1.2.2.2制备的总三萜酸样品进行分析,根据单一对照品的保留时间(retention time,RT)和最大吸收波长对样品中目标组分进行定性,将各个三萜酸的峰面积带入对应的标准曲线计算得到各自的含量,结果以新鲜物质(fresh material,FM)质量计,重复3次。
1.3 数据处理
采用Excel 2010 软件进行数据处理,SPSS 26.0软件对数据进行差异性分析(ANOVA),P<0.05为统计学上有显著差异,Adobepshoop cs6软件对色谱图进行处理。
2. 结果与分析
2.1 色谱条件的确定
2.1.1 检测波长的选择
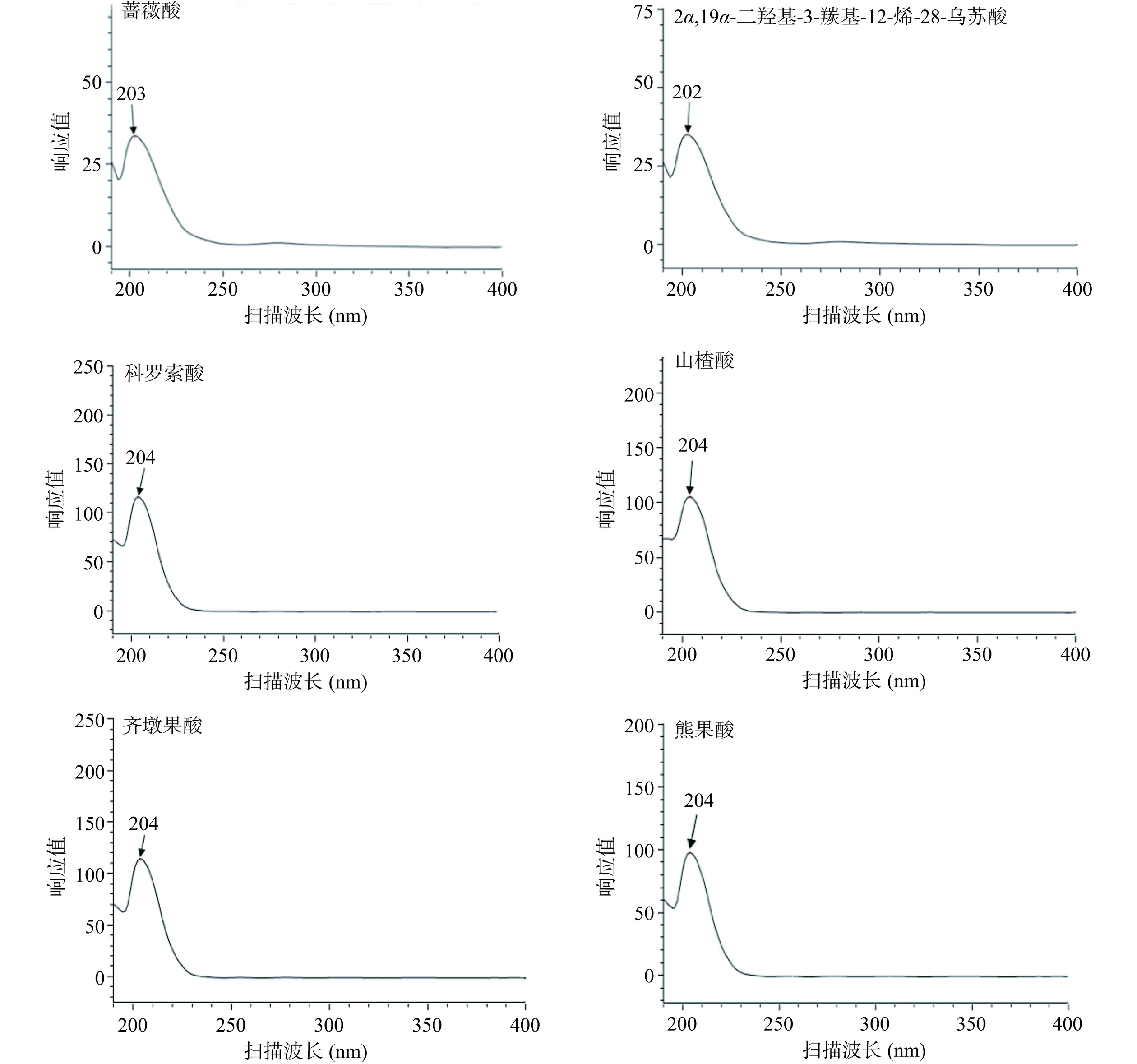
蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、科罗索酸、山楂酸、齐墩果酸、熊果酸单一对照品溶液的紫外光谱扫描结果显示,这6种三萜酸均在203 nm附近有最大吸收峰(图1);由于色谱甲醇溶剂的最大吸收波长在200 nm附近,与6种三萜酸的最大吸收峰很接近,如果使用203 nm或204 nm作为检测波长,检测时基线波动会比较大,不仅影响检测的灵敏度而且增加辨别目标成分的难度[20]。为避免甲醇溶剂带来的不良影响,选择210 nm作为检测波长。
2.1.2 色谱条件优化
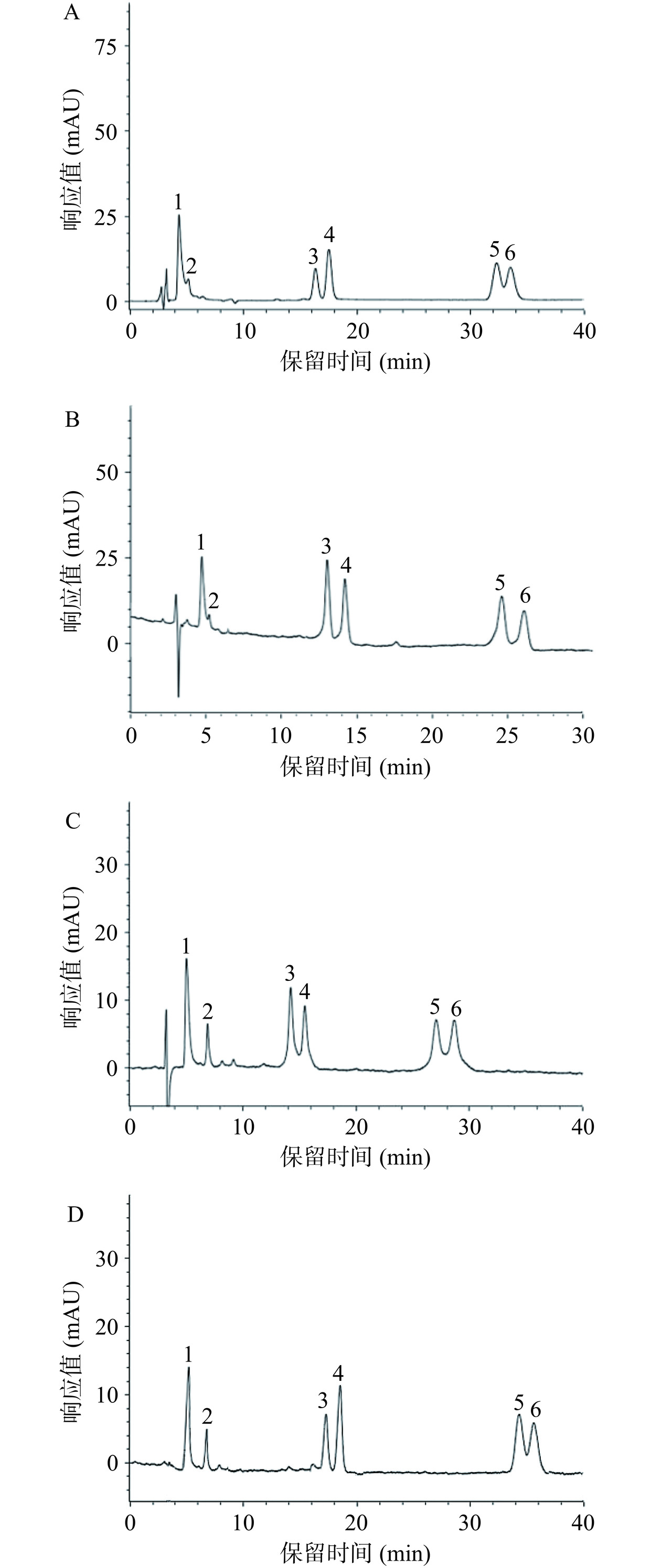
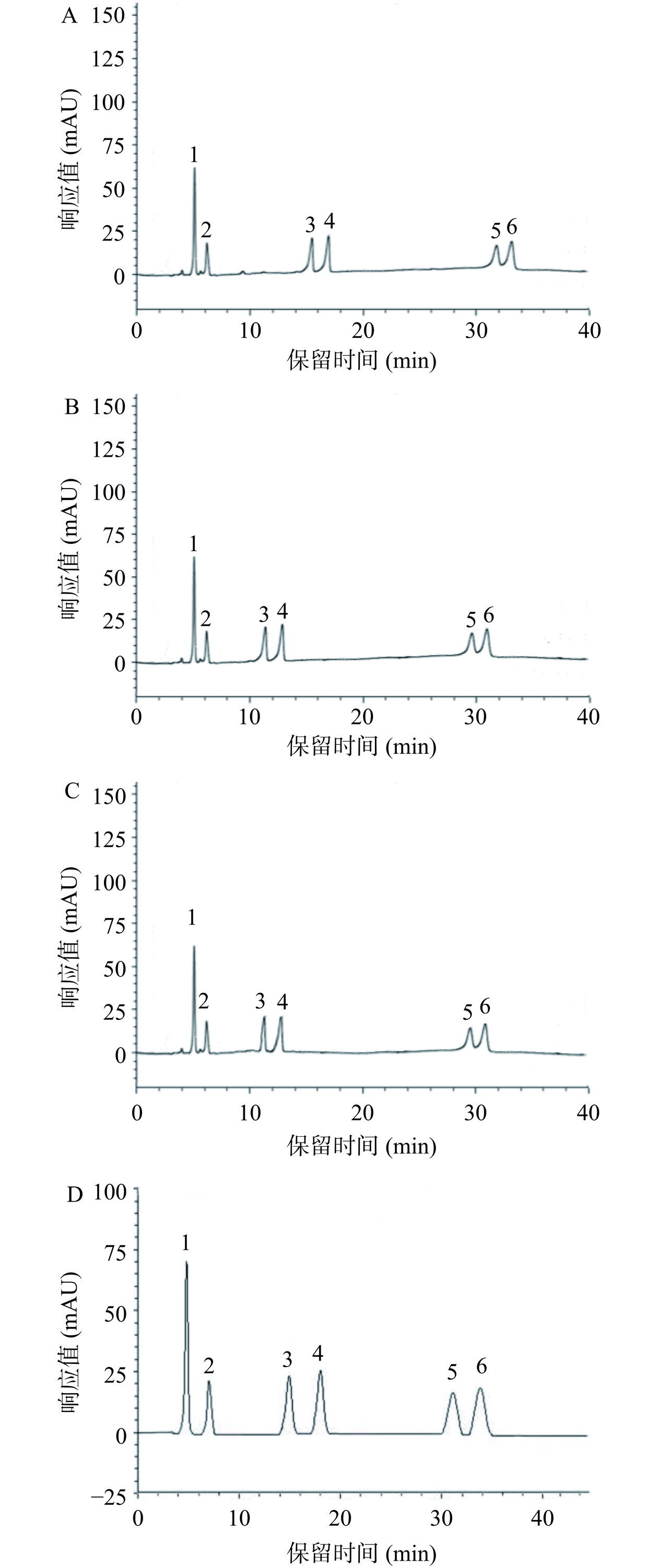
色谱柱对样品成分的分离至关重要[21],通过对4种反相色谱柱(Symmetry C18、ZORBAX SB-C18、BEH C18和Diamonsil C18(2))的测试,结果表明(图2):Diamonsil C18(2)(4.6 mm×250 mm,5 μm)色谱柱在相同检测条件下目标组分呈现较好的峰形,故选择该色谱柱进行后续的优化研究。流动相对HPLC的分离效果有重要影响,常用于三萜酸类成分分析的流动相为甲醇-水溶液或乙腈-水溶液,含有适当浓度的甲酸、三氟乙酸或磷酸的水溶液有助于增大样品的分离度和优化色谱峰峰形[14,22−24],通过分析甲醇、乙腈分别与甲酸水溶液、三氟乙酸水溶液和磷酸水溶液的流动相对6种三萜酸的分离效果,结果显示(图3):当流动相为0.1%三氟乙酸水溶液或磷酸水溶液时,甲醇、乙腈二者对目标组分的分离效果均较差,不仅出现前延峰且齐墩果酸和熊果酸有部分重叠,而当流动相为0.1%甲酸水溶液时,甲醇、乙腈二者均能使齐墩果酸和熊果酸之间的分离度增大,但乙腈的效果稍逊于甲醇,因此采用甲醇-0.1%甲酸水溶液系统进行后续的研究。
准确的定性、定量分析不仅要求目标成分之间达到有效分离,而且要求目标成分与样品中的干扰成分也能达到有效分离。图3D色谱图中的6种三萜酸标准品虽然达到分离,但由于蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸的出峰时间较靠前容易被样品中的酚酸、黄酮等物质干扰。进一步降低流动相中甲醇的浓度,结果表明分析时间虽然从45 min延长至82 min,但是三萜酸与酚酸、黄酮等干扰物质达到基线分离,能更为准确地对三萜酸进行定量分析。因此,选择色谱柱型号为Diamonsil C18(2)(4.6 mm×250 mm,5 μm)、0.1%甲酸水溶液(A)-甲醇(B)为流动相、梯度洗脱时间程序(0~10 min,79%~79%B;10.01~60 min,79%~82%B,60.01~75 min,82%~82%B,75.01~82 min,79%~79%B)、柱温30 ℃,流速0.8 mL/min、进样体积20 μL作为优化后的色谱条件。
2.1.3 色谱图分析
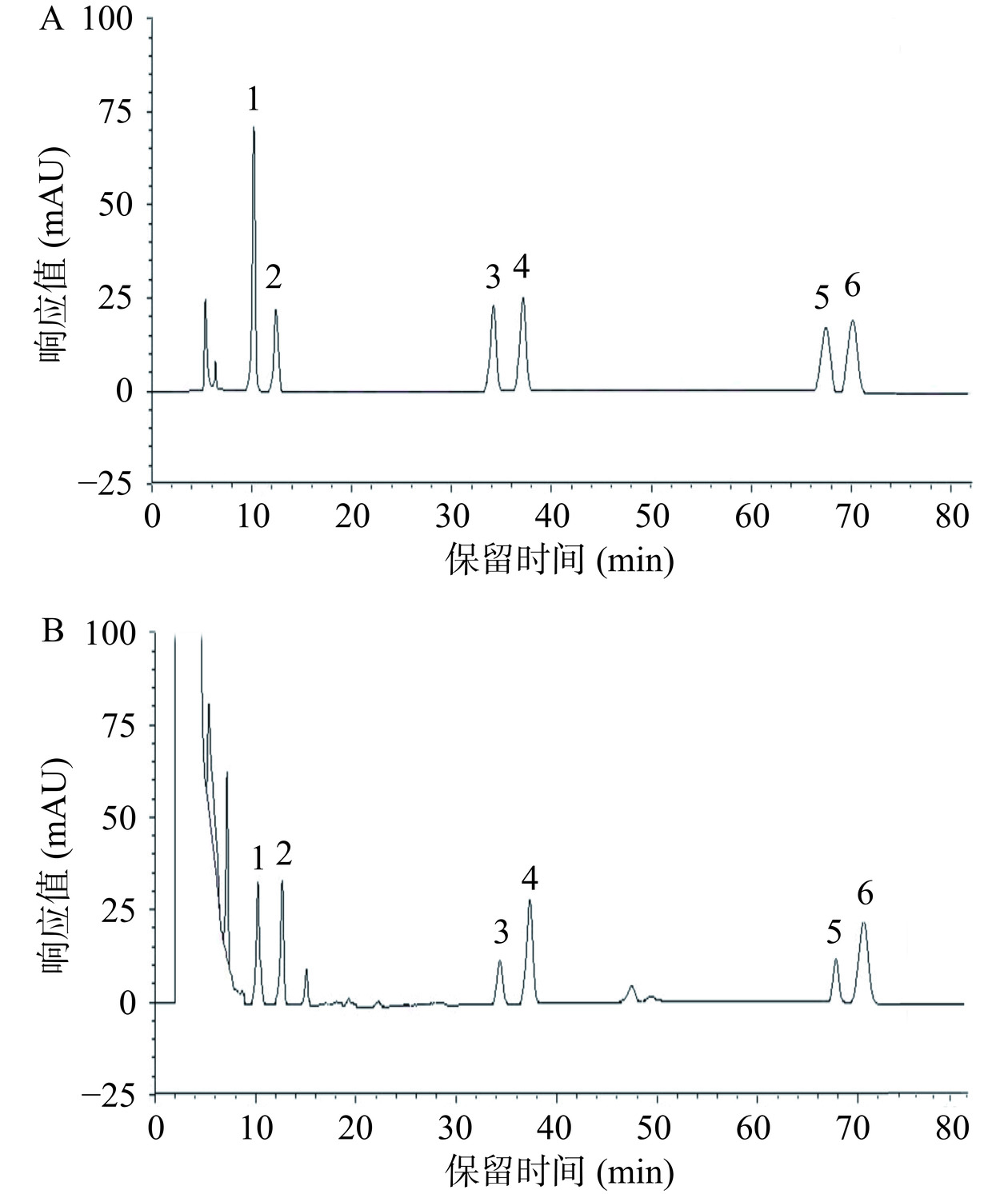
将混合三萜酸对照品溶液和经稀释至合适浓度的6个产地的三萜酸提取物样品采用2.1.2中优化后得到的色谱条件进行HPLC分析,对照品和样品的色谱图分别见图4A和B,6种三萜酸对照品色谱峰的RT分别为:蔷薇酸(10.215 min)、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸(12.414 min)、山楂酸(34.213 min)、科罗索酸(37.177 min)、齐墩果酸(67.504 min)、熊果酸(70.199 min),两两三萜酸色谱峰之间的分离度均大于1.5,峰形较对称,且样品中含量较高的熊果酸色谱峰的理论塔板数大于8000,基线无漂移,表明本HPLC法适用于定性定量分析大果山楂果实中的6种三萜酸类成分。
2.2 方法学考察结果
2.2.1 线性关系、检出限及定量限
从表1中可以看出,6种三萜酸对照品分别在1.53~156.00、2.32~90.54、4.69~500.00、5.00~500.00、5.77~500.00和6.67~1000.00 μg/mL的浓度范围内线性关系良好,相关系数0.9990~0.9999,检出限0.46~2.00 μg/mL,定量限1.53~6.67 μg/mL,表明本方法具有较高的检测灵敏度,能对样品中低浓度的三萜酸进行较为准确的定量分析。
表 1 6种三萜酸对照品的线性范围、线性方程、相关系数、检出限和定量限(n=6)Table 1. Linear range, linear equations, correlation coefficients, LOD and LOQ of six triterpenic acids standards (n=6)三萜酸 线性范围(μg/mL) 线性方程 相关系数 检出限(μg/mL) 定量限(μg/mL) T1 1.53~156.00 y=11173x−8514.8 0.9996 0.46 1.53 T2 2.32~90.54 y=8108.8x−4366.5 0.9997 0.70 2.32 T3 4.69~500.00 y=8662.7x+92708 0.9990 1.41 4.69 T4 5.00~500.00 y=9554.1x+66524 0.9994 1.50 5.00 T5 5.77~500.00 y=9573.2x+3122 0.9999 1.73 5.77 T6 6.67~1000.00 y=8385.2x+108129 0.9995 2.00 6.67 注:T1~T6分别代表蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、科罗索酸、山楂酸、齐墩果酸、熊果酸,表2~表4同。 2.2.2 精密度测定
同一混合样品连续检测6次,6种三萜酸峰面积的RSD值分别为:蔷薇酸0.86%、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸1.17%、山楂酸0.76%、科罗索酸0.70%、齐墩果酸0.85%、熊果酸0.67%,最大的变异系数为1.17%,表明精密度良好,符合检测要求。
2.2.3 稳定性测定
不同浓度三萜酸对照品的日内和日间稳定性测定结果如表2所示,各种三萜酸在日内的RSD值均小于1.59%,日间的RSD值均小于3.85%,表明对照品在放置的6 d内稳定性良好。
表 2 对照品的日内和日间RSD值(n=6)Table 2. RSD of inter-day and intra-day of standards (n=6)三萜酸 日内处理(μg/mL) 日间处理(μg/mL) 30.0 62.5 90.0 250.0 400.0 30.0 62.5 90.0 250.0 400.0 T1 1.02 0.97 0.87 – – 1.80 1.42 1.08 – – T2 1.43 1.59 1.32 – – 3.85 3.53 3.24 – – T3 – 1.29 – 0.88 0.82 – 2.20 – 1.66 1.50 T4 – 0.98 – 0.80 0.80 – 2.51 – 1.57 1.30 T5 – 1.11 – 0.86 0.75 – 2.37 – 2.06 2.16 T6 – 0.83 – 0.80 0.68 – 2.19 – 1.69 1.52 2.2.4 重复性测定
结果显示样品中6种三萜酸的RSD值分别为蔷薇酸1.93%、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸2.29%、山楂酸1.67%、科罗索酸2.30%、齐墩果酸2.70%、熊果酸1.62%,最大的RSD值为2.70%,表明该方法具有良好的重复性,符合分析要求。
2.2.5 加标回收率的测定
本方法大果山楂果实样品6种三萜酸的加标回收率结果见表3,平均加标回收率变化范围在99.2%~101.3%之间,RSD值均小于2.29%,表明该方法具有较好的准确度。
表 3 6种三萜酸的加标回收率(n=3)Table 3. Recovery of six triterpenic acids (n=3)三萜酸 原有量(mg/g) 加入量(mg/g) 测得量(mg/g) 回收率(%) 平均回收率(%) RSD(%) T1 0.1464 0.2196 0.3666 100.2 99.6 1.63 0.1464 0.2951 108.8 0.0732 0.2146 97.7 T2 0.1555 0.2333 0.3888 99.9 100.8 1.42 0.1555 0.3110 102.4 0.0778 0.2330 100.0 T3 0.0654 0.0981 0.1613 98.6 99.2 0.86 0.0654 0.1311 100.2 0.0327 0.0970 98.8 T4 0.0874 0.1311 0.2251 103.0 100.8 2.15 0.0874 0.1760 100.7 0.0437 0.1294 98.7 T5 0.1058 0.1587 0.2621 99.1 100.9 2.29 0.1058 0.2190 103.5 0.0529 0.1589 101.1 T6 0.3906 0.5859 0.9816 100.5 101.3 0.78 0.3906 0.7977 102.1 0.1953 0.5931 101.2 2.3 6个产地大果山楂果实三萜酸的含量
6个产地大果山楂果实中测定的6种三萜酸含量见表4,样品中均检出蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、山楂酸、科罗索酸、齐墩果酸、熊果酸6种三萜酸,均为五环三萜酸化合物,其中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸在大果山楂果实中首次被检出。单因素方差分析表明,不同产地果实总三萜酸以及各三萜酸之间的含量均存在显著差异(P<0.05),不同产地果实中总三萜酸含量在808.74~1090.75 μg/g FM之间,以柳州柳江区和桂林平乐县的果实总三萜含量相对较高,分别达到1090.75 μg/g FM和1045.20 μg/g FM,但二者的总三萜酸含量存在较大差异(P<0.05);除靖西产地的果实外,其余5个产地的果实中三萜酸均以熊果酸(307.83~390.63 μg/g FM)含量最高,其次为2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸(155.53~272.03 μg/g FM)、蔷薇酸(146.58~216.79 μg/g FM),三者含量之和占总三萜酸的72.82%~81.38%,齐墩果酸、科罗索酸、山楂酸含量相对偏低,而靖西产地的果实中三萜酸以蔷薇酸含量最高,达到220.57 μg/g FM,其次为2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸(201.56 μg/g FM)、熊果酸(158.71 μg/g FM),三者含量之和约为总三萜酸的71.82%,齐墩果酸、科罗索酸、山楂酸含量也相对偏低。由此可见,大果山楂果实五环三萜酸含量丰富,并以熊果酸、蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸为主成分,能为大果山楂功能产品的开发提供丰富的物质基础。
表 4 6个不同产地大果山楂果实中三萜酸的组成及含量(n=3)Table 4. Composition and content of triterpenic acids in Malus doumeri fruits from six different producing areas (n=3)编号 含量(μg/g FM) T1 T2 T3 T4 T5 T6 总量 D1 146.58±2.11c 155.53±2.65f 65.43±1.26b 87.35±1.32c 105.83±1.91b 390.63±8.87a 951.35±8.18d D2 159.60±3.70c 164.74±6.40e 42.66±0.82f 53.11±0.89d 108.97±1.51a 366.25±13.3c 900.47±28.50e D3 200.81±3.42b 272.03±1.92a 55.28±1.01d 51.94±1.33d 106.16±0.87b 307.83±7.72d 994.05±41.12c D4 220.57±1.01a 201.56±3.92d 71.00±1.32a 111.36±2.13b 45.54±0.92e 158.71±4.18e 808.74±4.61f D5 216.79±1.98a 260.67±3.09b 48.08±0.59e 43.35±0.90e 103.22±1.38c 373.10±10.5b 1045.20±12.77b D6 200.05±3.12b 213.51±4.09c 57.51±1.19c 135.41±2.75a 99.07±0.36d 385.19±7.39ab 1090.75±17.08a 注:同列不同小写字母表示不同产地果实样品中该种三萜酸有显著差异(P<0.05)。 3. 讨论与结论
本文通过色谱条件的优化,建立了简便、准确的同时测定大果山楂果实中6种三萜酸的HPLC法,该方法与以往大果山楂三萜酸的检测方法[12,17]相比,测定三萜酸种类更多,三萜酸之间分离度好,三萜酸与干扰物质之间得到有效分离,基线平整,准确度、灵敏度、精密度、重复性和稳定性均达到检测分析的要求,可用于大果山楂果实中三萜酸含量的分析。色谱条件为:Diamonsil C18(2)色谱柱(4.6 mm×150 mm,5 μm),以0.1%甲酸水溶液/甲醇(v/v)为流动相,梯度洗脱,柱温30 ℃,流速0.8 mL/min,检测波长210 nm,进样量20 μL。
6个产地的大果山楂果实中三萜酸含量丰富,均检出蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、山楂酸、科罗索酸、齐墩果酸和熊果酸6种三萜酸,均为五环三萜酸,其中蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸在大果山楂果实中首次检出;不同产地果实中总三萜酸及三萜酸之间的含量虽然差异明显,但是三萜酸的主成分均为熊果酸、蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸,主成分含量之和占总三萜酸的71.82%~81.38%,含量较低的三萜酸成分均为齐墩果酸、科罗索酸、山楂酸。含量较低的3种三萜酸与Wen等[12]的研究结果一致,而三萜酸主成分与Wen等[12]报道的果实中三萜酸主成分为熊果酸的研究结果显著不同,本研究发现果实中三萜酸主成分除熊果酸之外,还包括蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸,并且靖西的果实中最主要的三萜酸为蔷薇酸而非熊果酸,造成这一差异的原因为目前缺乏大果山楂果实中三萜酸类化学成分的研究,无法为果实中三萜酸类成分的定性定量研究提供参考,导致以往对大果山楂三萜酸组分的分析不全面,后续将对果实中的三萜酸类化学成分进行系统的分离与结构鉴定,在丰富大果山楂化学成分的同时也为果实中三萜酸的定性定量分析提供科学依据及标准物质。
熊果酸具有抗肿瘤、抗氧化、抗炎等保健功效[25],广泛存在于苹果、梨、枣等水果果实中[26−28];蔷薇酸具有保护血管、抗氧化、抗炎等[29−30]保健功效,在水果中报道较少,仅在梨幼果中被检出且含量极低[31],约为大果山楂果实中蔷薇酸含量的0.05%~0.07%,而孙莉琼等[28]研究表明成熟梨中总三萜酸含量远小于幼果,可知大果山楂果实中蔷薇酸含量远高于成熟梨中蔷薇酸的含量;2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸具有显著延缓二期皮肤癌变和较强的抑制HIV-1蛋白酶活性的功效[32−33],但在水果中尚未见该三萜酸的定性定量分析研究。因此,熊果酸、蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸可作为大果山楂成熟果实的特征成分,在大果山楂后续的功能产品开发及深度加工利用中值得关注。
尽管2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸在大果山楂果实中含量较高,但关于该三萜酸的活性研究较少,仅发现两种功能活性[32−33],功效有待进一步挖掘,后续可对该成分的其它活性进行研究,为大果山楂功能产品的开发提供更多科学参考。另外,三萜酸组成和含量不仅与品种、产地有关,还和果实的成熟度等紧密相关[28,34],对不同成熟度大果山楂果实三萜酸类成分的组成和含量进行连续监测,研究三萜类成分在大果山楂果实生长过程中的变化规律,更有利于对不同产地大果山楂果实的品质进行评估,为大果山楂的适时采摘提供科学参考。本研究结果可为大果山楂果实中三萜酸成分的定性定量分析提供技术支撑,同时能为大果山楂果原料和产品的质量评估及资源的开发利用提供科学依据。
-
表 1 6种三萜酸对照品的线性范围、线性方程、相关系数、检出限和定量限(n=6)
Table 1 Linear range, linear equations, correlation coefficients, LOD and LOQ of six triterpenic acids standards (n=6)
三萜酸 线性范围(μg/mL) 线性方程 相关系数 检出限(μg/mL) 定量限(μg/mL) T1 1.53~156.00 y=11173x−8514.8 0.9996 0.46 1.53 T2 2.32~90.54 y=8108.8x−4366.5 0.9997 0.70 2.32 T3 4.69~500.00 y=8662.7x+92708 0.9990 1.41 4.69 T4 5.00~500.00 y=9554.1x+66524 0.9994 1.50 5.00 T5 5.77~500.00 y=9573.2x+3122 0.9999 1.73 5.77 T6 6.67~1000.00 y=8385.2x+108129 0.9995 2.00 6.67 注:T1~T6分别代表蔷薇酸、2α,19α-二羟基-3-羰基-12-烯-28-乌苏酸、科罗索酸、山楂酸、齐墩果酸、熊果酸,表2~表4同。 表 2 对照品的日内和日间RSD值(n=6)
Table 2 RSD of inter-day and intra-day of standards (n=6)
三萜酸 日内处理(μg/mL) 日间处理(μg/mL) 30.0 62.5 90.0 250.0 400.0 30.0 62.5 90.0 250.0 400.0 T1 1.02 0.97 0.87 – – 1.80 1.42 1.08 – – T2 1.43 1.59 1.32 – – 3.85 3.53 3.24 – – T3 – 1.29 – 0.88 0.82 – 2.20 – 1.66 1.50 T4 – 0.98 – 0.80 0.80 – 2.51 – 1.57 1.30 T5 – 1.11 – 0.86 0.75 – 2.37 – 2.06 2.16 T6 – 0.83 – 0.80 0.68 – 2.19 – 1.69 1.52 表 3 6种三萜酸的加标回收率(n=3)
Table 3 Recovery of six triterpenic acids (n=3)
三萜酸 原有量(mg/g) 加入量(mg/g) 测得量(mg/g) 回收率(%) 平均回收率(%) RSD(%) T1 0.1464 0.2196 0.3666 100.2 99.6 1.63 0.1464 0.2951 108.8 0.0732 0.2146 97.7 T2 0.1555 0.2333 0.3888 99.9 100.8 1.42 0.1555 0.3110 102.4 0.0778 0.2330 100.0 T3 0.0654 0.0981 0.1613 98.6 99.2 0.86 0.0654 0.1311 100.2 0.0327 0.0970 98.8 T4 0.0874 0.1311 0.2251 103.0 100.8 2.15 0.0874 0.1760 100.7 0.0437 0.1294 98.7 T5 0.1058 0.1587 0.2621 99.1 100.9 2.29 0.1058 0.2190 103.5 0.0529 0.1589 101.1 T6 0.3906 0.5859 0.9816 100.5 101.3 0.78 0.3906 0.7977 102.1 0.1953 0.5931 101.2 表 4 6个不同产地大果山楂果实中三萜酸的组成及含量(n=3)
Table 4 Composition and content of triterpenic acids in Malus doumeri fruits from six different producing areas (n=3)
编号 含量(μg/g FM) T1 T2 T3 T4 T5 T6 总量 D1 146.58±2.11c 155.53±2.65f 65.43±1.26b 87.35±1.32c 105.83±1.91b 390.63±8.87a 951.35±8.18d D2 159.60±3.70c 164.74±6.40e 42.66±0.82f 53.11±0.89d 108.97±1.51a 366.25±13.3c 900.47±28.50e D3 200.81±3.42b 272.03±1.92a 55.28±1.01d 51.94±1.33d 106.16±0.87b 307.83±7.72d 994.05±41.12c D4 220.57±1.01a 201.56±3.92d 71.00±1.32a 111.36±2.13b 45.54±0.92e 158.71±4.18e 808.74±4.61f D5 216.79±1.98a 260.67±3.09b 48.08±0.59e 43.35±0.90e 103.22±1.38c 373.10±10.5b 1045.20±12.77b D6 200.05±3.12b 213.51±4.09c 57.51±1.19c 135.41±2.75a 99.07±0.36d 385.19±7.39ab 1090.75±17.08a 注:同列不同小写字母表示不同产地果实样品中该种三萜酸有显著差异(P<0.05)。 -
[1] 曾勇豪, 唐初明, 周云涛. 广西风味小野果涩梨的特点及开发利用价值研究[J]. 林业勘查设计,2014(2):85−88. [ZENG Y H, TANG C M, ZHOU Y T. Study of characteristics and utilization value of Malus doumeri in Guangxi[J]. Forest Investigation Design,2014(2):85−88.] ZENG Y H, TANG C M, ZHOU Y T. Study of characteristics and utilization value of Malus doumeri in Guangxi[J]. Forest Investigation Design, 2014(2): 85−88.
[2] 王雷宏, 杨俊仙, 郑玉红, 等. 台湾林檎(Malus doumeri (Bois.) Chev.)地理分布模拟[J]. 东北林业大学学报,2012,40(9):15−18. [WANG L H, YANG J S, ZHENG Y H, et al. Modeling of geographic distribution of Malus doumeri[J]. Journal of Northeast Forestry University,2012,40(9):15−18.] doi: 10.3969/j.issn.1000-5382.2012.09.004 WANG L H, YANG J S, ZHENG Y H, et al. Modeling of geographic distribution of Malus doumeri[J]. Journal of Northeast Forestry University, 2012, 40(9): 15−18. doi: 10.3969/j.issn.1000-5382.2012.09.004
[3] 黄欣欣. 大果山楂黄酮类物质的提取及其抗氧化性和降血脂功能研究[D]. 南宁:广西大学, 2015. [HANG X X. Study on the anti-oxidant activity and hypolipidemic effect of Malus doumeri (Bois.) Chev. flavonoids extraction[D]. Nanning:Guangxi University, 2015.] HANG X X. Study on the anti-oxidant activity and hypolipidemic effect of Malus doumeri (Bois.) Chev. flavonoids extraction[D]. Nanning: Guangxi University, 2015.
[4] 温玲蓉. 北山楂和大果山楂的活性成分及其抗氧化与抗增殖活性研究[D]. 广州:华南理工大学, 2016. [WEN L R. Study on the bioactive chemical constituents and their antioxidantive and anti-proliferative activities of Crataegus pinnatifida and Malus doumeri fruits[D]. Guangzhou:South China University of Technology, 2016.] WEN L R. Study on the bioactive chemical constituents and their antioxidantive and anti-proliferative activities of Crataegus pinnatifida and Malus doumeri fruits[D]. Guangzhou: South China University of Technology, 2016.
[5] 赵帅, 郝二伟, 杜正彩, 等. 广山楂的化学成分、药理作用与质量控制研究进展[J]. 中成药,2020,42(1):169−175. [ZHAO S, HAO E W, DU Z C, et al. Advance in studies on chemical constituents, pharmacology and quality control of Malus doumeri[J]. Chinese Traditional Patent Medicine,2020,42(1):169−175.] doi: 10.3969/j.issn.1001-1528.2020.01.035 ZHAO S, HAO E W, DU Z C, et al. Advance in studies on chemical constituents, pharmacology and quality control of Malus doumeri[J]. Chinese Traditional Patent Medicine, 2020, 42(1): 169−175. doi: 10.3969/j.issn.1001-1528.2020.01.035
[6] ZHU K, HUANG G B, JING X, et al. Preventive effect of flavonoids from Wushan Shencha (Malus doumeri leaves) on CCl4-induced liver injury[J]. Food Science Nutrition,2019,7(11):3808−3818. doi: 10.1002/fsn3.1243
[7] 黄翠丽, 李军集, 蓝金宣, 等. 靖西大果山楂叶、鲜果及酒中有效成分分析[J]. 广西林业科学,2021,50(1):66−70. [HUANG C L, LI J J, LAN J X, et al. Analysis on effective components of Crataegus jingxienis leaves, fresh fruit and wine[J]. Guangxi Forestry Science,2021,50(1):66−70.] HUANG C L, LI J J, LAN J X, et al. Analysis on effective components of Crataegus jingxienis leaves, fresh fruit and wine[J]. Guangxi Forestry Science, 2021, 50(1): 66−70.
[8] 邓家刚, 韦松基. 广西道地药材[M]. 北京:中国中医药出版社, 2007:24−31. [DENG J G, WEI S J. Authentic medicines of Guangxi[M]. Beijing:China Traditional Chinese Medicine Press, 2007:24−31.] DENG J G, WEI S J. Authentic medicines of Guangxi[M]. Beijing: China Traditional Chinese Medicine Press, 2007: 24−31.
[9] 广西壮族自治区食品药品监督管理局. 广西壮族自治区壮药质量标准(第二卷)[M]. 南宁:广西科学技术出版社, 2011:26−27. [Food and Drug Administration of Guangxi Autonomous Region. Quality standard of Zhuang medicine of Guangxi Autonomous Region Volume 2(2011 Edition)[M]. Nanning:Guangxi Science & Technology Press, 2011:26−27.] Food and Drug Administration of Guangxi Autonomous Region. Quality standard of Zhuang medicine of Guangxi Autonomous Region Volume 2(2011 Edition)[M]. Nanning: Guangxi Science & Technology Press, 2011: 26−27.
[10] 郭婷, 白向丽, 陈益能, 等. 干燥方式对大果山楂粉干燥速率及品质的影响[J]. 食品与机械,2019,35(10):122−125,188. [GUO T, BAI X L, CHEN Y N, et al. Effect of drying treatment methods on the drying rate and quality characteristics of big fruit hawthorn[J]. Food & Machinery,2019,35(10):122−125,188.] GUO T, BAI X L, CHEN Y N, et al. Effect of drying treatment methods on the drying rate and quality characteristics of big fruit hawthorn[J]. Food & Machinery, 2019, 35(10): 122−125,188.
[11] 张巧, 陈春喜, 陈振林, 等. 大果山楂酵素发酵过程中组分及抗氧化性研究[J]. 食品研究与开发,2018,39(22):15−19. [ZHANG Q, CHEN C X, CHEN Z L, et al. Research of compositions and antioxidant activity during natural fermentation of Malus domeri (Bois) Chev. enzyme drink[J]. Food Research and Development,2018,39(22):15−19.] doi: 10.3969/j.issn.1005-6521.2018.22.003 ZHANG Q, CHEN C X, CHEN Z L, et al. Research of compositions and antioxidant activity during natural fermentation of Malus domeri (Bois) Chev. enzyme drink[J]. Food Research and Development, 2018, 39(22): 15−19. doi: 10.3969/j.issn.1005-6521.2018.22.003
[12] WEN L R, ZHENG G Q, YOU L J, et al. Phytochemical profiles and cellular antioxidant activity of Malus doumeri (bois) chevalier on 2, 2′-azobis (2-amidinopropane) dihydrochloride (ABAP)-induced oxidative stress[J]. Journal of Functional Foods,2016,25:242−256. doi: 10.1016/j.jff.2016.06.004
[13] 陈秋虹, 黄岛平, 蒋艳芳. 大果山楂营养成分与功能成分分析及评价[J]. 轻工科技,2016,32(11):3−4. [CHEN Q H, HUANG D P, JIANG Y F. Analysis and evaluation of nutrients and functional components of Malus domeri (Bois) Chev J]. Light Industry Science and Technology,2016,32(11):3−4.
[14] 黄小兰, 何旭峰, 周浓, 等. HPLC法同时测定地参中3种三萜酸的含量[J]. 食品工业科技,2020,41(11):273−278,286. [HUANG X L, HE X F, ZHOU N, et al. Simultaneous determination of three triterpenic acids in Lycopus lucidus Turcz. var. hirtus Regel by high performance liquid chromatography[J]. Science and Technology of Food Industry,2020,41(11):273−278,286.] HUANG X L, HE X F, ZHOU N, et al. Simultaneous determination of three triterpenic acids in Lycopus lucidus Turcz. var. hirtus Regel by high performance liquid chromatography[J]. Science and Technology of Food Industry, 2020, 41(11): 273−278,286.
[15] 彭富全, 陈明权, 何风雷, 等. HPLC同时测定黑老虎药材中2种三萜酸的含量[J]. 中国医药导报,2018,15(22):31−34. [PENG F Q, CHEN M Q, HE F L, et al. Simultaneous determination of two triterpenic acids in root of Kadsura coccinea by HPLC[J]. China Medical Herald,2018,15(22):31−34.] PENG F Q, CHEN M Q, HE F L, et al. Simultaneous determination of two triterpenic acids in root of Kadsura coccinea by HPLC[J]. China Medical Herald, 2018, 15(22): 31−34.
[16] 孙燕, 葛斐林, 薛春苗, 等. 天然产物中五环三萜类化合物检测方法的研究进展[J]. 中国现代中药,2019,21(4):552−558. [SUN Y, GE F L, XUE C M, et al. Advances in determination method of pentacyclic triterpenoids in natural products[J]. Modern Chinese Medicine,2019,21(4):552−558.] SUN Y, GE F L, XUE C M, et al. Advances in determination method of pentacyclic triterpenoids in natural products[J]. Modern Chinese Medicine, 2019, 21(4): 552−558.
[17] 陈秋虹, 黄岛平, 徐慧. 超高效液相色谱测定法测定大果山楂中山楂酸[J]. 轻工科技,2016,32(12):6−7. [CHEN Q H, HUANG D P, XU H. Determination of maslinic acid in Malus domeri (Bois) Chev. by ultra performance liquid chromatography[J]. Light Industry Science and Technology,2016,32(12):6−7.] CHEN Q H, HUANG D P, XU H. Determination of maslinic acid in Malus domeri (Bois) Chev. by ultra performance liquid chromatography[J]. Light Industry Science and Technology, 2016, 32(12): 6−7.
[18] 张爽, 任亚梅, 刘春利, 等. 响应面试验优化苹果渣总三萜超声提取工艺[J]. 食品科学,2015,36(16):44−50. [ZHANG S, REN Y M, LIU C L, et al. Optimization of ultrasonic-assisted extraction of ttotal triterpenoids from apple pomace by response surface methodology[J]. Food Science,2015,36(16):44−50.] doi: 10.7506/spkx1002-6630-201516008 ZHANG S, REN Y M, LIU C L, et al. Optimization of ultrasonic-assisted extraction of ttotal triterpenoids from apple pomace by response surface methodology[J]. Food Science, 2015, 36(16): 44−50. doi: 10.7506/spkx1002-6630-201516008
[19] 陈丹丹, 郭雪峰, 赵蕾, 等. HPLC法同时检测刚竹属竹叶中4种黄酮碳苷的含量[J]. 林产化学与工业,2019,39(5):108−114. [CHEN D D, GUO X F, ZHAO L, et al. Stimultaneous determination of four flavone C-glycosides in bamboo leaves of Phyllostachys by HPLC[J]. Chemistry and Industry of Forest Products,2019,39(5):108−114.] doi: 10.3969/j.issn.0253-2417.2019.05.015 CHEN D D, GUO X F, ZHAO L, et al. Stimultaneous determination of four flavone C-glycosides in bamboo leaves of Phyllostachys by HPLC[J]. Chemistry and Industry of Forest Products, 2019, 39(5): 108−114. doi: 10.3969/j.issn.0253-2417.2019.05.015
[20] 刘康其, 马聿济, 华国瑛. 高纯甲醇用作反相高效液相色谱移动相[J]. 化学世界,1984(12):15−17. [LIU K Q, MA J Q, HUA G Y. High purity methanol as a mobile phase in reversed phase high performance liquid chromatography[J]. Chemical World,1984(12):15−17.] LIU K Q, MA J Q, HUA G Y. High purity methanol as a mobile phase in reversed phase high performance liquid chromatography[J]. Chemical World, 1984(12): 15−17.
[21] 孙博, 霍华珍, 蔡爱华, 等. HPLC法测定大果山楂果实中八种酚酸类成分的含量[J]. 广西植物,2021,41(7):1135−1144. [SUN B, HUO H Z, CAI A H, et al. Determination of content of 8 phenolic acids in Malus doumeri fruit by HPLC[J]. Guihaia,2021,41(7):1135−1144.] doi: 10.11931/guihaia.gxzw202003034 SUN B, HUO H Z, CAI A H, et al. Determination of content of 8 phenolic acids in Malus doumeri fruit by HPLC[J]. Guihaia, 2021, 41(7): 1135−1144. doi: 10.11931/guihaia.gxzw202003034
[22] 杨鹏飞, 李保明, 王振中, 等. HPLC法同时测定桂枝茯苓胶囊中4种茯苓三萜酸成分[J]. 中草药,2016,47(18):3215−3218. [YANG P F, LI B M, WANG Z Z, et al. Determination of four triterpenoid acids from Guizhi Fuling capsules by HPLC[J]. Chinese Traditional and Herbal Drugs,2016,47(18):3215−3218.] doi: 10.7501/j.issn.0253-2670.2016.18.013 YANG P F, LI B M, WANG Z Z, et al. Determination of four triterpenoid acids from Guizhi Fuling capsules by HPLC[J]. Chinese Traditional and Herbal Drugs, 2016, 47(18): 3215−3218. doi: 10.7501/j.issn.0253-2670.2016.18.013
[23] 刘宗洋, 赵文文, 武婧悦, 等. HPLC-ELSD测定壮药山绿茶中3对三萜同分异构体含量[J]. 中国中药杂志,2018,43(8):1662−1666. [LIU Z Y, ZHAO W W, WU J Y, et al. Determination of three pair of triterpenoid isomers in leaf of Ilex hainanensis by HPLC-ELSD[J]. China Journal of Chinese Materia Medica,2018,43(8):1662−1666.] LIU Z Y, ZHAO W W, WU J Y, et al. Determination of three pair of triterpenoid isomers in leaf of Ilex hainanensis by HPLC-ELSD[J]. China Journal of Chinese Materia Medica, 2018, 43(8): 1662−1666.
[24] 罗小凤, 邹盛勤. 南北山楂中5个三萜酸成分的比较研究[J]. 食品科技,2015,40(5):64−67. [LUO X, ZOU S Q. Comparative studies on content of five triterpenic acids in Crataegi cuneatae and Crataegus pinnatifida[J]. Food Science and Technology,2015,40(5):64−67.] LUO X, ZOU S Q. Comparative studies on content of five triterpenic acids in Crataegi cuneatae and Crataegus pinnatifida[J]. Food Science and Technology, 2015, 40(5): 64−67.
[25] 田春风, 郭宇帆, 商佳琪, 等. 熊果酸的生物活性研究进展[J]. 中国食品卫生杂志,2022,34(6):1361−1365. [TIAN C F, GUO Y F, SHANG J Q, et al. Research progress on biological activity of ursolic acid[J]. Chinese Journal of Food Hygiene,2022,34(6):1361−1365.] TIAN C F, GUO Y F, SHANG J Q, et al. Research progress on biological activity of ursolic acid[J]. Chinese Journal of Food Hygiene, 2022, 34(6): 1361−1365.
[26] 王向红, 崔同, 齐小菊, 等. HPLC法测定不同品种枣及酸枣中的齐墩果酸和熊果酸[J]. 食品科学,2002(6):137−138. [WANG X H, CUI T, QI X J, et al. Determination of ursolic scid and oleanolic acid in jujuba and wild jujuba by HPLC[J]. Food Science,2002(6):137−138.] doi: 10.3321/j.issn:1002-6630.2002.06.038 WANG X H, CUI T, QI X J, et al. Determination of ursolic scid and oleanolic acid in jujuba and wild jujuba by HPLC[J]. Food Science, 2002(6): 137−138. doi: 10.3321/j.issn:1002-6630.2002.06.038
[27] BUTKEVIČIŪTĖ A, LIAUDANSKAS M, KVIKLYS D, et al. Qualitative and quantitative composition of triterpenic compounds in the fruit of apple old cultivars grown in Lithuania[J]. Zemdirbyste-Agriculture,2021,108(1):63−70. doi: 10.13080/z-a.2021.108.009
[28] 孙莉琼, 郝雯菁, 唐晓清, 等. UPLC-MS/MS研究36个梨品种成熟果实中的特征性多酚和三萜酸类物质[J]. 食品科学,2020,41(22):206−214. [SUN L Q, HAO W J, TANG X Q, et al. Analysis of characteristic polyphenols and triterpenic acids in ripe pears of 36 cultivars by UPLC-MS/MS[J]. Food Science,2020,41(22):206−214.] doi: 10.7506/spkx1002-6630-20200423-301 SUN L Q, HAO W J, TANG X Q, et al. Analysis of characteristic polyphenols and triterpenic acids in ripe pears of 36 cultivars by UPLC-MS/MS[J]. Food Science, 2020, 41(22): 206−214. doi: 10.7506/spkx1002-6630-20200423-301
[29] JEONG N L, LEE S, CHOI Y A, et al. Inhibitory effects of euscaphic acid in the atopic dermatitis model by reducing skin inflammation and intense pruritus[J]. Inflammation,2022,45(4):1680−1691. doi: 10.1007/s10753-022-01652-x
[30] SHI C F, LI Z C, WU Y Q, et al. Euscaphic acid and tormentic acid protect vascular endothelial cells against hypoxia-induced apoptosis via PI3K/AKT or ERK1/2 signaling pathway[J]. Life Sciences,2020,252(C):117666.
[31] SUN L Q, TAO S T, ZHANG S L. Characterization and quantification of polyphenols and triterpenoids in thinned young fruits of ten pear varieties by UPLC-Q TRAP-MS/MS[J]. Molecules,2019,24(1):159−179. doi: 10.3390/molecules24010159
[32] SHOKO T, YOKO I, ERI K, et al. Production of bioactive triterpenes by Eriobotrya japonica calli[J]. Phytochemistry,2002,59:315−323. doi: 10.1016/S0031-9422(01)00455-1
[33] XU H X, ZENG F Q, WAN M, et al. Anti-HIV triterpene acids from Geum japonicum[J]. Journal of Natural Products,1996,59(7):643−645. doi: 10.1021/np960165e
[34] DOMINGUES R M A, GUERRA A R, DUARTE M, et al. Bioactive triterpenic acids from agroforestry biomass residues to promising therapeutic tools[J]. Mini-Reviews in Organic Chemistry,2014,11:382−399. doi: 10.2174/1570193X113106660001





 下载:
下载:
 下载:
下载:



