Research Progress on the Effects of Processing Conditions on the Meat Protein Oxidation and Meat Quality
-
摘要: 肉类是人类日常饮食中的重要组成部分,其品质对于消费者的健康和口感体验至关重要。动物在被宰杀后的胴体向食用肉转变和肉品加工过程中,经历复杂的生化反应,其中蛋白质氧化对肉类品质的形成具有重要影响。本文主要针对蛋白质氧化对肉类品质的影响,结合蛋白质氧化产物的类型,加工方式、条件等影响因素,总结了目前加工条件下蛋白质氧化与肉品质变化的关系,旨在为控制肉品蛋白质的氧化提供理论依据,并为实际生产提供科学指导。Abstract: Meat is an important part of the daily human diet, and its quality is essential for consumers' health and taste experience. During the transformation from carcass to meat and meat processing after animal slaughter, many complex biochemical reactions occur, among which protein oxidation plays an important role in the formation of meat quality. Based on the influence of protein oxidation on meat quality, the relationship between protein oxidation and changes in meat quality under factors such as the types of protein oxidation products, processing methods and conditions is summarized in this review, which will provide a theoretical basis for reducing the oxidation of meat protein, and a scientific guidance for practical production.
-
Keywords:
- protein oxidation /
- processing condition /
- meat quality /
- sensory quality /
- flavour
-
肉类是人类饮食中的重要组成部分,提供丰富的蛋白质、脂肪、维生素和矿物质。肉类的外观(色泽、纹理、形状)、气味(清新、腐败、酸味)和质地(水分含量、嫩度)三个指标是评估肉品质量好坏的直观特征。肉制品在加工的过程中,由于其组成成分的特性以及各种外界因素的影响,常发生蛋白质氧化及脂质氧化等[1]。蛋白质作为肉类产品中重要的营养成分,其氧化程度影响着肉制品的感官风味和营养价值[2]。本文综述了蛋白质氧化机制以及常见的氧化产物类型,并分析了加工条件下的蛋白质氧化对肉品感官、营养功能等的影响,以期控制肉品蛋白的氧化,为肉制品加工提供科学指导。
1. 蛋白质的氧化机制和氧化产物类型
1.1 蛋白质氧化的机制
蛋白质氧化是经活性自由基的直接反应或与氧化应激的次级副产物的间接反应而诱导的蛋白质共价修饰[3]。超氧阴离子自由基(·O2−)、羟基自由基(·OH)和过氧化氢(H2O2)等氧活性自由基作为蛋白质氧化的主要起始因子,参与链式反应,引发蛋白质自由基发生转移和重排反应,导致蛋白质折叠、聚集或破裂进而引发生物学效应[4]。
活性自由基攻击蛋白质的形式主要有三种,分别是侧链残基被修饰、肽主链的断裂、蛋白质间的交联与聚合。其中,蛋白质侧链残基的氧化结果包括芳香基团和脂肪族氨基酸侧链的羟基化和硝化、巯基的亚硝化、甲硫氨酸残基的磺基氧化、芳香基团和伯氨基的氯化,以及一些氨基酸残基转化为羰基衍生物[5]。肽主链的断裂则表现为蛋白质或肽链中的主要结构骨架出现断裂或切割,从而失去功能性和稳定性。而蛋白质分子发生交联与聚合相对速率的不同,也可能会表现出不同的功能性[6]。总之,蛋白质氧化的影响取决于氧化修饰的程度、位置和类型,以及细胞内氧化还原平衡的状态。
1.2 蛋白质氧化产物类型
在肉制品中,蛋白质的氧化是一个多因素影响的复杂过程,形成的蛋白质氧化产物也较多,无法用单一的方式测定蛋白质的氧化程度。了解蛋白质氧化产物的类型,有助于更加全面、准确评估肉品的蛋白质氧化水平。
1.2.1 羰基复合物
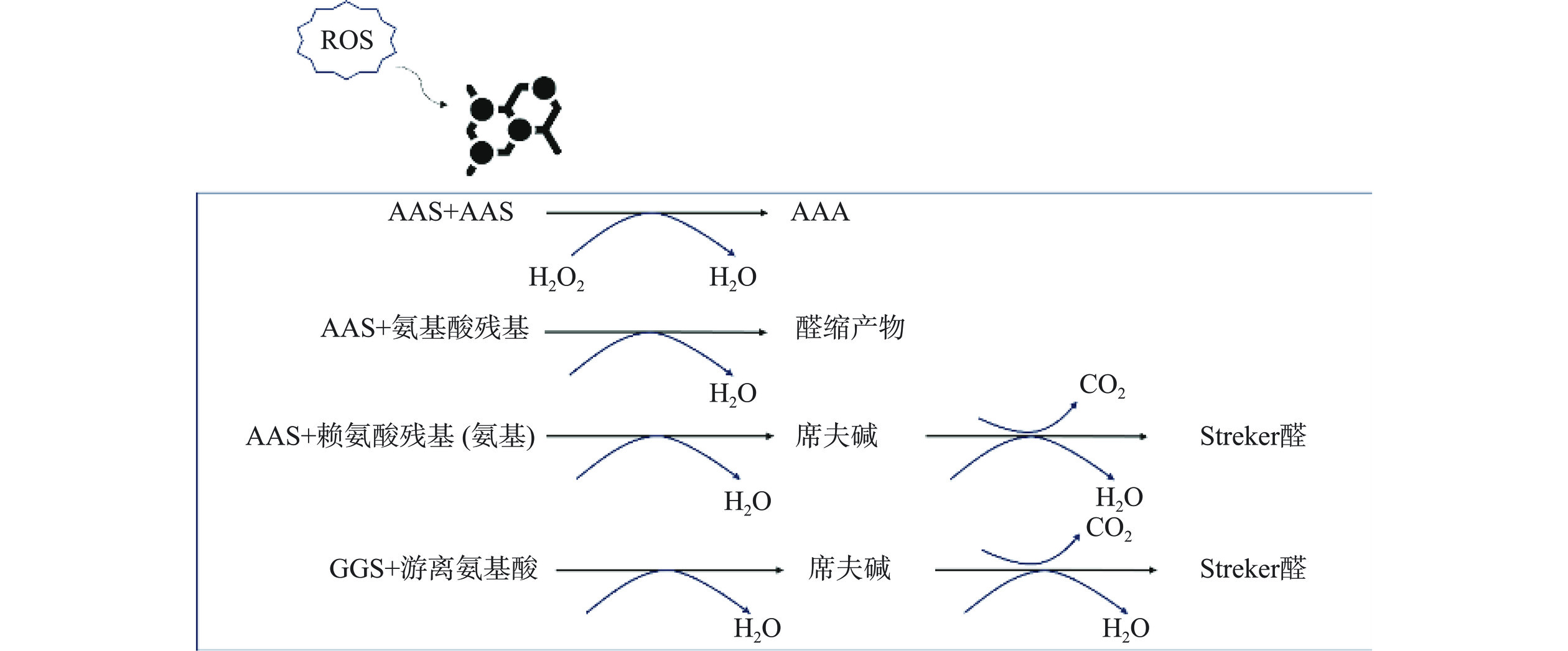
蛋白质羰基化是指活性物质攻击蛋白质中的氨基酸残基(赖氨酸、组氨酸和亮氨酸等),形成不可逆的羰基化修饰的产物。通常,蛋白质被活性氧、脂质衍生物、还原糖等活性物质氧化攻击后,形成醛、酮、内酰胺等羰基基团复合物,是蛋白质氧化中典型的化学修饰,因此可作为测定蛋白质氧化的指标[7]。典型的羰基化合物α-氨基己二酸半醛(α-aminoadipate semialdehyde,AAS)和γ-谷氨酸半醛(γ-glutamic semialdehyde,GGS)是活性化合物,它们在Streker降解反应中生成的醛类是重要的风味物质,会改变肉(如干腌产品)的气味[8](图1)。此外,由于蛋白质残基上的羰基可以与另一个氨基酸上的氨基缩合生成席夫碱,根据席夫碱的荧光强度可以判断蛋白质氧化程度,但脂质氧化产生的醛也可以与氨基酸残基的侧链反应生成席夫碱,这种产物缺乏特异性,只能作为辅助指标[9]。
1.2.2 巯基氧化产物
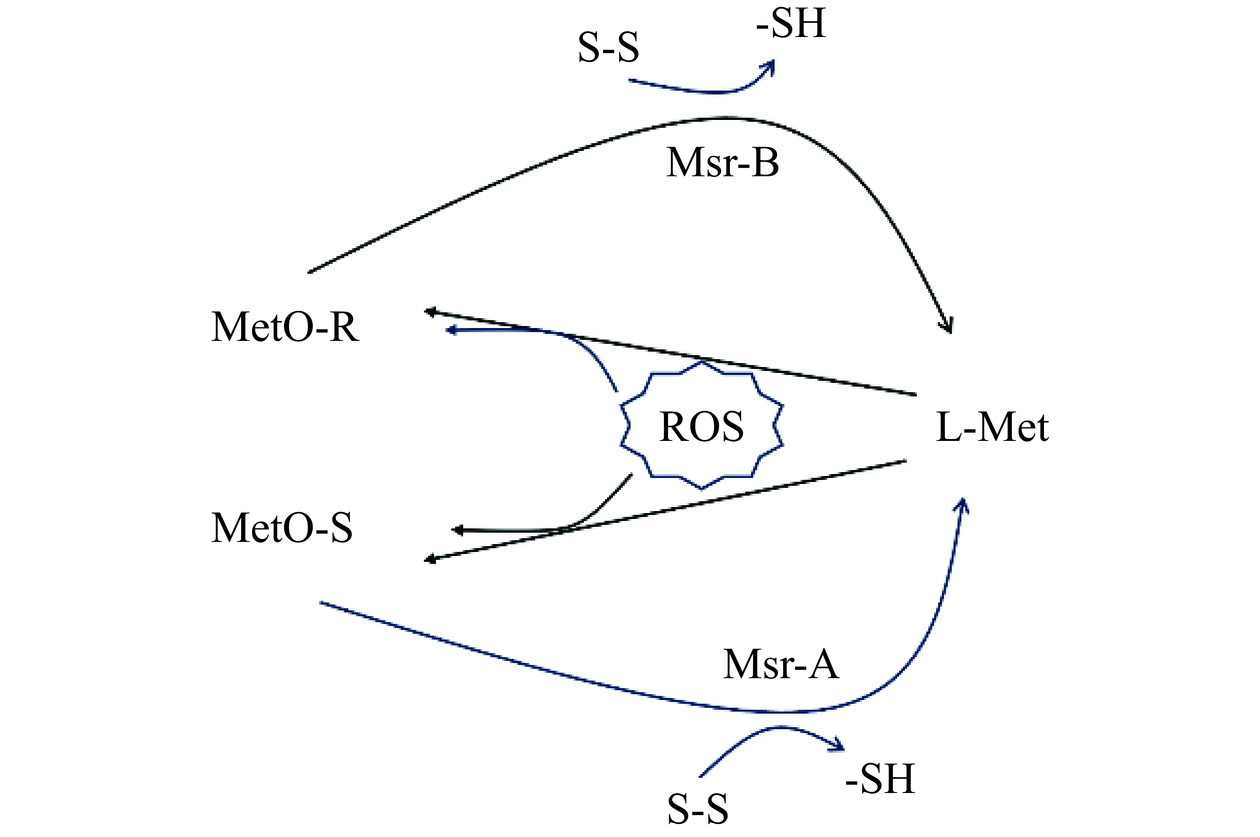
含硫氨基酸氧化性不稳定,其结构中的巯基(-SH)易被氧化剂氧化脱去自身的H+,与其他基团或分子重新键桥配对形成二硫键(S-S)(图2)。典型的含硫氨基酸有蛋氨酸、半胱氨酸等,它们的巯基基团对活性氧有高度的反应敏感性,容易发生氧化[10]。干腌火腿中的蛋氨酸表现出较高的氧化倾向[11],通过操控蛋白质折叠稳定性来改变蛋氨酸氧化速率,可以调控蛋白质氧化反应;另外,蛋氨酸氧化速率还可作为热力学折叠稳定性的直观指标[12]。巯基氧化产物通过形成特定基团改变蛋白质功能特性,如含硫氨基酸残基与亚硝酸形成的亚硝基团(R-N=O)对蛋白质活性、蛋白质表达,亚细胞定位及分子间相互作用产生影响,进而能调控蛋白质功能[13]。而通过单电子和双电子氧化反应形成的巯基自由基和亚磺酸可诱导蛋白质聚集或降解来破坏蛋白质功能,并参与过氧化物等酶的催化机制来影响蛋白质信号通路的氧化还原调节[14]。
![]() 图 2 以L-蛋氨酸为例的含硫氨基酸的氧化还原反应过程注:ROS:活性氧,reactive oxygen species;L-Met:L-蛋氨酸,L-methionine;MetO-S:S-蛋氨酸亚砜,S-epimers of methionine sulfoxide;MetO-R:R-蛋氨酸亚砜,R-epimers of methionine sulfoxide;Msr-A:S-蛋氨酸亚砜还原酶,S-methionine sulfoxide reductases;Msr-B:R-蛋氨酸亚砜还原酶,R-methionine sulfoxide reductases;S-S:二硫键,disulfide bond;-SH:巯基,sulfhydryl。Figure 2. REDOX reaction of sulfur-containing amino acids with L-methionine as an example
图 2 以L-蛋氨酸为例的含硫氨基酸的氧化还原反应过程注:ROS:活性氧,reactive oxygen species;L-Met:L-蛋氨酸,L-methionine;MetO-S:S-蛋氨酸亚砜,S-epimers of methionine sulfoxide;MetO-R:R-蛋氨酸亚砜,R-epimers of methionine sulfoxide;Msr-A:S-蛋氨酸亚砜还原酶,S-methionine sulfoxide reductases;Msr-B:R-蛋氨酸亚砜还原酶,R-methionine sulfoxide reductases;S-S:二硫键,disulfide bond;-SH:巯基,sulfhydryl。Figure 2. REDOX reaction of sulfur-containing amino acids with L-methionine as an example1.2.3 交联氧化产物
交联反应是指蛋白质分子之间的氨基酸残基之间发生共价结合,是蛋白质发生氧化的主要形式之一,1O2和ROO等氧化剂诱导蛋白质分子间和分子内交联。蛋白质在氧化过程中二级结构被破坏,色氨酸和酪氨酸等疏水基团易暴露在外,并且通过二硫键形式形成蛋白质交联,Jiang等[15]发现适度氧化下的蛋白质发生解折叠和交联可以使牛肉肌原纤维蛋白凝胶持水性增加,而过度氧化会减少凝胶持水能力。肌球蛋白重链(myosin heavy chains,MyHC)的二硫键在肌球蛋白交联中起重要作用[16],而高氧环境下蛋白质氧化的羰基化产物AAS可能会与赖氨酸残基交联形成赖氨酸正亮氨酸(lysinonorleucine,LNL),是除二硫键之外的另一种蛋白质交联形式,蛋白质交联的增加会导致肉类品质恶化[9]。Morzel等[17]通过SDS-PAGE模式发现肌球蛋白是对氧化极其敏感的蛋白,氧化后的肌球蛋白重链和轻链的含量减少,而二酪氨酸的含量急剧增加,二酪氨酸可能是干预肌球蛋白聚合的主要方式之一。
1.3 蛋白质氧化产物间的联系与区别
羰基复合物除了可以作为蛋白质氧化标记物之外,有些羰基化产物可能并非最终产物而继续参与生物化学反应,形成新的产物,进而影响肉品质量。含硫氨基酸和其他氨基酸残基氧化反应的区别则在于其氧化还原是可逆过程,可逆循环系统是重要的抗氧化防御机制,有助于调节和维持蛋白质的功能特性[5]。如蛋氨酸氧化会形成R-和S-蛋氨酸亚砜的立体异构体(亚砜是含硫酰基S=O),而蛋氨酸亚砜还原酶可将这两种异构体还原回蛋氨酸残基[18]。易羰基化基团和对活性氧高度敏感的含硫氨基酸都可看作内源性抗氧化剂,蛋白质表面的特定氨基酸残基的氧化牺牲可以保护其他氨基酸免受氧化。醛类羰基氧化产物是肉品风味物质的重要来源,而硫化产物也可能使肉品产生异味。相对于前两种蛋白质氧化产物,交联化产物广泛发生于蛋白质分子内和分子间。根据氧化程度不同,蛋白质交联形成的凝胶网络空隙大小和分布会影响其折叠状态、稳定性、生物活性等。
2. 不同加工条件对蛋白质氧化和肉品质的影响
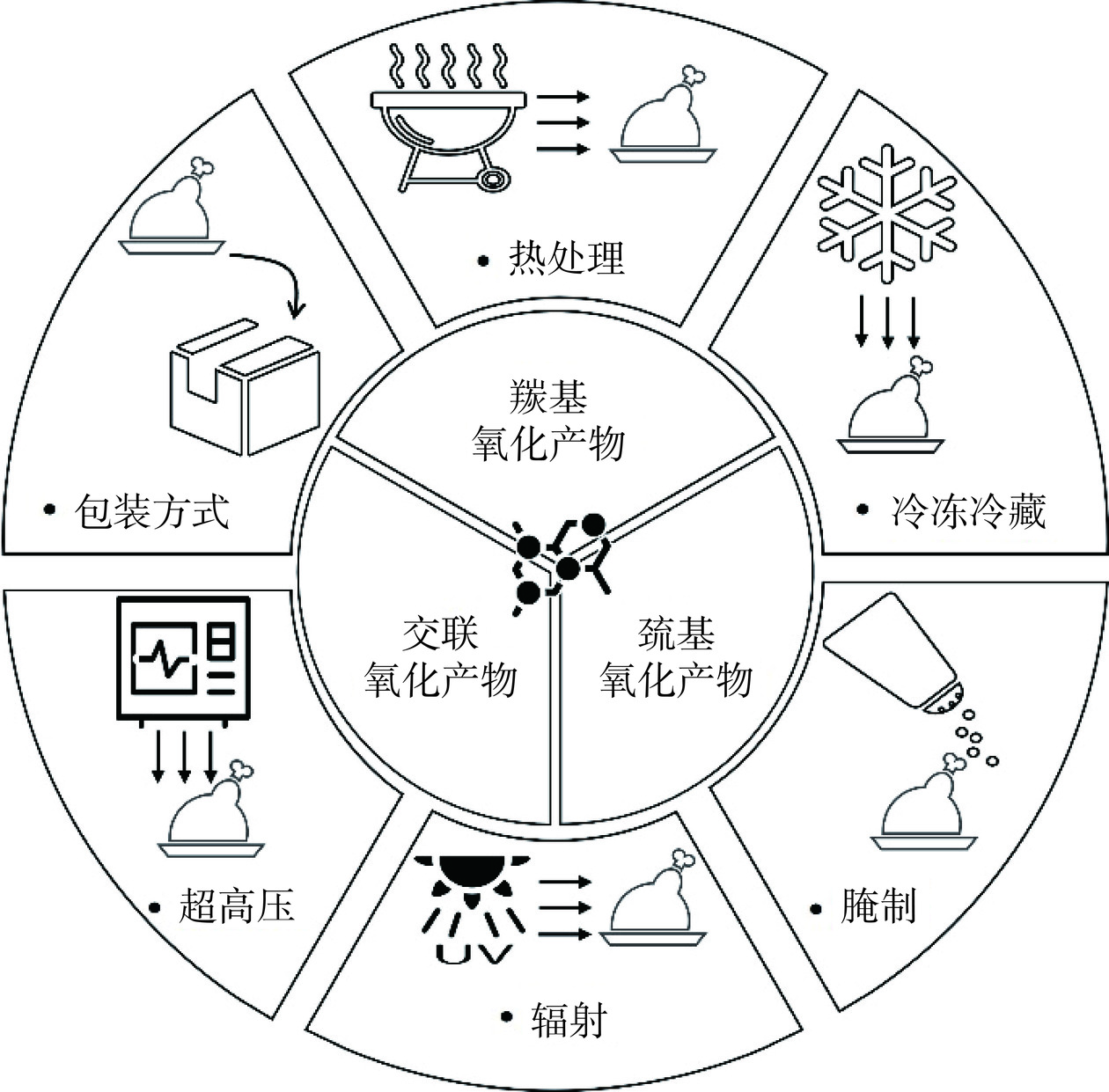
目前,肉品加工是肉类生产重要的环节要素,传统的肉类加工方法(烹饪、腌制、冷冻)以及新工艺技术(超高压、脉冲电场和包装系统)都会影响蛋白质的氧化进程。蛋白质氧化会引起蛋白质分子基团的化学修饰和结构变化,分子结构变化诱导蛋白质构象和功能改变,进而对肉质产生影响[3]。肉的功能品质(色泽、嫩度、凝胶性、风味)以及营养品质(消化率、必需氨基酸)都会受到蛋白质氧化的影响[1]。因此,本文重点综述了热处理、冷冻冷藏、腌制、辐射、超高压以及包装方式等加工条件对蛋白质氧化和肉品质的影响(图3和表1)。
表 1 部分加工对蛋白质氧化及肉品质的影响Table 1. Effect of processing on protein oxidation and meat quality加工方式 蛋白质氧化表征 肉品质指标 参考文献 热处理 游离硫醇减少 消化率和生物利用度下降 韦婕妤[22],Chen等[26] 热处理 AAS、GGS增加,LNL交联 韧性增加,持水性降低 Shen等[9],Wang等[25] 冷冻冷藏 肌红蛋白构象变化减少 氧化稳定性提高 李慧芝等[29],Jiang等[31] 腌制 疏水性提高 凝胶保水性提高 Zhang等[35],Zhou等[41] 辐照 肌原纤维降解 嫩度提高 Zhang等[44],Rodrigues等[46] 超高压 疏水性增加,羰基、巯基增多,氧合肌红蛋白
氧化还原速率加快保水性下降,色泽劣变或趋于稳定 李冬冬[48],Zeng等[49],陈腊梅等[50] MAP(相比于VP) AAS、LNL含量增加 蒸煮损失增加,嫩度下降 Shen等[9],扶庆权等[55] 2.1 热处理下的蛋白质氧化及肉品质变化
热处理是指蒸煮、烘烤、煎炸、微波等这一类加工过程,尤其是油炸过程,温度很高,造成的蛋白质氧化更严重,甚至产生苯并芘、杂环芳香胺(氨基咪唑氮杂芳烃类和氨基咔琳类)、晚期糖基化终末产物(advanced glycation end-products,AGEs)等有害物[19−20]。加热处理对肉类蛋白质的氧化影响尤为明显,烘烤条件下肌原纤维蛋白的羰基和席夫碱含量随加热时长增多而上升,且通过共价键或非共价键方式连接形成聚集体[21]。韦婕妤[22]用煎炸、油炸、微波、蒸制和煮制等5种不同烹饪方式对羊肉进行加工,羊肉蛋白的羰基含量均随肉样温度升高而增多、游离硫醇含量降低。此外,较高的蒸煮温度诱导AAS和LNL发生高级缩合反应形成非二硫交联[9]。在热处理加工肉制品时,温度、时间以及传热介质和传热类型等因素可能促发潜在毒性蛋白氧化产物(杂环胺、多环芳烃等)的生成[23]。
烹饪过程中肉品的感官和风味发生一系列变化,醛酮类、呋喃类、鲜甜味氨基酸等风味物质依赖于热处理加工,高温环境下(48 ℃和56 ℃)美拉德反应和脂质氧化会共同促进肉品风味的形成,较低温度的热处理(40 ℃)则通过蛋白质降解和脂质氧化途径提高醛类和游离氨基酸物质来获得最佳风味[24]。肉制品在烹饪过程中蛋白质发生的氧化交联会造成肌肉收缩等变化,改变水分分布和迁移,进而影响肉质的嫩度[25]。温和的热处理对蛋白质的消化率呈积极影响,而剧烈的烹饪会引起蛋白质热聚集,使其结构不易被消化酶识别和降解,导致消化率和生物利用度的降低,严重影响肉品的营养价值[26]。用红外、微波较水浴处理鸭肉,其氧化水平更低(α螺旋含量较高、β折叠含量较低),说明蛋白质未发生明显解折叠并保持结构的稳定性,用红外和微波加热肉样可以更好保持蛋白质的二级结构,有助于酶的识别和水解,提高消化率,且蛋白质二级结构和氧化产物影响着肉品的硬度、弹性和色泽[27]。综上,适当的热处理可以改善肉品的风味、质地和营养价值,但过度加热可能会导致氧化产物的生成和营养流失。
2.2 低温贮藏对肉类蛋白质氧化和品质的影响
低温冷藏/冷冻肉品是指将肉类食品在较低的温度下储存或冷冻,以延长其保质期、保持品质,并减缓微生物繁殖和食品变质的过程。在这种特定环境条件下,蛋白质可能会遭受氧化损伤,温度、冷冻速率、贮藏时间以及解冻方式是影响其氧化程度和肉品质量不可忽视的因素。经受氧化损伤的MyHC展开,暴露在外的赖氨酸、甘氨酸或异亮氨酸等具有高度化学活性的氨基酸残基会促进AGEs的形成,其中,典型的AGEs产物有羧甲基赖氨酸(Nε-carboxymethyl lysine,CML)和羧乙基赖氨酸(Nε-carboxyethyl lysine,CEL),这些羰基复合物含量随着冷冻时间延长而升高,且巯基可能由于与ROS反应形成磺酸、二硫键及其他氧化产物而减少[28]。此外,反复冻融肉品会加速蛋白质氧化程度,伴随蛋白质的标志性氧化产物的增加,如羰基化合物、GGS、席夫碱、AAS及AAS二次氧化分解产生的AAA;巯基基团减少[29]。而冷冻形成的冰晶破坏肌肉组织结构、浓缩细胞溶质和改变离子强度等,会改变肌肉食品的理化性质,造成肉品质量恶化[30]。
冷藏和超冷藏期间,肉品会同时发生肌红蛋白、脂质和蛋白质的氧化,其中,肌红蛋白、脂肪和蛋白质的氧化相互耦合、相互促进;超冷处理温度可以在一定程度上有效地保护肌红蛋白不发生构象变化,减缓高铁肌红蛋白的积累、脂肪氧化和肉品的变色[31]。为了缓解冷冻/解冻过程中肌肉食品的色泽恶化、保水力减弱、嫩度下降等特征,抑制蛋白质氧化和水解等机制,运用高压、超声和电磁等物理加工辅助冷冻技术是有效措施[32]。总体而言,低温处理可以减缓蛋白质氧化产物的生成,保持肉品的风味、质地和色泽,延长保鲜期,但在低温处理过程中,仍然需要注意一些质量问题,如冻结和解冻带来的影响。
2.3 腌制加工与蛋白质氧化及肉品质的关系
亚硝酸盐会促进Fe3+/Fe2+循环,影响Fenton反应产生活性氮和活性氧,从而加剧蛋白质的氧化和亚硝化反应,促使羰基含量增加、硫醇含量减少,同时,酪氨酸被氧化成二酪氨酸、色氨酸含量减少[33]。不同盐浓度均能加剧蛋白质氧化,提高羰基水平,且促进了CML、CEL形成,而较高的盐含量可能导致席夫碱降解物不稳定并发生可逆反应,产生Amadori重排产物[34]。超过3%的盐含量会增加猪肌原纤维蛋白(myofibrillar proteins,MPs)对ROS的敏感性,一定浓度(5%左右)的盐含量对调控MPs的氧化、构象变化、聚集和热稳定性起着关键作用[35]。火腿在烟熏干腌过程中,蛋白质水解和蛋白质氧化之间相互关联相互促进,而不同部位肌肉蛋白质水解活性有差异[36]。亚硝酸盐促进酪氨酸氧化后的亚硝化修饰产物—3-硝基酪氨酸(3-nitrotyrosine,3-NT),可作为生肉和熟肉制品中蛋白质氧化的潜在标志物[37]。
干腌火腿在贮藏期间蛋白质氧化水解,精氨酸、赖氨酸等游离氨基酸组成和含量发生显著变化,其硬度、胶性和咀嚼性会提高,弹性和凝胶性较低,L*(亮度)、a*(红度)、b*(黄度)有不同程度的下降[38]。如今,腌制加工常利用静态和翻滚腌制与真空、超声、脉冲等技术辅助联合处理肉品。Guo等[39]发现翻滚联合超声辅助腌制处理肉品能有效缩短腌制周期,提高肉品的浸泡吸收率和凝胶保水率,这可能是由于腌制液中高浓度离子流向肌肉纤维细胞中,肌原纤维吸收大量水分以平衡离子浓度。Li等[40]发现相比于静态、真空和加压腌制,脉冲压力腌制方法可显著提高肉的颜色亮度,减少蒸煮损失,提高肉的嫩度。不过,经过非热加工技术处理的肉制品,可能会因为未达到一定温度而缺少美拉德反应、脂肪氧化等产生的风味成分,影响挥发性风味物质的种类和含量[41]。总之,腌制加工对蛋白质氧化产物和肉品的影响是复杂的,可以改善食品的风味和保质期,但也可能影响其营养价值和质地。处理方法、腌制时间以及使用的成分都会影响最终的肉制品质量。
2.4 光电辐射下肉制品的蛋白质氧化和品质变化
辐射是一种利用电离辐射(如γ射线、电子束)处理食物的技术,辐射过程中产生的自由基和活性氧物质可以直接或间接与肌肉食品中的蛋白质分子发生反应,导致蛋白质氧化,这些氧化反应包括氧化剪切、氧化还原反应、酰基化和交联等[42]。高剂量的辐射促使肌肉结构蛋白的降解,猪肉经辐射后在贮藏期间,其总羰基含量增加,且巯基比对照组更易氧化,但不同辐射剂量对巯基含量无明显影响[43]。辐射过程脂肪氧化和蛋白质氧化会共同促进肉品风味的形成,辐照加剧脂质氧化,形成醛类或羧酸类氧化产物,造成肉类酸败味或哈喇味。电子束辐照肉类通过改变其氧化还原电位,增加生鲜肉类蛋白质的氧化作用,影响半胱氨酸、蛋氨酸等氨基酸的氧化和代谢,其硫醇基团可逆氧化生成的二硫化物,参与多种氧化还原反应,并催化二硫醇和二硫化物交换反应,与其他物质进行高度地相互作用,形成重要的风味物质[10]。其中,由蛋氨酸辐射分解形成的二甲基二硫化物是典型的异味挥发物[44]。
高剂量的辐射会扩大肌纤维间隙,导致自由水和结合水的不稳定性增加,从而使肉制品的保水性有所降低;同时辐射对肉品风味有显著影响,其促进游离脂肪酸和呈味核苷酸的降解,低剂量辐照可有效提高鲜味氨基酸含量,降低苦味和甜味氨基酸含量[45]。较高的辐射剂量(9 kGy)可以增加胶原蛋白的溶解度,同时,辐照和成熟时间的延长加深了牛肉肌原纤维的断裂程度,降低肉品的剪切力,提高其嫩度;而肌红蛋白的还原能力随辐照剂量(<3 kGy)的增加而降低,色泽发生改变[46]。但也有研究发现,虽然经过辐照后羊肉的剪切力显著降低,但贮藏过程中蛋白质发生的氧化交联会造成更紧密的肉质结构,使羊肉的剪切力增加速率升高,这可能归结于巯基氧化形成的二硫键对嫩度有负面影响[43]。超过3 kGy的辐照剂量被广泛应用于食品工业领域,能够杀灭微生物、降低蛋白质氧化程度,并在一定条件下促进脂质氧化,保持良好的风味物质。
2.5 超高压下肉制品的蛋白质氧化和品质变化
由于传统热处理加工对肉制品的营养价值可能会带来负面影响,超高压处理(ultra-high pressure,UHP)成为肉品加工和贮藏常见的非加热工艺。UHP是一种应用高压力(通常使用压力大约为100~600 MPa)对食品进行加工和杀菌的方法,可以通过不添加化学防腐剂或其他有害物质、有效抑制或灭活李斯特菌等致病菌而达到肉品保鲜的作用。高压诱导的蛋白质变性可能导致聚集修饰,形成较大的不溶性蛋白质聚集体。当压力超过200 MPa时,可能会导致肌原纤维的I带、M线和Z线断裂,并形成由二硫键或氢键作用形成的蛋白质聚集体[47]。然而,在高压条件下肌原纤维结构被破坏,这种肌肉组织结构的变化会影响蛋白酶水解活性及酶的释放,这可能会促进生/熟肉的嫩化。
有研究发现,在高压力水平处理下(200~500 MPa),滩羊肉中肌原纤维蛋白的羰基和二酪氨酸含量会增加,同时巯基含量会降低,这种变化可能会导致肌原纤维蛋白的二级结构稳定性下降[48]。但是Zeng等[49]在探讨UHP处理对冷冻肉内收肌内源蛋白酶与蛋白质降解的关系时发现,超高压(400和500 MPa)处理可以延缓肉制品在冷藏过程中的蛋白质氧化,且抑制了钙蛋白酶等内源性蛋白酶的活性,进而降低蛋白质降解率,对改善肉品的质构有着关键作用。UHP对肉品的色泽影响在于对血红素类蛋白的变性作用,肌红蛋白在400 MPa左右的压力水平处会发生变性,在此水平下的牦牛肉色更具稳定性[50]。而腌制硝化作用能保护肌红蛋白免受高压诱导的氧化。此外,超高压处理常与腌制相结合,因其可引起Na+离子与肉蛋白相互作用而在不增加实际盐含量的基础上增加咸味感,是促进肉制品减盐的有效办法,超高压和腌制联合处理肉制品的方式有利于食品工业领域健康产品的生产[51]。综上,不同的压力水平对肌肉蛋白有固定的变性参数区间,适当的压力水平有助于维持肉制品的色泽稳定性和其他功能特性。
2.6 包装系统对肉类蛋白质氧化和品质的影响
不同的包装方式对肉制品贮藏期间的品质影响不同。常见的肉制品包装方式有普通包装、气调包装(modified atmosphere packaging,MAP)和真空包装(vacuum packaging,VP)等。孙金龙等[52]比较了不同包装方式对土豆烧牛肉菜肴中蛋白质氧化程度的影响后发现,VP对牛肉的氧化作用弱于免拆膜包装和托盘包装。VP和高氧气调包装中的牛肉在4 ℃下保存10 d后,真空组牛肉的蒸煮损失低于高氧气调组,而高氧气调包装会增加牛肉的蛋白质羰基化-AAS和交联化-LNL的形成,进而引起肉品品质的恶化[9]。Li等[53]在研究了(40% O2/20% CO2/40% N2、60% O2/20% CO2/20% N2和80% O2/20% CO2)3种MAP和VP对猪肉冷藏期间色泽和蛋白质氧化影响时发现,VP肉和MAP肉中的肌浆蛋白AAS含量均高于肌原纤维蛋白AAS含量,可能是由于对氧自由基有高度敏感性的肌红蛋白在肌浆蛋白中通过赖氨酸脱胺被氧化成AAS;高氧包装肉中肌原纤维蛋白AAS参与进一步的氧化反应使其含量比真空包装肉中AAS含量更少。
包装方式对肉品色泽稳定性的影响是前人研究较为关心的问题。Jaspal等[54]在研究将乳酸组合透气包装(oxygen permeable,OP)和MAP对鸡肉肉质影响时发现,乳酸处理后的两种包装肉在贮藏期均呈现较高的L*值,OP包装中颜色a*值较高,1.25%乳酸处理与气调包装相结合,可有效保持鸡肉的贮藏特性。MAP中可考虑引入40%浓度水平的O2,此水平下猪肉的a*较高,而更高的氧气水平会增加蛋白质羰基化和肉的韧性[53]。MAP对肉的韧性和嫩度的影响机制或是因高氧引起蛋白质氧化加剧,阻碍了钙蛋白酶对肌钙蛋白-T等结构蛋白的降解[55]。在MAP系统中通过调控不同的气体比例以保持最佳的肉质品质,Ye等[56]发现30% O2/70% N2低温环境下的猪肉在感官评价、色泽和抑菌方面表现出较佳效果,而添加10% O2/90% N2气调下有效阻碍蛋白质氧化并提高肉类的保水能力和质地。总的来说,包装类型在肉品保鲜和质量维持方面发挥着重要作用。根据肉品的特性和特定需求选择适当的包装方式,有效减少氧化反应并延长保质期,有利于维护肉品的品质和食用价值,提高食品工业的可持续性,减少食品浪费。
3. 结论
蛋白质氧化是影响肉品品质的重要因素,包括质地和颜色变化、营养价值以及风味品质的发展规律。蛋白质氧化是蛋白质分子与氧气或氧化物相互作用,导致蛋白质结构和功能的改变的过程。这种现象在食品加工、储存以及生物体内都可能发生,而蛋白质氧化的机制涉及多种反应路径。本综述深入分析了蛋白质氧化产物的类型,包括羰基、巯基和交联等氧化产物,探讨了不同加工条件(热处理、低温、腌制、辐射、超高压以及包装方式)下蛋白质氧化的差异以及对肉品品质的影响。总体而言,每种加工方式根据强度的不同,对肉品的影响可能会呈现相反的效果。然而,适度的加工强度能改善肉品的感官质量并增加营养价值。需要注意的是,不同的肉品和蛋白质可能对氧化的敏感性不同。因此,制定新型加工方式有助于调整加工过程,从而有效控制蛋白质氧化方面的效果。未来的研究可以重点关注蛋白质氧化的机制,尤其是在不同加工条件下的变化规律。探索和开发新型的抗氧化剂,优化加工工艺,寻找最佳的处理方式来减少蛋白质氧化的程度,从而提高肉品的品质。
-
图 2 以L-蛋氨酸为例的含硫氨基酸的氧化还原反应过程
注:ROS:活性氧,reactive oxygen species;L-Met:L-蛋氨酸,L-methionine;MetO-S:S-蛋氨酸亚砜,S-epimers of methionine sulfoxide;MetO-R:R-蛋氨酸亚砜,R-epimers of methionine sulfoxide;Msr-A:S-蛋氨酸亚砜还原酶,S-methionine sulfoxide reductases;Msr-B:R-蛋氨酸亚砜还原酶,R-methionine sulfoxide reductases;S-S:二硫键,disulfide bond;-SH:巯基,sulfhydryl。
Figure 2. REDOX reaction of sulfur-containing amino acids with L-methionine as an example
表 1 部分加工对蛋白质氧化及肉品质的影响
Table 1 Effect of processing on protein oxidation and meat quality
加工方式 蛋白质氧化表征 肉品质指标 参考文献 热处理 游离硫醇减少 消化率和生物利用度下降 韦婕妤[22],Chen等[26] 热处理 AAS、GGS增加,LNL交联 韧性增加,持水性降低 Shen等[9],Wang等[25] 冷冻冷藏 肌红蛋白构象变化减少 氧化稳定性提高 李慧芝等[29],Jiang等[31] 腌制 疏水性提高 凝胶保水性提高 Zhang等[35],Zhou等[41] 辐照 肌原纤维降解 嫩度提高 Zhang等[44],Rodrigues等[46] 超高压 疏水性增加,羰基、巯基增多,氧合肌红蛋白
氧化还原速率加快保水性下降,色泽劣变或趋于稳定 李冬冬[48],Zeng等[49],陈腊梅等[50] MAP(相比于VP) AAS、LNL含量增加 蒸煮损失增加,嫩度下降 Shen等[9],扶庆权等[55] -
[1] DOMINGUEZ R, PATEIRO M, MUNEKATA P E S, et al. Protein oxidation in muscle foods:A comprehensive review[J]. Antioxidants,2022,11(1):83−95.
[2] DALLE ZOTTE A, GLEESON E, FRANCO D, et al. Proximate composition, amino acid profile, and oxidative stability of slow-growing indigenous chickens compared with commercial broiler chickens[J]. Foods,2020,9(5):10.
[3] ZHANG W, XIAO S, AHN D U. Protein oxidation:Basic principles and implications for meat quality[J]. Critical Reviews in Food Science and Nutrition,2013,53(11):1191−1201. doi: 10.1080/10408398.2011.577540
[4] SCHONEICH C. Radical rearrangement and transfer reactions in proteins[J]. Essays in Biochemistry,2020,64(1):87−96. doi: 10.1042/EBC20190046
[5] STADTMAN E R, LEVINE R L. Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J]. Amino Acids,2003,25(3-4):207−218. doi: 10.1007/s00726-003-0011-2
[6] LI C, XIONG Y L, CHEN J. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry,2012,60(32):8020−8027. doi: 10.1021/jf302150h
[7] AKAGAWA M. Protein carbonylation:Molecular mechanisms, biological implications, and analytical approaches[J]. Free Radical Research,2021,55(4):307−320. doi: 10.1080/10715762.2020.1851027
[8] ESTEVEZ M, VENTANAS S, HEINONEN M. Formation of strecker aldehydes between protein carbonyls-alpha-aminoadipic and gamma-glutamic semialdehydes-and leucine and isoleucine[J]. Food Chemistry,2011,128(4):1051−1057. doi: 10.1016/j.foodchem.2011.04.012
[9] SHEN Y Q, GUO X X, LI X P, et al. Effect of cooking temperatures on meat quality, protein carbonylation and protein cross-linking of beef packed in high oxygen atmosphere[J]. LWT,2022,154:112633. doi: 10.1016/j.lwt.2021.112633
[10] JIA W, SHI Q Y, ZHANG R, et al. Unraveling proteome changes of irradiated goat meat and its relationship to off-flavor analyzed by high-throughput proteomics analysis[J]. Food Chemistry,2021,337:127806. doi: 10.1016/j.foodchem.2020.127806
[11] GALLEGO M, MORA L, ARISTOY M C, et al. Evidence of peptide oxidation from major myofibrillar proteins in dry-cured ham[J]. Food Chemistry,2015,187:230−235. doi: 10.1016/j.foodchem.2015.04.102
[12] WALKER E J, BETTINGER J Q, WELLE K A, et al. Protein folding stabilities are a major determinant of oxidation rates for buried methionine residues[J]. Journal of Biological Chemistry,2022,298(5):101872. doi: 10.1016/j.jbc.2022.101872
[13] 陈畅, 黄波, 韩佩韦, 等. 蛋白质巯基亚硝基化—一种典型氧化还原依赖的蛋白质翻译后修饰[J]. 生物化学与生物物理进展,2006(7):609−615. [CHEN C, HUANG B, HAN P W, et al. Protein thionitrosylation—A typical redox dependent post-translational modification of proteins[J]. Progress in Biochemistry and Biophysics,2006(7):609−615.] doi: 10.3321/j.issn:1000-3282.2006.07.002 CHEN C, HUANG B, HAN P W, et al. Protein thionitrosylation—A typical redox dependent post-translational modification of proteins[J]. Progress in Biochemistry and Biophysics, 2006(7): 609−615. doi: 10.3321/j.issn:1000-3282.2006.07.002
[14] TURELL L, ZEIDA A, TRUJILLO M. Mechanisms and consequences of protein cysteine oxidation:The role of the initial short-lived intermediates[J]. Essays in Biochemistry,2020,64(1):55−66. doi: 10.1042/EBC20190053
[15] JIANG Y, LI D H, TU J C, et al. Mechanisms of change in gel water-holding capacity of myofibrillar proteins affected by lipid oxidation:The role of protein unfolding and cross-linking[J]. Food Chemistry,2020,344(5):128587.1−128587.8.
[16] WANG H, SONG Y, LIU Z, et al. Effects of iron-catalyzed and metmyoglobin oxidizing systems on biochemical properties of yak muscle myofibrillar protein[J]. Meat Science,2020,166:108041. doi: 10.1016/j.meatsci.2019.108041
[17] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science,2006,73(3):536−543. doi: 10.1016/j.meatsci.2006.02.005
[18] ESTEVEZ M. Protein carbonyls in meat systems:A review[J]. Meat Science,2011,89(3):259−279. doi: 10.1016/j.meatsci.2011.04.025
[19] 樊贺雨. 油炸牛肉饼中晚期糖基化终末产物和杂环胺形成受加工条件的影响及控制[D]. 南昌:南昌大学, 2022. [FAN H Y. The formation and inhibitory effect of processing conditions on the formation of advanced glycation end products and heterocyclic arometic amines in fried beef patties[D]. Nanchang:Nanchang University, 2022.] FAN H Y. The formation and inhibitory effect of processing conditions on the formation of advanced glycation end products and heterocyclic arometic amines in fried beef patties[D]. Nanchang: Nanchang University, 2022.
[20] NAWAZ A, IRSHAD S, KHAN I A, et al. Protein oxidation in muscle-based products:Effects on physicochemical properties, quality concerns, and challenges to food industry[J]. Food Research International,2022,157:12.
[21] TRAORE S, AUBRY L, GATELLIER P, et al. Effect of heat treatment on protein oxidation in pig meat[J]. Meat Science,2012,91(1):14−21. doi: 10.1016/j.meatsci.2011.11.037
[22] 韦婕妤. 热加工方式对羊肉制品蛋白质氧化及体外模拟消化性的影响研究[D]. 成都:西南民族大学, 2019. [WEI J Y. Effects of thermal processing on protein oxidation and digestive simulation of mutton products in vitro[D]. Chengdu:Southwest University for Nationalities, 2019.] WEI J Y. Effects of thermal processing on protein oxidation and digestive simulation of mutton products in vitro[D]. Chengdu: Southwest University for Nationalities, 2019.
[23] 谢强, 马承育, 苗淑萍, 等. 热处理对肉类蛋白特性及有害物质产生的影响研究进展[J]. 食品安全质量检测学报,2023,14(7):22−31. [XIE Q, MA C Y, MIAO S P, et al. Research progress on the effects of heat treatment on meat protein characteristics and harmful substances production[J]. Journal of Food Safety and Quality,2023,14(7):22−31.] XIE Q, MA C Y, MIAO S P, et al. Research progress on the effects of heat treatment on meat protein characteristics and harmful substances production[J]. Journal of Food Safety and Quality, 2023, 14(7): 22−31.
[24] QIU D, DUAN R, WANG Y, et al. Effects of different drying temperatures on the profile and sources of flavor in semi-dried golden pompano (Trachinotus ovatus)[J]. Food Chemistry,2023,401:134112−134112 . doi: 10.1016/j.foodchem.2022.134112
[25] WANG X, YAO Y, YU J, et al. Evolution of lean meat tenderness stimulated by coordinated variation of water status, protein structure and tissue histology during cooking of braised pork[J]. Food Research International,2023,171:113081. doi: 10.1016/j.foodres.2023.113081
[26] CHEN H, ZHAO G, YU X, et al. Exploring in vitro gastrointestinal digestion of myofibrillar proteins at different heating temperatures[J]. Food Chemistry,2023,414:135694. doi: 10.1016/j.foodchem.2023.135694
[27] 童今柱. 加热方式对鸭肉肌原纤维蛋白结构和功能性质及肉品质形成的影响研究[D]. 合肥:合肥工业大学, 2019. [TONG J Z. Effects of heating methods on the structure, functional properties and meat quality of duck myofibrin[D]. Hefei:Hefei University of Technology, 2019.] TONG J Z. Effects of heating methods on the structure, functional properties and meat quality of duck myofibrin[D]. Hefei: Hefei University of Technology, 2019.
[28] YU L, LI Q, LI Y, et al. Impact of frozen storage duration of raw pork on the formation of advanced glycation end-products in meatballs[J]. LWT-Food Science and Technology,2021,146(3):111481.
[29] 李慧芝, 谢含仪, 赵燕芳, 等. 反复冻融过程对肉类氧化关键指标的影响[J]. 食品科技,2020,45(11):102−109. [LI H Z, XIE H Y, ZHAO Y F, et al. Effect of multiple freeze-thaw cycles on the key oxidation indicators of meat samples[J]. Food Science and Technology,2020,45(11):102−109.] LI H Z, XIE H Y, ZHAO Y F, et al. Effect of multiple freeze-thaw cycles on the key oxidation indicators of meat samples[J]. Food Science and Technology, 2020, 45(11): 102−109.
[30] BAO Y, ERTBJERG P, ESTÉVEZ M, et al. Freezing of meat and aquatic food:Underlying mechanisms and implications on protein oxidation[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(6):5548−5569. doi: 10.1111/1541-4337.12841
[31] JIANG Q, DU Y, NAKAZAWA N, et al. Effects of frozen storage temperature on the quality and oxidative stability of bigeye tuna flesh after light salting[J]. International Journal of Food Science and Technology,2022,57(5):3069−3077. doi: 10.1111/ijfs.15636
[32] DU X, WANG B, LI H, et al. Research progress on quality deterioration mechanism and control technology of frozen muscle foods[J]. Comprehensive Reviews in Food Science and Food Safety,2022,21(6):4812−4846. doi: 10.1111/1541-4337.13040
[33] PENG R, WANG L, YU P T, et al. Exacerbated protein oxidation and tyrosine nitration through nitrite-enhanced fenton chemistry[J]. Journal of Agricultural and Food Chemistry,2022,70(1):353−359. doi: 10.1021/acs.jafc.1c04591
[34] LI Y, XUE C, QUAN W, et al. Assessment the influence of salt and polyphosphate on protein oxidation and Nε-(carboxymethyl) lysine and Nε-(carboxyethyl) lysine formation in roasted beef patties[J]. Meat Science,2021,177(4):108489.
[35] ZHANG M, LI C, ZHANG Y, et al. Impact of salt content and hydrogen peroxide-induced oxidative stress on protein oxidation, conformational/morphological changes, and micro-rheological properties of porcine myofibrillar proteins[J]. Food Chemistry,2022,370:131074.1−131074.11.
[36] POLJANEC I, RADOVI N M, PETRIEVI S, et al. Proteolysis and protein oxidation throughout the smoked dry-cured ham process[J]. Food Chemistry,2021,362(1):130207.
[37] FENG X, LI C, ULLAH N, et al. Potential biomarker of myofibrillar protein oxidation in raw and cooked ham:3-Nitrotyrosine formed by nitrosation[J]. Journal of Agricultural and Food Chemistry,2015,63(51):10957−10964. doi: 10.1021/acs.jafc.5b04107
[38] CHEN X, LUO J, LOU A, et al. Duck breast muscle proteins, free fatty acids and volatile compounds as affected by curing methods[J]. Food Chemistry,2021,338(2):128138.
[39] GUO X, WANG Y Q, LU S L, et al. Changes in proteolysis, protein oxidation, flavor, color and texture of dry-cured mutton ham during storage[J]. LWT-Food Science and Technology,2021,149(8):1−10.
[40] LI C, SHI J, ZHAI X D, et al. Effects of pulsed pressure curing on beef quality[J]. Foods,2023,12(3):656. doi: 10.3390/foods12030656
[41] ZHOU Y, HU M, WANG L. Effects of different curing methods on edible quality and myofibrillar protein characteristics of pork[J]. Food Chemistry,2022(1):387.
[42] 佟荟全, 杨丽芳, 肖志超, 等. 超声联合滚揉腌制对鸡胸肉品质的影响研究[J]. 核农学报,2022,36(4):777−787. [TONG H Q, YANG L F, XIAO Z C, et al. Effect of ultrasound combined with rolling and salting on the quality of chicken breast meat[J]. Journal of Nuclear Agricultural Sciences,2022,36(4):777−787.] doi: 10.11869/j.issn.100-8551.2022.04.0777 TONG H Q, YANG L F, XIAO Z C, et al. Effect of ultrasound combined with rolling and salting on the quality of chicken breast meat[J]. Journal of Nuclear Agricultural Sciences, 2022, 36(4): 777−787. doi: 10.11869/j.issn.100-8551.2022.04.0777
[43] 蔡颖萱, 魏文婧, 董鹏程, 等. 电子束辐照对肉中微生物和肉品质的影响及机制研究进展[J]. 食品工业科技,2023,44(8):446−453. [CAI Y X, WEI W J, DONG P C, et al. Advances in the effect and mechanism of electron beam irradiation microorganisms and meat quality[J]. Science and Technology of Food Industry,2023,44(8):446−453.] CAI Y X, WEI W J, DONG P C, et al. Advances in the effect and mechanism of electron beam irradiation microorganisms and meat quality[J]. Science and Technology of Food Industry, 2023, 44(8): 446−453.
[44] ZHANG M, HE L, LI C, et al. Effects of gamma ray irradiation-induced protein hydrolysis and oxidation on tenderness change of fresh pork during storage[J]. Meat Science,2020,163:108058. doi: 10.1016/j.meatsci.2020.108058
[45] FENG X, JO C, NAM K C, et al. Impact of electron-beam irradiation on the quality characteristics of raw ground beef[J]. Innovative Food Science & Emerging Technologies,2019,54:87−92.
[46] RODRIGUES L M, SALES L A, FONTES P R, et al. Combined effects of gamma irradiation and aging on tenderness and quality of beef from nellore cattle[J]. Food Chemistry,2020,313:126137. doi: 10.1016/j.foodchem.2019.126137
[47] HUANG X, YOU Y, LIU Q, et al. Effect of gamma irradiation treatment on microstructure, water mobility, flavor, sensory and quality properties of smoked chicken breast[J]. Food Chemistry,2023,421:136174. doi: 10.1016/j.foodchem.2023.136174
[48] 李冬冬. 基于蛋白氧化揭示高压处理滩羊肉品质变化的机理研究[D]. 银川:宁夏大学, 2022. [LI D D. Investigation on mechanism of quality changes of high pressure processing Tan lambs based on protein oxidation[D]. Yinchuan:Ningxia University, 2022.] LI D D. Investigation on mechanism of quality changes of high pressure processing Tan lambs based on protein oxidation[D]. Yinchuan: Ningxia University, 2022.
[49] ZENG X Y, JIAO D X, YU X A, et al. Effect of ultra-high pressure on the relationship between endogenous proteases and protein degradation of yesso scallop (Mizuhopecten yessoensis) adductor muscle during iced storage[J]. Food Chemistry:X,2022,15:8.
[50] 陈腊梅, 唐善虎, 李思宁, 等. 超高压处理对牦牛肉贮藏性能的影响[J]. 食品工业科技,2023,44(6):351−360. [CHEN L M, TANG S H, LI S N, et al. Effects of high-pressure processing on the storage properties of yak meat[J]. Science and Technology of Food Industry,2023,44(6):351−360.] CHEN L M, TANG S H, LI S N, et al. Effects of high-pressure processing on the storage properties of yak meat[J]. Science and Technology of Food Industry, 2023, 44(6): 351−360.
[51] JIA S, SHEN H, WANG D, et al. Novel nacl reduction technologies for dry-cured meat products and their mechanisms:A comprehensive review[J]. Food Chemistry,2024,431:137142. doi: 10.1016/j.foodchem.2023.137142
[52] 孙金龙, 黄峰, 师希雄, 等. 不同包装方式对土豆烧牛肉菜肴中牛肉脂肪与蛋白质氧化的影响[J]. 食品与发酵工业,2020,46(19):148−153. [SUN J L, HUANG F, SHI X X, et al. Effects of different packaging methods on fat and protein oxidation in braised beef with potatoes[J]. Food and Fermentation Industries,2020,46(19):148−153.] SUN J L, HUANG F, SHI X X, et al. Effects of different packaging methods on fat and protein oxidation in braised beef with potatoes[J]. Food and Fermentation Industries, 2020, 46(19): 148−153.
[53] LI S J, GUO X X, SHEN Y Q, et al. Effects of oxygen concentrations in modified atmosphere packaging on pork quality and protein oxidation[J]. Meat Science,2022,189:10.
[54] JASPAL M H, IJAZ M, HAQ H A U, et al. Effect of oregano essential oil or lactic acid treatments combined with air and modified atmosphere packaging on the quality and storage properties of chicken breast meat[J]. LWT,2021,146:111459. doi: 10.1016/j.lwt.2021.111459
[55] 扶庆权, 王海鸥, 李坤, 等. 高氧气调包装对宰后牛半膜肌成熟过程中品质的影响[J]. 食品科学,2020,41(23):236−242. [FU Q Q, WANG H O, LI K, et al. Effects of high oxygen modified atmosphere packaging on quality of beef semimembranosus muscles during postmortem aging[J]. Food science,2020,41(23):236−242.] doi: 10.7506/spkx1002-6630-20200512-126 FU Q Q, WANG H O, LI K, et al. Effects of high oxygen modified atmosphere packaging on quality of beef semimembranosus muscles during postmortem aging[J]. Food science, 2020, 41(23): 236−242. doi: 10.7506/spkx1002-6630-20200512-126
[56] YE K P, DING D M, ZHU X, et al. Modified atmosphere packaging with a small change in gas ratio could maintain pork quality during -3 ℃ storage[J]. Food Control,2020,109:7.





 下载:
下载:
 下载:
下载:
