Optimization and Antioxidant Activity of Peptides from Rapeseed Cake Assisted by Superfine Grinding
-
摘要: 本文引入超微粉碎前处理技术,以菜籽饼超微粉为原料直接酶解制备活性肽,利用单因素实验和响应面试验优化其制备工艺,酶解液经膜分离和Sephadex G-15凝胶分离后获得活性肽,并对其抗氧化活性和结构进行分析研究。结果表明,菜籽饼活性肽的最佳制备条件为:超微粉碎处理30 min、料液比1:20、加酶量6300 U/g、酶解pH2.94、酶解温度55 ℃、酶解时间2.25 h,此条件下活性肽得率为83.28%;菜籽饼酶解液中分子量低于1000 Da的F-2组分具有较好的抗氧化活性,1 mg/mL下对ABTS+自由基的清除率为71.62%,从中鉴定出PF、SF、TF、IAIPF和PLDLL五条预测活性最高的肽段。本研究结果可为以菜籽饼为原料直接开发活性肽提供一定的理论依据。Abstract: To prepare bioactive peptides from rapeseed cake directly, the superfine grinding technology was used, and the resulting rapeseed cake superfine powder was used as the material. Single-factor experiments and response surface analysis were used to optimize the preparation extraction. The active peptides were purified by membrane separation and Sephadex G-15 membrane separation, and their antioxidant activity and structure were evaluated. The results showed that the optimal preparation conditions were as follows: grinding time 30 min, solid-to-liquid ratio 1:20(g/mL), pH2.94, enzyme dosage 6300 U/g, temperature 55 ℃, and enzymatic hydrolysis time 2.25 h. Under these conditions, the yield of peptides could reach 83.28%. The F-2 fraction from hydrolysates with molecular mass less than 1000 Da showed good antioxidant activity, with an ABTS+ free radical eliminating rate of 71.62% at a concentration of 1 mg/mL. Furthermore, five peptides were identified, namely PF, SF, TF, IAIPF, and PLDLL which were predicted to have much higher activity. Overall, the results of this study can provide a theoretical basis for the exploration of bioactive peptides directly from rapeseed cakes.
-
Keywords:
- rapeseed cake /
- superfine grinding /
- flavourzyme /
- active peptide /
- antioxidant activity
-
菜籽饼作为油菜籽榨油后的副产物,占比高达60%~65%,其蛋白质含量约30%~45%,含有较丰富的碱性氨基酸和含硫氨基酸,如Met、Arg、Lys含量分别约为2.3%、4.1%、6.7%,是一种优质的植物蛋白资源[1],但目前菜籽饼仅被用作饲料、肥料或废料处理,造成了较大的资源浪费。生物活性肽作为蛋白质水解的中间产物,因具有一些特殊生理调节功能成为了研究热点[2],如研究人员已从亚麻籽粕[3]、鹰嘴豆[4]、南瓜籽[5]和酸枣仁[6]等中制备出抗氧化肽。随着菜籽蛋白先后被美国食品药品监督管理局(Food and Drug Administration,FDA)和欧洲食品安全局(European Food Safety Authority,EFSA)批准为安全的新型食品原料,菜籽饼中丰富的蛋白资源也受到了学者的广泛关注。
菜籽蛋白主要由菜籽球蛋白(cruciferin)和菜籽白蛋白(napin)组成,分别约占总菜籽蛋白的60%和20%,其中cruciferin由254~296个氨基酸组成,napin由111~180个氨基酸组成[7]。已有研究表明,菜籽蛋白水解物具有抗氧化[8−9]、降血压[10]、抗凝血[11]、抑菌[12]、抗肿瘤[13]以及促睡眠[14]等多种生物活性。Wang等[15]发现采用碱性蛋白酶酶解法制备的菜籽蛋白水解物具有较高的抗氧化活性,并从中分离纯化出抗氧化肽Trp-Ile(Leu)-Tyr;章绍兵等[16]从菜籽饼中分离出了2种抗氧化肽Arg-Asn-Leu(Ile)-Pro-Tyr和Tyr-Pro-Leu(Ile)-Tyr-Glu,其C-端或N-端均为Tyr(Y)残基,且通常当Tyr位于肽链N-端时其抗氧化活性较强。
目前研究大多需先采用有机溶剂脱脂、碱溶酸沉或不沉制备菜籽饼蛋白,再进行酶解提取菜籽活性肽[17],也可利用超声[18]、微波[19]等辅助技术提高肽得率,制备工艺较为繁琐。作为一种新兴的物理加工技术,超微粉碎可通过减小物料粒径、破坏物料表面结构来提高活性物质溶出效率[20]。因此,本研究引入超微粉碎前处理技术,以菜籽饼超微粉为原料直接酶解制备菜籽饼活性肽,并对其抗氧化活性和结构进行研究,以期为菜籽饼的高值化开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
菜籽饼 桐乡市名爵贸易有限公司;风味蛋白酶(1.5×104 U/g) 北京索莱宝科技有限公司;氢氧化钠、三氯乙酸(TCA)、Gly-Gly-Tyr-Arg四肽标准品、牛血清蛋白(BSA)、硫酸铜、酒石酸钾钠 均为分析纯,阿拉丁生化科技股份有限公司;乙腈、甲酸、碳酸氢铵 色谱纯、二硫苏糖醇(DTT)、碘乙酰胺(IAA) 美国Sigma公司;其他试剂均为分析纯。
BFM-6B型超微粉碎振动磨机 济南倍力粉体工程技术有限公司;Mastersizer2000激光粒度仪 马尔文帕纳科公司;TGL-24M高速冷冻离心机 湖南平凡科技有限公司;THZ-D台式恒温振荡器 苏州培英实验设备有限公司;KN680全自动凯氏定氮仪 山东海能科学仪器有限公司;FE28型pH计 梅特勒托利多科技(中国)有限公司;UV-1780紫外可见分光光度计 岛津仪器(苏州)有限公司;BONA-GM-18有机膜分离试验机 济南博纳生物技术有限公司;RE-2000A旋转蒸发器 西安禾普生物科技有限公司;BSZ-100自动收集器 海青浦沪西仪器厂;Easy-nLC 1200毛细管高效液相色谱仪、电喷雾-组合型离子阱Orbitrap质谱仪 美国Thermo公司。
1.2 实验方法
1.2.1 菜籽饼超微粉的制备及筛选
称取约400 g菜籽饼加至超微粉碎机储料罐中,在0~10 ℃条件下分别粉碎5、10、15、30、40、60 min,冷藏备用。各粉体的粒度分布采用激光粒度仪进行湿法测量,分散剂折射率设置为1.330。
以蛋白质溶出率为指标,筛选最佳菜籽饼超微粉碎处理条件,以普通粉碎60目菜籽饼为对照。其中菜籽饼粗蛋白质含量参考GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法进行测定[21];菜籽饼提取液中蛋白质含量采用双缩脲法测定[22],以牛血清蛋白为标准品。
蛋白质溶出率(%)=C×VM×100 式中:C:蛋白质浓度(mg/mL);V:提取液总体积(mL);M:原料中蛋白质质量(mg)。
1.2.2 风味蛋白酶制备菜籽饼活性肽
1.2.2.1 制备条件
称取5 g菜籽饼超微粉体,以1:20(g/mL)的料液比分散于蒸馏水中,调节混合液至适当pH,在55 ℃条件下恒温振荡反应,期间保证混合液pH恒定,反应结束后沸水浴灭酶10 min并冷却至室温,4 ℃条件下离心(6000 r/min,10 min),取上清液,4 ℃冷藏备用。
1.2.2.2 单因素实验
以菜籽饼超微粉体为底物,以多肽得率及水解度为评价指标,固定料液比为1:20、酶解反应温度为55 ℃、酶解pH3.0、酶解时间为3 h,蛋白酶加酶量为3000、4000、5000、6000、7000 U/g;固定料液比为1:20、酶解反应温度为55 ℃、酶解时间为3 h、蛋白酶加酶量为6000 U/g,酶解pH为2.0、2.5、3.0、3.5、4.0;固定料液比为1:20(g/mL)、酶解反应温度为55 ℃、蛋白酶加酶量为6000 U/g、酶解pH为3,酶解时间为1、2、3、4、5 h进行单因素实验。
1.2.2.3 响应面优化试验
在单因素实验基础上,根据Box-Behnken Design试验设计原理,对加酶量(A)、酶解pH(B)、酶解时间(C)三个因素进行进一步优化,以肽得率(R)为响应值进行三因素三水平试验,优化风味蛋白酶制备菜籽饼活性肽工艺条件,试验因素与水平设计见表1。
表 1 响应面试验设计因素与水平Table 1. Factors and levels of Box-Behnken design因子 水平 −1 0 1 A加酶量(U/g) 5000 6000 7000 B酶解pH 2.5 3.0 3.5 C酶解时间(h) 1 2 3 1.2.3 肽得率的测定
采用双缩脲法测定菜籽饼酶解液中的肽浓度并作适当修改[23]。具体方法如下:用5% TCA溶液依次配制0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、2.0、2.4 mg/mL的Gly-Gly-Tyr-Arg四肽标准溶液,然后分别取1 mL标准溶液,加入0.67 mL双缩脲试剂后涡旋混合均匀,常温静置10 min,于540 nm下测定吸光度值,以5% TCA溶液为空白对照。以四肽标准品浓度为横坐标、吸光值为纵坐标绘制标准曲线。
肽得率的测定:取1 mL酶解液与1 mL 10% TCA溶液涡旋混合均匀,常温静置10 min, 4 ℃条件下6000 r/min离心10 min后取上清液1 mL加入0.67 mL双缩脲试剂,常温静置10 min后于540 nm处测定吸光度值。对照标准曲线得到酶解液中的肽浓度(mg/mL)。
肽得率(%)=C×VM×100 式中:C:酶解液中肽浓度(mg/mL);V:酶解液总体积(mL);M:原料中所含蛋白质质量(mg)。
1.2.4 水解度的测定
氨基态氮的测定:参照GB 5009.235-2016 《食品安全国家标准 食品中氨基酸态氮的测定》中酸度计法[24]。
X=(V1−V2)×C×0.014V3×100 式中:X:样品中含有氨基态氮的量(g/100 mL);V1:样品加入甲醛后消耗氢氧化钠的量(mL);V2:空白加入甲醛后消耗氢氧化钠的量(mL);V3:样品体积(mL);C:氢氧化钠浓度(mol/L);0.014:与1.00 mL氢氧化钠标准滴定溶液(1.00 mol/L)相当的氮的质量(g)。
参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》测定酶解液的总氮[21]。
水解度(DH)的计算方式为:
DH(%)=氨基态氮总氮×100 1.2.5 膜分离联合凝胶色谱法分离菜籽饼活性肽
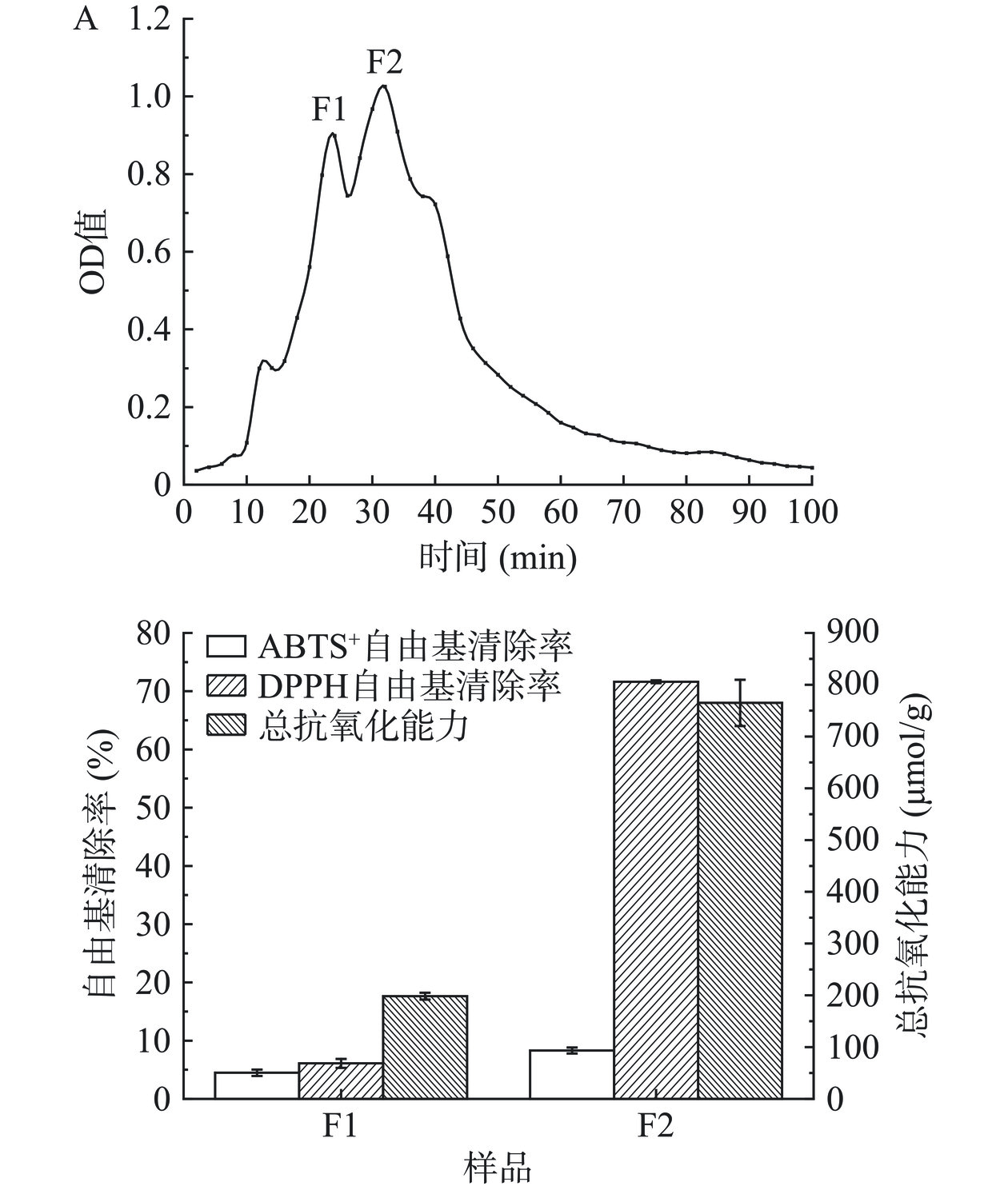
将所得菜籽饼酶解液稀释至1000 mL,利用截断分子质量为5、3、1 kDa的超滤膜进行顺次分级分离,过程中将超滤膜内外膜压力控制在0.2~0.4 MPa,分别收集得到>5 kDa、3~5 kDa、1~3 kDa和<1 kDa四个组分;以1 mg/mL各组分的抗氧化活性为指标,将抗氧化活性最强的菜籽饼活性肽组分使用凝胶色谱Sephadex G-15(16 mm×800 mm)进一步分离纯化,其中以蒸馏水为洗脱剂,恒流泵转速为15 r/min,每2 min收集1管,280 nm波长测定吸光度并绘制峰形图。收集出峰组分,将其浓度调整至1 mg/mL后进行抗氧化活性检测,并对活性最高的组分进行肽序列鉴定。
1.2.6 菜籽饼活性肽体外抗氧化活性测定
1.2.6.1 总抗氧化能力的测定
采用总抗氧化能力(T-AOC)试剂盒对菜籽饼活性肽的总抗氧化能力进行测定。本实验中,总抗氧化能力按下式计算:
总抗氧化能力(µmol/g)=X×V反总/(V样/V样总×W)=34×X/W 式中:X:样品的Fe2+当量浓度(μmol/mL);V反总:反应总体积1.02 mL;V样:反应中样本体积0.03 mL;V样总:加入提取液体积1 mL;W:样本质量(g)。
1.2.6.2 DPPH自由基清除能力
采用DPPH检测试剂盒对菜籽饼活性肽的DPPH自由基清除能力进行测定。本实验中,DPPH自由基清除能力按下式计算:
DPPH自由基清除率(%)=[A2−(A1−A0)]/A2×100 式中:A0:对照组吸光度值;A1:加入活性肽溶液组吸光度值;A2:空白吸光度值。
1.2.6.3 ABTS+自由基清除能力
采用ABTS检测试剂盒对菜籽饼活性肽的ABTS+自由基清除能力进行测定。本实验中,ABTS+自由基清除能力按下式计算:
ABTS+自由基清除率(%)=[A2−(A1−A0)]/A2×100 式中:A0:对照组吸光度值;A1:加入活性肽溶液组吸光度值;A2:空白吸光度值。
1.2.7 高效液相色谱-串联质谱联用鉴定菜籽饼活性肽
选取抗氧化活性最高的组分,委托北京百泰派克生物科技有限公司完成活性肽序列的测定。采用Acclaim PepMap RPLC C18(1.9 μm, 100 Å,150 μm i.d.×150 mm)纳米柱;流动相A为0.1%甲酸,流动相B为0.1%甲酸含80% CAN,流动相梯度:0~2 min,4%~8% B;2~45 min,8%~40% B;45~55 min,40%~60% B;55~56min,60%~95% B;56~66min,95% B;流速600 nL/min。质谱条件:喷淋电压2.2 kV,毛细管温度270 ℃。质谱原始文件使用Byonic进行分析,在Uniprot数据库中以Brassica napus为目标种类进行检索。使用PeptideRanker网站对高置信度鉴定肽进行生物活性预测(http://distilldeep.ucd.ie/PeptideRanker/)。
1.3 数据处理
实验均重复3次,结果表示为平均值±标准偏差,采用Design Expert 10和Origin 2021对实验数据进行做图分析,采用SPSS 20软件单因素方差分析对数据进行显著性分析,P<0.05表示具有显著性差异。
2. 结果与分析
2.1 菜籽饼超微粉碎处理时间的选择
超微粉碎技术可通过增大物料颗粒的比表面积及其孔隙率来增大物料组分的溶出效果[20]。由表2可知,与常规粉碎60目菜籽饼相比,经超微粉碎处理的菜籽饼蛋白质溶出率较高,且随着粉碎时间延长,蛋白质溶出率整体呈现先上升后趋于平缓的趋势,并在超微粉碎处理30 min时蛋白质溶出率达到最大约为33.85%,与常规粉碎相比提高了约29.7%。这主要是因为超微粉碎处理后的菜籽饼粒径变小、比表面积增大,促进了蛋白质从细胞内向细胞外的转移。进一步延长粉碎时间对蛋白质溶出效果影响不大,可能是因为长时间粉碎引起了菜籽饼粉颗粒团聚。因此,本实验选择超微粉碎处理30 min得到的菜籽饼超微粉体为原料,直接酶解制备活性肽。
表 2 不同粉碎时间下菜籽饼超微粉特征及其蛋白质溶出率Table 2. Characters and protein dissolution of rapeseed cake powders with different grinding times粉碎时间(min) D50(μm) Agf(m2/g) 蛋白质溶出率(%) 对照(60目) 165.46±4.59a 0.20±0.006a 26.10±0.21a 5 29.39±1.37b 0.61±0.010b 26.30±0.27a 10 21.27±0.32c 0.69±0.004c 27.44±1.12a 15 21.51±0.52c 0.66±0.008d 29.18±0.20b 20 19.37±0.79cd 0.73±0.018e 29.58±0.93b 30 19.57±0.24cd 0.71±0.005c 33.86±1.21c 40 16.63±0.35d 0.85±0.012f 33.02±0.68c 60 19.26±0.15cd 0.76±0.002g 32.80±1.37c 注:同一指标不同小写字母表示差异显著(P<0.05)。 2.2 风味蛋白酶制备菜籽饼活性肽工艺单因素实验
2.2.1 加酶量对菜籽饼酶解液的肽得率及水解度的影响
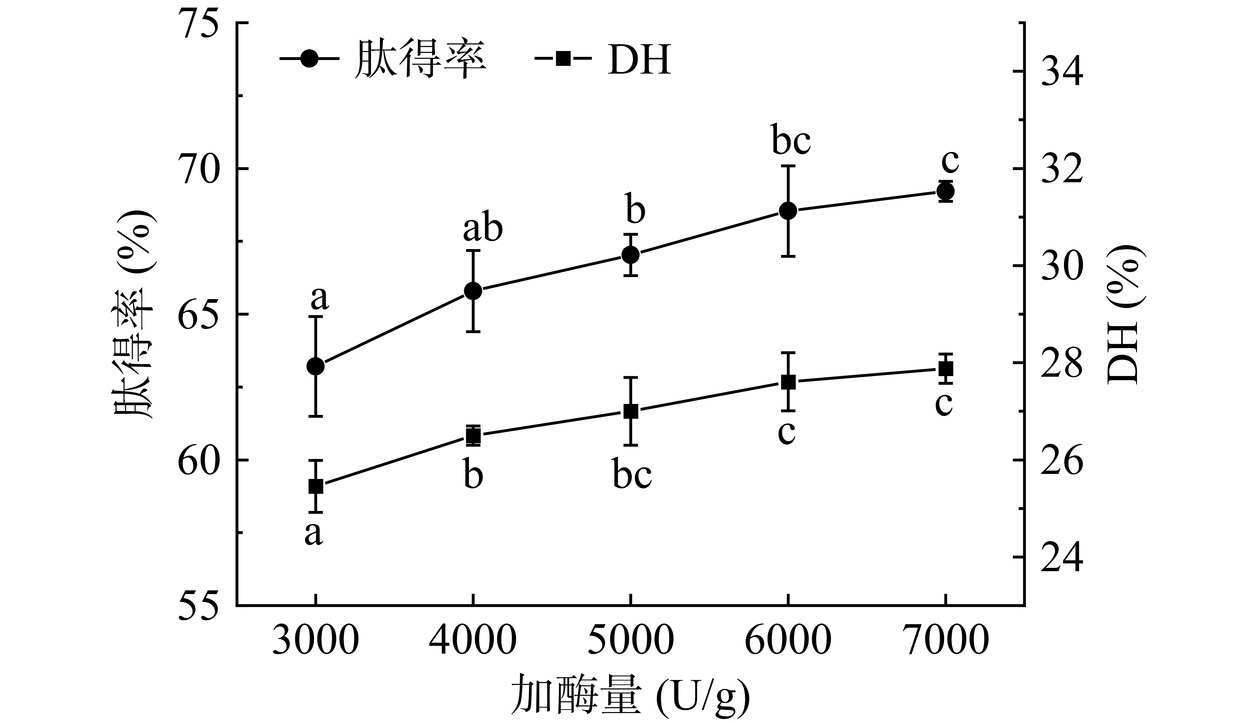
蛋白酶是酶法制备活性肽的关键,风味蛋白酶兼具内肽酶和外肽酶活性,较易获得更短的肽段[25]。图1为不同加酶量对菜籽饼酶解效果的影响,加酶量在3000~6000 U/g,菜籽饼酶解液的肽得率及DH均随着加酶量的提高而不断增大,可能是因为反应初期底物浓度较高,蛋白酶结合位点较多;当加酶量达到6000 U/g,肽得率达到了最大值68.54%±1.55%,此时DH为27.61%±0.60%;继续增加加酶量,肽得率及其水解度趋于平稳,这主要是因为蛋白酶相对底物的结合位点已趋于饱和[26]。因此,优选风味蛋白酶加酶量为6000 U/g进行下一步实验。
2.2.2 酶解pH对菜籽饼酶解液的肽得率及水解度的影响
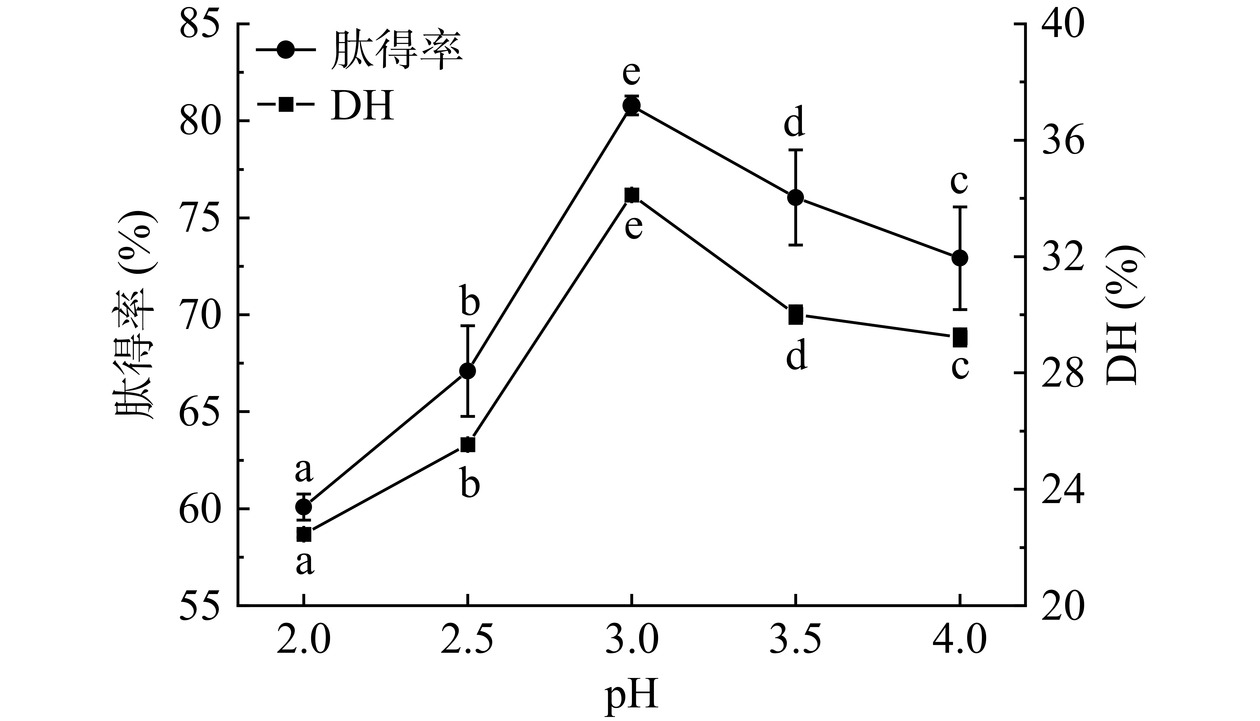
一种酶通常在其最适pH范围内具有最高活力,过酸或过碱会改变酶的空间构象,进而引起酶与底物结合受阻或导致酶失活[27]。如图2所示,酶解pH可显著(P<0.05)影响菜籽饼酶解液的肽得率及DH,随着酶解pH的升高,肽得率及DH的变化趋势基本一致,均表现为先升高后下降,并在pH3时达到最高值,分别为80.79%±0.49%、34.12%±0.2%,这主要是因为风味蛋白酶是一类偏酸性蛋白酶[28]。反应体系的最佳pH与酶的来源及底物种类有关,如Charoensiddhi等[29]采用风味蛋白酶酶解褐藻的最佳pH为7;Wang等[30]利用风味蛋白酶酶解鸭肉的最适pH为5.5。本文优选pH3为风味蛋白酶酶解菜籽饼超微粉的最佳pH。
2.2.3 酶解时间对菜籽饼酶解液的肽得率及水解度的影响
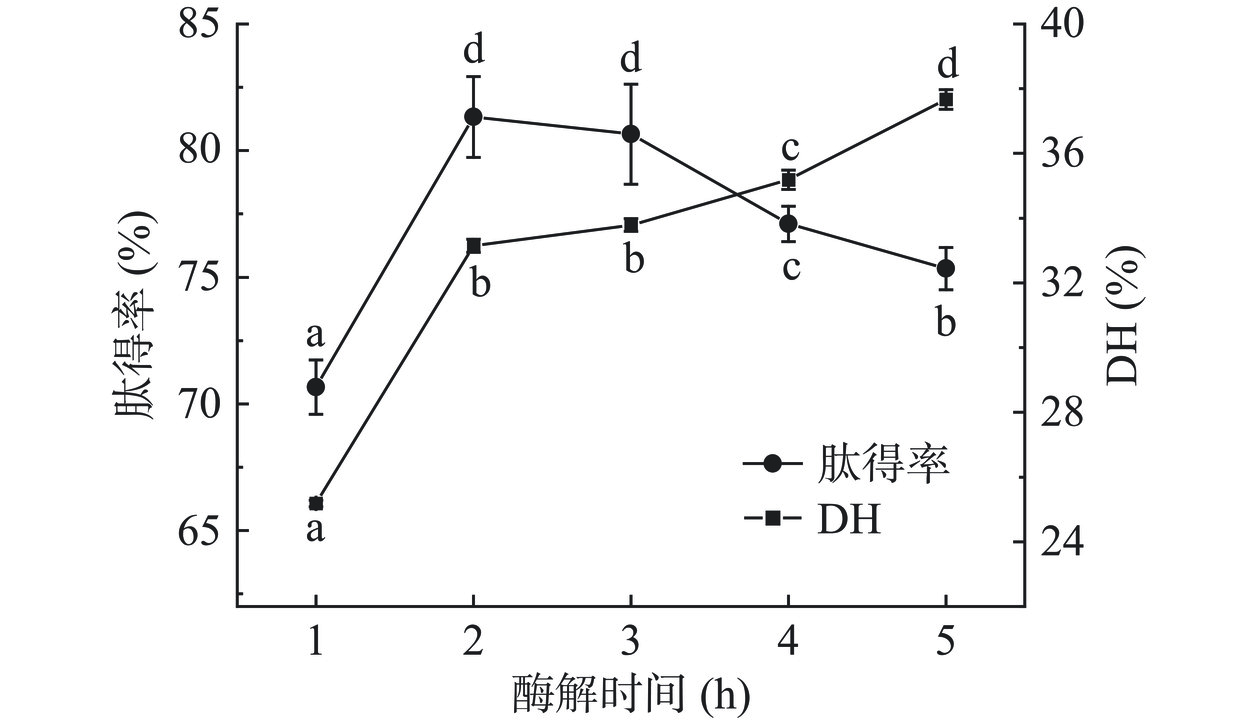
由图3可知,肽得率随酶解时间的延长呈现出先升高后下降的趋势,当酶解时间为2 h时,肽得率最高(81.33%±1.59%);DH随酶解时间的延长呈逐渐上升趋势。反应初期,菜籽饼酶解液的肽得率及其DH因底物浓度较大、蛋白酶反应速率较高呈显著(P<0.05)上升趋势;当酶解时间大于2 h后,因风味蛋白酶已被内切酶切断形成的肽链继续被水解为氨基酸,导致肽得率下降,同时因酶解中氨基态氮含量的增加使得DH升高;与此同时,DH升高速率的降低与酶解产物的抑制作用及酶活力的下降有关[31]。因此,优选风味蛋白酶酶解菜籽饼的最佳酶解时间为2 h。
2.3 风味蛋白酶制备菜籽饼活性肽响应面试验结果分析
在单因素实验结果的基础上,以加酶量(A)、酶解pH(B)、酶解时间(C)三个因素为自变量,肽得率(R)为响应值,采用Box-Behnken进行试验设计,共包括17组试验方案(表3)。
表 3 Box-Behnken试验设计与结果Table 3. Design and results of response surface experiment实验号 A 加酶量 B 酶解pH C 酶解时间 R 肽得率(%) 1 −1 −1 0 73.85±0.73 2 0 −1 1 68.42±0.30 3 −1 1 0 67.46±0.84 4 −1 0 1 73.67±0.33 5 1 1 0 67.40±2.22 6 1 −1 0 75.21±0.11 7 −1 0 −1 63.45±0.45 8 1 0 −1 67.38±0.79 9 0 0 0 80.20±1.03 10 0 1 −1 51.72±0.72 11 0 0 0 85.46±1.52 12 0 0 0 82.07±1.07 13 0 −1 −1 59.08±1.37 14 1 0 1 77.59±0.47 15 0 1 1 68.57±0.41 16 0 0 0 83.81±1.12 17 0 0 0 85.61±1.63 2.3.1 菜籽饼酶解液的肽得率回归模型的建立与方差分析
利用Design Expert 10软件对结果进行方差分析(表4),对拟合回归方程进行方差分析和显著性检验,将数据进行多元回归拟合,得到菜籽饼酶解液中肽得率(R)的回归方程为:Y=5.83C−0.35AB−0.03AC+1.88BC−1.94A2−10.51B2−10.87C2。由表3可知,该模型P值<0.0001,表明模型拟合效果显著,模型的失拟项P=0.4868>0.05,即失拟不显著,且模型的决定系数R2=0.9747,拟合效果较好,能够很好地反映出菜籽饼酶解液中肽得率与风味蛋白酶加酶量、酶解pH、酶解时间的关系。另外,回归方程的一次项系数绝对值的大小决定了各因素对响应值影响的主次顺序,可看出,酶解时间是影响菜籽饼肽得率的关键因素(P=0.0002),其次为酶解pH(P=0.0132),最后为加酶量(P=0.2022)。
表 4 方差分析及变异系数Table 4. Analysis of variance and coefficient of variation来源模型 平方和 自由度 均方 F值 P值 模型 1421.46 9 157.94 29.92 <0.0001** A加酶量 10.45 1 10.45 1.98 0.2022 B酶解pH 57.28 1 57.28 10.85 0.0132* C酶解时间 271.57 1 271.57 51.45 0.0002** AB 0.50 1 0.50 0.095 0.7664 AC 0.000654 1 0.000654 0.000001239 0.9973 BC 14.13 1 14.13 2.68 0.1459 A2 15.84 1 15.84 3.00 0.1268 B2 465.38 1 465.38 88.18 <0.0001** C2 506.62 1 506.62 95.99 <0.0001** 残差 36.95 7 5.28 失拟项 15.63 3 5.21 0.98 0.4868 纯误差 21.32 4 5.33 所有项 1458.41 16 R2 0.9747 R2Adj 0.9421 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 2.3.2 响应面交互作用分析
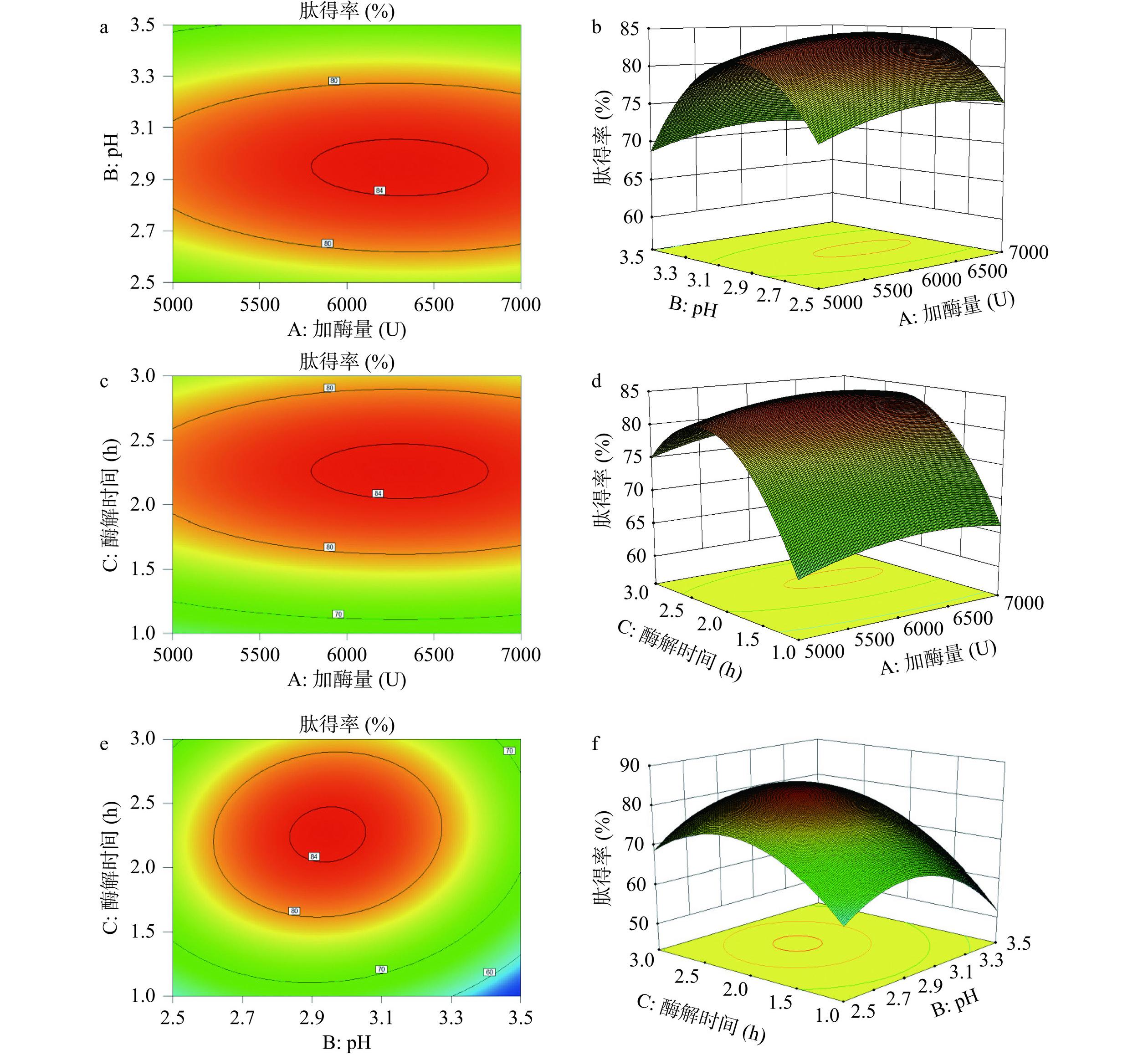
在模型分析的基础上,进一步分析了风味蛋白酶酶解制备菜籽饼活性肽工艺中交互因素对肽得率的影响。如图4所示,模型中交互因素的响应曲面较为陡峭、开口向下,等高线呈椭圆形,菜籽饼活性肽得率随加酶量(A)、酶解pH(B)、酶解时间(C)的增加呈现先升高后降低的趋势,说明在响应曲面上存在最大响应值,模型建立良好;同时风味蛋白酶加酶量、酶解pH及酶解时间三因素之间的交互作用对菜籽饼活性肽得率有显著的影响;结合拟合方程,交互作用AB、AC、BC对菜籽饼的肽得率影响不显著,二次项B2、C2对肽得率影响极显著(P<0.01)。以肽得率最大优化分析得到风味蛋白酶酶解制备菜籽饼活性肽的最佳工艺条件为加酶量6303.861 U/g、酶解pH2.945、酶解时间2.256 h,该条件下肽得率的理论值达84.503%。为验证模型的准确性,考虑实际操作性,将最优工艺条件调整为酶解温度55 ℃、料液比1:20、加酶量6300 U/g,酶解pH2.94,酶解时间2.25 h,进行验证试验,此条件下肽得率为83.28%±2.43%,与模型理论值无显著性差异(P>0.05),说明该响应面模型及最优条件可靠性较高。
2.4 菜籽饼活性肽的分离纯化
2.4.1 菜籽饼酶解液的超滤分离
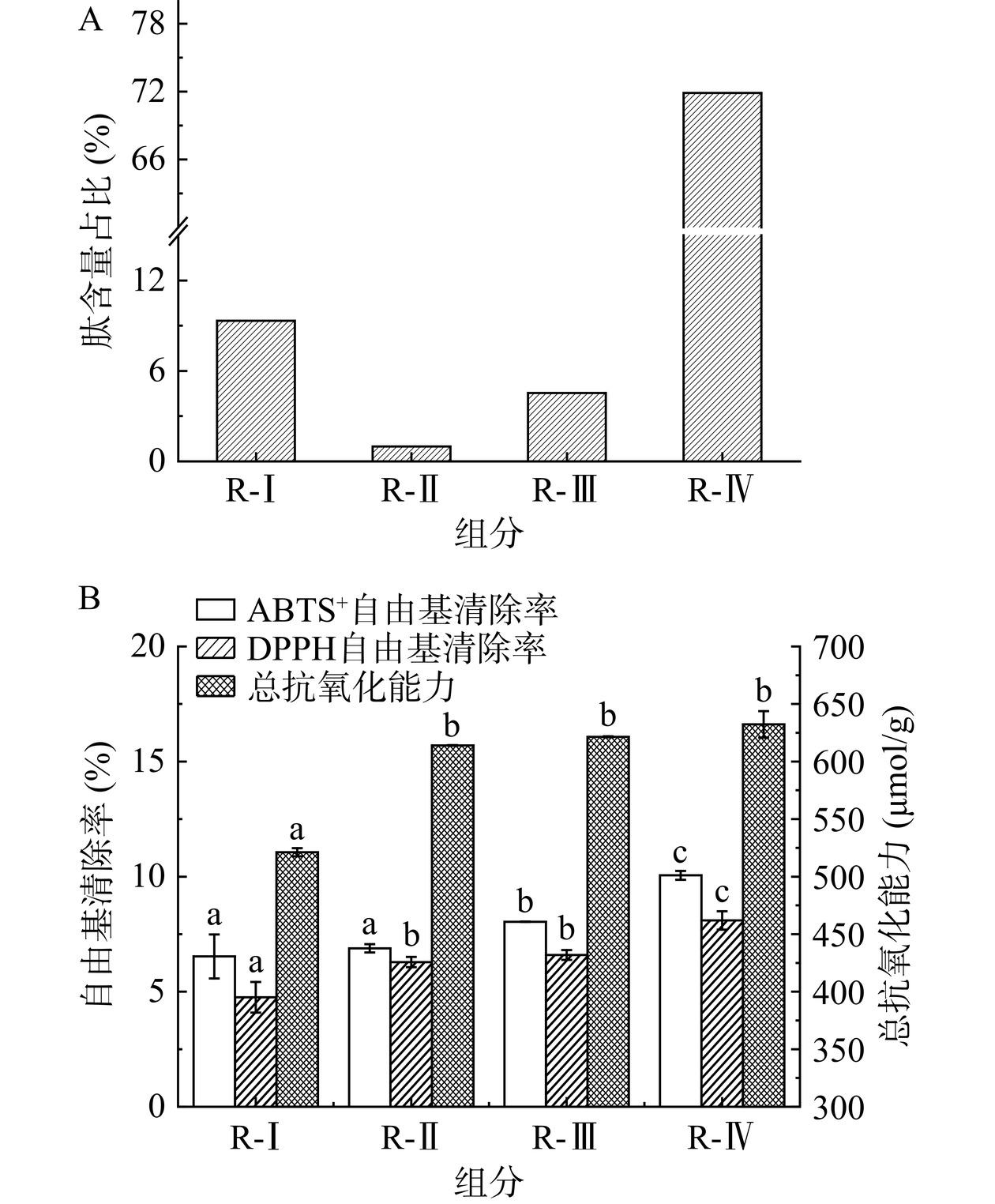
膜分离技术主要根据物质的分子量分布对混合物进行初步分离富集。根据菜籽饼风味蛋白酶酶解产物的分子量,通过5、3和1 kDa四种超滤膜分离产生了R-I(>5 kDa)、R-II(3~5 kDa)、R-III(1~3 kDa)和R-IV(<1 kDa)四个组分,如图5所示,其中R-IV组分占比最高约为71.89%,这可能与风味蛋白酶兼具内切酶和外切酶的属性有关。进一步分别评价各组分的总抗氧化能力和自由基清除率,R-IV(<1 kDa)比其余3个组分具有更高的总抗氧化能力及DPPH、ABTS+自由基清除能力,且菜籽饼酶解产物的抗氧化能力与其分子量成反比,这与张瑞等[32]的研究发现一致,并与亚麻籽粕肽[3]、微藻酶解肽[33]等的抗氧化活性依赖于其分子量的结论相同。因此选择菜籽饼酶解产物中R-IV组分进行凝胶色谱纯化。
2.4.2 菜籽饼活性肽的Sephadex G-15凝胶分离
R-IV组分经Sephadex G-15分离后得到了F1和F2两个组分(图6),分子量的大小为F1>F2。两组分均表现出一定的抗氧化活性,尤其是较好的ABTS+自由基清除能力,在同等浓度条件下,F2组分的ABTS+自由基清除率高达71.62%±0.23%、总抗氧化能力为764.95±44.71 μmol/g、DPPH自由基清除率为6.09%±0.77%,均显著高于F1组分(P<0.05);说明蛋白质水解物抗氧化活性与分子量密切相关,通常低分子量的蛋白质水解物或肽更易与自由基发生反应[4]。此外,组分F1和F2的DPPH自由基清除率均相对较低,这可能与肽的抗氧化活性主要与其氨基酸组成有关[33]。因此选取F2组分进行进一步研究。
2.4.3 菜籽饼抗氧化肽的结构鉴定
低于1 kDa中的F2组分具有较好的抗氧化活性,为进一步确定可能发挥活性的肽段结构,采用LC-MS/MS法鉴定了菜籽饼抗氧化肽段的序列,共得到2932条肽段,其中绝大多数为三肽和五肽,并含18条二肽。依据各肽段得分以及PeptideRanker预测结果>0.5的肽段共有5条,分别为PF、SF、TF、IAIPF、PLDLL,这与以往研究者酶解分离纯化出的WI(L)Y[15]、RNL(I)PY[16]、WDHHAPQLR[8]等菜籽抗氧化肽均不相同,可能与酶的种类及酶解条件有关,具体如表5所示。可以看出,二肽的预测活性较高,说明分子量是影响抗氧化肽活性的关键因素;同时,五条肽的C-末端均含Phe(F)残基或Leu(L)残基,说明肽的抗氧化活性与其氨基酸序列有关。研究表明抗氧化肽一般均含有脯氨酸(P)、亮氨酸(L)、异亮氨酸(I)等疏水性氨基酸,且色氨酸(W)、酪氨酸(Y)和苯丙氨酸(F)等芳香族氨基酸可显著提高肽的抗氧化能力[34−36],这可能是本研究中PF预测活性最高的原因。卢红妍等[37]选择碱性蛋白酶从松仁清蛋白中鉴定出了高抗氧化活性肽段FFPY和YLPF;付媛等[38]采用量子化学计算分析出裸燕麦活性肽FLWGTL的自由基反应活性位点在苯丙氨酸的胺基及亮氨酸的羧基上,活性肽VFNDRL的自由基反应活性位点则在亮氨酸的羧基上。此外,苯丙氨酸(F)为疏水性氨基酸,使得末端为苯丙氨酸的活性肽在脂质-水界面的溶解性增大,从而发挥较好的自由基清除能力,这可能也是本实验中菜籽抗氧化肽具有一定DPPH自由基清除能力的原因。
表 5 菜籽饼抗氧化肽组分的氨基酸序列结构及活性预测Table 5. Amino acid sequence and activity prediction of rapeseed cake antioxidant peptides序号 氨基酸序列 分子质量(Da) 肽段分值 PeptideRanker得分 1 PF 263.14 127.7 0.993 2 SF 253.12 148.1 0.949 3 TF 267.13 132.3 0.827 4 IAIPF 560.34 278.4 0.805 5 PLDLL 570.35 255.2 0.632 3. 结论
菜籽饼蛋白含量丰富、氨基酸组成合理,开发菜籽蛋白活性肽对菜籽饼精深加工的意义重大。本研究采用超微粉碎辅助风味蛋白酶直接酶解制备菜籽饼活性肽,在单因素实验的基础上,结合响应面试验,优化菜籽饼活性肽的最佳制备条件为:菜籽饼低温超微粉碎30 min、酶解pH2.94、加酶量6300 U/g、料液比1:20(20 g/mL)、酶解温度55 ℃、酶解时间2.25 h,该条件下菜籽饼酶解液的肽得率达83.28%,此时水解度为37.2%。菜籽饼酶解液经膜分离、Sephadex G-15凝胶分离纯化后的组分表现出了较好的总抗氧化能力及ABTS+自由基清除能力。利用LC-MS/MS对抗氧化活性最高的组分进行了结构鉴定,并结合活性预测网站,筛选出了PF、SF、TF、IAIPF及PLDLL五条肽段。本研究为直接以菜籽饼为原料制备抗氧化肽提供了一定理论依据。可进一步利用分子对接技术分析筛选出菜籽饼活性肽的潜在生物活性,通过固相合成技术对菜籽饼活性肽段进行化学合成,并验证合成肽的体内外生物活性及作用机制。
-
表 1 响应面试验设计因素与水平
Table 1 Factors and levels of Box-Behnken design
因子 水平 −1 0 1 A加酶量(U/g) 5000 6000 7000 B酶解pH 2.5 3.0 3.5 C酶解时间(h) 1 2 3 表 2 不同粉碎时间下菜籽饼超微粉特征及其蛋白质溶出率
Table 2 Characters and protein dissolution of rapeseed cake powders with different grinding times
粉碎时间(min) D50(μm) Agf(m2/g) 蛋白质溶出率(%) 对照(60目) 165.46±4.59a 0.20±0.006a 26.10±0.21a 5 29.39±1.37b 0.61±0.010b 26.30±0.27a 10 21.27±0.32c 0.69±0.004c 27.44±1.12a 15 21.51±0.52c 0.66±0.008d 29.18±0.20b 20 19.37±0.79cd 0.73±0.018e 29.58±0.93b 30 19.57±0.24cd 0.71±0.005c 33.86±1.21c 40 16.63±0.35d 0.85±0.012f 33.02±0.68c 60 19.26±0.15cd 0.76±0.002g 32.80±1.37c 注:同一指标不同小写字母表示差异显著(P<0.05)。 表 3 Box-Behnken试验设计与结果
Table 3 Design and results of response surface experiment
实验号 A 加酶量 B 酶解pH C 酶解时间 R 肽得率(%) 1 −1 −1 0 73.85±0.73 2 0 −1 1 68.42±0.30 3 −1 1 0 67.46±0.84 4 −1 0 1 73.67±0.33 5 1 1 0 67.40±2.22 6 1 −1 0 75.21±0.11 7 −1 0 −1 63.45±0.45 8 1 0 −1 67.38±0.79 9 0 0 0 80.20±1.03 10 0 1 −1 51.72±0.72 11 0 0 0 85.46±1.52 12 0 0 0 82.07±1.07 13 0 −1 −1 59.08±1.37 14 1 0 1 77.59±0.47 15 0 1 1 68.57±0.41 16 0 0 0 83.81±1.12 17 0 0 0 85.61±1.63 表 4 方差分析及变异系数
Table 4 Analysis of variance and coefficient of variation
来源模型 平方和 自由度 均方 F值 P值 模型 1421.46 9 157.94 29.92 <0.0001** A加酶量 10.45 1 10.45 1.98 0.2022 B酶解pH 57.28 1 57.28 10.85 0.0132* C酶解时间 271.57 1 271.57 51.45 0.0002** AB 0.50 1 0.50 0.095 0.7664 AC 0.000654 1 0.000654 0.000001239 0.9973 BC 14.13 1 14.13 2.68 0.1459 A2 15.84 1 15.84 3.00 0.1268 B2 465.38 1 465.38 88.18 <0.0001** C2 506.62 1 506.62 95.99 <0.0001** 残差 36.95 7 5.28 失拟项 15.63 3 5.21 0.98 0.4868 纯误差 21.32 4 5.33 所有项 1458.41 16 R2 0.9747 R2Adj 0.9421 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 5 菜籽饼抗氧化肽组分的氨基酸序列结构及活性预测
Table 5 Amino acid sequence and activity prediction of rapeseed cake antioxidant peptides
序号 氨基酸序列 分子质量(Da) 肽段分值 PeptideRanker得分 1 PF 263.14 127.7 0.993 2 SF 253.12 148.1 0.949 3 TF 267.13 132.3 0.827 4 IAIPF 560.34 278.4 0.805 5 PLDLL 570.35 255.2 0.632 -
[1] 翟晓娜, 裴海生, 梁亮, 等. 菜籽肽的酶法制备、分离纯化及生物功能特性研究进展[J]. 河南工业大学学报(自然科学版),2022,43(4):128−136. [ZHAI X N, PEI H S, LIANF L, et al. Enzymatic preparation, isolation and biological functions of rapeseed/canola peptides[J]. Journal of Henan University of Technology(Natural Science Edition),2022,43(4):128−136.] ZHAI X N, PEI H S, LIANF L, et al. Enzymatic preparation, isolation and biological functions of rapeseed/canola peptides[J]. Journal of Henan University of Technology(Natural Science Edition), 2022, 43(4): 128−136.
[2] 杨文清, 黄秀芳, 陈耀兵, 等. 植物源生物活性肽的研究进展[J]. 食品安全质量检测学报,2023,14(1):270−278. [YANG W Q, HUANG X F, CHEN Y B, et al. Research progress of plant-derived bioactive peptides[J]. Journal of Food Safety & Quality,2023,14(1):270−278.] YANG W Q, HUANG X F, CHEN Y B, et al. Research progress of plant-derived bioactive peptides[J]. Journal of Food Safety & Quality, 2023, 14(1): 270−278.
[3] 张文敏, 张健, 周浩纯, 等. 亚麻籽粕制备小分子抗氧化活性肽[J]. 食品科学,2020,41(8):36−44. [ZHANG W M, ZHANG J, ZHOU H C, et al. Preparation of small molecular antioxidant peptides form flaxseed meal[J]. Food Science,2020,41(8):36−44.] ZHANG W M, ZHANG J, ZHOU H C, et al. Preparation of small molecular antioxidant peptides form flaxseed meal[J]. Food Science, 2020, 41(8): 36−44.
[4] 梁雪荣, 路振康, 毛晓英, 等. 鹰嘴豆抗氧化肽的分离纯化、鉴定及其抗氧化活性[J]. 食品科学,2023,44(4):209−216. [LIANG X R, LU Z K, MAO X Y, et al. Purification, identification and antioxidant activity of antioxidant peptides from chickpea protein hydrolysate[J]. Food Science,2023,44(4):209−216.] LIANG X R, LU Z K, MAO X Y, et al. Purification, identification and antioxidant activity of antioxidant peptides from chickpea protein hydrolysate[J]. Food Science, 2023, 44(4): 209−216.
[5] 何海艳, 刘梦婷, 杨爱萍, 等. 南瓜籽蛋白源血管紧张素转化酶抑制肽的制备及其降血压活性[J]. 食品科学,2021,42(23):214−220. [HE H Y, LIU M T, YANG A P, et al. Preparation of angiotensin converting enzyme inhibitory peptides from pumpkin seed protein and their antihypertensive activity[J]. Food Science,2021,42(23):214−220.] HE H Y, LIU M T, YANG A P, et al. Preparation of angiotensin converting enzyme inhibitory peptides from pumpkin seed protein and their antihypertensive activity[J]. Food Science, 2021, 42(23): 214−220.
[6] 张双, 韩荣欣, 王欣, 等. 酸枣仁蛋白的不同蛋白酶酶解产物功能特性及抗氧化活性分析[J]. 食品工业科技,2022,43(9):31−39. [ZHANG S, HAN R X, WANG X, et al. Study on the functional properties and antioxidant activities of different enzymatic hydrolysates of Ziziphi Spinosae Semen protein[J]. Science and Technology of Food Industry,2022,43(9):31−39.] ZHANG S, HAN R X, WANG X, et al. Study on the functional properties and antioxidant activities of different enzymatic hydrolysates of Ziziphi Spinosae Semen protein[J]. Science and Technology of Food Industry, 2022, 43(9): 31−39.
[7] CHMIELEWSKA A, KOZOWSKA M, RACHWA D, et al. Canola/rapeseed protein -nutritional value, functionality and food application:a review Canola/rapeseed protein-nutritional value, functionality and food application:A review[J]. Critical Reviews in Food Science and Nutrition,2020,61(22):21.
[8] XU F R, ZHANG J, WANG Z G, et al. Absorption and metabolism of peptide WDHHAPQLR derived from rapeseed protein and inhibition of HUVEC Apoptosis under oxidative stress[J]. Journal of Agricultural & Food Chemistry,2018,66(20):5178−5189.
[9] HE R, WANG Y J, YANG Y J, et al. Rapeseed protein-derived ACE inhibitory peptides LY, RALP and GHS show antioxidant and anti-inflammatory effects on spontaneously hypertensive rats[J]. Journal of Functional Foods,2019,55:211−219. doi: 10.1016/j.jff.2019.02.031
[10] YAMADA Y, IWASAKI M, USUI H, et al. Rapakinin, an anti-hypertensive peptide derived from rapeseed protein, dilates mesenteric artery of spontaneously hypertensive rats via the prostaglandin IP receptor followed by CCK (1) receptor[J]. Peptides,2010,31(5):909−914. doi: 10.1016/j.peptides.2010.02.013
[11] DAROIT D J, BRANDELLI A. In vivo bioactivities of food protein-derived peptides–a current review[J]. Current Opinion in Food Science,2021,39:120−129. doi: 10.1016/j.cofs.2021.01.002
[12] 詹妍, 候若彤, 卢汀, 等. 油菜抗菌肽的分离及抑菌机制的初步研究[J]. 四川大学学报(自然科学版),2009,46(1):245−249. [ZHAN Y, HOU R T, LU T, et al. Isolation of the antifungal peptide from oil-rape (Brassica napus) seed and study on antifungal mechanism[J]. Journal of Sichuan University(Natural Science Edition),2009,46(1):245−249.] ZHAN Y, HOU R T, LU T, et al. Isolation of the antifungal peptide from oil-rape (Brassica napus) seed and study on antifungal mechanism[J]. Journal of Sichuan University(Natural Science Edition), 2009, 46(1): 245−249.
[13] 曾晓波, 吴谋成, 李小定, 等. 菜籽肽对S180肿瘤细胞体外生长影响的研究[J]. 营养学报,2004(3):216−219. [ZENG X B, WU M C, LI X D, et al. Effect of rapeseed peptides on growth of Sarcoma180 cell incubated in vitro[J]. Acta Nutrimenta Sinica,2004(3):216−219.] ZENG X B, WU M C, LI X D, et al. Effect of rapeseed peptides on growth of Sarcoma180 cell incubated in vitro[J]. Acta Nutrimenta Sinica, 2004(3): 216−219.
[14] 王禹程, 李云亮, 杨雪, 等. 菜籽多肽改善小鼠睡眠功效的研究[J]. 粮食与油脂,2017,30(4):57−60. [WANG Y C, LI Y L, YANG X, et al. Research of the effect of rapeseed peptides on improving mice slumber[J]. Cereals & Oils,2017,30(4):57−60.] WANG Y C, LI Y L, YANG X, et al. Research of the effect of rapeseed peptides on improving mice slumber[J]. Cereals & Oils, 2017, 30(4): 57−60.
[15] WANG L F, YANG J H, WANG Y M, et al. Study on antioxidant activity and amino acid analysis of rapeseed protein hydrolysates[J]. International Journal of Food Properties,2016,19(9):1899−1911. doi: 10.1080/10942912.2015.1085397
[16] 章绍兵, 王璋, 许时婴. 利用电喷雾串联质谱测定菜籽抗氧化肽的结构[J]. 河南工业大学学报(自然科学版),2009,30(2):1−4. [ZHANG S B, WANG Z, XU S Y. Structural analysis of rapeseed antioxidant peptides by electrospray ionization-mass spectrometry[J]. Journal of Henan University of Technology (Natural Science Edition),2009,30(2):1−4.] ZHANG S B, WANG Z, XU S Y. Structural analysis of rapeseed antioxidant peptides by electrospray ionization-mass spectrometry[J]. Journal of Henan University of Technology (Natural Science Edition), 2009, 30(2): 1−4.
[17] 吴刚, 邹智鹏, 何荣, 等. 高压、加热预处理菜籽蛋白对其酶解物生物活性的影响[J]. 食品工业科技,2020,41(16):54−59. [WU G, ZOU Z P, HE R, et al. Effect of high pressure and heat pretreatment on the biological activity of rapeseed hydrolysates[J]. Science and Technology of Food Industry,2020,41(16):54−59.] WU G, ZOU Z P, HE R, et al. Effect of high pressure and heat pretreatment on the biological activity of rapeseed hydrolysates[J]. Science and Technology of Food Industry, 2020, 41(16): 54−59.
[18] RUAN S Y, XIONG J, LI Y L, et al. Improvement in enzymolysis efficiency and bioavailability of rapeseed meal protein concentrate by sequential dual frequency ultrasound pretreatment[J]. Process Biochemistry,2021,102:240−249. doi: 10.1016/j.procbio.2021.01.012
[19] BOUKROUFA M, SICAIRE A G, FINE F, et al. Green sonoextraction of protein from oleaginous press rapeseed cake[J]. Molecules,2017,22(1):80. doi: 10.3390/molecules22010080
[20] GAO W J, CHEN F, WANG X, et al. Recent advances in processing food powders by using superfine grinding techniques:A review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):2222−2255. doi: 10.1111/1541-4337.12580
[21] , 中华人民共和国国家卫生和计划生育委员会. GB 5009.5-2016 食品中蛋白质的测定[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission, People's Republic of China. GB 5009.5-2016 Determination of protein in foods[S]. Beijing:Standards Press of China, 2016.] National Health and Family Planning Commission, People's Republic of China. GB 5009.5-2016 Determination of protein in foods[S]. Beijing: Standards Press of China, 2016.
[22] 周艳星, 侯敢, 陈泳诗, 等. 乳制品饮料中蛋白质含量测定方法的比较分析[J]. 食品安全导刊,2021(9):101−103. [ZHOU Y X, HOU G, CHEN Y S, et al. Methods comparative analysis of the content of protein in dairy beverages[J]. China Food Safety Magazine,2021(9):101−103.] ZHOU Y X, HOU G, CHEN Y S, et al. Methods comparative analysis of the content of protein in dairy beverages[J]. China Food Safety Magazine, 2021(9): 101−103.
[23] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005(7):169−171. [LU W, REN G P, SONG J M. Determination of content of peptides in protein hydrolysates[J]. Food Science,2005(7):169−171.] LU W, REN G P, SONG J M. Determination of content of peptides in protein hydrolysates[J]. Food Science, 2005(7): 169−171.
[24] , 中华人民共和国国家卫生和计划生育委员会. GB 5009.235-2016 食品中氨基酸态氮的测定[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission, People's Republic of China. GB 5009.235-2016 Determination of amino acid nitrogen in foods[S]. Beijing:Standards Press of China, 2016.] National Health and Family Planning Commission, People's Republic of China. GB 5009.235-2016 Determination of amino acid nitrogen in foods[S]. Beijing: Standards Press of China, 2016.
[25] LOURDES R F, RICHARD C, CHEN L Y. Sequential alcalase and flavourzyme treatment for preparation of α-amylase, α-glucosidase, and dipeptidyl peptidase (DPP)-IV inhibitory peptides from oat protein[J] Journal of Functional Foods, 2021, 87:104829.
[26] 尹剑, 武瑞赟, 胡锦蓉, 等. 鲟鱼皮中二肽基肽酶-IV抑制肽的分离纯化与鉴定[J]. 食品科学,2022,43(6):195−203. [YIN J, WU R Y, HU J R, et al. Purification and identification of dipeptidyl peptidase IV inhibitory peptide from sturgeon skin collagen[J]. Food Science,2022,43(6):195−203.] YIN J, WU R Y, HU J R, et al. Purification and identification of dipeptidyl peptidase IV inhibitory peptide from sturgeon skin collagen[J]. Food Science, 2022, 43(6): 195−203.
[27] 高瑀珑, 郑锐, 王玉梅, 等. 菜籽分离蛋白分子质量分布及酶解条件的研究[J]. 中国粮油学报,2014,29(6):38−45. [GAO Y L, ZHENG R, WANG Y M, et al. Molecular weight distribution of rapeseed protein isolate and optimization of enzymatic hydrolysis process[J]. Journal of the Chinese Cereals and Oils Association,2014,29(6):38−45.] GAO Y L, ZHENG R, WANG Y M, et al. Molecular weight distribution of rapeseed protein isolate and optimization of enzymatic hydrolysis process[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(6): 38−45.
[28] 于弋涵, 杜伟宁, 胡秋辉, 等. 酶法水解猴头菇多肽的生物活性[J]. 食品科学,2021,42(21):119−127. [YU Y H, DU W N, HU Q H, et al. Bioactivities of peptides derived from Hericium erinaceus proteins by enzymatic hydrolysis[J]. Food Science,2021,42(21):119−127.] YU Y H, DU W N, HU Q H, et al. Bioactivities of peptides derived from Hericium erinaceus proteins by enzymatic hydrolysis[J]. Food Science, 2021, 42(21): 119−127.
[29] CHAROENSIDDHI S, LORBEER A J, LAHNSTEIN J, et al. Enzyme-assisted extraction of carbohydrates from the brown alga Ecklonia radiata:Effect of enzyme type, pH and buffer on sugar yield and molecular weight profiles[J]. Process Biochemistry,2016,51(10):1503−1510. doi: 10.1016/j.procbio.2016.07.014
[30] WANG D Y, ZHANG M H, ZOU Y, et al. Optimization of flavourzyme hydrolysis condition for the preparation of antioxidant peptides from duck meat using response surface methodology[J]. Janpan Poultry Science Association,2018,55(3):217−223. doi: 10.2141/jpsa.0160155
[31] HUNSAKUL K, LAOKULDILOK T, SAKADATORN V, et al. Optimization of enzymatic hydrolysis by alcalase and flavourzyme to enhance the antioxidant properties of Jasmine Rice bran protein hydrolysate[J]. Scientific Reports,2022,12(1):12582. doi: 10.1038/s41598-022-16821-z
[32] 张瑞, 吴彩红, 凡海佳, 等. 发酵菜粕中菜籽小肽分离纯化及其体外抗氧化活性研究[J]. 饲料工业,2014,35(5):28−31. [ZHANG R, WU C H, FAN H J, et al. Studies of isolation, purification and antioxidant activity of rapeseed peptide from solid-state fermentation[J]. Feed Industry,2014,35(5):28−31.] ZHANG R, WU C H, FAN H J, et al. Studies of isolation, purification and antioxidant activity of rapeseed peptide from solid-state fermentation[J]. Feed Industry, 2014, 35(5): 28−31.
[33] PIMENTEL F B, MACHADO M, CERMEO M, et al. Enzyme-assisted release of antioxidant peptides from Porphyra dioica Conchocelis[J]. Antioxidants,2021,10(2):249. doi: 10.3390/antiox10020249
[34] WONG F C, XIAO J B, WANG S Y, et al. Advances on the antioxidant peptides from edible plant sources[J]. Trends in Food Science & Technology,2020,99:44−57.
[35] GIRGIH A T, HE R, MALOMO S, et al. Structural and functional characterization of hemp seed (Cannabis sativa L.) protein-derived antioxidant and antihypertensive peptides[J]. Journal of Functional Foods,2014,6(1):384−394.
[36] 张丰文, 董超, 周丽亚, 等. 抗氧化多肽来源、提取及检测的研究进展[J]. 生物技术,2021,31(1):96−103,64. [ZHANG F W, DONG C, ZHOU L Y, et al. Research progress of antioxidant peptides[J]. Biotechnology,2021,31(1):96−103,64.] ZHANG F W, DONG C, ZHOU L Y, et al. Research progress of antioxidant peptides[J]. Biotechnology, 2021, 31(1): 96−103,64.
[37] 卢红妍, 杨行, 方丽, 等. 松仁清蛋白抗氧化肽的分离纯化及结构鉴定[J]. 食品科学,2019,40(24):40−45. [LU H Y, YANG H, FANG L, et al. Isolation, purification and structural identification of antioxidant peptides derived from enzymatic hydrolysis of pine nut kernel (Pinus koraiensis Sieb. Et Zucc.) albumin[J]. Food Science,2019,40(24):40−45.] LU H Y, YANG H, FANG L, et al. Isolation, purification and structural identification of antioxidant peptides derived from enzymatic hydrolysis of pine nut kernel (Pinus koraiensis Sieb. Et Zucc.) albumin[J]. Food Science, 2019, 40(24): 40−45.
[38] 付媛, 张美莉, 张宇, 等. 基于量子化学计算分析裸燕麦源两种活性肽抗氧化机理[J]. 食品科学,2022,43(23):106−112. [FU Y, ZHANG M L, ZHANG Y, et al. Quantum chemical calculation for the antioxidant mechanism of two peptides form naked oat[J]. Food Science,2022,43(23):106−112.] doi: 10.7506/spkx1002-6630-20211202-013 FU Y, ZHANG M L, ZHANG Y, et al. Quantum chemical calculation for the antioxidant mechanism of two peptides form naked oat[J]. Food Science, 2022, 43(23): 106−112. doi: 10.7506/spkx1002-6630-20211202-013





 下载:
下载:
 下载:
下载:



