Effect and Comprehensive Evaluation of Hot Air Circulation Heating on the Active Substances and Antioxidant Function of Three Types of Radish Sprouts
-
摘要: 为探究热风循环加热对萝卜苗中功能价值影响,本研究以红、青、白三种萝卜苗为研究对象,采用不同温度和时间热风循环加热,分析总酚、花青素、总酚酸、类黄酮、VC和硫代葡萄糖苷等活性物质和DPPH自由基清除能力、还原能力等抗氧化活性变化,并以优劣解距离法为依据进行综合评价。结果表明,低温短时(60 ℃,30 s)热风循环加热对白萝卜苗的花青素和VC含量保留率的积极影响最大,保留率达到77.8%、85.3%,同时,低温短时(60 ℃,30 s)热风循环加热对青、白萝卜苗总酚酸保留率达到99.3%、82.5%,这对两种萝卜苗活性物质含量保留具有积极作用。此外,实验组(100 ℃,60 s)对萝卜苗的总酚、类黄酮、硫代葡萄糖苷含量的提高都有一定的积极影响,而综合评价显示短时热风循环加热(60 ℃,30 s)是保持三种萝卜苗功能价值和抗氧化活性的最佳热风循环加热条件。本实验为热风循环加热芽苗菜的深入研究提供了理论依据和数据支持。Abstract: In order to explore the effect of hot air circulation heating on the functional value of radish sprouts, red, green, and white radish sprouts were used as the research subjects in this study. Different temperature and time of hot air circulation heating were used to analyze the changes in active substances such as total phenolic substances, anthocyanins, total phenolic acids, flavonoids, VC, and glucosinolates, as well as the antioxidant activity changes such as DPPH free radical scavenging ability and reducing ability. A comprehensive evaluation was conducted based on the distance method of superior and inferior solutions. The results showed that low-temperature short-term (60 ℃ for 30 s) hot air circulation heating had the greatest positive effect on the retention rate of anthocyanins and VC content in white radish sprouts, with retention rates reaching 77.8% and 85.3%, respectively. At the same time, the retention rates of total phenolic acids in green and white radish sprouts were 99.3% and 82.5% by short-term (60 ℃ for 30 s) hot air circulation heating at low temperature, which had a positive effect on the retention of active substance content in the two types of radish sprouts. In addition, the experimental group (100 ℃ for 60 s) had a certain positive effect on the increase of total phenolic substances, flavonoids, and glucosinolates content in radish sprouts. Moreover, comprehensive evaluation found that short-term hot air circulation heating (60 ℃ for 30 s) was the best heating condition for maintaining the functional value and antioxidant activity of the three types of radish sprouts. This experiment provided theoretical basis and data support for the in-depth study of hot air circulation heating of sprouts.
-
萝卜(Raphanus sativus L.)芽苗菜是常见的一种十字花科芽苗菜,由萝卜种子在适宜条件下发芽形成的肥嫩幼苗[1]。萝卜苗生长周期短,最佳种植周期一般为7~10 d,在收获之前仍然保持生长状态,是有名的“活体蔬菜”[2]。萝卜苗营养成分丰富,富含酚类化合物、类黄酮、VC、硫代葡萄糖苷等活性物质及多种维生素、矿物质和硫化物,有助于中和自由基,减轻氧化应激对细胞的损害;激活抗氧化和解毒酶,减少有害物质对身体的影响;可能有助于铁的吸收,从而改善贫血问题等[3−5]。萝卜苗作为营养丰富、品质优良、无污染的绿色健康蔬菜,适当烹饪后,口感脆嫩、风味独特,容易消化[6],因此受到广大消费者的喜爱。
芽苗菜质地嫩脆、柔软和多汁,适当的热加工可以提高芽苗菜的口感和风味,同时也可以提高其杀菌效果,过度的加工可能会导致营养流失[7]。芽苗菜在加热过程中易受到热量的影响,导致质量损失,探究在加热过程中如何减少质量损失,保持蔬菜的颜色、口感、营养成分和香味,一直是关注的重点。研究发现,传统热加工中,蔬菜中的活性物质60%以上都是损失到加热介质中,如水煮、爆炒等方式[8−9]。因此,蔬菜非水油接触加热技术越来越成为人们加工蔬菜的选择,旨在保留蔬菜的营养价值、改善口感,以满足消费者对更方便、更健康、更美味的食品的需求,比如微波加热技术[10]、快速热加工技术[11]、热风循环加热[12]等技术,也逐步应用在芽苗菜中。其中,热风循环加热(Hot air circulation heating,HACH)是通过将热空气在加热室内循环流动,使蔬菜表面和内部受到均匀的加热,可通过控制加热参数(温度、风速等)以实现最佳的加热效果[12],同时,与传统热加工烹饪方式相比,HACH技术可提高蔬菜的加工效率、保持品质和延长货架寿命,具有加热速度快、热效率高、受热均匀、卫生无油烟,能有效改善食品品质等特点[12]。目前HACH对萝卜苗等芽苗菜的功能活性物质的影响研究较少。
因此,本研究采取HACH不同温度和时间对红、青、白三种萝卜苗进行处理,探究对萝卜苗中总酚、类黄酮、花青素、总酚酸、VC、硫代葡萄糖苷等活性物质和抗氧化功能的影响,并通过优劣解距离法(Technique for order preference by similarity to an ideal solution,TOPSIS)进行综合评价分析,以期获得适合萝卜苗的最佳HACH工艺,为芽苗菜精深加工提供科学理论指导。
1. 材料与方法
1.1 材料与仪器
萝卜苗种子 山东寿禾种业;矢车菊素-3-O-葡萄糖苷 优级纯,成都植标化纯生物技术有限公司;芦丁(优级纯)、黑芥子苷(优级纯)、咖啡酸(优级纯)、氯化钯(分析纯)、2,6-二氯靛酚(分析纯) 合肥博美生物科技有限公司;抗坏血酸、福林酚 分析纯,国药集团化学试剂有限公司;没食子酸、无水乙醇、羧甲基纤维素钠、十二烷基硫酸钠 分析纯,天津市大茂化学试剂厂。
PGX-350C恒温光照培养箱 宁波海曙赛福实验仪器厂;HBD-7001H UKOEO烤箱 珠海家宝德科技有限公司;IKA A11 basic研磨机 艾卡(广州)仪器设备有限公司;TU-1810PC紫外可见分光光度计 上海精密科学仪器有限公司;SN-QX-300超声波清洗机 上海尚普仪设备有限公司;RS-RDV1恒温振荡器 苏州捷美电子有限公司。
1.2 实验方法
1.2.1 萝卜苗培养
取红、青、白三种萝卜苗种子(寿禾种业,改良新一代萝卜苗青菜),挑选的种子需色泽圆润、质量上乘、无霉变。分两批次种植,每批次各萝卜苗种子约100 g。将萝卜苗种子淘洗三次后,清洗干净,之后用蒸馏水浸泡5 h,浸泡后再将种子淘洗2~3遍。将浸泡后的种子均匀撒在铺有四层纱布的育苗盘(40 cm×30 cm)中,光照强度100 mmol/m2·s,光照时间16 h/8 h(昼/夜),温度25±1 ℃,相对湿度70%~80%,早中晚各三次喷洒适量的蒸馏水,前3 d避光催芽,后4 d光照时间16 h/8 h(昼/夜),7 d种植完成,得到新鲜萝卜苗[4,13]。
1.2.2 HACH处理萝卜苗
将新鲜采摘的红、青、白三种萝卜苗均匀分成若干组,每组萝卜苗约100 g。分别设计对照组(新鲜萝卜苗),实验组(加热温度60、100、140 ℃,时间30、60 s)。热风循环加热烤箱在达到设置温度10 min后,将实验组三种萝卜苗分别均匀铺洒在铺有锡纸的烤盘内,将烤盘置于热风循环加热烤箱内部,按照设置的时间(30、60 s)进行HACH处理。将处理后的样品立即在液氮下研磨成粉,分装入离心管中冷冻(−20 ℃)保存备用。
1.2.3 功能活性物质的测定
1.2.3.1 总酚测定
准确称取5 g萝卜苗粉末置于50 mL离心管中,加入95%乙醇溶液10 mL,超声30 min,溶解。以3000 r/min转速离心10 min,取其上清液,吸取1 mL样品溶液置于50 mL离心管中,加入10 mL蒸馏水,再分别加入1 mL福林酚显色剂及3 mL 0.7 mol/L Na2CO3溶液,混匀,于40 ℃水浴锅中水浴反应30 min,静置冷却10~15 min。以没食子酸为标准溶液制作标准曲线。在765 nm下测定吸光度,结果以每克鲜重样品中含有的没食子酸含量(GAE)表示:mg/g(鲜重)[13]。
1.2.3.2 类黄酮测定
准确称取5 g萝卜苗粉末置于50 mL离心管中,加入30 mL 60%乙醇溶液,超声30 min,用60%乙醇溶液定容至50 mL容量瓶中。之后再将样液倒入50 mL离心管,并以3000 r/min转速离心10 min。取上清液1 mL于15 mL试管中,加入60%乙醇溶液至5 mL,加入5%亚硝酸钠溶液0.3 mL,混匀,静置8 min;再加入10%氯化铝溶液0.3 mL,摇匀,静置10 min;加入4%氢氧化钠溶液4 mL,用60%乙醇溶液定容至刻度,摇匀,静置10 min。以未加氢氧化钠试剂的溶液为空白参比溶液。在510 nm处测定吸光度,以芦丁作为标准溶液制作标准曲线,将测得的吸光度带入标准曲线计算类黄酮含量,结果以mg/g(鲜重)表示[14]。
1.2.3.3 花青素测定
准确称取矢车菊素-3-O-葡萄糖苷1.08 mg,用甲醇溶解并定容至10 mL,得到108 μg/mL的矢车菊素-3-O-葡萄糖苷标准溶液。准确称取0.2 g样品粉末加入20 mL 0.1 mol/L的盐酸乙醇溶液制成提取液,取10 mL提取液置于试管中并在60 ℃水浴锅中浸提30 min。向试管中再加入5 mL提取液于60 ℃水浴锅中浸提15 min,将浸提液倒入25 mL容量瓶并用0.1 mol/L盐酸乙醇溶液定容至刻度。以0.1 mol/L盐酸乙醇溶液为空白参比溶液。在530 nm处测定吸光度,以矢车菊-3-O-葡萄糖苷作为标准溶液制作标准曲线,将测得的吸光度带入标准曲线计算花青素含量,结果以mg/g(鲜重)表示[13]。
1.2.3.4 总酚酸测定
准确称取2 g萝卜苗粉末置于50 mL离心管中,加20 mL PBS(磷酸缓冲溶液,pH7.4),室温振荡1 h,3000 r/min离心15 min,取上清液。之后移取样品溶液0.2 mL于25 mL容量瓶中,加0.3%十二烷基硫酸钠溶液2 mL,0.6%三氯化铁-0.9%铁氰化钾混合溶液(v:v=1:1)1 mL,混匀,暗处放置5 min,用0.1 mol/L盐酸定容,避光放置20 min。在736 nm波长处测定吸光度。以咖啡酸制作标准曲线,结果以mg/g(鲜重)表示[13]。
1.2.3.5 VC测定
参照屠晶等[15]的方法,使用2,6-二氯靛酚滴定法进行测定,结果以mg/g(鲜重)表示。
1.2.3.6 硫代葡萄糖苷测定
参照Sun等[16]的方法,准确称取萝卜苗粉末2 g置于50 mL离心管中,加20 mL PBS(磷酸缓冲溶液,pH7.4),室温振荡1 h,3000 r/min离心15 min,取上清液。并移取样品溶液0.2 mL,加入质量分数0.15%的羧甲基纤维素钠溶液0.4 mL,摇匀后再加入0.2 mL 8 mmol/L的氯化钯显色溶液,暗处放置2 h,在540 nm波长处以氯化钯羧甲基纤维素钠空白溶液作为参比溶液,测定其吸光度,以黑芥子硫苷酸钾制作标准曲线,结果以mg/g(鲜重)表示。
1.2.4 抗氧化性的测定
1.2.4.1 DPPH自由基清除能力测定
准确称取1.0 g萝卜苗粉末于50 mL离心管中,加入40 mL 60%的乙醇溶液在60 ℃超声清洗仪中超声30 min,取出后在7500 r/min条件下离心3 min,取上清液备用。取2 mL样品溶液加入2 mL DPPH溶液,混匀,室温放置30 min。在518 nm处测定吸光度[17]。
清除率(%)=(1−A1−A2A0)×100 式中:A0为DPPH溶液加入无水乙醇的吸光度;A1为DPPH溶液加入样品溶液的吸光度;A2为样品溶液加入无水乙醇的吸光度。
1.2.4.2 还原能力测定
准确称取0.5 g萝卜苗粉末置于15 mL离心管中,向离心管中分别加入2.5 mL 0.2 mol/L pH6.6的磷酸缓冲液和2.5 mL 1%铁氰化钾溶液,混合均匀后于50 ℃水浴锅中反应30 min。取出后加入2.5 mL 10%三氯乙酸溶液终止反应,5000 r/min离心10 min。取上清液2.5 mL于试管中,加入2.5 mL蒸馏水和0.5 mL 0.1%的FeCl3溶液,混匀后静置10 min,在700 nm处测定吸光度[17]。
还原能力(%)=(1−A空白A样品)×100 式中:A空白为未加样品的提取液的吸光度;A样品为样品溶液的吸光度。
1.2.5 TOPSIS法
本研究中,首先确定评价指标,以三种萝卜苗的总酚、花青素、总酚酸、类黄酮、VC、硫代葡萄糖苷、DPPH自由基清除能力、还原能力作为评价指标,并以上述指标在经过HACH处理后的结果数据制作初始化矩阵,然后将初始化矩阵归一化,找出各方案的正负理想解(即最优方案和最劣方案),最后计算各评价指标与最差值的接近程度并排序,以此作为评价各方案优劣的依据,因本研究中各指标之间权重不分大小,故权重矩阵设置为单位矩阵[18−19]。
1.3 数据处理
采用SPSS 26.0软件进行数据分析,结果均表示为平均值±标准偏差,应用Origin 2022进行图形绘制,每组实验重复3次,不同小写字母表示差异显著(P<0.05)。
2. 结果与分析
2.1 HACH处理对萝卜苗功能活性物质的影响
2.1.1 总酚
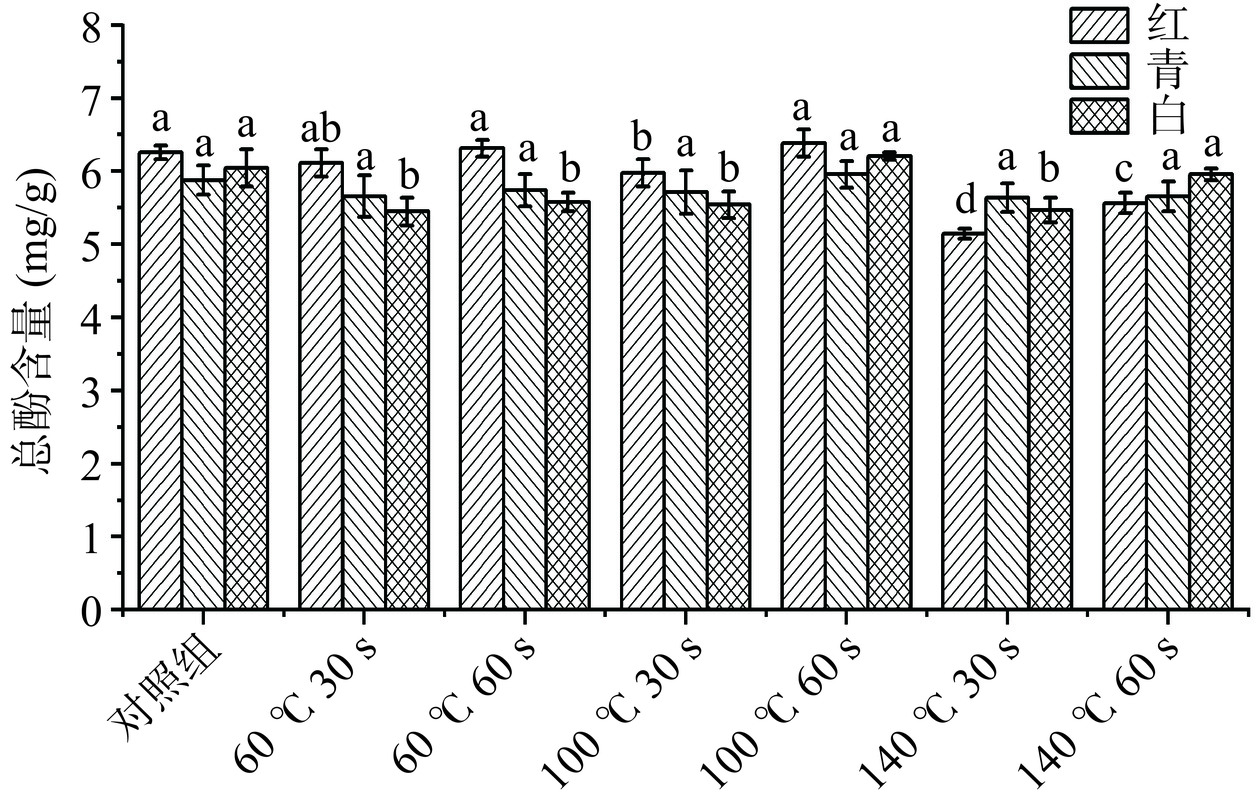
图1为经过不同HACH温度和时间处理后三种萝卜苗中总酚含量的变化情况。随着烤箱温度的上升和热风循环加热时间的延长,三种萝卜苗中总酚含量都有一定程度的减少,实验组(140 ℃,30 s)中红萝卜苗的总酚含量减少最显著(P<0.05)。实验组(100 ℃,60 s)三种萝卜苗的总酚含量和对照组相比,不存在显著损失,这可能是因为电热风烤箱的特殊加热原理,在短时间HACH处理过程中,萝卜苗不和加热介质接触,从而使总酚含量损失减少,同时热处理破坏了萝卜苗的植物组织,促进了多酚类物质的释放,形成游离的酚类物质[20]。但随着HACH温度的升高以及处理时间的延长,一部分酚类物质发生热降解或者发生氧化反应,因此导致总酚含量下降,这与Uchida等[20]的研究发现相似。结果表明,萝卜苗HACH过程中温度100 ℃,时间60 s,萝卜苗的总酚含量损失较少,热风循环加热效果最好。
2.1.2 类黄酮
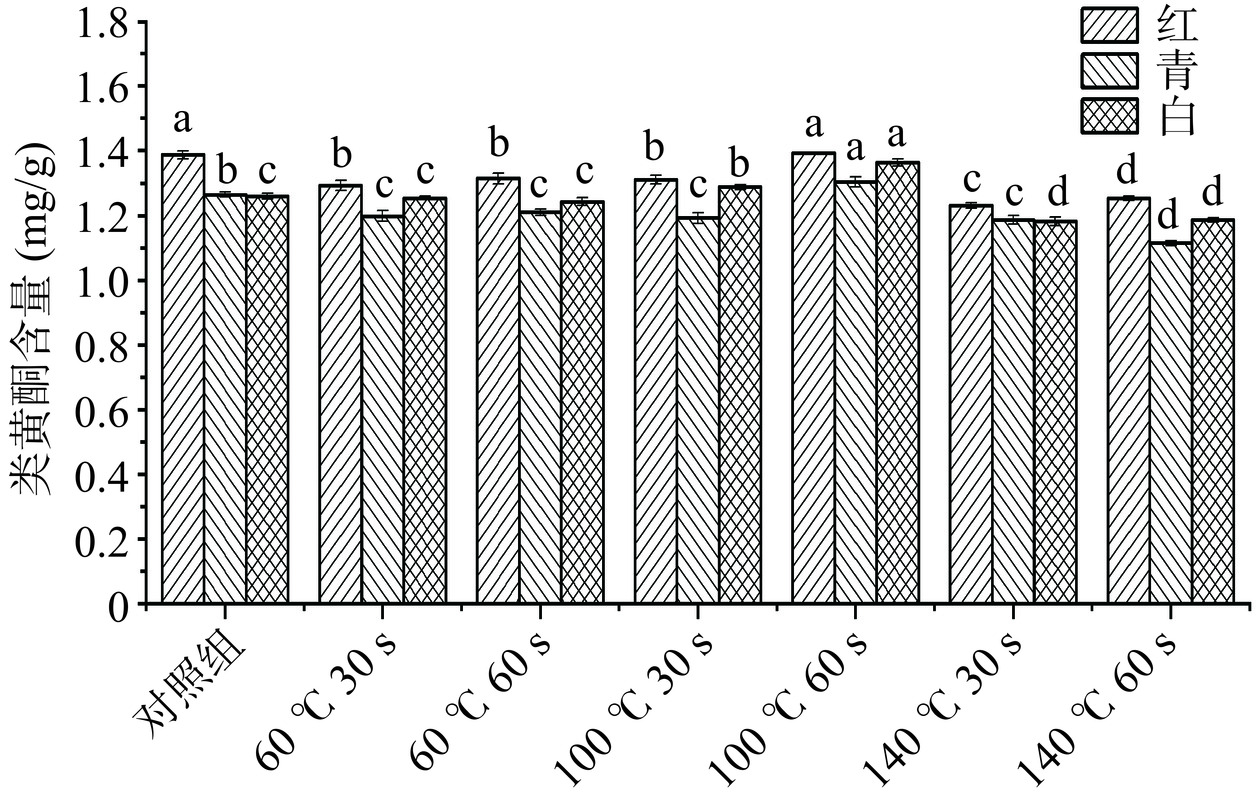
图2是三种萝卜苗在经过不同HACH处理后的类黄酮含量变化情况。研究结果发现,相对于对照组,三种萝卜苗经过HACH处理后类黄酮基本处于减少的趋势,但随着加热温度的升高和时间的延长,会导致萝卜苗细胞壁破裂,使水溶性类黄酮流出[21−22],导致三种萝卜苗在实验组(100 ℃,60 s) HACH条件下,类黄酮含量相较于空白对照组有一定程度的上升。但随着温度过高(140 ℃),三种萝卜苗细胞破损严重,导致水溶性类黄酮流失严重,实验组(140 ℃,60 s)三种萝卜苗的类黄酮含量显著降低(P<0.05),因此随着烤箱温度的上升,类黄酮含量显著下降(P<0.05)。因此,家庭HACH处理萝卜苗时,为最大程度保留类黄酮含量,应选择加热温度100 ℃,加热时间60 s。
2.1.3 花青素
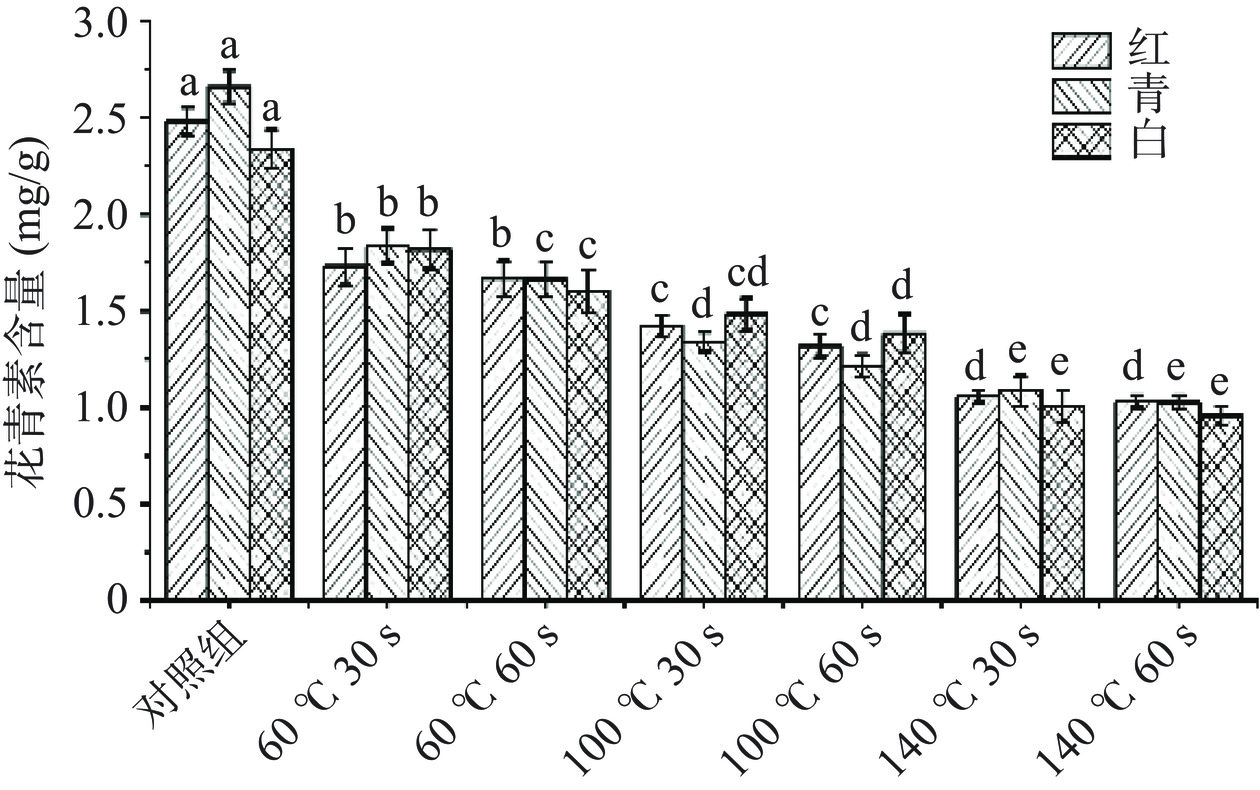
图3是不同HACH处理后三种萝卜苗的花青素含量变化情况。随着HACH温度增加和时间延长,三种萝卜苗的花青素含量呈显著下降趋势,且各处理之间存在显著性差异(P<0.05)。与对照相比,白萝卜苗的花青素含量在加热时间60 s时,三个温度下分别下降了31.5%、40.8%、59.1%,这可能是由于在HACH过程中,萝卜苗中含有的酶活性升高,水分挥发,促使花青素氧化分解,这与王璐等[23]的研究发现相符。因此,为保证减少萝卜苗中花青素含量的损失,家庭HACH处理萝卜苗时,应缩短时间,降低烤箱的加热温度,以维持萝卜苗的花青素含量。
2.1.4 总酚酸
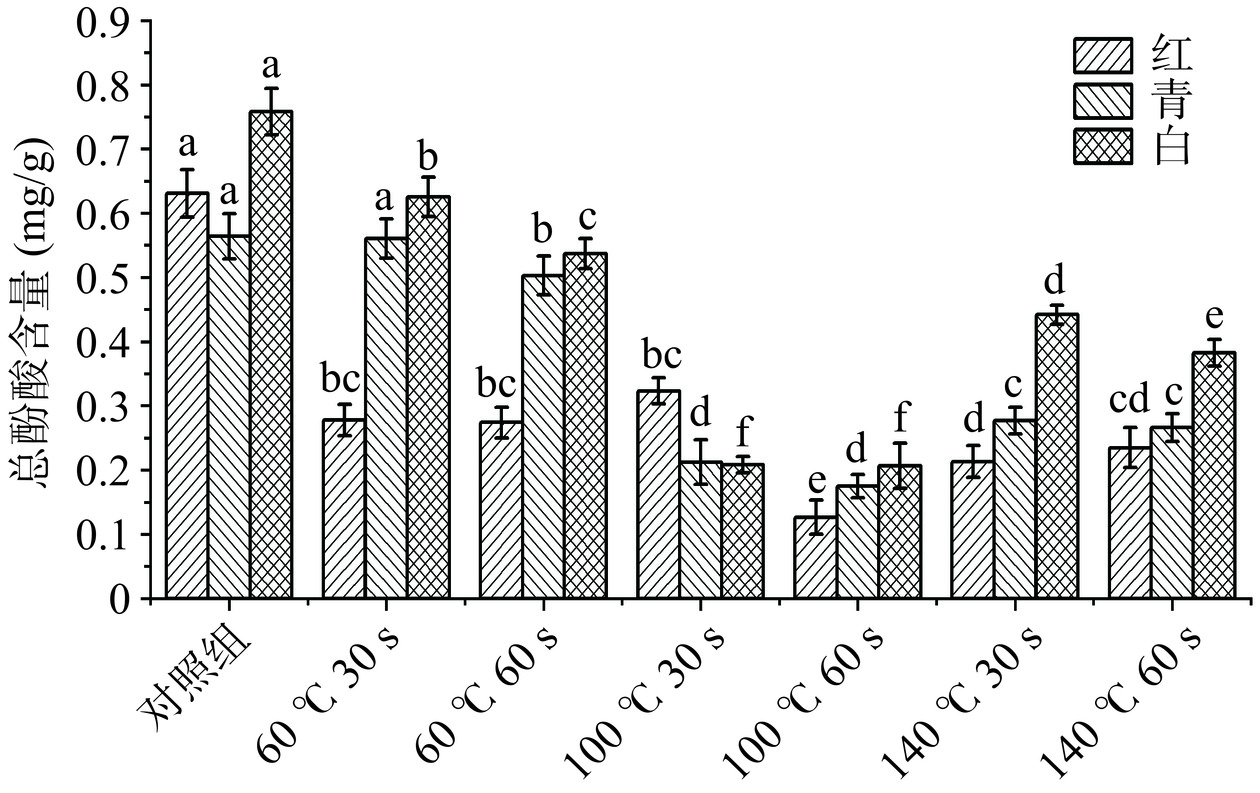
图4是红、青、白三种萝卜苗在经过不同HACH温度和时间处理后的总酚酸含量的变化情况。经过HACH处理,三种萝卜苗中总酚酸含量出现了显著降低,其中实验组(100 ℃,60 s)三种萝卜苗的总酚酸含量减少最明显,分别减少了80%、69%、72.8%(P<0.05),这是HACH过程烤箱温度过高,加热时间过长,导致萝卜苗植物组织破坏严重,萝卜苗中水分溶出,多酚类物质出现损失引起的[24]。而在140 ℃下处理发现总酚酸有小幅度上升,推测在此温度下,一些结合态酚酸逐渐分解为游离态酚酸[24],因此HACH处理条件下,烤箱温度100 ℃时间60 s,萝卜苗的总酚酸含量保留效果不佳。
2.1.5 VC
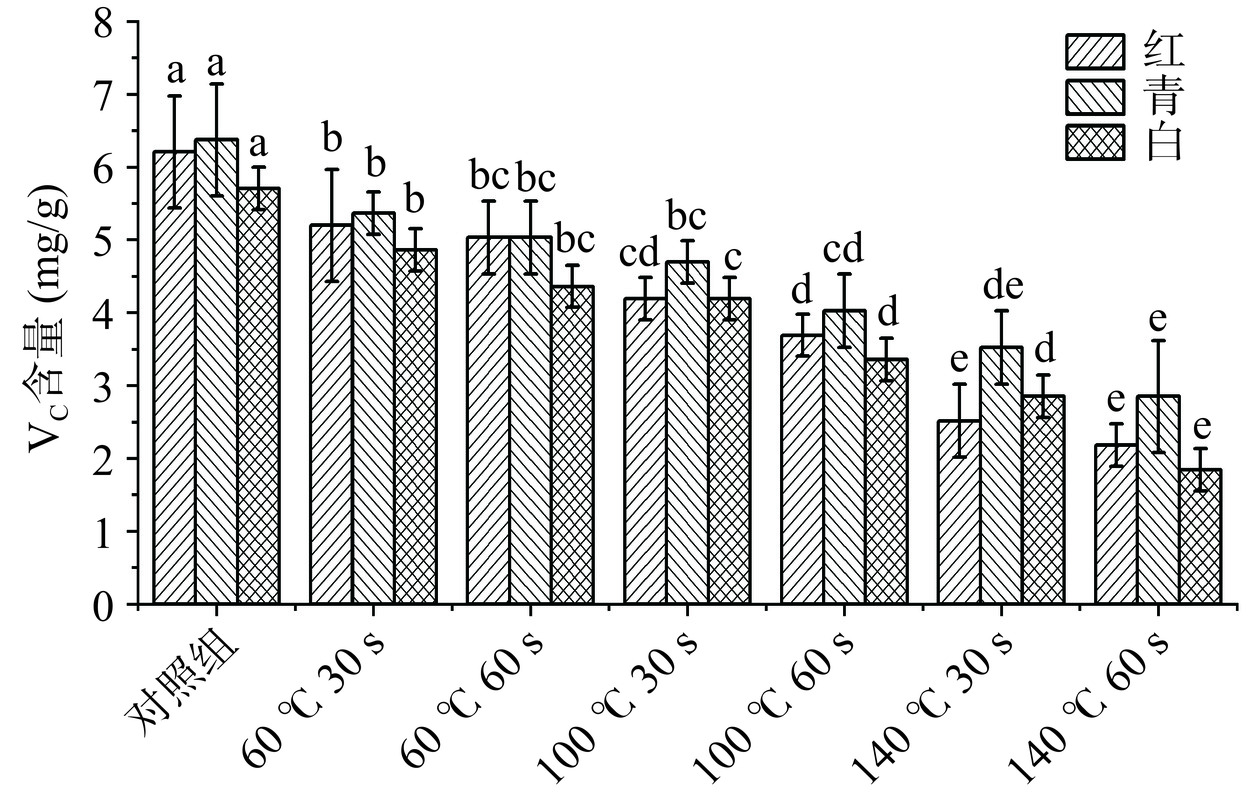
图5是三种萝卜苗在不同HACH处理后的VC含量。三种萝卜苗中VC含量随着处理温度上升呈现明显下降趋势,同时,也随着处理时间的延长呈现下降的情况,与新鲜萝卜苗相比较,140 ℃ 60 s处理下红、青、白萝卜苗的VC含量分别减少了64.8%、55.3%、68.4%(P<0.05)。VC是人体必需的且极易缺失的水溶性维生素,日常饮食90%以上VC都来源于蔬菜和水果。由于VC水溶性的特点,其受热不稳定,导致萝卜苗中VC含量受到高温分解造成严重损失[25]。因此,日常食用萝卜苗,为最大保留萝卜苗中VC的含量,减少烹饪对VC的损耗率,应降低HACH温度和时长,以60 ℃ 30 s HACH处理为宜。
2.1.6 硫代葡萄糖苷
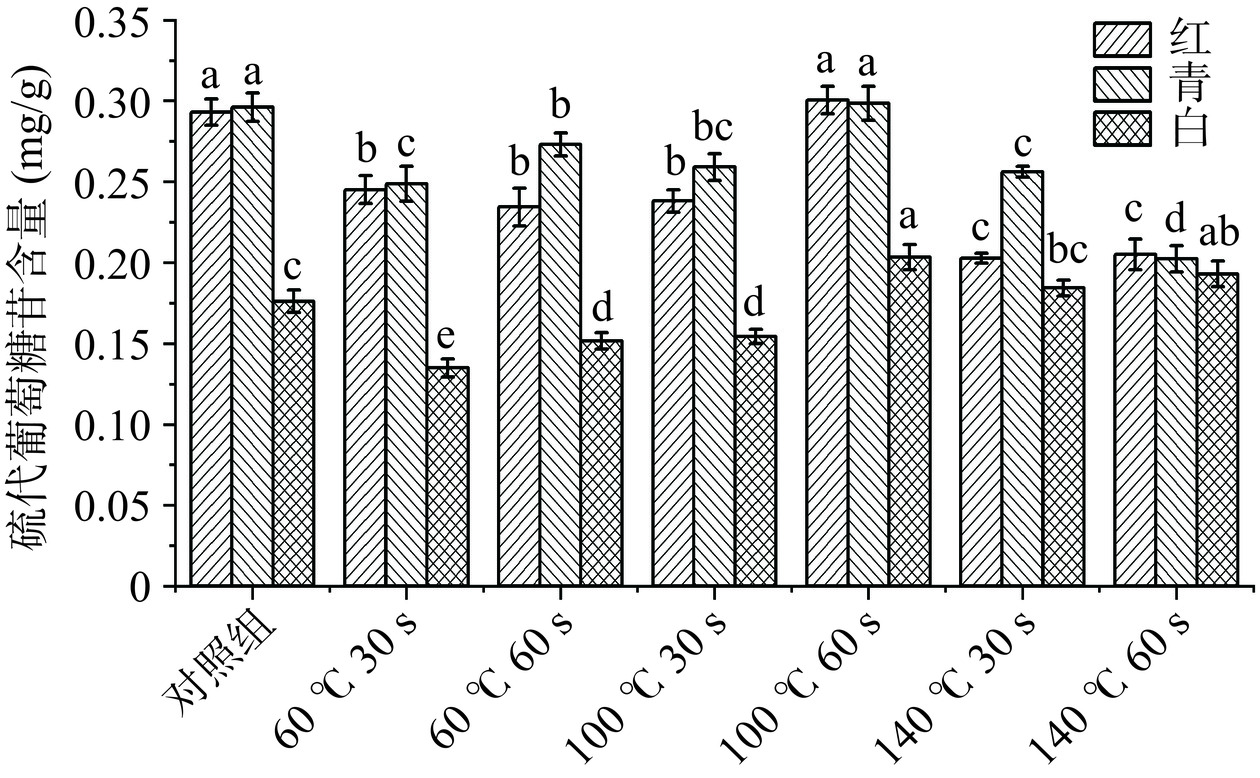
图6是经过不同HACH温度及时间处理后三种萝卜苗的硫代葡萄糖苷含量变化情况。硫代葡萄糖苷是十字花科蔬菜中特有的一类次生代谢产物,当植物组织受到损伤时,如切割、咀嚼等,硫代葡萄糖苷才会与芥子酶接触而分解,而芥子酶在高温下会失活[26]。三种萝卜苗中,红、青两种萝卜苗中硫代葡萄糖苷在对照组中含量最高。在30 s加工时间下,随着处理温度的增加,红萝卜苗的硫代葡萄糖苷含量处于下降趋势,青萝卜苗(100 ℃)的含量与其他温度处理组之间无显著差异(P>0.05),白萝卜苗组则是持续上升;60 s加工时间下,三种萝卜苗均是下降(60 ℃)后有上升(100 ℃),又下降(140 ℃)。在实验组(140 ℃,60 s)红、青两种萝卜苗的硫代葡萄糖苷含量降低最显著,分别减少了30%、31.8%(P<0.05)。实验组(60 ℃,30 s)中白萝卜苗的硫代葡萄糖苷含量减少最明显,降低了30.1%。这是由于硫代葡萄糖苷能溶于水,在HACH过程中,萝卜苗中水分受热流出,从而硫代葡萄糖苷随水分流出造成损失,这一结果与何湘漪等[26]的研究发现相符。同时,实验组(100 ℃,60 s)三种萝卜苗的硫代葡萄糖苷含量有所上升,这可能是由于萝卜苗在经短时热处理时,烤箱内部热量传递到萝卜苗内部,导致芥子酶活性丧失,从而使萝卜苗的硫代葡萄糖苷含量略有升高。结果表明,热风循环加热过程中,能够较好保留萝卜苗的硫代葡萄糖苷含量的HACH温度及时间是100 ℃及60 s。
2.2 HACH处理对萝卜苗抗氧化能力的影响
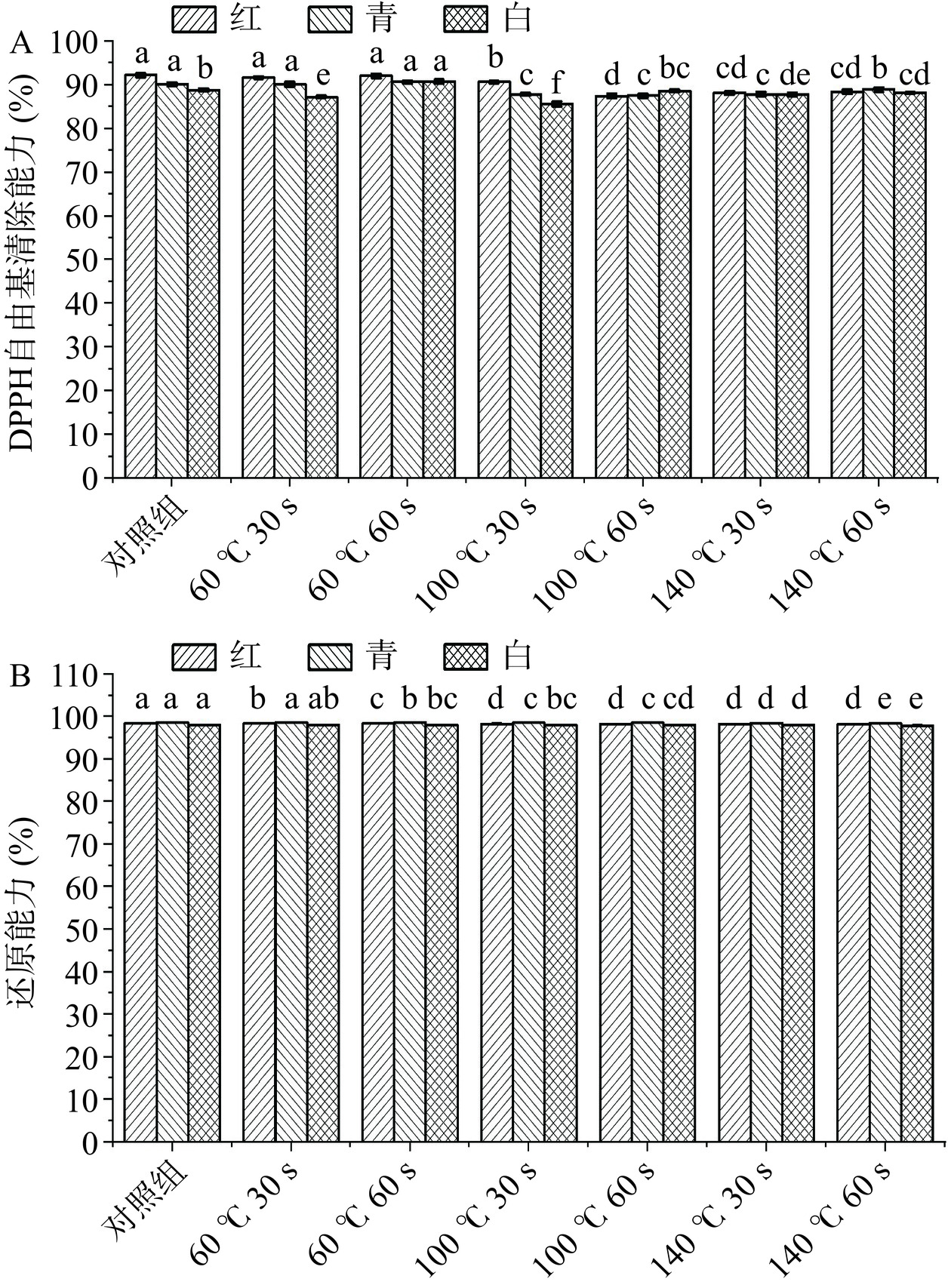
图7是红、青、白三种萝卜苗在经过不同HACH温度及热风循环加热时间处理后的抗氧化能力的变化情况。由图7A可知,实验组(60 ℃,60 s)三种萝卜苗的DPPH自由基清除能力最高,特别是白萝卜苗,甚至比新鲜苗显著增强(P<0.05)。这可能是白萝卜苗在60 ℃ 60 s处理下,内部植物组织发生热降解,具有抗氧化能力的新化合物形成;同时,氧化酶在高温下丧失活性,从而导致白萝卜苗抗氧化活性提高[27]。而随着热风循环加热温度越来越高,萝卜苗的DPPH自由基清除能力呈显著下降趋势(P<0.05),其中实验组(100 ℃,30 s)青、白萝卜苗的DPPH自由基清除能力下降最明显,分别下降了2.34%、3.22%。另外,红、青、白三种萝卜苗表现稍有不一,青、白萝卜苗在加热100 ℃ 30 s结果表现最差,而红萝卜苗则是100 ℃ 60 s。总的来看,HACH温度60 ℃、时间60 s是最佳HACH条件,此时萝卜苗的DPPH自由基清除能力最好。
图7B是不同HACH条件处理后三种萝卜苗的还原能力变化情况。随着HACH温度的提高以及HACH时间延长,三种萝卜苗的还原能力都有一定程度的降低,与对照组相比,实验组(140 ℃,60 s)三种萝卜苗的还原能力分别降低了0.13%、0.15%、0.19%,呈显著性差异(P<0.05)。这是由于低温短时HACH过程中,萝卜苗中的部分游离酚与其他物质反应结合形成结合酚,而结合酚的还原能力较强,但随着温度提高和时间延长,酚类物质减少,进而导致萝卜苗还原能力的降低[28]。因此,随着HACH温度提高、作用时间延长,萝卜苗的还原能力呈现一定程度的下降趋势。而低温短时HACH条件(60 ℃,30 s)时,萝卜苗还原能力的保留率最好。
2.3 HACH处理对萝卜苗功能价值的综合评价
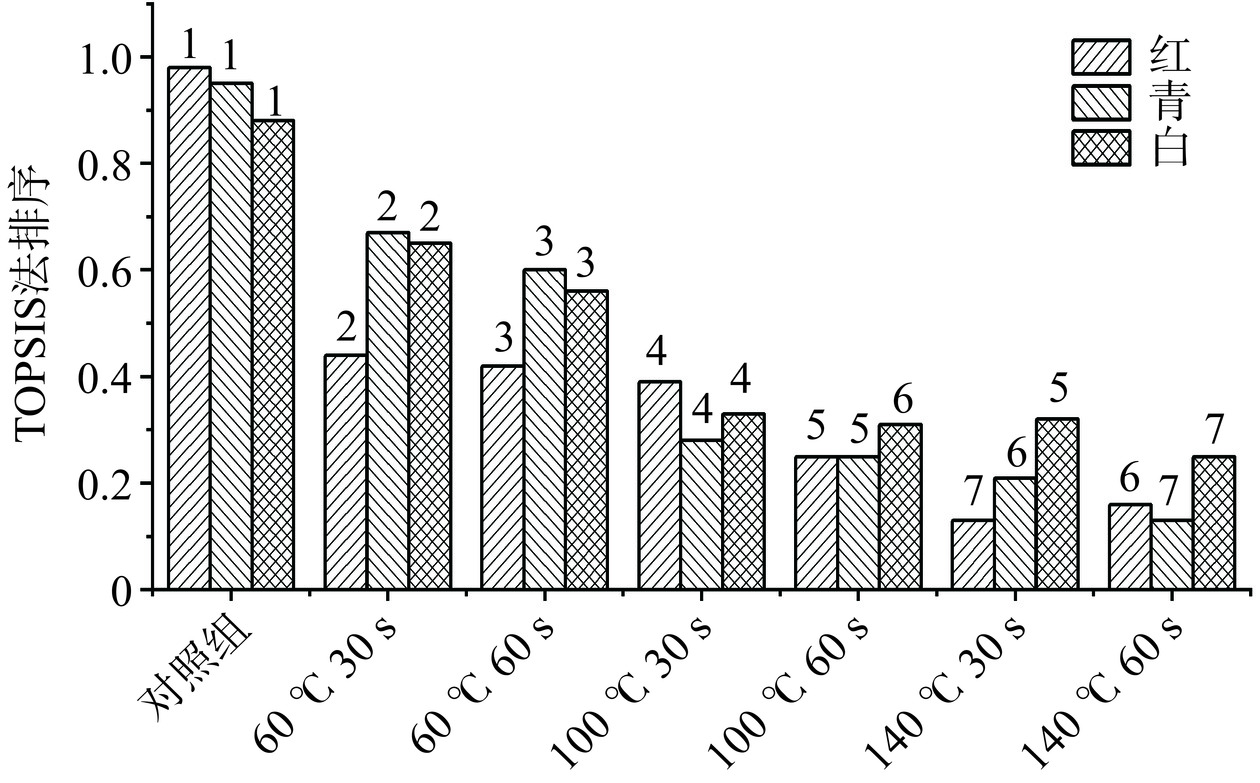
表1为红、青和白三种萝卜苗功能价值TOPSIS法综合评价数据归一化表,表中是基于萝卜苗HACH处理前后活性物质和抗氧化功能的指标进行数据归一化的结果[29],图8为HACH处理的三种萝卜苗TOPSIS法综合评价排序[30]。本研究主要针对HACH处理后对萝卜苗功能价值,采用TOPSIS法分别对三种萝卜苗的活性物质和抗氧化功能进行结果分析并评价,数值越高,排名越好,由图8可以判断随着HACH温度和时间的变化,三种萝卜苗的分值基本都处于下降趋势。在青、红、白三种萝卜苗中,未处理时,红萝卜苗的综合评分最高,但在60 ℃下HACH青和白萝卜苗的总体营养价值保持比红萝卜苗表现优异,因此,短时HACH时青、白萝卜苗更有优势。总的来说,HACH(60 ℃,30 s)处理条件下,三种萝卜苗的功能价值保持最好,是最佳HACH处理条件。
表 1 三种萝卜苗TOPSIS法综合评价数据归一化Table 1. Normalization for comprehensive evaluation data of three types of radish sprouts using TOPSIS method样品 红 青 白 1 2 3 4 5 6 7 8 1 2 3 4 5 6 7 8 1 2 3 4 5 6 7 8 对照组 0.40 0.40 0.59 0.72 0.54 0.45 0.39 0.38 0.39 0.39 0.61 0.54 0.51 0.42 0.38 0.38 0.40 0.38 0.56 0.58 0.53 0.39 0.38 0.38 60 ℃ 30 s 0.39 0.37 0.41 0.32 0.45 0.37 0.38 0.38 0.37 0.37 0.42 0.53 0.43 0.36 0.38 0.38 0.36 0.38 0.44 0.48 0.45 0.30 0.37 0.38 60 ℃ 60 s 0.40 0.38 0.39 0.31 0.44 0.36 0.39 0.38 0.38 0.38 0.38 0.48 0.41 0.39 0.38 0.38 0.37 0.37 0.38 0.41 0.41 0.33 0.39 0.38 100 ℃ 30 s 0.38 0.38 0.34 0.37 0.36 0.36 0.38 0.38 0.38 0.37 0.31 0.20 0.38 0.37 0.37 0.38 0.36 0.39 0.36 0.16 0.39 0.34 0.37 0.38 100 ℃ 60 s 0.40 0.40 0.31 0.14 0.32 0.46 0.37 0.38 0.39 0.41 0.28 0.17 0.32 0.43 0.37 0.38 0.41 0.41 0.33 0.16 0.31 0.45 0.38 0.38 140 ℃ 30 s 0.33 0.35 0.25 0.24 0.22 0.31 0.37 0.38 0.37 0.37 0.25 0.26 0.28 0.37 0.37 0.38 0.36 0.36 0.24 0.34 0.27 0.40 0.38 0.38 140 ℃ 60 s 0.35 0.36 0.24 0.27 0.19 0.31 0.37 0.38 0.37 0.35 0.24 0.25 0.23 0.29 0.38 0.38 0.39 0.36 0.23 0.29 0.17 0.42 0.38 0.38 注:1总酚;2类黄酮;3花青素;4总酚酸;5 VC;6硫代葡萄糖苷;7 DPPH自由基清除能力;8还原能力。 3. 结论
本实验对HACH处理后萝卜苗的活性物质和抗氧化活性进行分析发现,不同HACH条件处理后的熟制萝卜苗与新鲜萝卜苗相比,在总酚、类黄酮、花青素、总酚酸、VC、硫代葡萄糖苷、DPPH自由基清除能力和还原能力等指标上呈现显著差异(P<0.05)。HACH(100 ℃ 60 s)处理后,白萝卜苗硫代葡萄糖苷含量提高了15.3%;而(60 ℃ 30 s)HACH处理的萝卜苗的花青素、总酚酸、VC含量保留率最高,其中白萝卜苗花青素和VC含量保留率达到77.8%、85.3%,青萝卜苗总酚酸含量保留率达到99.3%;随着HACH温度提高和时间延长,萝卜苗的还原能力呈下降趋势。综上,HACH处理对萝卜苗的部分活性物质含量的提高和保留,以及对萝卜苗的抗氧化活性起到了一定的积极影响。TOPSIS法分析显示60 ℃ 30 s热风循环加热处理是萝卜苗活性物质和抗氧化活性保持较好的最佳热风循环加热条件。因实验条件有限,热风循环加热对萝卜苗活性物质的影响机制尚未做出进一步研究,因此,后期将进一步研究HACH处理后活性物质含量呈短暂上升趋势的影响机理,为今后HACH对萝卜苗品质的影响研究提供更多理论依据,为人体合理膳食提供帮助。
-
表 1 三种萝卜苗TOPSIS法综合评价数据归一化
Table 1 Normalization for comprehensive evaluation data of three types of radish sprouts using TOPSIS method
样品 红 青 白 1 2 3 4 5 6 7 8 1 2 3 4 5 6 7 8 1 2 3 4 5 6 7 8 对照组 0.40 0.40 0.59 0.72 0.54 0.45 0.39 0.38 0.39 0.39 0.61 0.54 0.51 0.42 0.38 0.38 0.40 0.38 0.56 0.58 0.53 0.39 0.38 0.38 60 ℃ 30 s 0.39 0.37 0.41 0.32 0.45 0.37 0.38 0.38 0.37 0.37 0.42 0.53 0.43 0.36 0.38 0.38 0.36 0.38 0.44 0.48 0.45 0.30 0.37 0.38 60 ℃ 60 s 0.40 0.38 0.39 0.31 0.44 0.36 0.39 0.38 0.38 0.38 0.38 0.48 0.41 0.39 0.38 0.38 0.37 0.37 0.38 0.41 0.41 0.33 0.39 0.38 100 ℃ 30 s 0.38 0.38 0.34 0.37 0.36 0.36 0.38 0.38 0.38 0.37 0.31 0.20 0.38 0.37 0.37 0.38 0.36 0.39 0.36 0.16 0.39 0.34 0.37 0.38 100 ℃ 60 s 0.40 0.40 0.31 0.14 0.32 0.46 0.37 0.38 0.39 0.41 0.28 0.17 0.32 0.43 0.37 0.38 0.41 0.41 0.33 0.16 0.31 0.45 0.38 0.38 140 ℃ 30 s 0.33 0.35 0.25 0.24 0.22 0.31 0.37 0.38 0.37 0.37 0.25 0.26 0.28 0.37 0.37 0.38 0.36 0.36 0.24 0.34 0.27 0.40 0.38 0.38 140 ℃ 60 s 0.35 0.36 0.24 0.27 0.19 0.31 0.37 0.38 0.37 0.35 0.24 0.25 0.23 0.29 0.38 0.38 0.39 0.36 0.23 0.29 0.17 0.42 0.38 0.38 注:1总酚;2类黄酮;3花青素;4总酚酸;5 VC;6硫代葡萄糖苷;7 DPPH自由基清除能力;8还原能力。 -
[1] 游晓清, 孙露, 彭镰心, 等. 非豆类芽苗菜的营养成分、生产与加工研究进展[J]. 食品研究与开发,2021,42(22):179−185. [YOU X Q, SUN L, PENG L X, et al. Research progress on nutrient composition, production, and processing of non-leguminous sprout vegetables[J]. Food Research and Development,2021,42(22):179−185.] YOU X Q, SUN L, PENG L X, et al. Research progress on nutrient composition, production, and processing of non-leguminous sprout vegetables[J]. Food Research and Development, 2021, 42(22): 179−185.
[2] 李晓红, 王辉, 杨洋, 等. 满堂红萝卜芽苗菜氨基酸营养分析[J]. 中国食品添加剂,2023,34(6):315−321. [LI X H, WANG H, YANG Y, et al. Amino acid nutritional analysis of man tang hong radish sprout vegetables[J]. China Food Additives,2023,34(6):315−321.] LI X H, WANG H, YANG Y, et al. Amino acid nutritional analysis of man tang hong radish sprout vegetables[J]. China Food Additives, 2023, 34(6): 315−321.
[3] KIM S Y, BAN G H, HONG Y W, et al. Microbiome shifts in sprouts (alfalfa, radish, and rapeseed) during production from seed to sprout using 16S rRNA microbiome sequencing[J]. Food Research International,2021,152(3):110896.
[4] LI R, HAO R, ZHU Y. Steam radish sprout (Raphanus sativus L.):Active substances, antioxidant activities and non-targeted metabolomics analysis[J]. International Journal of Food Science & Technology,2019,54(12):3138−3148.
[5] SUPAPVANICH S, ANAN W, CHIMSONTHORN V. Efficiency of combinative salicylic acid and chitosan preharvest-treatment on antioxidant and phytochemicals of ready to eat daikon sprouts during storage[J]. Food Chemistry,2019,284(1):8−15.
[6] KRZEPIŁKO A, WIĘCIŁO A, ZYCH-WĘŻYK I. The antioxidant properties and biological quality of radish seedlings biofortified with iodine[J]. Agronomy,2021,11(10):2011. doi: 10.3390/agronomy11102011
[7] RANDHIR R, KWON Y I, SHETTY K. Effect of thermal processing on phenolics, antioxidant activity and health-relevant functionality of select grain sprouts and seedlings[J]. Innovative Food Science & Emerging Technologies,2008,9(3):355−364.
[8] PALERMO M, PELLEGRINI N, FOGLIANO V. The effect of cooking on the phytochemical content of vegetables[J]. Journal of the Science of Food and Agriculture,2014,94(6):1057−1070. doi: 10.1002/jsfa.6478
[9] TABART J, PINCEMAIL J, KEVERS C, et al. Processing effects on antioxidant, glucosinolate, and sulforaphane contents in broccoli and red cabbage[J]. European Food Research and Technology,2018,244(12):2085−2094. doi: 10.1007/s00217-018-3126-0
[10] PAULSEN E, MORENO D A, PERIAGO P M, et al. Influence of microwave bag vs conventional microwave cooking on phytochemicals of industrially and domestically processed broccoli[J]. Food Research International (Ottawa, Ont.),2021,140:110077. doi: 10.1016/j.foodres.2020.110077
[11] TIMANS P J. Rapid thermal processing technology for the 21st century[J]. Materials ence in Semiconductor Processing,1999,1(3−4):169−179.
[12] YAMAZAKI H, NIWATA E, YANO T, et al. Search for the conditions of hot air treatment to inhibit root and sprout growth of garlic bulbs after subzero storage[J]. Horticultural Research,2014,13(4):371−378.
[13] LI R, ZHU Y. The primary active components, antioxidant properties, and differential metabolite profiles of radish sprouts (Raphanus sativus L.) upon domestic storage:Analysis of nutritional quality[J]. Journal of the Science of Food and Agriculture,2018,98(15):5853−5860. doi: 10.1002/jsfa.9137
[14] 严莎莎, 王少君, 王苗苗, 等. 燕麦坚果饮料总黄酮和总酚酸含量及抗氧化能力分析[J]. 北京农学院学报,2022,37(3):109−114. [YAN S S, WANG S J, WANG M M, et al. Analysis of total flavonoid and total phenolic acid content, as well as antioxidant capacity, in oat and nut beverages[J]. Journal of Beijing Agricultural College,2022,37(3):109−114.] YAN S S, WANG S J, WANG M M, et al. Analysis of total flavonoid and total phenolic acid content, as well as antioxidant capacity, in oat and nut beverages[J]. Journal of Beijing Agricultural College, 2022, 37(3): 109−114.
[15] 屠晶, 陈红云, 白萍, 等. 4种观赏海棠果实成熟前后维生素C含量变化研究[J]. 天津农业科学,2022,28(2):31−34. [TU J, CHEN H Y, BAI P, et al. Study on the changes of vitamin c content in the fruits of four ornamental crabapple varieties before and after maturation[J]. Tianjin Agricultural Science,2022,28(2):31−34.] TU J, CHEN H Y, BAI P, et al. Study on the changes of vitamin c content in the fruits of four ornamental crabapple varieties before and after maturation[J]. Tianjin Agricultural Science, 2022, 28(2): 31−34.
[16] SUN J, WANG Y, PANG X, et al. The effect of processing and cooking on glucoraphanin and sulforaphane in brassica vegetables[J]. Food Chemistry,2021,360:130007. doi: 10.1016/j.foodchem.2021.130007
[17] 李茹, 郝睿, 朱毅. 体外模拟胃、肠消化萝卜苗的表观抗氧化性及其综合评价[J]. 中国食品学报,2020,20(6):27−36. [LI R, HAO R, ZHU Y. In vitro simulation of gastric and intestinal digestion, apparent antioxidant capacity, and comprehensive evaluation of radish sprouts[J]. Chinese Journal of Food Science,2020,20(6):27−36.] LI R, HAO R, ZHU Y. In vitro simulation of gastric and intestinal digestion, apparent antioxidant capacity, and comprehensive evaluation of radish sprouts[J]. Chinese Journal of Food Science, 2020, 20(6): 27−36.
[18] YADAV D, DUTTA G, SAHA K. Assessing and ranking international markets based on stringency of food safety measures:Application of fuzzy AHP-TOPSIS method[J]. British Food Journal,2023,125(1):262−285. doi: 10.1108/BFJ-09-2021-1054
[19] YANG L, LI Y. A new method for ranking the usefulness of negative online reviews based on combined weighting method and improved TOPSIS[J]. Journal of Intelligent & Fuzzy Systems,2022,42(4):3719−3736.
[20] UCHIDA K, TOMITA H, TAKEMORI T, et al. Effects of grilling on total polyphenol content and antioxidant capacity of eggplant (Solanum melongena L.)[J]. Journal of Food Science,2017,82(1):202−207. doi: 10.1111/1750-3841.13567
[21] KALPOUTZAKIS E, CHATZIMITAKOS T, ATHANASIADIS V, et al. Determination of the total phenolics content and antioxidant activity of extracts from parts of plants from the greek island of crete[J]. Plants,2023,12(5):1092. doi: 10.3390/plants12051092
[22] OZTEKIN A, ALMAZ Z, GERNI S, et al. Purification of peroxidase enzyme from radish species in fast and high yield with affinity chromatography technique[J]. Journal of Chromatography B,2019,1114:86−92.
[23] 王璐, 何洪巨, 何湘漪, 等. 不同烹调方式对蔬菜植物化学物及 VC 的影响[J]. 食品工业科技,2014,35(1):338−341. [WANG L, HE H J, HE X Y, et al. Effects of different cooking methods on phytochemicals and vitamin C in vegetables[J]. Food Industry Science and Technology,2014,35(1):338−341.] WANG L, HE H J, HE X Y, et al. Effects of different cooking methods on phytochemicals and vitamin C in vegetables[J]. Food Industry Science and Technology, 2014, 35(1): 338−341.
[24] GUNATHILAKE K, RANAWEERA K, RUPASINGHE H. Effect of different cooking methods on polyphenols, carotenoids and antioxidant activities of selected edible leaves[J]. Antioxidants,2018,7(9):117. doi: 10.3390/antiox7090117
[25] 李铁纯, 侯冬岩, 刁全平, 等. 不同烹饪方式对两种十字花科蔬菜中维生素C的影响[J]. 鞍山师范学院学报,2022,24(6):28−31. [LI T C, HOU D Y, DIAO Q P, et al. Effects of different cooking methods on vitamin C in two cruciferous vegetables[J]. Journal of Anshan Normal University,2022,24(6):28−31.] LI T C, HOU D Y, DIAO Q P, et al. Effects of different cooking methods on vitamin C in two cruciferous vegetables[J]. Journal of Anshan Normal University, 2022, 24(6): 28−31.
[26] 何湘漪, 何洪巨, 范志红, 等. 烹调方法对3种十字花科蔬菜中硫代葡萄糖苷物质保存的影响[J]. 中国食品学报,2013(8):8. [HE X Y, HE H J, FAN Z H, et al. Effects of cooking methods on the preservation of glucosinolate compounds in three cruciferous vegetables[J]. Chinese Journal of Food Science,2013(8):8.] HE X Y, HE H J, FAN Z H, et al. Effects of cooking methods on the preservation of glucosinolate compounds in three cruciferous vegetables[J]. Chinese Journal of Food Science, 2013(8): 8.
[27] WANG Z, KWAN M L, PRATT R, et al. Effects of cooking methods on total isothiocyanate yield from cruciferous vegetables[J]. Food Science & Nutrition,2020,8(10):5673−5682.
[28] PÉREZ-BURILLO S, RUFIÁN-HENARES J Á, PASTORIZA S. Effect of home cooking on the antioxidant capacity of vegetables:Relationship with Maillard reaction indicators[J]. Food Research International,2019,121:514−523. doi: 10.1016/j.foodres.2018.12.007
[29] ORTIZ BARRIOS M, MIRANDA DE LA HOZ C, LÓPEZ MEZA P, et al. A case of food supply chain management with AHP, DEMATEL, and TOPSIS[J]. Journal of Multi-Criteria Decision Analysis,2020,27(1-2):104−128. doi: 10.1002/mcda.1693
[30] SUDER A, KAHRAMAN C. Multiattribute evaluation of organic and inorganic agricultural food investments using fuzzy TOPSIS[J]. Technological and Economic Development of Economy,2018,24(3):844−858. doi: 10.3846/20294913.2016.1216905





 下载:
下载:
 下载:
下载:



