In Vitro Digestion Properties of Low GI Wolfberry Multigrain Meal Replacement Powder
-
摘要: 为探究低血糖生成指数(Glycemic index,GI)枸杞杂粮代餐粉的体外消化特性,本研究对各原料粉及代餐粉的基本组分、吸水率及吸水膨胀率、淀粉组分、淀粉水解率及估计血糖生成指数(Estimate Glycemic index,eGI)值进行测定与分析,并通过体外模拟胃肠消化方法对比分析了各原料粉及代餐粉中蛋白质水解率、总酚含量、黄酮含量及抗氧化活性的变化。结果表明,代餐粉中脂肪和粗纤维含量相较于各原料粉处于偏低水平。各原料粉及代餐粉的高温吸水率为常温吸水率的2倍左右,其中代餐粉吸水率最低(常温条件下吸水率为0.27%±0.05%,高温条件下吸水率为0.59%±0.05%)。代餐粉中快速消化淀粉含量(40.4%±0.003%)及eGI值(23.4)相较于各原料粉均达到最低,而慢消化淀粉和抗性淀粉含量均相对较高。体外模拟胃肠消化实验中,各原料粉及代餐粉蛋白质水解率均逐渐升高且水解主要以胃部为主,其中代餐粉蛋白水解率相对较高;总酚含量在胃肠消化期间均呈上升趋势且代餐粉在消化结束时含量达到最高(7.26 mg/g)。黄酮含量在模拟胃消化过程中明显增加,而在模拟肠消化中含量下降。DPPH自由基和ABTS+自由基清除率在模拟胃消化过程中随时间延长显著(P<0.05)上升,而在模拟肠消化过程中随时间延长呈先上升后降低趋势,但整体变化幅度较为平缓。综上所述,枸杞杂粮代餐粉适合作为低GI原料或产品且具有良好的抗氧化能力,对于杂粮制品的开发具有一定指导的意义。Abstract: The study aimed to determine the in vitro digestive properties of wolfberry multigrain meal replacement powders with a low glycemic index (GI). The basic components, water absorption and swelling rate, starch components, starch hydrolysis rate, and estimated glycemic index (eGI) of each raw material powder and meal replacement powder were measured. The changes in protein hydrolysis rate, total phenolic content, flavonoid content and antioxidant activity in each raw material powder and meal replacement powder were comparatively analyzed by in vitro simulation of gastrointestinal digestive methods. The results showed that the contents of fat and crude fiber in the meal replacement powder were lower than the raw material powders. The water absorption rate of each raw material powder and meal replacement powder at a high temperature was approximately two times of that at room temperature, among which the meal replacement powder had the lowest water absorption rate (0.27%±0.05% at room temperature and 0.59%±0.05% at a high temperature). The rapidly digestion starch content (40.4%±0.003%) and eGI value (23.4) of the meal replacement powder were the lowest among all the ingredient powders, while the slowly digestion starch and resistant starch contents were both relatively high. In the in vitro simulated gastrointestinal digestion experiment, the protein hydrolysis rate of each raw material powder and meal replacement powder gradually increased and the hydrolysis was mainly in the stomach, in which the protein hydrolysis rate of the meal replacement powder was relatively high. The total phenol content tended to increase during gastrointestinal digestion, and the meal replacement powder reached the highest content at the end of digestion (7.26 mg/g). The flavonoid content increased significantly during simulated gastric digestion and decreased in simulated intestinal digestion. DPPH and ABTS+ radical scavenging rates increased significantly (P<0.05) with time during simulated gastric digestion, whereas they tended to increase and then decrease with time during simulated intestinal digestion, but the overall magnitude of the changes was relatively low. In summary, wolfberry multigrain meal replacement powder is suitable as a low GI ingredient or product and has good antioxidant capacity, which is of significance in guiding the development of miscellaneous grain products.
-
杂粮包括荞麦、燕麦、大麦、小豆等小宗粮豆作物,其富含膳食纤维,营养价值高,更加符合人体健康、膳食平衡的需求[1−2]。杂粮品类中,燕麦富含蛋白质,豆类富含优质蛋白,薯类富含维生素C和胡萝卜素,小米富含胡萝卜素和色氨酸,高粱富含铁和脂肪酸[3]。此外,杂粮还具备多种营养特性,例如荞麦中芦丁对血管具有保护作用;燕麦富含亚油酸及多种酶,可延缓细胞衰老[4];藜麦中膳食纤维能够促进肠胃蠕动,减少糖分在体内的吸收,对血糖调节有帮助[5];黄豆中的多肽物质可降低血糖血压,防止动脉硬化[6];黑豆中不饱和脂肪酸可降低人体血胆固醇含量,预防血脂升高[7];绿豆含有球蛋白和多糖,可促进体内胆固醇在肝脏分解成胆酸,加快胆汁里胆盐的分泌,降低小肠对胆固醇的吸收[8]。
血糖生成指数(Glycemic index,GI)一般指食用某类食品后的血糖反应程度[9]。通常情况下,低GI(GI<55)食物消化速度慢,吸收能力差,对血糖的影响不大。研究表明,日常饮食中低GI食物取代一半的高GI食物,即可显著改善人体血糖水平[10]。现如今,越来越多的低糖、低脂等相关标签的食品出现在大众视野中,因此营养价值高的方便食品开始受到消费者的重视。同时代餐粉、代餐粥、代餐奶昔等方便简单的产品已成为大多数消费者的必需食品[11]。基于杂粮丰富的营养成分,可将多种杂粮粉复配以提高营养价值。代餐粉是一种由谷物类、豆类、薯类和其他可食用植物部分,如根、茎、叶和果实等所制成的具有单一或组合性冲调粉剂产品,可为人体提供各种营养物质,并具有高纤维、低脂、低热量以及饱腹感强等特点[12]。近年来,代餐粉因具有诸多优势,发展势头强劲,受到越来越多消费者的青睐,企业也纷纷投身代餐市场,研究人员也围绕代餐粉的原料选择、生产工艺、营养特性等方面展开研究,现也常作为一种新型的手段应用于糖尿病、高脂血症等疾病的临床干预[13]。尽管如此,代餐粉产品种类丰富、原料来源广泛,针对不同的人群,代餐粉的饮食策略、作用机制、功能效果也有所不同,在现今的研究中仍有很多不足和技术障碍需要完善和解决。
因此,本研究在参考食品营养成分和GI值的基础上,选取低GI的燕麦、苦荞、藜麦、黄豆、绿豆和黑豆,并辅以药食同源的宁夏特产枸杞作为原料,从各原料粉及代餐粉的基本组分、吸水率及吸水膨胀率、淀粉组分、淀粉水解率、估计血糖生成指数(Estimate Glycemic index,eGI)值,以及胃肠模拟消化过程中蛋白质水解率、总酚含量、黄酮含量、抗氧化活性变化的角度,探讨所制得枸杞杂粮代餐粉的体外消化特性,以期为相关杂粮产品开发提供理论参考。
1. 材料与方法
1.1 材料与仪器
黄豆、绿豆、黑豆、燕麦、苦荞、藜麦、枸杞 新百超市;葡萄糖标品 英博生物科技有限公司;淀粉葡萄糖苷酶(160 U/mg)、胃蛋白酶(250 U/mg)、转化酶(100 U/mg)、胰蛋白酶(10000 U/mg) 国药集团;没食子酸(纯度>99%)、福林酚试剂、芦丁(纯度>99%) 成都万象宏润生物科技有限公司;ABTS 上海麦克林生化科技有限公司;葡萄糖、氯化钾、磷酸二氢钾、碳酸氢钠、碳酸钠、氯化钠、六水合氯化镁、碳酸铵、二水合氯化钙、苯甲酸、酒石酸钾钠、苯酚、氢氧化钠、磷酸二氢钠、磷酸氢二钠、乙酸钠、乙酸钾、甲醇、乙醇、乙酸乙酯、亚硝酸钠 济南铭锋生物科技有限公司;所有试剂均为分析纯。
AL204分析天平 梅特勒-托利多仪器有限公司;TDL-5型低速离心机 上海安亭科学仪器厂;BPG-9156A鼓风干燥箱 郑州南北仪器设备有限公司;高速万能粉碎机SE-150型 北京科一电器有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;80-2台式离心机 金坛市科析仪器有限公司;2519电子天平 上海上天精密仪器有限公司;Bio Tek ELx800酶标仪 Biotek美国;K9860型自动凯氏定氮仪 山东海能科学仪器有限公司;pH S-2F型pH计 上海仪电科学仪器股份有限公司;HHS-21-6电热恒温水浴锅、智能精密摇床 上海博迅实业有限公司医疗设备厂;KQ-500DE型数控超声 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 代餐粉制备
选取颗粒完整、饱满、无污染的黄豆、绿豆、黑豆、燕麦、苦荞和藜麦,在室温环境下,将黄豆、绿豆和黑豆于清水中浸泡、蒸煮熟化、干燥;燕麦、苦荞、藜麦炒制熟化;枸杞经清洗后进行真空干燥;所有粗原料粉碎后过80目筛,参照张园园[14]的配方比例,最后确定各原料添加量:黑豆粉9.245 g、燕麦粉10.357 g、枸杞粉10.535 g、黄豆粉10.000 g、绿豆粉10.000 g、苦荞粉8.000 g、藜麦粉8.000 g,充分混匀混合后得到代餐粉,于4 ℃保存备用。
1.2.2 基本组分的测定
水分的测定按GB 5009.3-2016《食品安全国家标准 食品中水分的测定》规定执行;灰分的测定按GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》规定执行;蛋白质的测定按GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》规定执行;脂肪的测定按GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》规定执行;粗纤维的测定按GB 5009.88-2023《食品安全国家标准 食品中膳食纤维的测定》规定执行;淀粉的测定按GB 5009.9-2016《食品安全国家标准 食品中淀粉的测定》规定执行。
1.2.3 吸水率及吸水膨胀率测定
常温吸水率的测定参照Gates等[15]的方法并略作修改,精确称取不同的原料粉和代餐粉10 g,加50 mL水搅拌并25 ℃浸泡20 min,于纱网上过滤10 min,滤去多余水分,称重吸水后的粉末质量。
高温吸水率的测定参照路长喜等[16]的方法并略作修改,称取各原料粉和代餐粉5 g加入25 g 100 ℃沸水,进行3000 r/min离心15 min,倒去上清液,称取沉淀物质的质量。
吸水膨胀率的测定参照陈子叶等[17]的方法并略作修改,分别称取5 g原料粉和代餐粉于100 mL量筒中,记录各粉末体积并向每个量筒内加入50 mL 100 ℃沸水,置于室温环境下10 min,记录每种原料粉吸湿膨胀后的体积。
1.2.4 淀粉组分测定
精确称量1 g待测定原料粉样品于50 mL三角瓶,加入20 mL去离子水,沸水浴30 min,期间不断摇晃避免样品凝固结块,用去离子水作空白;将糊化的原料粉试样冷却到37 ℃,分别添加3 mL的转化酶,在37 ℃下继续振荡30 min,沸水浴5 min使酶失活,迅速冷却至室温后于4℃、3000 r/min 离心5 min,取上清液,3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)法测葡萄糖。运用Englyst法[18]分析样品中淀粉组分。
1.2.5 淀粉水解率及eGI值测定
根据Wallis等[19]的研究方法测定淀粉水解率及eGI值。精确称量0.1 g各样品于100 mL锥形瓶中,添加pH=1.5的HCl-KCl缓冲液5 mL,混合均匀,添加胃蛋白酶液0.2 mL、HCl-KCl缓冲液2 mL,在40 ℃下振荡1 h;各样品添加pH=6.4的Tris-马来酸缓冲液10 mL,α-淀粉酶溶液0.1 mL,定容至25 mL;摇床温度调至37 ℃振荡3 h,每隔30 min取一次样,每次取水解液2 mL,经沸水浴5 min灭酶活。待水解溶液冷却到室温后,各样品分别加pH=4.8醋酸钠缓冲液3 mL,淀粉葡萄糖苷酶溶液0.1 mL,定容到5 mL,过滤。DNS法测定葡萄糖含量。参照Goni等[20]的计算方法:eGI=39.71+0.549 HI,采用葡萄糖作对照。
淀粉水解率(%)=反应液中葡萄糖释放量×0.9×稀释倍数×液体体积总干物质量×100 (1) 1.2.6 体外模拟消化环境建立
参考Minekijs等[21]建立体外模拟消化环境制备胃液(SGF)和肠液(SIF)电解质储备液,见表1,−20 ℃下储存,胃肠消化液的配制方法见表2。
表 1 模拟消化储备液的制备Table 1. Preparation of the simulated digestion stock solution组分 电解质溶液
浓度(mol/L)SGF(pH=3) SIF(pH=7) 电解液体积
(mL)浓度
(mmol/L)电解液体积
(mL)浓度
(mmol/L)KCl 0.5 6.9 6.9 6.8 6.8 K2HPO4 0.5 0.9 0.9 0.8 0.8 NaHCO3 1.0 12.5 25.0 42.5 85.0 NaCl 2.0 11.8 47.2 9.6 38.4 MgCl2(H2O)6 0.15 0.4 0.1 1.1 0.33 (NH4)2CO3 0.5 0.5 0.5 − − 注:储备溶液添加去离子水至400 mL后,添加酶、胆汁盐、Ca2+溶液等,保证最终混合溶液体积为500 mL;由于CaCl2(H2O)2会发生沉淀,因此将其直接添加至最终混合物中。 表 2 胃肠消化液的制备Table 2. Preparation of gastrointestinal digestive solution消化液 制备 pH 定容 胃部消化液 模拟胃液电解质储备液
(400 mL)调节pH=3 超纯水定容至
500 mL胃蛋白酶(2000 U/mL) 肠部消化液 模拟肠液电解质储备液
(400 mL)调节pH=7 超纯水定容至
500 mL胰蛋白酶(100 U/mL) 胰酶(4 U SP/mL) 猪胆盐(10 mmol/L) 1.2.7 蛋白质水解率测定
参考Krieg等[22]的研究方法,超纯水稀释胃肠消化液,制备10 mg/mL的胃液和50 mg/mL肠液,采用 BCA 法对消化液进行检测,按公式(2)计算蛋白质总消化率(PDT):
PDT(%)=(m0−m1)/m0×100 (2) 式中:m0表示消化前样品中蛋白质含量,mg;m1表示消化后剩余蛋白质含量,mg。
1.2.8 总酚含量的测定
制备0.2 mg/mL没食子酸溶液,分别取0、0.2、0.4、0.6、0.8、1.2 mL没食子酸溶液于试管中,60%乙醇溶液定容至10 mL,制得没食子酸工作液。取1.0 mL没食子酸工作液与2.5 mL福林酚试剂和2.5 mL 15%的Na2CO3溶液,去离子水定容至10 mL,均匀混合,室温静置2 h后,760 nm测量吸光值,绘制标准曲线。等体积样液代替标准溶液,根据以上步骤,计算样品中总酚含量[23]。
1.2.9 总黄酮含量的测定
配制0.2 mg/mL的芦丁标准液,分别移取0、0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0、5.0 mL芦丁标准液于带塞试管中,浓度为2.5 g/100 mL的AlCl3溶液和9.82 g/100 mL的乙酸钾溶液分别添加2.0 mL,30%乙醇定容至50 mL,30 min内415 nm下测量吸光值,绘制标准曲线。等体积样液代替芦丁标准液,依照上述步骤,计算样品总黄酮含量[24]。
1.2.10 抗氧化活性的测定
DPPH自由基清除能力测定参照张孟琴等[25]的方法。取0.5 mL样液,加入2.5 mL DPPH乙醇溶液(0.1 mmol/L),黑暗处缓慢摇动30 min,517 nm处测定吸光度,VC作对照。DPPH自由基的清除率计算公式如式(3):
DPPH自由基清除率(%)=(1−A2−A1A0)×100 (3) 式中,A2表示0.5 mL样液与2.5 mL DPPH乙醇液混合后的吸光度;A1表示0.5 mL样液与2.5 mL乙醇混合后的吸光度;A0表示2.5 mL DPPH溶液与0.5 mL乙醇混合后的吸光度。
ABTS+自由基清除能力参照张孟琴等[25]的方法,稍作修改。ABTS工作液的配制:取5 mL ABTS溶液(7 mmol/L)与88 μL K2S2O8溶液(40 mmol/L)混匀,室温避光放置14 h,80%乙醇稀释使其在734 nm处的吸光度达到0.7左右,成为ABTS工作液。测定方法:取0.3 mL的样液和2.7 mL ABTS工作液充分混匀,室温下避光反应10 min,在734 nm处测定吸光值,VC做阳性对照。清除率按公式(4)计算:
ABTS+自由基清除率(%)=(1−A2−A1A0)×100 (4) 式中,A2表示0.3 mL样液和2.7 mL ABTS工作液混合后的吸光度;A1表示0.3 mL样液与2.7 mL 80%乙醇混合后的吸光值;A0表示2.7 mL ABTS工作液与0.3 mL 80%乙醇混合后的吸光值。
1.3 数据处理
所有实验进行3次平行测定,结果采用平均值±标准差表示,采用SPSS 26对试验数据检验统计分析,采用Origin 2023进行绘图。
2. 结果与分析
2.1 基本组分分析
样品基本指标测定结果见表3。结果显示,黑豆粉、黄豆粉以及绿豆粉中的蛋白质含量均较高,燕麦粉中蛋白质含量最低。研究显示,豆类杂粮一般含有比谷类杂粮更高的蛋白质,是植物蛋白的重要来源[26]。黄豆粉中脂肪、粗纤维含量均最高,燕麦粉中粗纤维含量最低,苦荞粉中的脂肪含量最低;苦荞粉中的淀粉含量最高,绿豆粉中的淀粉含量最低。代餐粉中基本组分测定值与各原料粉相比,均处于中间水平;与同类型代餐粉相比[27−28],其基本营养成分较为丰富,这可能是由于原料产地与前处理方式的不同。
表 3 样品基本组分测定值Table 3. Measured value of basic components of samples样品名称 水分(g) 灰分(g) 蛋白质(g) 脂肪(g) 粗纤维(g) 淀粉(g) 黄豆粉 12.46±0.08b 4.95±0.02a 42.06±0.49b 17.31±0.21a 8.18±0.09a 26.91±0.81e 绿豆粉 13.31±0.12a 3.66±0.04e 41.31±0.39b 2.59±0.03f 4.6±0.31c 23.27±0.35f 黑豆粉 13.08±0.04a 4.45±0.04b 44.98±0.60a 11.93±0.17b 6.16±0.17b 50.53±1.27c 燕麦粉 9.41±0.05d 3.34±0.01g 8.77±0.09f 9.31±0.13c 1.38±0.21e 62.00±1.76b 苦荞粉 8.86±0.12e 3.45±0.02f 14.94±0.18e 2.41±0.05f 2.44±0.30d 69.62±1.20a 藜麦粉 8.66±0.20e 4.27±0.01c 17.77±0.24d 4.83±0.24e 6.28±0.24b 63.24±0.60b 代餐粉 10.91±0.05c 3.92±0.04d 23.41±0.38c 7.87±0.57d 4.33±0.22c 45.69±0.39d 注:每列中不同字母表示有显著性差异(P<0.01)。 2.2 吸水率及吸水膨胀率分析
由表4可知,各样品高温吸水率均高于常温吸水率。有研究发现,高温吸水率为常温吸水率的2倍左右[16],本研究结果与其基本一致。粉质复水性与蛋白质、淀粉、纤维素等大分子物质存在紧密联系,随着吸水率的增加,粉质变得越好[17]。燕麦粉和绿豆粉的吸水膨胀率明显高于其他各原料粉,各原料粉复水性优于代餐粉,推测由于枸杞粉与多种杂粮粉的混合不利于淀粉之间的粘结,导致其吸水率较低。因此,与各原料粉比较,代餐粉加工难度较大。
表 4 粉质吸水率和膨胀度指标对比Table 4. Comparison of powder water absorption and expansion indexes样品 常温吸水率(%) 高温吸水率(%) 吸水膨胀率(%) 黄豆粉 0.33±0.12cd 0.60±0.09c 1.30 绿豆粉 0.48±0.03ab 0.83±0.03a 3.50 黑豆粉 0.29±0.08d 0.61±0.10c 1.02 燕麦粉 0.53±0.15a 0.86±0.05a 4.10 苦荞粉 0.41±0.17bc 0.77±0.05b 2.50 藜麦粉 0.36±0.23cd 0.62±0.01c 2.29 代餐粉 0.27±0.05d 0.59±0.05c 1.25 注:每列中不同字母表示有显著性差异(P<0.01)。 2.3 淀粉组分分析
测定淀粉组分得到标曲:Y=0.9417x+0.0495(R2=0.9924),代入可得快消化淀粉(Rapidly digestion starch,RDS)、慢消化淀粉(Slowly digestion,SDS)和抗性淀粉(Resistant starch,RS)组分结果。各原料粉及代餐粉淀粉组分测定结果见表5,黄豆粉和黑豆粉的RDS含量较高,绿豆粉和代餐粉的SDS含量较高,苦荞粉和燕麦粉的RS含量较高。淀粉消化速度除受自身结构影响外,还与各杂粮存在的其它物质如蛋白质等有关[29]。实验证明慢消化淀粉、抗性淀粉具有调控血糖的作用[26]。综合分析发现代餐粉中RDS含量较低,而SDS和RS含量均较高,适合作为低GI产品的原料。
表 5 各样品的淀粉组分Table 5. Starch fractions of each sample样品 RDS(%) SDS(%) RS(%) 黄豆粉 63.7±0.016a 31.1±0.014c 5.3±0.004f 绿豆粉 58.2±0.01b 38.9±0.006a 2.8±0.004g 黑豆粉 65.1±0.004a 23.1±0.003e 11.8±0.003d 燕麦粉 54.7±0.003c 31.0±0.003c 14.3±0.00b 苦荞粉 56.8±0.002b 27.9±0.001d 15.3±0.002a 藜麦粉 58.2±0.001b 33.9±0.003b 7.9±0.002e 代餐粉 40.4±0.003d 46.3±0.003a 13.2±0.003c 注:每列中不同字母表示有显著性差异(P<0.01)。 2.4 淀粉水解率分析
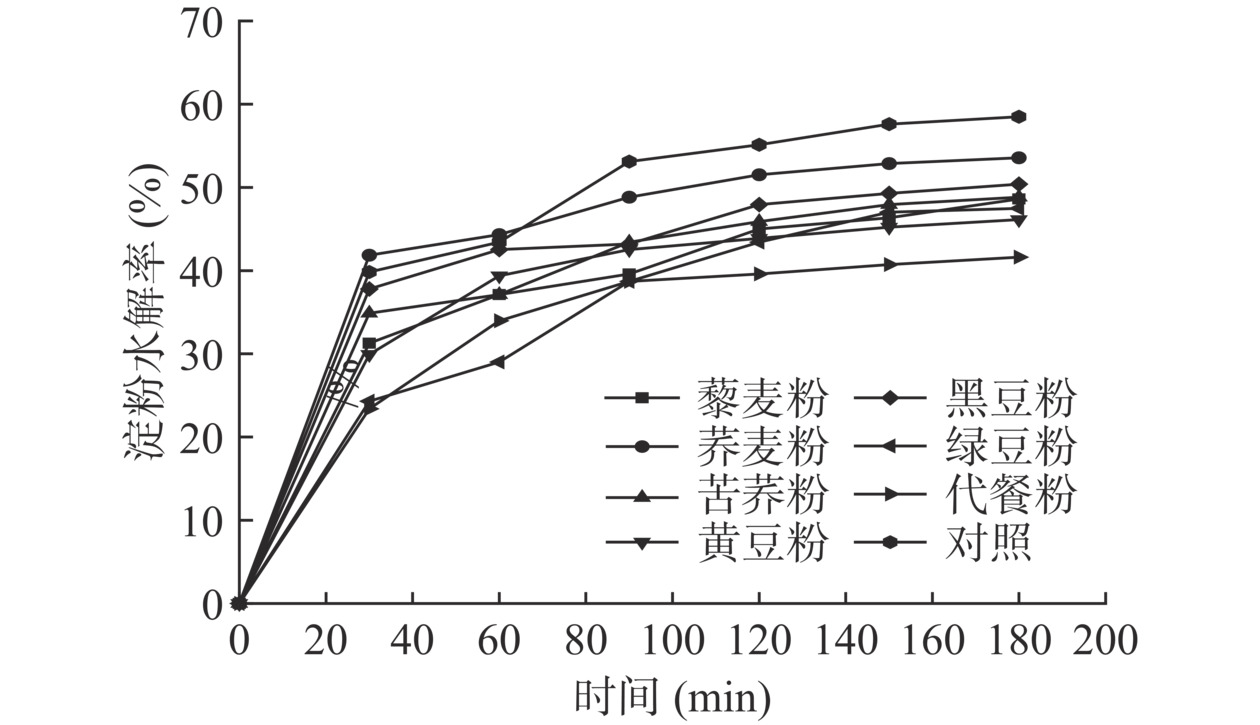
各原料粉及代餐粉淀粉水解率变化见图1。整个淀粉水解阶段,各样品的淀粉水解率趋势基本一致,在消化30 min时,各样品淀粉水解率均达到最大,从高到低依次为:燕麦粉(41.85%)>黑豆粉(37.8%)>苦荞粉(34.88%)>藜麦粉(31.28%)>黄豆粉(29.93%)>绿豆粉(24.30%)>代餐粉(23.40%),占其总水解率的68.08%、78.15%、75.00%、71.43%、64.35%、64.88%、51.18%、56.22%。淀粉水解速率相同时,淀粉含量越高,在体外模拟消化中所释放的葡萄糖就越多[30]。通过对比分析各原料粉及代餐粉的葡萄糖释放速率,发现代餐粉的释放速率最慢,燕麦粉的释放速率最快。
2.5 eGI值分析
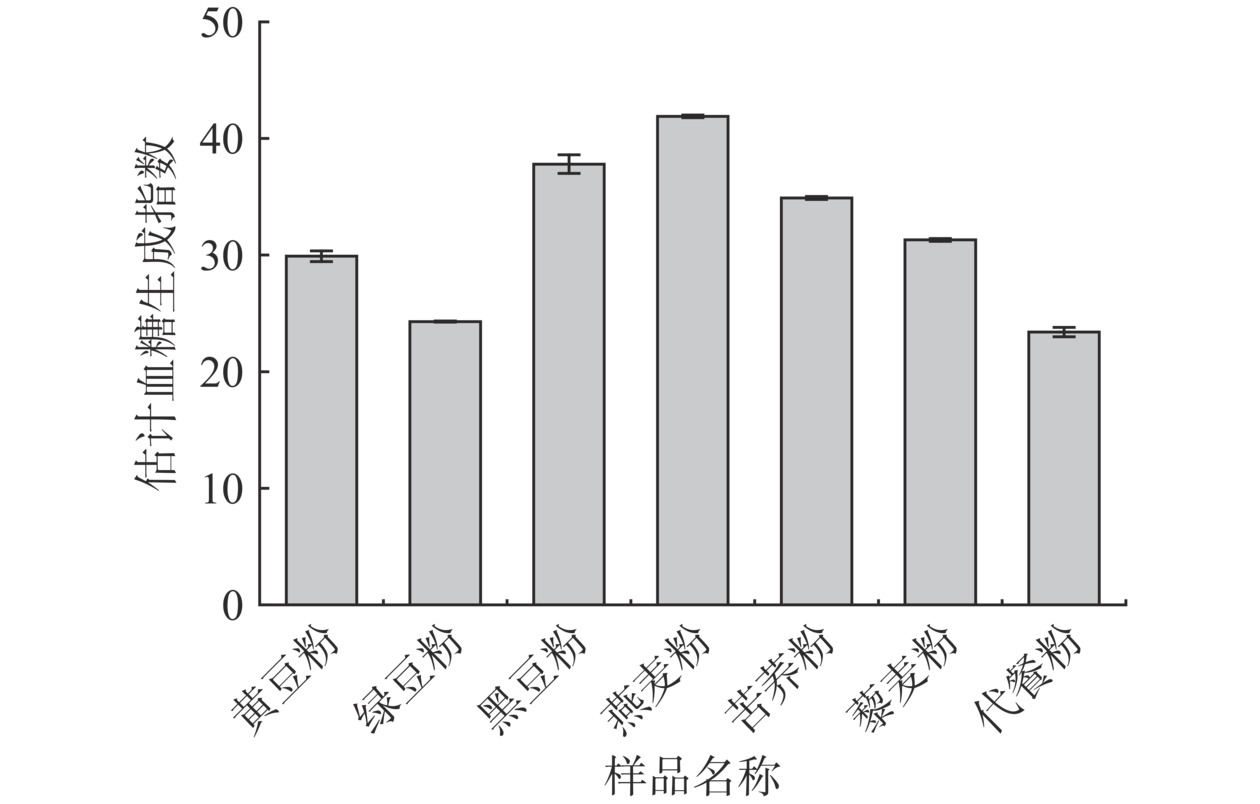
由图2可知,各样品的eGI值均小于55,说明各样品符合低GI食物的标准,且eGI值由高到低依次为:燕麦粉(41.9)>黑豆粉(37.8)>苦荞粉(34.9)>藜麦粉(31.3)>黄豆粉(29.9)>绿豆粉(24.3)>代餐粉(23.4)。有研究表明谷物类eGI值普遍高于豆类杂粮[31],本实验结果与之基本一致。代餐粉的eGI值最低,表明由多种低GI原料粉复配的代餐粉不仅能够综合提高食物的营养价值,还可以有效降低其eGI值。
2.6 胃肠消化对蛋白质水解率的影响
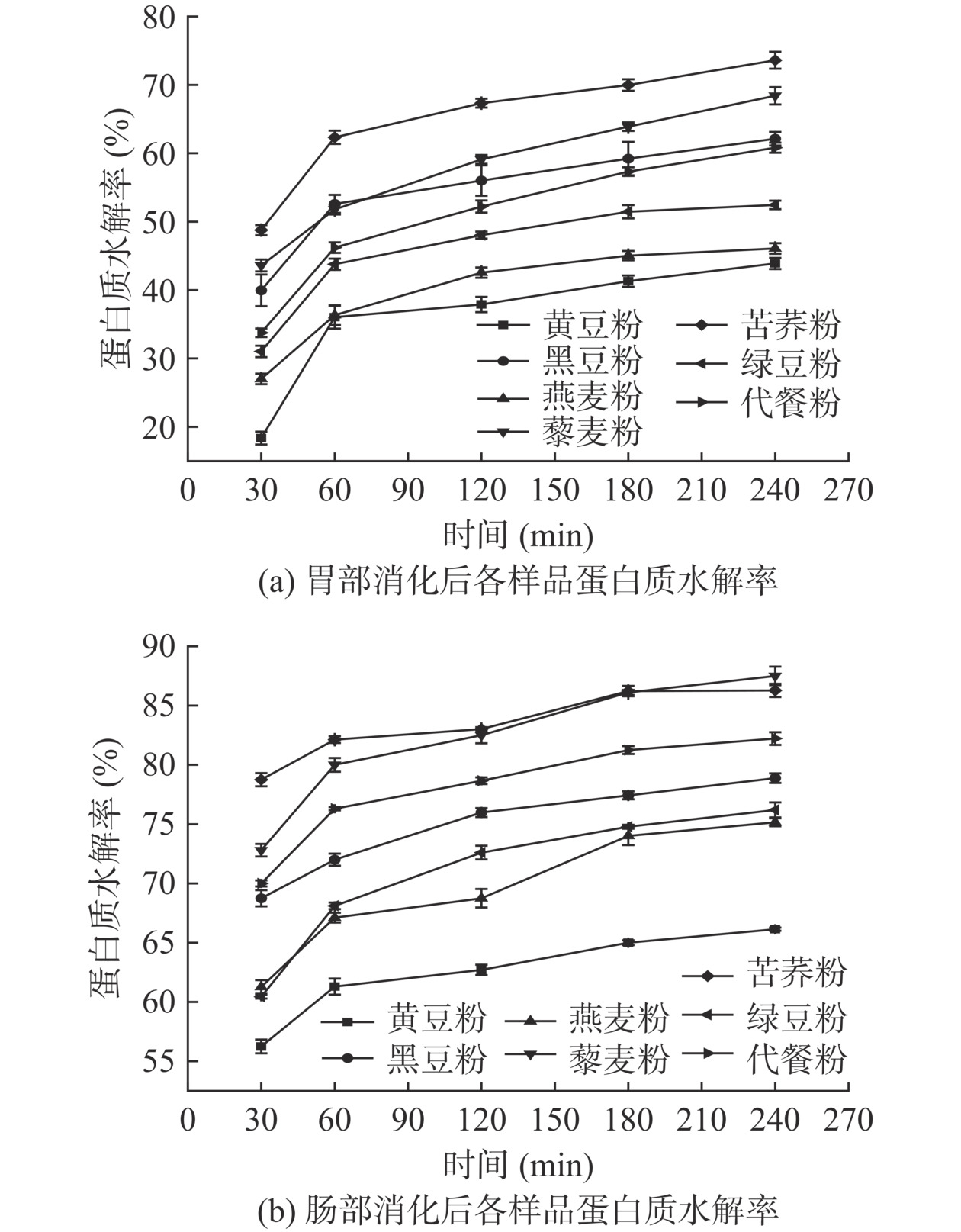
体外消化胃肠蛋白质消化率结果如图3所示。由图3a可知,体外胃液模拟消化前120 min内,蛋白质的消化速率达到最大。至消化阶段240 min,各样品蛋白质水解率由高至低为:苦荞粉(73.60%)>藜麦粉(68.41%)>黑豆粉(58.95%)>代餐粉(60.31%)>绿豆粉(56.18%)>燕麦粉(61.09%)>黄豆粉(49.04%)。有相关研究表明,食物纤维的加入会和样品中的蛋白质组成复杂的混合物,导致蛋白质水解受到抑制[32]。推测代餐粉的蛋白质水解率变化可能受几种原料粉不同纤维含量的影响。图3b显示,至消化阶段240 min,肠部消化后各样品的蛋白质水解率由高至低依次为:藜麦粉(87.5%)>苦荞粉(86.28%)>代餐粉(82.22%)>黑豆粉(78.88%)>绿豆粉(76.2%)>燕麦粉(75.16%)>黄豆粉(66.14%),与消化30 min比较,蛋白质水解率提高了17%~38%,对比图3a中胃肠消化期间蛋白质水解率变化,肠道消化期间蛋白质水解速率较胃消化期间低。因此,蛋白质水解以胃部消化为主要阶段。
2.7 胃肠消化对总酚含量的影响
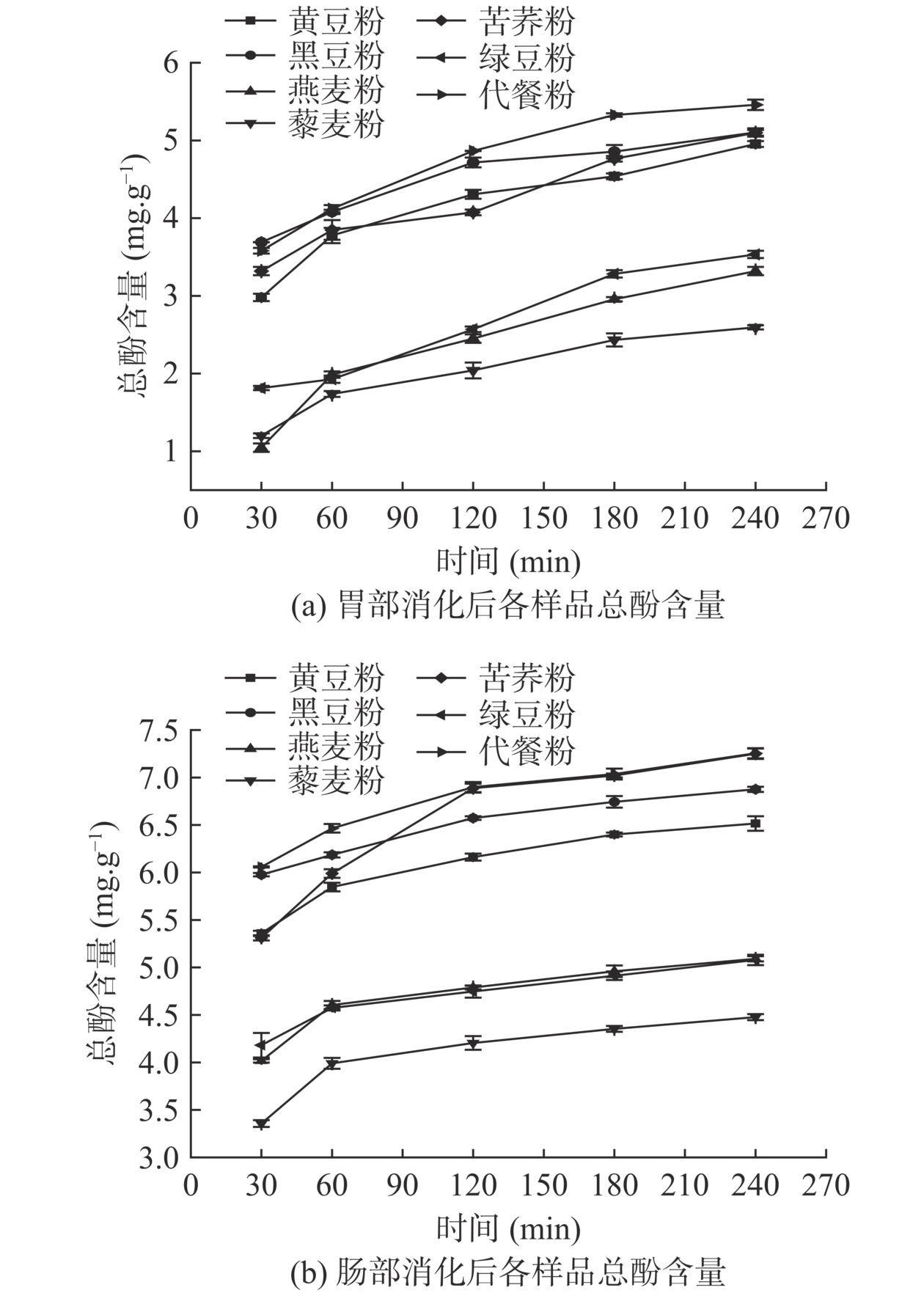
图4为体外消化对各原料粉及代餐粉总酚含量的影响曲线。各原料粉及代餐粉在胃肠消化期间总酚含量整体呈上升趋势。由图4a可知,至消化阶段240 min,各样品总酚含量由大到小依次为:代餐粉(5.46 mg/g)>黑豆粉(5.10 mg/g)>苦荞粉(5.09 mg/g)>黄豆粉(4.95 mg/g)>绿豆粉(3.53 mg/g)>燕麦粉(3.32 mg/g)>藜麦粉(2.60 mg/g),与消化30 min相比,分别提高了1.88、1.41、1.78、1.97、1.72、2.27、1.40 mg/g。由图4b可知,各样品的总酚含量在肠消化阶段仍继续升高,至消化阶段240 min,各样品总酚含量从高到底依次为:代餐粉(7.26 mg/g)>黑豆粉(6.88 mg/g)>黄豆粉(6.52 mg/g)>苦荞粉(6.25 mg/g)>绿豆粉(5.18 mg/g)>燕麦粉(5.09 mg/g)>藜麦粉(4.48 mg/g),与消化30 min比较,分别提高了1.20、0.90、1.16、1.32、0.87、1.08、1.12 mg/g。在胃液模拟消化系统中,添加的多种酶破坏了食物的细胞壁,从而促使了酚类化合物的逐渐释放[33]。此外,胃酸和胃蛋白酶可分解酚酸与细胞壁间的酯键,释放出酚酸,胰蛋白酶可通过促进多酚和蛋白质间的共价键,释放出游离酚[34]。在本实验中,整个体外模拟消化过程中代餐粉的多酚含量上升最快,说明与各原料粉比较,其在消化过程中的抗氧化能力较显著。
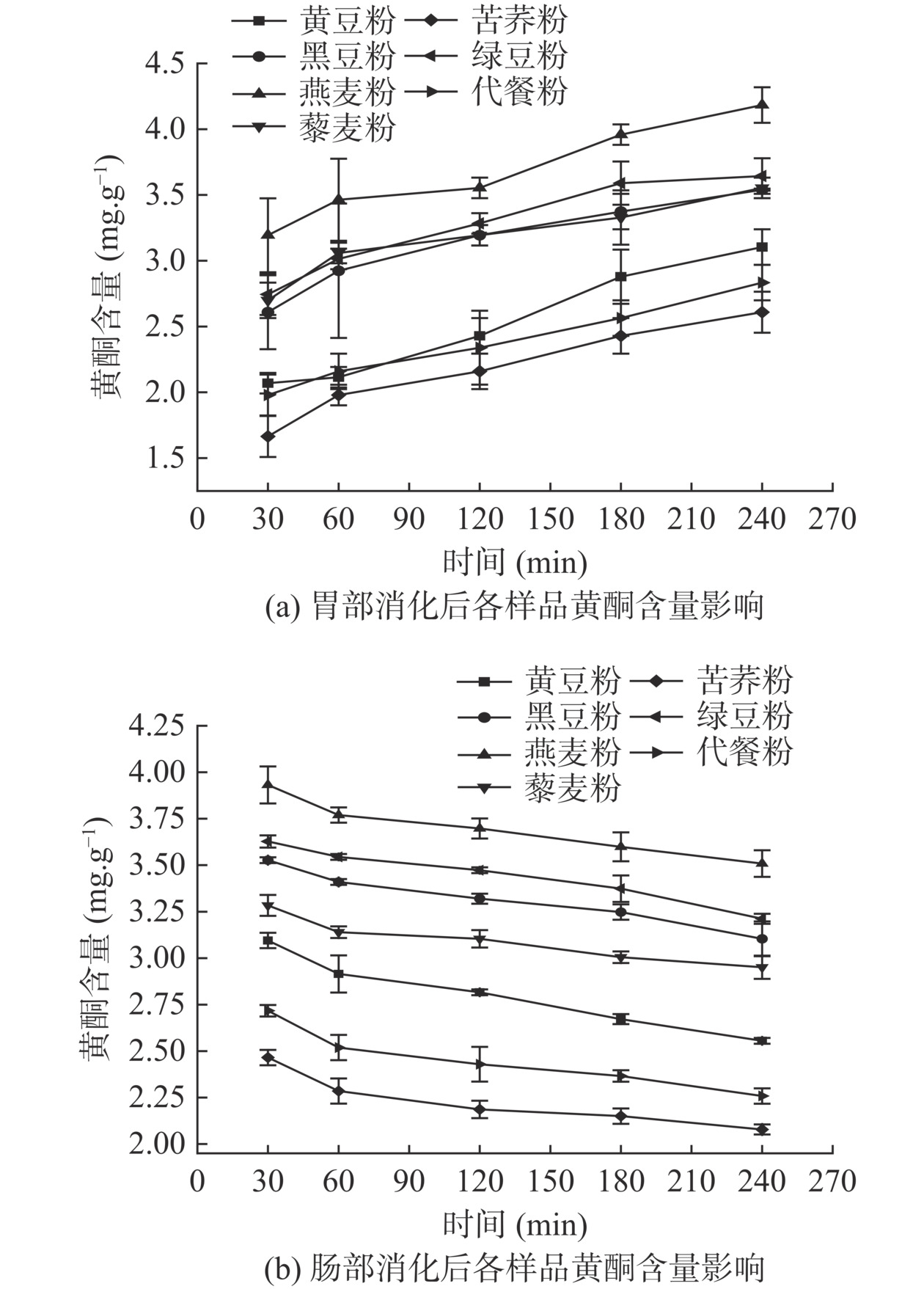
2.8 胃肠消化对黄酮含量的影响
图5为体外消化对各原料粉及代餐粉总黄酮含量的影响曲线。由图5a可知,各样品的黄酮含量在胃消化反应的曲线均呈逐步升高的趋势,至消化阶段240 min,各样品黄酮含量从高到低依次为:燕麦粉(4.18 mg/g)>绿豆粉(3.64 mg/g)>藜麦粉(3.55 mg/g)>黑豆粉(3.54 mg/g)>黄豆粉(3.10 mg/g)>代餐粉(2.83 mg/g)>苦荞粉(2.61 mg/g),与消化30 min比较,分别提高了0.99、0.90、0.85、0.93、1.03、0.85、0.94 mg/g。由图5b可知,各样品的黄酮含量在肠消化阶段逐步下降,至消化阶段240 min,各样品黄酮含量从高到底依次为:燕麦粉(3.51 mg/g)>绿豆粉(3.21 mg/g)>黑豆粉(3.10 mg/g)>藜麦粉(2.95 mg/g)>黄豆粉(2.56 mg/g)>代餐粉(2.26 mg/g)>苦荞粉(2.08 mg/g),与消化30 min比较,分别降低了0.42、0.41、0.42、0.33、0.54、0.46、0.37 mg/g。苦荞中的黄酮含量比普通谷物更多,被誉为“五谷之王”和“三降食品”[35],本研究中苦荞的黄酮含量在消化结束时最低,这可能是由于在预处理炒制熟化过程中,高温使黄酮类化合物从其蛋白、淀粉等结合形式受到破坏所致。综上分析,由于胃酸和胃蛋白酶促进结合态黄酮释放,并且在低pH胃液条件下,可以有效抑制体内的总黄酮分解,所以在胃部消化期,黄酮的含量会随着胃部的消化时间而不断增加;而在中性或弱碱性环境下,黄酮易被分解成酚醛等物质,因此肠内的黄酮含量降低。
2.9 胃肠消化对抗氧化活性的影响
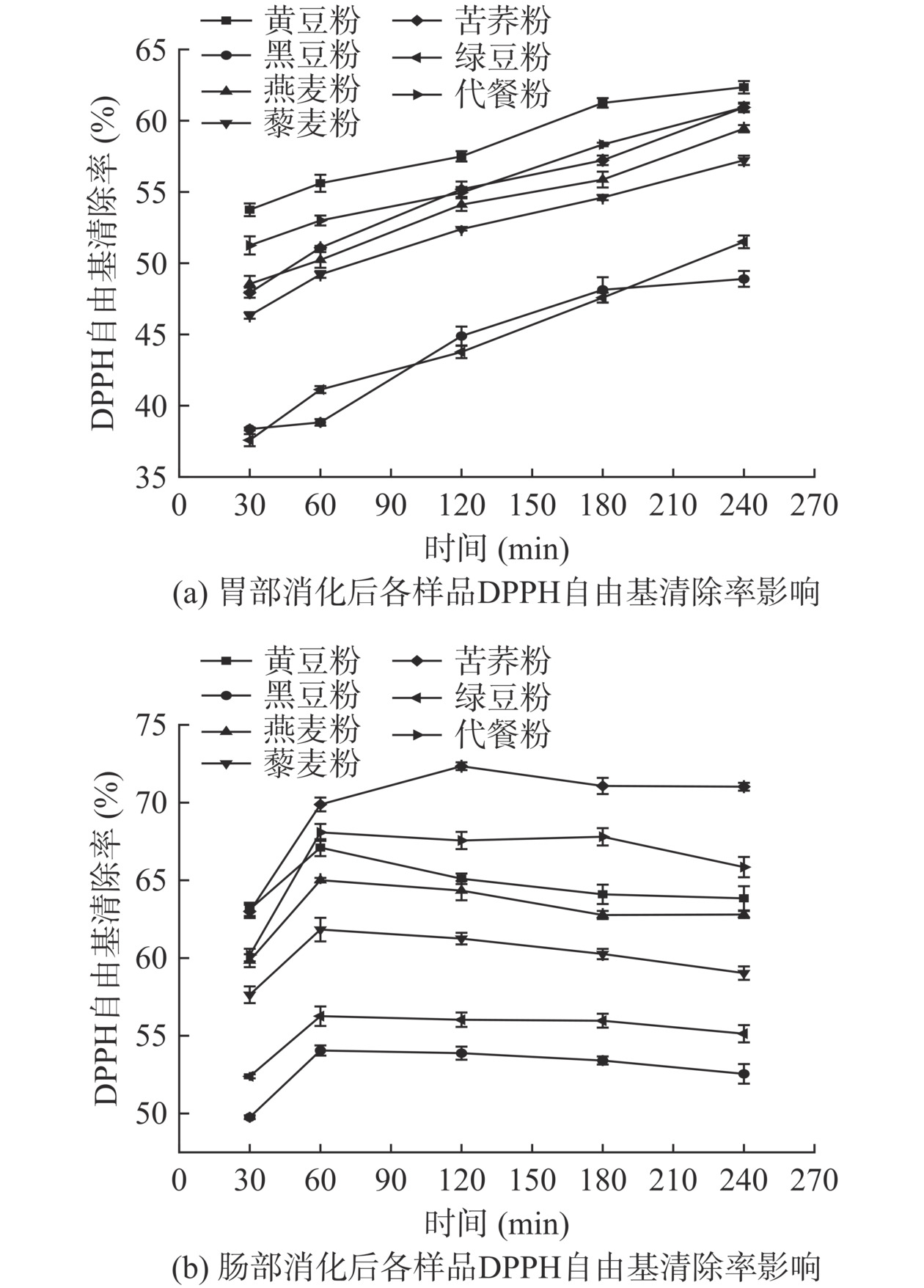
2.9.1 DPPH自由基清除能力
体外消化对各原料粉及代餐粉的DPPH自由基清除率的影响如图6所示。由图6a可知,在胃消化过程后各样品DPPH自由基清除率随消化时间的延长呈上升趋势。至消化240 min,各样品DPPH自由基清除率从高到底依次为:黄豆粉(62.35%)>代餐粉(60.93%)>苦荞粉(60.91%)>燕麦粉(59.44%)>藜麦粉(57.22%)>绿豆粉(51.5%)>黑豆粉(48.9%),与消化30 min比较,分别提高了7.48%、8.96%、12.12%、10.58%、10.89%、13.92%、10.54%。推测由于在胃消化阶段,各样品的总酚和黄酮含量均不断上升导致DPPH自由基清除率有所提高,该结果与Tagliazucchi等[36]研究结论一致。由图6b可知,在肠消化过程中,随时间的延长,各样品DPPH自由基呈先上升后趋于平缓的趋势。肠消化反应结束时,各样品DPPH自由基清除率从高到底依次为:苦荞粉(71.02%)>代餐粉(65.85%)>黄豆粉(63.84%)>燕麦粉(62.8%)>藜麦粉(59.03%)>绿豆粉(55.13%)>黑豆粉(52.55%),与消化30 min比较,分别增加了7.02%、5.66%、0.71%、2.87%、1.39%、2.74%、2.79%。本研究中,多酚含量显著升高,与DPPH自由基清除率变化趋势基本一致。综上分析,黄酮含量初期较高,有助于对DPPH自由基的清除,而后期黄酮含量下降显著,导致其清除DPPH自由基的能力下降,综合多酚含量逐渐上升,故DPPH自由基清除率趋于平稳。
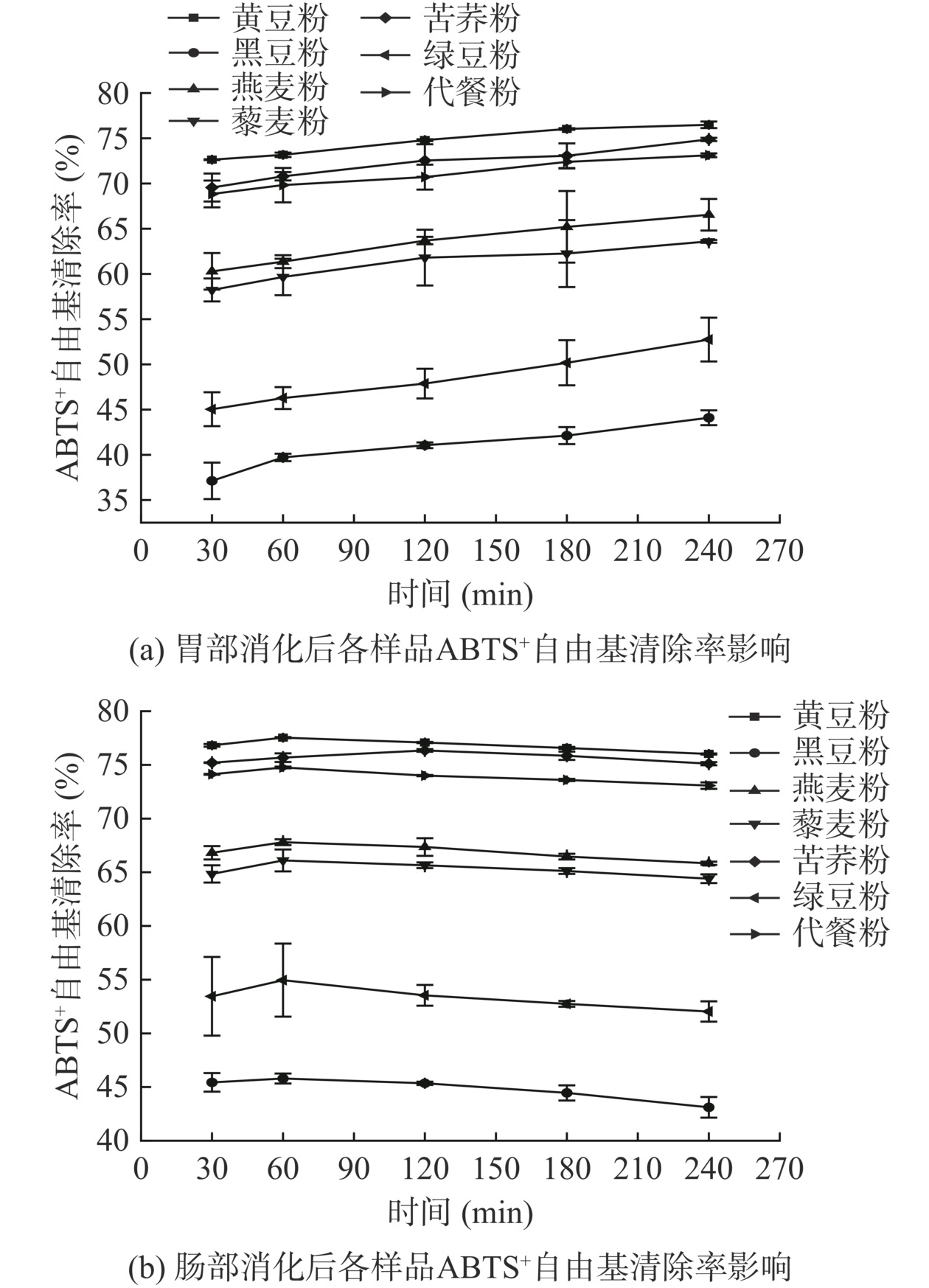
2.9.2 ABTS+自由基清除能力
体外消化对各原料粉及代餐粉的ABTS+自由基清除率的影响如图7所示。由图7a可知,在胃消化过程后各样品ABTS+自由基清除率随消化时间的延长呈上升的趋势。至消化阶段240 min,各样品ABTS+自由基清除率从高到低依次为,黄豆粉(76.49%)>苦荞粉(74.88%)>代餐粉(73.12%)>燕麦粉(66.55%)>藜麦粉(63.60%)>绿豆粉(52.74%)>黑豆粉(44.10%),与消化30 min比较,分别提高了3.86%、5.32%、4.27%、6.26%、5.37%、7.70%、6.98%。推测由于在胃消化阶段,各样品的总酚和黄酮含量均不断上升,使得ABTS+自由基清除率有所提高,该结果与Tagliazucchi等[36]研究结论一致。由图7b可知,在肠消化过程中,随时间的延长,各样品ABTS+自由基先上升后稍有降低,但整体趋于平缓。肠消化反应结束时,各样品ABTS+自由基清除率从高到低依次为:黄豆粉(76.01%)>苦荞粉(75.12%)>代餐粉(73.07%)>燕麦粉(65.83%)>藜麦粉(64.4%)>绿豆粉(52.04%)>黑豆粉(43.11%),与消化30 min比较,分别增加了0.81%、0.09%、1.05%、0.98%、0.45%、1.42%、2.33%,无显著性差异(P>0.05)。有相关研究表明,在模拟肠消化过程中,ABTS+自由基清除率与多酚、黄酮含量相关性较差(r=−0.25~0.57)[34],由此推测ABTS+自由基清除能力是各样品体系中所有抗氧化物质共同作用的结果。
3. 结论
本研究以6种杂粮粉及枸杞粉为原料复配了低GI枸杞杂粮代餐粉,对各原料粉及代餐粉的基本组分、吸水率及吸水膨胀率、淀粉组分及水解率、eGI值、蛋白质水解率、总酚含量、黄酮含量及抗氧化活性进行了分析。结果表明,代餐粉适用于低GI方便食品的开发。胃肠模拟消化过程中,各样品蛋白质水解率及总酚含量升高。各样品黄酮含量及抗氧化能力在胃液模拟消化中随时间延长而升高,在肠液模拟消化中,黄酮含量下降,抗氧化能力呈先上升后降低。本研究结果为代餐粉产品研制提供了数据支持,对杂粮类资源的综合利用有一定的积极意义,有利于代餐粉产品的进一步研发。本研究只是对低GI枸杞杂粮代餐粉的初步研究,后续研究中可采用动物模型,对低GI枸杞杂粮代餐粉的抗氧化能力及功能性深入研究与分析,以进一步对低GI枸杞杂粮代餐粉营养价值进行评估并进行产品推广。
-
表 1 模拟消化储备液的制备
Table 1 Preparation of the simulated digestion stock solution
组分 电解质溶液
浓度(mol/L)SGF(pH=3) SIF(pH=7) 电解液体积
(mL)浓度
(mmol/L)电解液体积
(mL)浓度
(mmol/L)KCl 0.5 6.9 6.9 6.8 6.8 K2HPO4 0.5 0.9 0.9 0.8 0.8 NaHCO3 1.0 12.5 25.0 42.5 85.0 NaCl 2.0 11.8 47.2 9.6 38.4 MgCl2(H2O)6 0.15 0.4 0.1 1.1 0.33 (NH4)2CO3 0.5 0.5 0.5 − − 注:储备溶液添加去离子水至400 mL后,添加酶、胆汁盐、Ca2+溶液等,保证最终混合溶液体积为500 mL;由于CaCl2(H2O)2会发生沉淀,因此将其直接添加至最终混合物中。 表 2 胃肠消化液的制备
Table 2 Preparation of gastrointestinal digestive solution
消化液 制备 pH 定容 胃部消化液 模拟胃液电解质储备液
(400 mL)调节pH=3 超纯水定容至
500 mL胃蛋白酶(2000 U/mL) 肠部消化液 模拟肠液电解质储备液
(400 mL)调节pH=7 超纯水定容至
500 mL胰蛋白酶(100 U/mL) 胰酶(4 U SP/mL) 猪胆盐(10 mmol/L) 表 3 样品基本组分测定值
Table 3 Measured value of basic components of samples
样品名称 水分(g) 灰分(g) 蛋白质(g) 脂肪(g) 粗纤维(g) 淀粉(g) 黄豆粉 12.46±0.08b 4.95±0.02a 42.06±0.49b 17.31±0.21a 8.18±0.09a 26.91±0.81e 绿豆粉 13.31±0.12a 3.66±0.04e 41.31±0.39b 2.59±0.03f 4.6±0.31c 23.27±0.35f 黑豆粉 13.08±0.04a 4.45±0.04b 44.98±0.60a 11.93±0.17b 6.16±0.17b 50.53±1.27c 燕麦粉 9.41±0.05d 3.34±0.01g 8.77±0.09f 9.31±0.13c 1.38±0.21e 62.00±1.76b 苦荞粉 8.86±0.12e 3.45±0.02f 14.94±0.18e 2.41±0.05f 2.44±0.30d 69.62±1.20a 藜麦粉 8.66±0.20e 4.27±0.01c 17.77±0.24d 4.83±0.24e 6.28±0.24b 63.24±0.60b 代餐粉 10.91±0.05c 3.92±0.04d 23.41±0.38c 7.87±0.57d 4.33±0.22c 45.69±0.39d 注:每列中不同字母表示有显著性差异(P<0.01)。 表 4 粉质吸水率和膨胀度指标对比
Table 4 Comparison of powder water absorption and expansion indexes
样品 常温吸水率(%) 高温吸水率(%) 吸水膨胀率(%) 黄豆粉 0.33±0.12cd 0.60±0.09c 1.30 绿豆粉 0.48±0.03ab 0.83±0.03a 3.50 黑豆粉 0.29±0.08d 0.61±0.10c 1.02 燕麦粉 0.53±0.15a 0.86±0.05a 4.10 苦荞粉 0.41±0.17bc 0.77±0.05b 2.50 藜麦粉 0.36±0.23cd 0.62±0.01c 2.29 代餐粉 0.27±0.05d 0.59±0.05c 1.25 注:每列中不同字母表示有显著性差异(P<0.01)。 表 5 各样品的淀粉组分
Table 5 Starch fractions of each sample
样品 RDS(%) SDS(%) RS(%) 黄豆粉 63.7±0.016a 31.1±0.014c 5.3±0.004f 绿豆粉 58.2±0.01b 38.9±0.006a 2.8±0.004g 黑豆粉 65.1±0.004a 23.1±0.003e 11.8±0.003d 燕麦粉 54.7±0.003c 31.0±0.003c 14.3±0.00b 苦荞粉 56.8±0.002b 27.9±0.001d 15.3±0.002a 藜麦粉 58.2±0.001b 33.9±0.003b 7.9±0.002e 代餐粉 40.4±0.003d 46.3±0.003a 13.2±0.003c 注:每列中不同字母表示有显著性差异(P<0.01)。 -
[1] 王乐, 鲁久林, 孙祖林, 等. 杂粮加工现状及发展研究[J]. 粮食与食品工业,2023,30(3):1−3. [WANG L, LU J L, SUN Z L, et al. The current status and development research of coarse grain processing[J]. Cereal & Food Industry,2023,30(3):1−3.] WANG L, LU J L, SUN Z L, et al. The current status and development research of coarse grain processing[J]. Cereal & Food Industry, 2023, 30(3): 1−3.
[2] 邹易卿, 余雪冰. 杂粮营养功能研究现状与趋势[J]. 福建轻纺,2023,409(6):16−21. [ZOU Y Q, YU X B. Status and trends of research on nutritional functions of mixed grains[J]. The Light & Textile Industries of Fujian,2023,409(6):16−21.] ZOU Y Q, YU X B. Status and trends of research on nutritional functions of mixed grains[J]. The Light & Textile Industries of Fujian, 2023, 409(6): 16−21.
[3] 孙君社, 王民敬, 郭力城, 等. 基于辩证营养学的营养与健康系统构建[J]. 农业工程学报,2020,36(6):317−322. [SUN J S, WANG M J, GUO L C, et al. Construction of a nutrition and health system based on dialectical nutrition[J]. Journal of Agricultural Engineering,2020,36(6):317−322.] SUN J S, WANG M J, GUO L C, et al. Construction of a nutrition and health system based on dialectical nutrition[J]. Journal of Agricultural Engineering, 2020, 36(6): 317−322.
[4] 胡红娟, 何永吉, 李云龙. 基于山西杂粮优势开发功能食品的发展思路和建议[J]. 农产品加工,2020(12):90−92. [HU H J, HE Y J, LI Y L. Development ideas and suggestions on developing functional food based on the advantages of Shanxi coarse grains[J]. Agricultural Products Processing,2020(12):90−92.] HU H J, HE Y J, LI Y L. Development ideas and suggestions on developing functional food based on the advantages of Shanxi coarse grains[J]. Agricultural Products Processing, 2020(12): 90−92.
[5] 陈茜, 王振兴, 孙健, 等. 藜麦的营养成分、生物活性及加工利用[J]. 生物加工过程,2023,21(3):292−300. [CHEN Q, WANG Z X, SUN J, et al. Research progress on nutritional components, functional activities, and processing and utilization of quinoa[J]. Chinese Journal of Bioprocess Engineering,2023,21(3):292−300.] CHEN Q, WANG Z X, SUN J, et al. Research progress on nutritional components, functional activities, and processing and utilization of quinoa[J]. Chinese Journal of Bioprocess Engineering, 2023, 21(3): 292−300.
[6] 吴琦. 黄豆的营养价值及其加工价值[J]. 现代食品,2022,28(9):110−112. [WU Q. Nutritionalvalue of soybean and its processing value[J]. Modern Food,2022,28(9):110−112.] WU Q. Nutritionalvalue of soybean and its processing value[J]. Modern Food, 2022, 28(9): 110−112.
[7] 徐飞, 葛阳阳, 刘新春, 等. 黑豆营养成分及生物活性的研究进展[J]. 中国食物与营养,2019,25(9):7. [XU F, GE Y Y, LIU X C, et al. Progress in the nutritional components and biological activities of black beans[J]. Chinese Food and Nutrition,2019,25(9):7.] XU F, GE Y Y, LIU X C, et al. Progress in the nutritional components and biological activities of black beans[J]. Chinese Food and Nutrition, 2019, 25(9): 7.
[8] 周素梅, 李若凝, 唐健, 等. 绿豆营养功能特性及其在植物基食品开发中的应用[J]. 粮油食品科技,2022,30(2):16−23,12. [ZHOU S M, LI R N, TANG J, et al. Nutritional components and health functions of mung bean and its application in the development of plant-based food[J]. Science and Technology of Cereals, Oils and Foods,2022,30(2):16−23,12.] ZHOU S M, LI R N, TANG J, et al. Nutritional components and health functions of mung bean and its application in the development of plant-based food[J]. Science and Technology of Cereals, Oils and Foods, 2022, 30(2): 16−23,12.
[9] 中华医学会糖尿病学分会, 中国医师协会营养医师专业委员会. 中国糖尿病医学营养治疗指南(2013)[J]. 糖尿病天地(临床),2016,10(7):289−307. [Diabetes Branch of Chinese Medical Association, Nutritionists Professional Committee of Chinese Medical Doctor Association. China medical Nutrition Therapy Guidelines for Diabetes Mellitus (2013)[J]. Clinical Journal of Diabetes World,2016,10(7):289−307.] Diabetes Branch of Chinese Medical Association, Nutritionists Professional Committee of Chinese Medical Doctor Association. China medical Nutrition Therapy Guidelines for Diabetes Mellitus (2013)[J]. Clinical Journal of Diabetes World, 2016, 10(7): 289−307.
[10] 王润, 党斌, 杨希娟, 等. 低血糖生成指数食品研究现状与展望[J]. 青海农林科技, 2018, 111(3):68−71. [WANG R, DANG B, YANG X J, et al. Research review of low glycemic index foods[J]. Science and Technology of Qinghai Agriculture and Forestry, 2018, 111(3):73−90.] WANG R, DANG B, YANG X J, et al. Research review of low glycemic index foods[J]. Science and Technology of Qinghai Agriculture and Forestry, 2018, 111(3): 73−90.
[11] 孟繁钰, 张丽, 姜大伟, 等. 多谷物复合营养粉研究进展[J]. 粮食加工,2023,48(2):10−12,20. [MENG F Y, ZHANG L, JIANG D W, et al. Research progress in multi-grain compound nutrition powder[J]. Grain Processing,2023,48(2):10−12,20.] MENG F Y, ZHANG L, JIANG D W, et al. Research progress in multi-grain compound nutrition powder[J]. Grain Processing, 2023, 48(2): 10−12,20.
[12] 田文静, 罗红霞, 林少华, 等. 代餐粉的研究进展[J]. 食品科技,2020,45(9):95−101. [TIAN W J, LUO H X, LIN S H, et al. Research progress of meal replacement powder[J]. Food Science and Technology,2020,45(9):95−101.] TIAN W J, LUO H X, LIN S H, et al. Research progress of meal replacement powder[J]. Food Science and Technology, 2020, 45(9): 95−101.
[13] 费永涛, 郑文雄, 陈燕清, 等. 代餐粉特性及加工生产的研究进展[J]. 食品安全质量检测学报,2021,12(9):3557−3564. [FEI Y T, ZHENG W X, CHEN Y Q, et al. Research progress on characteristics and processing of meal replacement powder[J]. Journal of Food Safety and Quality,2021,12(9):3557−3564.] FEI Y T, ZHENG W X, CHEN Y Q, et al. Research progress on characteristics and processing of meal replacement powder[J]. Journal of Food Safety and Quality, 2021, 12(9): 3557−3564.
[14] 张园园. 低GI枸杞杂粮代餐粉的研制及其血糖调节作用研究[D]. 宁夏:宁夏大学, 2022. [ZHANG Y Y. Preparation of low GI Lycium meal replacemengt powder and its regulation effect on blood glucose[D]. Ningxia:Ningxia University, 2022.] ZHANG Y Y. Preparation of low GI Lycium meal replacemengt powder and its regulation effect on blood glucose[D]. Ningxia: Ningxia University, 2022.
[15] GATES F K, SONTAG-STROHM T, STODDARD F L, et al. Interaction of heat-moisture conditions and physical properties in oat processing:II. Flake quality[J]. Journal of Cereal Science,2008,48(2):288−293. doi: 10.1016/j.jcs.2007.09.009
[16] 路长喜, 王岸娜, 周素梅, 等. 燕麦片加工品质评价及其品种相关性研究[J]. 中国粮油学报,2009,24(8):42−46. [LU C X, WANG A N, ZHOU S M, et al. Evaluation of oatmeal processing quality and its variety correlation study[J]. Chinese Grain and Oil Journal,2009,24(8):42−46.] LU C X, WANG A N, ZHOU S M, et al. Evaluation of oatmeal processing quality and its variety correlation study[J]. Chinese Grain and Oil Journal, 2009, 24(8): 42−46.
[17] 陈子叶, 王丽娟, 李再贵. 燕麦营养成分与燕麦片加工品质相关性研究[J]. 粮油食品科技,2017(3):28−32. [CHEN Z Y, WANG L J, LI Z G. Study on the correlation between oat nutrition and oatmeal processing quality[J]. Grain, Oil and Food Technology,2017(3):28−32.] CHEN Z Y, WANG L J, LI Z G. Study on the correlation between oat nutrition and oatmeal processing quality[J]. Grain, Oil and Food Technology, 2017(3): 28−32.
[18] BJORCK I, GRANFELDT Y, LILJEBERG H, et al. Food properties affecting the digestion and absortion of carbohydrates[J]. American Journal of Clinical Nutrition,1994,59(3):699−705. doi: 10.1093/ajcn/59.3.699S
[19] WALLIS K. Resistant starch a natural functional food ingredient[J]. Food Australia,2004,56(6):242−242.
[20] GONI I, ALONSO A G, CALIXTO F A. A starch hydrolysis procedure to estimate glycemic index[J]. Nutrition Research,1997,17(3):430−437.
[21] MINEKIJS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-An international consensus[J]. Food & Function,2014,5(6):1113−1124.
[22] KRIEG R C, DONG Y, SCHWAMBORN K, et al. Protein quantification and its tolerance for different interfering reagents using the BCA-method with regard to 2D SDS PAGE[J]. Journal of Biochemical & Biophysical Methods,2005,65(1):13−19.
[23] 徐春明, 陈莹莹, 庞高阳. 纳豆发酵和体外模拟消化中活性物质含量及抗氧化活性的变化研究[J]. 现代食品科技,2016,32(11):78−84. [XU C M, CHEN Y Y, PANG G Y. Changes in the bioactive content and antioxidant activity of natto during fermentation and in vitro digestion[J]. Modern Food Science and Technology,2016,32(11):78−84.] XU C M, CHEN Y Y, PANG G Y. Changes in the bioactive content and antioxidant activity of natto during fermentation and in vitro digestion[J]. Modern Food Science and Technology, 2016, 32(11): 78−84.
[24] 杨敏, 周蕊, 奚军伟. 青海藜麦总黄酮及多酚共提工艺及其抗氧化活性[J]. 中南农业科技,2023,44(8):62−67. [YANG M, ZHOU R, XI J W. Co-extraction process of total flavonoids and polyphenols from Qinghai quinoa and its antioxidant activity[J]. South-Central Agricultural Science and Technology,2023,44(8):62−67.] YANG M, ZHOU R, XI J W. Co-extraction process of total flavonoids and polyphenols from Qinghai quinoa and its antioxidant activity[J]. South-Central Agricultural Science and Technology, 2023, 44(8): 62−67.
[25] 张孟琴, 徐路, 张俊波, 等. 三叶木通果皮主要营养成分、活性成分含量测定及果皮提取物抗氧化活性评价[J]. 食品工业科技,2022,43(10):388−394. [ZHANG M Q, XU L, ZHANG J B, et al. Determination of contents of the main nutritional components, functiona components of akebia trifoliata pericarp and the antioxidant activity of its extracts[J]. Science and Technology of Food Industry,2022,43(10):388−394.] ZHANG M Q, XU L, ZHANG J B, et al. Determination of contents of the main nutritional components, functiona components of akebia trifoliata pericarp and the antioxidant activity of its extracts[J]. Science and Technology of Food Industry, 2022, 43(10): 388−394.
[26] 向月, 曹亚楠, 赵钢, 等. 杂粮营养功能与安全研究进展[J]. 食品工业科技,2021,42(14):362−370. [XIANG Y, CAO Y N, ZHAO G, et al. Advances in the nutritional function and safety of coarse cereals[J]. Science and Technology of Food Industry,2021,42(14):362−370.] XIANG Y, CAO Y N, ZHAO G, et al. Advances in the nutritional function and safety of coarse cereals[J]. Science and Technology of Food Industry, 2021, 42(14): 362−370.
[27] 田文静, 赵东瑞, 张彤, 等. 复合杂粮代餐粉的研制[J]. 食品工业,2021,42(9):27−32. [TIAN W J, ZHAO D R, ZHANG T, et al. Development of multi-grain meal replacement powder[J]. The Food Industry,2021,42(9):27−32.] TIAN W J, ZHAO D R, ZHANG T, et al. Development of multi-grain meal replacement powder[J]. The Food Industry, 2021, 42(9): 27−32.
[28] 宋盼盼, 曹亚楠, 刘颖翔, 等. 苦荞复合代餐粉的研制[J]. 保鲜与加工,2021,21(9):43−51. [SONG P P, CAO Y N, LIU Y X, et al. Development of tartary buckwheat composite meal substitute powder[J]. Storage and Process,2021,21(9):43−51.] SONG P P, CAO Y N, LIU Y X, et al. Development of tartary buckwheat composite meal substitute powder[J]. Storage and Process, 2021, 21(9): 43−51.
[29] 李恒, 刘静, 孙桂菊, 等. 抗性淀粉、脂肪和蛋白质对淀粉体外消化速度的影响[J]. 卫生研究,2007(3):308−310. [LI H, LIU J, SUN G J, et al. Effects of resistant starch, fat and protein on rates of starch hydrolysis in vitro[J]. Journal of Hygiene Research,2007(3):308−310.] LI H, LIU J, SUN G J, et al. Effects of resistant starch, fat and protein on rates of starch hydrolysis in vitro[J]. Journal of Hygiene Research, 2007(3): 308−310.
[30] DHITAL S, WARREN F J, BUTTERWORTH P J, et al. Mechanisms of starch digestion by a-amylase-Structural basis for kinetic properties[J]. Critical Reviews in Food Technology,2017,57(5):875−892. doi: 10.1080/10408398.2014.922043
[31] KATE F P, SUSANNA H A, JANETTE C B M. International table of glycemic index and glycemic load values[J]. American Journal of Clinical Nutrition,2002,76:5−56. doi: 10.1093/ajcn/76.1.5
[32] BILGICLI N, IBANOGˇLU S, HERKEN E N. Effect of dietary fibre addition on the selected nutritional properties of cookies[J]. Journal of Food Engineering,2007,78(1):86−89. doi: 10.1016/j.jfoodeng.2005.09.009
[33] JU H K, CHUNG H W, HONG S S, et al. Effect of steam treatment on soluble phenolic content and antioxidant activity of the Chaga mushroom (Inonotus obliquus)[J]. Food Chemistry,2010,119(2):619−625. doi: 10.1016/j.foodchem.2009.07.006
[34] 陈树俊, 郑婕. 复合果蔬发酵汁有机酸动态分析及体外模拟消化抗氧化活性和功能成分分析[J]. 食品科学,2021,42(7):90−97. [CHEN S J, ZHENG J. Dynamic analysis of organic acids in compound fruit and vegetable fermentation juice and antioxidant activity and functional components in vitro simulated digestion[J]. Food Science,2021,42(7):90−97.] CHEN S J, ZHENG J. Dynamic analysis of organic acids in compound fruit and vegetable fermentation juice and antioxidant activity and functional components in vitro simulated digestion[J]. Food Science, 2021, 42(7): 90−97.
[35] 严莎莎, 马挺军. 苦荞饮料黄酮、酚酸含量及抗氧化能力分析[J]. 饮料工业,2023,26(3):6−10. [YAN S S, MA T J. Analysis of flavonoid and phenolicacid contentsand antioxidant capacity of tartary buckwheat beverage[J]. Beverage Industry,2023,26(3):6−10.] YAN S S, MA T J. Analysis of flavonoid and phenolicacid contentsand antioxidant capacity of tartary buckwheat beverage[J]. Beverage Industry, 2023, 26(3): 6−10.
[36] TAGLIAZUCCHI D, VERZELLONI E, BERTOLINI D, et al. In vitro bio-accessibility and antioxidant activity of grape polyphenols[J]. Food Chemistry,2010,120(2):599−606. doi: 10.1016/j.foodchem.2009.10.030
-
期刊类型引用(1)
1. 赵梦瑶,王法云,张立攀,王俊朋,李冰. 谷物低GI食品的研究进展. 现代食品. 2024(22): 165-169 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



