Applications of Bacillus Proteases in the Food Industry: A Review
-
摘要: 芽孢杆菌蛋白酶是一种重要的微生物源蛋白酶,其种类多样、活性显著、研究较为深入,已被广泛应用于食品行业。本文综述了产蛋白酶芽孢杆菌的筛选、高产蛋白酶菌株的选育与工程菌株的构建、蛋白酶发酵条件的优化,分别以植物蛋白和动物蛋白为作用对象介绍了芽孢杆菌蛋白酶在食品行业中的应用情况,并对将来的研究方向和发展趋势进行了展望,旨在为芽孢杆菌蛋白酶的深入研究和应用提供参考。Abstract: Bacillus protease, a microbial protease known for its diverse range, significant activity and extensive research, has been widely used in the food industry. This review covers various aspects, including the screening and selection of protease high-producing Bacillus strains, the construction of engineered bacteria, the optimization of fermentation conditions for protease production, and the application of Bacillus protease in the food industry, specifically with plant proteins and animal proteins as substrates. Moreover, the future research direction and development trend are forecasted. The purpose of this review is to serve as a scholarly resource for future investigation and practical utilization of Bacillus protease.
-
蛋白酶在食品工业、生物医药、动物饲料等领域应用广泛[1−4]。据统计,蛋白酶占酶制剂市场份额的65% [5]。蛋白酶的种类多样,根据来源,蛋白酶可被分为微生物源蛋白酶、动物源蛋白酶、植物源蛋白酶[6]。微生物以其来源广泛、培养周期短、便于工程化操作成为国际上蛋白酶最主要的来源。目前商品化的微生物源蛋白酶已超过100种,总产值占蛋白酶市场的2/3以上[7]。微生物源蛋白酶中以芽孢杆菌蛋白酶的研究最为广泛,商业化程度最高。芽孢杆菌蛋白酶已广泛应用于食品工业,包括动物食品加工、植物蛋白多肽制备等。芽孢杆菌蛋白酶的主要来源是枯草芽孢杆菌、地衣芽孢杆菌和短小芽孢杆菌,其中比较成熟的工业化菌株包括枯草芽孢杆菌Bacillus subtilis AS1.398、地衣芽孢杆菌B. licheniformis 2709、B. licheniformis C1213、短小芽孢杆菌B. pumilus 289、B. pumilus 209[8]。与国外相比,我国工业化的芽孢杆菌菌种资源不足,高产蛋白酶的工艺体系缺乏更新,酶活力和产量有限。在食品行业中,随着特殊功能性食品的发展,对嗜酸、嗜热、嗜盐等蛋白酶的需求逐渐凸显。因此,高产蛋白酶菌株的筛选、新型蛋白酶的开发仍是芽孢杆菌蛋白酶的研究热点。本文主要综述了产蛋白酶芽孢杆菌的筛选、提高芽孢杆菌蛋白酶产量的方法、芽孢杆菌蛋白酶在食品行业中的应用及未来发展趋势的展望。
1. 产蛋白酶芽孢杆菌的筛选
极端环境微生物应用前景广阔,目前从极端环境中分离嗜酸、嗜碱、嗜热、嗜冷、嗜盐、嗜压的微生物菌株是芽孢杆菌菌株筛选的研究重点。极端环境微生物来源的极端酶具有优良的稳定性,可在极端条件下发挥作用,蛋白酶也不例外。乔羽等[9]从山西陈醋中分离得到一株产酸性蛋白酶的暹罗芽孢杆菌B. siamens CD92-3。孙同毅等[10]从天津螗沽盐碱土壤中分离出一株产碱性蛋白酶的嗜碱芽孢杆菌B. alcalophilus HAP。朱檬等[11]从高温炙烤环境中分离出产高温丝氨酸蛋白酶的喜油嗜热芽孢杆菌Geobacillus thermoleovorans G1201。Mushtaq等[12]从喜马拉雅山脉土壤样品中分离出一株产低温蛋白酶的嗜冷芽孢杆菌B. sp. HM49。Wen等[13]从山区植被中分离出一株产耐高盐蛋白酶的芽孢杆菌B. halotolerans DS5。以上菌株的筛选均采用10倍梯度稀释、水解圈法、蛋白酶活性检测、耐受能力分析,这也是筛选产蛋白酶微生物的常用步骤。表1总结了具体的筛选过程和方法。从极端环境中筛选产蛋白酶菌株,可用于开发在苛刻工业条件下保持高稳定性、高活性的新型蛋白酶,如嗜酸蛋白酶、嗜碱蛋白酶、嗜热蛋白酶、嗜冷蛋白酶、嗜盐蛋白酶、嗜压蛋白酶,在食品、制药等生物技术领域具有潜在的应用价值。
表 1 产蛋白酶芽孢杆菌的筛选Table 1. Screening of protease-producing Bacillus strains菌种名称 来源 菌株特性 筛选方法 参考文献 暹罗芽孢杆菌
B. siamens CD92-3山西老陈醋 嗜酸,可耐受pH3.5的酸性环境,产中性蛋白酶和酸性蛋
白酶将样品梯度稀释后,涂布于酪素培养基,选择D/d比值较大的
菌落进行复筛,复筛培养基为营养肉汤培养基,培养温度均
为30 ℃[9] 嗜碱芽孢杆菌
B. alcalophilus HAP天津螗沽盐碱土壤 嗜碱,在pH7.0~11.0条件下生长,最适生长pH为10.0 将样品梯度稀释后,涂布于牛肉膏蛋白胨培养基,用划线法纯化 [10] 喜油嗜热芽孢杆菌
Geobacillus thermoleovorans G1201蒸汽排气口下含油土样 嗜热,所产蛋白酶的最适反应温度为70 ℃ 将样品梯度稀释后,涂布于脱脂奶粉培养基,培养温度为65 ℃,选择D/d比值较大的菌落进行复筛,复筛温度为70 ℃ [11] 嗜冷芽孢杆菌
B. sp. HM49喜马拉雅山脉西北部海拔1743米处的草原土壤 嗜冷,产酶温度为10~30 ℃,
最适产酶温度为20 ℃,所产
蛋白酶耐受温度低至5 ℃将样品梯度稀释后,涂布于营养琼脂培养基,用划线法纯化获得可培养菌株,将获得的可培养细菌在脱脂牛奶平板上初筛,选择形成透明水解圈的菌株,培养温度均为37 ℃左右;将上述菌株在10~40 ℃培养,观察其在低温环境中的产酶情况 [12] 耐盐芽孢杆菌
B. halotolerans DS5山西省左权山区富含枯叶的植被表面 耐盐,耐受高浓度10%的NaCl 将样品梯度稀释后,涂布于牛奶平板,选择D/d比值较大的菌落进行复筛,复筛培养基为液体产酶培养基,培养温度均为37 ℃ [13] 注:D/d表示水解圈直径(D)/菌落直径(d)的比值。 2. 高产蛋白酶菌株的选育与工程菌株的构建
自然环境中筛选出的微生物源蛋白酶产量普遍较低,不适用于商业应用[14−15]。通过物理诱变、化学诱变、基因重组技术选育或构建高产蛋白酶菌株是国内外的热点研究方向,表2总结了高产蛋白酶菌株选育及工程菌株构建的研究进展。黄子凌等[16]对产中性蛋白酶的枯草芽孢杆菌B. subtilis WT进行紫外诱变、LiCl诱变和紫外-LiCl复合诱变,筛选出能稳定高产中性蛋白酶的突变菌株UL-191,其蛋白酶产量达到108.8 U/mL,与野生菌株相比提高了44.2%。胡悦等[17]对地衣芽孢杆菌B. lincheniformis E-417进行诱变,采用LiCl-常压室温等离子体(ARTP)复合诱变法,LiCl添加量为1.5%、ARTP照射时间为45 s,筛选得到一株碱性蛋白酶高产菌株F-3,该菌株遗传稳定性好,蛋白酶产量高,可达12147 U/mL。物理诱变、化学诱变操作方便、成本低廉,但是随机性较大、获得正突变的效率较低,另外常伴有毒素的产生,蛋白酶的分离纯化难度较高。
表 2 高产蛋白酶菌株的选育与工程菌株的构建Table 2. Selection of protease high-producing strains and construction of engineering bacteria诱变育种与工程菌株构建技术 作用方式 优点 缺点 作用效果举例 参考文献 物理诱变 紫外诱变 操作方便、成本低廉、诱变效果好 工作量大,效率较低;产生蛋白酶的同时伴有毒素的产生,分离纯化难度高 紫外照射时间240 s,芽孢杆菌诱变菌株
U-16蛋白酶产量为82.28 U/mL,与出发菌株
相比提高了9.6%[16] 常压室温等离子
体诱变作用温度低、效果
显著,安全、简便、
成本低—* —* 化学诱变 LiCl诱变 高效、低毒 LiCl浓度2.1%,芽孢杆菌诱变菌株L-49蛋白酶产量为95.612 U/mL,与出发菌株相比提高了17.2% [16] 物理-化学复合诱变 紫外-LiCl复合诱变 具有协同效应,提高正突变率,诱变效果显著 紫外照射时间240 s,LiCl浓度2.1%,芽孢杆
菌复合诱变菌株UL-191蛋白酶产量达到108.8 U/mL,与野生菌株相比提高了44.2%[16] LiCl-常压室温等离子体复合诱变 氯化锂浓度1.5%,ARTP照射45 s,芽孢杆菌复合诱变菌株F-3蛋白酶产量达到12147 U/mL,与原始菌株相比提高了31.7% [17] 基因工程菌株构建 异源表达 提高蛋白酶的表达量,可定向提高酶的应用性能、简化菌体培养和蛋白酶分离纯化的步骤 发酵过程中加入诱导剂,不符合食品行业
的安全性要求对蜡状芽孢杆菌B. cereus MBL13-U进行基因组测序,克隆其胶原蛋白酶基因Colm13,将该基因连入大肠杆菌表达载体pET30a后,转入大肠杆菌宿主菌株BL21,经6‰ IPTG、37 ℃诱导6 h后,该重组菌株的胶原蛋白酶产量可达64.99 U/mL [19] 定点突变 对枯草芽孢杆菌角蛋白酶KerZ1的柔性环区域进行复合突变,获得突变体T210S/N211S/T212G,与野生酶相比,
其低温催化活性提升了85.74%[20] 蛋白质表面改造 对枯草芽孢杆菌中度耐盐丝氨酸蛋白酶进行表面改造,天冬氨酸和精氨酸残基置换后,突变体在高盐环境中的表面水合度和溶解度提高,耐盐性和pH稳定性显著上升 [21] 底盘细胞构建 降低基因组的复杂程度,减少非必要代谢
途径的干扰,提高菌株的底物利用率及产物产量非模式菌株构建工业底盘细胞的发展受限于遗传工具的匮乏 敲除枯草芽孢杆菌B. subtilis MBG874基因组序列的20%(874 kb),相比于野生株,蛋白酶产量提高了150% [27] 对B. amyloliquefaciens TCCC111018基因组序列进行179.14 kb的精简,精简菌株的碱性蛋白酶产量提高了36.55% [28] 注:*常压室温等离子体诱变常用于霉菌、细菌、酵母的诱变改造,但未见于高产碱性蛋白酶芽孢杆菌的选育。 在传统的物理、化学诱变之外,随着分子生物学的发展,将基因重组技术应用于蛋白酶的基因序列分析、结构解析、定点突变、异源表达以及批量生产也为产蛋白酶工程菌株的构建提供了新思路[18]。芽孢杆菌蛋白酶基因于1985年首次克隆成功,目前克隆表达的芽孢杆菌蛋白酶基因已达数千种。刘丽莉等[19]对蜡状芽孢杆菌B. cereus MBL13-U进行基因组测序,克隆其胶原蛋白酶基因Colm13,将该基因连入大肠杆菌表达载体pET30a后,转入大肠杆菌宿主菌株BL21,经6‰异丙基硫代半乳糖苷(IPTG)、37 ℃诱导6 h后,该重组菌株的胶原蛋白酶产量可达64.99 U/mL。周冠宇等[20]对枯草芽孢杆菌角蛋白酶KerZ1的柔性环区域进行复合突变,获得突变体T210S/N211S/T212G。该三突变体的低温催化活性显著提高,与野生酶相比提升了85.74%。Takenaka等[21]对枯草芽孢杆菌中度耐盐丝氨酸蛋白酶进行表面改造,发现天冬氨酸和精氨酸残基置换后,蛋白突变体在高盐环境中的表面水合度和溶解度提高,其耐盐性和pH稳定性显著上升。基因重组技术应用于产蛋白酶工程菌株构建不仅能提高蛋白酶的表达量、定向改造蛋白酶的性能,还能简化菌株培养和蛋白酶分离纯化的步骤,但是发酵过程中加入的诱导剂,不符合食品行业的安全性要求。
对产蛋白酶菌株进行遗传改造,构建高产蛋白酶的底盘细胞也逐渐引起科学家的重视。构建底盘细胞的主要手段是基因组简化,常用的芽孢杆菌出发菌株为B. subtilis 168、B. subtilis BSK814、B. subtilis BSZ10、B. subtilis IIG-Bs20、B. amyloliquefaciens LL3,采用以同源重组系统、位点特异性重组系统和CRISPR/Cas系统为主的基因组编辑方法,已经实现芽孢杆菌底盘细胞构建[22−26]。Morimoto等[27]报道了一株芽孢杆菌B. subtilis MBG874,敲除基因组序列的20%(874 kb),相比于野生株,其蛋白酶产量提高了150%。李昕悦[28]以B. amyloliquefaciens TCCC111018为原始菌株,对其基因组进行了179.14 kb的精简,相比于出发菌株,精简菌株的碱性蛋白酶产量提高了36.55%。通过高产蛋白酶底盘细胞的构建,降低基因组的复杂程度和非必要代谢途径的干扰,芽孢杆菌蛋白酶的生产能力得以提高。构建底盘细胞需在维持基因组稳定性的前提下进行,成本和难度较高,另外遗传工具的匮乏限制了非模式菌株工业底盘细胞的构建。
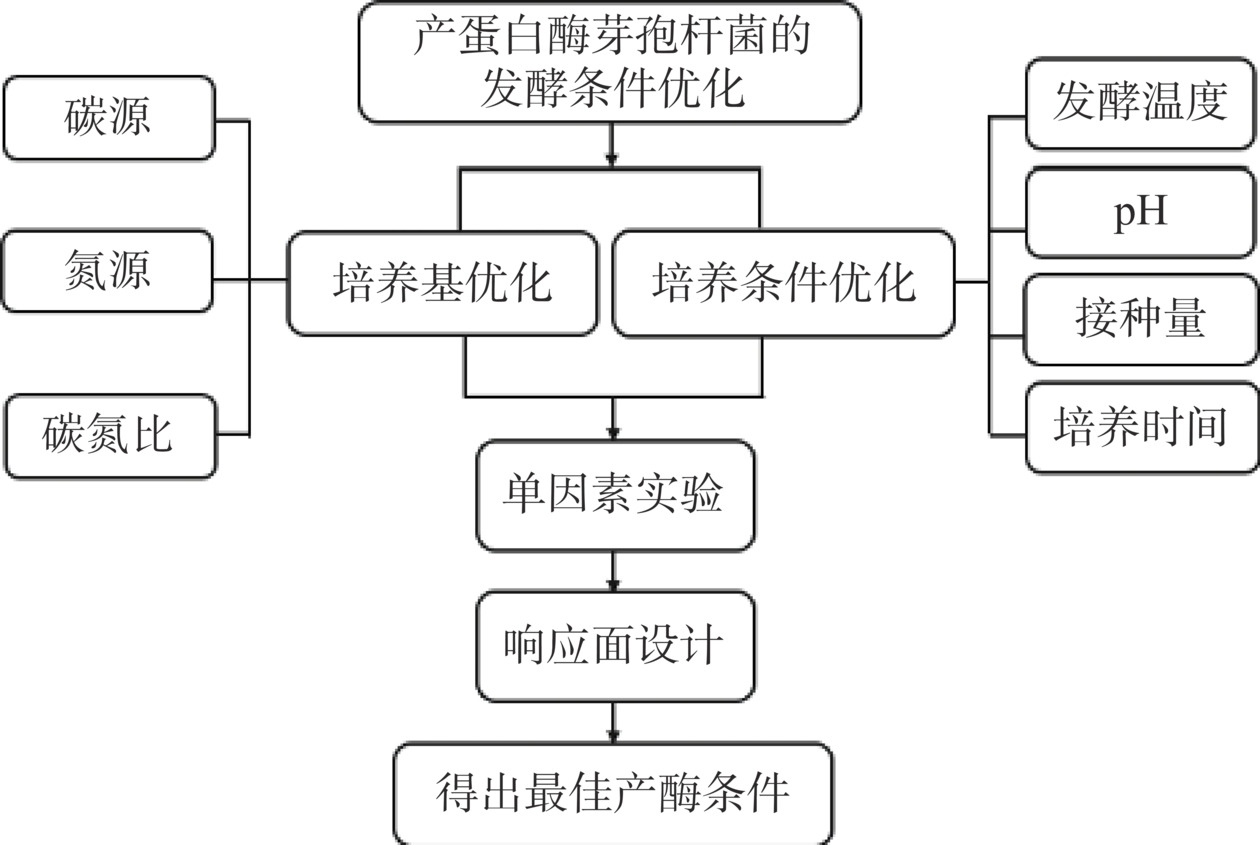
3. 产蛋白酶芽孢杆菌的发酵条件优化
芽孢杆菌的胞外蛋白酶产量受碳源、氮源等培养基组分和培养温度、pH等培养条件的影响,对以上因素进行优化可以大幅提高菌株的蛋白酶产量。响应面法(Response Surface Method,RSM)因其可以有效减少实验次数、并得出不同因素之间的交互作用的优势已成为优化微生物发酵条件的主要方法[29]。培养基与培养条件优化流程见图1。目前,常用Design Expert软件进行响应面试验设计与数学建模[30]。Yewande等[31]根据单因素实验的结果发现影响蛋白酶产量的4个最显著的因素为发酵温度、初始接种量、碳源、氮源,进一步使用Design Expert 11软件进行Box-Behnken响应面设计,对蜡样芽孢杆菌B. cereus ABBA1、枯草芽孢杆菌B. subtilis RD7和B. subtilis NRD9的产酶条件进行优化,优化后的最高酶活分别提高33.54、42.21、36.64倍。除液态发酵之外,固态发酵也是提高微生物胞外酶产量的常见方式[32]。Tuly等[33]以鸡毛粉(CFP)和豆渣为原料对地衣芽孢杆菌突变株进行固态发酵条件优化,发现最适的豆渣与CFP比值为7:10,最适接种量和时间分别15%和90 h,最终角蛋白酶产量达910.12 U/g,肽量达到185.99 mg/g,抗氧化清除活性达到85.03%,芽孢杆菌分泌蛋白酶发酵鸡毛粉和豆渣有利于其在食品工业中的高值化应用。优化芽孢杆菌的发酵条件不仅提高了蛋白酶的产量,还为廉价的农业废料的高值生物转化提供了新途径。
4. 芽孢杆菌蛋白酶在食品工业中的应用
芽孢杆菌蛋白酶在食品行业中的应用主要基于其对植物蛋白、动物蛋白的水解。目前芽孢杆菌蛋白酶的应用对象较多,包括大豆蛋白、豌豆蛋白、花生蛋白、米糠蛋白在内的多种植物蛋白以及胶原蛋白、弹性蛋白等动物蛋白。蛋白酶的应用可获取高值化、易吸收的蛋白肽,也可用于提高植物蛋白的提取率和肉类的嫩度,表3总结了芽孢杆菌蛋白酶以不同植物蛋白和动物蛋白为应用对象在食品中的应用。
表 3 芽孢杆菌蛋白酶在食品工业中的应用Table 3. Application of Bacillus proteases in the food industry作用对象 来源菌株 蛋白酶 作用效果 参考文献 植物蛋白 大豆蛋白 地衣芽孢杆菌B. licheniformis 碱性蛋白酶Alcalase 高效水解大豆分离蛋白,制备的大豆蛋白肽具有良好的生理功能和营养价值 [38] 枯草芽孢杆菌B. subtilis MTCC5480
枯草芽孢杆菌
B. subtilis MTCC1747纤维蛋白水解酶 高效水解大豆,随着大豆蛋白水解程度的提高,多肽和游离氨基酸的释放量增加并呈现出较强的抗氧化性能,可用于开发为食品/饲料添加剂 [44] 巨大芽孢杆菌B. megaterium 羧肽酶cpm32 羧肽酶cpm与碱性蛋白酶联合使用对大豆分离蛋白进行脱苦处理,苦味值降低到商业上可接受的水平,有效改善大豆分离蛋白的风味 [47] 豌豆蛋白 地衣芽孢杆菌B. licheniformis 热稳定蛋白酶(EC 3.4.21.19) 提高豌豆蛋白中精氨酸、亮氨酸、苯丙氨酸、组氨酸、酪氨酸、丙氨酸和脯氨酸的可消化率 [45] 地衣芽孢杆菌B. licheniformis LBA46 碱性蛋白酶LBA 地衣芽孢杆菌豌豆蛋白水解物呈现出显著的DPPH自由基清除率、氧自由基吸收率和铁离子还原抗氧化能力 [39] 花生蛋白 地衣芽孢杆菌B. licheniformis CGMCC0635 地衣芽孢杆菌胞外蛋白酶 提高花生蛋白中粗蛋白、有机酸、酸溶性寡肽等活性物质、矿物质和抗氧化特性、氨基酸平衡和体外消化率,增强花生营养和功能特性 [43] 米糠蛋白 嗜热芽孢杆菌B. thermophilus 嗜热芽孢杆菌蛋白酶Thermolysin 消化处理米糠,制备的肽具有抗高血压功能 [41] 枯草芽孢杆菌B. subtilis WS9 胰蛋白酶和氨肽酶ScAPase 制备的大米蛋白肽对血管紧张素转换酶呈现明显的抑制活性,并有较高的抗氧化活性,可用于制备生物活性肽、降低苦味以及提高大米分离蛋白水解物品质 [46] 动物蛋白 胶原蛋白 蜡状芽孢杆菌B. cereus CMCC63303 胶原蛋白酶 制备的胶原蛋白肽具有显著的抗氧化活性,对ABTS+自由基清除率高达99.21%±0.35%,同时具有较高的DPPH自由基清除力和还原力;获得五个具有Gly-Xaa-Yaa重复序列的抗氧化肽 [50] 弹性蛋白 枯草芽孢杆菌B. subtilis BEM01 弹性蛋白酶 对肉类样品的嫩化效果强于木瓜蛋白酶 [55] 枯草芽孢杆菌B. subtilis 10071 弹性蛋白酶 可水解猪肉、牛肉的主动脉,使其韧度下降,最适作用温度为50 ℃ [56] 枯草芽孢杆菌B. subtilis B13 暹罗芽孢杆菌B. siamemsis S6 丝氨酸蛋白酶
金属蛋白酶能高效水解弹性蛋白和牛肉肌内胶原蛋白,可用作嫩肉剂 [54] 枯草芽孢杆菌B. subtilis 枯草芽孢杆菌蛋白酶
CTC E-ssentials™ MT-70N在室温下对卡拉牛肉有显著的嫩化作用,并且比含有木瓜蛋白酶的市售嫩肉剂的嫩化作用更明显,具有取代植物源蛋白酶嫩肉粉的潜质 [57] 芽孢杆菌B. sp. EL31410 弹性蛋白酶 在4 ℃下处理48 h,对牛肉的嫩化作用显著,可用于低温条件下适用的肉类嫩化剂 [58] 4.1 以植物蛋白为应用对象
植物蛋白具有良好的营养价值、低廉的成本,被广泛用于多种食品。大豆蛋白被认为是营养价值最高的植物蛋白[34]。豌豆蛋白是一种相对新型的优质植物蛋白质[35]。榨油后的花生副产品中的蛋白质含量达到50% [36]。米糠中蛋白质含量约为10%~20%,其中6%~8%为胚乳[37]。芽孢杆菌蛋白酶已用于大豆蛋白、豌豆蛋白、花生蛋白、米糠蛋白等植物蛋白肽的制备、加工和脱苦。通过芽孢杆菌蛋白酶水解将植物蛋白转化为小分子的肽,可以提高其吸收率和生物可及性,并降低植物蛋白的致敏性。
4.1.1 植物蛋白肽的制备
地衣芽孢杆菌蛋白酶Alcalase酶解制备的大豆蛋白肽具有良好的生理功能和营养价值[38]。地衣芽孢杆菌B. licheniformis LBA46蛋白酶可用于水解豌豆蛋白制备豌豆蛋白肽,利用响应面法优化了豌豆蛋白的水解条件,最终选择pH10、酶浓度100 U/mL作为最优的水解工艺条件,水解产物具有显著的DPPH自由基清除率、氧自由基吸收率(ORAC)和铁离子还原抗氧化能力(FRAP),表现出一定的应用潜力[39]。据报道,蛋白酶水解米糠蛋白可以释放抗高血压肽。嗜热芽孢杆菌蛋白酶Thermolysin倾向于裂解疏水氨基酸的N端,如亮氨酸、苯丙氨酸、异亮氨酸、缬氨酸[40]。Thermolysin消化处理米糠,制备的肽的抗高血压功能已经在人体临床研究中得到证实[41]。
4.1.2 植物蛋白的加工
利用中性蛋白酶和碱性蛋白酶控制水解度在1%~10%之间,可以提取花生蛋白,并改善花生蛋白溶解度、乳化性和发泡性[42]。另外,在蛋白酶的作用下,花生蛋白的肽键断裂,释放包裹在蛋白质中的脂肪,不仅提高了花生油的提取率,还能得到花生蛋白肽。Yang等[43]发现地衣芽孢杆菌B. licheniformis CGMCC 0635能够改善花生蛋白酶解产物的粗蛋白、有机酸、酸溶性寡肽、矿物质等营养特性,并增强抗氧化性能、氨基酸平衡和体外消化率等功能特性。Samurailatpam等[44]使用枯草芽孢杆菌B. subtilis MTCC5480和B. subtilis MTCC1747蛋白酶水解大豆蛋白,释放的多肽和游离氨基酸呈现出较强的抗氧化性能。据报道,利用地衣芽孢杆菌B. licheniformis蛋白酶处理豌豆,可提高豌豆蛋白中多种氨基酸的可消化率[45]。
4.1.3 植物蛋白的脱苦
植物蛋白水解物的苦味是将其开发为食品配料或添加剂的限制因素之一。Yan等[46]在食品级表达宿主枯草芽孢杆菌中表达了氨肽酶ScAPase,联合使用胰蛋白酶(2.0 g/g RPI)和氨肽酶ScAPase(3.5 g/g RPI),对大米分离蛋白进行品质改良,反应温度为50 ℃,反应时间为4 h,制备的大米蛋白肽无任何苦味,并对血管紧张素转换酶呈现明显的抑制活性,有较高的抗氧化活性,显著提高了大米分离蛋白水解物的品质。Ding等[47]联合使用巨大芽孢杆菌B. megaterium羧肽酶cpm32与4%碱性蛋白酶,对大豆分离蛋白进行脱苦处理,苦味值降低47.6%,达到食品行业可接受的水平。
4.2 以动物蛋白为应用对象
4.2.1 胶原蛋白肽的制备
肉类加工的副产品动物骨、皮,如猪皮、牛骨、鱼鳞中富含胶原蛋白[48]。胶原蛋白因其特殊的三链螺旋结构,不易被普通蛋白酶水解。胶原蛋白酶可特异性识别并切割胶原蛋白,释放胶原蛋白肽。胶原蛋白酶水解动物胶原蛋白是提高其附加值和消化吸收率的有效措施[49]。Song等[50]对蜡状芽孢杆菌B. cereus CMCC63303胶原蛋白酶进行了异源表达和分离纯化,并将其应用于牛骨胶原蛋白的水解以制备胶原蛋白肽。采用响应面法对胶原蛋白肽的制备工艺进行优化,制备的胶原蛋白肽具有显著的抗氧化活性,并获得五个具有Gly-Xaa-Yaa典型重复序列的抗氧化肽,具有开发为骨胶原功能食品的潜力。
4.2.2 肉类的嫩化
芽孢杆菌蛋白酶通过降解弹性蛋白和肌原纤维进而使肉品嫩度增加[51]。刘书亮等[52]发现枯草芽孢杆菌紫外诱变株B. subtilis BEM01分泌的弹性蛋白酶具有比木瓜蛋白酶更强的肉品嫩化作用。韩建春等[53]研究了枯草芽孢杆菌B. subtilis 10071所产弹性蛋白酶对肉类样品的嫩化作用,发现该弹性蛋白酶可水解猪肉、牛肉的主动脉,使其韧度下降。Sorapukdee等[54]发现芽孢杆菌B. subtilis B13和B. siamemsis S6分泌的蛋白酶能高效水解牛跟腱胶原蛋白,与木瓜蛋白酶和菠萝蛋白酶相比,这两种芽孢杆菌蛋白酶对弹性蛋白和牛肉肌内胶原蛋白的水解活性更高,对牛肉肌原纤维蛋白的降解率较低,最适酶活温度分别为50 ℃和60 ℃,可以用作嫩肉剂。
在低温条件下进行肉品嫩化处理,更有利于保持肉品的新鲜程度、提高肉品的品质,因此低温蛋白酶的开发很有必要[55−56]。CTC E-ssentials™ MT-70N是一种商品化的枯草芽孢杆菌蛋白酶,能在室温下嫩化卡拉牛肉,其嫩化作用比含有木瓜蛋白酶的市售嫩肉剂更明显,具有取代植物源蛋白酶嫩肉粉的潜质[57]。Chen等[58]研究了芽孢杆菌B. sp. EL31410分泌的一种新型弹性蛋白酶对牛肉的嫩化作用,在4 ℃处理48 h后,该弹性蛋白酶选择性降解肌原纤维结构的弹性蛋白,说明该蛋白酶为低温蛋白酶,有望开发成低温条件下适用的肉类嫩化剂。
5. 结语及展望
随着生物技术的发展和产业结构的调整,微生物源蛋白酶尤其是芽孢杆菌蛋白酶的研究取得了重大进展,其在食品工业中的应用也获得了广泛的关注。芽孢杆菌属是主要的蛋白酶产生菌,研究较多的有枯草芽孢杆菌(B. subtilis)、地衣芽孢杆菌(B. licheniformis)、解淀粉芽胞杆菌(B. amyloliquefaciens)、短小芽孢杆菌(B. pumilus)、蜡样芽孢杆菌(B. cereus)和暹罗芽孢杆菌(B. siamemsis)。工业上对动植物蛋白资源的利用主要依赖于酸碱水解、高温高压水解。相比于这些理化方式,酶解法具有能耗低、环境污染小、营养损失小的优势。但是,芽孢杆菌所产蛋白酶的实际应用受限于产量低、活性差、性质弱等劣势,尤其是野生型产蛋白酶芽孢杆菌的酶表达量不高,难以满足工业化生产和应用。目前,国内外专家学者对产蛋白酶芽孢杆菌的筛选、高产蛋白酶菌株的选育及工程菌株的构建、芽孢杆菌蛋白酶的发酵条件优化及应用潜力评价等方面的研究较为深入。保持酶的高产量、高活性、高稳定性、高纯度是蛋白酶在工业应用中绕不开的挑战,有赖于经典的发酵技术和提纯工艺的进步,近年来飞速发展的合成生物学也为解决这些难题提供了新的途径。蛋白酶基因的定点突变、异源表达、底盘细胞设计等新技术的发展有望提高微生物源蛋白酶的活力、稳定性和产量。
于食品行业而言,酶制剂的一个不可忽视的问题是安全性。致病微生物或转基因微生物来源的酶制剂具有一定的安全隐患。根据《食品添加剂使用标准》(GB 2760)与食品添加剂公告规定的食品用酶制剂及其来源名单,允许使用的微生物源酶制剂有137种。蛋白酶是应用最广泛的工业化酶制剂。GB 2760中规定使用的芽孢杆菌蛋白酶来源于枯草芽孢杆菌(B. subtilis)、解淀粉芽孢杆菌(B. amyloliquefaciens)、热解蛋白无氧芽孢杆菌(Anoxybacillus caldiproteolyticus)、嗜热脂解地芽孢杆菌(Geobacillus stearothermophilus)等。但是该名单中的酶制剂在来源、品种及表述方式方面已不能完全适用于当今食品行业的需要。除此之外的酶制剂均应作为新型酶制剂进行申报,经审批后才能应用于食品工业。食品用酶制剂的安全性评价体系的建立及相关法规标准的健全是规范酶制剂管理、保证食品安全的必要条件,也是将来需要重点发展的方向。
产蛋白酶微生物资源库的丰富仍是未来的研究重点,尤其是来源于极端环境中的微生物及蛋白酶有更大的应用潜力。目前从极端环境中分离到的嗜热、嗜冷、嗜盐、嗜碱、嗜酸微生物均有芽孢杆菌属细菌的身影,其中多株能分泌高稳定性的蛋白酶,为食品工业应用提供了更多的选择。常用的极端环境微生物筛选方法仍是基于传统的微生物分离培养技术,但是极端环境中的绝大部分微生物是不可培养的,限制了极端环境微生物菌种资源和基因资源的发掘。近年来发展起来的宏基因组学是开发未培养微生物基因资源的有效途径,不依赖于微生物的纯培养环节,直接对特定环境中的微生物总基因组进行研究,筛选其中特定功能的基因。该技术已逐渐应用于特殊性质酯酶、蛋白酶、纤维素酶、淀粉酶的基因筛选。但是该技术在筛选新型蛋白酶的应用中还受限于测序的速度和费用、从巨大的文库中高效筛选目的基因的序列分析法、异源基因的表达,今后需要不断的探索和改进。
-
表 1 产蛋白酶芽孢杆菌的筛选
Table 1 Screening of protease-producing Bacillus strains
菌种名称 来源 菌株特性 筛选方法 参考文献 暹罗芽孢杆菌
B. siamens CD92-3山西老陈醋 嗜酸,可耐受pH3.5的酸性环境,产中性蛋白酶和酸性蛋
白酶将样品梯度稀释后,涂布于酪素培养基,选择D/d比值较大的
菌落进行复筛,复筛培养基为营养肉汤培养基,培养温度均
为30 ℃[9] 嗜碱芽孢杆菌
B. alcalophilus HAP天津螗沽盐碱土壤 嗜碱,在pH7.0~11.0条件下生长,最适生长pH为10.0 将样品梯度稀释后,涂布于牛肉膏蛋白胨培养基,用划线法纯化 [10] 喜油嗜热芽孢杆菌
Geobacillus thermoleovorans G1201蒸汽排气口下含油土样 嗜热,所产蛋白酶的最适反应温度为70 ℃ 将样品梯度稀释后,涂布于脱脂奶粉培养基,培养温度为65 ℃,选择D/d比值较大的菌落进行复筛,复筛温度为70 ℃ [11] 嗜冷芽孢杆菌
B. sp. HM49喜马拉雅山脉西北部海拔1743米处的草原土壤 嗜冷,产酶温度为10~30 ℃,
最适产酶温度为20 ℃,所产
蛋白酶耐受温度低至5 ℃将样品梯度稀释后,涂布于营养琼脂培养基,用划线法纯化获得可培养菌株,将获得的可培养细菌在脱脂牛奶平板上初筛,选择形成透明水解圈的菌株,培养温度均为37 ℃左右;将上述菌株在10~40 ℃培养,观察其在低温环境中的产酶情况 [12] 耐盐芽孢杆菌
B. halotolerans DS5山西省左权山区富含枯叶的植被表面 耐盐,耐受高浓度10%的NaCl 将样品梯度稀释后,涂布于牛奶平板,选择D/d比值较大的菌落进行复筛,复筛培养基为液体产酶培养基,培养温度均为37 ℃ [13] 注:D/d表示水解圈直径(D)/菌落直径(d)的比值。 表 2 高产蛋白酶菌株的选育与工程菌株的构建
Table 2 Selection of protease high-producing strains and construction of engineering bacteria
诱变育种与工程菌株构建技术 作用方式 优点 缺点 作用效果举例 参考文献 物理诱变 紫外诱变 操作方便、成本低廉、诱变效果好 工作量大,效率较低;产生蛋白酶的同时伴有毒素的产生,分离纯化难度高 紫外照射时间240 s,芽孢杆菌诱变菌株
U-16蛋白酶产量为82.28 U/mL,与出发菌株
相比提高了9.6%[16] 常压室温等离子
体诱变作用温度低、效果
显著,安全、简便、
成本低—* —* 化学诱变 LiCl诱变 高效、低毒 LiCl浓度2.1%,芽孢杆菌诱变菌株L-49蛋白酶产量为95.612 U/mL,与出发菌株相比提高了17.2% [16] 物理-化学复合诱变 紫外-LiCl复合诱变 具有协同效应,提高正突变率,诱变效果显著 紫外照射时间240 s,LiCl浓度2.1%,芽孢杆
菌复合诱变菌株UL-191蛋白酶产量达到108.8 U/mL,与野生菌株相比提高了44.2%[16] LiCl-常压室温等离子体复合诱变 氯化锂浓度1.5%,ARTP照射45 s,芽孢杆菌复合诱变菌株F-3蛋白酶产量达到12147 U/mL,与原始菌株相比提高了31.7% [17] 基因工程菌株构建 异源表达 提高蛋白酶的表达量,可定向提高酶的应用性能、简化菌体培养和蛋白酶分离纯化的步骤 发酵过程中加入诱导剂,不符合食品行业
的安全性要求对蜡状芽孢杆菌B. cereus MBL13-U进行基因组测序,克隆其胶原蛋白酶基因Colm13,将该基因连入大肠杆菌表达载体pET30a后,转入大肠杆菌宿主菌株BL21,经6‰ IPTG、37 ℃诱导6 h后,该重组菌株的胶原蛋白酶产量可达64.99 U/mL [19] 定点突变 对枯草芽孢杆菌角蛋白酶KerZ1的柔性环区域进行复合突变,获得突变体T210S/N211S/T212G,与野生酶相比,
其低温催化活性提升了85.74%[20] 蛋白质表面改造 对枯草芽孢杆菌中度耐盐丝氨酸蛋白酶进行表面改造,天冬氨酸和精氨酸残基置换后,突变体在高盐环境中的表面水合度和溶解度提高,耐盐性和pH稳定性显著上升 [21] 底盘细胞构建 降低基因组的复杂程度,减少非必要代谢
途径的干扰,提高菌株的底物利用率及产物产量非模式菌株构建工业底盘细胞的发展受限于遗传工具的匮乏 敲除枯草芽孢杆菌B. subtilis MBG874基因组序列的20%(874 kb),相比于野生株,蛋白酶产量提高了150% [27] 对B. amyloliquefaciens TCCC111018基因组序列进行179.14 kb的精简,精简菌株的碱性蛋白酶产量提高了36.55% [28] 注:*常压室温等离子体诱变常用于霉菌、细菌、酵母的诱变改造,但未见于高产碱性蛋白酶芽孢杆菌的选育。 表 3 芽孢杆菌蛋白酶在食品工业中的应用
Table 3 Application of Bacillus proteases in the food industry
作用对象 来源菌株 蛋白酶 作用效果 参考文献 植物蛋白 大豆蛋白 地衣芽孢杆菌B. licheniformis 碱性蛋白酶Alcalase 高效水解大豆分离蛋白,制备的大豆蛋白肽具有良好的生理功能和营养价值 [38] 枯草芽孢杆菌B. subtilis MTCC5480
枯草芽孢杆菌
B. subtilis MTCC1747纤维蛋白水解酶 高效水解大豆,随着大豆蛋白水解程度的提高,多肽和游离氨基酸的释放量增加并呈现出较强的抗氧化性能,可用于开发为食品/饲料添加剂 [44] 巨大芽孢杆菌B. megaterium 羧肽酶cpm32 羧肽酶cpm与碱性蛋白酶联合使用对大豆分离蛋白进行脱苦处理,苦味值降低到商业上可接受的水平,有效改善大豆分离蛋白的风味 [47] 豌豆蛋白 地衣芽孢杆菌B. licheniformis 热稳定蛋白酶(EC 3.4.21.19) 提高豌豆蛋白中精氨酸、亮氨酸、苯丙氨酸、组氨酸、酪氨酸、丙氨酸和脯氨酸的可消化率 [45] 地衣芽孢杆菌B. licheniformis LBA46 碱性蛋白酶LBA 地衣芽孢杆菌豌豆蛋白水解物呈现出显著的DPPH自由基清除率、氧自由基吸收率和铁离子还原抗氧化能力 [39] 花生蛋白 地衣芽孢杆菌B. licheniformis CGMCC0635 地衣芽孢杆菌胞外蛋白酶 提高花生蛋白中粗蛋白、有机酸、酸溶性寡肽等活性物质、矿物质和抗氧化特性、氨基酸平衡和体外消化率,增强花生营养和功能特性 [43] 米糠蛋白 嗜热芽孢杆菌B. thermophilus 嗜热芽孢杆菌蛋白酶Thermolysin 消化处理米糠,制备的肽具有抗高血压功能 [41] 枯草芽孢杆菌B. subtilis WS9 胰蛋白酶和氨肽酶ScAPase 制备的大米蛋白肽对血管紧张素转换酶呈现明显的抑制活性,并有较高的抗氧化活性,可用于制备生物活性肽、降低苦味以及提高大米分离蛋白水解物品质 [46] 动物蛋白 胶原蛋白 蜡状芽孢杆菌B. cereus CMCC63303 胶原蛋白酶 制备的胶原蛋白肽具有显著的抗氧化活性,对ABTS+自由基清除率高达99.21%±0.35%,同时具有较高的DPPH自由基清除力和还原力;获得五个具有Gly-Xaa-Yaa重复序列的抗氧化肽 [50] 弹性蛋白 枯草芽孢杆菌B. subtilis BEM01 弹性蛋白酶 对肉类样品的嫩化效果强于木瓜蛋白酶 [55] 枯草芽孢杆菌B. subtilis 10071 弹性蛋白酶 可水解猪肉、牛肉的主动脉,使其韧度下降,最适作用温度为50 ℃ [56] 枯草芽孢杆菌B. subtilis B13 暹罗芽孢杆菌B. siamemsis S6 丝氨酸蛋白酶
金属蛋白酶能高效水解弹性蛋白和牛肉肌内胶原蛋白,可用作嫩肉剂 [54] 枯草芽孢杆菌B. subtilis 枯草芽孢杆菌蛋白酶
CTC E-ssentials™ MT-70N在室温下对卡拉牛肉有显著的嫩化作用,并且比含有木瓜蛋白酶的市售嫩肉剂的嫩化作用更明显,具有取代植物源蛋白酶嫩肉粉的潜质 [57] 芽孢杆菌B. sp. EL31410 弹性蛋白酶 在4 ℃下处理48 h,对牛肉的嫩化作用显著,可用于低温条件下适用的肉类嫩化剂 [58] -
[1] BANERJEE G, RAY A K. Impact of microbial proteases on biotechnological industries[J]. Biotechnology and Genetic Engineering Reviews,2017,33(2):119−143. doi: 10.1080/02648725.2017.1408256
[2] MOHD A S, KUMAR P, SHARMA N, et al. Application of plant proteases in meat tenderization:Recent trends and future prospects[J]. Foods,2023,12(6):1206−1336. doi: 10.3390/foods12061206
[3] LIANG Q, YUAN M, XU L, et al. Application of enzymes as a feed additive in aquaculture[J]. Marine Life Science and Technology,2022,4(2):208−221. doi: 10.1007/s42995-022-00128-z
[4] KAMAL S, REHMAN S, IQBAL H. Biotechnological valorization of proteases:From hyper-production to industrial exploitation-A review[J]. Environmental Progress and Sustainable Energy,2016,36(2):511−522.
[5] GARG S, NURGALI K, MISHRA V K. Food proteins as source of opioid peptides-A review[J]. Current Medicinal Chemistry,2016,23(9):893−910. doi: 10.2174/0929867323666160219115226
[6] POLGÁR L. Common feature of the four types of protease mechanism[J]. Biological Chemistry Hoppe-Seyler,1990,371:327−331.
[7] 于建荣, 毛开云, 陈大明. 工业酶制剂新产品开发和产业化情况分析[J]. 生物产业技术,2015(3):53−57. [YU J R, MAO K Y, CHEN D M. Analysis of product development and industrialization of industrial enzyme preparation[J]. Biotechnology and Business,2015(3):53−57.] YU J R, MAO K Y, CHEN D M. Analysis of product development and industrialization of industrial enzyme preparation[J]. Biotechnology and Business, 2015(3): 53−57.
[8] 艾雨晴, 陈松骏, 秦娟, 等. 微生物产蛋白酶的研究进展[J]. 食品工业科技,2021,42(19):451−458. [AI Y Q, CHEN S J, QIN J, et al. Advances in proteases produced by microorganisms[J]. Science and Technology of Food Industry,2021,42(19):451−458.] AI Y Q, CHEN S J, QIN J, et al. Advances in proteases produced by microorganisms[J]. Science and Technology of Food Industry, 2021, 42(19): 451−458.
[9] 乔羽, 于迪, 范振宇, 等. 山西老陈醋发酵过程中高产蛋白酶芽孢杆菌的筛选与鉴定[J]. 食品与发酵科技,2017,53(6):11−16,33. [QIAO Y, YU D, FAN Z Y, et al. Screening and identification of high protease producing Bacillus subtilis during the fermentation process of Shanxi aged vinegar[J]. Food and Fermentation Technology,2017,53(6):11−16,33.] QIAO Y, YU D, FAN Z Y, et al. Screening and identification of high protease producing Bacillus subtilis during the fermentation process of Shanxi aged vinegar[J]. Food and Fermentation Technology, 2017, 53(6): 11−16,33.
[10] 孙同毅, 邵伟光, 高志芹, 等. 一株产碱性蛋白酶的嗜碱芽孢杆菌的分离和鉴定[J]. 现代生物医学进展,2008(7):1256−1258. [SUN T Y, SHAO W G, GAO Z Q, et al. Isolation and identification of an alkaline protease producing Bacillus subtilis[J]. Progress in Modern Biomedical Sciences,2008(7):1256−1258.] doi: 10.3969/j.issn.1673-6273.2008.07.019 SUN T Y, SHAO W G, GAO Z Q, et al. Isolation and identification of an alkaline protease producing Bacillus subtilis[J]. Progress in Modern Biomedical Sciences, 2008(7): 1256−1258. doi: 10.3969/j.issn.1673-6273.2008.07.019
[11] 朱檬, 刘国瑞, 张军, 等. 一株喜油嗜热芽孢杆菌G1201产高温蛋白酶的性质研究及异源表达初探[J]. 中国饲料,2022(9):30−37. [ZHU M, LIU G R, ZHANG J, et al. Study on the properties and heterologous expression of high-temperature protease produced by an Geobacillus thermoleovorans G1201[J]. China Feed,2022(9):30−37.] ZHU M, LIU G R, ZHANG J, et al. Study on the properties and heterologous expression of high-temperature protease produced by an Geobacillus thermoleovorans G1201[J]. China Feed, 2022(9): 30−37.
[12] MUSHTAQ H, GANAI S A, JEHANGIR A, et al. Molecular and functional characterization of protease from psychrotrophic Bacillus sp. HM49 in North-western Himalaya[J]. PLoS One,2023,18(3):e0283677. doi: 10.1371/journal.pone.0283677
[13] WEN Y X, QIANG J Y, ZHOU G X, et al. Characterization of redox and salinity-tolerant alkaline protease from Bacillus halotolerans strain DS5[J]. Frontiers in Microbiology,2022,13:935072. doi: 10.3389/fmicb.2022.935072
[14] BALACHANDRAN C, VISHALI A, NAGENDRAN N A, et al. Optimization of protease production from Bacillus halodurans under solid state fermentation using agrowastes[J]. Saudi Journal of Biological Sciences,2021,28(8):4263−4269. doi: 10.1016/j.sjbs.2021.04.069
[15] ROSAZZA T, EIGENTLER L, EARL C, et al. Bacillus subtilis extracellular protease production incurs a context-dependent cost[J]. Molecular Microbiology,2023,120(2):105−121. doi: 10.1111/mmi.15110
[16] 黄子凌, 莫港澳, 李文, 等. 高产中性蛋白酶菌株的诱变选育及益生特性[J]. 食品与发酵工业,2021,47(17):84−90. [HUANG Z L, MO G A, LI W, et al. Mutation breeding and probiotic characteristics of high yield neutral protease strains[J]. Food and Fermentation Industry,2021,47(17):84−90.] HUANG Z L, MO G A, LI W, et al. Mutation breeding and probiotic characteristics of high yield neutral protease strains[J]. Food and Fermentation Industry, 2021, 47(17): 84−90.
[17] 胡悦, 李汉文, 喻晨, 等. LiCl-ARTP复合诱变选育高产碱性蛋白酶菌株及其发酵条件优化[J]. 中国酿造,2021,40(2):59−65. [HU Y, LI H W, YU C, et al. Breeding of high yield alkaline protease strains by LiCl-ARTP composite mutation and optimization of fermentation conditions[J]. Chinese Brewing,2021,40(2):59−65.] doi: 10.11882/j.issn.0254-5071.2021.02.012 HU Y, LI H W, YU C, et al. Breeding of high yield alkaline protease strains by LiCl-ARTP composite mutation and optimization of fermentation conditions[J]. Chinese Brewing, 2021, 40(2): 59−65. doi: 10.11882/j.issn.0254-5071.2021.02.012
[18] 李西波, 张旭, 杨柳, 等. 高产酸性蛋白酶菌株的选育及酶学性质研究[J]. 中国调味品,2018,43(3):28−33,40. [LI X B, ZHANG X, YANG L, et al. Breeding of high-yield acidic protease strains and study on their enzymatic properties[J]. Chinese Seasoning,2018,43(3):28−33,40.] doi: 10.3969/j.issn.1000-9973.2018.03.007 LI X B, ZHANG X, YANG L, et al. Breeding of high-yield acidic protease strains and study on their enzymatic properties[J]. Chinese Seasoning, 2018, 43(3): 28−33,40. doi: 10.3969/j.issn.1000-9973.2018.03.007
[19] 刘丽莉, 杨陈柳, 尤晓颜, 等. 蜡样芽孢杆菌胶原蛋白酶基因的异源表达与活性分析[J]. 中国食品学报,2020,20(1):69−75. [LIU L L, YANG C L, YOU X Y, et al. Heterologous expression and activity analysis of Bacillus cereus collagenase gene[J]. Journal of China Foods Limited,2020,20(1):69−75.] LIU L L, YANG C L, YOU X Y, et al. Heterologous expression and activity analysis of Bacillus cereus collagenase gene[J]. Journal of China Foods Limited, 2020, 20(1): 69−75.
[20] 周冠宇, 李江华, 彭政, 等. 定点突变提高枯草芽孢杆菌角蛋白酶的低温催化活性[J]. 微生物学通报,2022,49(1):1−13. [ZHOU G Y, LI J H, PENG Z, et al. Site-directed mutagenesis enhances low-temperature catalytic activity of Bacillus subtilis keratinase[J]. Microbiology Bulletin,2022,49(1):1−13.] ZHOU G Y, LI J H, PENG Z, et al. Site-directed mutagenesis enhances low-temperature catalytic activity of Bacillus subtilis keratinase[J]. Microbiology Bulletin, 2022, 49(1): 1−13.
[21] TAKENAKA S, TAKADA A, KIMURA Y, et al. Improvement of the halotolerance of a Bacillus serine protease by protein surface engineering[J]. Journal of Basic Microbiol,2021,62(2):174−184.
[22] SO Y, PARK S Y, PARK E H, et al. A highly efficient CRISPR-Cas9-mediated large genomic deletion in Bacillus subtilis[J]. Frontiers in Microbiology,2017,8(1167):1−12.
[23] YAN P P, WU Y P, LI Y, et al. Engineering genome-reduced Bacillus subtilis for acetoin production from xylose[J]. Biotechnology Letters,2018,40:393−398. doi: 10.1007/s10529-017-2481-4
[24] 张雪玉. 枯草芽胞杆菌基因组最小化的初步研究[D]. 天津:天津大学, 2013. [ZHANG X Y. Preliminary study on genome minimization of Bacillus subtilis[D]. Tianjin:Tianjin University, 2013.] ZHANG X Y. Preliminary study on genome minimization of Bacillus subtilis[D]. Tianjin: Tianjin University, 2013.
[25] ZHANG F, HUO K Y, SONG X Y, et al. Engineering of a genome-reduced strain Bacillus amyloliquefaciens for enhancing surfactin production[J]. Microbial Cell Factories,2020,19:223. doi: 10.1186/s12934-020-01485-z
[26] XIANG M J, KANG Q, ZHANG D W. Advances on systems metabolic engineering of Bacillus subtilis as a chassis cell[J]. Synthetic and Systems Biotechnology,2020,5:245−251. doi: 10.1016/j.synbio.2020.07.005
[27] MORIMOTO T, KADOYA R, ENDO K, et al. Enhanced recombinant protein productivity by genome reduction in Bacillus subtilis[J]. DNA Research,2008,15(2):73−81. doi: 10.1093/dnares/dsn002
[28] 李昕悦. 解淀粉芽胞杆菌基因组精简对碱性蛋白酶表达的影响[D]. 天津:天津科技大学, 2022. [LI X Y. The effect of genome simplification of Bacillus amyloliquefaciens on alkaline protease expression[D]. Tianjin:Tianjin University of Science and Technology, 2022.] LI X Y. The effect of genome simplification of Bacillus amyloliquefaciens on alkaline protease expression[D]. Tianjin: Tianjin University of Science and Technology, 2022.
[29] SETYANI W, MURWANTI, SULAIMAN T N S, et al. Application of response surface methodology (RSM) for the optimization of ultrasound-assisted extraction (UAE) of Moringa oleifera:Extraction yield, content of bioactive compounds, and biological effects in vitro[J]. Plants,2023,12(13):2455. doi: 10.3390/plants12132455
[30] AZARI S R, HOJJATOLESLAMY M, MOUSAVI Z E, et al. Production and optimization of conjugated linoleic and eicosapentaenoic acids by Bifidobacterium lactis in cold-pressed soybean cake[J]. Frontiers in Nutrition,2022,9:916728. doi: 10.3389/fnut.2022.916728
[31] YEWANDE S, IDOWU A, TITILOLA S, et al. Optimization of protease production in indigenous Bacillus species isolated from soil samples in Lagos, Nigeria using response surface methodology[J]. Biocatalysis and Agricultural Biotechnology,2019,18:101011. doi: 10.1016/j.bcab.2019.01.049
[32] FASIKU S A, BELLO M A, ODENIYI O A. Production of xylanase by Aspergillus niger GIO and Bacillus megaterium through solid-state fermentation[J]. Access Microbiology,2023,5(6):000506.
[33] TULY J A, ZABED H M, NIZAMI A, et al. Bioconversion of agro-food industrial wastes into value-added peptides by a Bacillus sp. Mutant through solid-state fermentation[J]. Bioresource Technology,2021,346:126513.
[34] SUI X, ZHANG T, JIANG L. Soy protein:Molecular structure revisited and recent advances in processing technologies[J]. Annual Review of Food Science and Technology,2021,12(1):119−147. doi: 10.1146/annurev-food-062220-104405
[35] LU Z X, HE J F, ZHANG Y C, et al. Composition, physicochemical properties of pea protein and its application in functional foods[J]. Critical Reviews Food Science Nutrition,2019,60(15):1−13.
[36] ALEXANDRA S C, ASWATHY S, KEITH R S. Peanut and peanut products:A food safety perspective[J]. Food Control,2013,32(1):296−303. doi: 10.1016/j.foodcont.2012.12.007
[37] KADOWAKI M, KUBOTA M, WATANABE R. Physiological multifunctions of rice proteins of endosperm and bran[J]. Journal of Nutritional Science and Vitaminology,2019,65:42−47. doi: 10.3177/jnsv.65.S42
[38] 汪建斌, 邓勇. Alcalase碱性蛋白酶对大豆分离蛋白水解作用的研究[J]. 食品工业科技,2002(1):61−63. [WANG J B, DENG Y. Study on the hydrolysis effect of alcalase alkaline protease on soybean protein isolates[J]. Food Industry Science and Technology,2002(1):61−63.] doi: 10.3969/j.issn.1002-0306.2002.01.023 WANG J B, DENG Y. Study on the hydrolysis effect of alcalase alkaline protease on soybean protein isolates[J]. Food Industry Science and Technology, 2002(1): 61−63. doi: 10.3969/j.issn.1002-0306.2002.01.023
[39] AGUILAR J G S, CASTRO R J S, SATO H H. Production of antioxidant peptides from pea protein using protease from Bacillus licheniformis LBA 46[J]. International Journal of Peptide Research and Therapeutics,2020,26(1):435−443. doi: 10.1007/s10989-019-09849-9
[40] ADEKOYA O A, SYLTE I. The thermolysin family (M4) of enzymes:Therapeutic and biotechnological potential[J]. Chemical Biology and Drug Design,2009,73(1):7−16. doi: 10.1111/j.1747-0285.2008.00757.x
[41] SHOBAKO N, OGAWA Y, ISHIKADO A, et al. A novel antihypertensive peptide identified in thermolysin-digested rice bran[J]. Molecular Nutrition and Food Research,2018,62(4):1−7.
[42] HARIHARAN S, PATTI A, ARORA A. Functional proteins from biovalorization of peanut meal:Advances in process technology and applications[J]. Plant Foods for Human Nutrition,2023,78(1):13−24. doi: 10.1007/s11130-022-01040-8
[43] YANG X J, TANG D, WANG X M, et al. Enhancement of nutritional and antioxidant properties of peanut meal by bio-modification with Bacillus licheniformis[J]. Applied Biochemistry and Biotechnology,2016,180(6):1227−1242. doi: 10.1007/s12010-016-2163-z
[44] SAMURAILATPAM S, AMIT K R, ALI M, et al. Enhancement of antioxidant properties of two soybean varieties of Sikkim Himalayan region by proteolytic Bacillus subtilis fermentation[J]. Journal of Functional Foods,2015,14:650−658. doi: 10.1016/j.jff.2015.02.033
[45] HEJDYSZ M, KACZMAREK S A, KUBIŚ M, et al. The effect of protease and Bacillus licheniformis on nutritional value of pea, faba bean, yellow lupin and narrow-leaved lupin in broiler chicken diets[J]. British Poultry Science,2020,61(3):287−293. doi: 10.1080/00071668.2020.1716303
[46] YAN Z F, YUAN S, QIN Q, et al. Enhancement of rice protein hydrolysate quality using a novel dual enzyme system[J]. LWT,2022,158:113110. doi: 10.1016/j.lwt.2022.113110
[47] DING S L, MAO B J, LU X Y, et al. Efficient production and biochemical characterization of a thermostable carboxypeptidase from Bacillus megaterium and its application on flavor improvement of soy isolate protein hydrolysates[J]. European Food Research and Technology,2022,248(8):2135−2143. doi: 10.1007/s00217-022-04036-5
[48] ELGADIR M A, MARIOD A A. Gelatin and chitosan as meat by-products and their recent applications[J]. Foods,2022,12(1):60. doi: 10.3390/foods12010060
[49] KVIATKOVSKY S A, HICKNER R C, ORMSBEE M J. Collagen peptide supplementation for pain and function:Is it effective and if so, why[J]. Current Opinion in Clinical Nutrition and Metabolic Care,2022,25(6):401−406. doi: 10.1097/MCO.0000000000000870
[50] SONG Y H, FU Y S, HUANG S Y, et al. Identification and antioxidant activity of bovine bone collagen-derived novel peptides prepared by recombinant collagenase from Bacillus cereus[J]. Food Chemistry,2021,349:129143. doi: 10.1016/j.foodchem.2021.129143
[51] KESHAPAGA U R, JATHOTH K, SINGH S S, et al. Characterization of high-yield Bacillus subtilis cysteine protease for diverse industrial applications[J]. Braz Journal of Microbiology,2023,54(2):739−752. doi: 10.1007/s42770-023-00992-6
[52] 刘书亮, 詹莉, 吴琦, 等. 枯草芽孢杆菌弹性蛋白酶对蛋白质水解及肉类嫩化的效果[J]. 食品科技,2010,35(6):162−165,174. [LIU S L, ZHAN L, WU Q, et al. Effect of Bacillus subtilis elastase on protein hydrolysis and meat tenderization[J]. Food Technology,2010,35(6):162−165,174.] LIU S L, ZHAN L, WU Q, et al. Effect of Bacillus subtilis elastase on protein hydrolysis and meat tenderization[J]. Food Technology, 2010, 35(6): 162−165,174.
[53] 韩建春, 邢明伟. 枯草芽孢杆菌产弹性蛋白酶对肉嫩化的工艺研究[J]. 食品工业科技,2011,32(2):166−168,263. [HAN J C, XING M W. Study on the technology of elastase produced by Bacillus subtilis for meat tenderization[J]. Food Industry Technology,2011,32(2):166−168,263.] HAN J C, XING M W. Study on the technology of elastase produced by Bacillus subtilis for meat tenderization[J]. Food Industry Technology, 2011, 32(2): 166−168,263.
[54] SORAPUKDEE S, SUMPAVAPOL P, BENJAKUL S, et al. Collagenolytic proteases from Bacillus subtilis B13 and Bacillus siamensis S6 and their specificity toward collagen with low hydrolysis of myofibrils[J]. LWT,2020,126:109307. doi: 10.1016/j.lwt.2020.109307
[55] ZHAO G Y, ZHOU M Y, ZHAO H L, et al. Tenderization effect of cold-adapted collagenolytic protease MCP-01 on beef meat at low temperature and its mechanism[J]. Food Chemistry,2012,134(4):1738−1744. doi: 10.1016/j.foodchem.2012.03.118
[56] MAGESWARI A, SUBRAMANIAN P, CHANDRASEKARAN S, et al. Systematic functional analysis and application of a cold-active serine protease from a novel Chryseobacterium sp[J]. Food Chemistry,2017,217:18−27. doi: 10.1016/j.foodchem.2016.08.064
[57] BUREROS K J C, DIZON E I, ISRAEL K A C, et al. Physicochemical and sensory properties of carabeef treated with Bacillus subtilis (Ehrenberg) Cohn protease as meat tenderizer[J]. Journal of Food Science Technology,2020,57(1):310−318. doi: 10.1007/s13197-019-04062-4
[58] CHEN Q H, HE G Q, JIAO Y C, et al. Effects of elastase from a Bacillus strain on the tenderization of beef meat[J]. Food Chemistry,2005,98(4):624−629.





 下载:
下载:
 下载:
下载:



