Mechanism of Curcumin Mediated Photodynamic Sterilization on Clostridium perfringens
-
摘要: 为实现非热技术对食源性致病菌产气荚膜梭菌的控制,本文以姜黄素为光敏剂,探究姜黄素对产气荚膜梭菌的作用机制。首先研究了不同姜黄素浓度对产气荚膜梭菌的杀菌效果,随后利用电子显微镜观察姜黄素处理后细胞形态,利用激光共聚焦显微镜和胞外大分子的泄漏分析细胞膜的完整性,通过测定细胞内ROS含量分析姜黄素对产气荚膜梭菌的氧化损伤。结果表明,姜黄素介导的光动力杀菌对产气荚膜梭菌具有显著(P<0.05)的杀菌效果,当姜黄素浓度为20 μmol/L,作用10 min时,产气荚膜梭菌被完全杀死。姜黄素通过产生具有细胞毒性的活性氧(Reactive Oxygen Species,ROS)导致DNA和蛋白质等大分子受损,最后细胞膜破裂,内容物溶出进而导致细胞裂解死亡。本研究为低温肉制品中光动力杀菌技术的开发提供理论基础。Abstract: To achieve the control of foodborne pathogenic bacteria Clostridium perfringens by non-thermal technology, curcumin was used as the photosensitizer to explore its inhibitory mechanism on C. perfringens. The bactericidal effect of different curcumin concentrations on C. perfringens was investigated. The cell morphology after curcumin treatment was investigated through scan electron microscopy. The integrity of the cell membrane was analyzed by confocal laser scanning microscope and leakage of extracellular macromolecules. The oxidative damage of C. perfringens was determined by ROS analysis. The results indicated that curcumin showed a significantly (P<0.05) photodynamic inactivation against C. perfringens. C. perfringens was completely killed when curcumin was used at a concentration of 20 μmol/L for 10 min. Cytotoxic ROS was generated in this process, which caused the damage of DNA and proteins, cell membrane rupture and leakage of cellular contents, ultimately leading to cell death. These findings gave support for the development of photodynamic sterilization technology in low-temperature meat products.
-
近年来,随着生活水平的提高,消费者越来越关心食物品质和食品安全[1]。低温肉制品是指肉制品加工过程中,其中心温度维持在68~72 ℃,且在0~4 ℃的条件下进行储藏、运输、销售的肉制品。与传统杀菌技术相比,低温杀菌能最大程度地保持肉的口感和营养成分,但其较低的杀菌温度会导致耐热菌的滋生,比如产生抗逆性强的芽孢[2−3]。产气荚膜梭菌是一种革兰氏阳性产芽孢的厌氧菌,是低温肉制品中主要的致病菌,能够产生多种毒素,引起气性坏疽和肠道疾病[4]。在美国,产气荚膜梭菌被称为第三大食源性致病菌,每年因产气荚膜梭菌引起的经济损失达到3.43亿美元[5]。因此,如何控制产气荚膜梭菌的生长繁殖成为低温肉制品运输贮存中的难题[3,6]。
过去的近十年,针对肉类中产气荚膜梭菌的控制方式主要为加热与化学消毒防腐剂杀菌,为满足消费者对更天然和更健康的食品需求,对肉类中微生物控制的技术重点逐渐转向新型非热保存技术[3,7]。光动力杀菌是一种新型非热杀菌技术,具有高效、低成本、不破坏产品原有风味品质、可食用等优点,在食品保鲜领域有广阔的前景[8]。光动力杀菌是通过光、光敏剂、氧气之间的互相作用产生具有细胞毒性的活性氧物质,进而使有害微生物的细胞损伤、死亡以抑制细菌生长的技术[9−10]。有研究表明,光动力杀菌能有效杀死金黄色葡萄球菌、大肠杆菌等细菌,同时对黑曲霉、白色念珠菌等真菌也有抑制作用[11−12]。
姜黄素是一种天然多酚化合物,具有低毒性、抗氧化、光敏性,是一种优秀的天然光敏剂,在400~500 nm波长的光照下能增强抗菌活性并产生具有细胞毒性的活性氧[8]。Bhavya等[13]发现姜黄素介导的光动力杀菌对大肠杆菌、金黄色葡萄球菌等食源性病菌有抑制作用。林以琳等[14]研究发现姜黄素介导的光动力杀菌能抑制南美对虾中微生物的生长。Dong等[15]研究发现姜黄素介导的光动力杀菌对抑制枯草芽孢杆菌生长繁殖有明显的效果。但目前关于姜黄素介导的光动力杀菌对低温肉制品中产气荚膜梭菌的控制还鲜有报道。本研究将姜黄素介导的光动力杀菌应用于产气荚膜梭菌的控制,系统地探究其对产气荚膜梭菌的杀菌效果及杀菌机理,为光动力杀菌应用于食品保鲜领域提供参考。
1. 材料与方法
1.1 材料与仪器
姜黄素 纯度>95%,上海麦克林生化科技股份有限公司;细菌基因组DNA提取试剂盒 北京天根生化科技有限公司;增强型ATP检测试剂盒 碧云天生物科技有限公司;胰胨-亚硫酸盐-环丝氨酸琼脂基础培养基(TSC)、液体硫乙醇酸盐培养基(FTG) 山东海博生物科技有限公司;8-苯胺-1-萘磺酸(ANS) 上海源叶生物科技有限公司;2′,7′-二氯荧光素二乙酸酯(DCFDA) 上海麦克林生化科技股份有限公司;LIVE/DEADTMBaclightTM试剂盒 Invitrogen公司。
带有蓝色LED的光源灯板(波长465~475 nm) 爱佳电子科技有限公司;EVO-LS10型扫描电子显微镜 德国ZEISSE Oberkochen公司;Cary Eclipse型荧光分光光度计 安捷伦科技有限公司;Cytation5型多功能酶标仪 美国伯腾仪器有限公司、Ultra View VOX型激光扫描电子显微镜 美国PE公司。
1.2 实验方法
1.2.1 细菌菌株培养条件
产气荚膜梭菌(Clostridium perfringens)由本课题组分离自低温肉制品,保藏于−80 ℃冰箱中。接种200 μL到FTG培养基中,37 ℃厌氧培养12 h,转接1 mL菌液到FTG中37 ℃厌氧培养4 h。培养的菌液用于后续试验。
1.2.2 姜黄素的最小杀菌浓度
0.1%乙酸溶解姜黄素至5、10、20、40、80、160 μmol/L,将C. perfringens菌液8000 r/min离心3 min保留菌泥,用姜黄素溶液悬起并加入96孔板中,以PBS悬起的菌泥为对照组,蓝光LED照射10 min。将处理过的菌液点10 μL在TSC平板上观察生长情况。
1.2.3 细胞形态的变化
将C. perfringens菌液在4 ℃条件下以8000 r/min离心3 min,去掉上清液,用PBS溶液洗涤两次保留菌泥,分别用0、5、10、20 μL姜黄素溶液悬起并加入24孔板中,蓝光LED照射10 min,以用PBS悬起未经光照的菌泥为对照组,处理过的菌液8000 r/min离心3 min去掉上清液,用PBS溶液洗涤两次,将所得菌泥与2.5%戊二醛混合,4 ℃下放置24 h固定,将固定好的菌液酒精梯度脱水后,利用扫描电子显微镜观察。
1.2.4 细胞膜完整性变化
1.2.4.1 胞外ATP浓度的测定
将处理过的C. perfringens菌液在4 ℃条件下以8000 r/min离心3 min,取上清液保存在冰沙上,根据增强型ATP检测试剂盒的说明书,测定上清液中ATP浓度。
1.2.4.2 胞外大分子物质检测
将处理过的C. perfringens菌液在4 ℃、8000 r/min离心3 min,吸取上清液,利用0.22 μmol/L滤膜过滤,使用多功能酶标仪测定其在260、280 nm下的吸光度(OD260、OD280)。
1.2.4.3 激光扫描共聚焦显微镜检测
将处理过的C. perfringens菌液在4 ℃下8000 r/min离心3 min保留底部的菌体沉淀,用PBS洗涤两次。将洗涤好的菌体悬浮于1 mL的PBS缓冲液中,加入LIVE/DEADTMBaclightTM试剂盒中SYTO-9和PI混合液3 μL,在37 ℃下避光反应30 min,染色完成后在4 ℃、8000 r/min离心3 min保留菌体沉淀,用PBS洗涤2次,最终使菌体悬浮于1 mL的PBS缓冲液中。使用激光扫描电子显微镜观察菌体。
1.2.5 细胞膜流动性变化
1.2.5.1 细胞膜表面疏水性变化
向3 mL处理过的C. perfringens菌液中加入3 mL的三氯甲烷,涡旋振荡15 s充分混匀,置于室温下12 min使两相完全分离。随后使用无菌针头抽取离心管下方的水相,使用多功能酶标仪测量水相在600 nm下的吸光度(OD600)根据以下公式计算细胞吸附率(OD%),OD0为原始吸光度,OD1为处理后的吸光度。
OD%=(OD0−OD1)/OD0×100 1.2.5.2 8-苯胺-1-萘磺酸 (ANS)荧光检测
向处理过的C. perfringens菌液加入ANS使终其浓度为8 mmol/L并置于暗处反应30 min,将反应液置于荧光分光光度计中测量荧光值,激发波长为385 nm,发射波长为473 nm。
1.2.6 氧化损伤检测
使用荧光探针2′,7′-二氯荧光素二乙酸酯(DCFDA)分析细胞内的氧化应激。将处理过的C. perfringens菌液8000 r/min离心3 min保留菌体沉淀,用PBS洗涤三次,重新悬浮于含有10 μmol/L DCFDA的PBS中,在37 ℃置于暗处反应30 min,反应液用PBS洗涤两次以除去多余染料,将沉淀重新悬浮于PBS中,使用激光共聚焦电子显微镜对细胞进行成像,激发波长485 nm,发射波长520 nm。
1.2.7 DNA损伤检测
DNA损伤的检测通过参考Huang等[16]的方法确定。将处理过的C. perfringens菌液4 ℃下10000 r/min离心2 min,按照细菌基因组DNA提取试剂盒的要求提取基因组DNA,通过1%琼脂糖凝胶电泳分离产物,用溴化乙锭染色,使用凝胶成像系统进行可视化观察。
1.3 数据处理
实验设置三个重复,实验结果以平均值±标准差表示。采用Graghpad Prism 9作图并对数据进行单因素方差分析(P<0.05)。
2. 结果与分析
2.1 姜黄素介导的光动力杀菌技术对C. perfringens的抗菌效果
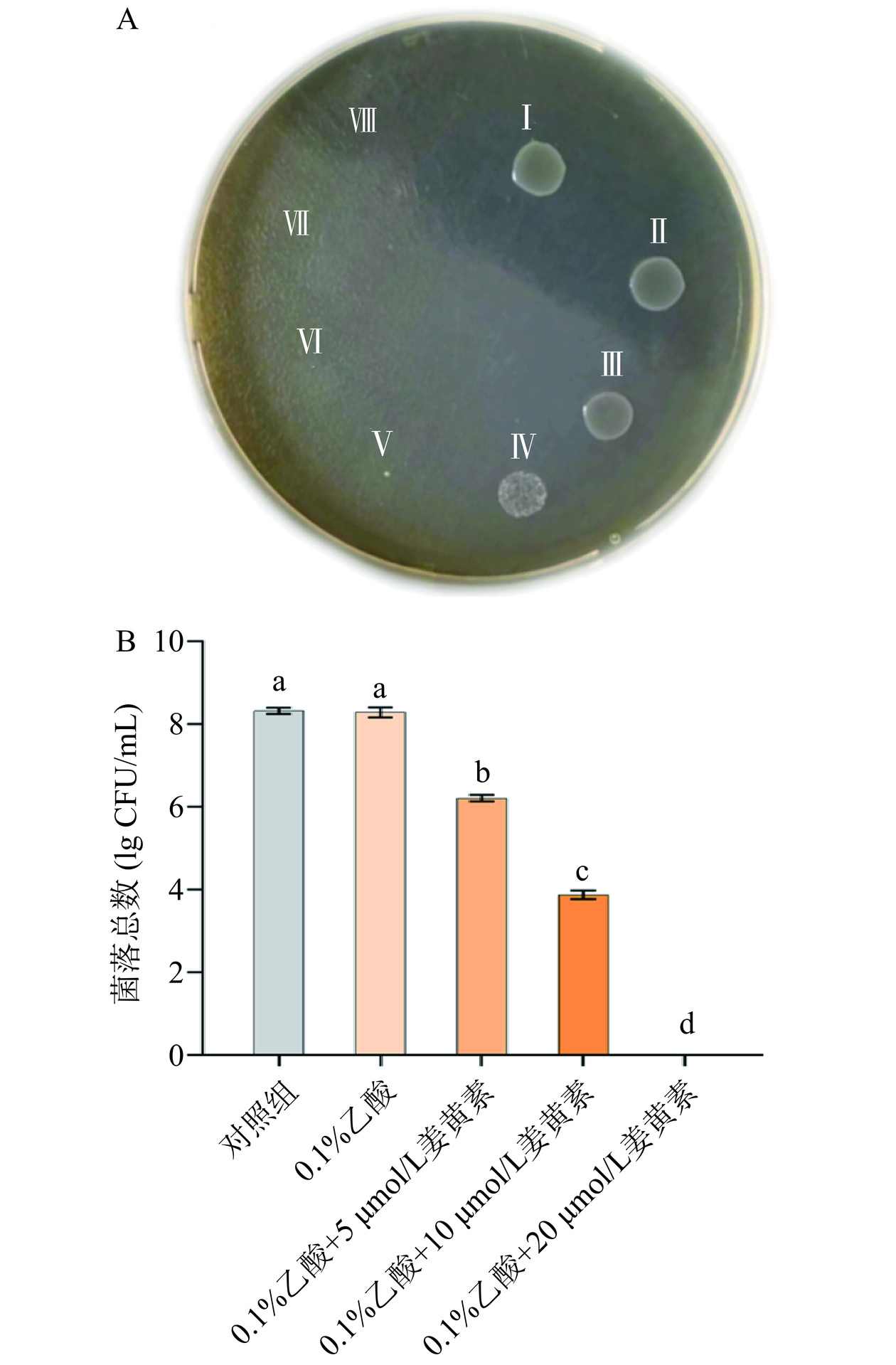
为了确定姜黄素的最小杀菌浓度,用不同浓度的姜黄素溶液将菌泥悬起,对样品蓝光光照10 min,姜黄素降解程度较低且能被LED充分激发[17−18],在TSC平板上培养,确定姜黄素的最小杀菌浓度。如图1A所示,0.1%乙酸没有明显的杀菌作用,随着姜黄素含量的增加,C. perfringens的活菌数明显降低。可知20 μmol/L为姜黄素对C. perfringens最小杀菌浓度,后续实验采用5、10、20 μmol/L浓度的姜黄素对C. perfringens进行处理并分析。将5、10、20 μmol/L浓度姜黄素处理的C. perfringens进行涂板计数,结果如图1B所示,生长至对数期的C. perfringens菌落总数为8.32 lg CFU/mL,经5 μmol/L姜黄素处理后菌落总数为6.25 lg CFU/mL,经10 μmol/L姜黄素处理后的菌落总数为3.92 lg CFU/mL,经20 μmol/L姜黄素处理后,平板上没有检出活菌,此结果与图1A结果一致。因此,姜黄素对C. perfringens的最小杀菌浓度为20 μmol/L。与Gao等[19]的研究相比,姜黄素介导的光动力杀菌对C. perfringens的杀菌效果优于大肠杆菌和金黄色葡萄球菌,因此姜黄素介导的光动力杀菌具有较强的抑制C.perfringens的潜力。
![]() 图 1 姜黄素介导的光动力杀菌对C. perfringens的抗菌效果注:A.平板培养;B.菌落计数;I.对照组,II.0.1%乙酸,III.0.1%乙酸+5 μmol/L姜黄素,IV. 0.1%乙酸+10 μmol/L姜黄素,V. 0.1%乙酸+20 μmol/L姜黄素,VI. 0.1%乙酸+40 μmol/L姜黄素,VII. 0.1%乙酸+80 μmol/L姜黄素,VIII. 0.1%乙酸+160 μmol/L姜黄素;不同小写字母代表数据存在显著性差异,P<0.05,图3、图5~图6同。Figure 1. Antibacterial effects of curcumin mediated photodynamic sterilization on C. perfringens
图 1 姜黄素介导的光动力杀菌对C. perfringens的抗菌效果注:A.平板培养;B.菌落计数;I.对照组,II.0.1%乙酸,III.0.1%乙酸+5 μmol/L姜黄素,IV. 0.1%乙酸+10 μmol/L姜黄素,V. 0.1%乙酸+20 μmol/L姜黄素,VI. 0.1%乙酸+40 μmol/L姜黄素,VII. 0.1%乙酸+80 μmol/L姜黄素,VIII. 0.1%乙酸+160 μmol/L姜黄素;不同小写字母代表数据存在显著性差异,P<0.05,图3、图5~图6同。Figure 1. Antibacterial effects of curcumin mediated photodynamic sterilization on C. perfringens2.2 姜黄素介导的光动力杀菌技术对C.perfringens形态的影响
通过扫描电子显微镜观察姜黄素处理后C. perfringens菌体的形态变化[20]。从图2可以看出,空白对照组菌体呈梭状,表面光滑菌体结构完整。0.1%乙酸对C. perfringens形态没有明显影响,经5 μmol/L姜黄素处理后,C. perfringens菌体表面有少量蛋白质溶出,部分菌体黏连、抱团。经10 μmol/L姜黄素处理后,C. perfringens菌体大量黏连在一起,有明显的内容物溶出,菌体表面明显粗糙,部分菌体初步溶解。经20 μmol/L姜黄素处理后,菌体出现明显黏连,菌体出现明显溶解,细胞内容物溶出,C. perfringens已无法维持细胞结构,细胞膜和细胞壁受到严重破坏。由此可以推测姜黄素介导的光动力杀菌破坏了C. perfringens的细胞膜结构,导致内容物溶出,使细胞死亡。
2.3 姜黄素介导的光动力杀菌技术对C. perfringens细胞膜完整性的影响
2.3.1 胞外ATP含量
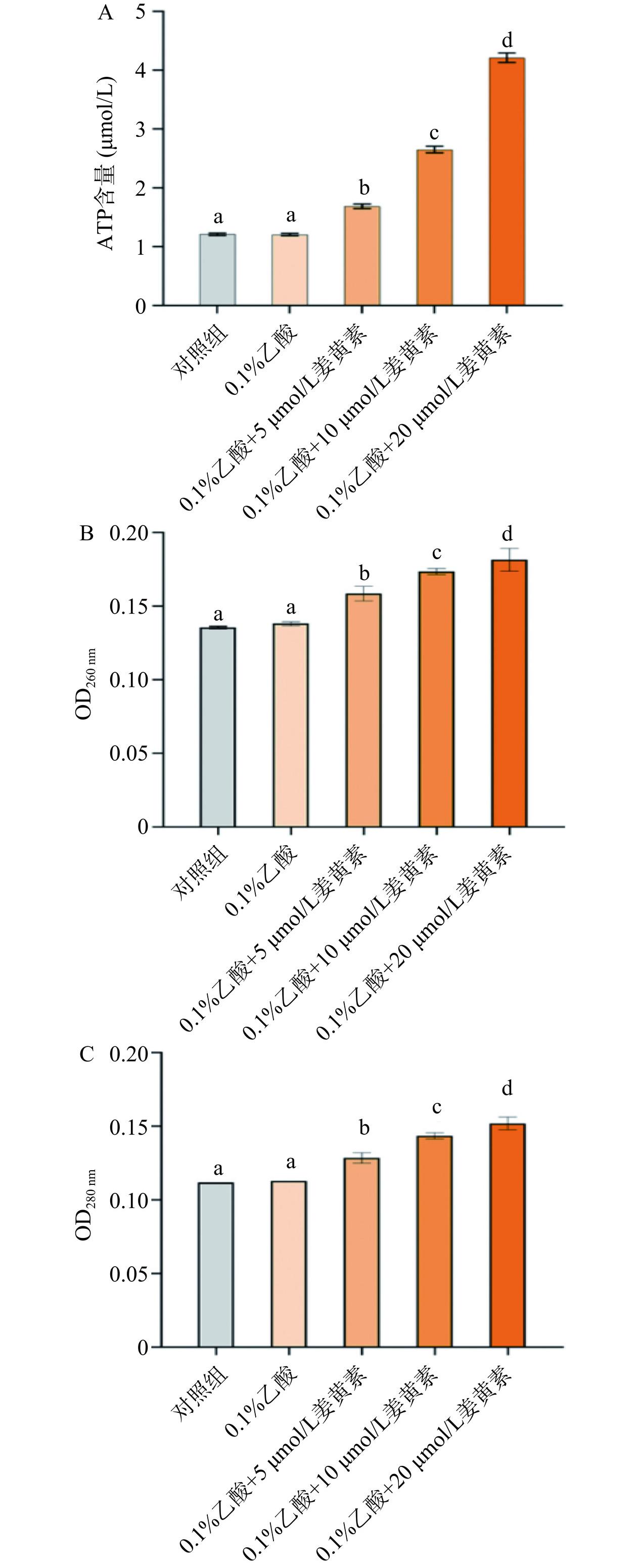
ATP是能够为细胞供能、维持细胞正常生命活动重要物质,一般不会在细胞外被大量检出,当细胞膜被破坏,细胞膜的通透性发生改变,细胞外ATP检出量增加[16]。如图3A所示,0.1%乙酸对胞外ATP浓度无明显影响,经过5 μmol/L姜黄素处理,胞外ATP的浓度增加了0.43 μmol/L,经过10 μmol/L姜黄素处理后,胞外ATP的浓度增加了1.52 μmol/L,经20 μmol/L姜黄素处理,胞外ATP的浓度增加了2.95 μmol/L。可以看出经过姜黄素介导的光动力杀菌,C. perfringens细胞膜不再完整,导致细胞内ATP泄漏。这可能是由于姜黄素破坏了膜相关蛋白的定位和细菌细胞膜的通透性[21]。
2.3.2 胞外大分子物质
细胞膜的完整性是C.perfringens菌体能够正常生长代谢的重要影响因素,当细胞膜完整性受到破坏时,细胞内的大分子物质泄漏,进而被检测到,这些大分子物质是维持细胞生命活动的基础[22]。细胞内的大分子物质DNA和蛋白质的最大紫外吸收峰在260 nm和280 nm,因此OD260与OD280可以作为评估细胞膜完整性的重要指标[23]。如图3B、C所示,经过姜黄素介导的光动力杀菌处理后,C. perfringens菌液中的OD260与OD280值都有明显的升高,说明姜黄素的处理确实会使C. perfringens内的大分子物质泄漏,且大分子物质的泄漏量与姜黄素的含量呈正相关。可以看出经过姜黄素介导的光动力杀菌,C. perfringens细胞膜不再完整,细胞内大分子物质泄漏。徐令清等[24]探究大黄对金黄色葡萄球菌细胞壁膜的影响,经大黄处理的细菌显著提高胞内大分子物质外泄,与本研究结果类似。
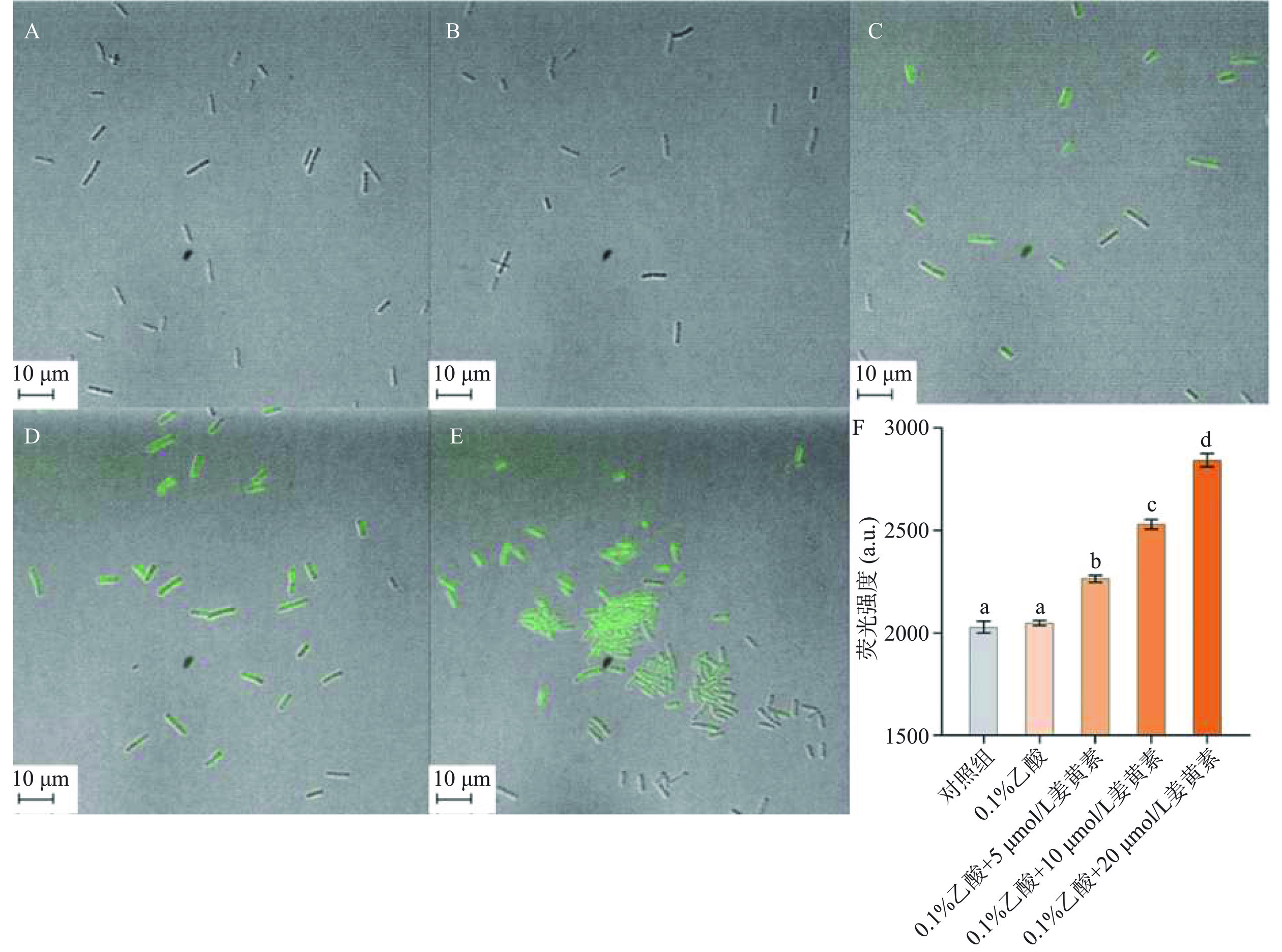
2.3.3 激光共聚焦观察
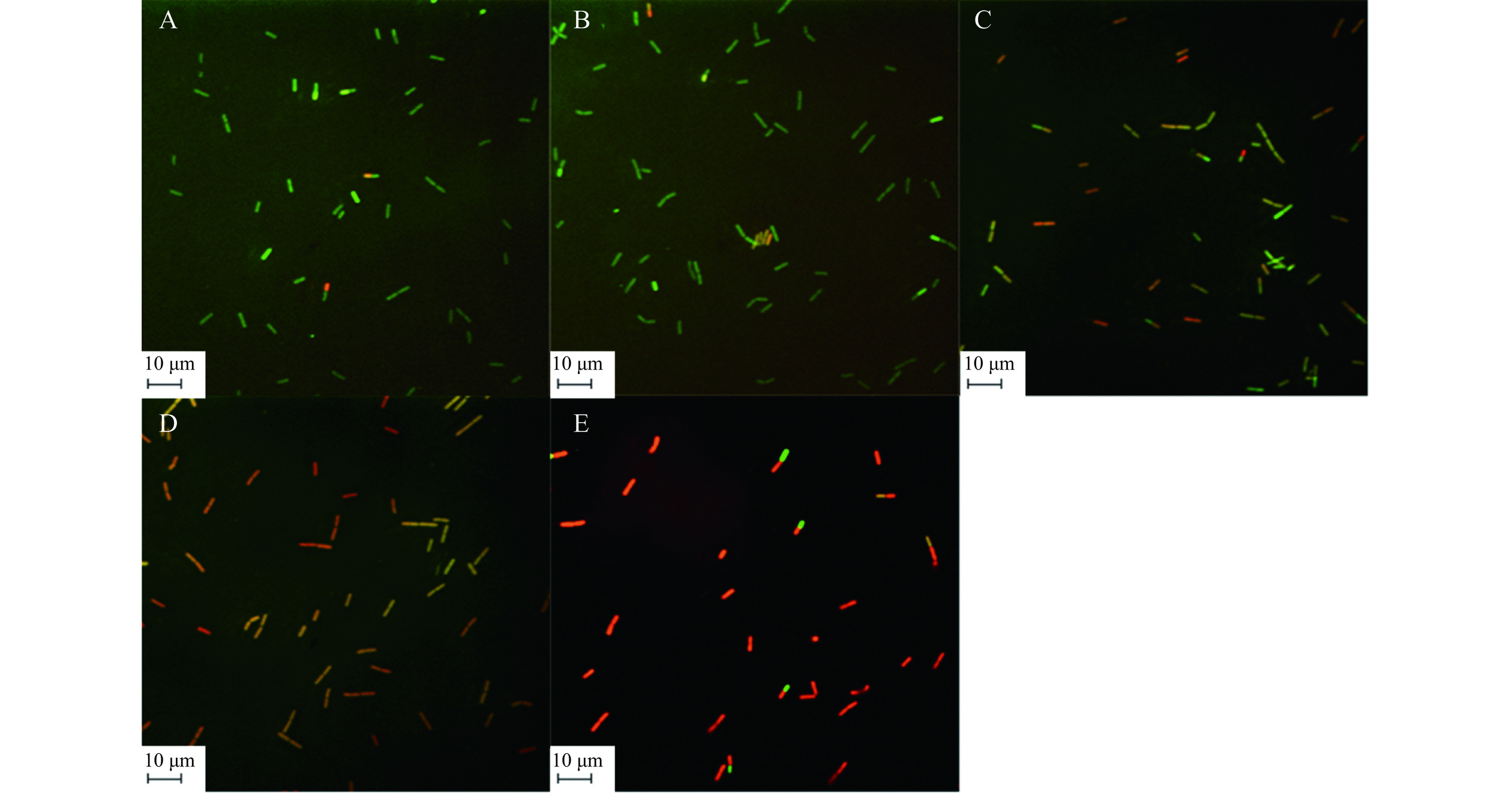
荧光探针法是使荧光探针与细胞内的物质结合产生特殊的荧光,通过荧光的数量和强度反应被测物质的含量。PI是一种无法通过细胞膜的DNA荧光探针,只有当细胞膜被破坏时,PI可以进入细胞内与DNA结合发出红色荧光,当细胞膜完整时,PI无法进入细胞而使细胞发出绿色荧光[25]。如图4A~图4B所示,空白对照组与0.1%乙酸处理组中,C. perfringens仅有少许的红色荧光,大多数都发出绿色荧光,说明细胞有完好的完整性。如图4C~图4E所示,当经过姜黄素介导光动力杀菌后,随着姜黄素浓度的增加,细胞中红色荧光的比例明显增加,红色荧光的强度也有明显的增强,绿色荧光减少,结果与2.2相对应,进一步证明姜黄素破坏了C. perfringens的细胞膜完整性导致细胞的快速死亡。与Dong等[15]的研究相比,姜黄素介导的光动力杀菌对C. perfringens细胞膜破坏程度更强于枯草芽孢杆菌。
2.4 姜黄素介导的光动力杀菌技术对C. perfringens细胞膜流动性的影响
2.4.1 疏水性变化
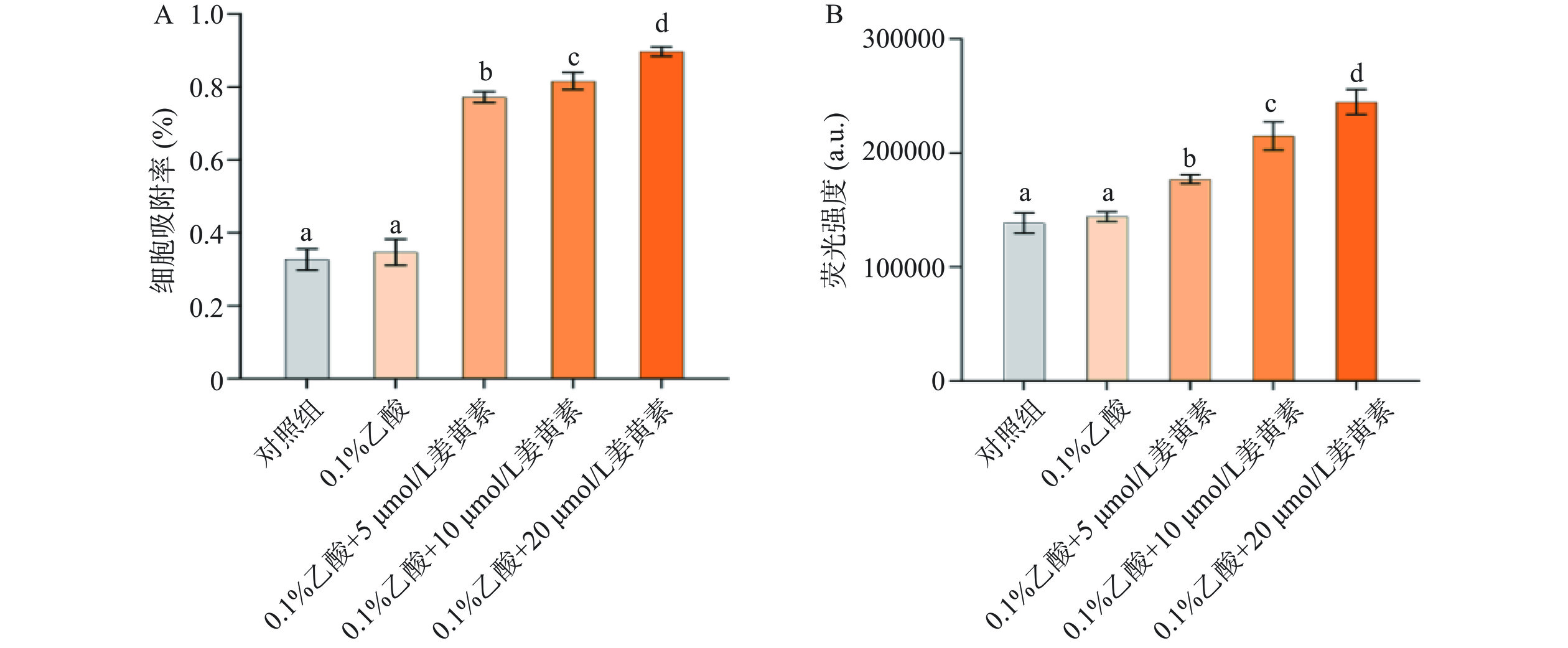
菌体的表面疏水性是影响菌体稳定生长的重要因素,尤其是在液体培养基环境下,表面疏水性越高,菌体越容易聚集沉降,影响菌体的正常生长繁殖[26]。如图5A所示,与空白对照组相比,0.1%乙酸处理对细胞吸附率无明显影响,经过不同浓度姜黄素介导的光动力杀菌处理后,C. perfringens细胞的表面疏水性显著上升(P<0.05),且疏水性上升幅度与姜黄素的含量呈正相关。这一现象的出现可能是因为经过处理使菌体表面的非极性集团增加,导致菌体的表面疏水性升高。
2.4.2 荧光探针检测
细胞膜流动性起着维持细胞的物质运输与因袭交换的重要作用,是细胞的一种重要性质。当细胞膜的流动性发生异常,会影响细胞膜蛋白的活性和细胞膜的通透性[27]。ANS是一种疏水性荧光探针,可以与细胞膜上的疏水区域结合,细胞膜的流动性越强越不利于ANS与细胞膜结合荧光强度越低,流动性越弱ANS越容易与细胞膜结合而使荧光强度越强[28]。如图5B所示,C. perfringens经过不同浓度姜黄素介导的光动力杀菌处理后,ANS在473 nm处的荧光强度呈现出上升趋势,说明姜黄素介导的光动力杀菌降低了C. perfringens细胞膜的流动性。王梓源等[29]探究ε-PL对大肠杆菌细胞膜流动性的影响,经ε-PL处理后荧光强度显著提高,与本研究结果类似。这可能是光动力杀菌对细胞整体结构造成的负面影响,显著降低了生物膜的粘附能力[30]。
2.5 姜黄素介导的光动力杀菌技术对C. perfringens氧化值的影响
DCFDA荧光探针具有细胞膜透过性和非荧光性,但可以被ROS氧化产生绿色荧光物质,这种物质能稳定地存在于细胞中,因此可以通过绿色荧光的强度来判断细胞中ROS含量的变化[31]。在正常的生理条件下,生物体内的氧化和抗氧化系统保持动态平衡,然而当细胞受刺激时生物体内的ROS增加,可能导致氧化应激[32]。如图6所示,C. perfringens经过0.1%乙酸处理没有明显变化,而经过姜黄素介导的光动力杀菌处理后,ROS的水平显著提高(P<0.05),ROS的产生量与姜黄素的浓度呈正相关。表明经姜黄素介导的光动力杀菌处理后,C. perfringens因氧化而受到严重的损害,其氧化应激的强度取决于姜黄素的浓度。值得注意的是,细胞内ROS的水平与细胞的死亡率变化一致,这意味着二者具有一定的相关性。Dlas等[33]研究表明,姜黄素在特定波长的光激发下将O2活化形成ROS,这与本研究结果相同。Baltazar等[34]研究发现,当添加ROS清除剂时,杀菌效果会明显降低,这表明ROS对杀菌至关重要。
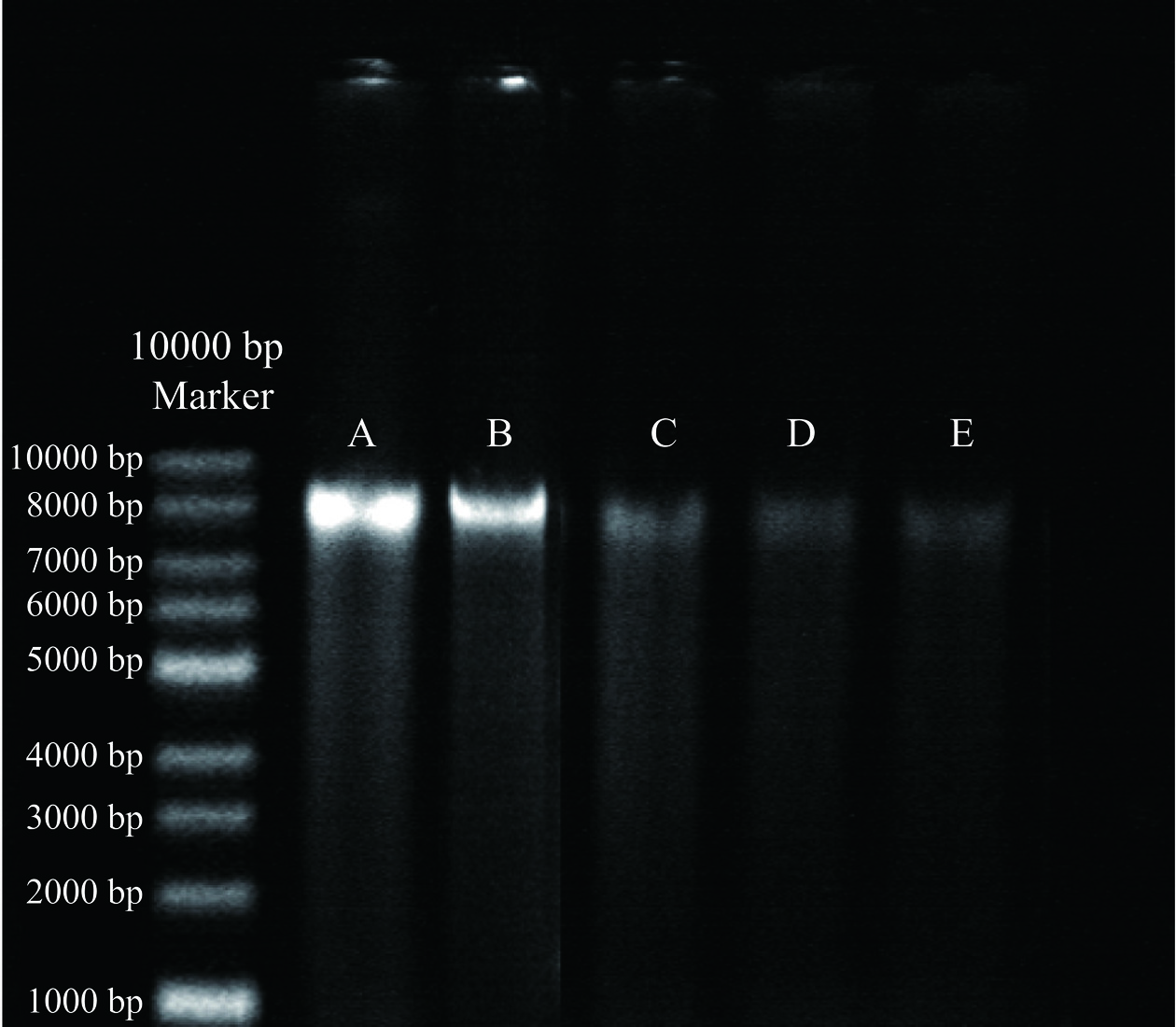
2.6 姜黄素介导的光动力杀菌技术对C. perfringens的DNA 损伤影响
DNA是细菌进行正常生理活动和生长繁殖的基础,一旦DNA受损,细菌将无法继续正常生长[16]。在此基础上,测量了姜黄素介导的光动力杀菌对C. perfringens基因组DNA损伤的影响。如图7所示,对照组提取的DNA条带没有任何损伤。然而经过姜黄素介导的光动力杀菌,所提取的DNA条带有明显的损伤,并且损伤强度与姜黄素的浓度呈正相关。C. perfringens的DNA受到破坏后从细胞膜泄漏,这与上文的结论一致。结果表明,姜黄素介导的光动力杀菌会使C. perfringens的DNA受到严重的损伤,影响其正常的生命活动。Kim等[35]探究LED在制冷温度下对沙门氏菌DNA的影响,经处理后DNA受到损伤,与本研究结果相同,这可能是由于DNA中的核苷被ROS所氧化导致的。
3. 结论
本研究通过测试了蓝光LED激发条件下不同姜黄素浓度的杀菌性能,并探究了姜黄素介导的光动力杀菌的机制。结果表明,姜黄素的最小杀菌浓度为20 μmol/L,该技术对C. perfringens的灭活能力主要取决于姜黄素浓度。通过形态观察、胞外大分子泄漏及氧化损伤检测,结果表明姜黄素介导的光动力杀菌诱导细胞内产生大量ROS使细菌氧化应激,这个过程导致细胞出现菌体黏连、溶解、胞膜破裂,致使胞内核酸、电解质、蛋白质等生物大分子物质大量泄漏;同时胞内遗传物质DNA等受到损伤,影响细菌细胞的正常生命活动、能量代谢,使细菌死亡。总之,与现有的化学杀菌相比,姜黄素介导的光动力杀菌技术具有非热和环保的优点,并对C. perfringens有较强的抗菌作用,具有成为先进食品保鲜材料的潜力,为肉制品保鲜材料的制备提供理论支撑。
-
图 1 姜黄素介导的光动力杀菌对C. perfringens的抗菌效果
注:A.平板培养;B.菌落计数;I.对照组,II.0.1%乙酸,III.0.1%乙酸+5 μmol/L姜黄素,IV. 0.1%乙酸+10 μmol/L姜黄素,V. 0.1%乙酸+20 μmol/L姜黄素,VI. 0.1%乙酸+40 μmol/L姜黄素,VII. 0.1%乙酸+80 μmol/L姜黄素,VIII. 0.1%乙酸+160 μmol/L姜黄素;不同小写字母代表数据存在显著性差异,P<0.05,图3、图5~图6同。
Figure 1. Antibacterial effects of curcumin mediated photodynamic sterilization on C. perfringens
-
[1] LI Y R, MAN S L, YE S Y, et al. CRISPR-Cas-based detection for food safety problems:Current status, challenges, and opportunities[J]. Comprehensive Reviews in Food Science and Food Safety,2022,21(4):3770−3398. doi: 10.1111/1541-4337.13000
[2] 杨丽. 低温肉制品研发生产现状及发展分析[J]. 食品安全导刊,2020(36):7. [YANG L. Current situation and development analysis of research and production of low temperature meat products[J]. China Food Safety,2020(36):7.] YANG L. Current situation and development analysis of research and production of low temperature meat products[J]. China Food Safety, 2020(36): 7.
[3] 孙晋跃, 孙芝兰, 吴海虹, 等. 非热杀菌技术在低温鸡肉制品致病菌控制中的应用研究进展[J]. 肉类研究,2020,34(8):84−90. [SUN J Y, SUN Z L, WU H H, et al. Advances in application of non-thermal sterilization technologies to control pathogens in low temperature chicken products[J]. Meat Research,2020,34(8):84−90.] doi: 10.7506/rlyj1001-8123-20200529-139 SUN J Y, SUN Z L, WU H H, et al. Advances in application of non-thermal sterilization technologies to control pathogens in low temperature chicken products[J]. Meat Research, 2020, 34(8): 84−90. doi: 10.7506/rlyj1001-8123-20200529-139
[4] 李璐, 赵宝华. 产气荚膜梭菌主要致死性毒素的研究进展[J]. 畜牧与饲料科学,2011,32(4):94−98. [LI L, ZHAO B H. Research progress of major lethal toxins of clostridium perfringens[J]. Animal Husbandry and Feed Science,2011,32(4):94−98.] LI L, ZHAO B H. Research progress of major lethal toxins of clostridium perfringens[J]. Animal Husbandry and Feed Science, 2011, 32(4): 94−98.
[5] 崔肖爽, 梁栋, 李苗云, 等. 产气荚膜梭菌芽孢萌发剂筛选及其萌发特性研究[J]. 食品安全质量检测学报,2023,14(2):191−197. [CUI X S, LIANG D, LI M Y, et al. Screening of germinant for inducing the germination of Clostridium perfringens spores and study on its germination characteristics[J]. Journal of Food Safety and Quality,2023,14(2):191−197.] CUI X S, LIANG D, LI M Y, et al. Screening of germinant for inducing the germination of Clostridium perfringens spores and study on its germination characteristics[J]. Journal of Food Safety and Quality, 2023, 14(2): 191−197.
[6] OHTANI K, SHIMIZU T. Regulation of toxin production in Clostridium perfringens[J]. Toxins,2016,8(7):207. doi: 10.3390/toxins8070207
[7] LUKSIENE Z, BROVKO L. Antibacterial photosensitization-based treatment for food safety[J]. Food Engineering Reviews,2013,5(4):185−199. doi: 10.1007/s12393-013-9070-7
[8] SEIDI D M, MEREDDY R, NETZEL M E, et al. An insight into curcumin-based photosensitization as a promising and green food preservation technology[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):1727−1759. doi: 10.1111/1541-4337.12583
[9] MEEROVICH G A, AKHLYUSTINA E V, DENISOV D S, et al. Photodynamic inactivation of Escherichia coli bacteria by cationic photosensitizers[J]. Laser Physics Letters,2021,18(11):115601. doi: 10.1088/1612-202X/ac2cd1
[10] ZUHLKE M, MEILING T T, RODER P, et al. Photodynamic inactivation of E. coli bacteria via carbon nanodots[J]. ACS Omega,2021,6(37):23742−23749. doi: 10.1021/acsomega.1c01700
[11] PENHA C B, BONIN E, SILVA A F D, et al. Photodynamic inactivation of foodborne and food spoilage bacteria by curcumin[J]. LWT-Food Science and Technology,2017,76(8):198−202.
[12] FAHAD A, RAM M, YASMINA S. A novel photosensitization treatment for the inactivation of fungal spores and cells mediated by curcumin[J]. Journal of Photochemistry & Photobiology, B:Biology, 2017, 173:301-306.
[13] BHAVYA M L, HEBBAR U H. Efficacy of blue LED in microbial inactivation:Effect of photosensitization and process parameters[J]. International Journal of Food Microbiology,2019,290:296−304. doi: 10.1016/j.ijfoodmicro.2018.10.021
[14] 林以琳, 李璟, 张江玲, 等. 姜黄素介导的光动力技术对生鲜南美白对虾品质的影响[J]. 中国食品学报,2023,23(5):271−280. [LIN Y L, LI J, ZHANG J L, et al. The effect of curcumin mediated photodynamic technology on the quality of fresh south American white shrimp[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(5):271−280.] LIN Y L, LI J, ZHANG J L, et al. The effect of curcumin mediated photodynamic technology on the quality of fresh south American white shrimp[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(5): 271−280.
[15] DONG L, QIN J R, TAI L Y, et al. Inactivation of bacillus subtilis by curcumin-mediated photodynamic technology through inducing oxidative stress response[J]. Microorganisms,2022,10(4):802. doi: 10.3390/microorganisms10040802
[16] HUANG J M, CHEN B W, LI H H, et al. Enhanced antibacterial and antibiofilm functions of the curcumin-mediated photodynamic inactivation against Listeria monocytogenes[J]. Food Control,2020,108:106886. doi: 10.1016/j.foodcont.2019.106886
[17] TAO R, ZHANG F, TANG Q J, et al. Effects of curcumin-based photodynamic treatment on the storage quality of fresh-cut apples[J]. Food Chemistry,2018,274:415−421.
[18] WANG Y J, PAN M H, CHENG A L, et al, Stability of curcumin in buffer solutions and characterization of its degradation products[J]. Journal of Pharmaceutical and Biomedical Analysis, 1997, 15(12):1867-1876.
[19] GAO Y, WE J, LI Z J, et al. Curcumin-mediated photodynamic inactivation (PDI) against DH5 alpha contaminated in oysters and cellular toxicological evaluation of PDI-treated oysters[J]. Photodiagnosis and Photodynamic Therapy,2019,26:244−251. doi: 10.1016/j.pdpdt.2019.04.002
[20] 李路, 李蔚, 车金鑫, 等. p-茴香醛抑制柑橘酸腐病菌的作用机制[J]. 食品科学, 2020, 41(9):133−138. [LI L, LI W, CHE J X, et al. Antifungal activity and mechanism of p-anisaldehyde aganist geotrichum citri-aurantii[J]. Food Science, 2020, 41(9):133−138.] LI L, LI W, CHE J X, et al. Antifungal activity and mechanism of p-anisaldehyde aganist geotrichum citri-aurantii[J]. Food Science, 2020, 41(9): 133−138.
[21] DURACKA M, LUKAC N, KACANIOVA M, et al. Antibiotics versus natural biomolecules:The case of in vitro induced bacteriospermia by enterococcus faecalis in rabbit semen[J]. Molecules,2019,24(23):4329. doi: 10.3390/molecules24234329
[22] 陈梦玲, 蓝蔚青, 李函笑, 等. 牛至精油对腐生葡萄球菌抑制作用机制[J]. 食品科学,2020,41(7):46−51. [CHEN M L, LAN W Q, LI H X, et al. Action mechanism of oregano essential oil against staphylococcus saprophyticus[J]. Food Science,2020,41(7):46−51.] CHEN M L, LAN W Q, LI H X, et al. Action mechanism of oregano essential oil against staphylococcus saprophyticus[J]. Food Science, 2020, 41(7): 46−51.
[23] HU J M, LIN S L, TAN B K, et al. Photodynamic inactivation of Burkholderia cepacia by curcumin in combination with EDTA[J]. Food Research International,2018,111:265−271. doi: 10.1016/j.foodres.2018.05.042
[24] 徐令清, 莫艳梅, 简永欢, 等. 大黄及单体对金黄色葡萄球菌的体外抑菌作用及作用机制研究[J]. 国际检验医学杂志,2021,42(16):1929−1934. [XU L Q, MO Y M, JIAN Y H, et al. Study on the antibacterial effect and mechanis m of rhubarb and monomer on Staphylococcus aureus[J]. International Journal of Laboratory Medicine,2021,42(16):1929−1934.] XU L Q, MO Y M, JIAN Y H, et al. Study on the antibacterial effect and mechanis m of rhubarb and monomer on Staphylococcus aureus[J]. International Journal of Laboratory Medicine, 2021, 42(16): 1929−1934.
[25] LIU F, LIU Y N, SUN Z L, et al. Preparation and antibacterial properties of epsilon-polylysine-containing gelatin/chitosan nanofiber films[J]. International Journal of Biological Macromolecules,2020,164:3376−3387. doi: 10.1016/j.ijbiomac.2020.08.152
[26] 吴晶晶. 酶响应型山苍子精油脂质体对产气荚膜梭菌的抑制作用及在肉丸中的应用研究[D]. 镇江:江苏大学, 2022. [WU J J. Inhibitory effect of enzyme-responsive litsea cubeba essential oil Liposomes on Clostridium perfringens and its application meatball[D]. Zhenjiang:Jiangsu University, 2022.] WU J J. Inhibitory effect of enzyme-responsive litsea cubeba essential oil Liposomes on Clostridium perfringens and its application meatball[D]. Zhenjiang: Jiangsu University, 2022.
[27] LI S G, HUANG Y, AN F P, et al. Hydroxyl radical-induced early stage oxidation improves the foaming and emulsifying properties of ovalbumin[J]. Poultry Science,2019,98(2):1047−1054. doi: 10.3382/ps/pey370
[28] 朱玉林. 罗勒精油对李斯特菌的抗菌机制及其纳米纤维在猪肉中的应用研究[D]. 镇江:江苏大学, 2021. [ZHU Y L. Study on antibacterial mechanism of basil essential oil against Listeria monocytogenes and application of its nanofibers in pork preservation[D]. Zhenjiang:Jiangsu University, 2021.] ZHU Y L. Study on antibacterial mechanism of basil essential oil against Listeria monocytogenes and application of its nanofibers in pork preservation[D]. Zhenjiang: Jiangsu University, 2021.
[29] 王梓源, 李欣颖, 吕俊阁, 等. ε-聚赖氨酸对大肠杆菌的抑菌机制[J]. 食品与发酵工业, 2020, 46(21):34-41. [WANG Z Y, LI X Y, LÜ J G, et al. The antimicrobial mechanism ofε-poly-L-lysine against Escherichia coli[J] Food and Fermentation Industries, 2020, 46(21):34-41.] WANG Z Y, LI X Y, LÜ J G, et al. The antimicrobial mechanism of ε-poly-L-lysine against Escherichia coli[J] Food and Fermentation Industries, 2020, 46(21): 34-41.
[30] ZHENG D T, HUANG C X, HUANG H H, et al. Antibacterial mechanism of curcumin:A review[J]. Chemistry & Biodiversity,2020,17(8):e2000171.
[31] ZHANG J W, ZHENG P Y, LI J, et al. Curcumin-mediated sono-photodynamic treatment inactivates listeria monocytogenes via ros-induced physical disruption and oxidative damage[J]. Foods,2022,11(6):808. doi: 10.3390/foods11060808
[32] KAWANO A, YAMASAKI R, SAKAKURA T, et al. Reactive oxygen species penetrate persister cell membranes of escherichia colifor effective cell killing[J]. Frontiers in Cellular and Infection Microbiology,2020,10:496. doi: 10.3389/fcimb.2020.00496
[33] DIAS L D, AGUIAR A S N, DE MELO N J, et al. Structural basis of antibacterial photodynamic action of curcumin against[J]. Photodiagnosis and Photodynamic Therapy,2023,43:103645. doi: 10.1016/j.pdpdt.2023.103645
[34] BALTAZAR L D M, SOARES B M, CARNEIRO H C S, et al. Photodynamic inhibition of Trichophyton rubrum:In vitro activity and the role of oxidative and nitrosative bursts in fungal death[J]. Journal of Antimicrobial Chemotherapy,2013,68(2):354−361. doi: 10.1093/jac/dks414
[35] KIM M J, YUK H G. Antibacterial mechanism of 405-nanometer light-emitting diode against salmonella at refrigeration temperature[J]. Applied and Environmental Microbiology,2017,83(5):e02582.
-
期刊类型引用(2)
1. 潘海军,王锋,马路凯,刘东杰,王琴,肖更生. 姜黄素光动力技术在微生物杀菌中的研究进展. 保鲜与加工. 2025(01): 130-138 .  百度学术
百度学术
2. 何荣强,高土玲,符天晓,夏体泽. 光动力杀菌技术在鲜切水果保鲜中的研究进展. 保鲜与加工. 2025(02): 150-156 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



