Effect of Buffalo Milk Exosomes on Lipid Metabolism Disorder in Liver of Mouse Induced by High-fat-diet
-
摘要: 为探究水牛乳外泌体对高脂饮食引起的小鼠肝脏脂质代谢紊乱的影响。该试验通过超高速离心的方法获得水牛乳外泌体,选取32只雄性C57BL/J6小鼠,随机分成正常对照组(ND组)、高脂日粮组(HFD组)、外泌体低剂量组(HFD-L组)和外泌体高剂量组(HFD-H组)。正常对照组小鼠和其他组小鼠分别用10% kcal对照饲料和60% kcal高脂饲料喂养8周。之后按分组情况每48 h分别灌胃磷酸盐缓冲液(PBS)或水牛乳外泌体(5和20 mg/kg),持续28 d。测定小鼠体重,脂肪和肝脏质量;检测血清和肝脏甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及血清谷草转氨酶(AST)和谷丙转氨酶(ALT)水平,并对肝脏组织进行HE染色和油红O染色。结果显示,通过超高速离心的方法可以获得完整的水牛乳外泌体;水牛乳外泌体可一定程度缓解高脂饮食诱导的小鼠体重增加;同时能以剂量依赖的方式显著降低高脂小鼠肝脏和血清TG、TC、LDL-C(P<0.05),提高高脂小鼠肝脏和血清HDL-C及降低血清AST、ALT(P<0.05),减缓高脂小鼠肝损伤。此外,HE染色和油红O染色结果均显示水牛乳外泌体可显著改善小鼠肝脏空泡变性,减少肝脏脂质沉积(P<0.05)。综上,水牛乳外泌体减轻了高脂肪饮食引起的肝脏脂质紊乱,为乳源性外泌体作为天然纳米药物的应用与开发提供理论依据。Abstract: To investigate the effects of buffalo milk exosomes on lipid metabolism disorders in the liver of mice induced by high-fat diet. In the experiment, exosomes were obtained through ultra-high speed centrifugation from buffalo milk, and a total 32 male C57BL/J6 mice were selected and randomly divided into normal control group (ND group), high-fat diet group (HFD group), low-dose exosomes group (HFD-L group), and high-dose exosomes group (HFD-H group). The mice in normal control group and the other groups were respectively fed with a 10% kcal control feed and a 60% kcal high-fat diet for 8 weeks. Subsequently, the mice were gavaged with either PBS or buffalo milk exosomes (5 and 20 mg/kg) every 48 h for a duration of 28 d, based on their respective groupings. The following indexes were detected: body weight, total adipose, liver tissue masses, levels of serum, liver triglycerides (TG), total cholesterol (TC), high-density lipoprotein cholesterol (HDL-C), low-density lipoprotein cholesterol (LDL-C), as well as serum gluten transaminase (AST) and alanine transaminase (ALT). Furthermore, liver tissue was subjected to HE staining and oil red O staining. The results showed that the intact buffalo milk exosomes could be obtained through ultra-high speed centrifugation, and buffalo milk exosomes could alleviate the weight gain caused by a high-fat diet in mice to a certain degree. Additionally, the exosomes significantly reduced liver and serum levels of TG, TC and LDL-C in a dose-dependent manner in high-fat mice, conversely increased liver and serum levels of HDL-C, and increased the serum levels of AST and ALT (P<0.05), slowing down the liver damage in high-fat mice. In addition, the results from both HE staining and oil red O staining demonstrated that buffalo milk exosomes could improve liver vacuolar degeneration and reduce liver lipid deposition in mice (P<0.05). In summary, the buffalo milk exosomes would possess the potential to alleviate liver lipid disorders induced by a high-fat diet, thereby provide a theoretical basis for the application and advancement of milk-derived exosomes as natural nanomedicines.
-
Keywords:
- exosomes /
- buffalo milk /
- liver /
- high-fat diet /
- lipid disorder
-
肝脏能调节脂质稳态,在脂质代谢中起着关键作用,它可以把血液中的糖、甘油和脂肪酸通过磷脂酸途径合成为三酰甘油,并与载脂蛋白结合成脂蛋白,释放入血液,以供人体的需要,促进脂溶性物质的消化和吸收,同时吸收肝外胆固醇在肝内转化成胆汁排出,以防止体内胆固醇过载[1]。肝脏脂质代谢紊乱将会造成例如非酒精性脂肪肝、糖尿病等的代谢性相关疾病[2]。当今,随着生活水平大幅提高,人们饮食结构发生改变,高热量食物摄入增加以及长时间缺乏锻炼,导致能量囤积,引起脂肪肝及其他代谢综合征,引发全球健康问题。另有研究发现儿童期严重肥胖会增加青年和成年早期T2DM的风险[3]。因此,寻找可靠、安全的治疗方法显得尤为重要。
乳汁作为哺乳动物幼体的主要营养来源,含有蛋白质、乳糖、脂肪、维生素、矿物质等多种营养素及生长调节因子、免疫相关因子等重要生理活性物质[4]。在众多饮品中,牛乳是消耗最多的饮品之一。作为新生哺乳动物的主要营养来源,牛乳不仅含有营养元素,乳中的生物活性成分对机体多种生理活动诸如免疫系统等的发育还发挥重要作用[5]。许多研究还表明牛奶有利于促进身体机体抵抗各种疾病,如高血糖、2型糖尿病、高血压等[6],具有能够保护肾脏和肝脏的功能,但其作用机制尚不明确。此外,有研究发现喝牛奶可降低胆固醇[7]。随着研究的深入,越来越多的研究表明机体重要生命过程中的关键作用与乳外泌体相关[8−9]。水牛乳是一种品质优良、口感醇香的特色乳,营养成分含量丰富。虽然水牛乳产量较奶牛低,但其干物质、蛋白质、乳脂肪及矿物质等含量均较普通牛乳高,有“乳中精品”之称[10]。外泌体作为乳汁重要成分之一,能够携带和传递miRNA等信号分子,已成为目前食源外泌体的研究热点[11]。乳外泌体是天然存在于人乳、牛乳等各种乳源液体的一种分泌小体,直径为30~150 nm的膜状纳米囊泡[12−13]。研究表明,牛乳外泌体在人体免疫系统和肠道发育中扮演着重要角色[14−16],还能帮助机体预防一些疾病和缓解癌症[11,17]。目前,研究者已经从奶牛[18−20]、牦牛[21]、骆驼[22−23]等多种动物乳中获取外泌体并进行了功能研究,但关于水牛乳外泌体的功能研究还比较匮乏。本试验通过超高速离心的方法分离了水牛奶中的外泌体,通过电镜、纳米颗粒跟踪分析仪和蛋白质印记法鉴定提取的外泌体。利用高脂饲料诱导普通小鼠为高脂代谢紊乱模型小鼠,灌胃外泌体溶液,初步探讨水牛乳外泌体对高脂肪饮食引起的肝脏脂质紊乱的影响,为乳源性外泌体的应用与开发提供理论依据,也为研究水牛乳的营养价值提供新的思路。
1. 材料与方法
1.1 材料与仪器
水牛奶(泌乳中期) 四方坡牛场;BCA蛋白浓度测定试剂盒 碧云天生物技术有限公司;谷丙转氨酶(ALT)、血清谷草转氨酶(AST)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C) 南京建成生物工程研究所;C57BL/6J雄性健康小鼠 2周龄,体重(20±2) g,32只,购自北京生命河实验动物科技有限公司,许可证号:SCXK(京)2019-0010。所有动物实验均经广西大学动物伦理委员会批准(编号GXU-2022-337)。
Beckman Optima XPN-100Ultracentrifuge 智能型高效离心机 贝克曼库尔特有限公司;Varioskan LUX酶标仪 赛默飞世尔科技(中国)有限公司;QMR23060H-I核磁共振波谱仪 纽曼(中国苏州)公司;Nano-ZS90X Zeta电位粒度仪 英国马尔文仪器设备有限公司。
1.2 实验方法
1.2.1 水牛奶中外泌体的制备
收集水牛奶样品,使用超高速离心法获得外泌体,具体步骤:将新鲜的水牛奶样品装入50 mL干净离心管,2000~3000×g于4 ℃离心20~30 min,用注射器吸取中间层乳清;得到的乳清12000~15000×g于4 ℃离心20~30 min,吸取中间层乳清;中间层乳清于4 ℃、3000×g离心60 min,收集中层乳;重复一次上述步骤;将收集的中层乳在4 ℃下以83000×g再离心60 min,收集中层乳;将收集的中层乳液体经0.22 µm滤器过滤,得到的液体在4 ℃以100000~130000×g离心90 min 后再重复一次上述步骤,收集沉淀,获得外泌体。将沉淀外泌体悬浮在磷酸盐缓冲液(PBS)中,得到的外泌体溶液放入−80 ℃冰箱保存,待用。
1.2.2 外泌体的鉴定
使用透射电子显微镜(transmission electronmicroscope,TEM)观察水牛奶中外泌体的形态。将20 μL外泌体悬浮液滴在无定形碳包覆铜网上自然吸附5~10 min。通过加入20 μL中性的2%磷钨酸进行染色,静置3~5 min。然后通过在80 kV加速电压下运行的TEM查看铜网上的外泌体。
使用马尔文粒度仪分析水牛奶中外泌体的粒径大小和颗粒分布。提取的水牛乳外泌体用超纯水1:5000(v:v)稀释,而后分别取1 mL已稀释好的乳外泌体缓慢注入马尔文粒度仪检测,再根据 Stockes-Einstein方程式测算出所得到水牛乳外泌体流体力学直径及分布。
使用BCA蛋白试剂盒根据外泌体蛋白含量对外泌体进行定量。通过Western Blot检测外泌体标志基因ALG-2相互作用蛋白X(ALIX)、四跨膜蛋白(CD9)、肿瘤易感基因101蛋白(TSG101)和内参基因重组人钙连蛋白(Calnexin)表达。
1.2.3 小鼠灌胃
32只2周龄C57BL/6J 雄性健康小鼠在温度为23±2 °C的动物房中,光照/黑暗循环12 h,自由摄食和饮水适应2周。2周适应期后,将32只4周龄C57BL/6J雄性健康小鼠随机分为正常对照组(ND组)、高脂组(HFD*组)。其中,正常对照(ND组)8只,高脂组(HFD*组)24只。正常对照组予普通饲粮,高脂组(HFD*组)给予高脂饲粮,喂食8周,称量小鼠体重,核磁检测小鼠体成分。8周干预后,再将24只高脂组小鼠随机分为高脂日粮组(HFD组)、外泌体低剂量组(HFD-L组)和外泌体高剂量组(HFD-H组),每组8只。HFD-L组和HFD-H组分别灌胃5 mg/kg和20 mg/kg水牛乳外泌体,每48 h灌胃一次,每4 d测量体重,持续28 d,ND组和HFD组灌胃等量PBS,灌胃浓度与灌胃方法参考文献[22,24−25]。
1.2.4 核磁共振(NMR)
灌胃28 d,每4 d使用NMR分析活小鼠的身体成分,以及它们的脂肪和瘦肉质量。测量前使用标准对相关参数进行校准,校准结束后,将小鼠装入测量筒,将测量筒轻轻放入分析仪,点击开始测量体成分,待检测完成后取出测量筒并将小鼠放回。
1.2.5 样品采集与处理
外泌体干预28 d后小鼠解剖取样,解剖前12 h对小鼠禁食。C57BL/6J小鼠麻醉失去知觉后眼部取血后颈部断颈处死,迅速采集小鼠脂肪和肝脏组织,一部分放于液氮中保存,随后转移至−80 ℃冰箱保存备用,一部分放入10%中性福尔马林固定液中,4 ℃保存待用。血液于37 ℃放置30 min,3000 r/min离心10 min后收集血清。
1.2.6 肝脏HE染色和油红O染色
将肝组织固定在组织固定液中,脱水,石蜡包埋,切片,苏木精和伊红(HE)染色。新鲜肝组织在液氮中冷冻,切片,油红O染色。
1.2.7 血清和肝脏指标检测
1.2.7.1 血清检测
干预4周后,过夜禁食12 h(禁食期间小鼠自由饮水),通过眼球取血法留取足量空腹血,血样置于1.5 mL EP管中,4 ℃静置过夜,以3000 r/min 离心15 min,取上清,按甘油三酯(TG)说明书于空白孔、校准孔以及样本孔分别加入蒸馏水、校准品以及样品2.5 μL[26]。随后每孔加入250 μL工作液,振荡混匀。于37 ℃孵育10 min,酶标仪上以510 nm波长测定各孔吸光度值。最后,根据说明书中的公式计算得出每个样本的TG值、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、血清谷草转氨酶(AST)、谷丙转氨酶(ALT)。
1.2.7.2 肝脏检测
取100 mg肝脏组织放入EP管,在EP管中加入配比为PMSF:RIPA=1:100(v:v)的组织裂解液,放入组织破碎仪破碎15 min,破碎匀浆于4 ℃摇臂过夜裂解;裂解完毕后放入预冷4 ℃离心机,12000×g离心10 min,取上清,用BCA法测定肝脏上清蛋白浓度,根据说明书检测肝脏上清TG、TC、LDL-C、HDL-C吸光值,用蛋白浓度进行标定。
1.3 数据处理
数据采用SPSS 26.0统计学软件进行处理分析,使用GraphPad Prism 8.0软件绘图。所有数据均以平均值±标准误x±s表示。单因素方差分析用于两组以上的数据。P<0.05被认为差异具有统计学意义。“*”表示P<0.05,差异显著;“**”表示P<0.01,差异极显著。
2. 结果与分析
2.1 水牛奶中外泌体的鉴定
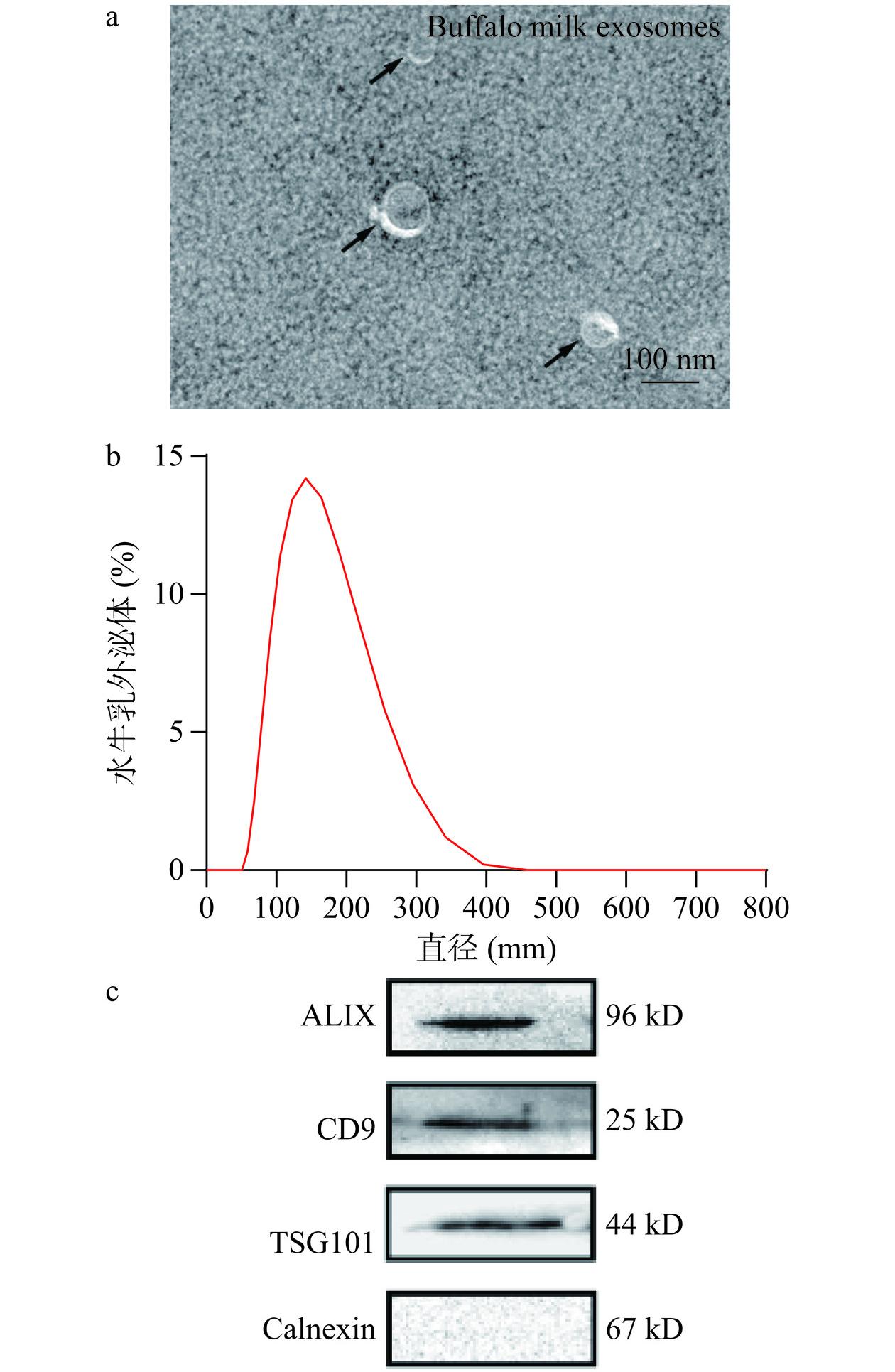
本研究使用传统超高速离心法提取了水牛乳外泌体。如图1a所示,在透射电子显微镜下可以观察到结构完整的茶杯形状,直径小于150 nm,为清晰的圆形的囊泡。通过马尔文粒径分析仪测得水牛乳外泌体的平均直径约为122.1 nm(图1b)。此外,通过Western Blot鉴定乳外泌体中标记蛋白,结果如图1c,显示标记蛋白ALIX、CD9和TSG101都正常表达且大小正确,细胞内参蛋白Calnexin未在水牛乳外泌体中表达。以上结果表明本研究提取的水牛乳外泌体准确可靠,具有良好的稳定性,可以应用于后续实验。
2.2 水牛乳外泌体对小鼠体重和脂肪沉积的影响
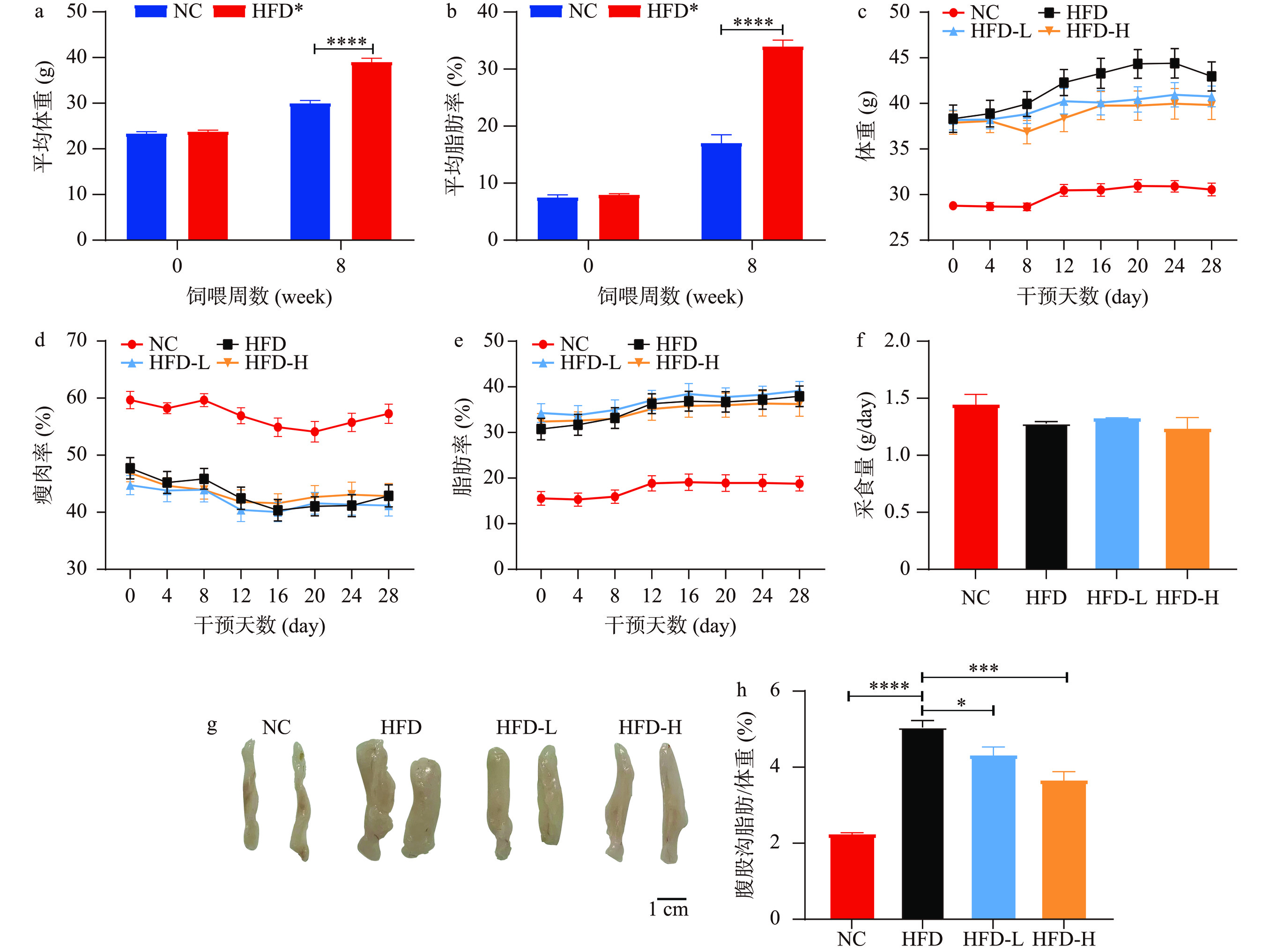
如图2a~图2b所示,高脂饲料饲喂小鼠8周后,与对照组小鼠相比,高脂饲喂的小鼠平均体重和脂肪率极显著(P<0.0001)增加。随后按照提前设置的分组,对HFD-L组和HFD-H组分别灌胃5 mg/kg和20 mg/kg水牛乳外泌体,ND组和HFD组灌胃等量PBS;图2c所示结果为灌胃期间各组小鼠体重变化情况,与HFD组相比,HFD-L组和HFD-H组小鼠体重变化虽未达到显著性差异(P>0.05),但都表现出一定程度的降低。对于小鼠体成分变化来说,灌胃第12 d后,与HFD组相比,HFD-H组小鼠瘦肉率开始升高(图2d),HFD-H组小鼠脂肪率开始降低(图2e),说明高浓度水牛乳外泌体具有增加小鼠瘦肉率的能力,但是增加瘦肉率的能力十分有限;图2f所示为各组小鼠的采食量情况,结果表明水牛乳外泌体对小鼠的采食量没有显著(P>0.05)影响,可排除了水牛乳外泌体通过抑制能量摄入降低体重的可能性;对于小鼠腹股沟脂肪沉积来说,灌胃4周后,与HFD组相比,HFD-L组和HFD-H组的小鼠的腹股沟脂肪明显减少(图2g),腹股沟脂肪重量/体重比显著降低(P<0.05,P<0.001),且高剂量组更显著。以上结果表明,水牛乳外泌体可改善由高脂肪饮食诱导的小鼠体重增加与腹股沟脂肪沉积。
2.3 水牛乳外泌体对小鼠肝脏组织学的影响
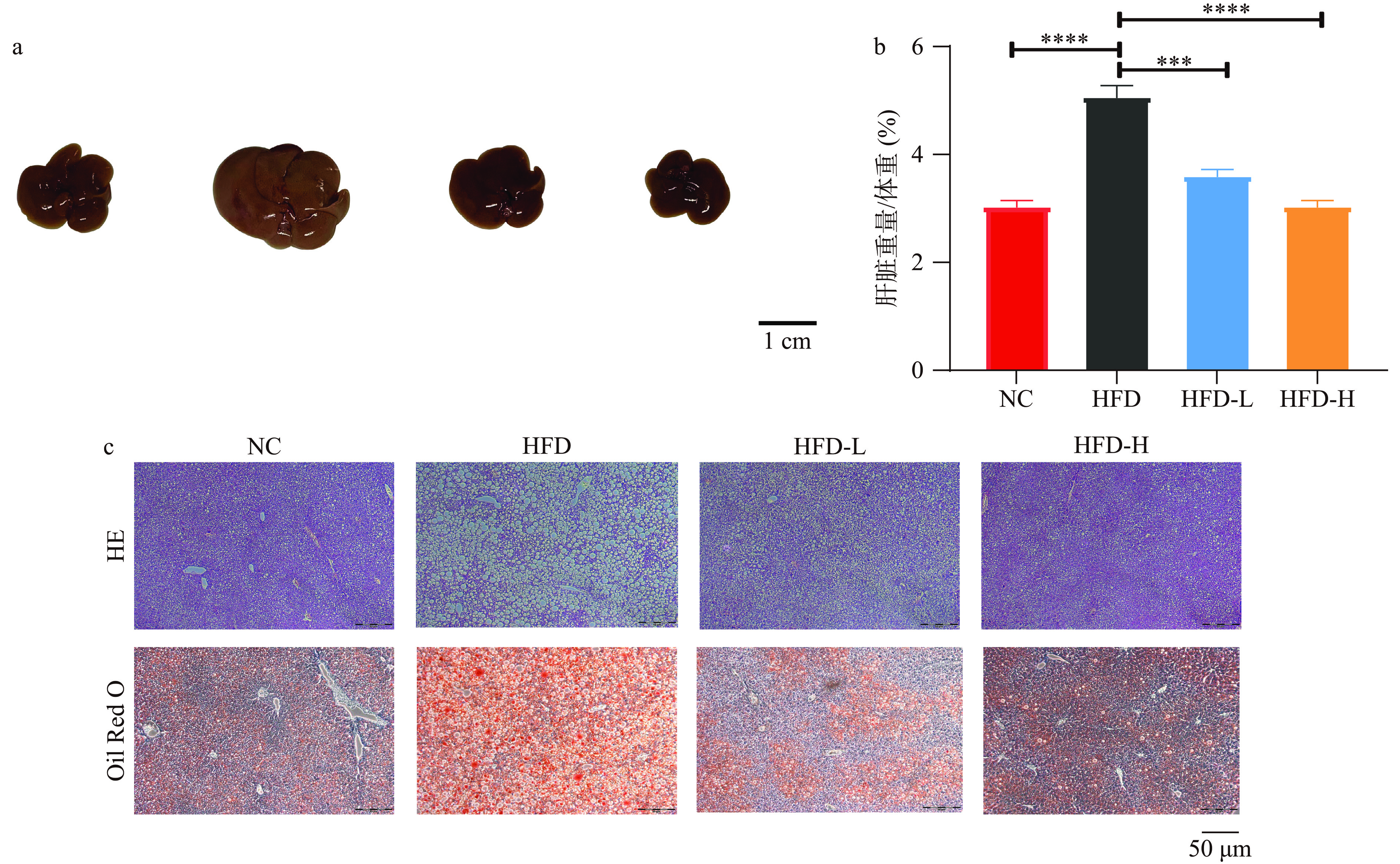
为探讨水牛乳外泌体对肝脏脂肪沉积与损伤的作用,本研究又对肝脏组织形态进行了研究。结果发现,相比于NC组,高脂饮食会导致HFD组肝脏明显肿大,发黄且表面有明显的脂肪粒(图3a),说明HFD组的小鼠肝脏已经发展为脂肪肝。而相比于HFD组,HFD-L组和HFD-H组都极显著降低了肝脏/体重比值(图3b)(P<0.001,P<0.0001),极显著抑制了高脂诱导的肝肥大与脂肪粒的产生,并使肝呈现出正常的鲜红色(图3a),且HFD-H组相对于HFD-L组的效果更好,说明高剂量的水牛乳外泌体有更好的抑制肝脏脂肪变性的作用。HE和油红O染色结果也表明,与NC组相比,HFD组肝脏变性空泡化,脂滴增加。相对于HFD组,HFD-L组和HFD-H组减少了由高脂饮食带来的肝脏空泡变性和脂滴积累(图3c)。
2.4 水牛乳外泌体对小鼠血清中脂质沉积的影响
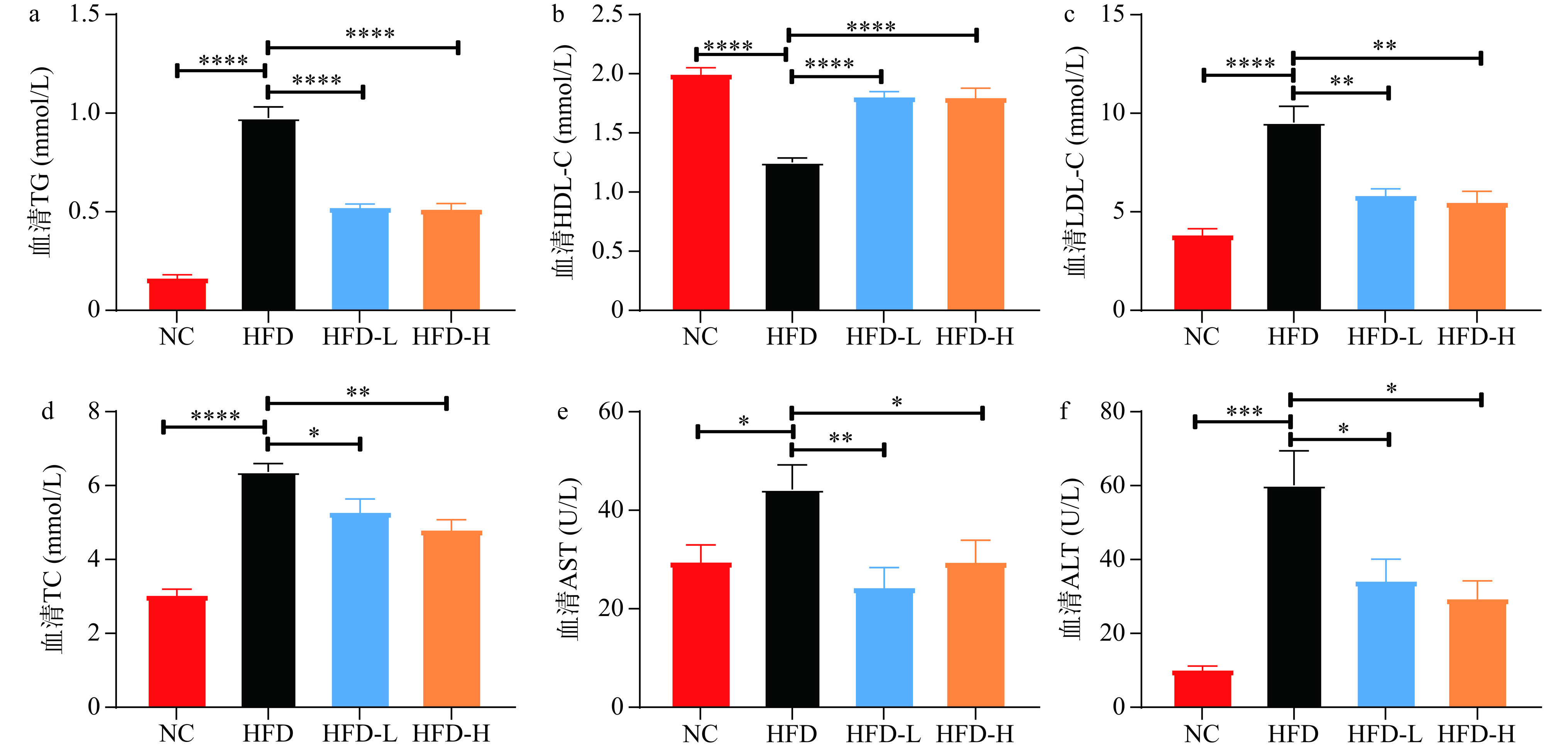
为了进一步探讨水牛乳外泌体对肝脏脂质代谢的影响,本研究先测定了血清中的TG、HDL-C、LDL-C、TC、AST、ALT的水平。由图4可知,与HFD组相比,HFD-L组和HFD-H组小鼠血清的TG水平(图4a)极显著降低(P<0.0001)、LDL-C(图4c)极显著降低(P<0.001,P<0.0001)、TC(图4d)水平显著降低(P<0.05,P<0.01),同时HDL-C水平显著增加(图4b)(P<0.0001),说明水牛乳外泌体改善了小鼠血清脂质沉积和过度脂质沉积带来的LDL水平升高。此外,与HFD组小鼠相比,灌胃水牛乳外泌体后,小鼠血清的AST(图4e)(P<0.01,P<0.05)、ALT(图4f)显著降低(P<0.05),说明水牛乳外泌体能够显著缓解高脂饮食带来的肝功能损伤。
2.5 水牛乳外泌体对小鼠肝脏中脂质沉积的影响
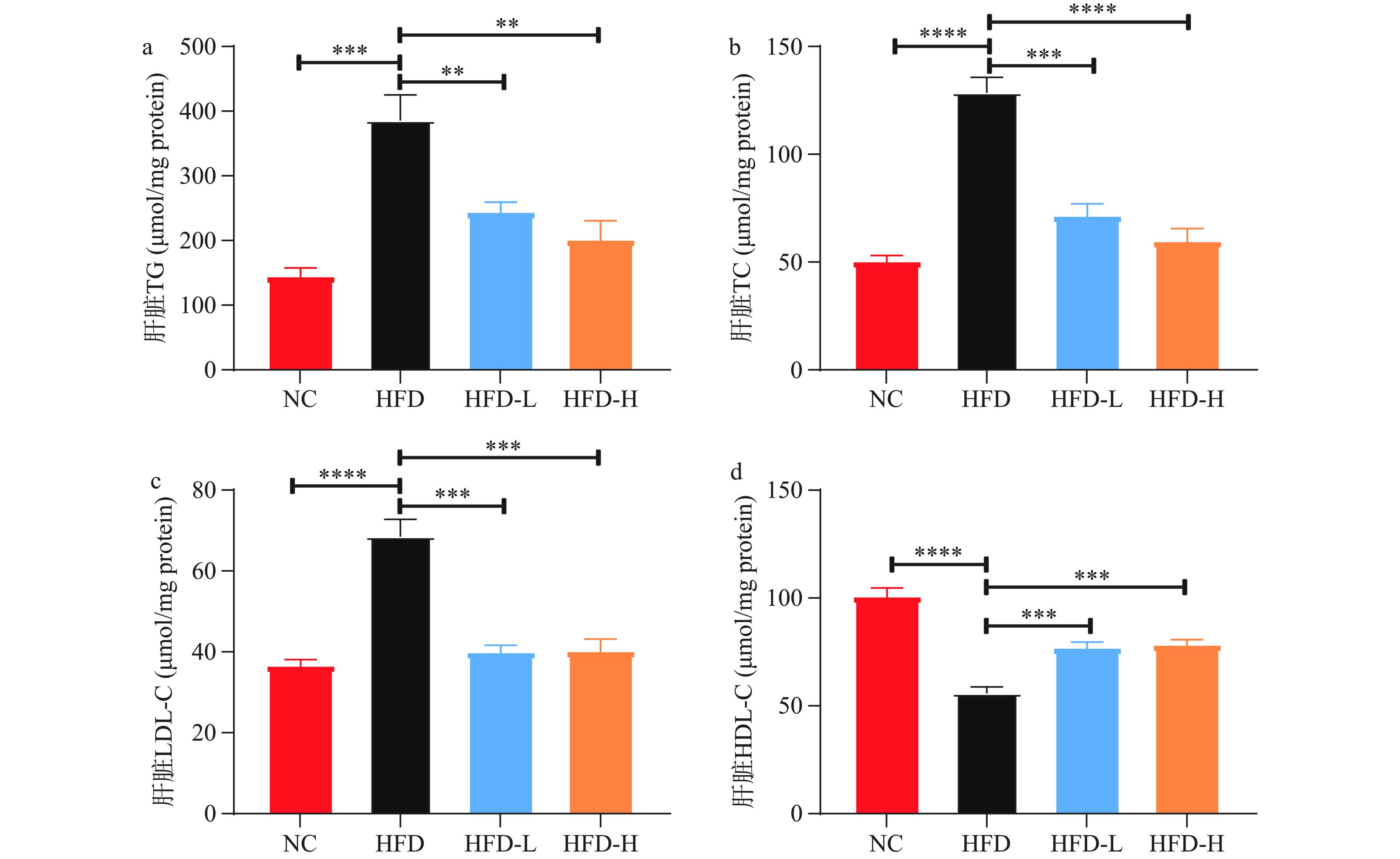
通过进一步测定肝脏组织的TG、TC、LDL-C、HDL-C水平,结果发现,如图5所示,与NC组相比,HFD组的TG(图5a)显著升高(P<0.001)、TC(图5b)极显著升高(P<0.0001)、LDL(图5c)极显著升高(P<0.0001),HDL(图5d)极显著降低(P<0.0001)。灌胃水牛乳外泌体后,小鼠肝脏的TG(图5a)显著降低(P<0.01)、TC(图5b)极显著降低(P<0.001,P<0.0001)、LDL-C(图5c)随着水牛乳外泌体剂量的增加极显著降低(P<0.001),HDL-C(图5d)极显著升高(P<0.001)。说明水牛乳外泌体能够显著缓解高脂饮食引发的脂质代谢紊乱。
3. 讨论与结论
逐年增加的肥胖和糖尿病人群给医疗体系带来严峻挑战,肝脏作为所有类型脂质的主要代谢器官,其脂质代谢过程复杂,涉及脂质摄取和转化、脂质的合成与降解等。外泌体作为介导细胞间信息传递的重要媒介,参与机体众多生命过程。本研究发现水牛乳外泌体对高脂饮食小鼠的肥胖干预效果较好,能够产生积极的缓解作用,具有较好的降脂作用,为牛奶在脂代谢调控方面的功能提供了新的理论依据。关于水牛乳外泌体是通过影响哪些过程从而表现出降脂效果还有待进一步研究。
能量摄入和消耗的不平衡导致能量堆积,造成肥胖进而形成脂肪肝。体质量变化是反映机体功能正常与否最为直观的指标,动物体质量增长过快会影响正常的生命活动。张梦丹等[22]利用高糖高脂饲料加链脲佐菌素(streptozotocin,STZ)诱导普通小鼠为Ⅰ型糖尿病模型小鼠后,每日定时给各组小鼠灌胃骆驼乳外泌体溶液达40 d,结果发现骆驼乳外泌体显著缓解了Ⅰ型糖尿病带来的体重下降和血糖升高。在Zhao等[24]的研究中,8周高脂诱导小鼠肥胖后,给予蓝莓外泌体(胃内给药,每隔1 d一次),持续4周,结果发现蓝莓外泌体对体重增加有一定的抑制作用但无显著性。课题组高脂诱导小鼠肥胖后,给予水牛乳外泌体干预4周,结果表明水牛乳外泌体能够一定程度降低高脂饮食带来的体重增加,但不显著,推测可能与干预时间有关。后续研究可适当延长水牛乳外泌体的干预时间,以明确其对体重的影响作用。
非酒精性脂肪性肝病(NAFLD)是一种高度普遍且复杂的疾病,以肝脏内TG异常沉积为主要病理特征,是肝细胞发生脂肪变性的一种脂类代谢紊乱性疾病,随着病程发展可进一步发展为脂肪性肝脏炎症,甚至是肝纤维化、肝癌[27]。组织学表现为肝细胞胞浆内充满脂肪滴。在脂肪肝的体内研究中,HFD喂养常被用来诱导肝脏脂肪变性[28]。Zhao等[24]探究蓝莓外泌体(blueberry-derived exosomes-like nanoparticles,BELN)对HFD小鼠NAFLD影响,发现给药BELN显著降低了HFD喂养小鼠的TC和TG含量、ALT和AST水平以及LDL-C含量,并增加了HDL-C含量,本文也得到了同样的结论。课题组通过高脂饮食建立肥胖非酒精性脂肪肝小鼠模型,结果显示,高脂模型小鼠体重和肝重明显增加,且伴有肝脏脂肪变性及脂质代谢紊乱。对高脂模型小鼠灌胃水牛乳外泌体干预4周,结果发现,HFD-L组和HFD-H组小鼠血清和肝脏TG、TC及LDL-C水平均较HFD组小鼠明显降低,HDL-C水平较HFD组小鼠明显升高,表明水牛乳外泌体缓解了HFD喂养小鼠发生的脂代谢紊乱。
HFD喂养会诱导小鼠肝脏肿大,肝脏组织呈现空泡样病变、局部细胞坏死,脂肪浸润严重,腹股沟脂肪过度沉积,说明HFD喂养的小鼠发生了肝脏脂肪变性;而水牛乳外泌体干预4周后明显改善脂肪空泡变性,抑制脂滴在肝脏的形成,减少脂肪在腹股沟的过度沉积,说明水牛乳外泌体能缓解HFD诱导的肝损伤和肝脏脂肪病变。Zhao等[24]进一步对BELN改善HFD小鼠NAFLD机制研究发现,HFD诱导细胞质中Nrf2略微增加,但补充BELN加速了Nrf2在HFD小鼠肝脏中从细胞质向细胞核的转运,Nrf2是肝细胞氧化还原平衡的关键调节因子[29]。生姜来源的外泌体样纳米颗粒以TLR4/TRIF依赖的方式在Nrf2的激活中发挥关键作用,以防止酒精诱导的肝损伤[30]。这表明水牛乳外泌体可能通过激活Nrf2,HFD小鼠肝脏中Nrf2的运转来改善NAFLD导致的脂质紊乱。本研究结果为治疗NAFLD提供了一种新的可能策略。
越来越多的证据表明,外泌体纳米颗粒可以作为细胞外信使,介导细胞间的交流通信,甚至通过其包含的物质(如microRNA、生物活性脂质和蛋白质)在种间通信中发挥作用[31]。外泌体能够在不同消化液(包括唾液、胃液、胰液和胆汁)中保留生物活性,所以机体可以通过饮食摄入并吸收牛乳外泌体[32],Yamauchi等[33]灌胃小鼠不同浓度的外泌体,发现牛乳外泌体主要分布在肠黏膜、肝脏和大肠中,少部分聚集在其他组织。因此,如果有合适的来源和载体,外泌体纳米颗粒可以作为治疗许多肝脏和肠道疾病的天然疗法。研究发现,外泌体作为组织间通讯的一种新载体,对肝-脂肪串扰中起着重要作用。有学者发现,肝外泌体来源miR130a-3p通过降低PHLPP2在脂肪细胞中的表达降低了脂滴在脂肪细胞中的合成,并且通过激活AKT-AS160-GLUT4信号通路来缓解葡萄糖代谢异常[34]。研究发现,脂肪组织巨噬细胞衍生的外泌体microRNA可以调节体内和体外胰岛素敏感性[35]。以上研究表明外泌体可通过其携带的micrRNA调控机体脂质和葡萄糖代谢。关于牛乳外泌体生物功能的研究并不全面,仍有很多争议,研究对象更多为荷斯坦奶牛。有报道牛乳外泌体中可能存在人类罹患肥胖潜在的危险因素,某些外泌体microRNA被证实与肥胖有关[36−37],miR-148a能够通过Wnt信号促进脂肪细胞分化[38],miR-21参与脂肪细胞分化调控,能显著促进脂肪细胞分化[39],而本研究中,水牛外泌体缓解了高脂饮食导致的脂代谢紊乱,揭示水牛乳外泌体和荷斯坦乳外泌体microRNA可能存在差异,未来还需对两者进行更全面深入的研究。
本研究初步探究了水牛乳外泌体对高脂肪饮食引起的肝脏脂质紊乱的治疗效果,对其作用机制尚未解析。在后续研究中课题组会进一步关注水牛乳外泌体中相关microRNA或其他活性成分的作用,以期揭示水牛乳外泌体参与脂质代谢的调控机制。
-
-
[1] TREFTS E, GANNON M, WASSERMAN D H. The liver[J]. Curr Biol,2017,27(21):R1147−R1151. doi: 10.1016/j.cub.2017.09.019
[2] GEISLER C E, RENQUIST B J. Hepatic lipid accumulation:cause and consequence of dysregulated glucoregulatory hormones[J]. J Endocrinol,2017,234(1):R1−R21. doi: 10.1530/JOE-16-0513
[3] BJORNSTAD P, NEHUS E, EL GHORMLI L, et al. Insulin sensitivity and diabetic kidney disease in children and adolescents with type 2 diabetes:An observational analysis of data from the TODAY clinical trial[J]. American Journal of Kidney Diseases,2018,71(1):65−74. doi: 10.1053/j.ajkd.2017.07.015
[4] PEREIRA P C. Milk nutritional composition and its role in human health[J]. Nutrition,2014,30(6):619−627. doi: 10.1016/j.nut.2013.10.011
[5] CACHO N T, LAWRENCE R M. Innate immunity and breast milk[J]. Frontiers in Immunology,2017,8:584. doi: 10.3389/fimmu.2017.00584
[6] SHIN S, LEE H, KIM C E, et al. Association between milk consumption and metabolic syndrome among korean adults:Results from the health examinees study[J]. Nutrients,2017,9(10):1102. doi: 10.3390/nu9101102
[7] 宋志臣. 喝牛奶可降低胆固醇[J]. 乳品与人类, 2001(1):29. [SONG Zhichen. Drinking milk can lower cholesterol[J]. Dairy and Human, 2001 (1):29.] SONG Zhichen. Drinking milk can lower cholesterol[J]. Dairy and Human, 2001 (1): 29.
[8] CHIOFALO B, DUGO P, BONACCORSI I L, et al. Comparison of major lipid components in human and donkey milk:New perspectives for a hypoallergenic diet in humans[J]. Immunopharmacology and Immunotoxicology,2011,33(4):633−644. doi: 10.3109/08923973.2011.555409
[9] MELNIK B C, SCHMITZ G. MicroRNAs:Milk's epigenetic regulators[J]. Best Practice & Research Clinical Endocrinology & Metabolism,2017,31(4):427−442.
[10] 李春梅, 钟璇, 韩佳临, 等. 水牛乳成分、理化特性及其干酪产品研究进展[J]. 食品科技, 2023, 48(8):44−50. [LI Chunmei, ZHONG Xuan, HAN Jialin, et al. Research progress on the composition, physicochemical properties, and cheese products of buffalo milk[J]. Food Technology, 2023, 48 (8):44−50.] LI Chunmei, ZHONG Xuan, HAN Jialin, et al. Research progress on the composition, physicochemical properties, and cheese products of buffalo milk[J]. Food Technology, 2023, 48 (8): 44−50.
[11] MUNIR J, LEE M, RYU S. Exosomes in food:Health benefits and clinical relevance in diseases[J]. Advances in Nutrition,2020,11(3):687−696. doi: 10.1093/advances/nmz123
[12] THÉRY C, AMIGORENA S, RAPOSO G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Current Protocols in Cell Biology,2006,30(1):3−22.
[13] RAPOSO G, STOORVOGEL W. Extracellular vesicles:Exosomes, microvesicles, and friends[J]. Journal of Cell Biology,2013,200(4):373−383. doi: 10.1083/jcb.201211138
[14] ALSAWEED M, HARTMANN P, GEDDES D, et al. MicroRNAs in breastmilk and the lactating breast:Potential immunoprotectors and developmental regulators for the infant and the mother[J]. International Journal of Environmental Research and Public Health,2015,12(11):13981−14020. doi: 10.3390/ijerph121113981
[15] MELNIK B C, JOHN S, SCHMITZ G. Milk:an exosomal microRNA transmitter promoting thymic regulatory T cell maturation preventing the development of atopy?[J]. Journal of Translational Medicine,2014,12(1):43. doi: 10.1186/1479-5876-12-43
[16] CHEN T, XIE M, SUN J J, et al. Porcine milk-derived exosomes promote proliferation of intestinal epithelial cells[J]. Scientific Reports,2016,6(1):33862. doi: 10.1038/srep33862
[17] REIF S, ELBAUM-SHIFF Y, KOROUKHOV N, et al. Cow and human milk-derived exosomes ameliorate colitis in DSS murine model[J]. Nutrients, 2020, 12(9).
[18] REINHARDT T A, LIPPOLIS J D, NONNECKE B J, et al. Bovine milk exosome proteome[J]. J Proteomics,2012,75(5):1486−1492. doi: 10.1016/j.jprot.2011.11.017
[19] LI B, HOCK A, WU R Y, et al. Bovine milk-derived exosomes enhance goblet cell activity and prevent the development of experimental necrotizing enterocolitis[J]. PLoS One,2019,14(1):e211431.
[20] SAMUEL M, CHISANGA D, LIEM M, et al. Bovine milk-derived exosomes from colostrum are enriched with proteins implicated in immune response and growth[J]. Sci Rep,2017,7(1):5933. doi: 10.1038/s41598-017-06288-8
[21] GAO H N, GUO H Y, ZHANG H. Yak-milk-derived exosomes promote proliferation of intestinal epithelial cells in an hypoxic environment[J]. Journal of Dairy Science,2019,102(2):985−996. doi: 10.3168/jds.2018-14946
[22] 张梦丹, 王浪, 李伟, 等. 骆驼奶中外泌体对Ⅰ型糖尿病小鼠治疗的作用研究[J]. 食品研究与开发, 2020, 41(24):8−11. [ZHANG Mengdan, WANG Lang, LI Wei, et al. Study on the therapeutic effect of exocrine body in camel milk on type I diabetes mice[J]. Food Research and Development, 2020, 41 (24):8−11.] ZHANG Mengdan, WANG Lang, LI Wei, et al. Study on the therapeutic effect of exocrine body in camel milk on type I diabetes mice[J]. Food Research and Development, 2020, 41 (24): 8−11.
[23] El-KATTAWY A M, ALGEZAWY O, ALFAIFI M Y, et al. Therapeutic potential of camel milk exosomes against HepaRG cells with potent apoptotic, anti-inflammatory, and anti-angiogenesis effects for colostrum exosomes[J]. Biomed Pharmacother,2021,143:112220. doi: 10.1016/j.biopha.2021.112220
[24] ZHAO W J, BIAN Y P, WANG Q H, et al. Blueberry-derived exosomes-like nanoparticles ameliorate nonalcoholic fatty liver disease by attenuating mitochondrial oxidative stress[J]. Acta Pharmacologica Sinica,2022,43(3):645−658. doi: 10.1038/s41401-021-00681-w
[25] JIANG X, WU Y Y, ZHONG H, et al. Human milk-derived extracellular vesicles alleviate high fat diet-induced non-alcoholic fatty liver disease in mice[J]. Mol Biol Rep,2023,50(3):2257−2268. doi: 10.1007/s11033-022-08206-2
[26] LI M M, XIAO Y, XIAO L G, et al. Epigoitrin alleviates lipid and glucose metabolic disorders induced by a high-fat diet[J]. Food Funct,2022,13(13):7260−7273. doi: 10.1039/D2FO00242F
[27] FOERSTER F, GAIRING S J, MÜLLER L, et al. NAFLD-driven HCC:Safety and efficacy of current and emerging treatment options[J]. Journal of Hepatology,2022,76(2):446−457. doi: 10.1016/j.jhep.2021.09.007
[28] 徐强, 黄松, 季珂, 等. DEHP促进酒精结合高脂饮食诱导大鼠酒精性脂肪肝的机制[J]. 安徽医科大学学报, 2021, 56(11):1718-1722. [XU Qiang, HUANG Song, JI Ke, et al. The mechanism of DEHP promoting the induction of alcoholic fatty liver in rats by combining alcohol with a high-fat diet[J]. Journal of Anhui Medical University, 2021, 56 (11):1718−1722.] XU Qiang, HUANG Song, JI Ke, et al. The mechanism of DEHP promoting the induction of alcoholic fatty liver in rats by combining alcohol with a high-fat diet[J]. Journal of Anhui Medical University, 2021, 56 (11): 1718−1722.
[29] MOHS A, OTTO T, SCHNEIDER K M, et al. Hepatocyte-specific NRF2 activation controls fibrogenesis and carcinogenesis in steatohepatitis[J]. J Hepatol,2021,74(3):638−648. doi: 10.1016/j.jhep.2020.09.037
[30] ZHUANG X, DENG Z B, MU J, et al. Ginger-derived nanoparticles protect against alcohol-induced liver damage[J]. J Extracell Vesicles,2015,4:28713. doi: 10.3402/jev.v4.28713
[31] ZHENG J, SHARP S J, IMAMURA F, et al. Association of plasma biomarkers of fruit and vegetable intake with incident type 2 diabetes:EPIC-InterAct case-cohort study in eight European countries[J]. BMJ,2020,370:m2194.
[32] ZENG B, CHEN T, XIE M Y, et al. Exploration of long noncoding RNA in bovine milk exosomes and their stability during digestion in vitro[J]. J Dairy Sci,2019,102(8):6726−6737. doi: 10.3168/jds.2019-16257
[33] YAMAUCHI M, SHIMIZU K, RAHMAN M, et al. Efficient method for isolation of exosomes from raw bovine milk[J]. Drug Dev Ind Pharm,2019,45(3):359−364. doi: 10.1080/03639045.2018.1539743
[34] WU J H, DONG T, CHEN T, et al. Hepatic exosome-derived miR-130a-3p attenuates glucose intolerance via suppressing PHLPP2 gene in adipocyte[J]. Metabolism,2020,103:154006. doi: 10.1016/j.metabol.2019.154006
[35] YING W, RIOPEL M, BANDYOPADHYAY G, et al. Adipose tissue macrophage-derived exosomal miRNAs can modulate in vivo and in vitro insulin sensitivity[J]. Cell,2017,171(2):372−384. doi: 10.1016/j.cell.2017.08.035
[36] PARDO F, VILLALOBOS-LABRA R, SOBREVIA B, et al. Extracellular vesicles in obesity and diabetes mellitus[J]. Mol Aspects Med,2018,60:81−91. doi: 10.1016/j.mam.2017.11.010
[37] KANG H, HATA A. The role of microRNAs in cell fate determination of mesenchymal stem cells:balancing adipogenesis and osteogenesis[J]. BMB Rep,2015,48(6):319−323. doi: 10.5483/BMBRep.2015.48.6.206
[38] SHI C M, ZHANG M, TONG M L, et al. MiR-148a is associated with obesity and modulates adipocyte differentiation of mesenchymal stem cells through Wnt Signaling[J]. Sci Rep,2015,5:9930. doi: 10.1038/srep09930
[39] KANG M, YAN L M, ZHANG W Y, et al. Role of microRNA-21 in regulating 3T3-L1 adipocyte differentiation and adiponectin expression[J]. Mol Biol Rep,2013,40(8):5027−5034. doi: 10.1007/s11033-013-2603-6
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:
 下载:
下载:



