Effects of Exogenous Melatonin Treatment on the Storage Quality and Antioxidant Capacity of Spaghetti Squash
-
摘要: 为探讨采后外源褪黑素处理对金丝绞瓜贮藏品质的影响,本文以0.2 mmol/L褪黑素(melatonin,MT)溶液处理金丝绞瓜,探究了在(9±1)℃、相对湿度65%~70%贮藏条件下果实品质和抗氧化能力的变化。结果表明,与对照组相比,MT处理将贮藏过程中金丝绞瓜腐烂的发生延后40 d。贮藏160 d时,MT处理组金丝绞瓜的腐烂率仅为15.56%,显著低于对照组果实(34.07%,P<0.05)。贮藏结束时,与对照组相比,MT处理将果实的失重率和呼吸强度分别降低了29.68%和18.02%,并延缓了硬度、脆度和颜色的退化。MT处理将果实超氧化物歧化酶活性峰值提升了14.18%,并有效提高了过氧化氢酶、过氧化物酶和抗坏血酸过氧化物酶的活性,降低了超氧阴离子的产生速率,抑制了过氧化氢和丙二醛的积累,并显著提升总酚和抗坏血酸含量(P<0.05),增强对DPPH·、ABTS+·和·OH的清除能力。综合分析表明,采后MT处理可提升金丝绞瓜贮藏过程中的抗氧化能力,保持较好的贮藏品质。Abstract: In order to explore the effects of postharvest exogenous melatonin (MT) treatment on the storage quality of spaghetti squash, squash was treated with 0.2 mmol/L MT solution to investigate the changes in fruit quality and antioxidant capacity during storage at (9±1) ℃ with relative humidity of 65%~70%. The results showed that MT treatment delayed the occurrence of decay of spaghetti squash by 40 days during storage compared with the control group. At 160 d of storage, the decay rate of MT-treated fruit was only 15.56%, which was significantly lower than that of the control fruit (34.07%, P<0.05). At the end of storage, compared with the control group, MT treatment reduced the weight loss rate and respiration rate of fruits by 29.68% and 18.02%, respectively, and delayed the degradation of hardness, brittleness and color. In addition, MT treatment increased the peak activity of superoxide dismutase in fruits by 14.18% and effectively enhanced the activities of catalase, peroxidase and ascorbate peroxidase, reduced O2−· production rate, significantly inhibited the accumulation of H2O2 and malondialdehyde. MT treatment also significantly improved the contents of total phenolics and ascorbic acid (reduced) in fruit (P<0.05), enhanced the scavenging capacity of DPPH·, ABTS+· and ·OH. Comprehensive analysis indicated that postharvest MT treatment could effectively enhance the antioxidant capacity and maintain the better quality of spaghetti squash during storage.
-
Keywords:
- exogenous melatonin /
- spaghetti squash /
- storage /
- quality /
- antioxidant capacity
-
金丝绞瓜(Cucurbita pepo L. var. Medullosa Alef.),又名金瓜、金丝瓜,是葫芦科南瓜属美洲南瓜的变种,原产于墨西哥或中北美洲地区[1−2]。其营养丰富,含瓜氨酸、精氨酸和天冬氨酸等多种氨基酸[3]。金丝绞瓜采后生理代谢较为旺盛,易失水导致其品质退化,且贮藏过程中白霉病、灰霉病和黑腐病频发,果实腐烂率严重时达70%~100%,严重制约其产业的发展[4−5]。目前,关于金丝绞瓜鲜食与加工[6−7]、栽培技术[8−11]和品种选育[4]的研究较多,对其贮藏保鲜的研究较少。因此,迫切需要开发延长金丝绞瓜采后贮藏寿命的新型保鲜方法。
褪黑素(melatonin,MT)是一种小分子的吲哚化合物,于1958年被首次报道,因其能使某些鱼类、爬行动物和两栖动物的皮肤变亮而得名[12]。褪黑素广泛存在于植物界,除了调节植物生长发育外,也是一种强有力的自由基清除剂,参与调节植物内部和环境氧化应激[13−15]。研究证实,外源褪黑素处理可降低采后桃果实的失重率、腐烂发生率和呼吸速率,并通过提高过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等抗氧化酶活性以加速活性氧(reactive oxygen species,ROS)的清除[16];诱导采后草莓果实总酚积累,提升果实清除自由基的能力,减轻果实腐烂并保持其品质[17−18];通过提高SOD和CAT活性来维持细胞ROS稳态,抑制木薯的采后生理退化[19]。但目前未有关于褪黑素处理影响金丝绞瓜采后贮藏品质的研究报道。
本实验室前期研究发现,金丝绞瓜采后贮藏的最适温度和相对湿度分别为(9±1) ℃和65%~70%。此外,以0.1、0.2和0.3 mmol/L MT溶液处理金丝绞瓜,发现0.2 mmol/L MT溶液处理对果实腐烂的抑制效果最好。因此,本研究旨在探索0.2 mmol/L MT溶液处理对金丝绞瓜在最适贮藏条件下果实品质和抗氧化能力的影响,以期为改善金丝绞瓜贮藏品质退化问题提供新思路。
1. 材料与方法
1.1 材料与仪器
“拍砸二号”金丝绞瓜(Cucurbita pepo L. var. medullosa Alef.) 采于中国安徽省泗县草沟镇秦桥村金丝绞瓜种植基地;褪黑素(纯度≥98%) 上海源叶生物科技有限公司;其他试剂 均为分析纯。
Telaire7001红外线CO2分析仪 美国Telaire公司;Ci7600色差仪 美国X-Rite公司;TAXT PLUS/50物性测定仪 英国SMS公司;紫外可见分光光度计 上海仪电分析器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.2 实验方法
1.2.1 材料处理及贮藏
金丝绞瓜采摘后以塑料筐分装(每筐6个果实),并运输至陕西省咸阳市杨凌区西北农林科技大学实验室。选择外观均一且无缺陷的金丝绞瓜用于试验,随机分为2组,每组270个。使用气压式喷壶将金丝绞瓜以0.2 mmol/L MT溶液喷施10 min,每5 min将果实翻面以确保其各个面喷施均匀,后置于通风处晾干,作为处理组(图1)。对照组不做任何处理。每个处理重复三次,每组重复90个果实。将晾干后的果实用塑料筐分装(每筐6个果实),后置于(9±1) ℃、相对湿度65%~70%的冷库中进行贮藏,贮藏期间每隔20 d测定相关指标。
1.2.2 指标测定
1.2.2.1 腐烂率、失重率和呼吸强度的测定
腐烂、可见真菌生长和细菌病变被认定为腐烂症状,腐烂率(%)=腐烂症状果实数/总果实数×100。失重率采用称量法进行测定,失重率(%)=(初重−末重)/初重×100。采用红外线CO2分析仪测定呼吸强度,随机选取9个果实放入3个密闭容器(每个容器3个果实),静置2 h,结果以mg CO2/(kg·h)表示。
1.2.2.2 颜色、可溶性固形物(TSS)和可滴定酸(TA)
使用色差仪分析果实颜色。测定果实赤道部位3个点的果肉颜色,每个点重复测定三次,取平均值。可溶性固形物含量使用便携式数显糖度计测定,以%表示。可滴定酸含量以酸碱滴定法测定,以%表示。
1.2.2.3 硬度和脆度
通过物性测定仪测定果实硬度和脆度。每个处理随机选取6个金丝绞瓜,使用5 mm圆柱形探针测定果肉硬度,穿透深度为10 mm,探针速度为1.0 mm/s,以g表示。瓜丝脆度使用A/CKB轻刀片探头测定,以g表示。
1.2.2.4 抗坏血酸和总酚含量
抗坏血酸(ascorbic acid,AsA)含量测定参考Bessey等[20]的方法,以mg/(100 g)表示。总酚含量测定参考Toor等[21]的方法,以mg/g表示。
1.2.2.5 超氧阴离子产生速率、过氧化氢含量和丙二醛含量
超氧阴离子自由基(superoxide anion,O2−·)产生速率的测定参考Yang等[22]的方法,以nmol/(g·min)表示。过氧化氢(hydrogen peroxide,H2O2)含量测定参考范冬梅等[23]的方法,以μmol/g表示。丙二醛(malondialdehyde,MDA)含量测定参考Liu等[18]的方法,以nmol/g表示。
1.2.2.6 自由基清除率测定
·OH、DPPH·和ABTS+·清除能力分别参考Wang等[24]、Nakajima等[25]和Re等[26]的方法测定,并分别按式(1)~式(3)计算:
⋅OH清除率(%)=(1−A1−A2A0)×100 (1) DPPH⋅清除率(%)=(1−A1−A2A0)×100 (2) ABTS+⋅清除率(%)=(1−A1A0)×100 (3) 式(1)中:A1为上清液与各试剂混合后的吸光度;A2为蒸馏水代替水杨酸乙醇溶液的吸光度;A0为蒸馏水代替上清液的吸光度;式(2)中:A1为上清液与DPPH混合后的吸光度;A2为上清液与乙醇混合后的吸光度;A0为乙醇和DPPH混合后的吸光度;式(3)中:A1为上清液与ABTS工作液混合后的吸光度;A0为蒸馏水与ABTS工作液混合后的吸光度。
1.2.2.7 抗氧化酶活性
超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性均参照曹建康等[27]的方法测定。
1.3 数据处理
使用Excel进行数据整理,使用Minitab18.0进行Student t检验和方差分析(ANOVA),使用Origin8.0作图。所有指标重复测定3次。P<0.05代表差异显著,P<0.01代表差异极显著。
2. 结果与分析
2.1 褪黑素处理对金丝绞瓜贮藏期间果实外观、腐烂率、失重率和呼吸强度的影响
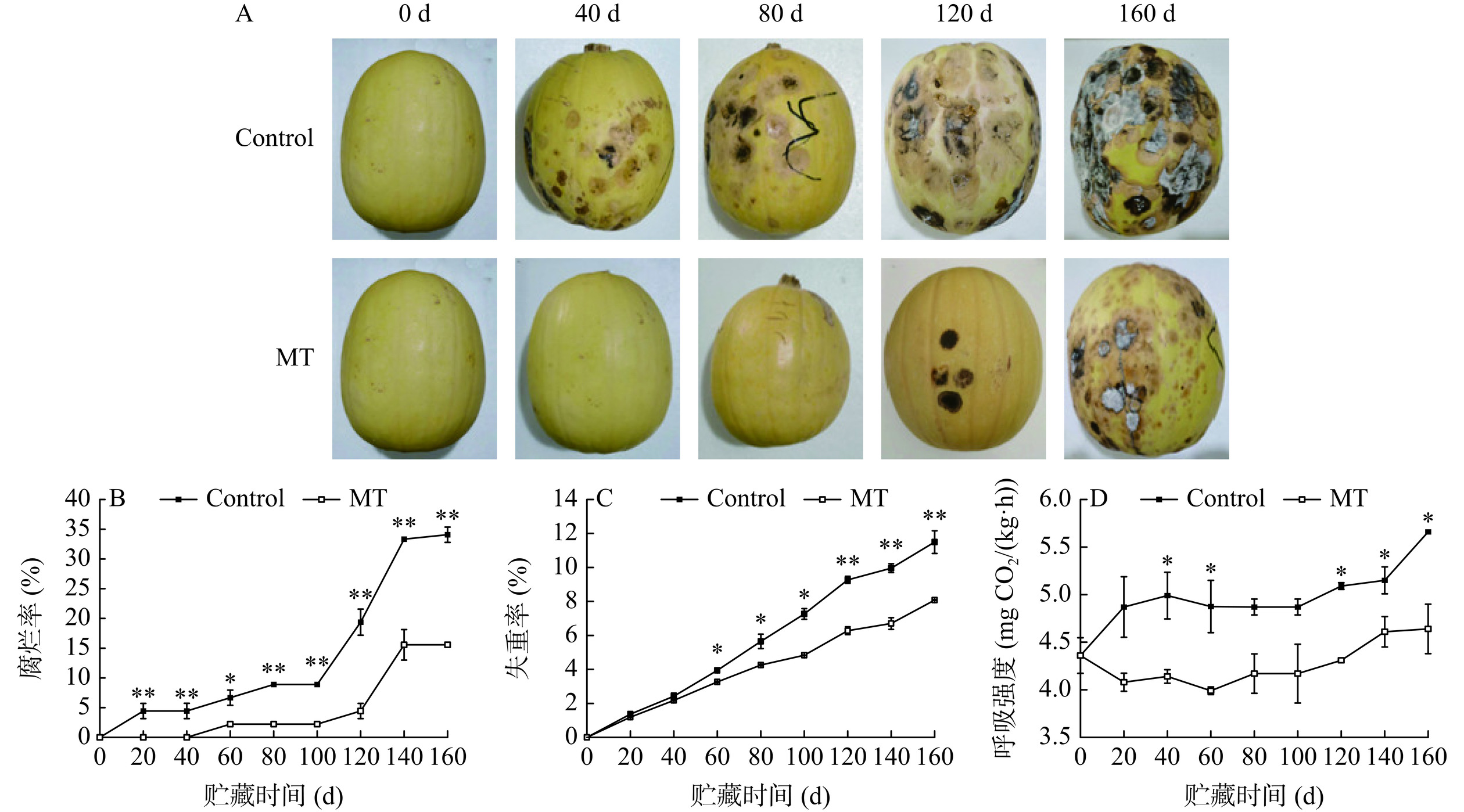
在采后贮藏期间,金丝绞瓜由于呼吸、蒸腾和病原菌侵染等原因逐渐衰老,导致果实色泽、质地和口感等退化,甚至出现腐烂,影响销售和食用。如图2A所示,随着贮藏时间的延长,果实腐烂情况加重,表现为果实表面出现褐色斑点和凹陷,并伴随肉眼可见的黑霉和白霉等霉菌生长。这可能是由于果实腐烂部位的细胞对病原菌侵染的抵抗能力降低,导致霉菌大量生长进而加速果实腐烂。MT处理延缓了果实腐烂,并有效改善了病原菌侵染症状。如图2B所示,对照组和MT处理组金丝绞瓜分别于贮藏的第20 d和第60 d首次出现腐烂,MT处理将果实腐烂的发生延后40 d。两组果实腐烂率在贮藏过程中逐渐增加,贮藏第100~160 d,对照组果实腐烂率迅速上升,MT处理组腐烂率显著较低(P<0.01);贮藏结束时,对照组和MT处理组果实腐烂率分别为34.07%和15.56%。表明MT处理较好地抑制了贮藏期间金丝绞瓜腐烂的发生。
失水是导致金丝绞瓜采后品质下降的重要原因之一。如图2C所示,金丝绞瓜的失重率随贮藏的进行而增加。贮藏第60~160 d,对照组果实的失重率显著高于MT处理组(P<0.05);贮藏结束时,MT处理组失重率较对照组降低了29.68%。表明MT处理可有效降低贮藏期间金丝绞瓜水分的流失。
整个贮藏期间,对照组金丝绞瓜的呼吸强度均高于MT处理组(图2D)。贮藏后期,对照组金丝绞瓜细胞衰老加速,果实呼吸强度迅速增加,MT处理对果实呼吸强度有显著抑制作用,贮藏160 d后,MT处理组呼吸强度较对照组降低18.02%。表明MT处理有效抑制了贮藏期间金丝绞瓜的呼吸速率,从而延缓果实衰老。
2.2 褪黑素处理对金丝绞瓜贮藏期间颜色、TSS含量和TA含量的影响
颜色是影响消费者对金丝绞瓜感官印象的重要因素之一。本研究通过测定L*、C*和h°评价金丝绞瓜颜色。L*代表亮度,其值越大表明果实颜色越明亮;C*代表饱和度,其值越高,表明果实颜色越纯;h°代表色相角,其值越接近90°,说明果实颜色越黄。如表1所示,MT处理对贮藏过程中金丝绞瓜的L*无显著影响(P>0.05)。贮藏第100~120 d,MT处理组果实的C*显著高于对照组(P<0.05)。与L*相似,两组果实h°在贮藏期间呈先增加后降低的趋势,MT处理可抑制这两个颜色参数的降低。整个贮藏期间(第40 d和第100 d除外),MT处理组果实的h°显著高于对照组(P<0.05)。金丝绞瓜色泽金黄,较高的h°和C*表示果实偏黄且色泽纯净,品质较好。综上,MT处理可有效抑制贮藏过程中金丝绞瓜颜色的退化,保持更好的果实品质。
表 1 褪黑素处理对金丝绞瓜贮藏期间L*、C*、h°、TSS含量和TA含量的影响Table 1. Effects of melatonin treatment on L*, C*, h°, TSS content and TA content of spaghetti squash during storage贮藏时间(d) 处理 L* C* h° TSS(%) TA(%) 0 Control 70.14±0.90cd 38.27±0.64fgh 77.69±0.29defgh 4.22±0.04fg 0.13±0.01def 20 Control 73.45±0.49abc 34.69±1.03h 79.63±0.42bc 4.02±0.07h 0.13±0.01cde MT 74.15±0.42ab 37.21±2.29gh 81.55±0.42a 4.14±0.05gh 0.18±0.01a 40 Control 72.72±0.57abc 40.71±0.39efg 80.42±0.09abc 3.73±0.10i 0.10±0.01gh MT 75.57±1.81a 41.40±2.55ef 81.73±0.47a 4.20±0.01fg 0.14±0.01bcd 60 Control 68.79±0.11de 41.76±0.91ef 78.68±0.85cdefg 4.63±0.14e 0.14±0.01bcd MT 70.54±1.81bcd 43.39±1.42cde 80.58±0.57ab 4.18±0.04fgh 0.10±0.01gh 80 Control 66.85±0.93efg 46.48±0.81abcd 77.34±0.79 efgh 5.70±0.07b 0.11±0.01efgh MT 68.39±0.02def 49.03±0.76a 79.30±0.77bcd 4.32±0.05f 0.11±0.01fgh 100 Control 64.81±1.86fg 41.18±1.09 ef 76.12±0.14h 4.52±0.04e 0.15±0.01bc MT 66.62±1.50efg 47.23±0.92ab 77.16±0.45efgh 4.32±0.05f 0.15±0.01 bc 120 Control 64.48±1.43g 38.27±0.64fgh 76.51±0.35h 3.58±0.04i 0.10±0.01gh MT 66.14±2.80efg 41.96±1.72e 78.78±0.82bcdef 4.10±0.01gh 0.09±0.01h 140 Control 63.38±1.12g 41.12±1.05ef 76.89±0.83gh 5.20±0.06c 0.16±0.01b MT 65.13±0.66g 42.91±0.67de 78.78±0.73bcde 3.42±0.05j 0.09±0.01 h 160 Control 62.42±1.94g 43.59±0.44bcde 76.97±0.20fgh 6.18±0.07a 0.16±0.01ab MT 64.88±0.91efg 46.79±0.74abc 79.02±1.17bcde 4.82±0.05d 0.12±0.01defg 注:同列数据后不同小写字母表示处理间存在显著差异(P<0.05)。 如表1所示,与对照组相比,贮藏第80 d和贮藏第140~160 d,MT处理组TSS含量显著较低(P<0.05)。果实成熟过程通常伴随TSS含量的上升,贮藏后期金丝绞瓜衰老加速,TA含量增加,导致瓜丝变黏变酸[5]。MT处理显著抑制贮藏后期果实TA的积累(P<0.05),贮藏结束时,MT处理组果实TA含量比对照组低25.00%。这表明MT处理通过抑制金丝绞瓜TSS和TA的积累,延缓果实成熟和品质退化,从而更好地保持原有风味。
2.3 褪黑素处理对金丝绞瓜贮藏期间硬度和脆度的影响
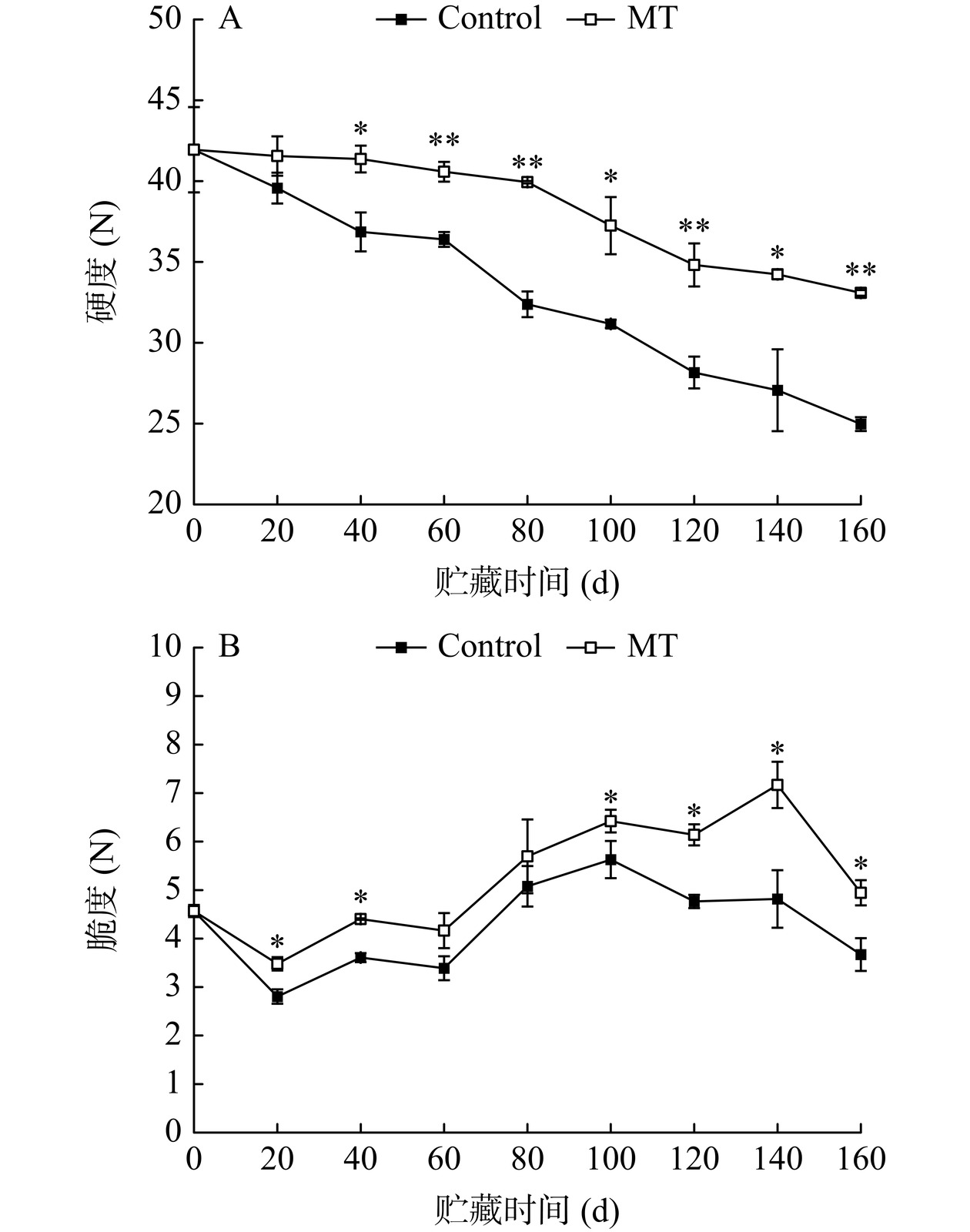
硬度和瓜丝脆度是反映金丝绞瓜质地和品质的重要指标之一,品质好的金丝绞瓜更适合加工。如图3A,随着贮藏的进行,对照组和MT处理组金丝绞瓜硬度逐渐降低。与对照组相比,贮藏第40~160 d,MT处理显著抑制果实硬度的降低(P<0.05);贮藏结束时,MT处理组果实硬度较对照组提升32.48%。如图3B,贮藏期间,对照组和MT处理组瓜丝脆度先增加后降低。与对照组相比,贮藏第100~160 d,MT处理显著抑制了瓜丝脆度的下降(P<0.05);贮藏结束时,MT处理组瓜丝脆度为对照组的1.35倍。表明MT处理可较好地保持贮藏期间金丝绞瓜的硬度和瓜丝脆度,有效延缓果实软化。
2.4 褪黑素处理对金丝绞瓜贮藏期间抗坏血酸和总酚含量的影响
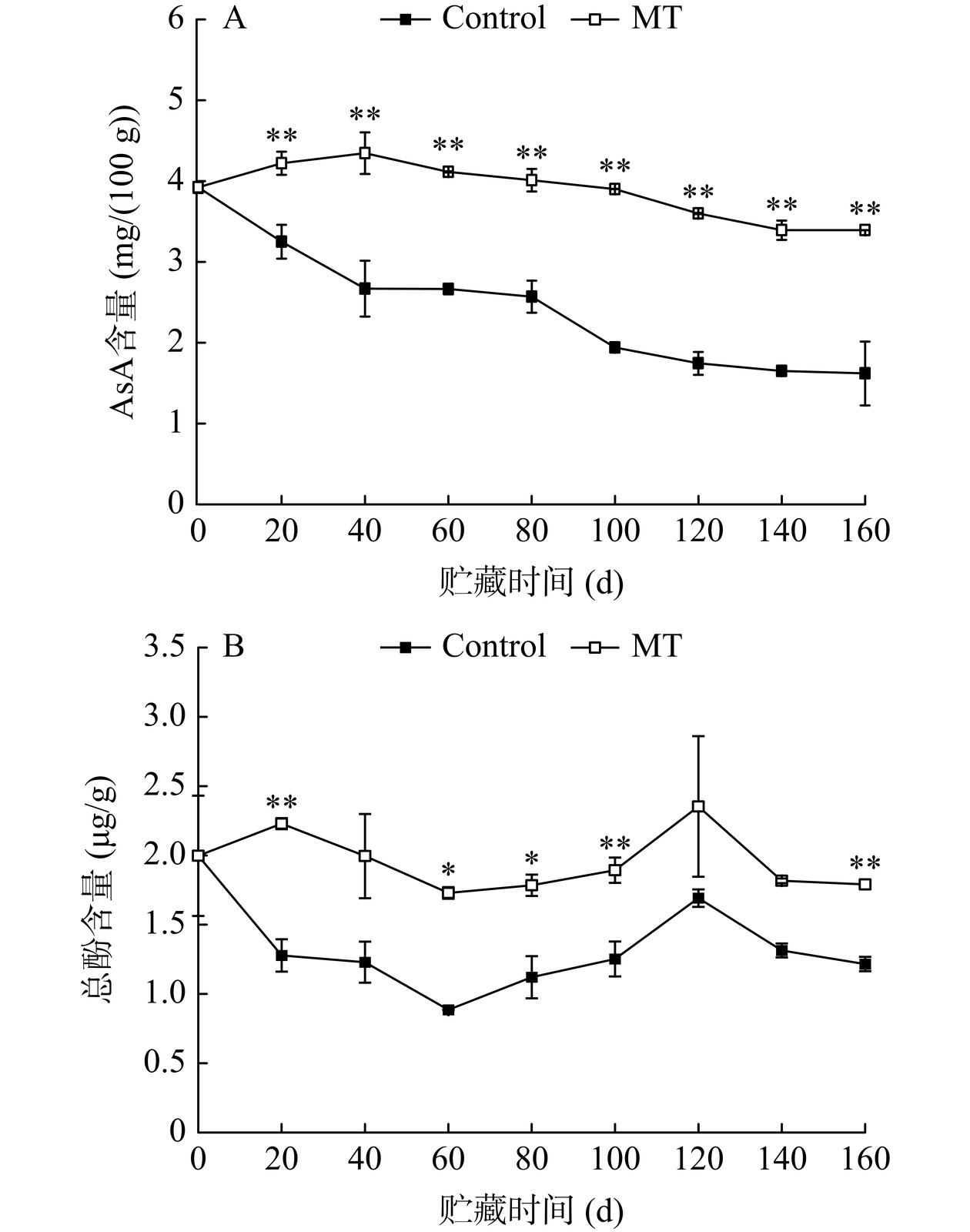
AsA和酚类物质在对抗某些应激条件的反应中起着核心作用,可直接作为ROS清除剂来对抗氧化应激,有助于维持细胞中的氧化还原稳态[28−30]。如图4A,整个贮藏期间,MT处理组果实AsA含量均较高,且与对照组存在极显著差异(P<0.01)。贮藏结束时,MT处理组果实AsA含量为对照组的2.09倍,对照组和MT处理组AsA含量较贮藏初期分别降低了58.68%和13.47%。表明MT处理可有效抑制金丝绞瓜中AsA含量的下降,提升果实抗氧化能力,从而减少果实细胞受到的氧化应激损伤。Gao等[16]指出MT处理通过保持桃果实AsA含量来延缓衰老,与本研究结果相似。此外,整个贮藏期间,MT处理组果实的总酚含量均高于对照组(图4B)。贮藏第20、100和160 d,处理组与对照组果实之间总酚含量差异极显著(P<0.01);贮藏结束时,MT处理组总酚含量较对照组提升了47.20%。表明MT处理对维持贮藏期间金丝绞瓜的总酚含量有积极效果。Zheng等[30]研究发现,MT处理可显著抑制冷藏期间桃果实总酚含量的降低,维持细胞较高的抗氧化能力,延缓果实衰老,与本研究结果一致。
2.5 褪黑素处理对金丝绞瓜贮藏期间O2−·产生速率、H2O2含量和MDA含量的影响
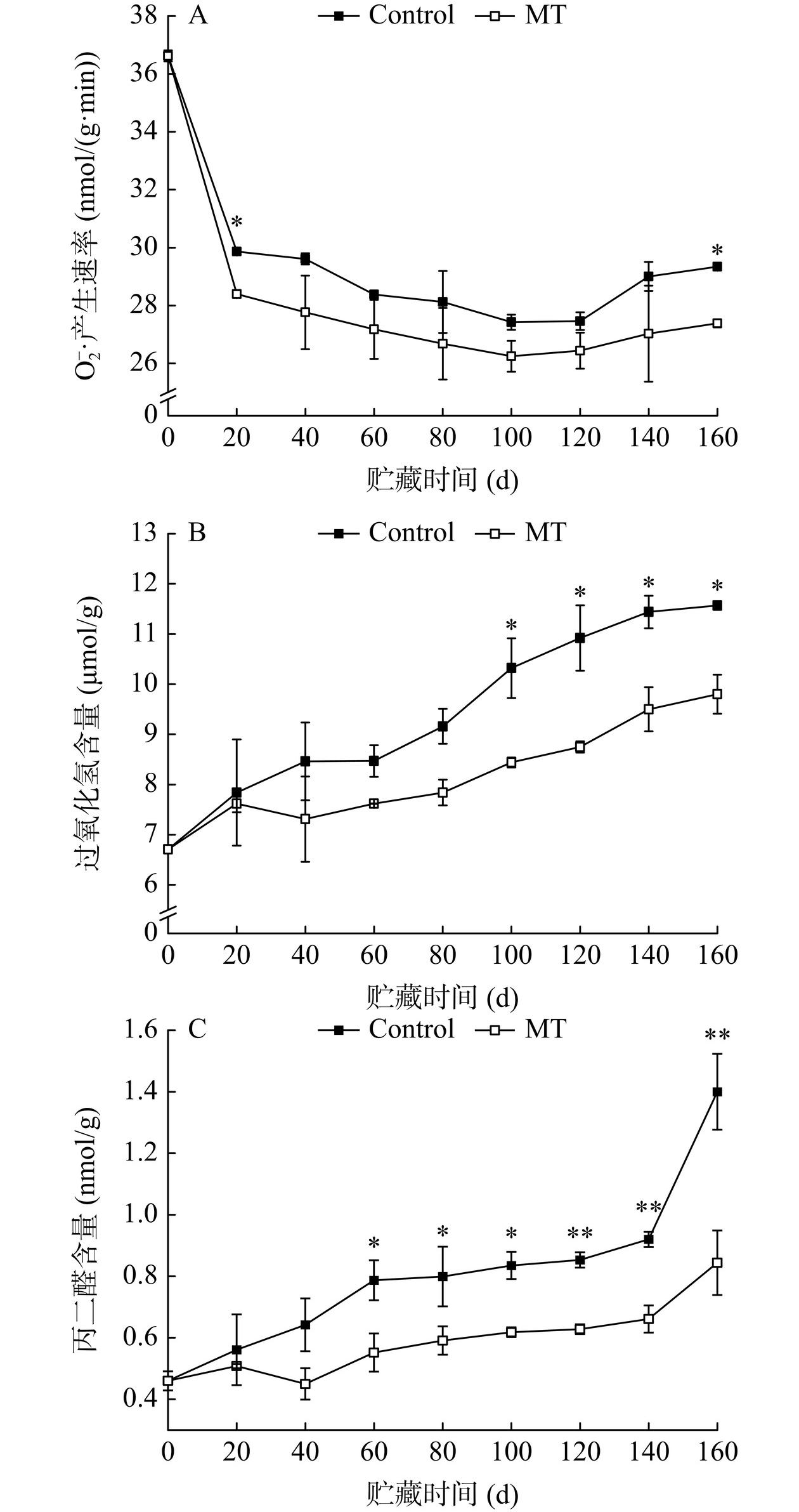
众所周知,ROS(如H2O2和O2−·等)通过膜脂质过氧化作用引起膜损伤。如图5A,贮藏第0~20 d,对照组和MT处理组金丝绞瓜的O2−·产生速率均急剧下降,可能是细胞在低温下维持较低水平的生命活动。贮藏结束时,MT处理组果实的O2−·产生速率较对照组降低6.65%。如图5B,对照组和MT处理组金丝绞瓜的H2O2含量随贮藏的进行而增加,且与对照组相比,MT处理组果实H2O2含量始终较低。贮藏结束时,MT处理组果实H2O2含量较对照组降低15.30%。MDA作为膜脂质过氧化的终产物,其含量可直接作为膜损伤严重程度的衡量指标[31−32]。如图5C,贮藏第60~160 d,与对照组相比,MT处理显著抑制了果实MDA含量的增加(P<0.05);贮藏结束时,MT处理组果实MDA含量较对照组减少了39.71%。MT处理抑制了O2−·的产生,降低了H2O2和MDA的积累,说明MT处理可提高冷藏期间金丝绞瓜抵抗氧化应激的能力,调节活性氧代谢,减少细胞膜的氧化损伤,从而延缓果实衰老。
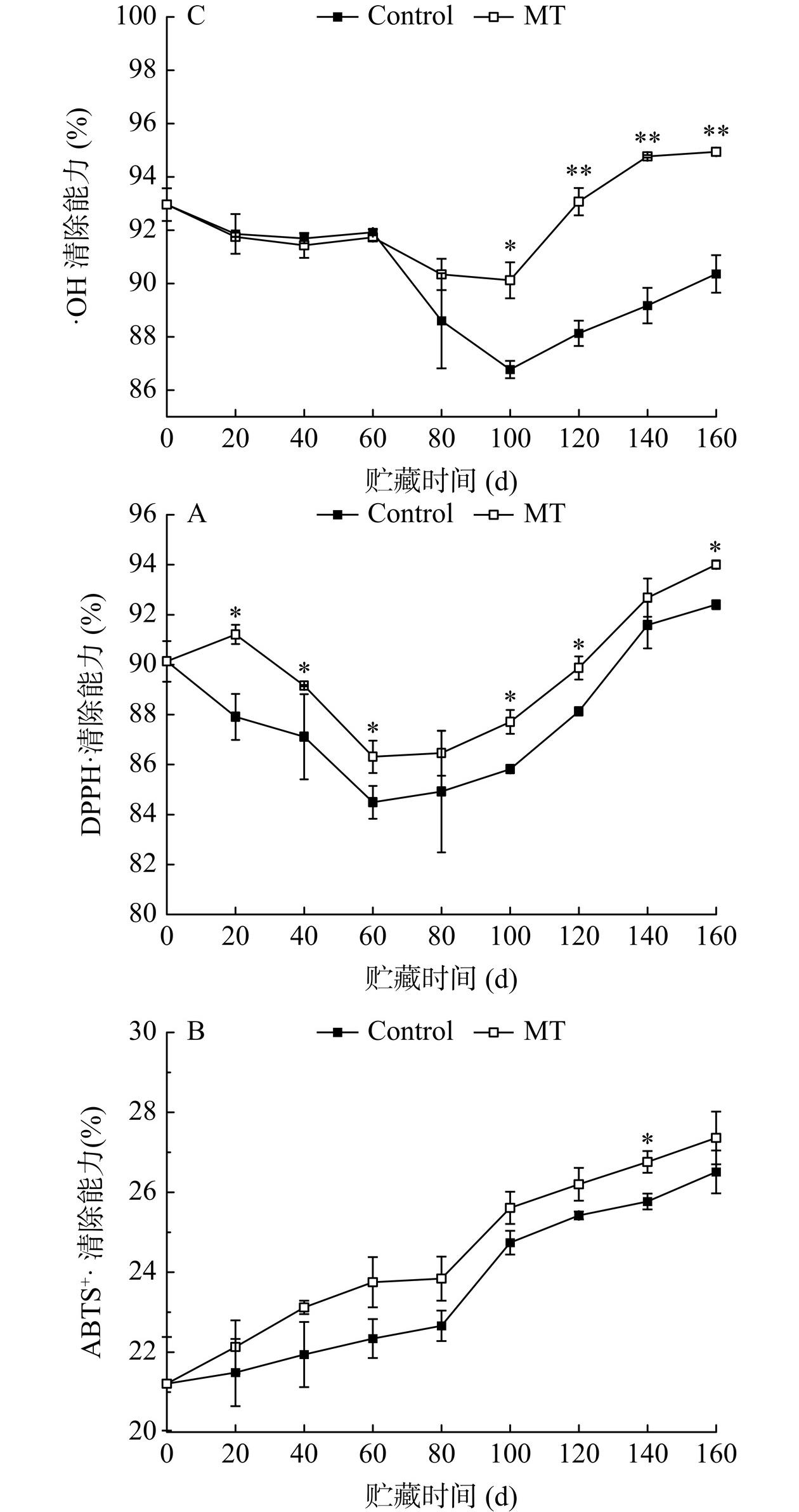
2.6 褪黑素处理对金丝绞瓜贮藏期间自由基清除能力的影响
果实细胞较强的自由基清除能力代表更好的抗氧化能力[33],本研究通过测定DPPH·、ABTS+·和·OH清除能力来评价金丝绞瓜的抗氧化能力。如图6A,整个贮藏期间,MT处理组金丝绞瓜DPPH·清除能力始终高于对照组;贮藏第0~60 d、第100、120和160 d,二者间差异显著(P<0.05)。如图6B,整个贮藏期间,MT处理组金丝绞瓜ABTS+·清除能力均高于对照组;贮藏第140 d,二者间差异显著(P<0.05)。如图6C,对照组和MT处理组金丝绞瓜·OH清除能力整体均呈先降低后增加的趋势。贮藏第120~160 d,MT处理显著提高果实的·OH清除能力(P<0.01);贮藏结束时,MT处理组果实的·OH清除能力较对照组提升5.07%。表明MT处理有效提高了贮藏期间金丝绞瓜的自由基清除能力,增强细胞抗氧化活性,从而延缓衰老。这可能与MT处理上调了金丝绞瓜的总酚水平有关,Puerta-Gomez等[34]指出采后贮藏期间果实抗氧化能力与总酚含量密切相关。
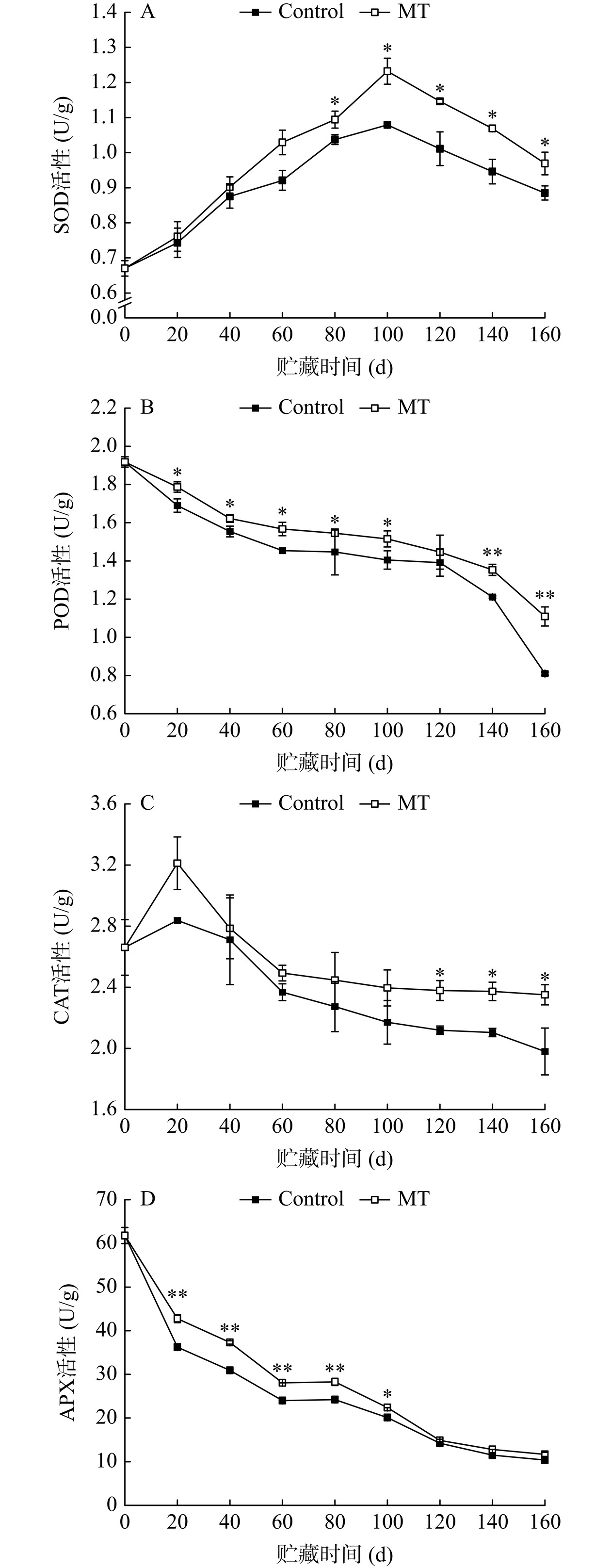
2.7 褪黑素处理对金丝绞瓜贮藏期间抗氧化酶活性的影响
众所周知,CAT、SOD、POD和APX是植物活性氧清除系统中至关重要的抗氧化酶。其中,SOD可将O2−·歧化为H2O2,而CAT,POD和APX将有害的H2O2分解为对细胞无毒害作用的H2O[35]。对照组和MT处理组金丝绞瓜的SOD活性在贮藏期间先增加后降低(图7A)。对照组和MT处理组果实SOD活性均于贮藏第100 d到达峰值,此时MT处理组SOD活性较对照组提升14.18%;贮藏第100~160 d,两组果实SOD活性均开始下降,MT处理显著抑制SOD活性的降低(P<0.05)。如图7B,对照组和MT处理组金丝绞瓜的POD活性随贮藏的进行而降低,且对照组果实POD活性始终低于MT处理组。贮藏第140、160 d,果实POD活性骤降,与对照相比,MT处理极显著抑制其降低(P<0.01);贮藏结束时,MT处理组POD活性为对照组的1.37倍。此外,对照组和MT处理组金丝绞瓜的CAT活性在贮藏期间先增加后降低,且MT处理组果实始终保持较高的CAT活性(图7C)。贮藏第120~160 d,二者间差异显著(P<0.05);贮藏结束时MT处理组CAT活性较对照组提升18.74%。如图7D,对照组和MT处理组金丝绞瓜贮藏期间APX活性均呈降低趋势,且MT处理组果实的APX活性始终高于对照组;贮藏第0~80 d,二者间差异极显著(P<0.01);贮藏第40 d,对照组和MT处理组果实的APX活性较贮藏第0 d分别降低了50.80%和39.61%。综合表明,MT处理对金丝绞瓜CAT、SOD、POD和APX具有激发作用,这增强了冷藏期间果实清除ROS(包括O2−·和H2O2)的能力,从而减少了衰老引起的氧化应激对细胞的损害,这与MT处理组较低的O2−·产生速率、H2O2含量和MDA含量相对应。Jannatizadeh等[36]研究发现,外源MT处理可上调石榴果实中CAT、SOD和APX的活性,抑制MDA积累,从而保持较高的膜完整性,与本研究结果一致。Mirshekari等[37]指出,MT处理可提高贮藏期间人心果果实中SOD和CAT等抗氧化酶的活性,延长果实贮藏寿命并保持其品质。
3. 结论
采后喷施0.2 mmol/L MT可有效降低冷藏期间金丝绞瓜的腐烂率、失重率和呼吸强度,维持较好的色泽、硬度和瓜丝脆度。MT处理显著提高金丝绞瓜中AsA和总酚的水平,增强DPPH·、ABTS+·和·OH清除能力,提升机体抗氧化能力。此外,MT处理上调了SOD、POD、CAT和APX等关键抗氧化酶活性,降低O2−·产生速率,抑制H2O2和MDA的积累,减少果实细胞受到的氧化损伤。可见,MT处理可能通过提升金丝绞瓜的抗氧化能力来保持果实贮藏品质。本研究为MT处理在金丝绞瓜及其他园艺产品采后贮藏保鲜方面的应用提供理论依据。
-
表 1 褪黑素处理对金丝绞瓜贮藏期间L*、C*、h°、TSS含量和TA含量的影响
Table 1 Effects of melatonin treatment on L*, C*, h°, TSS content and TA content of spaghetti squash during storage
贮藏时间(d) 处理 L* C* h° TSS(%) TA(%) 0 Control 70.14±0.90cd 38.27±0.64fgh 77.69±0.29defgh 4.22±0.04fg 0.13±0.01def 20 Control 73.45±0.49abc 34.69±1.03h 79.63±0.42bc 4.02±0.07h 0.13±0.01cde MT 74.15±0.42ab 37.21±2.29gh 81.55±0.42a 4.14±0.05gh 0.18±0.01a 40 Control 72.72±0.57abc 40.71±0.39efg 80.42±0.09abc 3.73±0.10i 0.10±0.01gh MT 75.57±1.81a 41.40±2.55ef 81.73±0.47a 4.20±0.01fg 0.14±0.01bcd 60 Control 68.79±0.11de 41.76±0.91ef 78.68±0.85cdefg 4.63±0.14e 0.14±0.01bcd MT 70.54±1.81bcd 43.39±1.42cde 80.58±0.57ab 4.18±0.04fgh 0.10±0.01gh 80 Control 66.85±0.93efg 46.48±0.81abcd 77.34±0.79 efgh 5.70±0.07b 0.11±0.01efgh MT 68.39±0.02def 49.03±0.76a 79.30±0.77bcd 4.32±0.05f 0.11±0.01fgh 100 Control 64.81±1.86fg 41.18±1.09 ef 76.12±0.14h 4.52±0.04e 0.15±0.01bc MT 66.62±1.50efg 47.23±0.92ab 77.16±0.45efgh 4.32±0.05f 0.15±0.01 bc 120 Control 64.48±1.43g 38.27±0.64fgh 76.51±0.35h 3.58±0.04i 0.10±0.01gh MT 66.14±2.80efg 41.96±1.72e 78.78±0.82bcdef 4.10±0.01gh 0.09±0.01h 140 Control 63.38±1.12g 41.12±1.05ef 76.89±0.83gh 5.20±0.06c 0.16±0.01b MT 65.13±0.66g 42.91±0.67de 78.78±0.73bcde 3.42±0.05j 0.09±0.01 h 160 Control 62.42±1.94g 43.59±0.44bcde 76.97±0.20fgh 6.18±0.07a 0.16±0.01ab MT 64.88±0.91efg 46.79±0.74abc 79.02±1.17bcde 4.82±0.05d 0.12±0.01defg 注:同列数据后不同小写字母表示处理间存在显著差异(P<0.05)。 -
[1] 潘静, 颜曰红. 金丝瓜特征特性及栽培技术[J]. 现代农业科技,2009(21):96−99. [PAN J, YAN Y H. Characteristics and cultivation techniques of spaghetti squash[J]. Modern Agricultural Science and Technology,2009(21):96−99.] PAN J, YAN Y H. Characteristics and cultivation techniques of spaghetti squash[J]. Modern Agricultural Science and Technology, 2009(21): 96−99.
[2] 叶年玉, 王世忠, 朱忠南. 金瓜的贮藏与加工技术[J]. 中国瓜菜,2005(5):45−46. [YE N Y, WANG S Z, ZHU Z N. Storage and processing technology of spaghetti squash[J]. China Cucurbits and Vegetables,2005(5):45−46.] doi: 10.3969/j.issn.1673-2871.2005.05.020 YE N Y, WANG S Z, ZHU Z N. Storage and processing technology of spaghetti squash[J]. China Cucurbits and Vegetables, 2005(5): 45−46. doi: 10.3969/j.issn.1673-2871.2005.05.020
[3] 朱忠南. 金瓜栽培与加工[M]. 上海:上海科学技术出版社, 2009:1−17. [ZHU Z N. Cultivation and processing of spaghetti squash[M]. Shanghai:Shanghai Science and Technology Press, 2009:1−17.] ZHU Z N. Cultivation and processing of spaghetti squash[M]. Shanghai: Shanghai Science and Technology Press, 2009: 1−17.
[4] 朱爱萍, 李虹, 朱忠南, 等. 耐贮金瓜种质资源的鉴定与筛选初报[J]. 农产品加工,2019(18):51−53. [ZHU A P, LI H, ZHU Z N, et al. Preliminary report on identification and screening of storable golden melon germplasm resources[J]. Farm Products Processing,2019(18):51−53.] ZHU A P, LI H, ZHU Z N, et al. Preliminary report on identification and screening of storable golden melon germplasm resources[J]. Farm Products Processing, 2019(18): 51−53.
[5] 李阳, 沙飞, 高月霞, 等. 高能电子束辐照对金丝绞瓜的保鲜效果[J]. 现代食品科技,2021,37(2):171−182. [LI Y, SHA F, GAO Y X, et al. Effects of high energy electron beam lrradiation on the preservation of spaghetti squash[J]. Modern Food Science and Technology,2021,37(2):171−182.] LI Y, SHA F, GAO Y X, et al. Effects of high energy electron beam lrradiation on the preservation of spaghetti squash[J]. Modern Food Science and Technology, 2021, 37(2): 171−182.
[6] STEPIEN B. Methods and apparatuses for preparing spaghetti squash:US15/265416[P]. 2016:09-14.
[7] 崇明金瓜吃法小妙招[J]. 长江蔬菜, 2021(1):15. [Chongming golden melon eating tips[J]. Journal of Changjiang Vegetables, 2021(1):15.] Chongming golden melon eating tips[J]. Journal of Changjiang Vegetables, 2021(1): 15.
[8] 郭成君. 泗县金丝绞瓜的特征特性及高产栽培技术[J]. 安徽农学通报,2020,26(1):48−49. [GUO C J. Characteristics and high-yield cultivation technology of Si County spaghetti squash[J]. Anhui Agricultural Science Bulletin,2020,26(1):48−49.] GUO C J. Characteristics and high-yield cultivation technology of Si County spaghetti squash[J]. Anhui Agricultural Science Bulletin, 2020, 26(1): 48−49.
[9] 张春静, 张兴洪, 钱春桃. 美国金瓜春季爬地高效栽培技术[J]. 现代农业科技,2020(3):76−82. [ZHANG C J, ZHANG X H, QIAN C T. Efficient cultivation technology of American gourd in spring climbing[J]. Modern Agricultural Science and Technology,2020(3):76−82.] ZHANG C J, ZHANG X H, QIAN C T. Efficient cultivation technology of American gourd in spring climbing[J]. Modern Agricultural Science and Technology, 2020(3): 76−82.
[10] WADAS W, KALINOWSKI K. The effect of selected agricultural factors on the yielding of spaghetti squash (Cucurbita pepo L.)[J]. Acta scientiarum Polonorum Hortorum Cultus,2010,9(2):93−101.
[11] 李阳, 马晶, 高月霞, 等. 泗县金丝绞瓜高效栽培和贮藏技术[J]. 北方园艺,2020(19):169−173. [LI Y, MA J, GAO Y X, et al. High-efficiency cultivation and storage technology of spaghetti squash in sixian county[J]. Northern Horticulture,2020(19):169−173.] LI Y, MA J, GAO Y X, et al. High-efficiency cultivation and storage technology of spaghetti squash in sixian county[J]. Northern Horticulture, 2020(19): 169−173.
[12] LERNER A B, CASE J D, TAKAHASHI Y, et al. Isolation of melatonin, the pineal gland factor that lightens melanocytes1[J]. Journal of the American Chemical Society,2002,80(10):2587.
[13] ZHANG N, SUN Q Q, ZHANG H J, et al. Roles of melatonin in abiotic stress resistance in plants[J]. Journal of Experimental Botany,2015,66(3):647−656.
[14] ARNAO M B, HERNÁNDEZ-RUIZ J. Functions of melatonin in plants:A review[J]. Journal of Pineal Research,2015,59(2):133−150.
[15] TAN D X, CHEN L D, POEGGELER B, et al. Melatonin:a potent, endogenous hydroxyl radical scavenger[J]. Endocrine Journal, 1993:57−60.
[16] GAO H, ZHANG Z K, CHAI H K, et al. Melatonin treatment delays postharvest senescence and regulates reactive oxygen species metabolism in peach fruit[J]. Postharvest Biology and Technology, 2016:103−110.
[17] AGHDAM M S, FARD J R. Melatonin treatment attenuates postharvest decay and maintains nutritional quality of strawberry fruits (Fragaria×anannasa cv. Selva) by enhancing GABA shunt activity[J]. Food Chemistry,2017,221:1650−1657. doi: 10.1016/j.foodchem.2016.10.123
[18] LIU C H, ZHENG H H, SHENG K L, et al. Effects of melatonin treatment on the postharvest quality of strawberry fruit[J]. Postharvest Biology and Technology,2018,139:47−55. doi: 10.1016/j.postharvbio.2018.01.016
[19] MA Q X, ZHANG T, ZHANG P, et al. Melatonin attenuates postharvest physiological deterioration of cassava storage roots[J]. Journal of Pineal Research,2016,60(4):424−434. doi: 10.1111/jpi.12325
[20] BESSEY O A, KING C G. The distribution of vitamin C in plant and animal tissues, and its determination[J]. Journal of Biological Chemistry,1993,103:687−698.
[21] TOOR R K, SAVAGE G P. Antioxidant activity in different fractions of tomatoes[J]. Food Research International,2004,38(5):487−494.
[22] YANG Q Z, WANG F, RAO J P. Effect of putrescine treatment on chilling injury, fatty acid composition and antioxidant system in kiwifruit[J]. PLoS One,2016,11(9):e0162159. doi: 10.1371/journal.pone.0162159
[23] 范冬梅, 王莉. 分光光度法测定牛百叶中过氧化氢的含量[J]. 山西大学学报(自然科学版),2008(1):89−91. [FAN D M, WANG L. Absorptiophotometric determination of hydrogen peroxide in omasum[J]. Journal of Shanxi University (Natural Science Edition),2008(1):89−91.] FAN D M, WANG L. Absorptiophotometric determination of hydrogen peroxide in omasum[J]. Journal of Shanxi University (Natural Science Edition), 2008(1): 89−91.
[24] WANG K T, JIN P, CAO S F, et al. Methyl jasmonate reduces decay and enhances antioxidant capacity in Chinese bayberries[J]. Journal of Agricultural and Food Chemistry,2009,57(13):5809−5815. doi: 10.1021/jf900914a
[25] NAKAJIMA J I, TANAKA I, SEO S, et al. LC/PDA/ESI-MS profiling and radical scavenging activity of anthocyanins in various berries[J]. Journal of Biomedicine and Biotechnology,2004(5):241−247.
[26] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9):1231−1237.
[27] 曹建康, 姜微波. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007. [CAO J K, JIANG W B. Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M]. Beijing:China Light Industry Press, 2007.] CAO J K, JIANG W B. Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M]. Beijing: China Light Industry Press, 2007.
[28] BROAD R C, BONNEAU J P, HELLENS R P, et al. Manipulation of ascorbate biosynthetic, recycling, and regulatory pathways for improved abiotic stress tolerance in plants[J]. International Journal of Molecular Sciences,2020,21(5):1790. doi: 10.3390/ijms21051790
[29] KOŁTON A, DŁUGOSZ-GROCHOWSKA O, WOJCIECHOWSKA R, et al. Biosynthesis regulation of folates and phenols in plants[J]. Scientia Horticulturae,2022,291(5):110561.
[30] ZHENG H H, LIU W, LIU S, et al. Effects of melatonin treatment on the enzymatic browning and nutritional quality of fresh-cut pear fruit[J]. Food Chemistry,2019,299:125116. doi: 10.1016/j.foodchem.2019.125116
[31] LI D, LIMWACHIRANON J, LI L, et al. Involvement of energy metabolism to chilling tolerance induced by hydrogen sulfide in cold-stored banana fruit[J]. Food Chemistry,2016,208:272−278. doi: 10.1016/j.foodchem.2016.03.113
[32] DONG J X, KEBBEH M, YAN R, et al. Melatonin treatment delays ripening in mangoes associated with maintaining the membrane integrity of fruit exocarp during postharvest[J]. Plant Physiology and Biochemistry,2021,169:22−28. doi: 10.1016/j.plaphy.2021.10.038
[33] LI D, ZHANG X C, LI L, et al. Elevated CO2 delayed the chlorophyll degradation and anthocyanin accumulation in postharvest strawberry fruit[J]. Food Chemistry,2019,285:163−170. doi: 10.1016/j.foodchem.2019.01.150
[34] PUERTA-GOMEZ A, CISNEROS-ZEVALLOS L. Postharvest studies beyond fresh market eating quality:Phytochemical antioxidant changes in peach and plum fruit during ripening and advanced senescence[J]. Postharvest Biology and Technology,2011,60(3):220−224. doi: 10.1016/j.postharvbio.2011.01.005
[35] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7(9):405−410. doi: 10.1016/S1360-1385(02)02312-9
[36] JANNATIZADEH A. Exogenous melatonin applying confers chilling tolerance in pomegranate fruit during cold storage[J]. Scientia Horticulturae,2019,246:544−549. doi: 10.1016/j.scienta.2018.11.027
[37] MIRSHEKARI A, MADANI B, YAHIA E M, et al. Postharvest melatonin treatment reduces chilling injury in sapota fruit[J]. Journal of the Science of Food and Agriculture,2020,100(5):1897−1903. doi: 10.1002/jsfa.10198
-
期刊类型引用(4)
1. 曲扬,刘振红. 复合凝聚法制备山奈酚微胶囊及对剧烈运动所致氧化应激损伤保护作用. 食品科技. 2025(01): 275-283 .  百度学术
百度学术
2. 赵雅玲,卞赢莹,房耀维,周文梅,韩舒婷,冯娟,刘姝. 嗜热链球菌FUA329发酵红茶工艺优化及贮藏品质变化. 中国食品添加剂. 2024(11): 178-186 .  百度学术
百度学术
3. 李国巍,石雨,张正海,姬妍茹,杨庆丽,董艳,高宝昌,李柏阳. 黑海棠果多酚提取工艺优化及抗氧化活性分析. 中国食品添加剂. 2024(12): 19-30 .  百度学术
百度学术
4. 卢翠文,欧萍,叶有明,何晓燕,杨东美. 微波辅助酶法提取茶酒糟中可溶性膳食纤维及其抗氧化性能研究. 饲料研究. 2024(20): 75-79 .  百度学术
百度学术
其他类型引用(2)






 下载:
下载:
 下载:
下载:



