Fractionation, Characterization and Calcium-holding Properties of Casein Phosphopeptide-Calcium Chelates
-
摘要: 利用酪蛋白磷酸肽螯合钙离子的特性,以钙离子浓度为尺度,分级制取不同钙螯合能力的CPPs,同时提高其纯度。以酪蛋白的胰蛋白酶酶解产物为原料,通过逐级增加Ca2+添加量,在终浓度为55%(v/v)的乙醇溶液中分级沉淀出三个酪蛋白磷酸肽-钙螯合物级分(CPP1-Ca、CPP2-Ca和CPP3-Ca),并利用PBS脱钙得到三个级分相应的酪蛋白磷酸肽(CPP1、CPP2和CPP3)。以传统钙乙醇沉淀法得到的肽钙螯合物(CPP-Ca)为对照,分析并对比三个酪蛋白磷酸肽-钙螯合物级分的理化性质以及持钙特性。结果表明,三个酪蛋白磷酸肽-钙螯合物级分中,CPP3-Ca含有最高的纯度和钙螯合量,分别为89.42%和69.59 mg/g,明显高于未分级CPP-Ca的83.77%和55.05 mg/g。氨基酸组成及N/P(摩尔比)分析发现CPP3-Ca含有更高磷酸丝氨酸基团,进而能够结合更多的Ca2+。不同酪蛋白磷酸肽级分持钙能力分析结果显示CPP3能够更好地延迟和阻止磷酸钙沉淀的形成,具有更高的持钙能力。同时CPP3-Ca在模拟肠道环境中具有更高的钙溶解度,表明分级后的酪蛋白磷酸肽-钙螯合物的体外生物利用度提高。Abstract: In this paper, a novel casein phosphopeptide fractionation process was proposed based on the calcium chelating properties of casein phosphopeptide and different casein phosphopeptide fractions with different chelating abilities and enhanced purity were produced using different calcium ion concentrations. Three casein phosphopeptide-calcium chelate fractions (CPP1-Ca, CPP2-Ca and CPP3-Ca) were precipitated hierarchically from the trypsin digest of casein by increasing the Ca2+ addition step by step in an ethanol solution with a concentration of 55% (v/v), and PBS was used to decalcify to obtain the corresponding casein phosphopeptides (CPP1, CPP2 and CPP3). The physicochemical properties and calcium uptake characteristics of the three casein phosphopeptide-calcium chelate fractions were analyzed and compared with those of the peptide-calcium chelate fraction (CPP-Ca) obtained by the conventional calcium-ethanol precipitation method as a control. The results showed that among the three casein phosphopeptide-calcium chelate fractions, CPP3-Ca contained the highest purity and calcium chelating amount of 89.42% and 69.59 mg/g, respectively, which were significantly higher than those of the ungraded CPP-Ca of 83.77% and 55.05 mg/g. The analysis of the amino acid composition and the N/P (molar ratio) revealed that the CPP3-Ca contained a higher phosphatidylserine group, which in turn binds more Ca2+. Analysis of the calcium holding capacity of different casein phosphopeptide fractions showed that CPP3 was able to better delay and prevent the formation of calcium phosphate precipitation, and had a higher calcium holding capacity. Meanwhile, CPP3-Ca had higher calcium solubility in the simulated intestinal environment, indicating that the in vitro bioavailability of the graded casein phosphopeptide-calcium chelates was improved.
-
作为人体必需矿物质成分之一,钙参与到人体代谢、骨骼生长和酶调节等多种生理过程[1−2]。通过饮食摄入是增加身体中钙储存最有效的方法[3−5]。然而,传统钙制剂容易在小肠中形成不溶性沉淀物,从而减少人体对钙离子的吸收效果[6−7]。酪蛋白磷酸肽(Casein Phosphopeptides,CPPs)是以牛乳酪蛋白为原料,经酶水解、分离、纯化而制得的含有磷酸丝氨酰基的天然活性肽。其在pH呈中性到弱碱性的动物肠道内,能阻止磷酸钙沉淀的产生,从而促进钙的吸收[8−11]。
钙-乙醇沉淀法是目前分离酪蛋白磷酸肽最普遍的方法之一[12−15],即向酪蛋白水解液中加入一定浓度的Ca2+,使CPPs分子之间形成钙桥,再向溶液中加入一定量的乙醇,改变溶液的介电常数,使CPPs沉淀下来。但是,由于传统钙乙醇沉淀法加入的Ca2+相对于酶解液中CPPs来说是过量的,导致溶液中与其螯合的CPPs达到饱和,进而全部沉淀下来,所以获得的产品在钙螯合能力和纯度等方面有限,降低了产品的应用价值。
本研究利用酪蛋白磷酸肽螯合钙离子的特性,以钙离子浓度为尺度,分级制取不同钙螯合能力的CPPs,同时提高其纯度。通过改变钙离子浓度,连续沉淀出不同钙螯合活性的酪蛋白磷酸肽,以钙螯合量为指标对CPPs进行分级。测定不同级分的氨基酸组成、N/P摩尔比对其进行分析。并通过紫外吸收光谱、FT-IR红外吸收光谱及Zeta电位对钙螯合量最高的酪蛋白磷酸肽和肽钙螯合物结构进行表征。最后,进行了分级酪蛋白磷酸肽的体外持钙能力测定和酪蛋白磷酸肽钙螯合物的体外消化模拟实验,并分析了酪蛋白磷酸肽钙螯合物在模拟胃肠消化中的生物利用度,特别是在肠道pH环境下的钙保持能力,旨在为提高酪蛋白磷酸肽及钙螯合物的生物利用度提供理论依据。
1. 材料与方法
1.1 材料与仪器
干酪素 蛋白含量90%,湖北百特威生物科技有限公司;酪蛋白磷酸肽 纯度80%,阿拉丁试剂股份有限公司;胰蛋白酶(25000 U/g)、胃蛋白酶(15000 U/g) 上海源叶生物科技有限公司;EDTA、碳酸氢钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸 均为分析纯,国药集团化学试剂有限公司;无水乙醇 津东天正精细化学试剂厂。
H1850型高速离心机 湖南湘仪有限公司;Scientz-10N/A型冷冻干燥机 宁波新芝生物科技股份有限公司;Kjeltec 8400型凯氏定氮仪 福特(中国)有限公司;IS50型傅里叶红外光谱仪 美国尼高利仪器公司;BeNano 90 Zeta型Zeta电位仪 英国马尔文帕纳科公司。
1.2 实验方法
1.2.1 酪蛋白酶解液的制备
称取适量酪蛋白酸钠溶于去离子水(50 mg/mL)中,利用1 mol/L NaOH溶液调至pH8。加入胰蛋白酶(酶与底物质量比1:50,w/w),于45 ºC水浴锅中酶解4 h,酶解结束后置于90 ºC水浴锅中灭酶10 min,冷却至室温。将酶解液用1 mol/L HCl调节pH至4.6,静置,10000 r/min 离心 10 min,取上清液备用。此制备条件下酪蛋白酸钠酶解较充分,水解度为19.22%±0.68%。
1.2.2 钙-乙醇分级酪蛋白磷酸肽
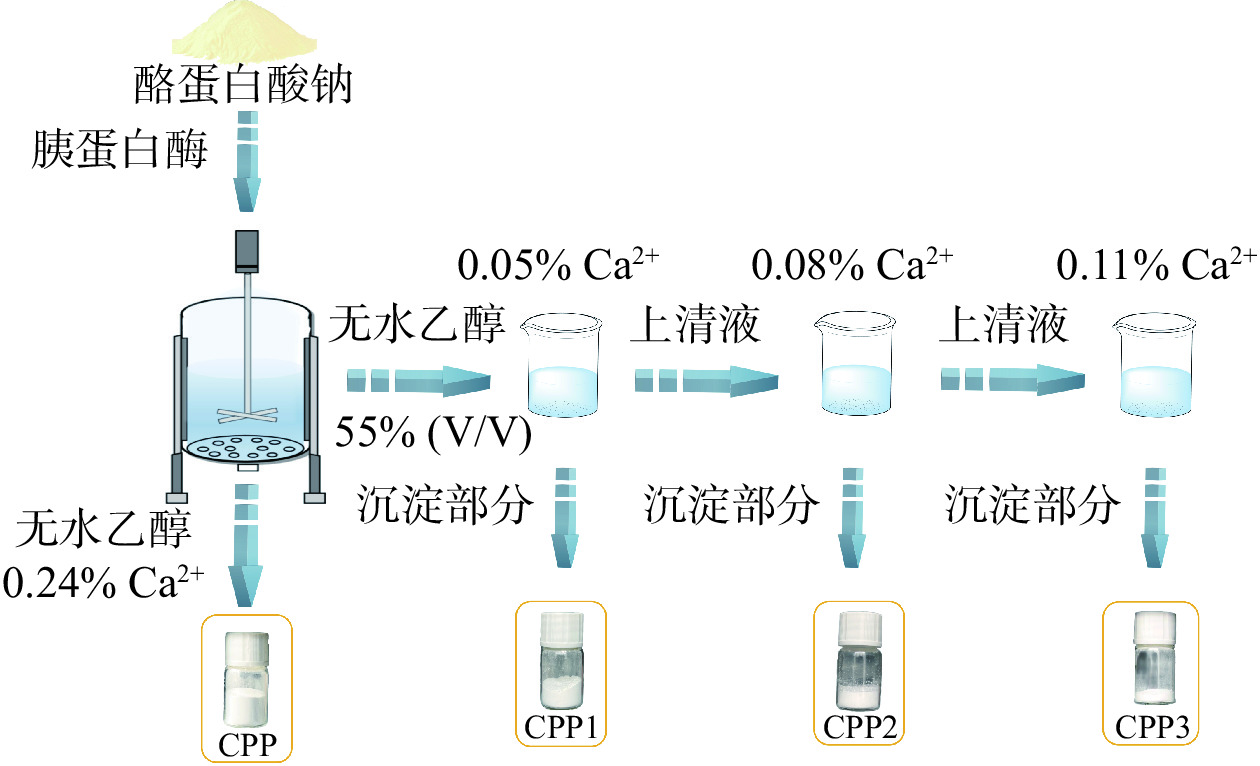
将酪蛋白酶解液用1 mol/L HCl溶液调至pH为5.5,加入CaCl2,使CaCl2浓度为0.24%。将CaCl2总量分为三个等级(终浓度分别为0.05%、0.08%、0.11%),加入无水乙醇,使其终浓度达到55%(v/v),对酶解液进行钙-乙醇分级。静置6 h,10000 r/min 离心 10 min,取沉淀进行冷冻干燥。收集不同组分,分别命名为CPP1-Ca、CPP2-Ca、CPP3-Ca。将直接加入CaCl2浓度为0.24%的酶解液进行钙乙醇沉淀,得到的组分被命名为CPP-Ca。
1.2.3 PBS脱钙
取1 g不同级分肽钙螯合物,加入200 mL 0.2 mol /L的pH为8的PBS缓冲液,搅拌4 h后离心10 min[16]。取上清液进行透析,去除磷酸根,然后将不同级分进行冷干,得到脱钙后的各级分,分别命名为CPP,CPP1,CPP2,CPP3。该方法可脱除酪蛋白磷酸肽钙螯合物中99%以上的钙,且酪蛋白磷酸肽无损失。
1.2.4 分级酪蛋白磷酸肽钙螯合物纯度和得率测定
参考国标钡乙醇法GB 31617-2014《食品安全国家标准 食品营养强化剂酪蛋白磷酸肽》测定不同级分酪蛋白磷酸肽的纯度。不同级分酪蛋白磷酸肽钙螯合物得率计算公式如下:
W1(%)=A1A2×100 (1) W2(%)=B1B2×100 (2) 式中:W1表示酪蛋白磷酸肽钙螯合物绝对得率,%;A1为不同级分酪蛋白磷酸肽质量,g;A2为酪蛋白质量,g;W2表示酪蛋白磷酸肽钙螯合物相对得率,%;B1为不同级分肽钙螯合物质量,g;B2为总肽钙螯合物质量,g。
1.2.5 分级酪蛋白磷酸肽钙螯合物理化性质测定
钙螯合量测定参照GB 5009.92-2016《食品安全国家标准 食品中钙的测定》中火焰原子吸收光谱法;氨基酸组成的测定参照GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》;氮含量测定参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法;磷含量测定采用半微量定磷法[17−18],根据下式计算得出N/P(摩尔比)。
N/P(摩尔比)=W1W2×3114 (3) 式中:W1为氮的质量百分含量;W2为磷的质量百分含量。
1.2.6 分级酪蛋白磷酸肽及肽钙螯合物结构表征
Zeta电位采用电位分析仪进行测定[19]:样品溶于去离子水中,充分混匀后使其浓度为1 mg/mL。随后利用纳米粒度电位仪对不同级分样品的 ξ 电势进行测定。测定紫外吸收光谱[19−22]:将CPP3-Ca和CPP3样品分散在浓度为1 mg/mL的蒸馏水中,滤膜(0.22 μm)过滤后用紫外吸收分光光度计在190~400 nm波长范围内扫描,记录样品的紫外可见光谱。参考齐立伟等[21]的方法测定傅里叶红外光谱:少量样品(CPP3和CPP3-Ca)与溴化钾混合,挤压成透明片,装入FT-IR样品板。每个样本在4000~400 cm−1的波数范围内进行扫描。
1.2.7 分级酪蛋白磷酸肽持钙能力测定和体外生物利用度
酪蛋白磷酸肽持钙能力测定:采用pH-stat法测定不同级分酪蛋白磷酸肽的持钙能力[23−24]。反应条件为37 ºC,pH为8.0,与人体小肠末端环境一致。加入不同级分CPP的终浓度为0.1 g/L,以不加CPP样品的为空白对照。体外消化模拟[25−27]:将不同级分肽钙螯合物、氯化钙分别溶解于去离子水(1 mg/mL)中,调节pH至2.0,37 ºC孵育5 min后,按1:35(w/w)的酶底物比加入胃蛋白酶消化2 h。胃消化完成后,用饱和NaHCO3调pH至6.8后,按照1:25(w/w)的酶底物比加入胰蛋白酶,继续用1 mol/L NaOH 调节至pH7.5后消化2 h。分别在体外消化0、30、60、90和120 min 时取一定量样品,沸水浴灭酶 10 min 后进行样品可溶性钙含量测定。用EDTA滴定法[27−28]测定消化过程中样品可溶性钙含量的变化,以不同时间间隔计算样品的钙含量。钙的溶解度计算公式如下:
钙溶解度(%)=M1M0×100 (4) 式中:M1为溶解钙含量,mg/L;M0为总钙含量,mg/L。
1.3 数据处理
所有试验均重复3次,试验数据采用 SPSS 22.0 软件的 ANOVA(变异系数分析)进行显著性分析(P<0.05),利用Origin Pro 9.0 进行制图。
2. 结果与分析
2.1 酪蛋白磷酸肽及肽钙螯合物的制备
图1为钙乙醇分级酪蛋白磷酸肽的制备工艺流程。酪蛋白经胰蛋白酶酶解后,利用钙乙醇沉淀酶解液中酪蛋白磷酸肽的原理,改变钙离子浓度,连续沉淀出不同钙螯合量的酪蛋白磷酸肽钙螯合物(CPP1-Ca、CPP2-Ca和CPP3-Ca),并且以传统钙乙醇沉淀的方法得到的酪蛋白磷酸肽钙螯合物(CPP-Ca)作对照。另外,相对应的酪蛋白磷酸肽(CPP1、CPP2和CPP3)可以通过以磷酸肽钙螯合物为原料,经PBS脱钙法得到[16]。
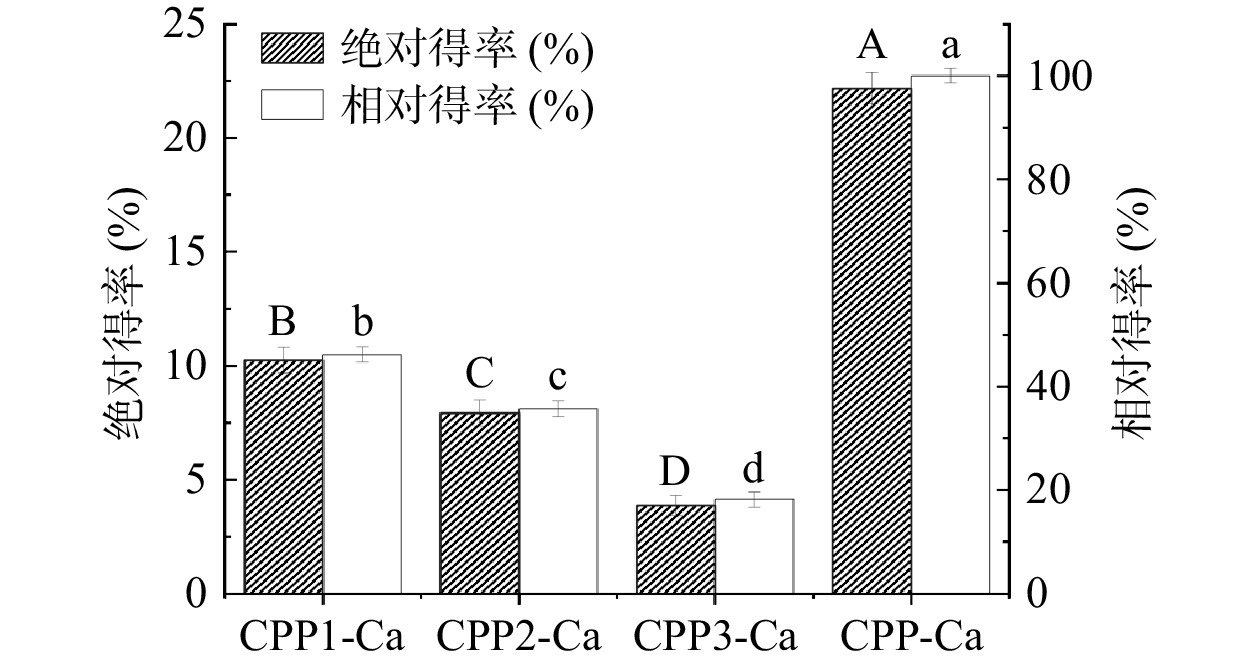
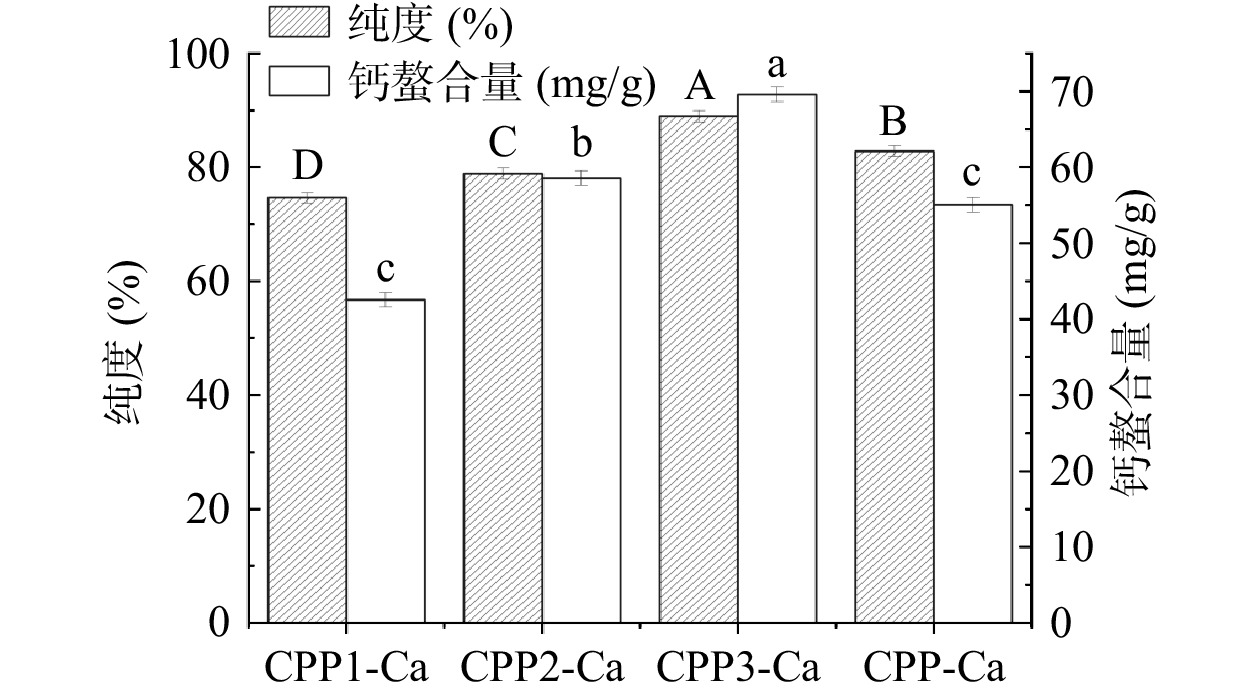
得率和纯度是评价分离酪蛋白磷酸肽的重要指标。由图2可知,未分级得到的酪蛋白磷酸肽钙螯合物得率为22.16%。钙乙醇分级得到的CPP1-Ca、CPP2-Ca、CPP3-Ca得率分别为10.36%、8.02%和4.31%,相较于未分级的酪蛋白磷酸肽钙螯合物得率较低。其中,三种不同级分的酪蛋白磷酸肽钙螯合物中CPP1-Ca的相对得率最高,为46.18%,CPP3-Ca的相对得率最低,仅有18.15%。郭长慧等[29]在酪蛋白磷酸肽制备工艺参数的优化研究中得到最优条件下CPPs的得率最大为16.11%(质量分数)。由图3可知,实验所制备的CPP1-Ca、CPP2-Ca、CPP3-Ca和CPP-Ca纯度均在70%以上。利用钙乙醇分级得到的不同级分酪蛋白磷酸肽钙螯合物中,CPP3-Ca的纯度最高,为89.42%,相较于未分级的酪蛋白磷酸肽钙螯合物(CPP-Ca)的83.77%的纯度提高了6.74%。陈雪香等[13]的研究中用乙醇-钡法测定8种商品CPPs的纯度,其中样品CPP纯度最大的为38.01%,最小的为19.43%。CPP1-Ca到CPP3-Ca的钙螯合量逐渐增高,其中CPP3-Ca的钙螯合量最高,为69.59 mg/g,均显著(P<0.05)高于CPP1-Ca和CPP2-Ca两个级分的42.53和58.54 mg/g以及未分级的CPP-Ca(55.05 mg/g)。
2.2 分级酪蛋白磷酸肽钙螯合物的理化性质分析
2.2.1 氨基酸组成分析
有研究表明,肽结合金属离子的能力主要取决于其氨基酸组成,其中,酪蛋白磷酸肽的钙结合量与其中的磷酸丝氨酸基团含量呈正相关[30]。为了研究不同级分酪蛋白磷酸肽中氨基酸组成对酪蛋白磷酸肽与钙离子反应的影响,测定了酪蛋白磷酸肽钙螯合物的氨基酸组成。从总氨基酸含量结果(表1)来看,各级分酪蛋白磷酸肽钙螯合物中谷氨酸含量较高,其次还含有亮氨酸和异亮氨酸,这与文献[31−32]所报道的结果相似。由表2可知,四种酪蛋白磷酸肽钙螯合物的氨基酸组成中,丝氨酸(Ser)和谷氨酸(Glu)含量最高,可见四种酪蛋白磷酸肽钙螯合物的核心结构-SerP-SerP-SerP-Glu-Glu-占整个肽链的比例较大,酪蛋白磷酸肽的纯度较高,这一结果与前文酪蛋白磷酸肽纯度的测定结果一致(图3)。磷酸化残基在矿物结合中起重要作用,研究表明去磷酸化的肽并没有显示与任何矿物结合的活性[33]。由表2可知,CPP1-Ca、CPP2-Ca、CPP3-Ca、CPP-Ca 分别具有较高含量的磷酸丝氨酰残基,其中 CPP-Ca 的丝氨酸(Ser)和谷氨酸(Glu)含量最低,仅占29.87%,而 CPP3-Ca 的丝氨酸(Ser)和谷氨酸(Glu)含量最高,占33.25%。该结果与冯颖杰等[33]利用米曲霉蛋白酶制备CPP的氨基酸组成分析中结果一致。所以由此可证明CPP3-Ca具有更高的钙螯合能力。这也进一步表明磷酸化的残基在矿物结合和运输中起重要作用。
表 1 不同酪蛋白磷酸肽钙螯合物中氨基酸组成及含量Table 1. Amino acid compositions and contents in different calcium casein phosphopeptide chelates氨基酸 CPP1-Ca(%) CPP2-Ca(%) CPP3-Ca(%) CPP-Ca(%) 天冬氨酸 8.818 7.466 8.698 10.584 苏氨酸 4.201 4.038 4.481 5.309 丝氨酸 9.343 10.231 9.989 8.171 谷氨酸 22.336 22.348 23.263 21.705 甘氨酸 2.014 1.746 1.902 2.103 丙氨酸 3.585 2.816 3.094 3.574 胱氨酸 0.341 0.425 0.362 0.342 缬氨酸 5.668 5.713 5.752 4.785 蛋氨酸 4.879 4.458 4.693 5.622 异亮氨酸 7.758 7.463 7.743 8.243 亮氨酸 7.007 7.348 6.996 6.892 酪氨酸 2.991 2.877 2.816 2.612 苯丙氨酸 2.562 2.077 2.243 2.772 组氨酸 1.953 3.823 1.750 1.756 赖氨酸 8.020 8.049 7.065 8.375 精氨酸 2.867 4.044 3.246 2.041 脯氨酸 5.656 5.077 5.906 5.114 总和 100.000 100.000 100.000 100.000 表 2 不同酪蛋白磷酸肽钙螯合物中Ser和Glu含量Table 2. Ser and Glu contents in different casein phosphopeptide calcium chelates样品名称 CPP1-Ca CPP2-Ca CPP3-Ca CPP-Ca Ser和Glu占比(%) 31.67 32.57 33.25 29.87 2.2.2 N/P(摩尔比)分析
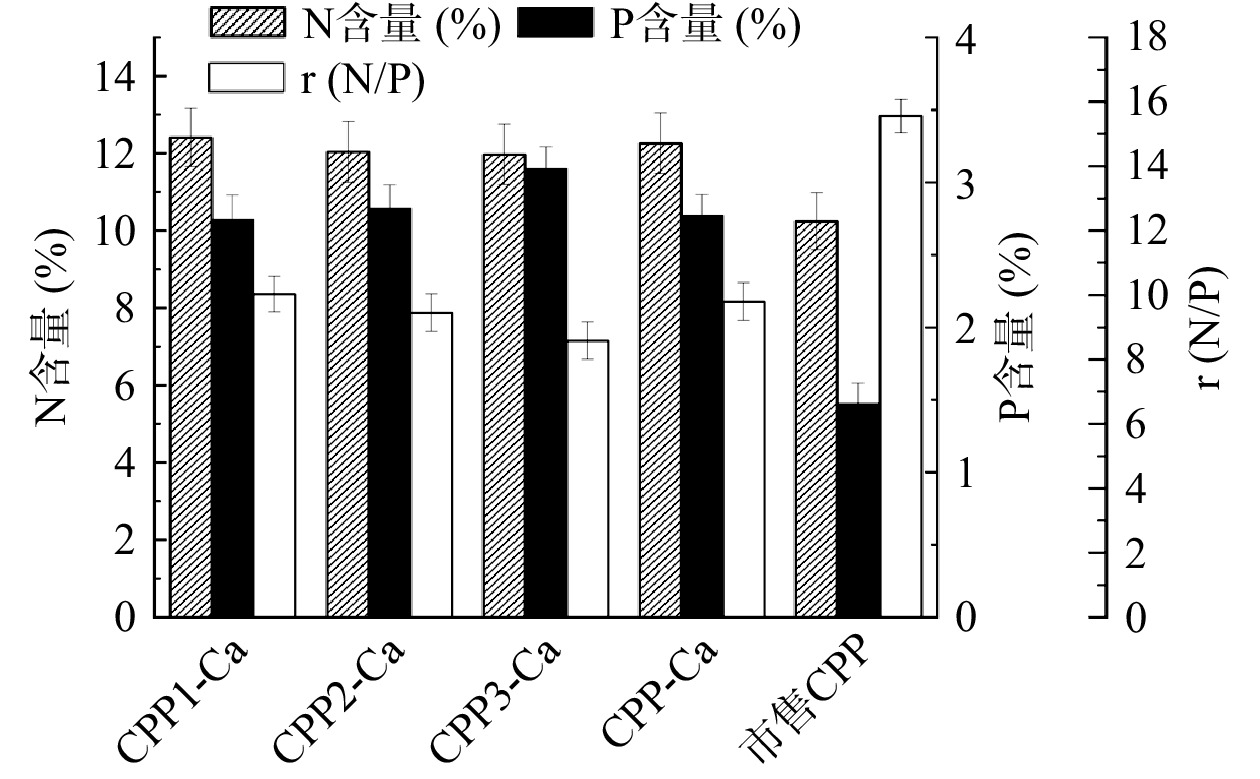
N/P(摩尔比)是评价CPP质量的一个重要指标,本研究规定N/P在24以上的CPP为高N/P的CPP,N/P在15~24的CPP为中N/P的CPP,摩尔比在15以下的CPP为低N/P的CPP[17,34]。N/P反映了产品中磷酸丝氨酸残基的密度,N/P越低,磷酸丝氨酸残基密度越高。由图4可以看出,四种酪蛋白磷酸肽高螯合物的N/P均在15以下,属低N/P的CPP,而市售CPPs的N/P为15.55,属于中N/P的CPP。其中CPP3的N/P最低,达到8.27。在Alcalase水解酪蛋白制备磷酸肽和非磷肽的研究中,赵一明[35]发现酪蛋白水解液经选择沉淀法得到的酪蛋白磷酸肽N/P(摩尔比)是9.61。由此可以说明CPP3含有较高密度的磷酸丝氨酸残基,这一结果与前文中氨基酸组成的测定结果一致(表2)。
2.3 分级酪蛋白磷酸肽及肽钙螯合物结构表征
钙乙醇分级的原理是利用钙离子与酪蛋白磷酸肽之间的结合作用,以钙离子浓度为尺度,通过连续沉淀的方法,将不同钙螯合能力的酪蛋白磷酸肽分离开来,从而得到不同钙螯合量的酪蛋白磷酸肽钙螯合物。其中CPP3-Ca为持钙能力最高的级分,将其进行PBS脱钙后,酪蛋白磷酸肽-钙螯合物上面的钙被脱除,从而能得到有最佳持钙能力的酪蛋白磷酸肽。利用紫外吸收光谱、红外吸收光谱以及Zeta电位表征对比分析最佳持钙能力的酪蛋白磷酸肽在螯合钙前后的结构差异,进一步验证其相互作用。
2.3.1 紫外吸收光谱分析
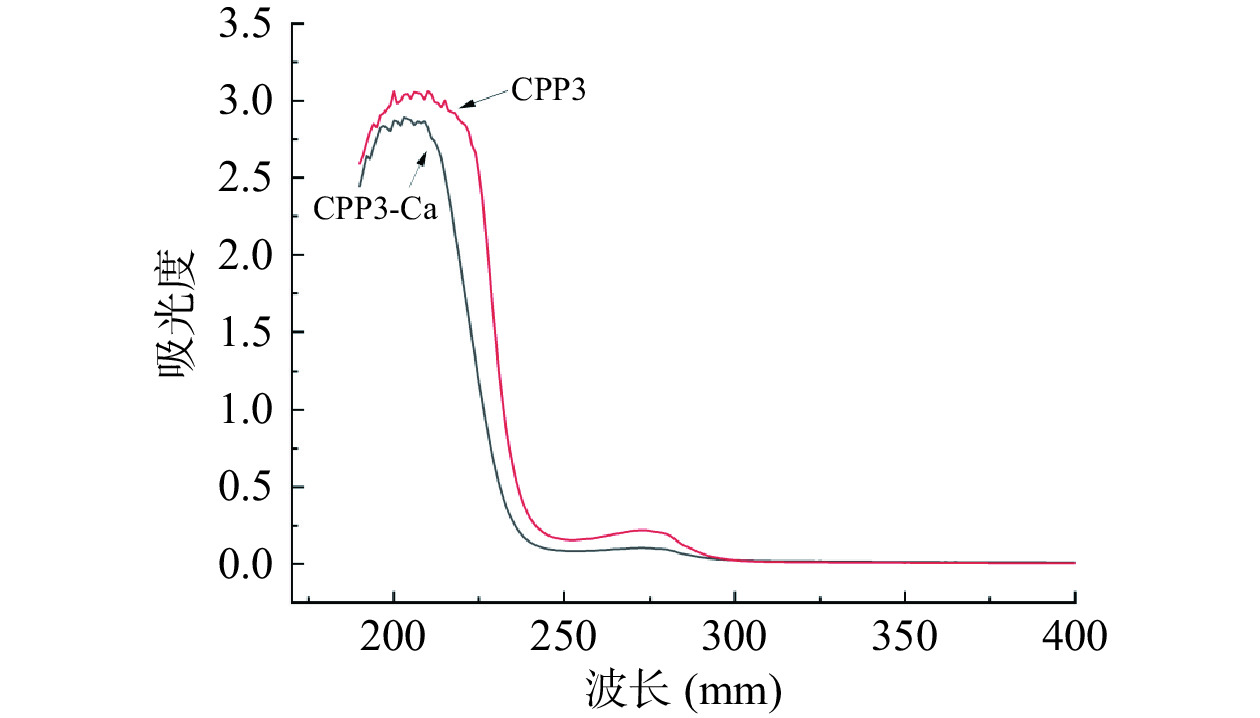
从紫外线吸收光谱的强度和位移的变化中可以推导出酪蛋白磷酸肽和钙之间可能的相互作用机制。CPP和CPP-Ca的UV光谱显示在图5中。CPP3在200 nm 附近显示出高强度的吸收峰,这是对应肽链中酰胺键C=O的n→π*跃迁产生的特征峰,与钙离子螯合后,CPP3-Ca可以观察到吸收峰强度明显增加,这可能是由于酪蛋白磷酸肽螯合钙后,导致酰胺键的电子云和配体的吸收特性发生变化而引起的[36]。在275 nm处观察到CPP有较弱的吸收峰。这是由于多肽中芳香族氨基酸的构象变化造成的[27]。钙螯合后,吸收峰强度明显降低,这表明在反应过程中存在分子或原子相互作用,并发生了电子跃迁[36−37]。该结果与宋丽等[37]的研究卵黄高磷蛋白肽-钙螯合物的紫外吸收光谱结果趋于一致。上述结果表明,CPP3与Ca2+相互作用形成了不同于CPP3的肽钙螯合物。
2.3.2 FT-IR红外吸收光谱分析
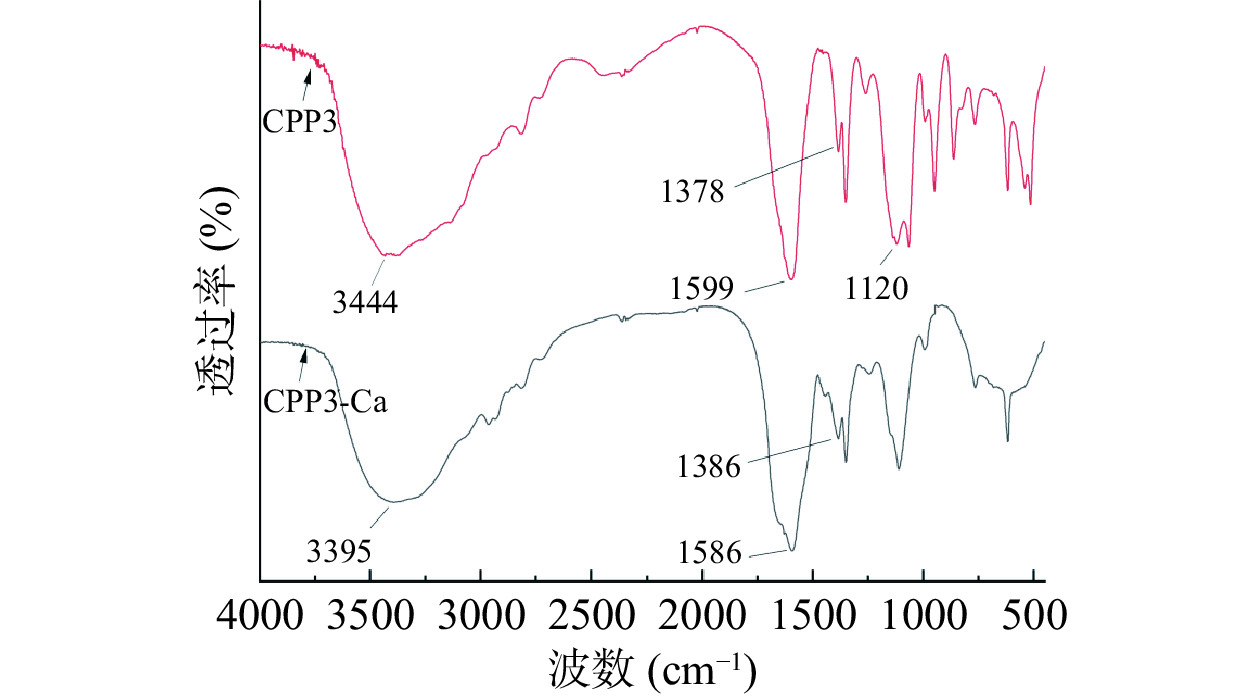
FT-IR是探究肽结构和肽钙反应机制的方法之一[37]。吸收峰的变化可以反映金属离子和有机基团之间的协调反应。与CPP3的红外光谱相比,CPP3-Ca螯合物的红外光谱具有明显的不同,这可能是钙离子在与酪蛋白磷酸肽进行螯合时,使肽的某些官能团结构发生变化,引起吸收峰发生变化[38−39]。从图6可以看出,CPP3经过钙螯合反应后,在某些波数上的红外吸收量上有所变化。CPP的光谱中位于3444 cm−1的特征吸收带对应于-NH的拉伸振动。当与钙螯合时,该带移到较低的波数3395 cm−1,表明酰胺中-NH可能与钙离子发生反应,N-Ca键取代氢键导致N-H键延伸。代表-COOH弯曲振动的1378 cm−1的波段,随着强度的减弱而转移到1386 cm−1,这表明羧基氧的非键合自由电子转移到钙离子上,羧基氧参与了钙结合反应。该结果与刘玉玉等[40]利用FT-IR研究白鲢鱼皮胶原蛋白肽的羧基和氨基与钙离子螯合后生成肽-钙螯合物结果趋于一致。此外,与CPP3相比,CPP3-Ca在1120 cm−1处的吸收峰几乎消失,PO43−上的吸收峰几乎消失,PO43−上的P-O伸缩振动的红外特征吸收峰在1150~1060 cm−1范围内[38],1120cm−1正好在其吸收特征峰内,所以可推测CPP3的磷酸基团参与到与金属离子钙的螯合。基于以上结果分析,CPP3与Ca2+结合位点主要是氨基氮原子、羧基氧原子和磷酸基团。
2.3.3 Zeta电位分析
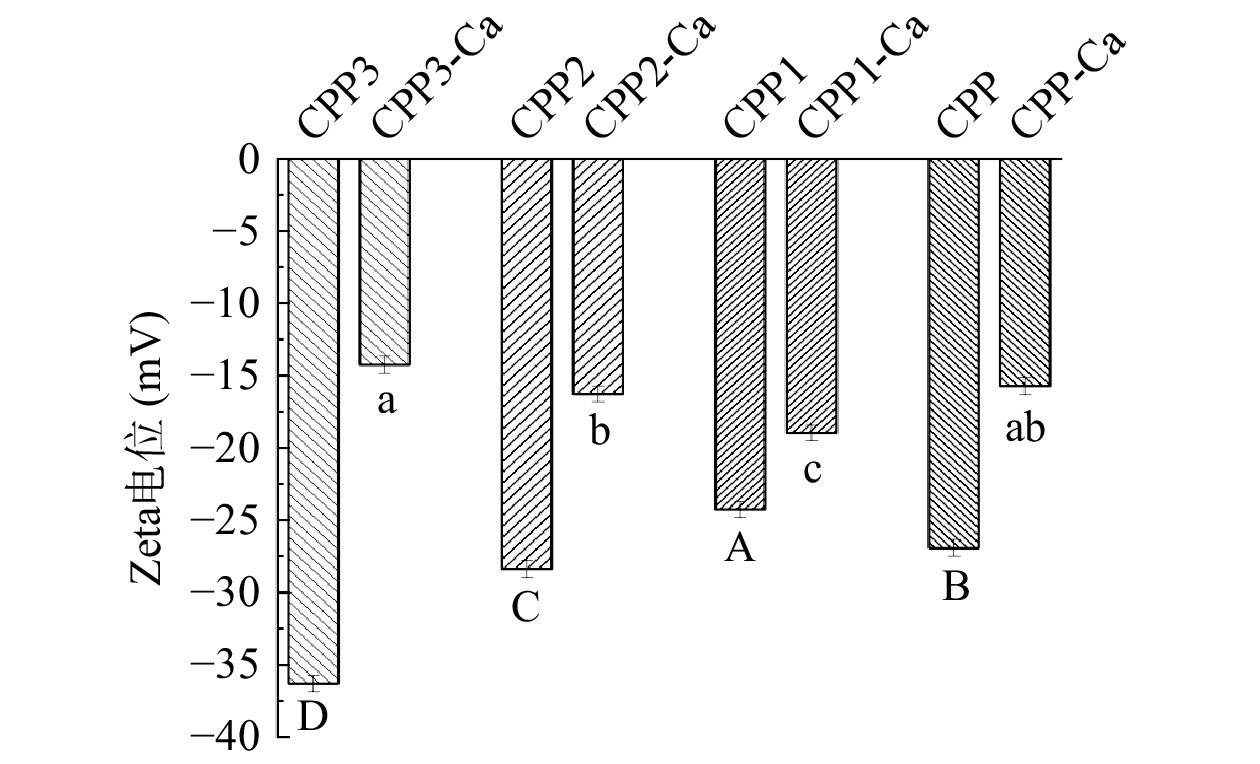
Zeta电位值可表征多肽溶液的稳定性。不同级分酪蛋白磷酸肽的表面电荷性质通过 ξ电势进行确定[19]。如图7所示,酪蛋白磷酸肽与钙离子结合后,电位绝对值有显著下降,其中,CPP3的电位变化最大。这是可能是由于CPP与钙离子相互作用,多肽中带负电荷的磷酸基团和羧基基团与带正电荷的钙离子相结合,导致多肽表面所带负电荷被中和,整体电位发生明显变化。这与宋丽等[37]探究卵黄高磷蛋白肽与钙离子结合机制中Zeta电位分析结果一致。在钙乙醇分级得到的三个级分中,CPP3的电势最低,为−36.3 mV,CPP1的电势最高,为−24.27 mV。这可能是因为CPP3带有更多的磷酸丝氨酸残基,本身带有负电荷。且在N/P摩尔比和氨基酸组成分析中可以得出,CPP3的磷酸丝氨酸残基的密度最大。由此也可以证明钙乙醇分级能富集含更多的磷酸丝氨酸残基的酪蛋白磷酸肽。
2.4 分级酪蛋白磷酸肽持钙能力和体外生物利用度
2.4.1 分级酪蛋白磷酸肽持钙能力
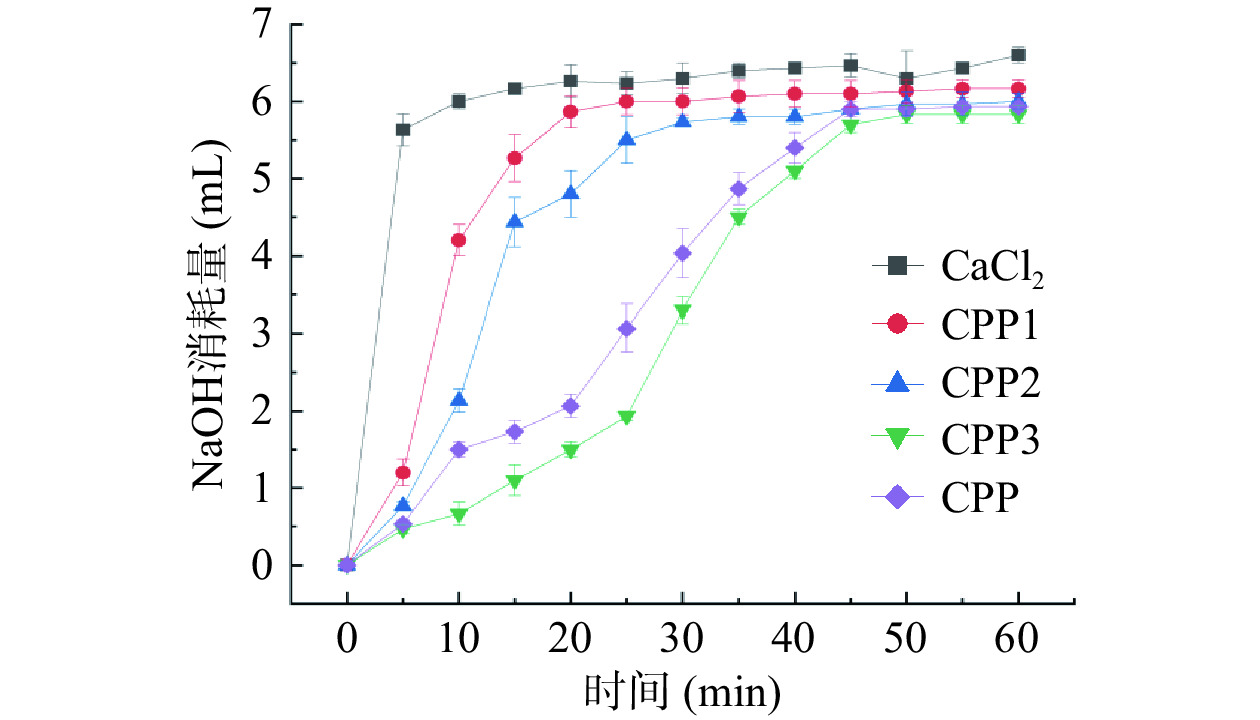
由图8可以看出,未添加CPP时,在5 min内迅速形成磷酸钙沉淀。而添加CPP后,磷酸钙沉淀形成速度明显减慢。这在一定程度上说明了CPP的确能够延迟和阻止磷酸钙沉淀的形成,具有较好的持钙能力。其中,CPP1、CPP2分别在第30、35 min时出现沉淀,可使磷酸钙沉淀的形成推迟10~15 min。CPP样品在40 min时出现沉淀,使磷酸钙沉淀的形成推迟20~25 min。而CPP3样品在第50 min时出现磷酸钙沉淀,可使沉淀的形成时间推迟40 min以上,持钙能力明显优于其他级分。结合之前对不同级分酪蛋白磷酸肽的几项指标测试结果来看,与其他级分相比较,CPP3磷酸丝氨酸残基的密度最大,同时N/P摩尔比最低,与钙离子结合机会增加,从而可有效阻止磷酸钙的形成。
2.4.2 分级酪蛋白磷酸肽-钙螯合物体外生物利用度
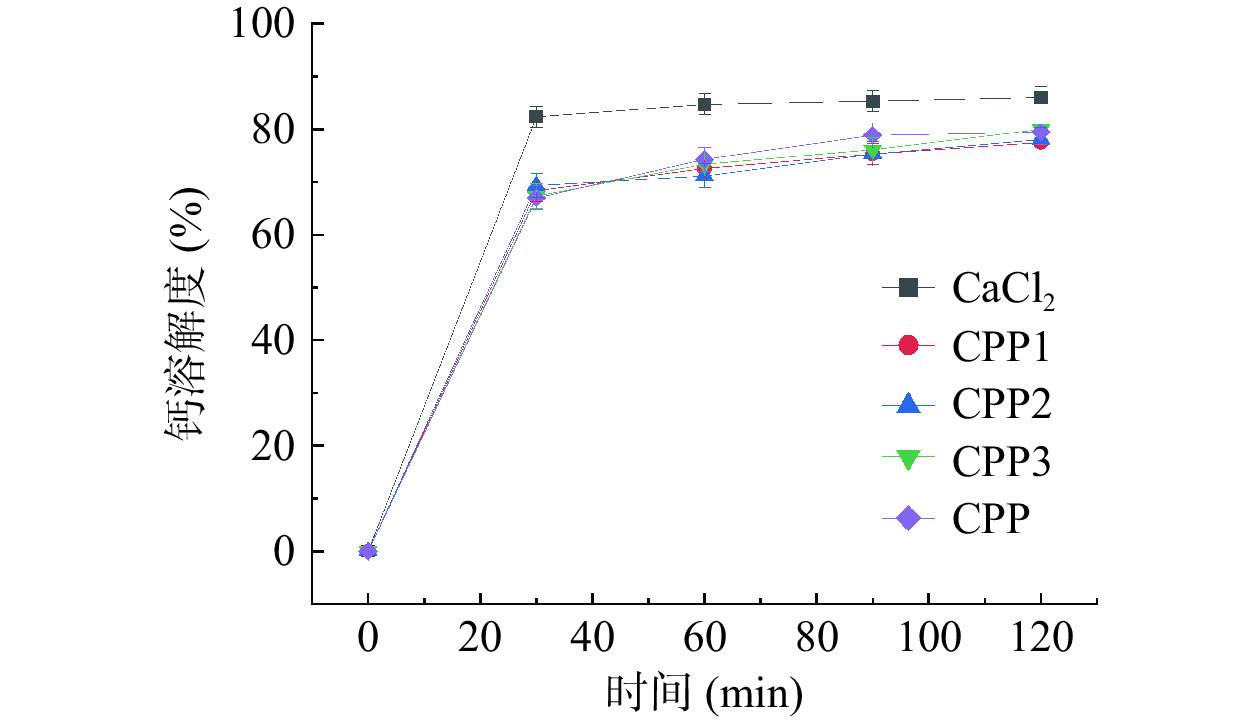
钙被吸收的一个先决条件是它在肠道中的溶解度(即生物利用度)。在胃液消化过程中钙离子的溶解度变化趋势如图9,当各级分酪蛋白磷酸肽钙螯合物刚进入模拟胃液进行消化时,五种钙源的溶解度均能达到80%以上,这是由于各样品的初始pH为2,酸性条件下,样品的钙离子被释放出来呈游离状态。各级分酪蛋白磷酸肽钙螯合物释放率相较于CaCl2来说变化较慢,说明酪蛋白磷酸肽钙螯合物具有一定的抗消化性,能降低对胃部的刺激。
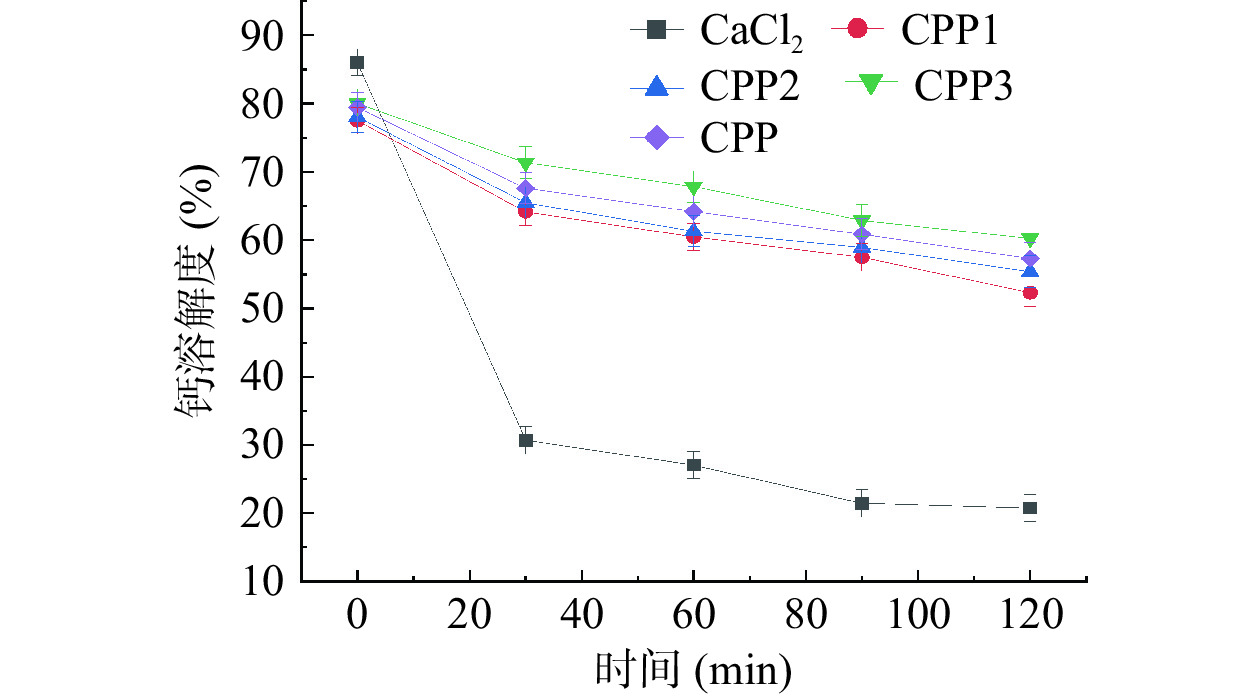
如图10所示,在肠液消化过程中,由于肠道环境呈弱碱性,钙离子易形成氢氧化钙沉淀,使钙的生物利用度降低。经体外模拟胃肠道消化后,五种钙源的钙溶解率均逐渐降低。在消化结束时,CPP3-Ca的钙溶解度最高,达到62.82%,CaCl2的溶解度最低,仅有21.05%。这说明CPP3-Ca能使更多的Ca2+在弱碱性环境的肠道中溶解,被人体消化吸收。因此,钙乙醇分级得到的CPP3-Ca能有效提高钙的生物利用度。
3. 结论
以传统的钙乙醇沉淀法分离酪蛋白磷酸肽为基础,通过逐级增加酶解液中钙离子浓度,再用终浓度为55%(v/v)的乙醇沉淀出不同钙鳌合量的酪蛋白磷酸肽钙鳌合物。第三级分(CPP3-Ca)的钙鳌合量最高,达到69.59 mg/g,其纯度和体外持钙能力均比未分级的高。基于氨基酸组成和N/P摩尔比测定分析,证明了CPP3-Ca有更高密度的磷酸基团。通过紫外吸收光谱、红外吸收光谱以及Zeta电位可以证明酪蛋白磷酸肽中参与钙鳌合的主要是羧基、氨基和磷酸基团,从而证明了CPP3具有更高的钙鳌合能力以及酪蛋白磷酸肽钙鳌合物的形成。研究不同级分酪蛋白磷酸肽阻止磷酸钙沉淀形成的能力,分析结果显示CPP 能够延迟和阻止磷酸钙沉淀的形成,具有较好的持钙能力,其中,CPP3具有更高的持钙能力。在模拟胃消化过程中,不同级分酪蛋白磷酸肽钙螯合物的释放率相对较慢,说明酪蛋白磷酸肽钙螯合物具有一定的抗消化性,能降低对胃部的刺激。在模拟肠道消化过程中,分级出的CPP3-Ca有更高的钙溶解度,表明分级出的酪蛋白磷酸肽钙鳌合物的体外生物利用度更高。
-
表 1 不同酪蛋白磷酸肽钙螯合物中氨基酸组成及含量
Table 1 Amino acid compositions and contents in different calcium casein phosphopeptide chelates
氨基酸 CPP1-Ca(%) CPP2-Ca(%) CPP3-Ca(%) CPP-Ca(%) 天冬氨酸 8.818 7.466 8.698 10.584 苏氨酸 4.201 4.038 4.481 5.309 丝氨酸 9.343 10.231 9.989 8.171 谷氨酸 22.336 22.348 23.263 21.705 甘氨酸 2.014 1.746 1.902 2.103 丙氨酸 3.585 2.816 3.094 3.574 胱氨酸 0.341 0.425 0.362 0.342 缬氨酸 5.668 5.713 5.752 4.785 蛋氨酸 4.879 4.458 4.693 5.622 异亮氨酸 7.758 7.463 7.743 8.243 亮氨酸 7.007 7.348 6.996 6.892 酪氨酸 2.991 2.877 2.816 2.612 苯丙氨酸 2.562 2.077 2.243 2.772 组氨酸 1.953 3.823 1.750 1.756 赖氨酸 8.020 8.049 7.065 8.375 精氨酸 2.867 4.044 3.246 2.041 脯氨酸 5.656 5.077 5.906 5.114 总和 100.000 100.000 100.000 100.000 表 2 不同酪蛋白磷酸肽钙螯合物中Ser和Glu含量
Table 2 Ser and Glu contents in different casein phosphopeptide calcium chelates
样品名称 CPP1-Ca CPP2-Ca CPP3-Ca CPP-Ca Ser和Glu占比(%) 31.67 32.57 33.25 29.87 -
[1] BAILEY R L, ZOU P S, WALLACE T C, et al. Calcium supplement use is associated with less bone mineral density loss, but does not lessen the risk of bone fracture across the menopause transition:data from the study of women’s health across the nation[J]. JBMR Plus,2020,4(1):e10246. doi: 10.1002/jbm4.10246
[2] CHA K H, YANG J S, KIM K A, et al. Improvement in host metabolic homeostasis and alteration in gut microbiota in mice on the high-fat diet:A comparison of calcium supplements[J]. Food Research International,2020,136:109495. doi: 10.1016/j.foodres.2020.109495
[3] BAZARBASHI N, RISHI P, NICHOLLS S, et al. Oral calcium supplements associate with seria coronary calcification:Insights from intravascular ultrasound[J]. Journal of the American College of Cardiology, 2019, 73(9):1418.
[4] 苑晴晴, 罗琴, 何凯鑫, 等. 肽钙螯合物的研究进展[J]. 粮食与食品工业,2023,30(2):24−26. [YUAN Q Q, LUO Q, HE K X, et al. Progress of calcium chelate of microalgal peptide[J]. Cereal & Food Industry,2023,30(2):24−26.] YUAN Q Q, LUO Q, HE K X, et al. Progress of calcium chelate of microalgal peptide[J]. Cereal & Food Industry, 2023, 30(2): 24−26.
[5] QI L W, ZHANG H R, GUO Y J, et al. A novel calcium-binding peptide from bovine bone collagen hydrolysate and chelation mechanism and calcium absorption activity of peptide-calcium chelate[J]. Food Chemistry,2023,410:135387. doi: 10.1016/j.foodchem.2023.135387
[6] 胡冠华, 王德宝, 苏琳, 等. 食源性钙螯合肽的研究概况[J]. 食品与发酵工业,2021,47(3):224−229. [HU G H, WANG D B, SU L, et al. Research progress on food-derived calcium chelating peptides[J]. Food and Fermentation Industries,2021,47(3):224−229.] HU G H, WANG D B, SU L, et al. Research progress on food-derived calcium chelating peptides[J]. Food and Fermentation Industries, 2021, 47(3): 224−229.
[7] HUANG M, ZHAO X, MAO Y H, et al. Metabolite release and rheological properties of sponge cake after in vitro digestion and the influence of a flour replacer rich in dietary fibre[J]. Food Research International,2021,144:110355. doi: 10.1016/j.foodres.2021.110355
[8] SUN S W, LIU F, LIU G, et al. Effects of casein phosphopeptides on calcium absorption and metabolism bioactivity in vitro and in vivo[J]. Food & Function,2018,9(10):5220−5229.
[9] 王青华, 赵征. 酪蛋白磷酸肽(CPPs)的开发趋势及应用前景[J]. 食品研究与开发,2007,28(5):146−149. [WANG Q H, ZHAO Z. Tendency and application of casein phosphopetides[J]. Food Research and Development,2007,28(5):146−149.] WANG Q H, ZHAO Z. Tendency and application of casein phosphopetides[J]. Food Research and Development, 2007, 28(5): 146−149.
[10] 丁莉莎, 张永忠. 超声波法混合蛋白酶水解酪蛋白制备酪蛋白磷酸肽的研究[J]. 中国乳品工业,2007,35(11):12−14,56. [DING L S, ZHANG Y Z. Study of producing CPPs by the Hydrolysis of Casein by hydrolyzing casein with Ultrasound[J]. China Dairy Industry,2007,35(11):12−14,56.] doi: 10.3969/j.issn.1001-2230.2007.11.003 DING L S, ZHANG Y Z. Study of producing CPPs by the Hydrolysis of Casein by hydrolyzing casein with Ultrasound[J]. China Dairy Industry, 2007, 35(11): 12−14,56. doi: 10.3969/j.issn.1001-2230.2007.11.003
[11] 许涌捷, 王冠华, 伍昌军, 等. 奶渣酪蛋白特性及营养价值分析[J]. 食品研究与开发,2022,43(23):24−33. [XU Y J, WANG G H, WU C J, et al. Analysis of properties and nutritional value of milk residue casein[J]. Food Research and Development,2022,43(23):24−33.] doi: 10.12161/j.issn.1005-6521.2022.23.004 XU Y J, WANG G H, WU C J, et al. Analysis of properties and nutritional value of milk residue casein[J]. Food Research and Development, 2022, 43(23): 24−33. doi: 10.12161/j.issn.1005-6521.2022.23.004
[12] 申勇涛, 原恺, 霍乃蕊, 等. 高钙含量肽钙螯合物的制备与表征分析[J]. 山西农业大学学报(自然科学版),2018,38(5):50−56. [SHEN Y T, YUAN K, HUO N R, et al. Preparation and characterization analysis of peptide-calcium chelation with high calcium content[J]. Journal of Shanxi Agricultural University(Natural Science Edition),2018,38(5):50−56.] SHEN Y T, YUAN K, HUO N R, et al. Preparation and characterization analysis of peptide-calcium chelation with high calcium content[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2018, 38(5): 50−56.
[13] 陈雪香, 罗珍, 刘飞, 等. 酪蛋白磷酸肽的质量评价方法研究[J]. 食品工业科技,2012,33(8):75−77,82. [CHEN X X, LUO Z, LIU F, et al. Study on the quality evaluation method on casein phosphopeptide (CPP) products[J]. Science and Technology of Food Industry,2012,33(8):75−77,82.] CHEN X X, LUO Z, LIU F, et al. Study on the quality evaluation method on casein phosphopeptide (CPP) products[J]. Science and Technology of Food Industry, 2012, 33(8): 75−77,82.
[14] 郭斌, 刘飞, 李双祁, 等. 高效液相色谱法测定奶粉中酪蛋白磷酸肽的含量[J]. 食品工业,2018,39(2):305−310. [GUO B, LIU F, LI S Q, et al. Determination of casein phosphopeptides in milk powder by high performance liquid chromatography[J]. The Food Industry,2018,39(2):305−310.] GUO B, LIU F, LI S Q, et al. Determination of casein phosphopeptides in milk powder by high performance liquid chromatography[J]. The Food Industry, 2018, 39(2): 305−310.
[15] 刘果. 酪蛋白磷酸肽制备、鉴定、促钙吸收活性及机理研究[D]. 广州:华南农业大学, 2018. [LIU G. Study on preparation, identification, calcium absorption promoting activity and mechanism of casein phosphopeptide[D]. Guangzhou:South China Agricultural University, 2018.] LIU G. Study on preparation, identification, calcium absorption promoting activity and mechanism of casein phosphopeptide[D]. Guangzhou: South China Agricultural University, 2018.
[16] 王俊强, 孔祥珍, 华欲飞, 等. 大豆肽钙螯合物的制备、稳定性及表征[J]. 中国油脂,2019,44(10):46−50. [WANG J Q, KONG X Z, HUA Y F, et al. Preparation, stability and characterization of calcium-binding peptides from soybean meal[J]. China Oils and Fats,2019,44(10):46−50.] WANG J Q, KONG X Z, HUA Y F, et al. Preparation, stability and characterization of calcium-binding peptides from soybean meal[J]. China Oils and Fats, 2019, 44(10): 46−50.
[17] 焦宇知, 王璋. 中、高N/P(摩尔比)酪蛋白磷酸肽的生产工艺研究[J]. 食品与机械,2004,20(5):9−11. [JIAO Y Z, WANG Z. Investigation on technologies to produce CPP products with middle and higher N/P(molar ratio)[J]. Food & Machinery,2004,20(5):9−11.] JIAO Y Z, WANG Z. Investigation on technologies to produce CPP products with middle and higher N/P(molar ratio)[J]. Food & Machinery, 2004, 20(5): 9−11.
[18] 赵利, 王璋, 许时婴, 等. Alcalase在酪蛋白磷酸肽生产中的应用研究[J]. 中国奶牛,2002,1(5):13−16. [ZHAO L, WANG Z, XU S Y, et al. Studies on the application of Alcalase in the production of casein phosphopeptide[J]. China Dairy Cattle,2002,1(5):13−16.] ZHAO L, WANG Z, XU S Y, et al. Studies on the application of Alcalase in the production of casein phosphopeptide[J]. China Dairy Cattle, 2002, 1(5): 13−16.
[19] 王波, 杨继国, 任杰, 等. 酪蛋白肽电荷性质对其肽-锌螯合物的胃肠稳定性及吸收的影响[J]. 中国食品添加剂,2019,30(3):59−66. [WANG B, YANG J G, REN J, et al. Effect of charge properties of casein-derived peptides on in vitro gastrointestinal stability and absorption of zinc-peptide complexes[J]. China Food Additives,2019,30(3):59−66.] WANG B, YANG J G, REN J, et al. Effect of charge properties of casein-derived peptides on in vitro gastrointestinal stability and absorption of zinc-peptide complexes[J]. China Food Additives, 2019, 30(3): 59−66.
[20] 冯思敏, 王晶, 王羽莹, 等. 珍珠肽螯合钙的制备与性质表征[J]. 食品工业科技,2022,43(1):119−126. [FENG S M, WANG J, WANG Y Y, et al. Preparation and properties of pearl peptide chelated calcium[J]. Science and Technology of Food Industry,2022,43(1):119−126.] FENG S M, WANG J, WANG Y Y, et al. Preparation and properties of pearl peptide chelated calcium[J]. Science and Technology of Food Industry, 2022, 43(1): 119−126.
[21] 齐立伟, 张鸿儒, 郭玉杰, 等. 牛骨肽钙螯合物制备、表征及其促MC3T3-E1细胞成骨活性[J]. 食品科学,2023,44(6):107−115. [QI L W, ZHANG H R, GUO Y J, et al. preparation and characterization of bovine bone peptide-calcium chelate and its promoting effect on osteogenic activity of MC3T3-E1 cells[J]. Food Science,2023,44(6):107−115.] QI L W, ZHANG H R, GUO Y J, et al. preparation and characterization of bovine bone peptide-calcium chelate and its promoting effect on osteogenic activity of MC3T3-E1 cells[J]. Food Science, 2023, 44(6): 107−115.
[22] 樊建, 郑金玲, 孙小东, 等. 肽钙螯合物LQVLEK-Ca的制备及表征分析[J]. 昆明理工大学学报(自然科学版),2021,46(6):91−97. [FAN J, ZHENG J L, SUN X D, et al. preparation and characterization of peptide calcium chelate LQVLEK-Ca[J]. Journal of Kunming University of Science and Technology(Natural Science Edition),2021,46(6):91−97.] FAN J, ZHENG J L, SUN X D, et al. preparation and characterization of peptide calcium chelate LQVLEK-Ca[J]. Journal of Kunming University of Science and Technology(Natural Science Edition), 2021, 46(6): 91−97.
[23] 徐曼, 何东平, 卫娜, 等. 酪蛋白磷酸肽持钙能力的研究[J]. 现代食品科技,2012,28(3):278−281. [XU M, HE D P, WEI N, et al. The calcium holding capacity of casein phosphopeptide[J]. Modern Food Science & Technology,2012,28(3):278−281.] XU M, HE D P, WEI N, et al. The calcium holding capacity of casein phosphopeptide[J]. Modern Food Science & Technology, 2012, 28(3): 278−281.
[24] 姜春秀, 全威, 陈洁, 等. 不同酪蛋白磷酸肽产品理化性质与持钙能力的相关性分析[J]. 食品工业科技,2021,42(18):292−299. [JIANG C X, QUAN W, CHEN J, et al. Correlation analysis between properties and calcium-holding capacity of different casein phosphopeptide products[J]. Science and Technology of Food Industry,2021,42(18):292−299.] JIANG C X, QUAN W, CHEN J, et al. Correlation analysis between properties and calcium-holding capacity of different casein phosphopeptide products[J]. Science and Technology of Food Industry, 2021, 42(18): 292−299.
[25] 李海枝, 王俊, 熊菲菲, 等. 不同钙制剂体外消化的稳定性比较及消化后的结构研究[J]. 食品与发酵工业,2021,47(7):116−122. [LI H Z, WANG J, XIONG F F, et al. Comparison of the structure and stability of different calcium preparations after digestion in vitro[J]. Food and Fermentation Industries,2021,47(7):116−122.] LI H Z, WANG J, XIONG F F, et al. Comparison of the structure and stability of different calcium preparations after digestion in vitro[J]. Food and Fermentation Industries, 2021, 47(7): 116−122.
[26] JIANG L, LI S H, WANG N, et al. Preparation of dextran-casein phosphopeptide conjugates, evaluation of its calcium binding capacity and digestion in vitro[J]. Food Chemistry,2021,352:129332. doi: 10.1016/j.foodchem.2021.129332
[27] WANG Y, BAI H S, WANG S J, et al. Casein phosphopeptide-calcium chelate:Preparation, calcium holding capacity and simulated digestion in vitro[J]. Food Chemistry,2023,401:134218. doi: 10.1016/j.foodchem.2022.134218
[28] 陶玉霞. 乳粉中钙含量测定EDTA滴定法操作探索[J]. 畜牧兽医科技信息,2022(9):26−27. [TAO Y X. Determination of calcium content in milk powder by EDTA titration method[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine,2022(9):26−27.] TAO Y X. Determination of calcium content in milk powder by EDTA titration method[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2022(9): 26−27.
[29] 郭长慧, 张娜, 刘丽洁, 等. 酪蛋白磷酸肽制备工艺参数的优化研究[J]. 中国乳品工业,2016,44(1):4−8. [GUO C H, ZHANG N, LIU L J, et al. Optimization of the preparation of casein phosphopeptides[J]. China Dairy Industry,2016,44(1):4−8.] GUO C H, ZHANG N, LIU L J, et al. Optimization of the preparation of casein phosphopeptides[J]. China Dairy Industry, 2016, 44(1): 4−8.
[30] 王思远, 赵梓月, 穆利霞, 等. 磷酸化处理对蚕蛹多肽结合钙能力的影响[J]. 食品科学技术学报,2021,39(2):103−109. [WANG S Y, ZHAO Z Y, MU L X, et al. Effect of phosphorylation on calcium-binding ability of silkworm pupa polypeptide[J]. Journal of Food Science and Technology,2021,39(2):103−109.] WANG S Y, ZHAO Z Y, MU L X, et al. Effect of phosphorylation on calcium-binding ability of silkworm pupa polypeptide[J]. Journal of Food Science and Technology, 2021, 39(2): 103−109.
[31] 解冠华. 酶水解法制备水牛乳酪蛋白磷酸肽[D]. 南昌:南昌大学, 2007. [XIE G H. Preparation of buffalo cheese protein phosphopeptide by enzymatic hydrolysis[D]. Nanchang:Nanchang University, 2007.] XIE G H. Preparation of buffalo cheese protein phosphopeptide by enzymatic hydrolysis[D]. Nanchang: Nanchang University, 2007.
[32] 王青华. 瑞士乳杆菌乳制品中酪蛋白磷酸肽的研究[D]. 天津:天津科技大学, 2008. [WANG Q H. Study on casein phosphopeptides in Lactobacillus Swiss dairy products[D]. Tianjin:Tianjin University of Science and Technology, 2008.] WANG Q H. Study on casein phosphopeptides in Lactobacillus Swiss dairy products[D]. Tianjin: Tianjin University of Science and Technology, 2008.
[33] 冯颖杰, 宗红, 诸葛斌, 等. 一种米曲霉蛋白酶的酶学性质及其在酪蛋白磷酸肽制备中的应用[J]. 微生物学通报,2015,42(11):2073−2078. [FENG Y J, ZONG H, ZHU G B, et al. Characterization of a protease from Aspergillus oryzae and application in casein phosphopeptides preparation[J]. Microbiology,2015,42(11):2073−2078.] FENG Y J, ZONG H, ZHU G B, et al. Characterization of a protease from Aspergillus oryzae and application in casein phosphopeptides preparation[J]. Microbiology, 2015, 42(11): 2073−2078.
[34] 焦宇知, 王璋. CPP(酪蛋白磷酸肽)新生产工艺研究[J]. 现代食品科技,2005(2):15−17. [JIAO Y Z, WANG Z. Research on new production technology of CPP(casein phosphopeptide)[J]. Modern Food Science & Technology,2005(2):15−17.] JIAO Y Z, WANG Z. Research on new production technology of CPP(casein phosphopeptide)[J]. Modern Food Science & Technology, 2005(2): 15−17.
[35] 赵一明. 酪蛋白非磷肽的制备及其ACE抑制活性的研究[D]. 无锡:江南大学, 2008. [ZHAO Y M. Preparation of casein non-phosphopeptide and its ACE inhibitory activity[D]. Wuxi:Jiangnan University, 2008.] ZHAO Y M. Preparation of casein non-phosphopeptide and its ACE inhibitory activity[D]. Wuxi: Jiangnan University, 2008.
[36] LAO L H, HE J, LIAO W W, et al. Casein calcium-binding peptides:Preparation, characterization, and promotion of calcium uptake in Caco-2 cell monolayers[J]. Process Biochemistry,2023,130:78−86. doi: 10.1016/j.procbio.2023.03.031
[37] 宋丽, 朱临娴, 宋璐杉, 等. 钙结合卵黄高磷蛋白磷酸肽的制备及其肽钙螯合物的结构表征[J]. 食品科学,2023,44(6):125−133. [SONG L, ZHU L X, SONG L S, et al. Preparation of calcium-binding phosvitin phosphopeptide and structural characterization of its calcium chelate[J]. Food Science,2023,44(6):125−133.] SONG L, ZHU L X, SONG L S, et al. Preparation of calcium-binding phosvitin phosphopeptide and structural characterization of its calcium chelate[J]. Food Science, 2023, 44(6): 125−133.
[38] WU X P, WANG F F, CAI X X, et al. Glycosylated peptide-calcium chelate:Characterization, calcium absorption promotion and prebiotic effect[J]. Food Chemistry,2023,403:134335. doi: 10.1016/j.foodchem.2022.134335
[39] LUO J Q, YAO X T, SOLADOYE O P, et al. Phosphorylation modification of collagen peptides from fish bone enhances their calcium-chelating and antioxidant activity[J]. LWT-Food Science and Technology,2022,155:112978. doi: 10.1016/j.lwt.2021.112978
[40] 刘玉玉, 胡筱波, 蔡晓雯, 等. 白鲢鱼皮胶原蛋白肽钙螯合物的制备及其对Caco-2细胞钙转运的影响[J]. 食品科技,2020,45(8):138−145. [LIU Y Y, HU X B, CAI X W, et al. Preparation and effect on calcium transport in Caco-2 cells of silver carp skin collagen peptide-calcium chelate[J]. Food Science and Technology,2020,45(8):138−145.] LIU Y Y, HU X B, CAI X W, et al. Preparation and effect on calcium transport in Caco-2 cells of silver carp skin collagen peptide-calcium chelate[J]. Food Science and Technology, 2020, 45(8): 138−145.
-
期刊类型引用(3)
1. 张昊彤,周雪巍,乔凯娜,武惠敏,杨瑞,张玉玉. 肽-钙螯合方式及吸收机制研究现状. 食品工业科技. 2024(19): 383-391 .  本站查看
本站查看
2. 苑贤伟,石梦园,颜如玉,任钏,李洪波,李红娟,于景华. 胶束酪蛋白复酶水解肽与钙形成螯合物的制备、表征及螯合机制. 食品科学. 2024(20): 57-64 .  百度学术
百度学术
3. 乔巍,许倩,王宇,韩雪,吕晓红,侯爱菊. 酪蛋白磷酸肽提高矿物质元素生物利用度的研究进展. 乳业科学与技术. 2024(05): 32-38 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



