Optimization of Enzymatic Hydrolysis Process for Preparing Peptides from Asini Corii Colla and Its Antioxidant Activity
-
摘要: 目的:研究酶解法制备阿胶蛋白肽的工艺条件及阿胶蛋白肽的抗氧化活性。方法:以阿胶为原料,通过酶解实验优化碱性蛋白酶Alcalase 2.4L制备阿胶蛋白肽的酶解工艺条件。以酶解pH、酶与底物比、酶解温度作为考察因素,以阿胶的水解度为指标,在单因素实验的基础上,通过正交试验确定最佳工艺条件;利用高效凝胶色谱法测定酶解前后阿胶溶液的分子量分布情况,并通过检测对ABTS+和DPPH自由基的清除率,考察酶解前后阿胶溶液的抗氧化活性,从而综合分析酶解效果;采用4种不同大小孔径的超滤膜分离阿胶蛋白肽液,研究经超滤膜分离后不同分子量阿胶蛋白肽的抗氧化活性。结果:阿胶溶液的最佳酶解条件为:pH10.5、酶与底物比9%、酶解温度63 ℃,此条件下测得阿胶酶解液的水解度为15.93%±1.32%;酶解后阿胶溶液的分子量大部分分布在5000 Da以下;当浓度为10 mg/mL时,未酶解和酶解后的阿胶蛋白肽溶液ABTS+自由基清除率分别为75.83%±0.32%和93.16%±0.21%,DPPH自由基清除率为16.93%±2.41%和39.95%±1.27%;经超滤处理获得五组不同分子量的阿胶蛋白肽(>30 kDa、10~30 kDa、3~10 kDa、1~3 kDa和<1 kDa),分析比较发现低分子量的阿胶蛋白肽抗氧化效果较好。结论:碱性蛋白酶Alcalase 2.4L能够有效制备阿胶蛋白肽,且阿胶蛋白肽具有良好的抗氧化活性。试验结果为后续开展阿胶蛋白肽的抗氧化机制研究提供科学依据。Abstract: Objective: To investigate the technological conditions and antioxidant properties of Asini Corii Colla (ACC) peptides prepared by enzymolysis. Methods: The enzymatic hydrolysis conditions of ACC protein peptide prepared by Alcalase 2.4L were optimized using ACC as raw material. On the basis of single factor experiments, orthogonal test was carried out to determine the optimum process conditions with pH, enzyme-substrate ratio and enzymolysis temperature as the factors and the degree of hydrolysis (DH) of ACC as the indexes. To comprehensively analyze the enzymatic hydrolysis effect, the molecular weight distribution of ACC solution before and after enzymatic hydrolysis was determined by high performance gel chromatography, and the antioxidant activity of ACC solution before and after enzymatic hydrolysis was investigated by detecting scavenging rates of ABTS+ and DPPH free radicals. Four kinds of ultrafiltration membranes with different pore sizes were used to separate the ACC peptide solution, and the antioxidant activity of ACC peptide with different molecular weight was studied. Results: The optimum enzymolysis conditions were pH10.5, enzyme-substrate ratio 9% and enzymolysis temperature 63 ℃. Under these conditions, the DH was 15.93%. After enzymatic hydrolysis, the molecular weight of ACC solution was mostly below 5000 Da. When the concentration was 10 mg/mL, the ABTS+ free radical scavenging rate of the ACC peptide solutions before and after enzymolysis were 75.83%±0.32% and 93.16%±0.21%, respectively. The ability of scavenging DPPH free radicals was 16.93%±2.41% and 39.95%±1.27%. Five groups of ACC peptides with different molecular weight (>30 kDa, 10~30 kDa, 3~10 kDa, 1~3 kDa and <1 kDa) were obtained by ultrafiltration. It was showed that the ACC peptides with small molecular weight had good antioxidant effects. Conclusion: Alcalase 2.4L could be effectively used for preparing CCA peptides, and the ACC peptides possess good antioxidant activities. These results would provide scientific basis for further research on the antioxidant mechanism of ACC peptide.
-
阿胶(Asini Corii Colla)为马科动物驴(Equus asinus L.)的干燥皮或鲜皮经煎煮、浓缩制成的固体胶[1]。阿胶呈长方形或方形块,黑褐色,有光泽。质硬而脆,断面光亮,光照射下呈棕色半透明,气微、味甘、性平,归肺、肝、肾经,集治疗保健于一体[2],具有治疗贫血[3]、提高免疫力[4]、抗炎[5]和美容养颜[6]等功效。阿胶含有蛋白质、肽、氨基酸,还含有丰富的微量元素[7−8],其中蛋白质含量最高,约为60%~80%[9]。阿胶中的蛋白质为胶原蛋白,具有独特的三股超螺旋结构,三条链相互平行而且由链间氢键相连,具有十分稳定的性质,一般的加工温度及短时间加热都难使其分解,很难被人体吸收,食用利用率较低[10]。因此,通过可控酶解技术将阿胶水解成蛋白肽,成为解决这一问题的关键[11−12]。
酶解是利用蛋白酶催化作用蛋白质生成氨基酸和多肽的过程,木瓜蛋白酶、嗜热菌蛋白酶、碱性蛋白酶、中性蛋白酶和肌动蛋白酶是常用的酶。其中,碱性蛋白酶能够水解肽键、酯键、酰胺键等,且价格低廉、来源广泛,被广泛应用于食品行业[13]。酶解法制备生物活性肽的优点在于工艺流程简单、提取速度快、酶解条件容易控制,制备的生物活性肽性能比较稳定,在酸性条件和较高温度条件下结构保持完整[13]。经酶解法制备的阿胶蛋白肽具有吸收快速、低耗和不饱和的特点。因此,将阿胶中大分子蛋白转换成小分子的蛋白肽,更能发挥阿胶的功效[14]。刘元涛等[15]的研究证实,酶解后的阿胶具有更好的提高小鼠免疫力的作用。Pang等[16]的研究发现,酶解后阿胶的相对分子质量减小且具有显著的补血升白作用。Wu等[17]研究发现,模拟人体消化过程酶解阿胶得到得<5000 Da的组分A和5000~8000 Da的组分B,这两种组分可以刺激贫血小鼠造血,组分A的效果优于组分B。
机体内的自由基能够与生物活性分子发生反应,引起细胞或组织的损伤。近年来,开发能够清除体内过多自由基的抗氧化剂成为食品行业的研究热点。研究证明很多动植物蛋白水解物不但具有良好的抗氧化活性而且安全、无毒,因此有关抗氧化肽的研究逐渐受到国内外学者的青睐[18]。目前,已从玉米、土豆、蛋清等多种动植物原料中分离鉴定出了抗氧化活性肽[19−20]。然而,有关阿胶蛋白肽在抗氧化功能方面的实验研究鲜有报道。因此,开展阿胶抗氧化活性蛋白肽的分离鉴定以及作用机理研究是十分必要的。
目前对抗氧化物质的体外活性评价方法主要有自由基(DPPH自由基、ABTS+自由基、超氧阴离子自由基、羟基自由基等)清除实验,脂质过氧化抑制实验和总抗氧化能力的测定等评价方法[21]。其中DPPH法具有稳定性好、灵敏度高、操作简单等优点[22];ABTS法应用广泛,简单快速,适用于常规测定。本实验基于酶标仪-微孔板,建立微量ABTS+自由基清除率和DPPH自由基清除率实验,从这两方面验证阿胶酶解物的体外抗氧化作用。利用碱性蛋白酶Alcalase 2.4L制备阿胶抗氧化肽并表征其抗氧化活性,不但能够提高阿胶的生物利用度,还有助于阿胶新型制剂的研发与生产,为我国传统中药的现代化起到积极的推动作用。
1. 材料与方法
1.1 材料与仪器
块状阿胶 东阿阿胶股份有限公司;碱性蛋白酶(Alcalase2.4L,酶活力2.4 AU-A/g) 诺维信中国总部;酪蛋白磷酸蛋白肽 上海麦克林生化科技有限公司;三氯乙酸 上海阿拉丁生化科技股份有限公司;氢氧化钠 烟台远东精细化工有限公司;盐酸 莱阳经济技术开发区精细化工厂;以上化学试剂均为分析纯;2,4,6-吡啶基三嗪、DPPH(1,1-二苯基-2-苦肼基自由基、ABTS([2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐]) 上海麦克林生化科技有限公司;谷胱甘肽(还原性) 北京索莱宝科技有限公司;过硫酸钾 北京博奥拓达科技有限公司;NaCl 北京伊诺凯科技有限公司;标准品Dextranstandards 1152 上海源叶生物科技有限公司;葡聚糖标准品5000 Da、11600 Da、23800 Da、48600 Da、80900 Da、148000 Da、273000 Da、409800 Da、667800 Da 美国西格玛奥德里奇公司(Sigma-Aldrich)。
LC-10A高效液相色谱仪 日本岛津公司;BRT105-104-102串联凝胶柱(BRT105-104-102,8×300 mm) 博瑞糖生物技术有限公司;HHW-ZICU-6OOS水浴锅 上海福玛实验设备有限公司;ZT-150高速多功能粉碎机 永康市展帆工贸有限公司;PHS-3C pH计 上海仪器电科学仪器股份有限公司;JJ-1A 300W数显电动搅拌器 金坛区西城新瑞仪器厂;XW-80A微型漩涡混合仪 上海沪西分析仪器厂有限公司;UV-1800紫外分光光度计 上海美谱达仪器有限公司;TDZ5-WS台式低速离心机 上海安亭科学仪器厂;LG-21M立式高速冷冻离心机 四川蜀科仪器有限公司;FD-1-50冷冻干燥机 北京博医康仪器有限公司;WTM-1812D多功能卷式膜小试设备 杭州沃腾膜工程有限公司;1530-00645B全自动酶标仪 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 原料预处理
用高速多功能粉碎机将块状阿胶粉碎成粉末状固体,过80目筛后,于4 ℃条件下保存备用,取部分样品参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》[23]中凯式定氮法测定阿胶中蛋白质的含量。
1.2.2 阿胶蛋白的酶解
准确称取5 g阿胶粉,溶解于120 mL水中(4%的底物浓度),80 ℃水浴炖化30 min。冷却至酶解所需温度后,用1 mol/L NaOH标准溶液调节pH到反应所需条件。加入一定量的碱性蛋白酶进行水解,酶解过程中加入1 mol/L 的NaOH标准溶液,pH范围保持在±0.05以内,并记录酶解过程中的耗碱量。水解3 h后,90 ℃水浴灭酶10 min,冷却后在4 ℃、1×104 r/min条件下离心10 min,收集上清液,用1 mol/L 的HCl标准溶液调节pH7.00备用。
1.2.3 水解度(degree of hydrolysis,DH)的测定
蛋白质的水解程度以蛋白质中的肽键断裂百分率表示,pH-stat法[24]具有操作简单、连续测定的优点,并且当pH大于6时,水解过程中加入碱的量与断裂的肽键的数量有定量的关系,因此采用该法来检测阿胶蛋白的水解度。
DH(%)=hhtot×100 h=B×Nb×1/α×1/Mp 式中:h—单位质量蛋白质中被水解的肽键的量(mmol/g);B—消耗的碱液体积,mL;Nb—碱液的浓度,mol/L;1/α—校正系数;Mp—底物中蛋白质的含量,g;htot—底物中蛋白质中的肽键总数,mmol/g(阿胶蛋白取11.1[25])。
1.2.4 酶解工艺条件优化
以水解度为评价指标,分别考察单因素实验中酶解pH、酶解温度、加酶量(酶与底物比,%)对碱性蛋白酶水解阿胶蛋白质的影响,以pH9、酶与底物比8%、酶解温度55 ℃为变量因素水平(单因素水平见表1),并在此基础上,采用正交试验对酶解工艺条件进行优化,正交试验因素水平设计见表2。
表 1 单因素水平设计Table 1. Design of single factor horizontal因素 水平 酶解pH 7 8 9 10 11 酶解温度(℃) 45 50 55 60 65 酶与底物比(%) 4 6 8 10 12 表 2 正交试验因素水平设计Table 2. Factor level of orthogonal experiment序号 因素 A酶解pH B酶与底物比(%) C酶解温度(℃) 1 1(9.5) 1(10) 1(63) 2 1 2(11) 2(60) 3 1 3(9) 3(57) 4 2(10) 2 1 5 2 1 3 6 2 3 2 7 3(10.5) 2 3 8 3 3 1 9 3 1 2 1.2.5 分子量分布的测定
精密称取样品和标准品,样品配制成5 mg/mL溶液,12000 r/min 离心10 min,上清液用0.22 μm的微孔滤膜过滤,然后将样品转置于1.8 mL进样小瓶中。色谱柱:BRT105-104-102串联凝胶柱(8×300 mm);流动相:0.05 mol/L NaCl溶液;流速:0.6 mL/min,柱温:40 ℃;进样量:20 μL;检测器:示差检测器RI-10A。
1.2.6 酶解前后抗氧化活性的测定
1.2.6.1 ABTS+自由基清除率的测定
参考王佳琦[26]的方法,用去离子水配制A液为2.45 mmol/L的K2S2O8溶液和B液为7 mmol/L的ABTS溶液,A液和B液混合均匀后,避光放置12~16 h。使用前用去离子水稀释至734 nm处的吸光度值为0.7。将未酶解和酶解后的样品配制成浓度梯度为0、2、4、6、8、10 mg/mL,空白组用去离子水代替样液。分别取浓度梯度的样品溶液50 μL于96孔板上并加入100 μL ABTS工作液,室温下放置6 min后,于734 nm读取吸光度OD值。每个样品平行测量四组数据,取平均值。
ABTS+自由基清除率(%)=Ab−AsAb×100 式中:Ab代表空白组的吸光值;As代表样品组的吸光度值。
ABTS+-谷胱甘肽标准曲线制作方法:称取0.0158 g谷胱甘肽,溶于50 mL水中,配制成1 mmol/L的谷胱甘肽标准溶液,用水稀释成浓度梯度为0.02、0.04、0.06、0.08、0.1 mmol/L的谷胱甘肽溶液,分别取50 μL各浓度的谷胱甘肽溶液与100 μL ABTS工作液反应,于734 nm读取吸光度OD值。以谷胱甘肽溶液浓度为横坐标,ABTS+自由基清除率为纵坐标绘制标准曲线。谷胱甘肽清除ABTS+自由基的标准曲线在0~0.1 mmol/L范围内浓度与吸光度呈良好的线性关系,其方程为:y=532.34x+33.98,R2=0.9016。
1.2.6.2 DPPH自由基清除率的测定
参考Xu等[27]的方法,取0.0236 g DPPH粉用甲醇溶解,转移到容量瓶中定容至100 mL,依次取100 μL甲醇溶液、100 μL浓度梯度分别为0、2、4、6、8、10 mg/mL的样品溶液(空白为甲醇溶液)100 μL的样品溶液于96孔板上,再加入100 μL DPPH溶液,避光30 min后,于515 nm下读取吸光度OD值。每个样品平行测量四组数据,取平均值。
DPPH 自由基清除率 (%)=Ab−AsAb×100 式中,Ab代表空白组的吸光值;As代表样品组的吸光度值。
DPPH-谷胱甘肽标准曲线制作方法:称取0.0158 g谷胱甘肽,溶于50 mL水中,配制成1 mmol/L的谷胱甘肽标准溶液,用水稀释成浓度梯度为0.02、0.04、0.06、0.08、0.1 mmol/L的谷胱甘肽溶液,分别取100 μL甲醇、50 μL各浓度的谷胱甘肽溶液与100 μL DPPH溶液反应,于515 nm读取吸光度OD值。以谷胱甘肽溶液浓度为横坐标,DPPH自由基清除率为纵坐标绘制标准曲线。谷胱甘肽清除DPPH自由基的标准曲线在0~0.1 mmol/L范围内浓度与吸光度呈良好的线性关系,其方程为:y=199.14x+15.807,R2=0.9863。
1.2.7 阿胶多肽的超滤分离
在室温条件下,采用截流分子量为30、10、3和1 kDa的超滤膜,对经过碱性蛋白酶酶解后的阿胶蛋白肽进行分离纯化,分别得到>30 kDa、10~30 kDa、3~10 kDa、1~3 kDa和<1 kDa的五组不同分子量的阿胶蛋白肽。在超滤分离过程中,保证流量计的流量范围在5~7 LPM,进膜压力表的压力区间为0~8 bar。分别收集不同分子量的阿胶蛋白肽,于冷冻干燥机中进行干燥,将干燥好的样品进行密封处理备用。
1.2.8 不同组分阿胶蛋白肽抗氧化活性的测定
通过ABTS+和DPPH自由基清除率的测定评价阿胶蛋白肽抗氧化活性。阿胶蛋白肽的浓度梯度为2、4、6、8、10 mg/mL。
1.3 数据处理
采用Excel 2019、Origin 2022b制图,采用SPSS 21.0 对数据进行极差分析、方差分析、显著性检验,显著性水平设置为P<0.05。
2. 结果与分析
2.1 酶解条件对阿胶蛋白质水解度的影响
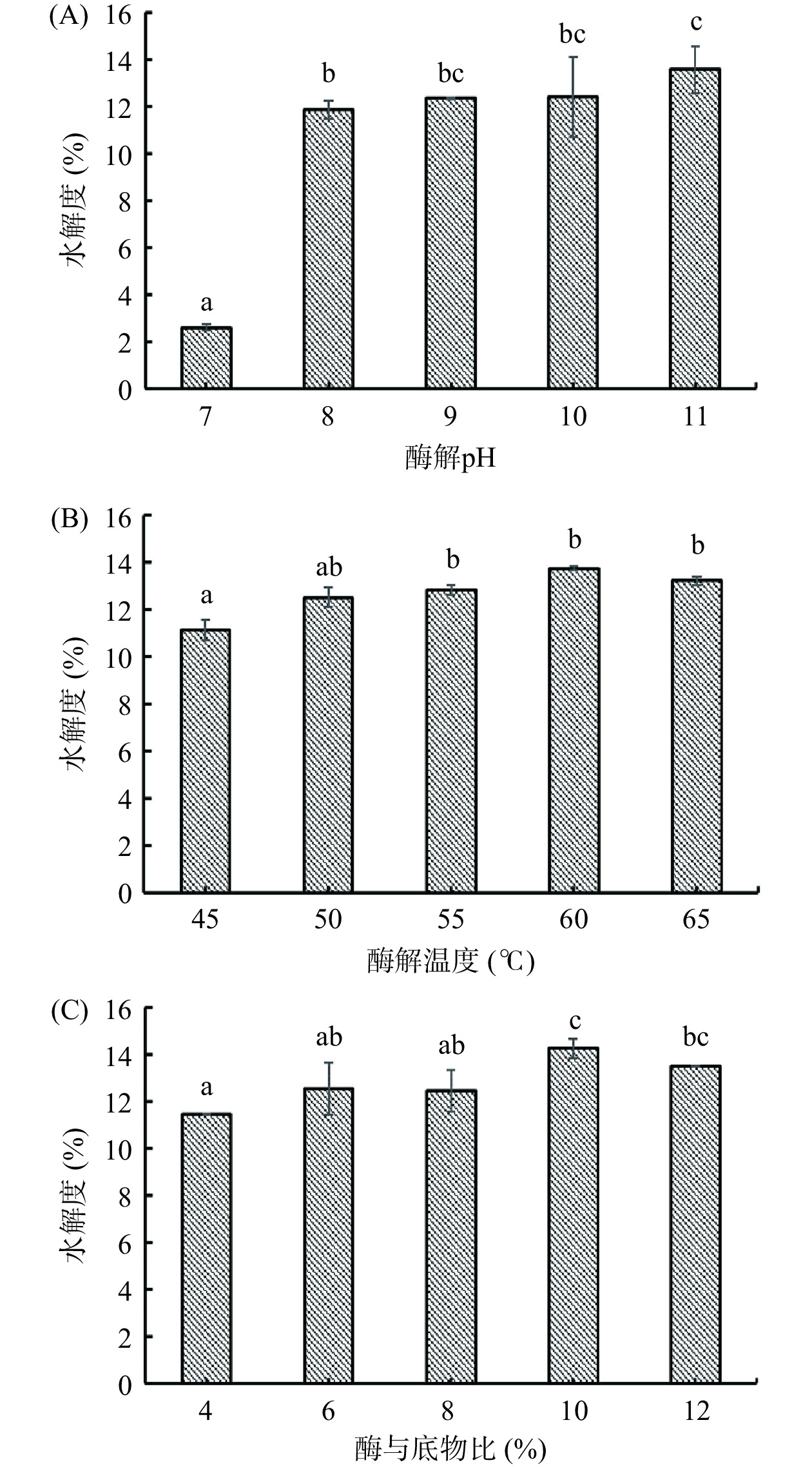
图1分别为酶解pH、酶解温度、酶与底物比对碱性蛋白酶水解阿胶蛋白质的影响。凯氏定氮法测得阿胶中蛋白质含量为74.2%,并用此数据计算水解度。由图1(A)可知,在酶解温度55 ℃、酶与底物比8%的条件下,不同酶解pH对阿胶水解度产生影响较大。阿胶的水解度随着pH的增大呈上升趋势,在pH8~10之间水解度趋于平缓,在酶解pH为11时,水解度达到最大值13.57%±0.99%。如图1(B)所示,当在酶解pH9、酶与底物比8%的条件下,随酶解温度的升高,阿胶蛋白水解度呈逐渐上升趋势,酶解温度为60 ℃时,达到最大值13.73%±0.10%,在60 ℃以后,温度升高水解度略有下降。图1(C)为碱性蛋白酶的酶与底物比(%)对阿胶蛋白质水解度的影响。在酶解pH 9、酶解温度55 ℃的条件下,阿胶蛋白水解度呈先增加后降低的趋势,当酶与底物比为10%时阿胶蛋白水解度达到最大值14.27%±0.41%。根据单因素实验结果选择的酶解正交试验因素为酶解pH10,酶解温度60 ℃及酶与底物比10%。在此参数下符合碱性蛋白酶Alcalase 2.4L的最适反应条件,且在酶解温度及酶与底物比的单因素设计中,阿胶水解度能够达到最大值,有利于下一步正交试验的开展。
2.2 正交试验优化酶解工艺
2.2.1 正交试验结果
参考刘振峰等[28]描述的极差分析法,分析试验结果。由表3可知,以水解度为指标的因素影响依次为A、C、B,即酶解pH>酶解温度>酶与底物比,最佳组合为A2B1C3,即酶解pH10,酶与底物比为9%,酶解温度为63 ℃。正交试验得出最优条件下的水解度为13.937%,并不是最大值,经验证最优条件为酶解pH10.5、酶与底物比9%、酶解温度为63 ℃,此条件下阿胶蛋白的水解度为15.93%±1.32%。
表 3 正交试验结果Table 3. Results of orthogonal experimental
实验号因素 水解度(%) A 酶解pH B 酶与底物比 C 酶解温度 1 1 2 3 14.252 2 1 3 2 14.340 3 1 1 1 14.121 4 2 3 3 15.388 5 2 2 1 15.330 6 2 1 2 15.119 7 3 3 1 14.354 8 3 1 3 15.927 9 3 2 2 14.835 k1 14.238 15.082 14.602 k2 15.305 14.806 14.791 k3 15.039 14.694 15.189 R 1.068 0.388 0.587 2.3 分子量分布的测定结果
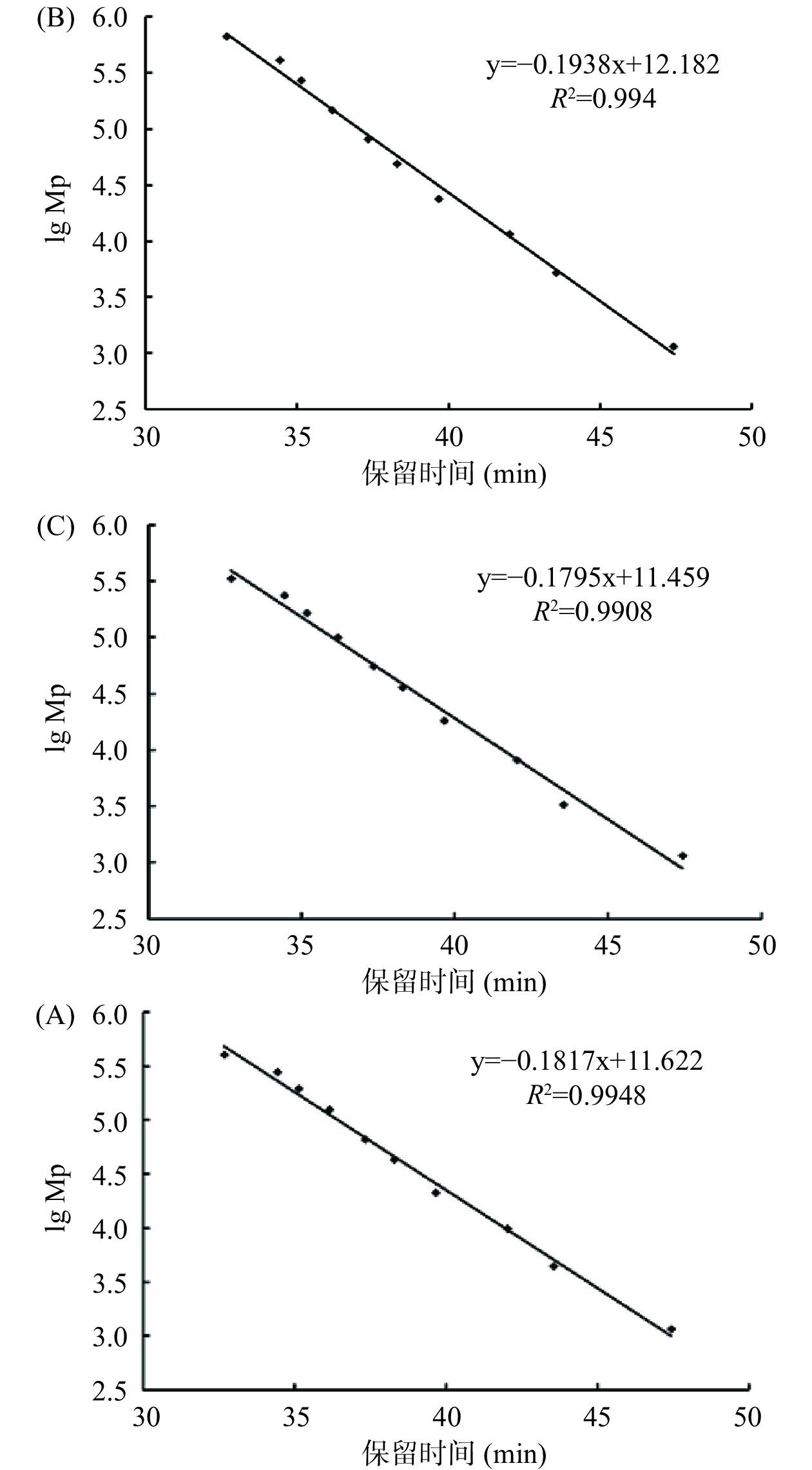
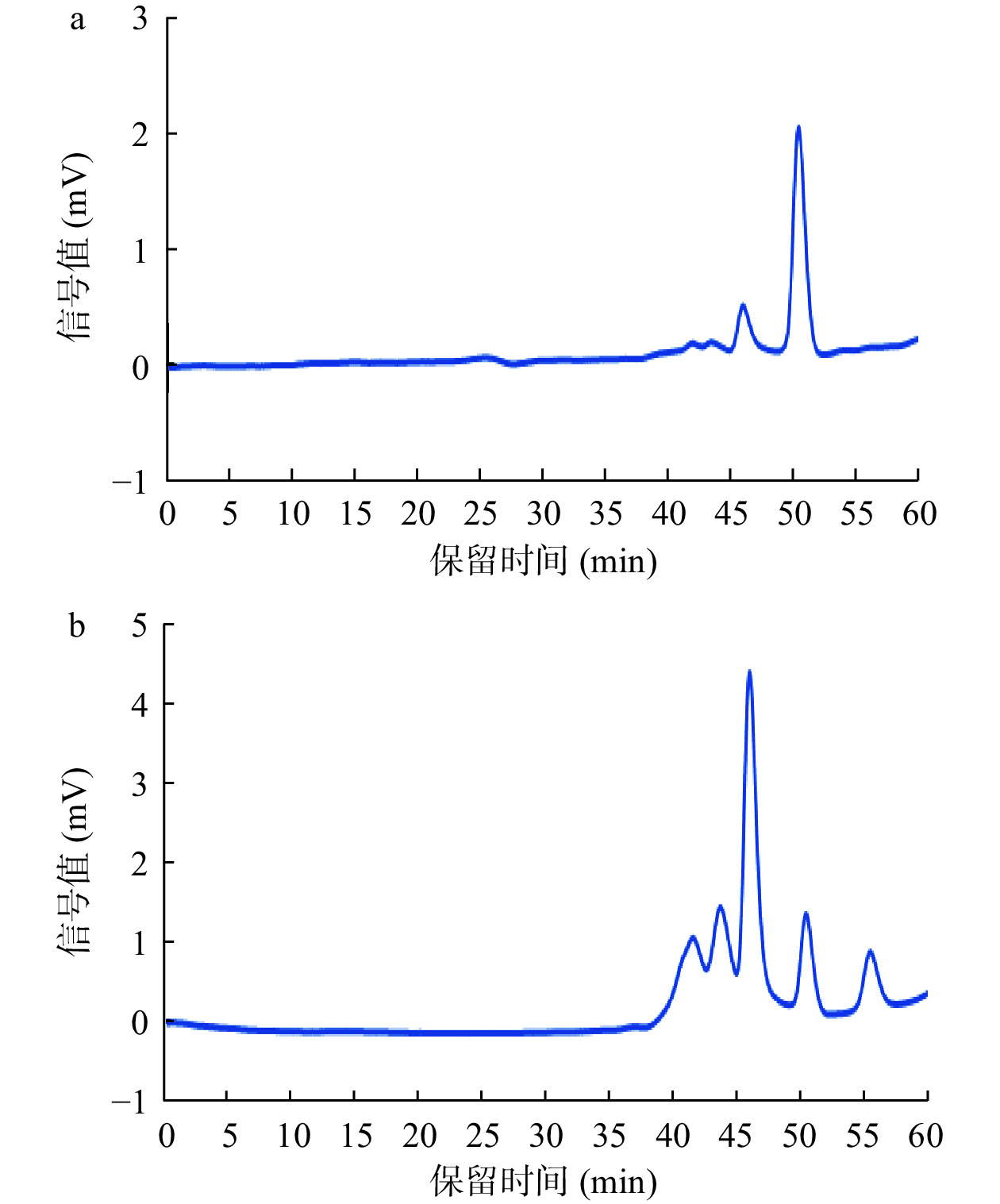
利用高效凝胶色谱法测定酶解前后阿胶蛋白溶液的分子量分布情况。图2为校正曲线。峰位分子量(lg Mp-RT)校正曲线方程为:y=−0.1817x+11.622,R2=0.9948;重均分子量(lg Mw-RT)校正曲线方程为:y=−0.1938x+12.182,R2=0.994;数均分子量(lg Mn-RT)校正曲线方程为:y=−0.1795x+11.459,R2=0.9908;根据标准品曲线可计算出样品的分子量大小。如图3所示,酶解前阿胶溶液的出锋保留时间为41.5、43.5、50.5 min(46.0 min为流动相的峰),根据标准曲线测定结果,经回归方程计算发现其分子量绝大部分分布在5000 Da以上;经酶解后阿胶溶液在保留时间55.5 min出现了新的峰,分子量为16 Da,且分子量5000 Da以下的物质增多。结果表明,经过碱性蛋白酶的处理,阿胶大分子蛋白或多肽被进一步水解,分子量减小。阿胶分子质量的降低能够使其具有较好的溶解性,机体更容易消化吸收,从而提高了阿胶的生物利用度[29]。
2.4 抗氧化活性结果分析
2.4.1 阿胶酶解前后抗氧化活性
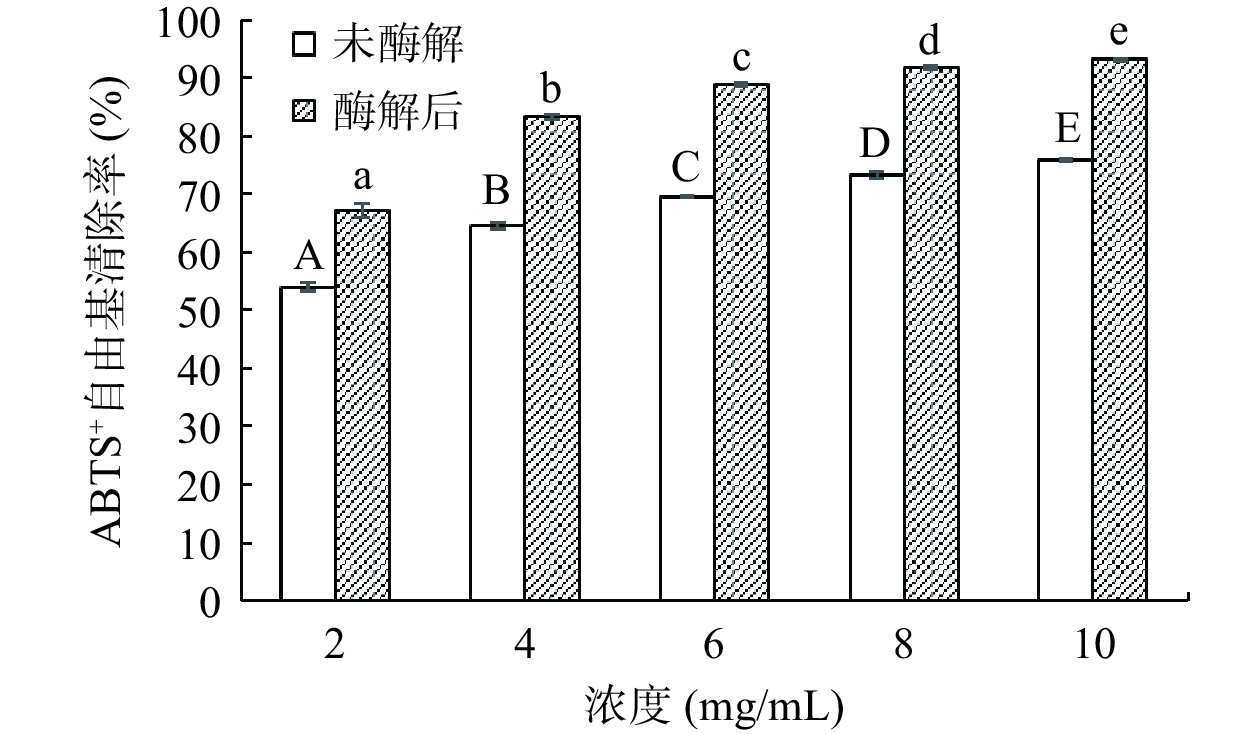
阿胶未酶解和酶解后的ABTS+自由基清除率见图4。阿胶未酶解和酶解后的ABTS+自由基清除率的趋势相同。在浓度为0~10 mg/mL之间具有量效关系,且具有统计学显著差异(P<0.05);ABTS+自由基清率随溶液浓度的增大逐渐升高;在浓度为10 mg/mL时,未酶解阿胶和酶解后的阿胶蛋白肽溶液清除ABTS+自由基的能力达到最高,分别为75.83%±0.32%和93.16%±0.21%。由图4可见,所有同等剂量下阿胶酶解液的ABTS+自由基清除率均高于未酶解的阿胶溶液,与樊雨梅等[30]的结果一致。Oh等[31]的研究表明,产生这一结果的原因是蛋白原料的酶解产物对ABTS+自由基的清除率与其蛋白原料中的酪氨酸、色氨酸、半胱氨酸、蛋氨酸等抗氧化氨基酸的含量高度相关。
![]() 图 4 酶解处理对阿胶蛋白肽的ABTS+自由基清除率的影响注:不同字母表示同一酶解条件下数据差异显著,P<0.05;图5同。Figure 4. Effects of enzymatic hydrolysis on ABTS+ radical scavenging rate of donkey hide gelatin peptides
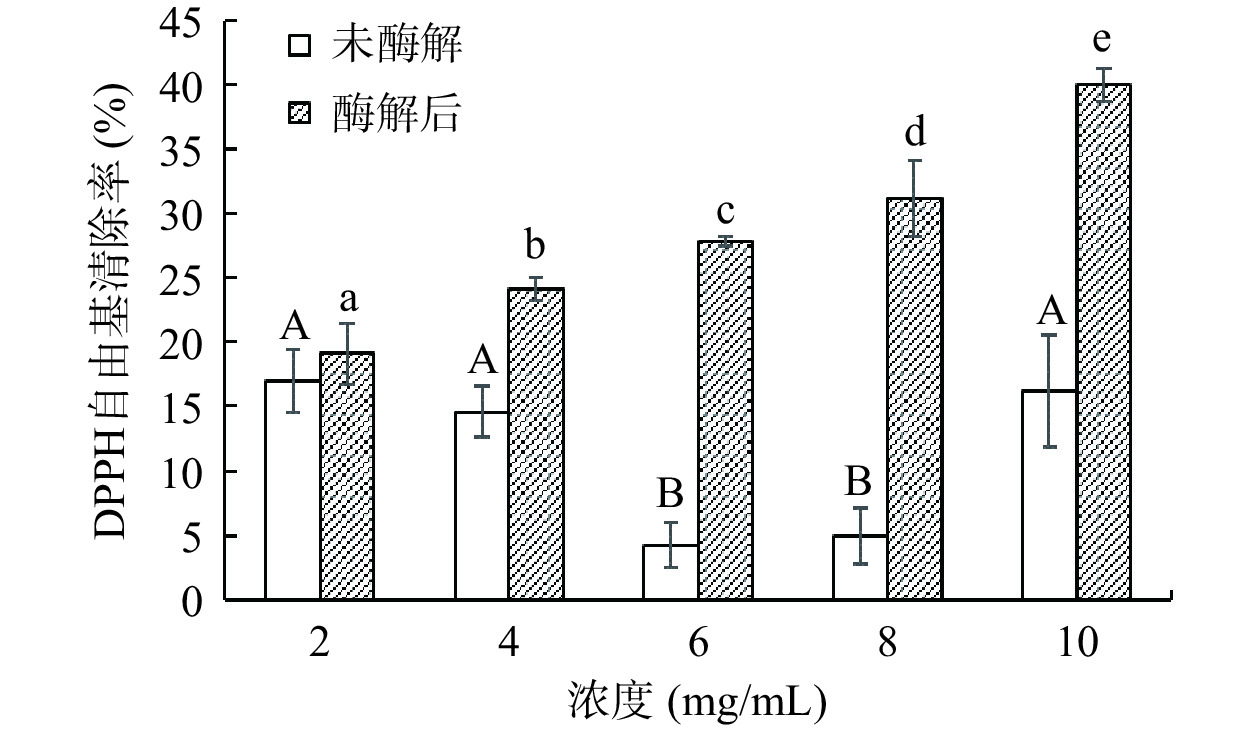
图 4 酶解处理对阿胶蛋白肽的ABTS+自由基清除率的影响注:不同字母表示同一酶解条件下数据差异显著,P<0.05;图5同。Figure 4. Effects of enzymatic hydrolysis on ABTS+ radical scavenging rate of donkey hide gelatin peptides未酶解阿胶溶液和酶解后阿胶蛋白肽的DPPH自由基清除率见图5。未酶解阿胶溶液清除DPPH自由基的趋势呈先下降后上升的趋势,在阿胶溶液浓度为2 mg/mL时,对DPPH自由基的清除率最高,为16.93%±2.41%;在阿胶溶液浓度为6 mg/mL,DPPH自由基清除率最低,为4.23%±1.74%;在溶液浓度4~6 mg/mL和8~10 mg/mL之间具有量效关系,且具有统计学显著性差异(P<0.05)。酶解后的阿胶蛋白肽对DPPH自由基的清除率呈上升趋势,在溶液浓度为10 mg/mL时,对DPPH自由基的清除率最高,为39.95%±1.27%;阿胶酶解液浓度在2~4 mg/mL之间具有量效关系,且具有显著性差异(P<0.05)。所有同等剂量下酶解后阿胶蛋白肽溶液的DPPH自由基清除率均高于未酶解的阿胶溶液,这与Wu等[32]的结果一致。
2.4.2 不同分子量阿胶蛋白肽抗氧化活性的测定结果
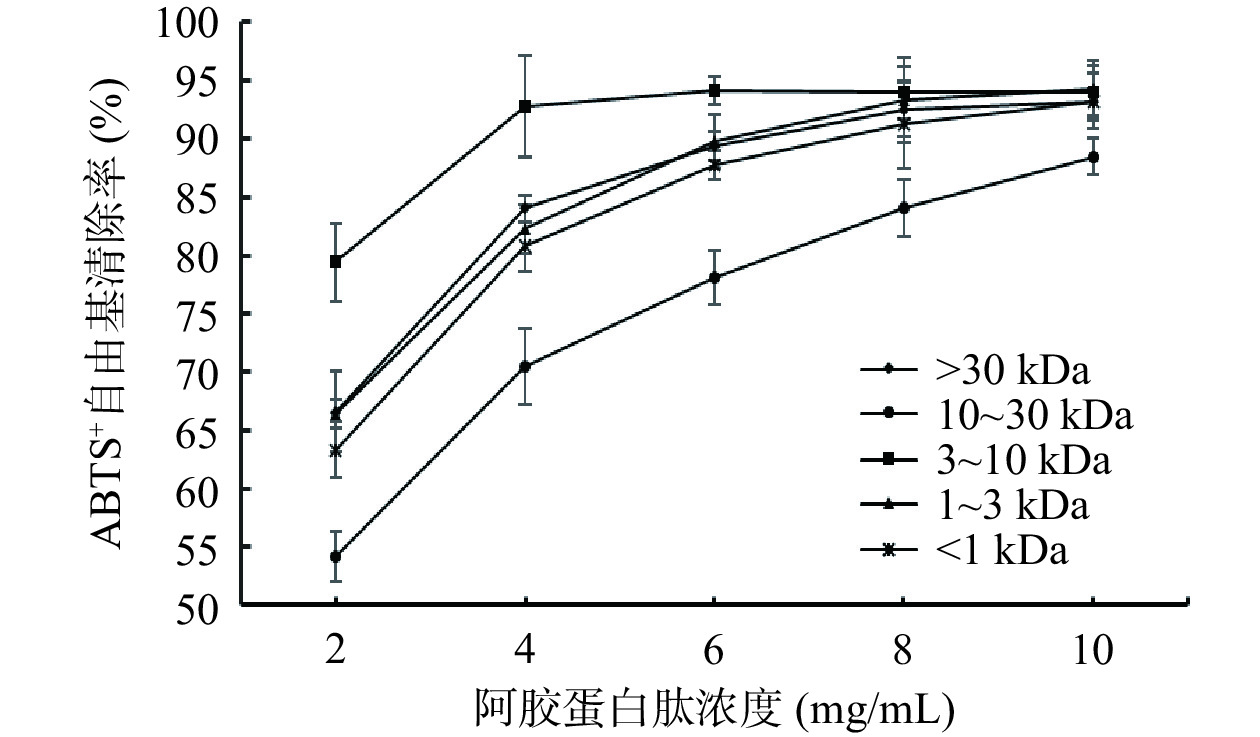
采用碱性蛋白酶酶解得到的阿胶蛋白肽,经过超滤技术将阿胶蛋白肽分离为>30 kDa、10~30 kDa、3~10 kDa、1~3 kDa和<1 kDa五个组分。不同组分阿胶蛋白肽ABTS+清除率结果如图6所示。随着阿胶蛋白肽浓度的增大,ABTS+自由基清除率也随之增大,其变化趋势与谷胱甘肽对ABTS+自由基清除效果相似。从图6可以看出,阿胶蛋白肽以高浓度存在时,其抗氧化活性高。在2~6 mg/mL浓度范围内,不同超滤组分的ABTS+自由基清除率随阿胶蛋白肽浓度增加而显著(P<0.05)升高,在6~10 mg/mL浓度范围内,自由基清除率变化趋势不明显。在10 mg/mL时不同分子量的阿胶蛋白肽清除能力最大,ABTS+自由基清除率由大到小依次为:分子量1~3 kDa,分子量3~10 kDa,分子量>30 kDa,分子量<1 kDa,分子量10~30 kDa。本研究中分子量1~3 kDa的阿胶蛋白肽在10 mg/mL浓度下具有良好的抗氧化效果,且与其他分子量的阿胶蛋白肽相比差异显著(P<0.05)。郑天芝[33]通过对茶渣抗氧化肽的研究,得出分子量1~3 kDa的茶渣抗氧化肽具有良好的抗氧化效果,与本研究的结论一致。
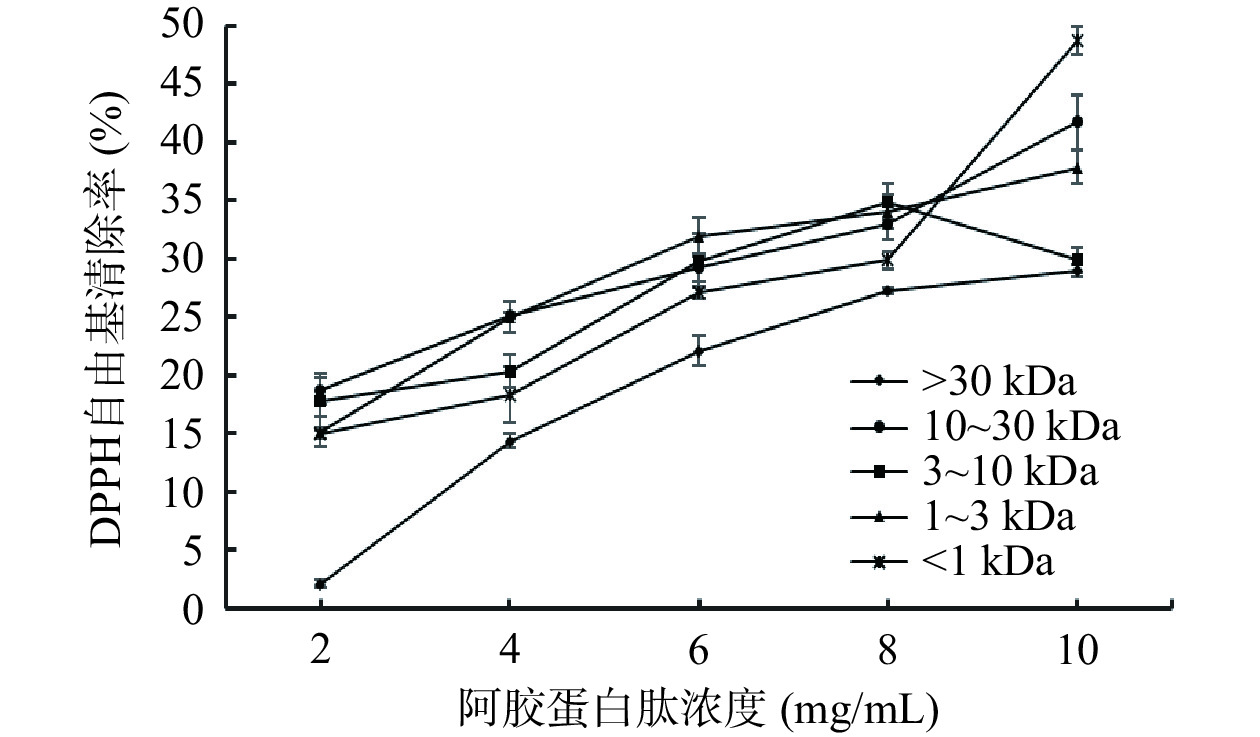
由图7可知,不同组分阿胶蛋白肽的DPPH自由基清除率随阿胶蛋白肽浓度的增加而增强,且与谷胱甘肽对DPPH自由基清除率的趋势大致相同,在2~10 mg/mL的浓度范围内具有一定的量效关系。当阿胶蛋白肽的浓度为10 mg/mL时,DPPH自由基清除率最强。其中<1 kDa的阿胶蛋白肽自由基清除率最高为48.7±21.11%,其次为分子量10~30 kDa(41.69%±3.84%),分子量1~3 kDa(37.80%±1.37%),分子量>30 kDa(28.95%±2.89%)。结果表明,在一定浓度条件下,分子量的变化对阿胶蛋白肽清除DPPH自由基的清除能力有显著影响,且分子量越小清除能力越强。低分子量的阿胶蛋白肽倾向于与DPPH自由基反应,这可能会增加多肽或氨基酸小分子去除自由基的能力。相关研究表明,在一定浓度范围内,食源性肽的分子量越低,其抗氧化活性越强[34]。例如,王宝琴[35]在对榛子抗氧化肽活性分析时发现,分子量最小的榛子抗氧化肽组分(<1 kDa)的DPPH自由基清除率最强。
3. 结论
本实验研究获得了阿胶蛋白肽的最佳酶解工艺,发现酶解后阿胶蛋白肽的抗氧化活性高于未酶解的阿胶,并且小分子的阿胶蛋白肽具有较强的ABTS+及DPPH自由基清除率,说明阿胶蛋白肽具有良好的体外抗氧化活性。然而本研究未涉及阿胶蛋白肽体内抗氧化活性的检测及抗氧化机理的探讨,这也是今后需要解决的问题及研究方向。本实验研究为后续开展阿胶蛋白肽抗氧化机理探索奠定良好基础,也为阿胶新产品的开发提供一定的理论依据。
-
图 4 酶解处理对阿胶蛋白肽的ABTS+自由基清除率的影响
注:不同字母表示同一酶解条件下数据差异显著,P<0.05;图5同。
Figure 4. Effects of enzymatic hydrolysis on ABTS+ radical scavenging rate of donkey hide gelatin peptides
表 1 单因素水平设计
Table 1 Design of single factor horizontal
因素 水平 酶解pH 7 8 9 10 11 酶解温度(℃) 45 50 55 60 65 酶与底物比(%) 4 6 8 10 12 表 2 正交试验因素水平设计
Table 2 Factor level of orthogonal experiment
序号 因素 A酶解pH B酶与底物比(%) C酶解温度(℃) 1 1(9.5) 1(10) 1(63) 2 1 2(11) 2(60) 3 1 3(9) 3(57) 4 2(10) 2 1 5 2 1 3 6 2 3 2 7 3(10.5) 2 3 8 3 3 1 9 3 1 2 表 3 正交试验结果
Table 3 Results of orthogonal experimental
实验号因素 水解度(%) A 酶解pH B 酶与底物比 C 酶解温度 1 1 2 3 14.252 2 1 3 2 14.340 3 1 1 1 14.121 4 2 3 3 15.388 5 2 2 1 15.330 6 2 1 2 15.119 7 3 3 1 14.354 8 3 1 3 15.927 9 3 2 2 14.835 k1 14.238 15.082 14.602 k2 15.305 14.806 14.791 k3 15.039 14.694 15.189 R 1.068 0.388 0.587 -
[1] 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京:中国医药科技出版社, 2015:189. [National Pharmacopoeia Committee Pharmacopoeia of the people's Republic of China (Volume I)[S]. Beijing:China Medical Science and Technology Press, 2015:189.] National Pharmacopoeia Committee Pharmacopoeia of the people's Republic of China (Volume I)[S]. Beijing: China Medical Science and Technology Press, 2015: 189.
[2] 毛跟年, 郭倩, 瞿建波, 等. 阿胶化学成分及药理作用研究进展[J]. 动物医学进展,2010,31(11):83−85. [MAO Gennian, GUO Qian, QU Jianbo, et al. Research progress on chemical constituents and pharmacological effects of donkey hide gelatin[J]. Advances in Animal Medicine,2010,31(11):83−85.] MAO Gennian, GUO Qian, QU Jianbo, et al. Research progress on chemical constituents and pharmacological effects of donkey hide gelatin[J]. Advances in Animal Medicine, 2010, 31(11): 83−85.
[3] LI Y F, ZHANG Z F, YANG L L, et al. Colla Corii Asini might upregulate ZNF471 and THOC5 by KRAB domain-containing zinc-finger protein pathway and THO complex subunit 5 pathway to improve anemia of pregnant women with β- thalassemia[J]. Annals of Hematology,2019,98(8):1813−1826. doi: 10.1007/s00277-019-03710-1
[4] LIU T T, ZHANG P P, LING Y H, et al. Protective effect of Colla Corii Asini against lung injuries induced by intratracheal instillation of artificial fine particles in rats[J]. Intermational Journal of Molecular Sciences,2018,20(1):55. doi: 10.3390/ijms20010055
[5] 张喆, 马云, 胡晶红, 等. 阿胶对气道炎症小鼠Th17/Treg亚群失衡的逆转作用[J]. 山东医药,2018,58(6):11−14. [ZHANG Zhe, MA Yun, HU Jinghong, et al. Reverse effect of donkey hide gelatin on th17/treg subgroup imbalance in mice with airway inflammation[J]. Shandong Medicine,2018,58(6):11−14.] ZHANG Zhe, MA Yun, HU Jinghong, et al. Reverse effect of donkey hide gelatin on th17/treg subgroup imbalance in mice with airway inflammation[J]. Shandong Medicine, 2018, 58(6): 11−14.
[6] KIM J S, KIM D, KIM H J, et al. Protection effect of donkey hide gelatin hydrolysates on UVB-induced photoaging of human skin fibroblasts[J]. Process Biochemistry,2018,67:118−126. doi: 10.1016/j.procbio.2018.02.004
[7] 郑筱祥, 杨勇, 叶剑锋, 等. 东阿阿胶的升白作用及机制研究[J]. 中国现代应用药学,2005,22(2):102−105. [ZHENG Xiaoxiang, YANG Yong, YE Jianfeng, et al. Study on the whitening effect and mechanism of Dong'e donkey hide gelatin[J]. China Modern Applied Pharmacy,2005,22(2):102−105.] ZHENG Xiaoxiang, YANG Yong, YE Jianfeng, et al. Study on the whitening effect and mechanism of Dong'e donkey hide gelatin[J]. China Modern Applied Pharmacy, 2005, 22(2): 102−105.
[8] 李晶峰, 边学峰, 孙佳明, 等. 基于肽键热振荡理论和酶工程技术的动物药肽类化合物研究[J]. 中国现代中药,2019,21(9):1147−1156. [LI Jingfeng, BIAN Xuefeng, SUN Jiaming, et al. Study on peptide compounds of animal medicine based on thermal oscillation theory of peptide bond and enzyme engineering technology[J]. China Modern Traditional Chinese Medicine,2019,21(9):1147−1156.] LI Jingfeng, BIAN Xuefeng, SUN Jiaming, et al. Study on peptide compounds of animal medicine based on thermal oscillation theory of peptide bond and enzyme engineering technology[J]. China Modern Traditional Chinese Medicine, 2019, 21(9): 1147−1156.
[9] 张国伟, 马俊华, 梁玉景, 等. 阿胶化学成分及保健作用研究进展[J]. 食品科技,2021,46(3):39−43. [ZHANG Guowei, MA Junhua, LIANG Yujing, et al. Research progress on chemical composition and health care function of donkey hide gelatin[J]. Food Science and Technology,2021,46(3):39−43.] ZHANG Guowei, MA Junhua, LIANG Yujing, et al. Research progress on chemical composition and health care function of donkey hide gelatin[J]. Food Science and Technology, 2021, 46(3): 39−43.
[10] 胡孝勇, 袁晓玲, 蒋寅, 等. 胶原蛋白酶解的研究进展[J]. 现代食品科技,2008,24(10):1075−1078,980. [HU Xiaoyong, YUAN Xiaoling, JIANG Yin, et al. Research progress in enzymatic hydrolysis of collagen[J]. Modern Food Technology,2008,24(10):1075−1078,980.] HU Xiaoyong, YUAN Xiaoling, JIANG Yin, et al. Research progress in enzymatic hydrolysis of collagen[J]. Modern Food Technology, 2008, 24(10): 1075−1078,980.
[11] 董洪霜, 张静娴, 胡青, 等. 胶类中药质量控制研究进展[J]. 中草药,2018,49(13):3166−3173. [DONG Hongshuang, ZHANG Jingxian, HU Qing, et al. Research progress of quality control of traditional Chinese medicine of gelatin[J]. Chinese Herbal Medicine,2018,49(13):3166−3173.] DONG Hongshuang, ZHANG Jingxian, HU Qing, et al. Research progress of quality control of traditional Chinese medicine of gelatin[J]. Chinese Herbal Medicine, 2018, 49(13): 3166−3173.
[12] 杜博玮, 徐晓冰, 郭尚伟, 等. 高抗氧化性小分子阿胶的研究[J]. 北京化工大学学报(自然科学版),2019,46(6):16−20. [DU Bowei, XU Xiaobing, GUO Shangwei, et al. Study on high antioxidant small molecule donkey-hide gelatin[J]. Journal of beijing university of chemical technology (Natural Science Edition),2019,46(6):16−20.] DU Bowei, XU Xiaobing, GUO Shangwei, et al. Study on high antioxidant small molecule donkey-hide gelatin[J]. Journal of beijing university of chemical technology (Natural Science Edition), 2019, 46(6): 16−20.
[13] 胡子聪, 于阿立, 刘香云, 等. 食物蛋白源生物活性肽的研究进展[J]. 食品工业,2022,43(6):271−276. [HU Zicong, YU Ali, LIU Xiangyun, et al. Research progress of bioactive peptides derived from food proteins[J]. Food Industry,2022,43(6):271−276.] HU Zicong, YU Ali, LIU Xiangyun, et al. Research progress of bioactive peptides derived from food proteins[J]. Food Industry, 2022, 43(6): 271−276.
[14] YU Z P, WANG Y X, SHUIAN D, et al. Identification and molecular mechanism of novel immunomodulatory peptides from gelatin hydrolysates:molecular docking, dynamic simulation, and cell experiments[J]. Journal of Agricultural and Food Chemistry,2023,71(6):2924−2934. doi: 10.1021/acs.jafc.2c06982
[15] 刘元涛, 张惠惠, 王升光, 等. 阿胶仿生酶解前后提高免疫力作用对比研究[J]. 时珍国医国药,2016,27(9):2158−2160. [LIU Yuantao, ZHANG Huihui, WANG Shengguang, et al. Comparative study on immune enhancement effect of donkey-hide gelatin before and after bionic enzymolysis[J]. Shizhen Traditional Chinese Medicine,2016,27(9):2158−2160.] LIU Yuantao, ZHANG Huihui, WANG Shengguang, et al. Comparative study on immune enhancement effect of donkey-hide gelatin before and after bionic enzymolysis[J]. Shizhen Traditional Chinese Medicine, 2016, 27(9): 2158−2160.
[16] PANG M M, LI M, TIAN C Y, et al. Distribution of relative molecular mass of asini colla hydrolyzate and investigation of its blood enrichment and leukogenic effect[J]. Chinese Journal of Experimental Traditional Medical Formulae,2017,23(12):13−17.
[17] WU H Z, YANG F, CUI S Y, et al. Hematopoietic effect of fractions from the enzyme-digested Colla Corii Asini on mice with 5-fuorouracil induced anemia[J]. The American Journal of Chinese Medicine,2007,35(5):853−866. doi: 10.1142/S0192415X07005326
[18] SU G W, ZHENG L, CUI C, et al. Characterization of antioxidant activity and volatile compounds of Maillard reaction products derived from different peptide fractions of peanut hydrolysate[J]. Food Research International,2011,44(10):3250−3258. doi: 10.1016/j.foodres.2011.09.009
[19] PUCHALSKA P, MARINA M L, GARCÍA M C. Isolation and identification of antioxidant peptides from commercial soybean-based infant formulas[J]. Food Chemistry,2014,148:147−154. doi: 10.1016/j.foodchem.2013.10.030
[20] XIANG N, LYU Y, ZHU X, et al. Effect of physicochemical properties of peptides from soy protein on their antimicrobial activity[J]. Peptides,2017,94:10−18. doi: 10.1016/j.peptides.2017.05.010
[21] 王荣, 罗倩, 冯怡. DPPH、ABTS和FRAP微量法测定山奈酚的抗氧化能力[J]. 广州化工,2021,49(3):58−59,63. [WANG Rong, LUO Qian, FENG Yi. Determination of antioxidant capacity of kaempferol by DPPH, ABTS and FRAP[J]. Guangzhou Chemical Industry,2021,49(3):58−59,63.] WANG Rong, LUO Qian, FENG Yi. Determination of antioxidant capacity of kaempferol by DPPH, ABTS and FRAP[J]. Guangzhou Chemical Industry, 2021, 49(3): 58−59,63.
[22] JIN J, LI Z, ZHANG F. Scavenging function of mulberry vinegar extractives for 1,1-diphenyl-2-picrylhydrazyl (DPPH)[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry,2006,34(3):135−137.
[23] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.5-2016 食品安全国家标准食品中蛋白质的测定[S]. 2016. [State health and Family Planning Commission of the people's Republic of China, State Food and drug administration GB 5009.5-2016 National food safety standard. Determination of protein in food [S]. 2016.] State health and Family Planning Commission of the people's Republic of China, State Food and drug administration GB 5009.5-2016 National food safety standard. Determination of protein in food [S]. 2016.
[24] ADLER-NISSEN J. Enzymic hydrolysis of food proteins[M]. London:Elsevier Applied Science Publishers,1986:12−14.
[25] 侯刚北, 张新武, 孙志伟, 等. 方便型阿胶元粉的生物复合酶酶解工艺技术研究及开发[J]. 中国酿造, 2013, 32(4):90−94. [HOU Gangbei, ZHANG Xinwu, SUN Zhiwei, et al. Research and development of bio complex enzyme hydrolysis technology of convenient ejiaoyuan powder[J] China Brewing, 2013, 32 (4):90−94.] HOU Gangbei, ZHANG Xinwu, SUN Zhiwei, et al. Research and development of bio complex enzyme hydrolysis technology of convenient ejiaoyuan powder[J] China Brewing, 2013, 32 (4): 90−94.
[26] 王佳琦. 乳清蛋白—菊粉干/湿糖基化复合物理化及抗氧化特性研究[D]. 长春:吉林大学, 2018. [WANG J Q. Study on the effects of dry/moist glycosylation on the physicochemical and antioxidant properties of whey protein-inulin complex[D]. Changchun:Jilin University, 2018.] WANG J Q. Study on the effects of dry/moist glycosylation on the physicochemical and antioxidant properties of whey protein-inulin complex[D]. Changchun: Jilin University, 2018.
[27] XU X B, GUO S W, HAO X H, et al. Improving antioxidant and antiproliferative activities of colla corii asini hydrolysates using ginkgo biloba extracts[J]. Food Science & Nutrition,2018,6(4):765−772.
[28] 刘振锋, 戴圣佳, 黄小鸣, 等. 酶法制备鱿鱼皮胶原蛋白肽工艺的条件优化[J]. 食品研究与开发,2016,37(5):72−76,217. [LIU Zhenfeng, DAI Shengjia, HUANG Xiaoming, et al. Optimization of enzymatic preparation of collagen peptide from squid skin[J]. Food Research and Development,2016,37(5):72−76,217.] doi: 10.3969/j.issn.1005-6521.2016.05.018 LIU Zhenfeng, DAI Shengjia, HUANG Xiaoming, et al. Optimization of enzymatic preparation of collagen peptide from squid skin[J]. Food Research and Development, 2016, 37(5): 72−76,217. doi: 10.3969/j.issn.1005-6521.2016.05.018
[29] YANG H, SHEN Y P, XU Y, et al. A novel strategy for the discrimination of gelatinous Chinese medicines based on enzymatic digestion followed by nano-flow liquid chromatography in tandem with orbitrap mass spectrum detection[J]. International Journal of Nanomedicine,2015,10:4947−4955.
[30] 樊雨梅, 汝文文, 史传超, 等. 阿胶低聚肽的成分分析及其抗氧化活性[J]. 食品工业科技,2020,41(18):314−318,323. [FAN Yumei, RU Wenwen, SHI Chuanchao, et al. Component analysis and antioxidant activity of donkey hide gelatin oligopeptides[J]. Food Industry Science and Technology,2020,41(18):314−318,323.] FAN Yumei, RU Wenwen, SHI Chuanchao, et al. Component analysis and antioxidant activity of donkey hide gelatin oligopeptides[J]. Food Industry Science and Technology, 2020, 41(18): 314−318,323.
[31] OH S C, KOMINE S C, WARABI E, et al. Nuclear factor (erythroid derived 2)-like 2 activation increases exercise endurance capacity via redox modulation in skeletal muscles[J]. Scientific Reports,2017,7(1):12902. doi: 10.1038/s41598-017-12926-y
[32] WU H Z, REN C Y, YANG F, et al. Extraction and identification of collagen-derived peptides with hematopoietic activity from Colla corii asini[J]. Journal of Ethnopharmacology,2016,182:129−136. doi: 10.1016/j.jep.2016.02.019
[33] 郑天芝. 茶渣多肽的制备及其活性研究[D]. 广州:华南农业大学, 2018. [ZHENG Tianzhi. Study on preparation and activity of tea -residue polypeptide[D]. Guangzhou:South China Agricultural University, 2018.] ZHENG Tianzhi. Study on preparation and activity of tea -residue polypeptide[D]. Guangzhou: South China Agricultural University, 2018.
[34] 张丰文. 纳豆抗氧化肽的分离纯化及其构效关系研究[D]. 天津:河北工业大学, 2021. [ZHANG Fengwen. Purification and molecular structure activity relationship of natto antioxidant peptides[D]. Tianjin:Hebei University of Technology, 2021.] ZHANG Fengwen. Purification and molecular structure activity relationship of natto antioxidant peptides[D]. Tianjin: Hebei University of Technology, 2021.
[35] 王宝琴. 榛子抗氧化肽的制备及产品开发[D]. 长春:吉林大学, 2019. [WANG Baoqin. Preparation and product development of antioxidant peptides from hazelnut[D]. Changchun:Jilin University, 2019.] WANG Baoqin. Preparation and product development of antioxidant peptides from hazelnut[D]. Changchun: Jilin University, 2019.
-
期刊类型引用(2)
1. 陈瑛琪,任世利,刘广志,王乐涛,李明,张翠翠,朱明月,史瑞瑞,王超. 阿胶多肽的组成及功能研究进展. 山东农业大学学报(自然科学版). 2024(02): 288-294 .  百度学术
百度学术
2. 宋露露,李云飞,刘鑫源,徐睿绮,郑郭芳,秦楠. 阿胶中驴血清白蛋白的提取纯化、功能特性及抗氧化活性分析. 食品工业科技. 2024(23): 179-188 .  本站查看
本站查看
其他类型引用(0)





 下载:
下载:
 下载:
下载:



