Study on Synthesis, Characterization and in Vitro Activity of Sweet Corncob Polysaccharide Nano-Silver
-
摘要: 纳米银(AgNPs)在生物医药领域有广泛应用,但传统物理化学方法合成纳米银存在污染及产物毒性、耗时长等问题,因此探究纳米银的制备极其重要。以甜玉米芯多糖(SCP)为原料,采用绿色方法成功合成了甜玉米芯多糖纳米银(SCP-AgNPs)并对反应条件进行优化,使用透射电子显微镜(TEM)、X射线衍射仪、X光电子能谱仪、傅里叶变换红外光谱对生成的纳米银进行表征,并对其体外抗氧化及抗糖尿病能力进行探究。结果表明:SCP-AgNPs的最佳反应条件为:溶液中硝酸银浓度为0.75×10−3 mol/L,pH为10.0,反应80 min,所制备的SCP-AgNPs呈球状,平均粒径为13.5 nm。结构表现为面心立方晶体结构,确定其中Ag为Ag0状态。合成的SCP-AgNPs有较强的体外清除自由基作用。同时,SCP-AgNPs对α-葡萄糖苷酶和α-淀粉酶这两种糖尿病标记酶的活性具有良好的抑制作用。SCP-AgNPs对糖尿病关键酶具有显著的抑制效果,具备潜在抗糖尿病活性,是一种适合纳米生物医学应用的纳米药物,未来将广泛应用于食品加工、医学等领域。Abstract: Silver nanoparticles (AgNPs) are widely used in the field of biomedicine. However, the synthesis of AgNPs by traditional physical and chemical methods has problems such as pollution, product toxicity, and time-consuming. Therefore, it is extremely important to explore the preparation of AgNPs. Silver nanoparticles (AgNPs) of sweet corncob polysaccharide (SCP-AgNPs) were successfully synthesized by green method using sweet corncob polysaccharide (SCP) as raw material and the reaction conditions were optimized. The generated AgNPs were characterized by transmission electron microscopy (TEM), X-ray diffraction, X-ray photoelectron spectroscopy and Fourier transform infrared spectroscopy, and their antioxidant and anti-diabetic abilities in vitro were investigated. The results showed that the optimum reaction conditions of SCP-AgNPs were as follows: The concentration of silver nitrate in the solution was 0.75×10−3 mol/L, the pH was 10.0, and the reaction time was 80 min. The prepared SCP-AgNPs were spherical with an average particle size of 13.5 nm. The structure showed a face-centered cubic crystal structure, and Ag was determined to be Ag0 state. The synthesized SCP-AgNPs had strong free radical scavenging effect in vitro. At the same time, SCP-AgNPs had a good inhibitory effect on the activity of α-glucosidase and α-amylase. SCP-AgNPs has a significant inhibitory effect on key enzymes of diabetes and has potential anti-diabetic activity. It is a nano-drug suitable for nano-biomedical applications and will be widely used in food processing, medicine and other fields in the future.
-
Keywords:
- sweet corncob polysaccharide /
- silver nanoparticles /
- characterize /
- antioxidation /
- antidiabetic
-
中国玉米产量位居世界第二,每年有大量玉米芯遭到遗弃。甜玉米芯多糖(SCP)是从甜玉米芯中提取出的一种水溶性多糖,此前研究表明该多糖具有体内外的抗糖基化作用[1],能够抑制小肠内葡萄糖消化酶活性[2],改善胰岛素抵抗HepG2细胞糖代谢功能[3],同时对于链脲霉素(Streptozocin,STZ)诱导糖尿病大鼠具有剂量依赖的降血糖作用[4]。将硒纳米颗粒负载于甜玉米芯多糖内形成纳米硒复合物(SCP-Se),SCP-Se能够抑制葡萄糖关键酶,维持SZT诱导的2型糖尿病小鼠血糖稳定、降低血脂并具备抗氧化功能,并通过相关通路抑制炎症,改善肠道菌群失衡,并增加中厚壁菌门丰度[5],甜玉米芯多糖是一种富有潜力的生物活性物质。
纳米银(AgNPs)由于具有其独特的理化性质,在抗糖尿病、抗氧化、抗癌、抗菌等研究方面具有广泛潜力,也应用于食品、化学、环境等领域[6],但是,传统物理、化学方法制备纳米银,存在效益低、污染环境、产物毒性等问题[7],在一定程度上限制了应用。而采用绿色方法[8],以不同类型的生物源(细菌、酵母、藻类、植物衍生物)为还原剂能够快速制备具有更高溶解度、稳定性和生物相容性的纳米银,银离子的还原与羟基和羰基的氧化是耦合的,而植物多糖有大量的羟基和羰基,有利于附着在银表面,起到稳定与保护作用[9]。因此,甜玉米芯多糖(SCP)是一种良好的还原剂,可以快速制备良性、规则、稳定的纳米颗粒,同时可以发挥其生物活性。Mahmoudi等[10]发现相较于化学合成,利用植物提取物绿色合成的纳米银对糖尿病大鼠具有更好的肝功能调节与保护作用,Jian等[11]发现以多糖为原料合成纳米银对DPPH具有较高的自由基清除活性,Ganesh等[12]发现利用花菜多糖合成纳米银对α-葡萄糖苷酶具有明显的抑制活性,但这些研究中原料多为粗提取物,对于结果分析停留于生物碱、糖类、黄酮、多酚类化合物等多种活性成分共同作用。
本文采用绿色方法,首次利用甜玉米芯多糖为原料还原硝酸银制备纳米银,相较于传统方法是一种环境友好、绿色节能方法。以从甜玉米芯中提取的水溶性甜玉米芯多糖(SCP)为还原剂与稳定剂合成甜玉米芯多糖纳米银(SCP-AgNPs)并探讨银前驱体浓度、溶液pH、反应时间对反应效率的影响。通过多种表征方法对所制得的SCP-AgNPs进行表征,最后对比了SCP-AgNPs与SCP的体外抗氧化与降血糖能力,以期为纳米银材料的制备提供新的绿色方法,也为其医疗及食品领域的应用提供一定的可能,同时也为甜玉米芯的综合开发利用提供新的思路和途径。
1. 材料与方法
1.1 材料与仪器
甜玉米芯 昊伟农业有限公司;甜玉米芯多糖(SCP) 为从甜玉米芯中经过提取并冻干后得到的水溶性多糖;硝酸银、硫酸亚铁 分析纯,上海精细化工材料研究所;氢氧化钠 分析纯,天津市天新精细化工开发中心;DPPH、ATBS 上海阿拉丁生化科技股份有限公司;α淀粉酶、α葡萄糖苷酶 酶活均为50000 U/g,山东隆科特酶制剂有限公司;所有分离用有机溶剂均为国产分析纯。
DF-101S型集热式恒温加热磁力搅拌器 上海力辰邦西仪器科技有限公司;UV-5200型紫外/可见分光光度计 上海元析仪器有限公司;Nano-ZS90型激光粒度仪 英国马尔文仪器有限公司;HWS-26型电热恒温水浴锅 上海一恒科学仪器有限公司;Lambda365型全波长自动扫描分光光度计、Spectrum Two N型傅里叶变换红外光谱仪 美国珀金埃尔默股份有限公司;CM200型透射电子显微镜 美国飞利浦公司;D8 ADVANCE型X射线衍射仪 德国布鲁克公司;Axis Ultra DLD X射线光电子能谱仪 英国克雷斯托分析仪器公司。
1.2 实验方法
1.2.1 甜玉米芯多糖(SCP)的制备
多糖提取参考文献方法并稍作修改[13],甜玉米芯筛选去除杂质后干燥粉碎过60目筛,得到甜玉米芯粉,与正己烷(1:5)混合脱脂,过滤取剩余固体(1:20)热水浸提,100 ℃提取3 h后收集上清液,随后与大孔树脂按10:1比例混合并置于50 ℃水浴30 min,对其脱色[14](D301R大孔弱碱性阴树脂法)、脱蛋白(Sevage)后加入无水乙醇以80%浓度室温静置醇沉12 h,除去上清液并对剩余醇沉物进行冷冻干燥处理,收集粉末得到甜玉米芯多糖SCP,并置于−18 ℃处储存。
1.2.2 甜玉米芯多糖纳米银绿色合成及单因素实验设计
纳米银的合成参考文献方法并稍作修改[15],称取0.3 g SCP,溶解于50 mL蒸馏水中,持续搅拌10 min使多糖充分溶解得到多糖水溶液,将50 mL多糖水溶液与50 mL硝酸银溶液等体积混合,当溶液颜色从无色变为红棕色,取3 mL溶液测定其在420 nm处附近出现紫外吸收峰,置于烘箱50 ℃避光干燥8 h,收集避光储存即得到SCP-AgNPs粉末。由于反应过程中硝酸银浓度、反应pH、反应时间等各种参数对纳米银的形状和尺寸均有显著影响[16],在上述工艺条件基础上,以SCP-AgNPs在420 nm处附近紫外吸收强度影响为指标,分别探究包括硝酸银溶液的浓度(0.25×10−3、0.5×10−3、0.75×10−3、1×10−3、1.25×10−3 mol/L),反应体系pH(4.0、6.0、8.0、10.0和12.0)和反应时间(20、40、60、80、100 min)对产物的影响,确定最佳的反应条件。
1.2.3 甜玉米芯多糖纳米银的表征
1.2.3.1 傅里叶红外光谱(FTIR)分析
采用FTIR测定法鉴定可能参与SCP-AgNPs合成和封盖的物质。在FTIR分析中,将2 mL浓度为100 μg/mL SCP-AgNPs溶液与溴化钾粉末完全混合,在干净的研钵和研杵中吸湿。SCP进行相同处理,并在400~4000 cm−1的扫描波数范围内对样品进行红外光谱分析,扫描分辨率为4 cm−1。
1.2.3.2 激光粒度仪分析
将合成的SCP-AgNPs进行聚合物分散性指数(Polymer dispersity index,PDI)和粒径评估。在扫描时间为15 s,遮光率为18%~20%,样品折射率为1.52的条件下进行测定。取2 mL 浓度为100 μg/mL SCP-AgNPs分散液放入粒径样品池中,在25 ℃条件下测定粒径分布和稳定性。
1.2.3.3 透射电子显微镜(TEM)分析
采用CM200型透射电镜(TEM)对SCP-AgNPs的形貌和微观结构进行表征。在超声器中超声10 min,超声频率30 kHz,超声功率400 W,制备了SCP-AgNPs的透射电镜样品。将一滴SCP-AgNPs溶液滴在碳涂层的铜网格上,然后暴露在红外光下(30 min)进行溶剂蒸发,加速电压为200 kV。
1.2.3.4 X射线衍射(XRD)分析
利用XRD观察SCP-AgNPs的衍射峰位置与强度以分析其晶体构型。将合成的SCP-AgNPs溶液分层在玻璃支架上并干燥。衍射角在20o~90o范围内记录衍射图,测试条件为电压40 kV,电流150 mA,靶材为Cu Kα。
1.2.3.5 X射线光电子能谱(XPS)分析
对SCP-AgNPs进行XPS窄谱扫描,激发源为Al Kα射线,工作电压为12 kV,灯丝电流为6 mA,用Avantage软件进行峰的拟合并且分析。
1.2.4 甜玉米芯多糖纳米银体外抗氧化能力测定
1.2.4.1 DPPH自由基清除能力测定
以样品对DPPH自由基的清除能力为指标判断其抗氧化活性[17]。称取适量SCP、SCP-AgNPs配制成浓度为(20、40、60、80、100 μg/mL)的SCP、SCP-AgNPs溶液;称取DPPH自由基溶于无水乙醇,配制成浓度为0.2 mmol/L DPPH 无水乙醇溶液储存于100 mL棕色容量瓶,室温避光保存备用。
参照文献报道的方法并稍作修改[18],分析SCP-AgNPs的抗氧化活性。将3组分为A0、A1、A2。A0,1 mL无水乙醇+1 mL DPPH;A1,1 mL样品溶液+1 mL DPPH;A2,1 mL样品溶液+1 mL无水乙醇。所有组混合均匀置于暗处反应30 min,测定517 nm处的吸光度,每个实验重复三次。按下列公式计算清除率,以抗坏血酸溶液为阳性对照,操作方法同样品组。DPPH自由基清除率计算见式(1):
DPPH自由基清除率(%)=A0−(A1−A2)A0×100 (1) 式中,A0为(无水乙醇+DPPH)组吸光度,A1为(样品溶液+DPPH)吸光度,A2为(样品溶液+无水乙醇)吸光度。
1.2.4.2 ABTS+自由基清除能力测定
参照文献报道的方法并稍作修改[19],分析SCP-AgNPs的抗氧化活性。将ABTS溶液与K2(SO4)2溶液按1:1混合,使用磷酸盐缓冲液进行稀释,测定其在734 nm处的吸光度达到0.70后室温避光存放16 h,得到ABTS+自由基溶液。将3组分为A0、A1、A2。A0,1 mL蒸馏水+1 mL ABTS+自由基溶液;A1,1 mL样品(样品配制浓度同1.2.4.1)溶液+1 mL ABTS+自由基溶液;A2,1 mL样品溶液+1 mL K2(SO4)2溶液。所有组混合均匀置于暗处反应60 min。于734 nm处测定样品吸光度,并进行三次重复。以抗坏血酸为阳性对照,操作方法同样品组。ABTS+自由基清除率计算见式(2):
ABTS+自由基清除率(%)=A0−(A1−A2)A0×100 (2) 式中,A0为(蒸馏水+ABTS)组吸光度,A1为样品组(样品溶液+ABTS),A2为(样品溶液+K2(SO4)2溶液)组吸光度。
1.2.4.3 羟基自由基清除能力测定
羟基自由基清除能力测定根据朱文卿等[20]的方法并稍作修改,分析SCP-AgNPs的抗氧化活性。将3组实验组分为A0、A1、A2。A0,蒸馏水+硫酸亚铁溶液+水杨酸溶液+H2O2溶液各1 mL;A1,样品溶液(样品浓度同1.2.4.1)+硫酸亚铁溶液+水杨酸溶液+H2O2溶液各1 mL;A2,样品溶液+蒸馏水+蒸馏水+无水乙醇各1 mL。所有组混合均匀后置于37 ℃水中孵育30 min,于510 nm处测定样品吸光度。每组实验重复3次,羟基自由基清除率计算见公式(3):
羟基自由基清除率(%)=A0−(A1−A2)A0×100 (3) 式中,A0为(蒸馏水+FeSO4溶液+水杨酸溶液+H2O2溶液)组吸光度,A1为(SCP-AgNPs+FeSO4溶液+水杨酸溶液+H2O2溶液)组吸光度,A2为(SCP-AgNPs+蒸馏水+蒸馏水+无水乙醇)组吸光度。
1.2.5 甜玉米芯多糖纳米银体外抗糖尿病活性
1.2.5.1 α-淀粉酶的抑制活性
根据Yang等[21]的方法并稍作修改,探究SCP-AgNPs的α-淀粉酶抑制活性。称取适量SCP、SCP-AgNPs配制浓度为(20、40、60、80、100 μg/mL)的SCP、SCP-AgNPs溶液,并配制浓度为1 U/mL α-淀粉酶溶液,将4组实验组分别命名为A1、A2、A3、A4。A1,100 μL α-淀粉酶溶液+100 μL磷酸盐缓冲液(pH6.9)。A2,200 μL磷酸盐缓冲液。A3,100 μL α-淀粉酶溶液+100 μL样品溶液。A4,100 μL样品溶液+100 μL磷酸盐缓冲液。将各组溶液混合均匀,置于37 ℃水浴10 min,水浴完成加入100 μL 1%淀粉溶液混合均匀。继续37 ℃水浴10 min。随后,加入200 μL DNS试剂。沸水浴反应10 min后,在540 nm的波长下测定吸光度。以阿卡波糖(Acarbose)为阳性对照组。每组实验重复3次,α-淀粉酶抑制率计算见公式(4):
α-淀粉酶抑制率(%)=(A1−A2)−(A3−A4)A1−A2×100 (4) 1.2.5.2 α-葡萄糖苷酶的抑制活性
根据Chen等[22]的方法并稍作修改,探究SCP-AgNPs的α-葡萄糖苷酶抑制活性。反应体系由100 μL的α-葡萄糖苷酶溶液(1 U/mL);2 mL磷酸盐缓冲液(pH6.9);50 μL样品溶液;100 μL 1 mg/mL的还原型谷胱甘肽组成,将上述溶液混合并于37 ℃水浴10 min,水浴结束后加入100 μL饱和PNPG溶液,最后加入10 mL 0.1 mol/L Na2CO3溶液终止反应,并测定在400 nm波长下吸光度值A1。不添加样品的反应体系吸光度值为A2,没有α-葡萄糖苷酶溶液的体系吸光度值为A3。以阿卡波糖(Acarbose)作为阳性对照组,每组实验重复3次,α-葡萄糖苷酶抑制率计算见公式(5):
α-葡萄糖苷酶抑制率(%)=A1−A3A2×100 (5) 1.3 数据处理
利用SPSS 26.0、Origin 95-64和Nano scope等软件进行数据处理并绘制图像,实验平行进行三次,结果以平均数±标准差表示。采用单因素方差(ANOVA)对数据进行显著性分析,以P<0.05为显著,P<0.01为极显著。
2. 结果与分析
2.1 甜玉米芯多糖纳米银绿色合成与优化
2.1.1 甜玉米芯多糖纳米银绿色合成
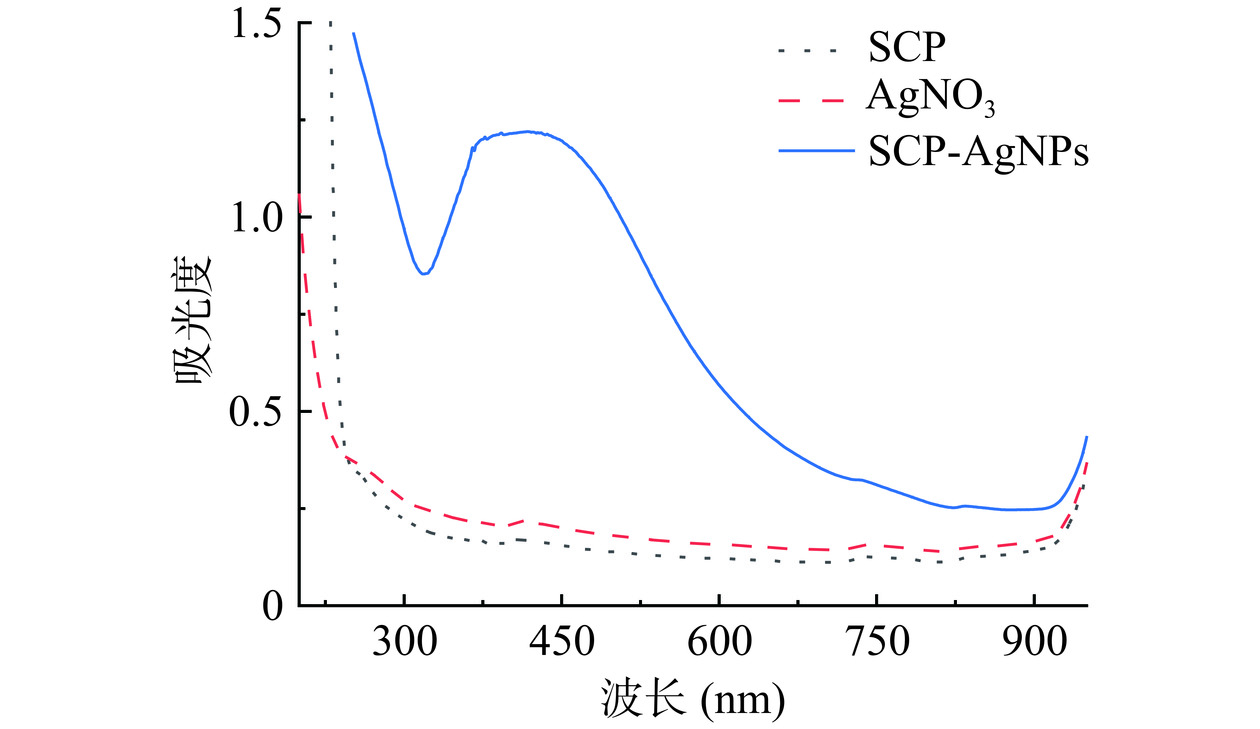
反应过程中SCP同时起到还原剂、稳定剂和修饰剂的作用,当SCP与硝酸银混合后,体系颜色由无色变为红棕色,这种颜色可能由于纳米银表面等离子体振动(Surface plasmon resonance,SPR)的激发造成的。Arago等[23]研究证实,纳米银的表面等离子体共振使得其在紫外可见光区域内有光吸收,并且在UV-Vis光谱410 nm附近会出现特征等离子体共振吸收峰。使用UV-Vis分别对SCP、AgNO3及生成的SCP-AgNPs溶液进行分析,实验结果如图1所示,发现SCP、AgNO3在410 nm处均没有波动,而SCP-AgNPs在421 nm波长处出现最大吸收峰,与形状为球形或近球形的纳米银吸光特性相同[24]。实验结果与Ibrahim等[25]利用香蕉皮提取物制备纳米银效果相同,因此初步表明SCP-AgNPs成功合成。
2.1.2 AgNO3 浓度对SCP-AgNPs合成的影响
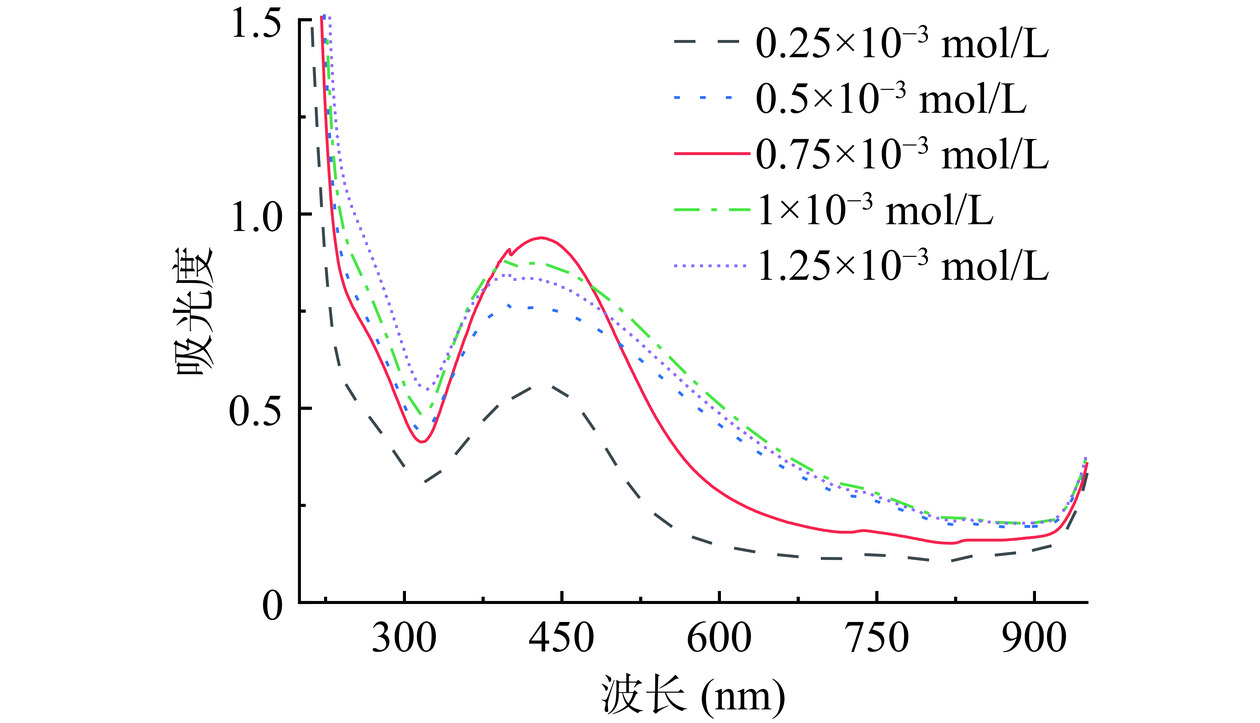
在溶液pH为10.0和反应时间为100 min的初始条件下,探究不同AgNO3浓度对SCP-AgNPs合成的影响,结果如图2所示。当AgNO3浓度低于0.75×10−3 mol/L时,随着体系中AgNO3浓度的增加,混合溶液最大吸收峰逐渐增大。当AgNO3浓度为0.75×10−3 mol/L时,紫外可见光谱显示出最大吸收峰。当AgNO3浓度继续提高时,溶液的颜色未发生明显变化但紫外吸收峰高度降低并变宽,说明生成的SCP-AgNPs粒径分布均匀性变差且SCP-AgNPs浓度降低[26]。原因可能是当AgNO3在较低浓度时,SCP与AgNO3浓度比例适中,SCP中的官能团可以立刻参与到SCP-AgNPs的合成过程中;而当AgNO3浓度超过一定范围,Ag+与SCP的官能团之间竞争加剧,不利于反应进行,阻碍了SCP-AgNPs的合成[27]。因此确定最佳的AgNO3反应浓度为0.75×10−3 mol/L。
2.1.3 溶液pH对SCP-AgNPs合成的影响
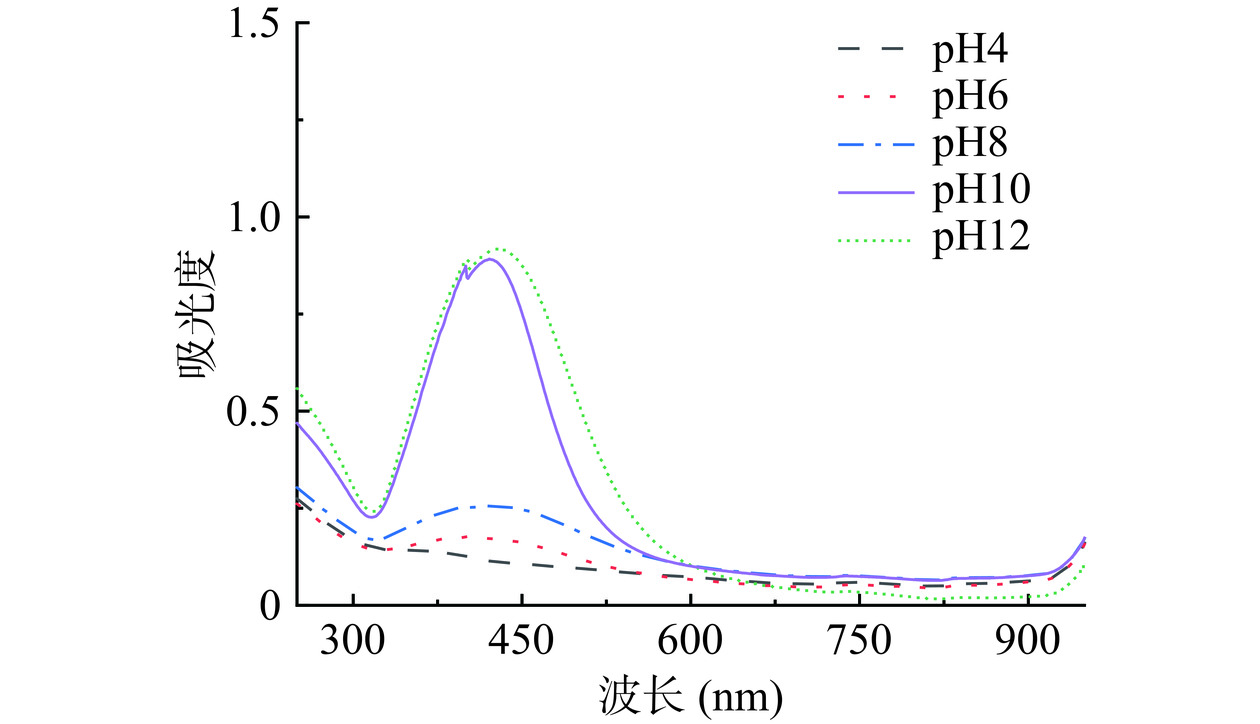
在AgNO3反应浓度为0.75×10−3 mol/L和反应时间为60 min的初始条件下,在4.0~12.0的pH范围内研究了酸碱度对SCP-AgNPs合成的影响。结果如图3所示,当pH为4.0时紫外光谱中没有出现特征吸收峰,pH为6.0时混合溶液出现一个平缓的弧形峰,这可能由于生成的SCP-AgNPs之间的负电静电斥力平衡在酸性条件下受到溶液中部分阳离子的干扰,导致纳米粒子的聚集[28]。当pH为8.0时可能由于溶液中碱性较弱,还原反应速度较慢导致生成的纳米银数量少。因此SCP-AgNPs的合成不适合在酸性及碱性较弱条件下进行。在pH10.0~12.0条件下,溶液颜色在较短时间加深,对应的最大特征吸收峰强度增加。可以看出,碱性条件更适于SCP-AgNPs的合成,但当pH达到12.0时,虽然有更多的SCP-AgNPs生成但是特征峰图像发生红移,这说明生成的SCP-AgNPs粒径逐渐增大。根据以上实验结果,选择pH为10.0作为最佳酸碱条件,获得较高产量的粒径均匀的SCP-AgNPs。
2.1.4 反应时间对SCP-AgNPs合成的影响
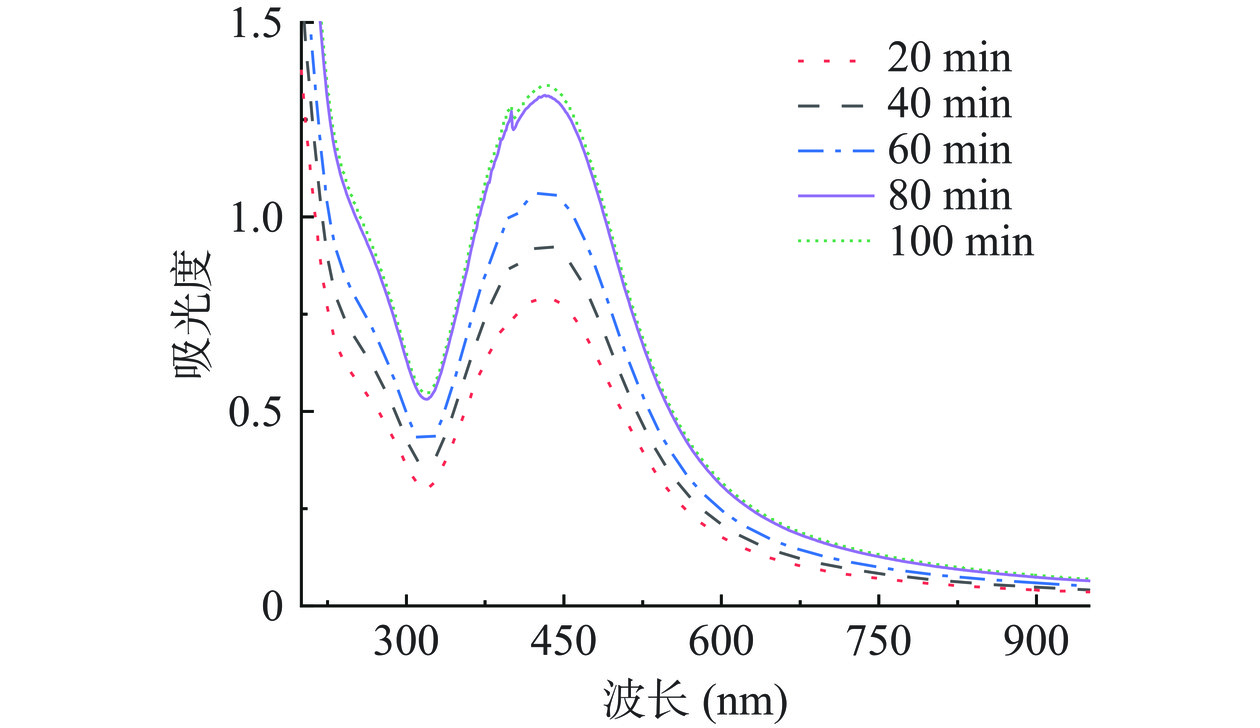
在AgNO3浓度为0.75×10−3 mol/L和溶液pH为10.0的条件下,探究不同反应时间对SCP-AgNPs合成的影响,结果如图4所示,随着反应时间的增加,溶液呈现出红棕色,吸光度值显著增加,表现为溶液颜色逐渐变深,在20~60 min时,反应速度较慢,吸光度值增加较慢。随着反应时间增加,最终在100 min时吸光度达到最大值,这说明反应生成的SCP-AgNPs数量与时间呈正比,延长反应时间能提高SCP-AgNPs的产率,第100 min时,吸光度值相较于80 min变化较小,这说明溶液中的SCP-AgNPs浓度变化较少,可能是由于SCP-AgNPs浓度过高导致发生团聚[29],且100 min时反应时间较长。因此确定最佳的反应时间为80 min,用于后续研究。
2.2 甜玉米芯多糖纳米银的表征
2.2.1 傅里叶红外光谱(FT-IR)分析
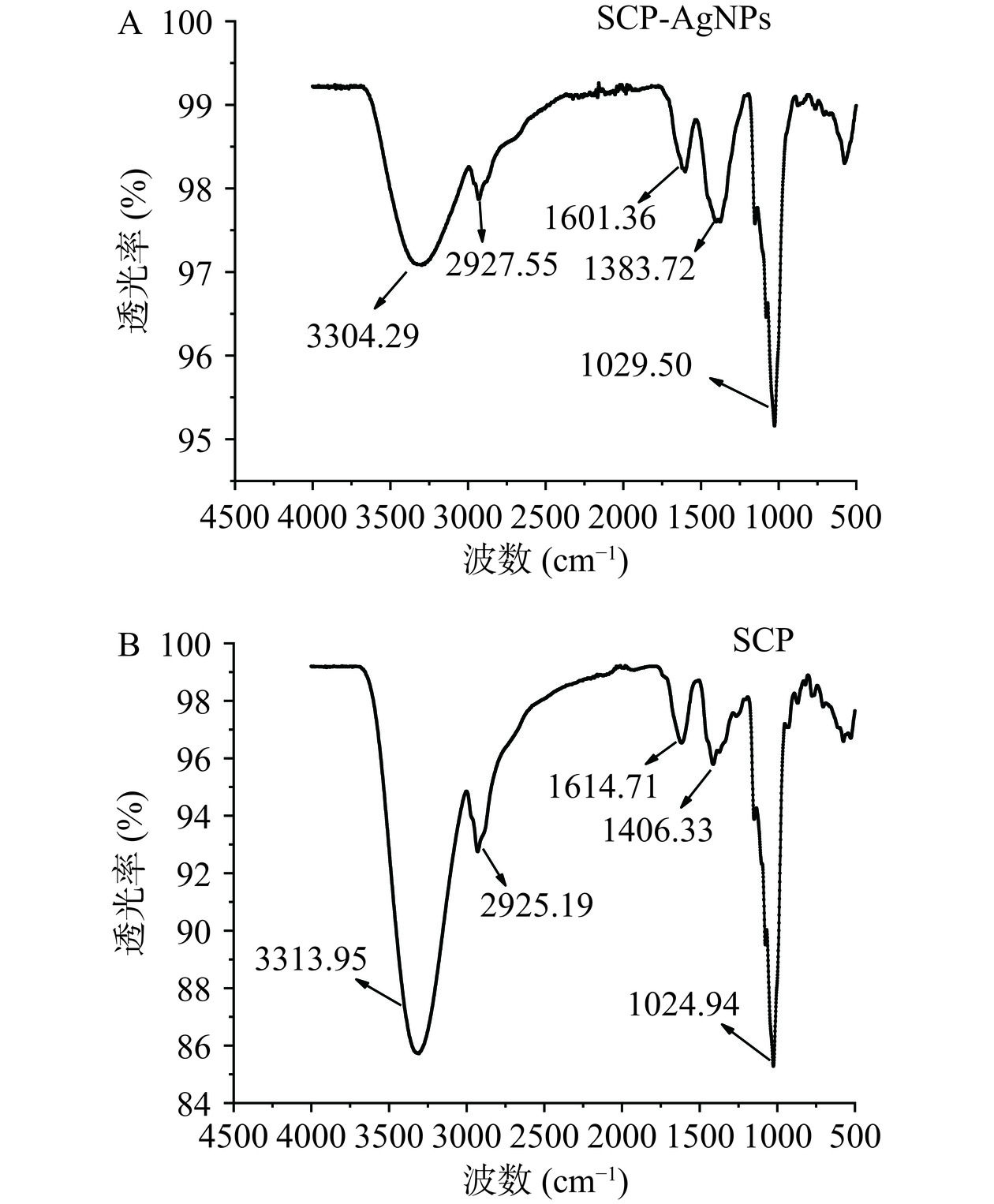
通过傅里叶变换红外光谱图分析参与SCP-AgNPs合成的化合物官能团。结果如图5所示,显示了合成的SCP-AgNPs傅里叶变换红外光图谱(A)和SCP的傅里叶变换红外光图谱(B)。SCP-AgNPs红外吸收峰位于3304.29、2927.55、1601.36、1383.72和1029.50 cm−1。3304.29 cm−1处的峰值归因于O−H基团的伸缩振动,在2927.55 cm−1处吸收峰归因于分子的不对称和对称拉伸−CH3。图谱1383.72 cm−1与1601.36 cm−1处的吸收峰表明有氨基存在[30],分别对应于N-H和C-N伸缩,表明氨基参与了还原过程。此外,SCP-AgNPs的红外特征吸收峰位置与SCP接近,说明甜玉米芯多糖溶液中多糖成分可能存在于产物表面并作为稳定剂包裹在纳米银表面,阻止纳米银粒子聚集,起到保护和稳定的作用。
2.2.2 激光粒度分析仪分析
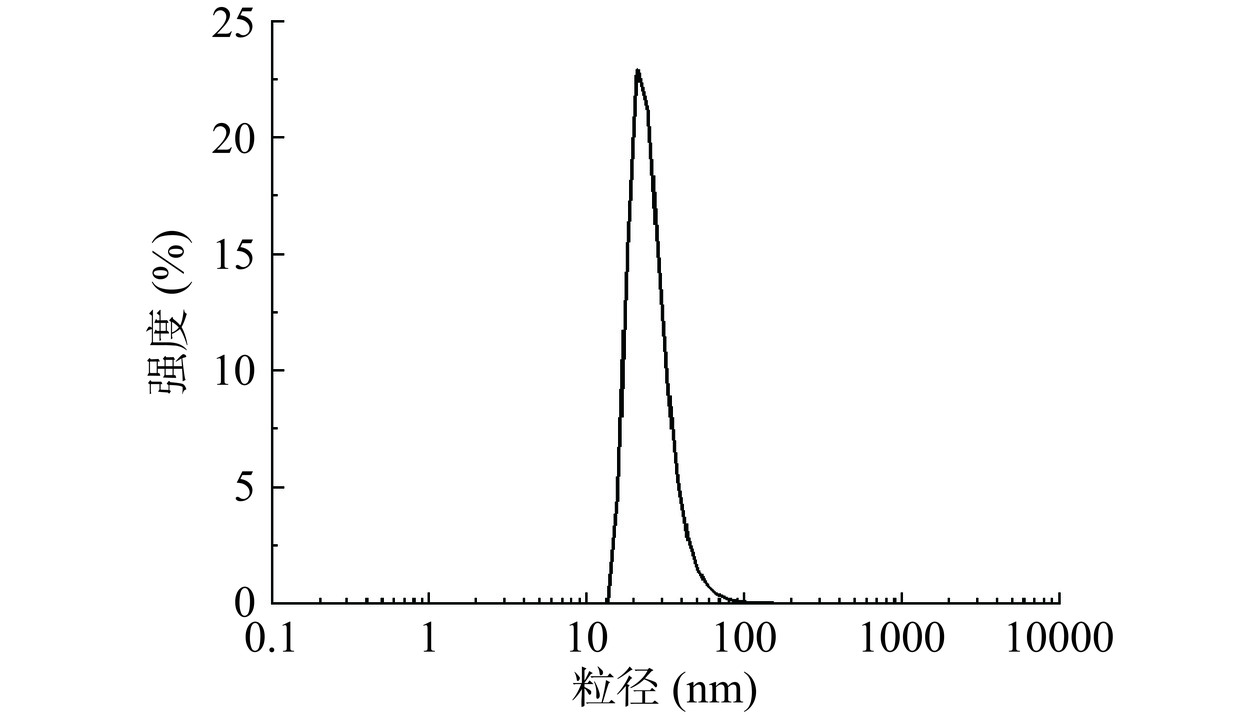
通过马尔文激光粒度仪测定SCP-AgNPs的粒径大小,结果如图6所示,SCP-AgNPs的平均水合粒径为52 nm,大于TEM测定的粒径尺寸,这是因为TEM测得的纳米粒子处于干燥状态,得到的粒径值接近纳米粒子的实际尺寸[31]。通过激光粒度仪测定得到的粒径值一方面受金属颗粒尺寸的影响,另一方面检测时溶液中的SCP成分、离子、分子和额外的水合物层会附着在SCP-AgNPs的表面,从而影响粒径的测定值[32]。其分散指数(PDI)为0.217,表明纳米颗粒分散良好[33]。
2.2.3 透射电子显微镜(TEM)分析
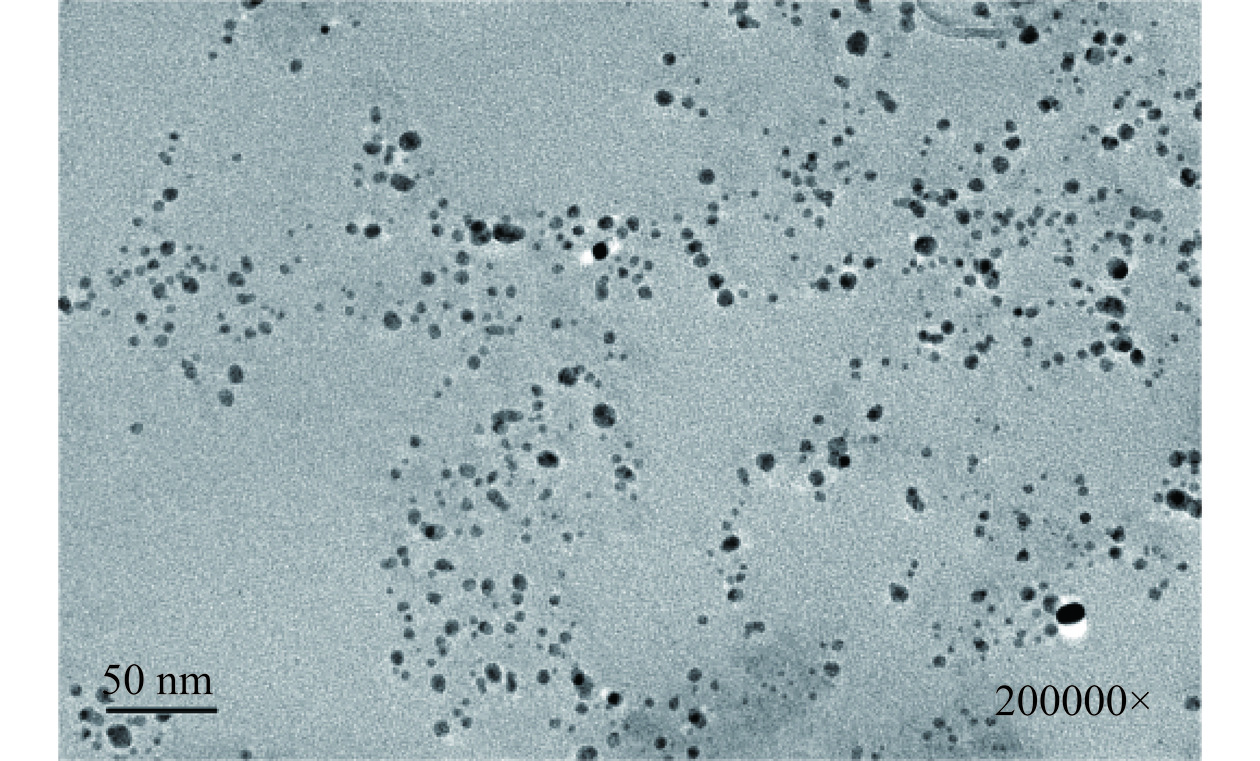
为了进一步测定SCP-AgNPs的形貌、分散状态和粒径,使用TEM对制备的SCP-AgNPs进行分析,结果如图7所示,SCP-AgNPs呈现类球形,分散均匀良好,其平均粒径为13.5 nm,团聚现象较少,分布均匀,这可能是SCP在合成过程中作为封盖剂起到稳定作用导致的。部分区域SCP-AgNPs数量多密度高,说明SCP自身具备一定的还原能力促进SCP-AgNPs合成。
2.2.4 X-射线衍射(XRD)分析
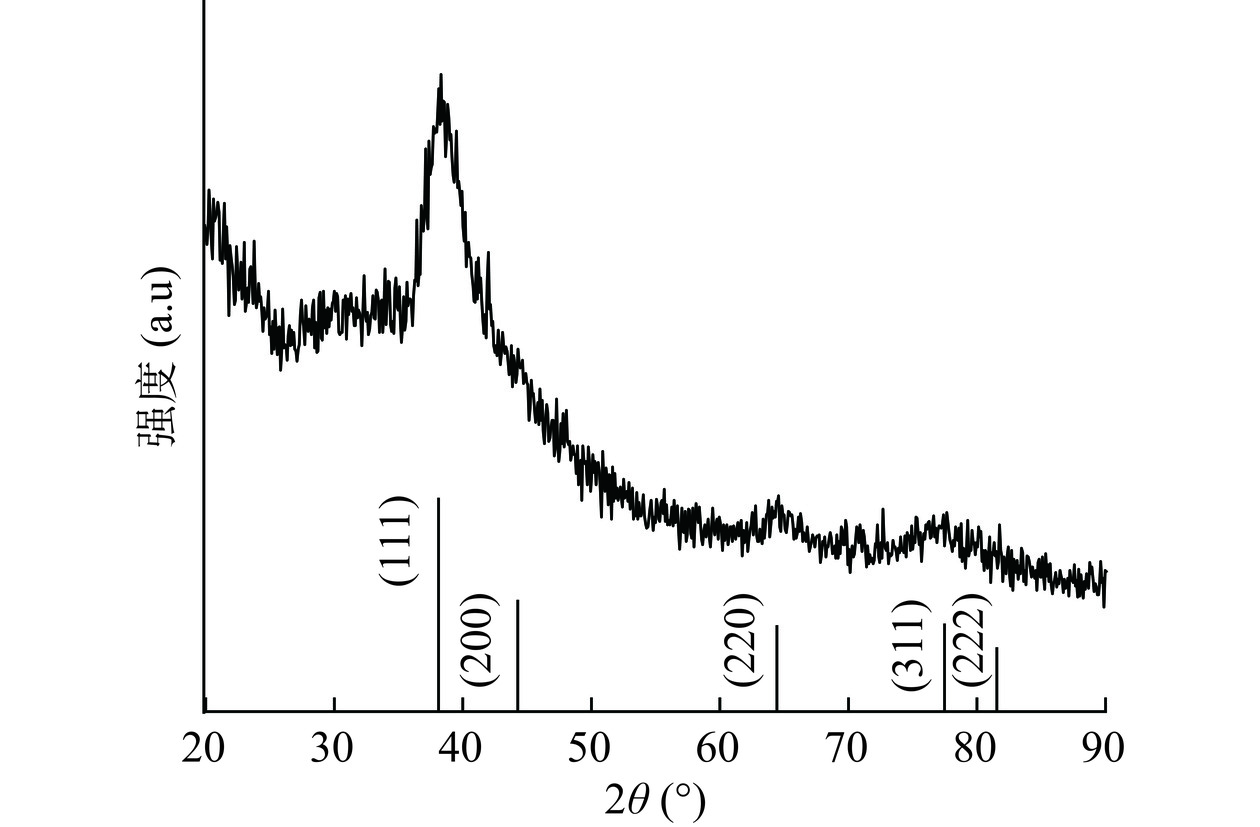
使用X射线衍射分析仪对合成物质的晶体结构进行分析,SCP-AgNPs的X射线衍射结果见图8,可以发现所制备SCP-AgNPs在2θ谱 20°到90°之间有5个较为明显的峰分别出现在38.11°、44.27°、64.42°、77.47°和81.53°处,与Ag的标准数据(JCPDS,NO:04-0783)相比,对应于(111)、(200)、(220)、(311)和(222)晶面的反射,说明了合成的SCP-AgNPs具有面心立方体结构[34],可以识别为Ag原子相关峰。
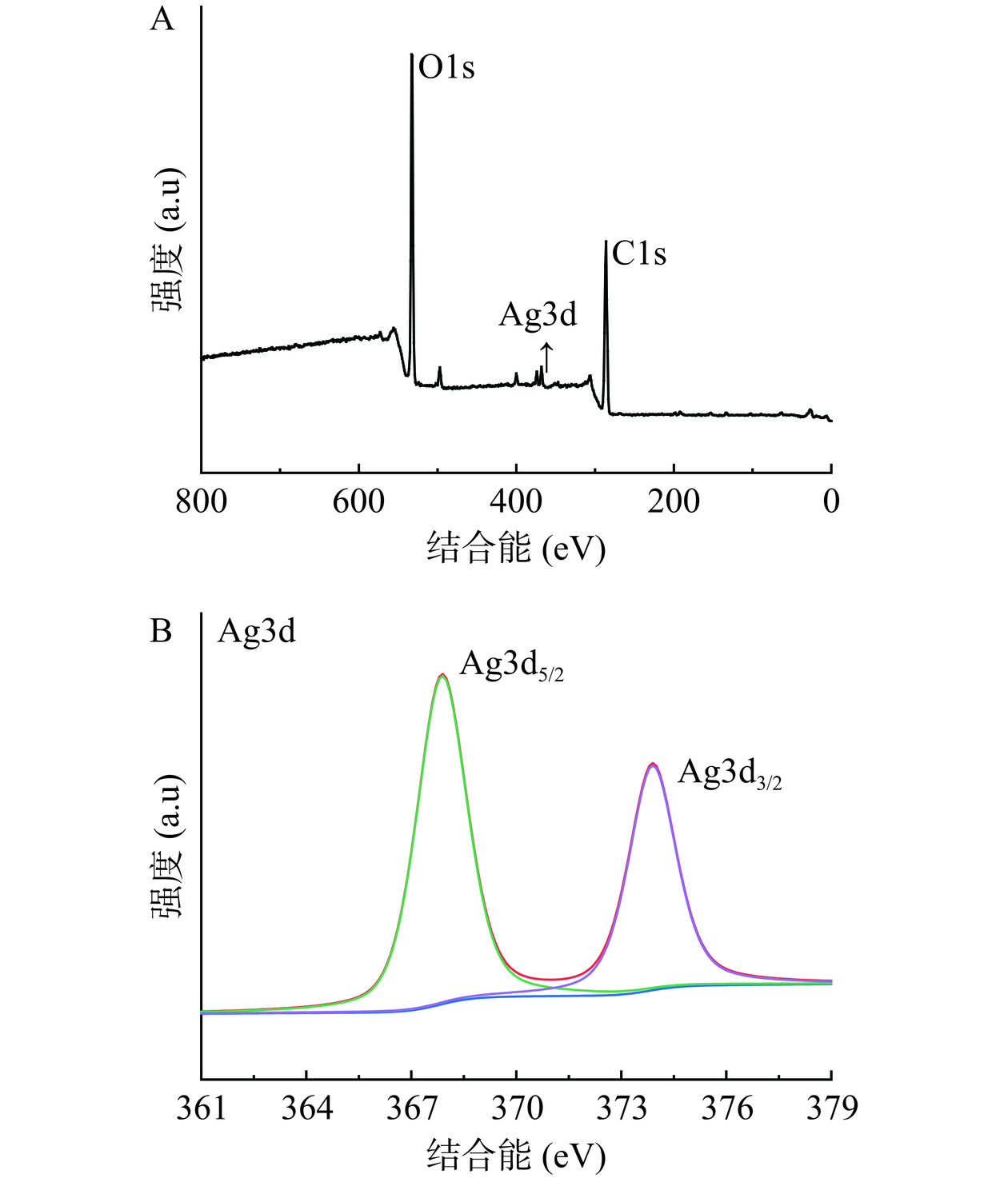
2.2.5 X射线光电子能谱(XPS)
对合成纳米银的XPS分析描述了SCP-AgNPs的外部化学性质和氧化状态。纳米银测试结果如图9所示,可以看出,C和O元素来自SCP,其他Ag元素来自硝酸银。C1s和O1s的结合能分别为286.5 eV和532.6 eV。Ag3d在370 eV处的尖峰表明了Ag金属的存在。Ag3d5/2和Ag3d3/2的结合能分别为367.4 eV和373.2 eV,Ag的3d偶态的分裂为~6 eV,表明SCP-AgNPs处于Ago状态[34]。这些结果表明SCP-AgNPs制备成功。
2.3 甜玉米芯多糖纳米银抗氧化能力
2.3.1 DPPH自由基清除能力测定
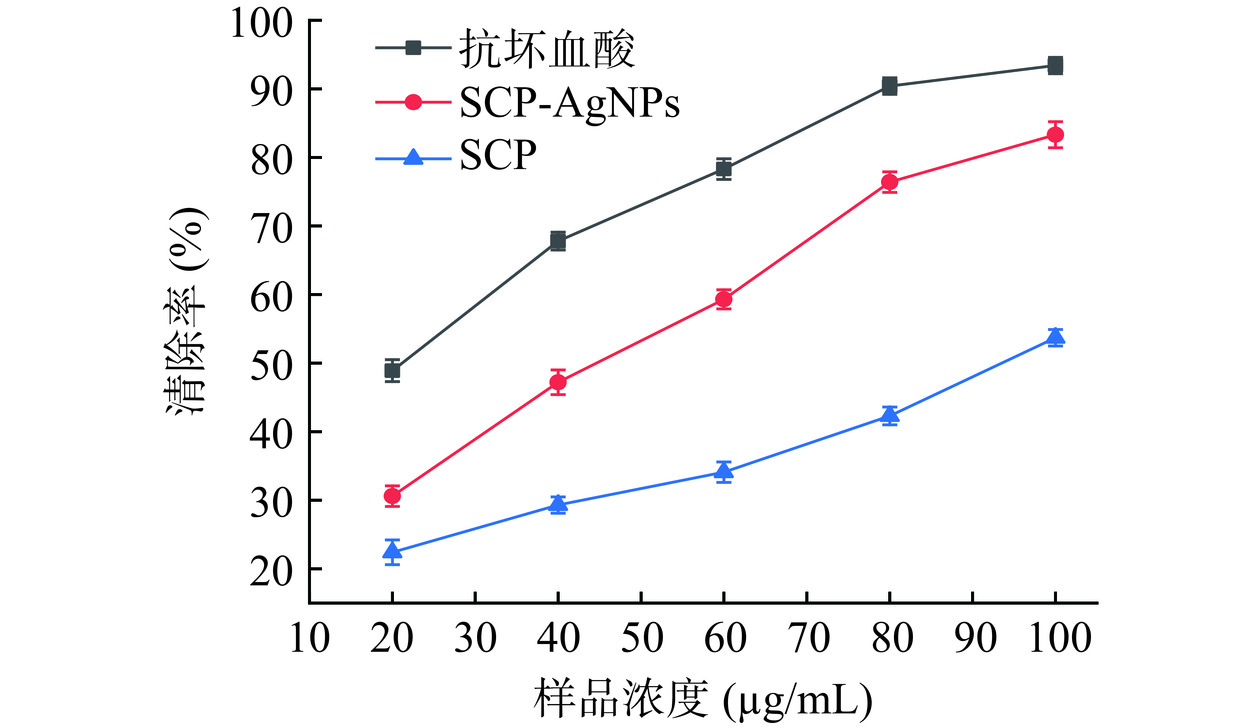
SCP-AgNPs对DPPH自由基清除效果如图10所示,在20~100 μg/mL浓度范围内,SCP、SCP-AgNPs和抗坏血酸对DPPH自由基均有一定清除作用,清除率与样品浓度呈正比。当浓度为100 μg/mL时,SCP-AgNPs对DPPH自由基的清除率可达83.30%±1.90%,高于Wang等[35]用番石榴叶提取物合成100 μg/mL AgNPs时,DPPH自由基清除活性45.13%,且高于同浓度SCP的清除率53.70%±1.2%。结果表明,SCP-AgNPs具有良好的抗氧化活性。
2.3.2 ABTS+自由基清除能力测定
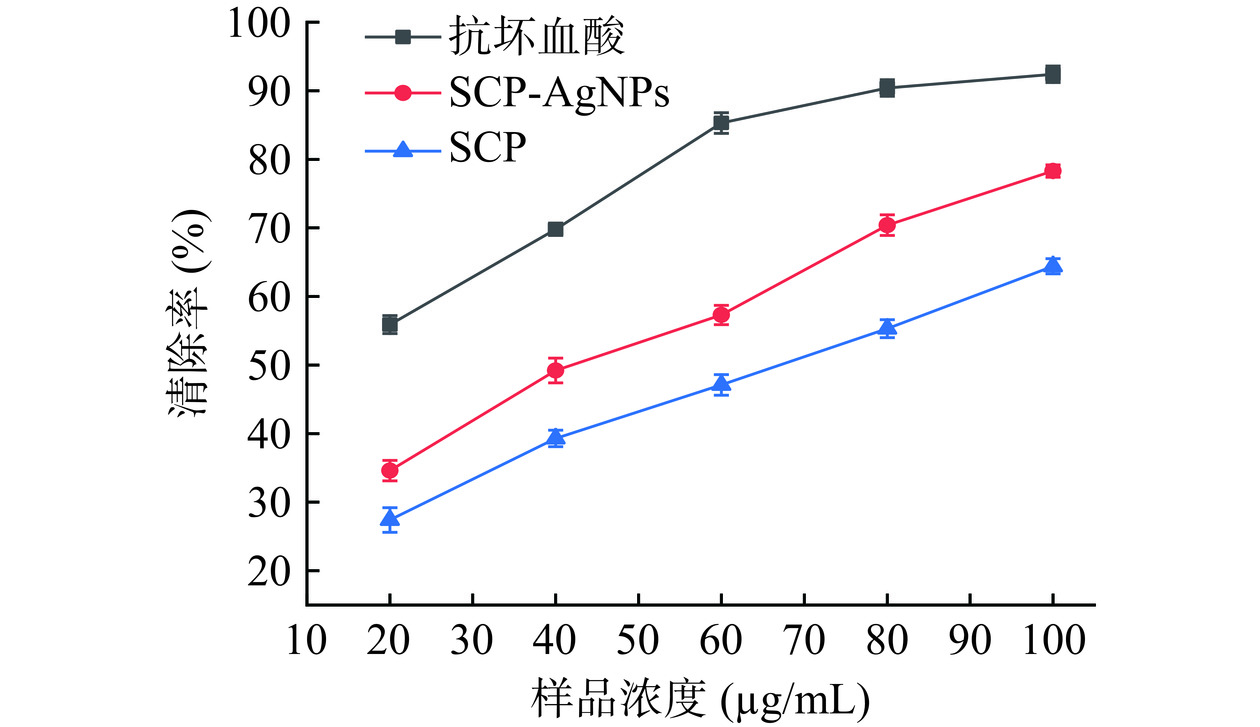
SCP-AgNPs对ABTS+自由基清除能力测定实验结果如图11所示,在20~100 μg/mL浓度范围内,随着样品浓度增大,SCP、SCP-AgNPs和抗坏血酸对ABTS+自由基的清除率也增强,样品浓度与清除效果呈正相关;SCP、SCP-AgNPs的IC50分别为67.05±1.12、43.41±1.30 μg/mL。当浓度为100 μg/mL时,SCP-AgNPs对ABTS+自由基的清除率为78.30%±0.91%,高于同浓度SCP的清除率64.42%±1.1%,与SCP相比更接近阳性对照组,说明SCP-AgNPs具有更好的抗氧化能力。
2.3.3 羟基自由基清除能力测定
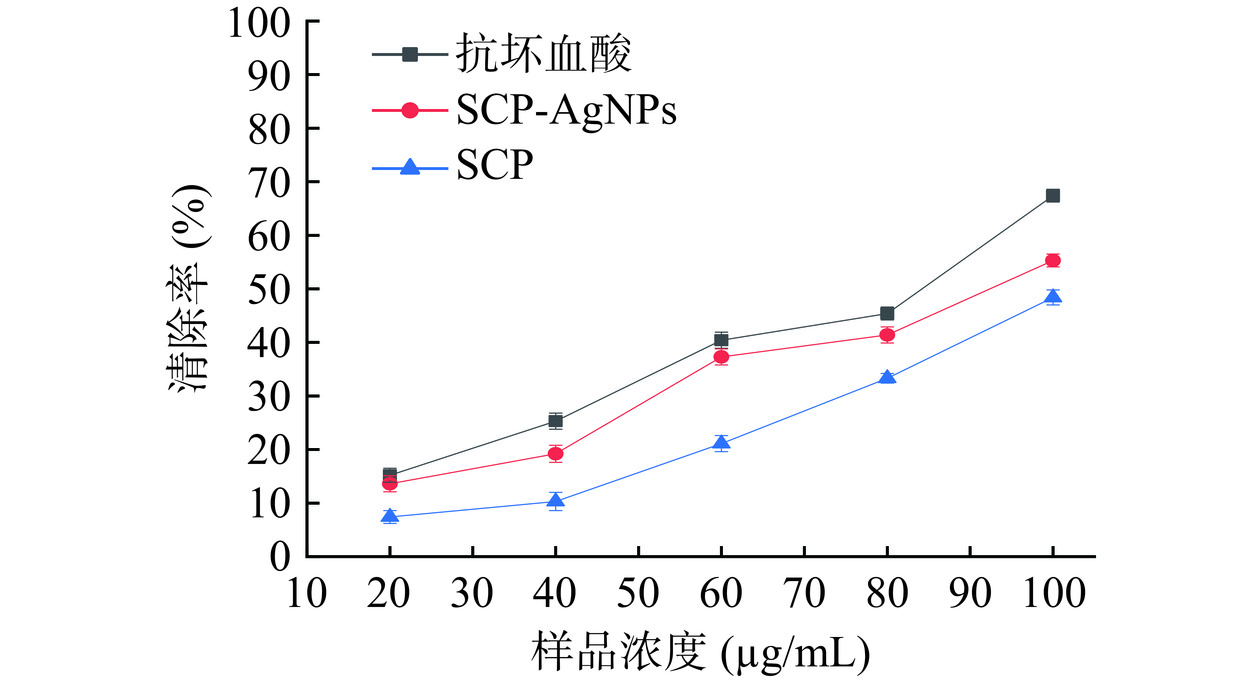
羟基自由基在生物体内活性较强并破坏机体内细胞膜、脂质、蛋白质和遗传物质,造成组织损伤,羟基自由基在糖尿病发展中具有一定作用[36]。羟基自由基清除能力测定结果如图12所示,在20~100 μg/mL的浓度范围内,SCP、SCP-AgNPs和抗坏血酸对羟基自由基的清除效果与浓度呈正比,SCP-AgNPs对羟基自由基具有较好的清除能力,当浓度为100 μg/mL时,SCP-AgNPs的清除率可达到55.3%±1.24%,其中SCP与SCP-AgNPs的IC50分别为108.84±1.10与90.52±0.92 μg/mL,与Fredrick等[37]发现利用毕赤酵母花基培养基合成AgNPs具有较强的自由基清除活性相同。如2.2.1傅里叶红外光谱图所示,SCP-AgNPs较好的抗氧化活性可能是由于不同类型的活性分子(酚类、黄酮类、多糖等)分布在纳米银的表面造成的。Kup等[38]研究表明这些活性物质不仅在纳米银合成过程中发挥Ag+的作用,还可以包覆在纳米银表面发挥抗氧化等生物活性,有些活性成分与纳米银还会产生协同作用。
2.4 甜玉米芯多糖纳米银抗糖尿病能力
2.4.1 α-淀粉酶抑制能力测定
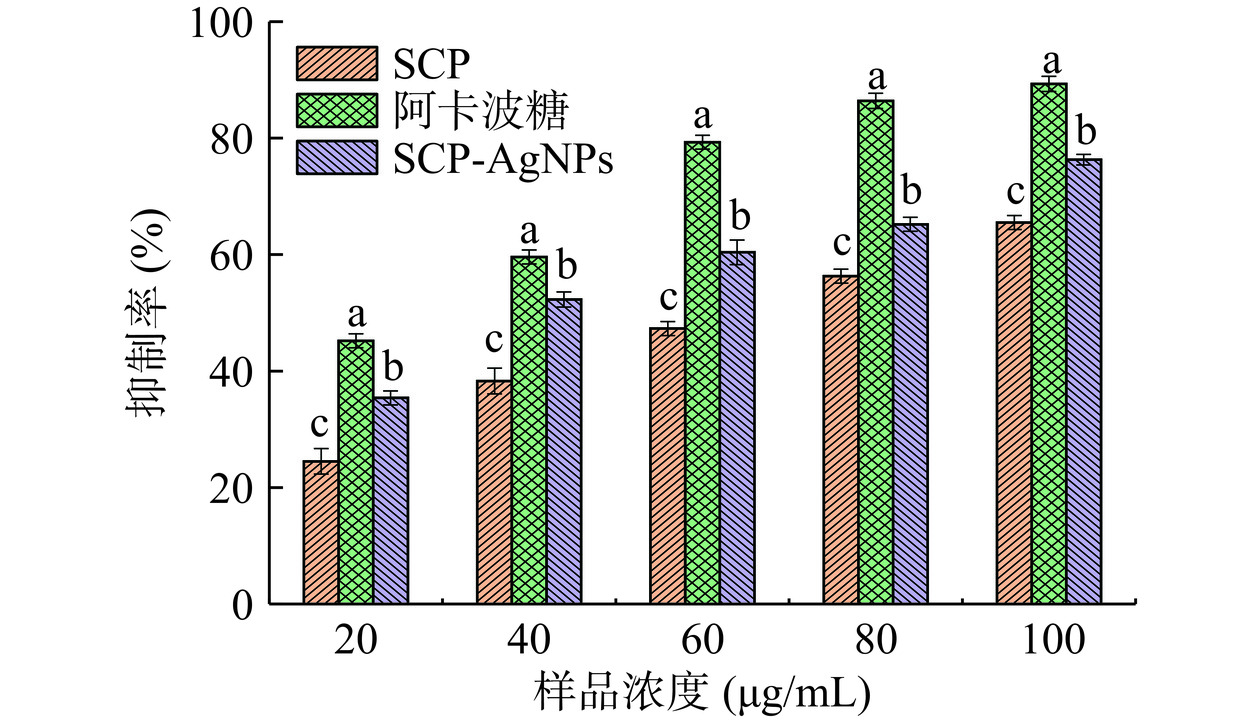
α-淀粉酶在体内参与碳水化合物的分解并协助肠道吸收,通过抑制α-淀粉酶可以减缓血液中葡萄糖释放并降低血糖[39]。SCP-AgNPs对α-淀粉酶的抑制效果如图13所示,随着浓度升高各组抑制率均增加,浓度为100 μg/mL时SCP-AgNPs对α-淀粉酶的抑制率达到76.38%±0.98%,显著高于同浓度SCP对α-淀粉酶的抑制率65.5%±1.21%(P<0.05)。
![]() 图 13 α-淀粉酶抑制能力测定注:不同字母表示相同浓度下数据存在显著差异(P<0.05);图14同。Figure 13. Determination of α-amylase inhibition capacity
图 13 α-淀粉酶抑制能力测定注:不同字母表示相同浓度下数据存在显著差异(P<0.05);图14同。Figure 13. Determination of α-amylase inhibition capacity2.4.2 α-葡萄糖苷酶抑制能力
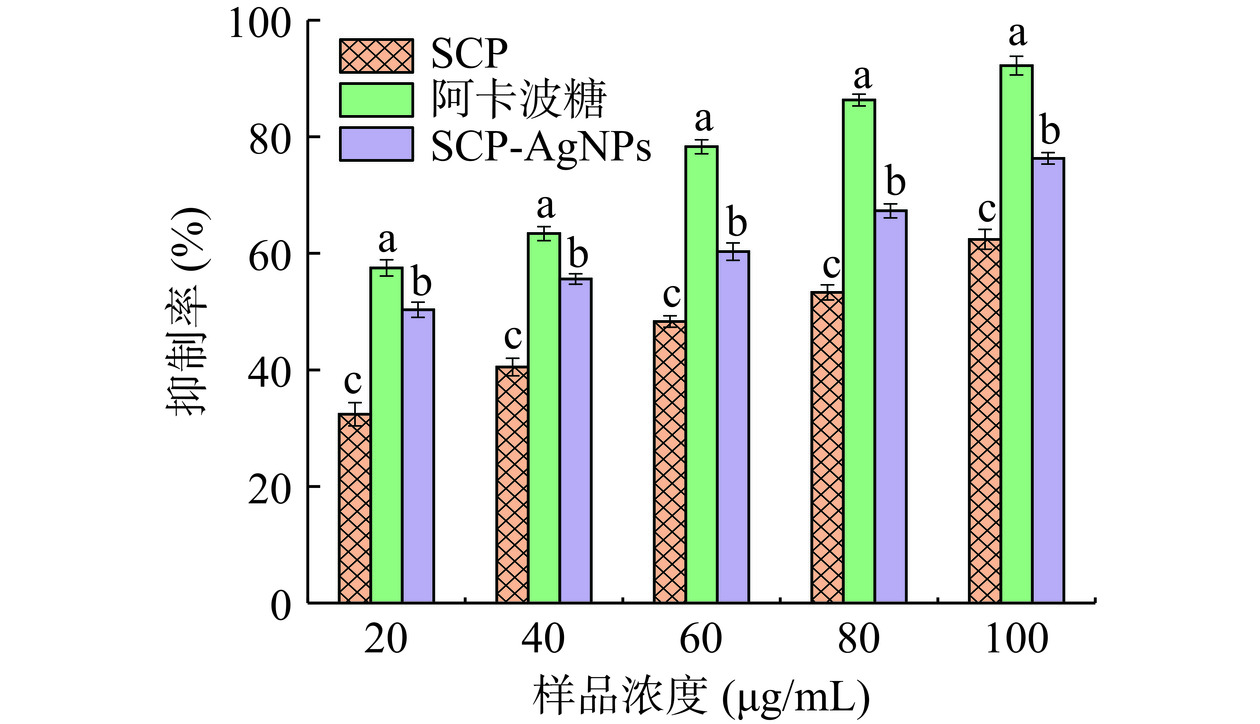
α-葡萄糖苷酶涉及负责将低聚糖和双糖分解成适合吸收的单糖,通过抑制此种消化酶可以使碳水化合物的代谢过程变慢并有效控制血糖浓度[40]。SCP-AgNPs对α-葡萄糖苷酶的抑制效果如图14所示,随着浓度升高SCP-AgNPs对α-葡萄糖苷酶表现出剂量依赖性的抑制作用,同时SCP-AgNPs对α-葡萄糖苷酶的抑制效果显著高于SCP(P<0.05)。对α-葡萄糖苷酶的抑制能力(P<0.05)大小依次为SCP<SCP-AgNPs<阿卡波糖。其原因可能在于SCP-AgNPs比表面积大,表面吸附了较多多糖等有效活性物质,而SCP粉末中含有较多杂质,活性物质的浓度较低,因此酶抑制能力弱于等质量的SCP-AgNPs。
3. 结论
综上所述,以甜玉米芯中提取出的SCP为原料,采用绿色合成法成功制备了具有良好的分散性和稳定性的SCP-AgNPs,该方法快速、廉价且环保,且不使用表面活性剂与稳定剂等化学试剂,因此具有更好的生物相容性。通过单因素优化,得到最优合成条件为硝酸银浓度0.75×10−3 mol/L,pH10.0,反应时间80 min。对合成的SCP-AgNPs进行表征分析,结果表明,合成的SCP-AgNPs粒径较小呈均匀球状形貌,表面被SCP包覆并带有负电荷。体外试验表明,碳水化合物同化酶的活性被SCP-AgNPs以浓度依赖性的方式显著抑制。合成的SCP-AgNPs具有较高的清除DPPH、ABTS+以及羟基自由基的活性,这表明其在食品和制药工业中具有巨大的应用潜力,但纳米银目前对生物细胞毒性及器官影响仍存在争议,值得进一步探讨。总之,本文的研究为制备具有良好的抗氧化活性、抗糖尿病能力的纳米银提供了一种简单的方法,这在生命科学和技术领域至关重要。
-
图 13 α-淀粉酶抑制能力测定
注:不同字母表示相同浓度下数据存在显著差异(P<0.05);图14同。
Figure 13. Determination of α-amylase inhibition capacity
-
[1] 王鑫, 王峙力, 谢静南, 等. 甜玉米芯多糖对α-淀粉酶抑制作用研究[J]. 食品工业科技,2021,42(10):48−54. [WANG X, WANG Z L, XIE J N, et al. Study on the inhibitory effect of sweet corn cob polysaccharide on α-amylase[J]. Science and Technology of Food Industry,2021,42(10):48−54.] WANG X, WANG Z L, XIE J N, et al. Study on the inhibitory effect of sweet corn cob polysaccharide on α-amylase[J]. Science and Technology of Food Industry, 2021, 42(10): 48−54.
[2] 马永强, 张凯, 王鑫, 等. 甜玉米芯多糖对糖尿病大鼠的降血糖作用[J]. 食品科学,2020,41(13):169−173. [MA Y Q, ZHANG K, WANG X, et al. Hypoglycemic effect of sweet corncob polysaccharide on diabetic rats[J]. Food Science,2020,41(13):169−173.] doi: 10.7506/spkx1002-6630-20190702-030 MA Y Q, ZHANG K, WANG X, et al. Hypoglycemic effect of sweet corncob polysaccharide on diabetic rats[J]. Food Science, 2020, 41(13): 169−173. doi: 10.7506/spkx1002-6630-20190702-030
[3] 王峙力, 王鑫, 韩烨, 等. 甜玉米芯硒多糖的制备及其对淀粉酶抑制作用[J]. 包装工程,2021,42(21):33−41. [WANG Z L, WANG X, HAN Y, at al. Preparation of selenium polysaccharide from sweet corncob and its inhibitory effect on amylase[J]. Package Engineering,2021,42(21):33−41.] WANG Z L, WANG X, HAN Y, at al. Preparation of selenium polysaccharide from sweet corncob and its inhibitory effect on amylase[J]. Package Engineering, 2021, 42(21): 33−41.
[4] XIN W, WEI X, YE H, et al. Structural characterization of a novel polysaccharide from sweet corncob that inhibits glycosylase in STZ-induced diabetic rats:Structural characterization of a novel polysaccharide[J]. Glycoconjugate Journal,2022,39(3):413−427. doi: 10.1007/s10719-022-10059-7
[5] WANG X, WANG J, XIU W, et al. Selenium nanoparticles stabilized by sweet corncob polysaccharide inhibit hypoglycemia in vitro and alleviate symptoms in type 2 diabetes mice[J]. Journal of Functional Foods,2024,112:105920. doi: 10.1016/j.jff.2023.105920
[6] MO F, ZHOU Q, HE Y Q, et al. Nano-Ag:Environmental applications and perspectives[J]. Science of the Total Environment,2022,829:154644. doi: 10.1016/j.scitotenv.2022.154644
[7] NIE P, ZHAO Y, XU H. Synthesis, applications, toxicity and toxicity mechanisms of silver nanoparticles:A review[J]. Ecotoxicology and Environmental Safety,2023,253:114636. doi: 10.1016/j.ecoenv.2023.114636
[8] BAR H, BHUI D K, SAHOO G P, et al. Green synthesis of silver nanoparticles using seed extract of Jatropha curcas[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects,2009,348(1-3):212−216.
[9] SKIBA M, VOROBYOVA V, PIVOVAROV A, et al. Green synthesis of silver nanoparticles in the presence of polysaccharide:Optimization and characterization[J]. Journal of Nanomaterials,2020,2020(2):1−10.
[10] MAHMOUDI F, MAHMOUDI F, GOLLO K H, et al. Biosynthesis of novel silver nanoparticles using Eryngium thyrsoideum Boiss extract and comparison of their antidiabetic activity with chemical synthesized silver nanoparticles in diabetic rats[J]. Biological Trace Element Research ,2020,199(5):1967−1978.
[11] JIAN W, MA Y, WU H, et al. Fabrication of highly stable silver nanoparticles using polysaccharide-protein complexes from abalone viscera and antibacterial activity evaluation[J]. International Journal of Biological Macromolecules,2019,128:839−847. doi: 10.1016/j.ijbiomac.2019.01.197
[12] GANESH D S, RIJUTA G S, SI-KYUNG C, et al. Investigation of photocatalytic degradation of reactive textile dyes by Portulaca oleracea-functionalized silver nanocomposites and exploration of their antibacterial and antidiabetic potentials[J]. Journal of Alloys and Compounds:An Interdisciplinary Journal of Materials Science and Solid-state Chemistry and Physics,2020,833:155083.
[13] 马永强, 王鑫, 高爽, 等. 甜玉米芯多糖提取及抗凝血活性初探[J]. 食品工业科技,2016,37(21):114−118,188. [MA Y Q, WANG X, GAO S, et al. Preliminary study on extraction and anticoagulant activity of sweet corncob polysaccharide[J]. Science and Technology of Food Industry,2016,37(21):114−118,188.] MA Y Q, WANG X, GAO S, et al. Preliminary study on extraction and anticoagulant activity of sweet corncob polysaccharide[J]. Science and Technology of Food Industry, 2016, 37(21): 114−118,188.
[14] 马永强, 周恪驰, 王鑫, 等. 甜玉米芯多糖脱色工艺研究[J]. 哈尔滨商业大学学报(自然科学版),2015,31(4):432−434,452. [MA Y Q, ZHOU K C, WANG X, et al. Study on decolorization technology of sweet corncob polysaccharide[J]. Journal of Harbin University of Commerce (Natural Science Edition),2015,31(4):432−434,452.] doi: 10.3969/j.issn.1672-0946.2015.04.012 MA Y Q, ZHOU K C, WANG X, et al. Study on decolorization technology of sweet corncob polysaccharide[J]. Journal of Harbin University of Commerce (Natural Science Edition), 2015, 31(4): 432−434,452. doi: 10.3969/j.issn.1672-0946.2015.04.012
[15] 曹建华. 款冬花多糖银纳米颗粒对HT29细胞的抑制作用及机制研究[D]. 太原:山西大学, 2021. [CAO J H. Study on inhibitory effect of silver nanoparticles from polysaccharide of Farfarae Flos on HT29 cells and its mechanism[D]. Taiyuan:Shanxi University, 2021.] CAO J H. Study on inhibitory effect of silver nanoparticles from polysaccharide of Farfarae Flos on HT29 cells and its mechanism[D]. Taiyuan: Shanxi University, 2021.
[16] AHMAD B, SHIREEN F, RAUF A, et al. Phyto-fabrication, purification, characterization, optimization and biological competence of nano-silver[J]. IET Nanobiotechnology,2020,15(1):1−18.
[17] CHENG S, HE F, FU L, et al. Polysaccharide from rubescens:Extraction, optimization, characterization and antioxidant activities[J]. RSC Advances,2021,11(31):18974−18983. doi: 10.1039/D1RA01365C
[18] 王威振, 杨盼盼, 遆永瑞, 等. 龙牙百合多糖的超声辅助提取及其抗氧化、降血脂活性分析[J]. 食品工业科技,2023,44(18):251−257. [WANG W Z, YANG P P, DI Y R, et al. Ultrasonic-assisted extraction of polysaccharide from Lilium brownii and its antioxidant and hypolipidemic activity analysis[J]. Science and Technology of Food Industry,2023,44(18):251−257.] WANG W Z, YANG P P, DI Y R, et al. Ultrasonic-assisted extraction of polysaccharide from Lilium brownii and its antioxidant and hypolipidemic activity analysis[J]. Science and Technology of Food Industry, 2023, 44(18): 251−257.
[19] ZHOU S, HUANG G, HUANG H. Extraction, derivatization and antioxidant activities of onion polysaccharide[J]. Food Chemistry,2022,388:133000. doi: 10.1016/j.foodchem.2022.133000
[20] 朱文卿, 朱姗姗, 何秋霞, 等. 牛蒡多糖与绿原酸对斑马鱼氧化损伤的协同抗氧化作用[J]. 中国食品学报,2022,22(4):95−103. [ZHU W Q, ZHU S S, HE Q X, et al. Synergistic antioxidant effect of burdock polysaccharide and chlorogenic acid on oxidative damage in zebrafish[J]. Chinese Journal of Food Science,2022,22(4):95−103.] ZHU W Q, ZHU S S, HE Q X, et al. Synergistic antioxidant effect of burdock polysaccharide and chlorogenic acid on oxidative damage in zebrafish[J]. Chinese Journal of Food Science, 2022, 22(4): 95−103.
[21] YANG H R, CHEEN L H, ZHENG Y J. Structure, antioxidant activity and in vitro hypoglycemic activity of a polysaccharide purified from Tricholoma matsutake[J]. Foods,2021,10(9):2184. doi: 10.3390/foods10092184
[22] CHEN X, CHEN C, FU X. Hypoglycemic activity in vitro and vivo of a water-soluble polysaccharide from Astragalus membranaceus[J]. Food Function,2022,13(21):11210−11222. doi: 10.1039/D2FO02298B
[23] ARAGO A P D, TMD OLIVEIRA, QUELEMES P V, et al. Green synthesis of silver nanoparticles using the seaweed Gracilaria birdiae and their antibacterial activity[J]. Arabian Journal of Chemistry,2019,12(8):4182−4188. doi: 10.1016/j.arabjc.2016.04.014
[24] GAJERA H P, HIRPARA D G, BHADANI R V, et al. Green synthesis and characterization of nano silver derived from extracellular metabolites of potent Bacillus subtilis for antifungal and eco-friendly action against phytopathogen[J]. Biometals,2022,35(3):479−497.
[25] IBRAHIM H M M. Green synthesis and characterization of silver nanoparticles using banana peel extract and their antimicrobial activity against representative microorganisms[J]. Journal of Radiation Research & Applied Sciences,2015,8(3):265−275.
[26] TANASE C, BERTA L, COMAN N A, et al. Antibacterial and antioxidant potential of silver nanoparticles biosynthesized using the spruce bark extract[J]. Nano Materials (Basel),2019,9(11):1541.
[27] MOHANTA Y K, PANDA S K, RASU J, et al. Antimicrobial, antioxidant and cytotoxic activity of silver nanoparticles synthesized by leaf extract of Erythrina suberosa (Roxb.)[J]. Frontiers in Molecular Biosciences,2017,4:14.
[28] DAS D, HAYDAR M S, MANDAL P. Impact of physical attributes on proficient phytosynthesis of silver nanoparticles using extract of fresh mulberry leaves:Characterization, stability and bioactivity assessment[J]. Journal of Inorganic and Organometallic Polymers and Materials,2021,31:1527−1548.
[29] JOSE E, KHARISSOVA O V, AGUIRRE-ARZOLA V E, et al. Evaluation of the conditions for the synthesis of silver nanoparticles from orange peels and its antibacterial effect[J]. Recent Patents on Nanotechnology,2020,14(3):250−258. doi: 10.2174/1872210514666200414101014
[30] KALPANA D, HAN J H, PARK W S, et al. Green biosynthesis of silver nanoparticles using Torreya nucifera and their antibacterial activity[J]. Arabian Journal of Chemistry,2019,12(7):1722−1732. doi: 10.1016/j.arabjc.2014.08.016
[31] MANI M, HARIKRISHNAN R, PURUSHOTHAMAN P, et al. Systematic green synthesis of silver oxide nanoparticles for antimicrobial activity[J]. Environmental Research,2021,202:111627. doi: 10.1016/j.envres.2021.111627
[32] VASEGHI Z, NEMATOLLAHZADEH A, TAVAKOLI O. Green methods for the synthesis of metal nanoparticles using biogenic reducing agents:A review[J]. Reviews in Chemical Engineering,2018,34(4):529−559. doi: 10.1515/revce-2017-0005
[33] DANAEI M, DEHGHANKHOLD M, ATAEI S, et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems[J]. Pharmaceutics,2018,10(2):57. doi: 10.3390/pharmaceutics10020057
[34] MA Z, JIANG X, JIN Y, et al. Preparation of nano-silver nanoparticles for conductive ink and the correlations with its conductivity[J]. Applied Nanoscience,2022,12(5):1657−1665. doi: 10.1007/s13204-022-02340-w
[35] WANG L, LU F, LIU Y, et al. Photocatalytic degradation of organic dyes and antimicrobial activity of silver nanoparticles fast synthesized by flavonoids fraction of Psidium guajava L. leaves[J]. Journal of Molecular Liquids,2018,263:187−192. doi: 10.1016/j.molliq.2018.04.151
[36] YARIBEYGI H, SATHYAPALAN T, ATKIN S L, et al. Molecular mechanisms linking oxidative stress and diabetes mellitus[J]. Oxidative Medicine and Cellular Longevity,2020,2020:8609213.
[37] FREDRICK N E, NWABOR O F. Valorization of Pichia spent medium via one-pot synthesis of biocompatible silver nanoparticles with potent antioxidant, antimicrobial, tyrosinase inhibitory and reusable catalytic activities[J]. Materials Science and Engineering:C,2020,115:111104.
[38] KUP F O, COSKUNCAY S, DUMAN F. Biosynthesis of silver nanoparticles using leaf extract of Aesculus hippocastanum (horse chestnut):Evaluation of their antibacterial, antioxidant and drug release system activities[J]. Materials Science & Engineering,2020,107(Feb.):110207.1−110207.11.
[39] WENG L, CHEN T H, ZHENG Q, et al. Syringaldehyde promoting intestinal motility with suppressing α-amylase hinders starch digestion in diabetic mice[J]. Biomedicine & Pharmacotherapy ,2021,141(2):111865.
[40] TAN K, TESAR C, WILTON R, et al. Interaction of antidiabetic α-glucosidase inhibitors and gut bacteria α-glucosidase[J]. Protein Science,2018,27(8):1498−1508. doi: 10.1002/pro.3444





 下载:
下载:
 下载:
下载:



