Protective Effects of Water Extracts from Different Ganoderma lucidum Mycelium on Ethanol-induced Hepatocyte Injury in LO2 Cells
-
摘要: 为了探讨不同灵芝菌丝体水提物对乙醇诱导LO2肝细胞损伤的保护作用,本文分析了7种不同灵芝菌株发酵菌丝体水提物对乙醇诱导LO2细胞损伤的保护作用。利用乙醇诱导LO2细胞建立体外肝损伤模型,并以细胞存活率、谷丙转氨酶(Alanine Aminotransferase, ALT)、谷草转氨酶(Aspartate Aminotransferase, AST)、活性氧(Reactive Oxygen Species, ROS)、超氧化物歧化酶(Superoxide dismutase, SOD)、谷胱甘肽(Glutathione, GSH)和丙二醛(Malondiadehyde, MDA)水平为指标考察灵芝菌丝体水提物对乙醇诱导LO2细胞损伤的保护效果。结果表明,7种灵芝菌株的菌丝体水提物均具有不同程度的保护作用。综合比较,G0119与G0154菌丝体的水提物作用效果较优,相较模型组,LO2细胞存活率显著提高(P<0.05),细胞培养液中的ALT、AST活力显著降低(P<0.05),细胞内ROS水平显著降低(P<0.05),SOD活力、GSH含量显著升高(P<0.05),MDA含量显著降低(P<0.05)。经相关性分析,发现水提物中多糖组分2的分子量大小与其保肝活性呈正相关,即分子量越大,活性越强。综上,灵芝菌丝体水提物对乙醇诱导的体外肝损伤起到保护作用,并且G0119与G0154菌株的作用效果较优,其保肝作用与提取物中多糖组分的分子量大小相关。Abstract: To explore the protective effects of water extracts from different Ganoderma lucidum (G. lucidum) mycelium on ethanol-induced hepatocyte injury in LO2 cells. The effects of water extracts obtained from different G. lucidum mycelium against ethanol-induced damage to LO2 cells were examined in this research. Cell survival rate, alanine aminotransferase (ALT), aspartate aminotransferase (AST), reactive oxygen species (ROS), superoxide dismutase (SOD), glutathione (GSH) and malondialdehyde (MDA) levels were measured in a liver injury model employing ethanol-induced LO2 cells, to assess the preventive effects of G. lucidum mycelium water extracts against ethanol-induced damage. The results showed that water extracts from the mycelium of all seven strains exhibited varying degrees of protective effects. Among them, the water extract from strains G0119 and G0154 had the best protective effect. Compared with the model group, the intervention of water extracts significantly increased LO2 cell survival (P<0.05), while decreased ALT and AST levels in the cell culture medium, respectively (P<0.05). Furthermore, the intracellular ROS level significantly decreased (P<0.05), while the activity of SOD and the content of GSH significantly increased (P<0.05), and the MDA content significantly decreased compared to the model group (P<0.05). Correlation analysis revealed a positive correlation between the molecular weight of polysaccharide component 2 in the water extract and its hepatoprotective activity, with higher molecular weight correlating with stronger activity. The results indicated that the water extract of G. lucidum mycelium exhibited a protective effect against ethanol-induced in vitro liver damage. Moreover, the effectiveness of the G0119 and G0154 strains were superior, and its hepatoprotective effect was correlated with the molecular weight of polysaccharide components in the extract.
-
酒精依赖和滥用正成为全球日益严重的问题,超过40%的成年人经常饮酒[1]。肝脏是人体重要代谢器官,长期饮酒或者过量饮酒所诱导的肝损伤是不同肝病发展的主要因素之一[2]。因此,如何有效保护肝脏免受酒精的损伤从而预防肝病的发生成为目前医药和食品领域研究的热点。研究发现,保护肝脏的作用机制包括抗炎、抗氧化以及调节乙醇代谢、调控肠道菌群等多个途径[3−5]。
灵芝(Ganoderma lucidum,G. lucidum)是一种著名的药用真菌,含有多糖、三萜等多种生物活性化合物[6]。其中,灵芝水提物中富含丰富的活性多糖,具有免疫调节、抗氧化、抗炎等多种功效[7−10]。灵芝天然活性物质可以形成多靶点的调控作用,且具有低毒副作用[11],因此在保护肝脏损伤药物和保健食品的开发中具有广阔的应用前景。
已有研究表明,富含多糖和三萜的灵芝子实体可以通过减少自由基的过量产生,抑制机体氧化应激,从而起到保护肝脏的作用[12−13]。陈玉胜等[14]研究指出灵芝子实体多糖能够降低四氯化碳(CCl4)诱导的急性肝损伤小鼠模型血清中谷丙转氨酶(Alanine Aminotransferase, ALT)、谷草转氨酶(Aspartate Aminotransferase,AST)、丙二醛(Malondiadehyde, MDA)水平,从而起到保护肝脏的作用。Guo等[15]研究发现灵芝子实体乙醇提取物对小鼠乙醇性肝损伤具有潜在保护作用,能明显抑制血清中AST和ALT的异常升高,显著改善酒精诱导的肝脏氧化应激。目前,关于灵芝活性成分保肝作用的研究主要集中于子实体,对于发酵产物的研究较少。我国灵芝种质资源丰富,不同菌株间的有效成分及生物活性差异较大[16−17]。因此,本文在前期研究的基础上,考察七种不同灵芝菌株发酵菌丝体水提物对乙醇诱导LO2细胞体外肝损伤模型的保护作用,为其种质资源的合理开发,以及在辅助预防酒精性肝损伤中的应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
赤芝菌株(G. lucidum)G0119、G0130、G0154、GZ02、GZ04、GZ37、G0149 其中GZ02、GZ04和GZ37三株灵芝杂交菌株是由灵芝亲本菌株G0119、G0130、G0154杂交而来,供试菌株均保藏于上海市农业科学院食用菌研究所[17−18];人正常肝细胞株LO2 购自中国科学院生命科学研究所细胞资源中心;RPMI 1640培养基、胎牛血清(FBS) 美国Gibco公司;Alamar Blue Assay Kit 美国Biosource公司;青霉素、链霉素 美国Amresco公司;无水乙醇 分析纯,国药集团化学试剂有限公司;谷丙转氨酶(ALT)测定试剂盒、谷草转氨酶(AST)测定试剂盒、超氧化物歧化酶(Superoxide dismutase, SOD)测定试剂盒、还原性谷胱甘肽(Glutathione, GSH)测定试剂盒、丙二醛(MDA)测定试剂盒 南京建成生物工程研究所;活性氧(Reactive Oxygen Species, ROS)测定试剂盒 碧云天生物技术有限公司。
WJ-3 CO2恒温培养箱 美国Thermo Fisher公司;Synergy HT多功能酶标仪 美国BioTek公司;Z1细胞计数仪 美国Bechman Coulter;Centrifuge 5810高速冷冻离心机 德国Eppendorf公司;IX2-ILL100显微镜 日本Olympus公司;2695高效液相色谱仪、2414示差折光检测仪 美国Waters公司;八角度激光散射仪 美国Wyatt公司;高效凝胶尺寸排阻色谱-多角度激光散色仪-示差折光检测仪联用系统 由2695高效液相色谱仪、2414示差折光检测仪和八角度激光散射仪组成。
1.2 实验方法
1.2.1 发酵菌丝体水提物制备及活性成分测定
1.2.1.1 发酵菌丝体水提物制备
参考高坤等[19]的方法,获得不同菌株的发酵菌丝体,真空冷冻干燥48 h后,得到干燥菌丝体粉末。采用70%的乙醇进行超声波提取,料液比1:10(W/V),提取2次,离心后合并去上清,挥发乙醇后,将沉淀沸水提取1 h,料液比1:10(W/V),提取2次,离心后合并两次上清液,于沸水浴浓缩至比重1~1.5,真空冷冻干燥48 h,得粉末状提取物,根据如下公式计算提取物得率。
得率(%)=[提取物质量(mg)/干燥菌丝体质量(mg)]×100 1.2.1.2 发酵菌丝体水提物制备及活性成分测定
采用苯酚-硫酸法测定总糖含量[20],3,5-二硝基水杨酸法测定还原糖含量[21],菌丝体多糖含量(%)=总糖含量(%)−还原糖含量(%)。
1.2.1.3 发酵菌丝体水提物分子量分布测定
水提物溶解后经0.22 μm的微孔膜过滤后,采用HPSEC-MALLS-RID System对其多糖组分进行分析,色谱条件:色谱柱为TSK-GEL系列G 6000 PWXL和G 4000 PWXL串联,流动相为0.05 mol/L NaNO3溶液,流速0.5 mL/min,柱温35 ℃,进样量100 μL。多糖在溶液中的折光指数增量(dn/dc)按照0.146 mL/g计算。使用Astra(version 6.1.1, Wyatt Technology, Santa Barbara, CA)数据分析软件对光散射数据进行采集和分析,计算重均分子量(Mw)与多分散系数(Mw/Mn)[22]。
1.2.2 乙醇诱导LO2细胞损伤模型的建立
1.2.2.1 细胞培养
将LO2细胞在含有10%胎牛血清的RPMI 1640培养基中于5% CO2、37℃培养,至对数生长期用于后续实验。
1.2.2.2 模型建立
将LO2细胞以5×104个细胞/mL的密度接种于96孔板中,37 ℃培养24 h后,实验组中加入不同浓度的乙醇溶液,使乙醇终浓度在100~1000 mmol/L之间,对照组加入等体积1640培养基。培养24 h后,孔内细胞采用Alamar Blue法测定细胞存活率[23]。
细胞存活率 (%)=117216×A1−80586×A2117216×A3−80586×A4×100 式中:A1为样品在570 nm波长下的吸光度;A2为样品在600 nm波长下的吸光度;A3为对照在570 nm波长下的吸光度;A4为对照在600 nm波长下的吸光度。
1.2.3 LO2细胞存活率的测定
将LO2细胞以5×104个细胞/mL的密度接种于96孔板中,培养24 h后,模型组加入乙醇溶液,样品组加入乙醇溶液与灵芝菌丝体水提物,使得乙醇终浓度为600 mmol/L,样品终浓度为25~100 μg/mL,对照组加入等体积的PBS溶液。培养24 h后,孔内细胞采用Alamar Blue法测定细胞存活率[23]。
1.2.4 LO2细胞培养液中ALT和AST活性测定
将LO2细胞以5×104个细胞/mL的密度接种于12孔板中,培养24 h后,模型组加入乙醇溶液,样品组加入灵芝菌丝体水提物与乙醇溶液,使得乙醇终浓度为600 mmol/L,样品终浓度为100 μg/mL,对照组加入等体积的PBS溶液,培养24 h后,收集细胞培养液,采用ALT、AST试剂盒说明书的方法测定细胞上清中ALT、AST酶活力。
1.2.5 LO2细胞内活性氧分析
同1.2.4所述,将LO2细胞接种于12孔板中,培养24 h后,模型组加入乙醇溶液,样品组加入灵芝菌丝体水提物与乙醇溶液,使得乙醇终浓度为600 mmol/L,样品终浓度为100 μg/mL,对照组加入等体积的PBS溶液,培养24 h后,弃掉细胞培养液,PBS洗涤后,加入终浓度为10 μmol/L的DCFH-DA工作液200 μL,避光37 ℃下孵育30 min后,在激发波长为488 nm、发射波长为525 nm的荧光条件下测定细胞内ROS水平[24],并用Analyze Particles工具进行分析。
1.2.6 LO2细胞内SOD、GSH和MDA水平分析
同1.2.4所述,将LO2细胞接种于12孔板中,培养24 h后,加入灵芝菌丝体水提物与乙醇溶液,使得乙醇终浓度为600 mmol/L,样品终浓度为100 μg/mL,培养24 h后,弃掉细胞培养液,加入裂解液,将裂解后的细胞悬液采用BCA法测定蛋白浓度,采用试剂盒说明书的方法测定细胞内SOD活力、GSH和MDA含量。
1.3 数据处理
所有试验均重复3次,数据以平均值±标准差(SD)表示,采用SPSS软件进行单因素方差分析,使用Duncan法进行显著性检验,显著性水平为P<0.05,利用Origin 2023软件绘制图形。
2. 结果与分析
2.1 灵芝发酵菌丝体水提物得率与活性成分含量
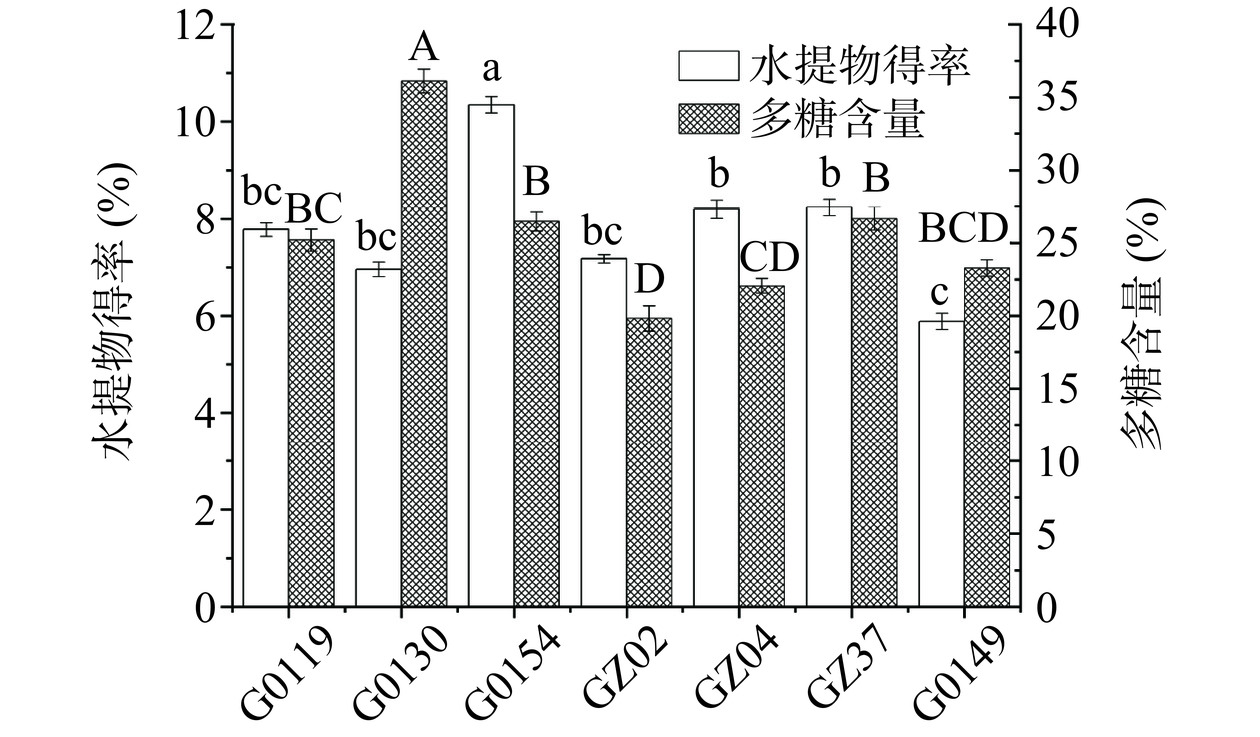
如图1所示,不同灵芝菌丝体的水提取物得率与多糖含量均存在较大差异,其中G0154水提取物得率显著(P<0.05)高于其他菌株,达到10.34%;提取物中的多糖含量在19.82%~36.11%之间,其中G0130水提物中的多糖含量最高,为36.11%。
2.2 灵芝发酵菌丝体水提物分子量分布
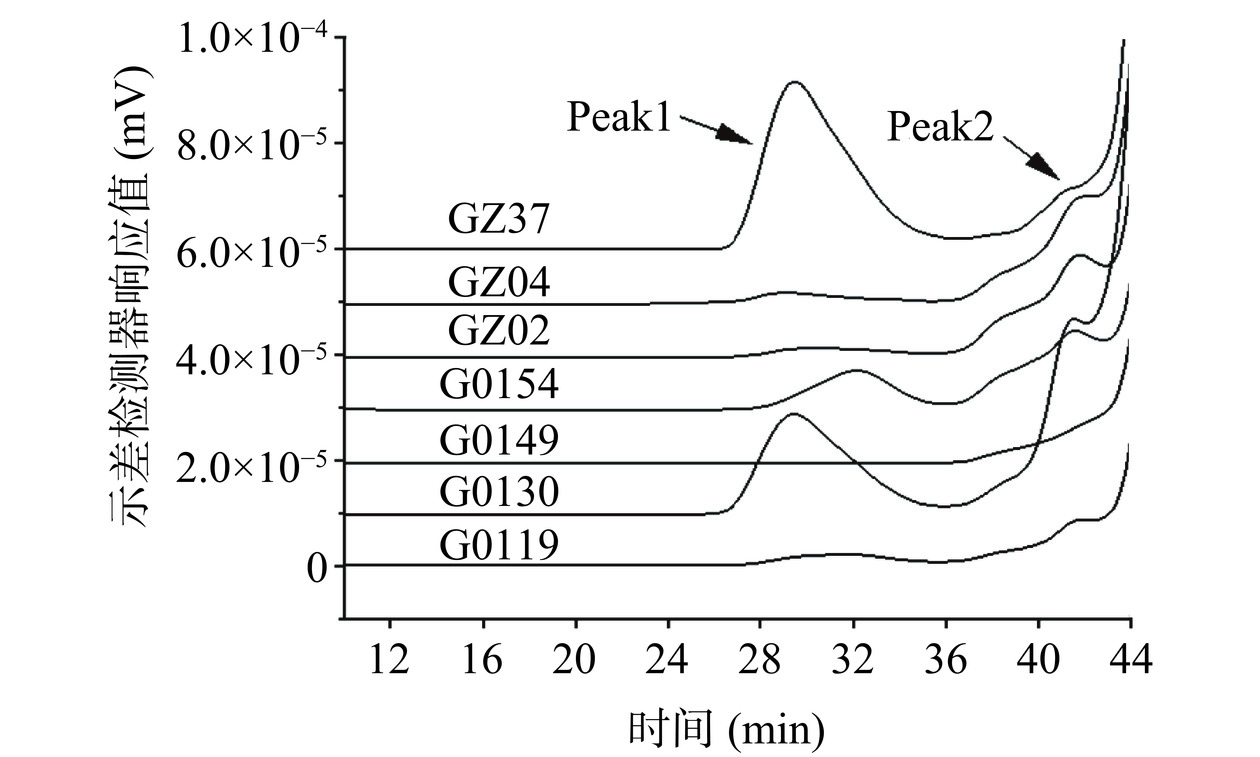
图2、表1为不同灵芝菌株菌丝体水提物的分子量分布,结果表明,不同菌丝体多糖的重均分子量分布差异显著。水提物中的多糖主要含有两个组分,组分1出峰时间为26~36 min,均为分子量大于106的高分子量多糖,组分2出峰时间为39~43 min,为分子量约105的中分子量多糖。不同菌株间峰面积有一定差异,其中G0130、G0154、GZ37组分1的峰面积较大,表明这三种水提物中大分子量多糖含量较高。
表 1 不同灵芝菌株发酵菌丝体水提取物分子量分布特征Table 1. Analysis of molecular weight characteristics of water extracts from different G. lucidum mycelia菌株名称 Peak 1 Peak 2 重均分子量Mw(g/mol) 多分散系数Mw/Mn 重均分子量Mw(g/mol) 多分散系数Mw/Mn G0119 5.144×106 2.166 8.075×105 1.052 G0130 2.617×107 1.524 4.574×105 1.613 G0154 6.402×106 1.412 4.898×105 1.411 GZ02 5.404×106 2.365 3.431×105 1.314 GZ04 1.495×107 1.881 8.082×105 1.397 GZ37 2.081×107 1.588 2.190×105 1.184 G0149 2.147×106 1.431 4.483×105 1.182 2.3 LO2细胞体外肝损伤模型构建
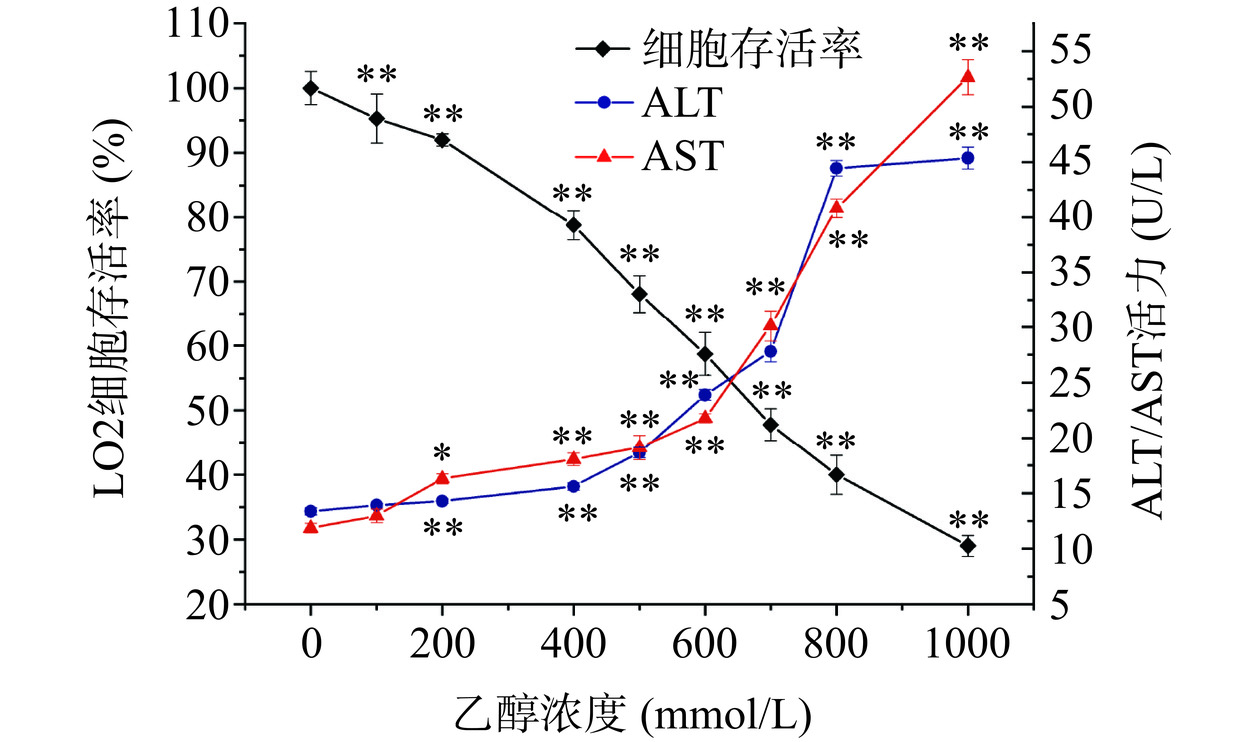
如图3所示,经不同浓度的乙醇处理后,细胞存活率随着乙醇浓度的升高呈下降趋势,细胞上清中ALT和AST活力随着乙醇浓度的升高呈上升趋势。当乙醇浓度为600 mmol/L时,细胞存活率从对照组的100%下降至58.74%,ALT活力从13.36 U/L升高至23.90 U/L,AST活力从11.86 U/L升高至21.79 U/L(P<0.01),故选择此浓度用于后续实验。
2.4 不同灵芝发酵菌丝体水提物对乙醇损伤LO2细胞存活率的影响
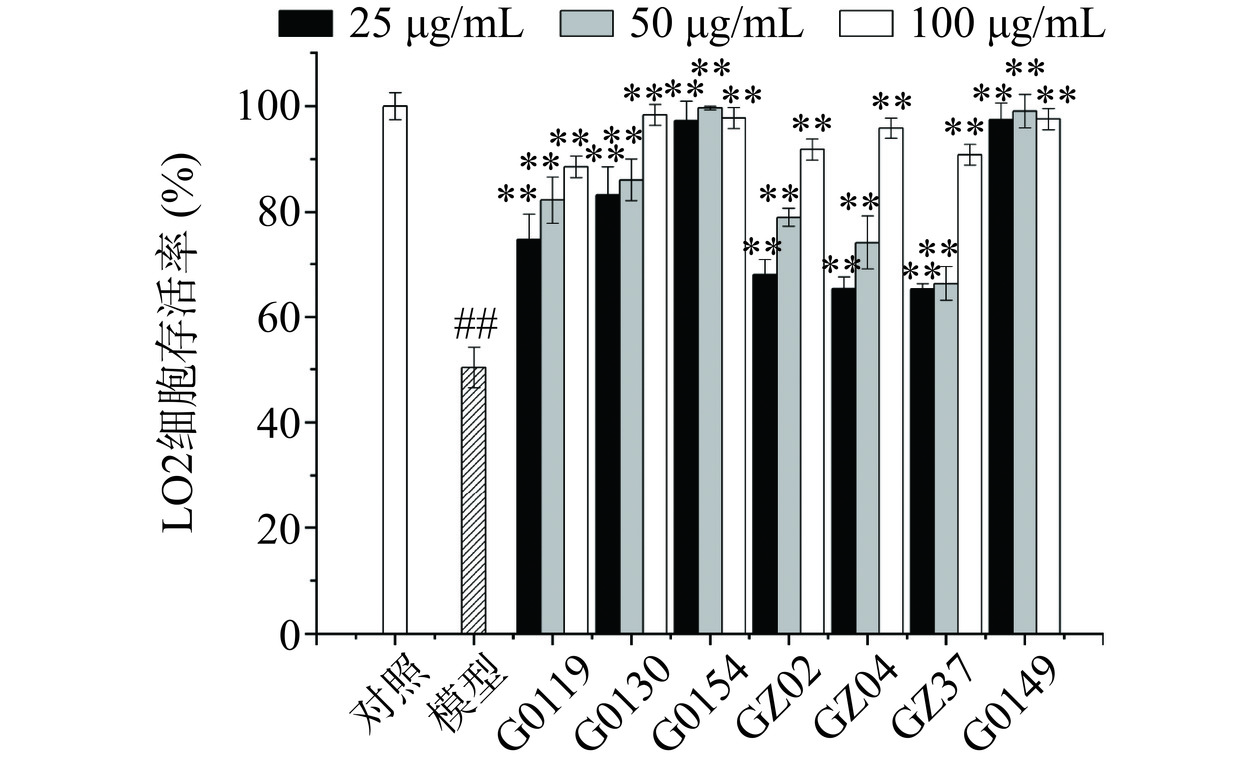
如图4所示,与对照组相比,模型组细胞存活率由100%降至53.39%(P<0.01);与模型组相比,当细胞经25~100 μg/mL不同灵芝发酵菌丝体的水提物处理后,均可以极显著提高细胞存活率(P<0.01),G0119、G0130、GZ02、GZ04与GZ37呈现出浓度依赖性,浓度为100 μg/mL时,作用效果最优,细胞存活率升高至88%~97%之间。而G0154与G0149的水提物均在浓度为25 μg/mL时,细胞存活率已恢复至97%左右。结果表明,不同灵芝菌株水提物均对乙醇诱导LO2细胞损伤具有一定保护作用,且G0154与G0149的作用效果最佳。综合比较,样品浓度为100 μg/mL时,在细胞存活率方面表现出良好的保护作用,因此,选用100 μg/mL为后续试验的样品浓度。
2.5 不同灵芝菌株发酵菌丝体水提物对乙醇损伤LO2细胞ALT、AST的影响
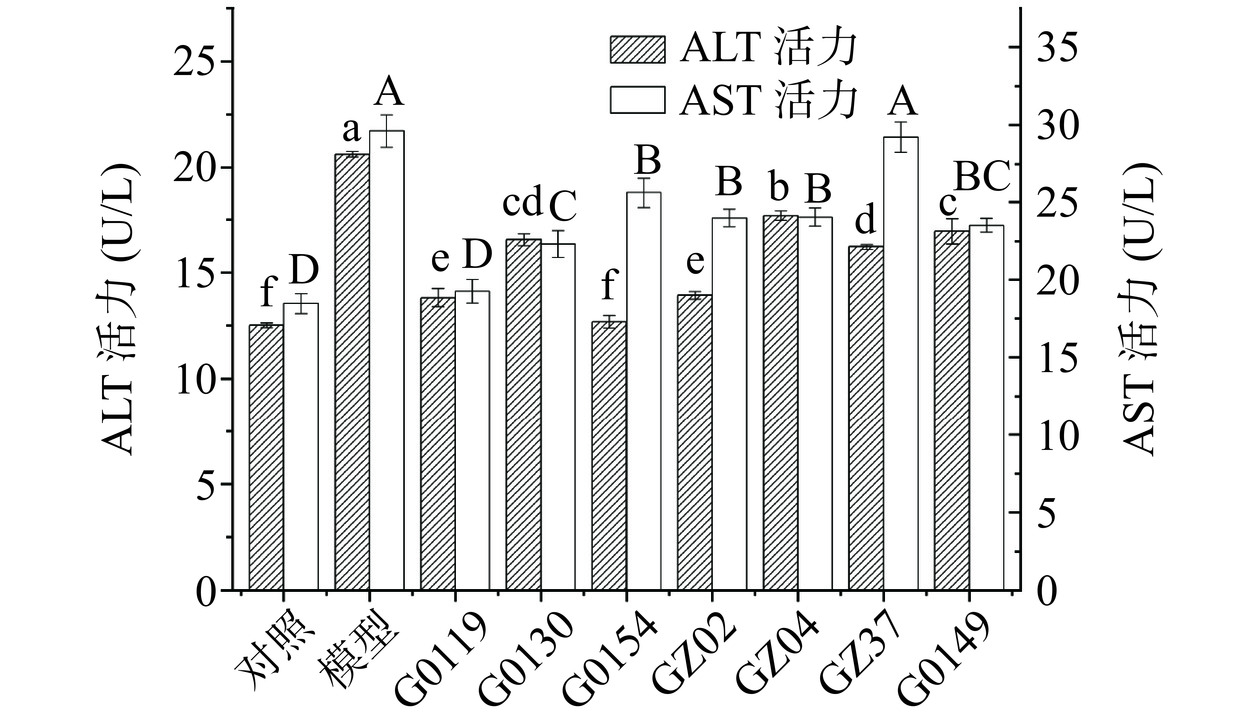
如图5所示,与对照组相比,模型组中的ALT与AST活力显著上升(P<0.05),与模型组相比,样品组ALT与AST活力显著降低(P<0.05)。结果表明,7种灵芝水提物均可以不同程度地降低ALT和AST活力,从而减轻乙醇诱导细胞的损伤;在ALT水平,G0154的作用效果要显著优于其他菌株(P<0.05),其次为G0119,ALT活力分别从模型组的20.63 U/L显著降低至12.68、13.81 U/L;在AST水平,G0119水提物的作用效果显著优于其他菌株(P<0.05),AST活力由模型组的29.62 U/L显著降低至19.26 U/L(P<0.05)。综合比较,G0119的水提物作用效果较佳。
2.6 不同灵芝菌株发酵水提物对乙醇损伤LO2细胞氧化应激的影响
2.6.1 不同灵芝菌株发酵水提物对乙醇损伤LO2细胞ROS水平的影响
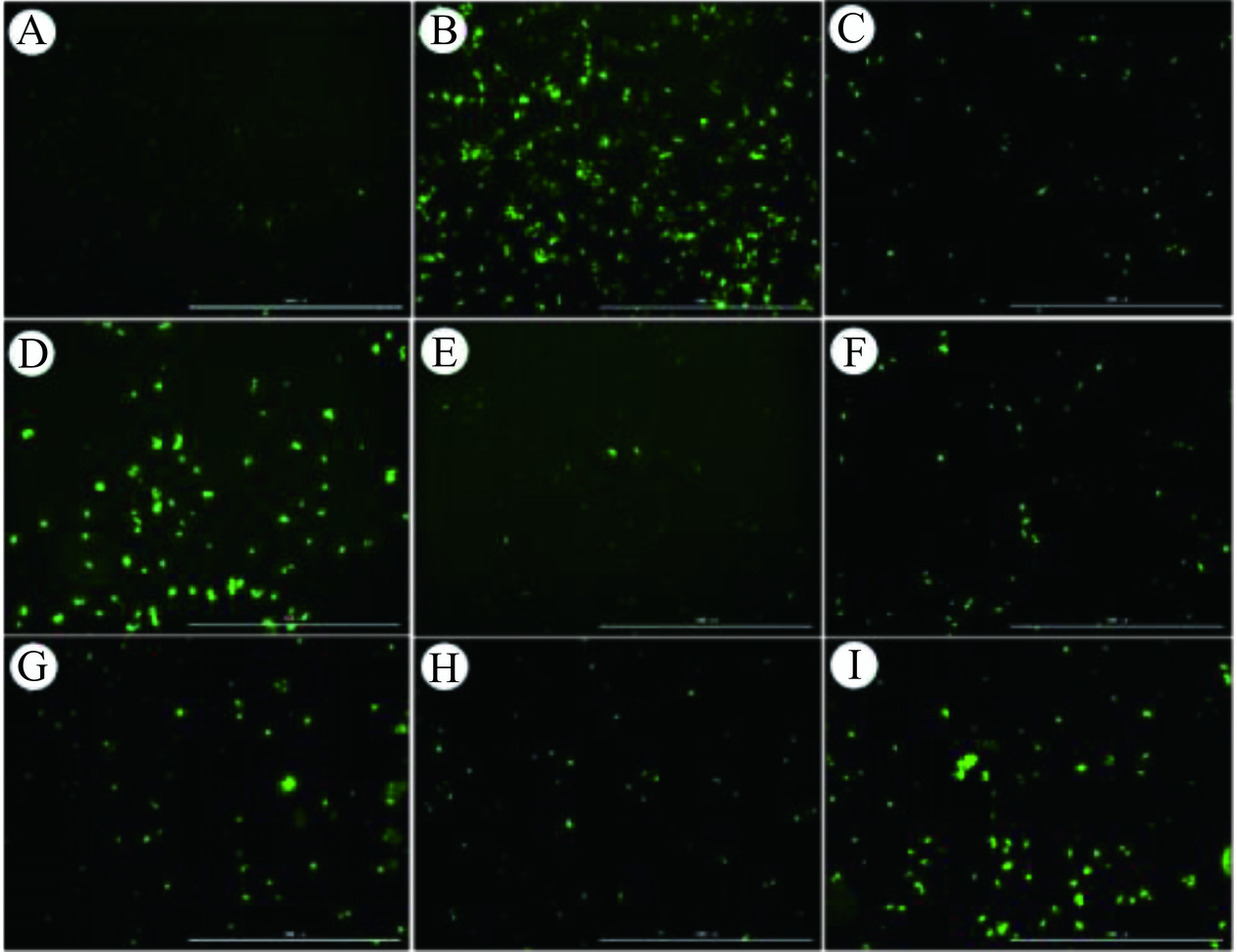
如图6,与对照组相比,模型组中ROS水平明显上升;而经不同水提物处理后,细胞内ROS水平均有不同程度的降低。乙醇在肝脏中会被细胞色素P450氧化,此过程会产生过量的ROS,因此,乙醇诱导后的模型组ROS水平激增,灵芝菌丝体水提物处理可以降低细胞内的ROS水平,从而减轻乙醇诱导LO2细胞造成的氧化损伤。如表2所示,通过比较各组细胞内的荧光粒子数,G0119和G0154组的荧光粒子数相较模型组,分别降低至136与103个,优于其他五组。
表 2 各组细胞内荧光粒子的比较Table 2. Comparison of intracellular fluorescent particles in different groups组别 水提物 对照组 模型组 G0119 G0130 G0154 GZ02 GZ04 GZ37 GZ149 荧光粒子
数(个)82 425 136 314 103 203 295 175 321 2.6.2 不同灵芝菌株发酵菌丝体水提物对乙醇损伤LO2细胞SOD、GSH和MDA水平的影响
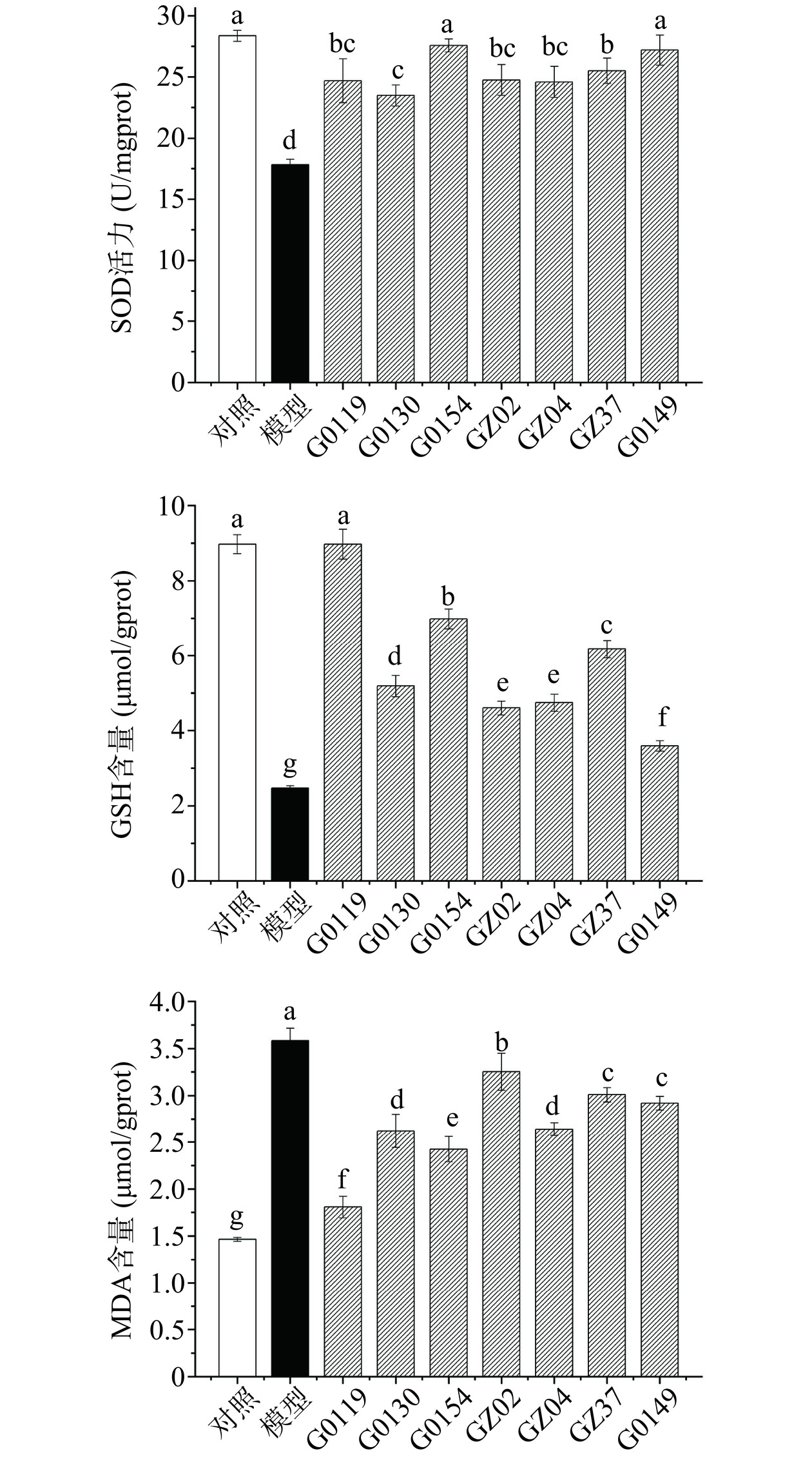
如图7所示,与对照组相比,模型组中的SOD活力与GSH含量显著降低(P<0.05),而MDA的含量显著上升(P<0.05);相较模型组,细胞经不同水提物处理后,SOD活力、GSH含量均有不同程度的升高,MDA的含量有不同程度的降低。不同菌株间作用效果均有一定差异,在SOD水平,G0154和G0149的作用效果显著优于其他菌株(P<0.05),SOD活力由模型组的17.85 U/mgprot恢复至27.57 U/mg prot与27.19 U/mg prot;在GSH与MDA水平上,G0119水提物的作用效果显著优于其他菌株,GSH含量从模型组的2.47 μmol/g prot增加到8.97 μmol/g prot,而MDA含量从模型组的3.58 μmol/gprot降低到1.81 μmol/ gprot(P<0.05),其次为G0154。上述结果表明,灵芝菌丝体水提物可以通过增加SOD活力、GSH含量和降低MDA含量来减轻乙醇诱导造成的细胞氧化损伤,不同菌株间具有一定差异。综合比较G0119与G0154水提物的作用效果优于其他菌株。因此,G0119与G0154可以作为具有保肝作用的优势菌株。
2.7 相关性分析
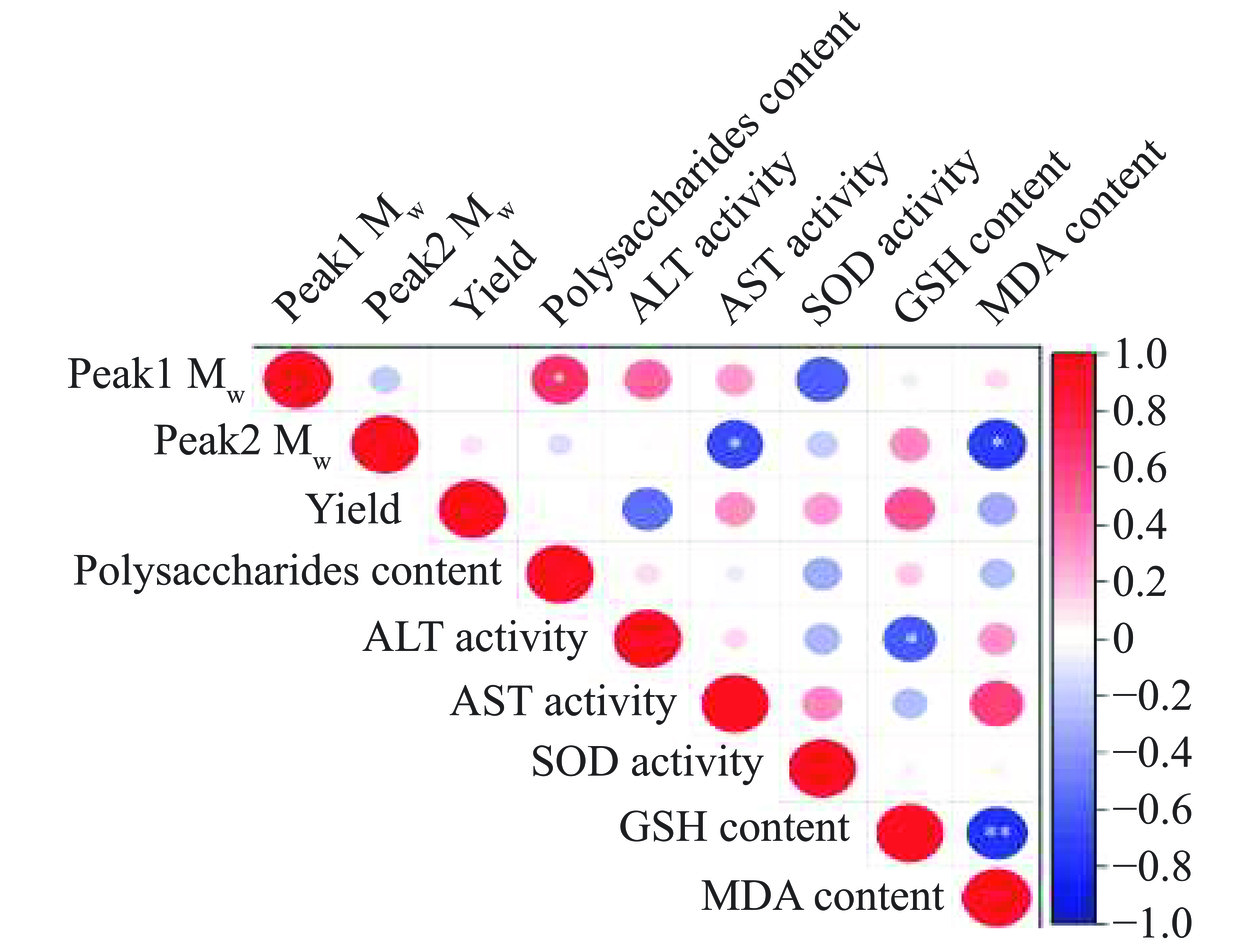
为了进一步分析不同水提物中发挥保肝作用的组分,本研究对水提物得率、多糖含量、分子量分布与保肝活性相关指标进行了Pearson相关性分析。结果如图8所示,水提物中多糖组分2的分子量分布与AST含量、MDA含量呈显著负相关(P<0.05),R2分别为−0.69和−0.75。即在一定范围内,水提物的分子量越大,AST含量越低,MDA含量越低,体外活性越强。GSH与ALT的水平也呈显著负相关(R2=-0.62,P<0.05),表明细胞内的氧化损伤水平与肝细胞损伤具有一定的相关性,可以共同调控肝细胞活性;GSH含量和MDA含量呈极显著负相关(R2=−0.81,P<0.01),共同表征细胞内氧化应激水平,因此,后续可以只采用一种指标进行检测。
水提物中多糖的含量与保肝活性并无显著相关性,推测可能是因为水提物中除了多糖外,还有蛋白质、多肽等活性成分,这些物质对保肝作用起到一个协同作用。通过对分子量分布的分析,推测多糖的结构不同对水提物保肝活性的影响较大。前期研究表明,食用菌多糖的生物活性与其高级结构和分子量有直接关系[25]。
3. 讨论与结论
酒精性肝病(Alcoholic liver disease,ALD)的发病机制非常复杂,多种途径协同参与ALD的发生与发展[26−28]。氧化应激是机体或细胞内氧化和抗氧化系统之间的平衡被破坏造成的应激状态,是肝脏疾病发生和恶化的原因之一,被认为是导致ALD发生和发展的重要病理机制[29]。长期饮酒能够造成过氧化物酶活力和谷胱甘肽等抗氧化物质含量下降,导致不能有效地清除活性氧,促进氧化应激的发生,最终造成肝细胞损伤[30−31]。
转氨酶是催化氨基酸与酮酸之间氨基转移的一类酶,临床上常以测定ALT与AST做为检测肝功能的指标。正常情况下,ALT与AST主要存在于肝细胞的胞浆和线粒体中。当过量摄入酒精时,肝细胞受到损伤,从而使肝细胞中的转氨酶渗透到细胞外,造成细胞培养液中ALT、AST的活性升高[32]。本研究以细胞存活率与上清液中的ALT、AST活力为指标,确定了乙醇体外诱导肝损伤的最佳条件以及不同灵芝菌株发酵提取物对其保护作用。乙醇诱导后,LO2细胞存活率会显著下降(P<0.05),且细胞上清中的ALT与AST活力升高,这表明乙醇破坏了LO2的细胞膜结构,对LO2细胞造成了一定程度的损伤,而经灵芝菌丝体水提物处理后,细胞存活率显著增加(P<0.05),ALT与AST活力显著下降(P<0.05),表明样品对损伤的LO2细胞起到了一定修复作用。乙醇可以通过多种途径介导氧化应激,包括活性氧的生成和脂质过氧化等[33]。SOD能够清除细胞内被氧化的脂质以及过氧自由基来维持细胞内的氧化还原稳态,从而达到保护细胞的作用[34]。GSH是一种重要的抗氧化剂,是对抗自由基的重要防线,能够清除机体内的自由基[35]。MDA是脂质过氧化反应的副产物,MDA积累会引起一系列反应[35]。本研究中,经乙醇诱导后,模型组ROS水平上升,SOD活性和GSH水平显著降低(P<0.05),MDA含量增加,从而导致细胞内氧化还原系统紊乱,损伤细胞内的大分子物质及其他组分,抑制肝细胞的正常代谢和生长。经不同灵芝菌丝体水提物处理后,细胞内ROS水平降低,SOD活性与GSH含量显著升高(P<0.05),MDA含量显著降低(P<0.05)。结果表明灵芝发酵水提物可以通过清除氧化应激,调节抗氧化系统平衡、降低脂质过氧化水平,达到保护肝细胞的作用。为了进一步验证灵芝水提物中发挥保肝作用的活性成分,对水提物中多糖的理化特性与保肝活性相关指标进行了相关性分析,在一定范围内,水提物中的多糖组分分子量越大,其活性越强,多糖的分子量大小与其保肝活性呈负相关,但是多糖的其他结构是否影响其保肝活性,以及水提物中其他能够发挥保肝作用的活性成分还需要进一步挖掘。
综上所述,灵芝菌丝体水提物可以通过降低ALT、AST水平,同时恢复细胞内抗氧化系统平衡,清除氧化应激,使细胞存活率显著增加,达到保护肝细胞的作用,来源于不同菌株的水提物其作用效果具有一定差异,综合比较,G0119与G0154菌株的作用效果优于其他菌株。因此,G0119与G0154可以作为开发具有保肝功能产品的优势菌株。
-
表 1 不同灵芝菌株发酵菌丝体水提取物分子量分布特征
Table 1 Analysis of molecular weight characteristics of water extracts from different G. lucidum mycelia
菌株名称 Peak 1 Peak 2 重均分子量Mw(g/mol) 多分散系数Mw/Mn 重均分子量Mw(g/mol) 多分散系数Mw/Mn G0119 5.144×106 2.166 8.075×105 1.052 G0130 2.617×107 1.524 4.574×105 1.613 G0154 6.402×106 1.412 4.898×105 1.411 GZ02 5.404×106 2.365 3.431×105 1.314 GZ04 1.495×107 1.881 8.082×105 1.397 GZ37 2.081×107 1.588 2.190×105 1.184 G0149 2.147×106 1.431 4.483×105 1.182 表 2 各组细胞内荧光粒子的比较
Table 2 Comparison of intracellular fluorescent particles in different groups
组别 水提物 对照组 模型组 G0119 G0130 G0154 GZ02 GZ04 GZ37 GZ149 荧光粒子
数(个)82 425 136 314 103 203 295 175 321 -
[1] SHIELD K D, RYLETT M, GMEL G, et al. Global alcohol exposure estimates by country, territory and region for 2005-a contribution to the comparative risk assessment for the 2010 global burden of disease study[J]. Addiction,2013,108(5):912−922. doi: 10.1111/add.12112
[2] STICKEL F, MORENO C, HAMPE J, et al. The genetics of alcohol dependence and alcohol-related liver disease[J]. Journal of Hepatology,2017,66:195−211. doi: 10.1016/j.jhep.2016.08.011
[3] 曲航, 高鑫, 伊娟娟, 等. 食源性天然产物对酒精性肝损伤的防护作用研究进展[J]. 食品科学,2020,41(17):283−290. [QU H, GAO X, YI J J, et al. Review on the protective effects of food-derived natural compounds on alcohol-induced liver injury[J]. Food Science,2020,41(17):283−290.] QU H, GAO X, YI J J, et al. Review on the protective effects of food-derived natural compounds on alcohol-induced liver injury[J]. Food Science, 2020, 41(17): 283−290.
[4] 叶红球. 枳椇子水提取液对乙醇体外诱导肝细胞株LO2细胞损伤的影响[D]. 长沙:中南大学, 2012. [YE H Q. Effects of Hovenia dulcis Thunb. liquid on the injured LO2 cells induced by ehanol in vitro[D]. Changsha:Zhongnan University, 2012.] YE H Q. Effects of Hovenia dulcis Thunb. liquid on the injured LO2 cells induced by ehanol in vitro[D]. Changsha: Zhongnan University, 2012.
[5] 杨颖. 白术多糖的分离纯化与结构解析及其对急性酒精性肝损伤保护作用研究[D]. 南京:南京中医药大学, 2021. [YANG Y. Isolation and chemical composition and protective effect on acute alcoholic liver injury of Atractylodes macrocephala polysaccharide[D]. Nanjing:Nanjing University of Chinese Medicine, 2021.] YANG Y. Isolation and chemical composition and protective effect on acute alcoholic liver injury of Atractylodes macrocephala polysaccharide[D]. Nanjing: Nanjing University of Chinese Medicine, 2021.
[6] QIN X, MA G H, LIU L P, et al. Microwave-assisted degradation of β-D-glucan from Ganoderma lucidum and the structural and immunoregulatory properties of oligosaccharide fractions[J]. International Journal of Biological Macromolecules,2022,20:1197−1211.
[7] SCHEPETKIN I A, QUINN M T. Botanical polysaccharides:Macrophage immunomodulation and therapeutic potential[J]. International Immunopharmacology,2006,6(3):317−333. doi: 10.1016/j.intimp.2005.10.005
[8] PARK M H, KIM M. Antioxidant and anti-Inflammatory activity and cytotoxicity of ethanol extracts from rhynchosia nulubilis cultivated with Ganoderma lucidum mycelium[J]. Preventive Nutrition and Food Science,2018,23(4):326−334. doi: 10.3746/pnf.2018.23.4.326
[9] 唐晨旻, 张劲松, 刘艳芳, 等. pH对灵芝液态发酵代谢物及抗氧化活性的影响[J]. 菌物学报,2023,42(2):570−583. [TANG C M, ZHANG J S, LIU Y F, et al. Effects of pH on metabolites and antioxidant activities of Ganoderma lingzhi liquid fermentation[J]. Mycosystema,2023,42(2):570−583.] TANG C M, ZHANG J S, LIU Y F, et al. Effects of pH on metabolites and antioxidant activities of Ganoderma lingzhi liquid fermentation[J]. Mycosystema, 2023, 42(2): 570−583.
[10] ABREU H, SIMAS F F, SMIDERLE F R S, et al. Gelling functional property, anti-inflammatory and antinociceptive bioactivities of β-D-glucan from the edible mushroom Pholiota nameko[J]. International Journal of Biological Macromolecules,2019,122:1128−1135. doi: 10.1016/j.ijbiomac.2018.09.062
[11] 刘洋, 韩忠明, 张瑞, 等. 灵芝保肝作用的研究进展[J]. 特产研究,2023,45(6):159−165. [LIU Y, HAN Z M, ZHANG R, et al. Research progress on the hepatoprotective effect of Ganoderma lucidum[J]. Special Wild Economic Animal and Plant Research,2023,45(6):159−165.] LIU Y, HAN Z M, ZHANG R, et al. Research progress on the hepatoprotective effect of Ganoderma lucidum[J]. Special Wild Economic Animal and Plant Research, 2023, 45(6): 159−165.
[12] CHIU H F, FU H Y, LU Y Y, et al. Triterpenoids and polysaccharide peptides-enriched Ganoderma lucidum:A randomized, double-blind placebo-controlled crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers[J]. Pharmaceutical Biology,2017,55:1041−1046. doi: 10.1080/13880209.2017.1288750
[13] GAO Z, YUAN F F, LI H P, et al. The ameliorations of Ganoderma applanatum residue polysaccharides against CCl4 induced liver injury[J]. International Journal of Biological Macromolecules,2019,137:1130−1140. doi: 10.1016/j.ijbiomac.2019.07.044
[14] 陈玉胜, 陈全战. 灵芝多糖对CCl4诱导的急性肝损伤小鼠的抗炎和保肝活性[J]. 食品科学,2017,38(17):210−215. [CHEN Y S, CHEN Q Z. Anti-inflammatory and hepatoprotective effects of Ganoderma lucidum polysaccharides on carbon tetrachloride-induced acute liver injury in mice[J]. Food Science,2017,38(17):210−215.] CHEN Y S, CHEN Q Z. Anti-inflammatory and hepatoprotective effects of Ganoderma lucidum polysaccharides on carbon tetrachloride-induced acute liver injury in mice[J]. Food Science, 2017, 38(17): 210−215.
[15] GUO W L, CAO Y J, YOU S Z, et al. Ganoderic acids-rich ethanol extract from Ganoderma lucidum protects against alcoholic liver injury and modulates intestinal microbiota in mice with excessive alcohol intake[J]. Current Research in Food Science,2022,5:515−530. doi: 10.1016/j.crfs.2022.02.013
[16] 王庆武, 兰玉菲, 安秀荣, 等. 灵芝品种对比试验[J]. 食用菌学报,2010(5):25−27. [WANG Q W, LAN Y F, AN X R, et al. Ganoderma species comparison test[J]. Acta Edulis Fungi,2010(5):25−27.] WANG Q W, LAN Y F, AN X R, et al. Ganoderma species comparison test[J]. Acta Edulis Fungi, 2010(5): 25−27.
[17] 李娜. 高产多糖和三萜的液态发酵专用灵芝优势菌株筛选及促三萜生成机制的探索[D]. 上海:上海海洋大学, 2021. [LI N. Screening of dominant strains of Ganoderma lucidum for liquid fermentation with high production of polysaccharides and triterpenes and exploration of the mechanism of promoting triterpenoid production[D]. Shanghai:Shanghai Ocean University, 2021.] LI N. Screening of dominant strains of Ganoderma lucidum for liquid fermentation with high production of polysaccharides and triterpenes and exploration of the mechanism of promoting triterpenoid production[D]. Shanghai: Shanghai Ocean University, 2021.
[18] 刘洁纯. 灵芝抗氧化发酵产物的制备及其在化妆品中的应用[D]. 上海:上海应用技术大学, 2020. [LIU J C. Preparation of antioxidant fermentation products of Ganoderma lucidum and its application of in cosmetics[D]. Shanghai:Shanghai University of Applied Technology, 2020.] LIU J C. Preparation of antioxidant fermentation products of Ganoderma lucidum and its application of in cosmetics[D]. Shanghai: Shanghai University of Applied Technology, 2020.
[19] 高坤, 冯杰, 颜梦秋, 等. 灵芝液态发酵高产胞外多糖菌株筛选及多糖特性分析[J]. 菌物学报,2019,38(6):886−894. [GAO K, FENG J, YAN M Q, et al. Screening of extracellular polysaccharide high-yielding strains of Ganoderma lingzhi in liquid submerged fermentation and polysaccharide characteristic analysis[J]. Mycosystema,2019,38(6):886−894.] GAO K, FENG J, YAN M Q, et al. Screening of extracellular polysaccharide high-yielding strains of Ganoderma lingzhi in liquid submerged fermentation and polysaccharide characteristic analysis[J]. Mycosystema, 2019, 38(6): 886−894.
[20] 王联珠, 李晓庆, 顾晓慧, 等. 干海参外源性总糖的测定方法[J]. 食品科学,2013,34(14):293−297. [WANG L Z, LI X Q, GU X H, et al. A method for determination of exogenous total sugar in dried sea cucumber[J]. Food Science,2013,34(14):293−297.] doi: 10.7506/spkx1002-6630-201314061 WANG L Z, LI X Q, GU X H, et al. A method for determination of exogenous total sugar in dried sea cucumber[J]. Food Science, 2013, 34(14): 293−297. doi: 10.7506/spkx1002-6630-201314061
[21] 黄小兰, 周祥德, 杨勤, 等. 不同产地地参中总糖、可溶性多糖和还原糖含量的比较分析[J]. 中国野生植物资源,2020,39(6):23−27. [HUANG X L, ZHOU X D, YANG Q, et al. Content comparative analysis of total sugar, soluble polysaccharide and reducing sugar in Lycopus lucidus var. hirtus regel from different habitats[J]. Chinese Wild Plant Resources,2020,39(6):23−27.] HUANG X L, ZHOU X D, YANG Q, et al. Content comparative analysis of total sugar, soluble polysaccharide and reducing sugar in Lycopus lucidus var. hirtus regel from different habitats[J]. Chinese Wild Plant Resources, 2020, 39(6): 23−27.
[22] 刘静, 周帅, 李德顺, 等. 五种食用菌多糖结构特征及其体外激活Dectin-1受体活性比较[J]. 食用菌学报,2021,28(5):87−95. [LIU J, ZHOU S, LI D S, et al. Characterization and Dectin-1 activation activity of polysaccharides from ftuiting bodies of five edible fungi[J]. Acta Edulis Fungi,2021,28(5):87−95.] LIU J, ZHOU S, LI D S, et al. Characterization and Dectin-1 activation activity of polysaccharides from ftuiting bodies of five edible fungi[J]. Acta Edulis Fungi, 2021, 28(5): 87−95.
[23] 朱晓璐, 韩伟, 冯娜, 等. 赤芝规模化液态深层发酵及其产物抗肿瘤活性研究[J]. 上海农业学报,2021,37(3):24−28. [ZHU X L, HAN W, FENG N, et al. Large scale submerged fermentation of Ganoderma lucidum and antitumor activity of its product[J]. Acta Agriculturae Shanghai,2021,37(3):24−28.] ZHU X L, HAN W, FENG N, et al. Large scale submerged fermentation of Ganoderma lucidum and antitumor activity of its product[J]. Acta Agriculturae Shanghai, 2021, 37(3): 24−28.
[24] 周泓妍, 郑怡, 王海东, 等. 南、北五味子蛋白抗氧化活性和对HepG2细胞氧化应激损伤的修复作用[J]. 食品与发酵工业, 2024, 50(7):51−60. [ZHOU H Y, ZHENG Y, WANG H D, et al. Antioxidant activity of Schisandrae sphenantherae and Schisandrae chinensis protein on HepG2 cells[J]. Food and Fermentation Industries, 2024, 50(7):51−60.] ZHOU H Y, ZHENG Y, WANG H D, et al. Antioxidant activity of Schisandrae sphenantherae and Schisandrae chinensis protein on HepG2 cells[J]. Food and Fermentation Industries, 2024, 50(7): 51−60.
[25] LIU Y F, TANG Q J, FENG J, et al. Effects of molecular weight on intestinal anti-inflammatory activities of β-D-glucan from Ganoderma lucidum[J]. Frontiers in Nutrition,2022,9:1028727. doi: 10.3389/fnut.2022.1028727
[26] 柯剑. “黄陂荆蜜”的解酒保肝活性与作用机制[D]. 武汉:华中农业大学, 2017. [KE J. The activity of “huang pi vitex honey” on dealcohol and hepatoprotective protective and the mechanism[D]. Wuhan:Huazhong Agricultural University, 2017.] KE J. The activity of “huang pi vitex honey” on dealcohol and hepatoprotective protective and the mechanism[D]. Wuhan: Huazhong Agricultural University, 2017.
[27] TESCHKE R. Alcoholic liver disease:alcohol metabolism, cascade of molecular mechanisms, cellular targets, and clinical aspects[J]. Biomedicines,2018,6(4):106−162. doi: 10.3390/biomedicines6040106
[28] 夏志宇, 刘协红, 邹联洪, 等. 灵芝酸A对α-鹅膏毒肽诱导的LO2肝细胞损伤的影响[J]. 中国临床药理学杂志,2021,37(24):3346−3349. [XIA Z Y, LIU X H, ZHOU L H, et al. Effects of ganoderica acid A on LO2 hepatocyte injury cells induced by α-amanoditide[J]. Clinical and Basic Bridging Research,2021,37(24):3346−3349.] XIA Z Y, LIU X H, ZHOU L H, et al. Effects of ganoderica acid A on LO2 hepatocyte injury cells induced by α-amanoditide[J]. Clinical and Basic Bridging Research, 2021, 37(24): 3346−3349.
[29] DOGRA A, GUPTA D, BAG S, et al. Glabridin ameliorates methotrexate-induced liver injury via attenuation of oxidative stress, inflammation, and apoptosis[J]. Life Sciences,2021,278:119583−119583. doi: 10.1016/j.lfs.2021.119583
[30] LEVENE A P, GOLDINR D. The epidemiology, pathogenesisand histopathology of fatty liver disease[J]. Histopathol,2012,61(2):141−152. doi: 10.1111/j.1365-2559.2011.04145.x
[31] KOWALCZYK P, SULEJCZAK D, KLECZKOWSKA P, et al. Mitochondrial oxidative stress-a causative factor and thera peutic target in many diseases[J]. International Journal of Molecular Sciences,2021,22(24):13384. doi: 10.3390/ijms222413384
[32] 舒承倩. 赶黄草配伍葛花对乙醇诱导的细胞损伤模型的研究[D]. 重庆:重庆医科大学, 2018. [SHU C Q. The effect of compatibility of penthorum chinense pursh and flos puerariae in L-02 liver cells induced by ethanol[D]. Chongqing :Chongqing Medical University, 2018.] SHU C Q. The effect of compatibility of penthorum chinense pursh and flos puerariae in L-02 liver cells induced by ethanol[D]. Chongqing : Chongqing Medical University, 2018.
[33] 颜蜜, 滕春丽, 陶会, 等. 红托竹荪多糖对大鼠酒精性肝损伤的保护作用[J]. 菌物学报,2022,41(2):291−302. [YAN M, TENG C L, TAO H, et al. Protective effects of Dictyophora rubrovalvata polysaccharide on alcoholic liver injury in rats[J]. Mycosystema,2022,41(2):291−302.] YAN M, TENG C L, TAO H, et al. Protective effects of Dictyophora rubrovalvata polysaccharide on alcoholic liver injury in rats[J]. Mycosystema, 2022, 41(2): 291−302.
[34] JAYAKUMAR T, RAMESH E, & GERALDINE, P. Antioxidant activity of the oystermushroom, Pleurotus ostreatus, on CCl4-induced liver injury in rats[J]. Food and Chemical Toxicology,2006,44:1989−1996. doi: 10.1016/j.fct.2006.06.025
[35] ZHAO C, FAN J L, LIU Y Y, et al. Hepatoprotective activity of Ganoderma lucidum triterpenoids in alcohol-induced liver injury in mice, an iTRAQ-based proteomic analysis[J]. Food Chemistry,2019,271(15):148−156.





 下载:
下载:
 下载:
下载:



