Analysis of Phenolic Substances in Citrus microcarpa with Nature Fermentation and Evaluation of Its Inhibitory Activites on Digestion-related Enzymes
-
摘要: 为了解自然发酵对青金桔酚类物质变化及抑制消化相关酶活性的影响,本研究测定了发酵前后青金桔可溶性总酚、总黄酮及α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶抑制率等变化情况,基于超高效液相色谱-四极杆/静电场轨道阱傅里叶转换联用质谱仪鉴定了发酵前后酚类物质的种类,筛选了发酵前后酚类差异代谢物及其富集通路。最后,基于相关系数分析了酚类差异代谢物对抑制以上消化相关酶活性的相关性。结果表明:自然发酵可使青金桔中可溶性总酚、总黄酮含量分别提升9.20%、23.68%,α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶抑制率提升11.90%~28.50%;青金桔中共检测到酚类物质52种,发酵未改变酚类物质种类,但可使川陈皮素、咖啡酸、牡荆素等9种酚类物质显著增加,甲氧沙林显著降低(P<0.01),显著影响以上酚类差异代谢物变化的通路有苯丙烷类化合物的生物合成通路、黄酮和黄酮醇生物合成通路、类黄酮生物合成通路及多种次生代谢产物的生物合成Ⅰ通路;川陈皮素、芹菜素、咖啡酸、山奈酚这4种酚类差异代谢物与抑制以上三种消化相关酶活性呈显著正相关(P<0.05)。因此,自然发酵可促进青金桔中可溶性总酚、总黄酮释放,提升消化相关酶抑制活性,其可作为青金桔加工的一种有效手段。Abstract: To understand the effects of natural fermentation on the changes of phenolic substances in Citrus microcarpa and the inhibition of digestive enzymes, the changes of soluble total phenol, total flavone, α-amylase, α-glucosidase, and pancreatic lipase inhibition rates before and after fermentation were measured. The types of phenolic substances before and after fermentation were identified by UPLC-Q Exactive Orbitrap-MS, and the differential metabolites and their enrichment pathways were screened. Finally, the correlation relationships between the different phenolic metabolites and the inhibitory activities of the above digestion-related enzymes were analyzed based on the correlation coefficient. The results showed that natural fermentation could increase the contents of soluble total phenol and total flavone by 9.20% and 23.68%, respectively, and increase the inhibition rates of α-amylase, α-glucosidase and pancreatic lipase from 11.90% to 28.50%. A total of 52 phenolic substances were detected in Citrus microcarpa. Fermentation did not change the types of phenolic substances, but it significantly increased nine phenolic substances such as nobiletin, caffeic acid, and vitexin, and significantly decreased methoxsarin (P<0.01). The four kinds of pathways significantly affected the change of the above phenolic metabolites, including the biosynthetic pathway of phenylpropane compounds, flavone and flavonol biosynthesis, flavonoid biosynthesis, biosynthesis Ⅰ pathway of various plant secondary metabolites. There was a significant positive correlation between the inhibitory activities of three digestive enzymes and the four different phenolic metabolites, which were nobiletin, apigenin, caffeic acid, and kaempferol (P<0.05). Therefore, natural fermentation can promote the release of soluble total phenol and total flavone in Citrus microcarpa and improve the inhibition rate of digestion-related enzymes, which can be used to effectively process Citrus microcarpa.
-
青金桔(Citrus microcarpa)为芸香科柑橘族金柑属,是宽皮柑橘(Citrus reticulate Blanco)和金桔(Fortunella spp.)的杂交品种[1],主要分布于我国海南省、台湾地区以及马来西亚、印度尼西亚、泰国、菲律宾等热带及亚热带地区,其产量可达5~8吨/年。目前海南省青金桔产量在25万吨/年左右,占全国青金桔总产量的90%以上。酚类化合物是植物中普遍存在的次级代谢产物,也是柑橘类水果中主要的功能活性物质,具有抗氧化、降血脂、防止肥胖、改善糖尿病等多种生物活性[2−5]。青金桔皮中酚类物质含量可达到1054~1894 mg/100 g[6],主要以根皮素-3',5'-二-C-β-葡萄糖苷、橙皮苷、川陈皮素、桔皮素等为主[7]。研究表明,以上酚类物质具有较好的抗氧化、抑制酪氨酸酶活性[1],以及降血糖、降血脂、降胆固醇等生理功能[4]。青金桔产量较高,其所含酚类物质等具有较好的功能活性,但目前青金桔深加工产品较为缺乏,现主要用于榨汁。并且,榨汁后产生大约45%的皮渣副产物,由于缺乏相应的加工技术,其基本被丢弃,从而造成较大的资源浪费和环境污染[8]。
果蔬自然发酵是指新鲜果蔬在添加或不添加辅料的条件下,通过果蔬自身携带及环境中的微生物的新陈代谢作用,合成具有多种生物活性的酶类和代谢产物的过程。因其具有设备投入少、操作简单、发酵产品风味独特,能实现对集中收获果蔬的快速加工等特点,现已成为果蔬加工研究的热点[9]。青金桔富含水、有机酸、果胶、糖类、维生素以及丰富的微量元素[10],在不添加任何其他物质的条件下,可作为自然发酵的天然培养基。因此,采用全果浆自然发酵可实现青金桔100%全利用,最大程度保留青金桔营养和风味。研究表明,微生物发酵果蔬过程中可产生纤维素酶等[11],促使植物细胞壁结构物质水解,促进可溶性酚类物质释放,从而改善发酵产物生理活性[12]。尽管如此,目前针对青金桔酚类物质的报道主要集中在提取及抗氧化性的变化[7,13],缺乏青金桔酚类物质种类系统、全面的研究,关于青金桔在发酵前后酚类物质的变化情况尚不不清楚,青金桔酚类物质对α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶等消化相关酶活性抑制情况也未见报道,这对青金桔的深加工及综合利用影响较大。非靶向代谢组学技术具有高通量、高灵敏度、检测范围广等特点,可最大程度检测样品中的代谢物,从而较为全面地反映样品的总代谢物特征,其在动植物代谢研究方面被广泛应用[14−16]。
为全面、系统地阐明青金桔酚类物质种类及自然发酵对青金桔酚类物质变化、消化相关酶活性抑制情况。本研究对青金桔全果浆进行自然发酵,比较了发酵前后青金桔可溶性总酚、总黄酮、结合酚含量及抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性的变化情况。基于超高效液相色谱-四极杆/静电场轨道阱傅里叶转换联用质谱仪(UPLC-Q Exactive Orbitrap-MS)代谢组学技术,对自然发酵前后酚类物质种类、酚类差异代谢物及其代谢通路进行分析,最后利用相关系数分析探讨酚类差异代谢物与可溶性总酚、α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶抑制率的相关关系,为自然发酵在青金桔加工中的应用提供参考。
1. 材料与方法
1.1 材料与仪器
青金桔 海南青金桔食品科技有限公司;甲醇 色谱纯,德国CNW公司;甲酸 色谱纯,上海阿拉丁生化科技股份有限公司;乙腈(色谱纯)、α-淀粉酶(≥5 units/mg,来源于猪胰)、胰脂肪酶(8×USP)、4-硝基苯基乙酸酯(分析纯) Sigma-aldrich西格玛奥德里奇(上海)贸易有限公司;α-葡萄糖苷酶(≥50 units/mg,来源于酵母)、对硝基苯基-α-D-吡喃葡萄糖(分析纯) 上海源叶生物科技有限公司。
DMM-40型胶体磨 上海秦硕化工机械设备有限公司;LGJ-10NS/GC型冷冻干燥机 北京亚星仪科科技发展有限公司;CenLee16X台式高速离心机 湖南湘立科学仪器有限公司;PLUS-E2-20TJ实验室级超纯水机 南京易普易达科技发展有限公司;FlexA-200酶联免疫分析仪 杭州优米仪器有限公司;UPLC-Q Exactive Orbitrap-MS超高效液相色谱-四极杆静电场轨道阱傅里叶转换联用质谱仪 Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 青金桔全果浆发酵样品的制备
青金桔清洗晾干后,全果打浆,过筛,放入发酵罐中自然发酵10 d。分别在未发酵(A组)以及发酵10 d后(B组)取样,4个生物学重复分别命名为A1、A2、A3、A4和B1、B2、B3、B4。取样后样品存放于−80 ℃冰箱中12 h,取出冷冻干燥12 h,装入带有磨口的棕色瓶中,−18 ℃储存,备用。
1.2.2 可溶性总酚提取及样液制备
1.2.2.1 可溶性总酚提取
酚类物质提取参考Rodríguez等[15]的方法,并进行了适当修改,具体方法如下。准确称取冷冻干燥后的样品0.2 g于15 mL离心管中,加入10 mL 70%甲醇浸泡,将样品置于超声清洗器中,360 W、50 ℃超声30 min。样品提取液用0.22 μm孔径滤膜过滤。
1.2.2.2 UPLC-Q Exactive Orbitrap-MS测试样液制备
取以上部分提取液于1.5 mL离心管中,−40 ℃静置1 h,于4 ℃、12000 r/min下离心15 min。移取200 μL上清,上机测定。质控样(quality control samples)由等量A、B组总酚提取液混合制备而成。
1.2.3 总酚含量的测定
方法参考Lou等[6],并进行适当修改。具体如下,125 μL上述提取液或标准物质与125 μL的福林酚试剂(Folin & Ciocalteu酚试剂)反应3 min。混合物加入到1.25 mL 20%的Na2CO3溶液中,室温条件下、黑暗环境反应30 min,过0.22 μm孔径滤膜,取200 μL于750 nm处测定吸光值。以70%甲醇溶液为空白,标准物质为没食子酸(GA)(50~500 μg/mL)。总酚以mgGA当量/100 g冻干样品表示。每个样品测试4次,取平均值。
1.2.4 总黄酮测定
方法参考Lou等[7],并进行适当修改。具体如下,取可溶性总酚提取液500 μL置于2 mL离心管中,向其加入30 μL 5% NaNO2溶液,振荡摇匀,置于室温条件下5 min;继续加入30 μL的10% AlCl3溶液,振荡摇匀后置于温室下放置6 min;加入200 μL 1 mol/L NaOH溶液,最后用70%甲醇溶液将反应混合液总体积定容至1 mL;将溶液再次振荡混匀,在室温下反应30 min。用酶标仪测定其在510 nm处的吸光度。以70%甲醇溶液作为空白对照,用20.0~100.0 μg/mL芦丁作为标准黄酮化合物,绘制芦丁的标准曲线。样品中总黄酮含量以mg芦丁/100 g冻干样表示。
1.2.5 结合态多酚测定
方法参考Multari等[17],并进行适当修改。具体如下,取上述可溶性总酚提取后剩余滤渣,转入真空冷冻旋转蒸发仪中,于50 ℃的条件下蒸干。加入10 mol/L NaOH溶液2 mL(渣:NaOH溶液=1:10,W/V),室温条件下水解16 h,溶液再用HCl(10 mol/L)调整pH至2.5,释放的酚类采用5 mL冷的乙醚(DE)和乙酸乙酯(EA)混合物(DE/EA,1:1,V/V)进行振荡萃取15 min,4000 r/min离心10 min,以上重复3次。合并3次所得的DE/EA层,采用真空旋转蒸发仪50 ℃干燥,干燥后样品溶入一定量色谱级甲醇中,溶液保存于带有磨口的棕色试剂品中,于−18 ℃储存待用。后续测定方法参考本文中1.2.3。
1.2.6 消化相关酶抑制率的测定
1.2.6.1 α-淀粉酶抑制率的测定
方法参考Fu等[18],并进行适当修改。将250 μL、50 U/mL的猪胰腺α-淀粉酶溶液(溶于20 mmol/L pH6.9磷酸盐缓冲液)与200 μL提取液在37 ℃水浴中孵育10 min,加入1%可溶性淀粉溶液160 μL,于37 ℃水浴条件下反应15 min,加入100 μL DNS溶液终止以上反应。以上混合液于沸水浴中反应5 min,取出冷却,取150 μL于波长540 nm处测定其吸光值。
IR(%)=(ABS控制−ABS控制空白)−(ABS样品−ABS样品空白)(ABS控制−ABS控制空白)×100 式中:IR表示α-淀粉酶抑制率,%;ABS控制表示酶与底物反应的吸光值;ABS控制空白表示不加酶时底物的吸光值;ABS样品表示样品、酶与底物反应的吸光值;ABS样品空白表示样品与底物反应的吸光值。
1.2.6.2 α-葡萄糖苷酶抑制率的测定
参考Fu等[18]的方法,并进行适当修改。10 μL提取液与50 μL α-葡萄糖苷酶(1.0 U/mL 溶于0.1 mol/L pH6.8的磷酸盐缓冲液中)添加到96孔板中,振动均匀,于37 ℃条件下孵化15 min。然后将50 μL的pNPG(5 mmol/L溶于0.1 mol/L pH6.8的磷酸盐缓冲液中)添加到96孔板中,振动均匀,继续于37 ℃条件下孵化15 min。添加150 μL 0.5 mmol/L的碳酸钠溶液终止反应,于415 nm处测吸光值。酶活力以从pNPG中释放的p-硝基酚表示。
IR(%)=(ABS控制−ABS控制空白)−(ABS样品−ABS样品空白)(ABS控制−ABS控制空白)×100 式中:IR代表α-葡萄糖苷酶抑制率,%;ABS控制代表酶与底物反应的吸光值;ABS控制空白表示不加酶时底物的吸光值;ABS样品表示样品、酶与底物反应的吸光值;ABS样品空白代表样品与底物反应的吸光值。
1.2.6.3 胰脂肪酶抑制率的测定
方法参考Podsędek等[19],并进行适当修改。配制50 mmol/L 4-硝基苯基乙酸酯,再用纯水稀释至10 mmol/L。猪胰脂肪酶用水溶解为10 mg/mL,13000 r/min离心5 min,取上清液。反应体系如下:10 μL提取液、50 μL脂肪酶、140 μL 0.1 mol/L Tris缓冲液(pH7.4),37 ℃孵育10 min,再加入50 μL 10 mmol/L的4-硝基苯基乙酸酯。37 ℃反应15 min后于400 nm处测其吸光度。胰脂肪酶抑制率为:
IR(%)=(ABS控制−ABS控制空白)−(ABS样品−ABS样品空白)(ABS控制−ABS控制空白)×100 式中:IR为胰脂肪酶抑制率,%;ABS控制表示酶与底物反应的吸光值;ABS控制空白表示不加酶时底物的吸光值;ABS样品表示样品、酶与底物反应的吸光值;ABS样品空白表示样品与底物反应的吸光值。
1.2.7 UPLC-Q Exactive Orbitrap-MS测定酚类物质种类及相对含量
色谱条件:色谱柱为ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);柱温为40 ℃;流速0.3 mL/min;流动相组成A:水(0.05%甲酸),B:乙腈(100%);进样量:5 μL,自动进样器温度4 ℃;采用梯度洗脱,程序如下:0~1.0 min,95% A;1~12.5 min,95%~5% A;12.5~13.5 min,5% A;13.5~13.6 min,5%~95% A;13.6~16.0 min,95% A。质谱检测参数:采用一级全扫描(Full Scan,m/z 70~1050)与数据依赖性二级质谱扫描(dd-MS2,TopN=10),分辨率:70000(一级质谱)&17500(二级质谱);碰撞模式为高能量碰撞解离(HCD);加热器温度300 ℃、毛细管温度为350 ℃、鞘气流速为45 arb、辅助气流速为15 arb、尾气流速为1 arb;正离子模式时电喷雾电压为3.0 kV、S-Lens RF Level为30%;负离子模式时电喷雾电压:−3.2 kV、S-Lens RF Level为60%。
1.3 数据处理
可溶性总酚含量、消化相关酶抑制率及UPLC-Q Exactive Orbitrap-MS测试均进行4次生物学重复,其中可溶性总酚含量及消化相关酶抑制率结果均以平均值加减标准差表示。
UPLC-Q Exactive Orbitrap-MS非靶向代谢组学数据分析均在美吉生物云平台(https://www.majorbio.com/web/www/index)进行处理。对单个峰进行过滤,只保留单组空值不多于50%或所有组中空值不多于50%的峰面积数据。采用最小值二分之一法填补原始数据中的缺失值,利用总和法进行归一化。处理后的数据通过与HumanMetabolome Database (HMDB)(http://www.hmdb.ca)、Metlin(https://metlin.scripps.edu)、massbank(http://www.massbank.jp/)、mzclound(https://www.mzcloud.org/)等数据库及自建数据库进行比对,对酚类物质进行定性。采用正交偏最小二乘法判别分析(OPLS-DA)对差异酚类物质进行筛选,差异酚类物质上传至KEGG网站,进行功能通路及通路富集分析。
2. 结果与分析
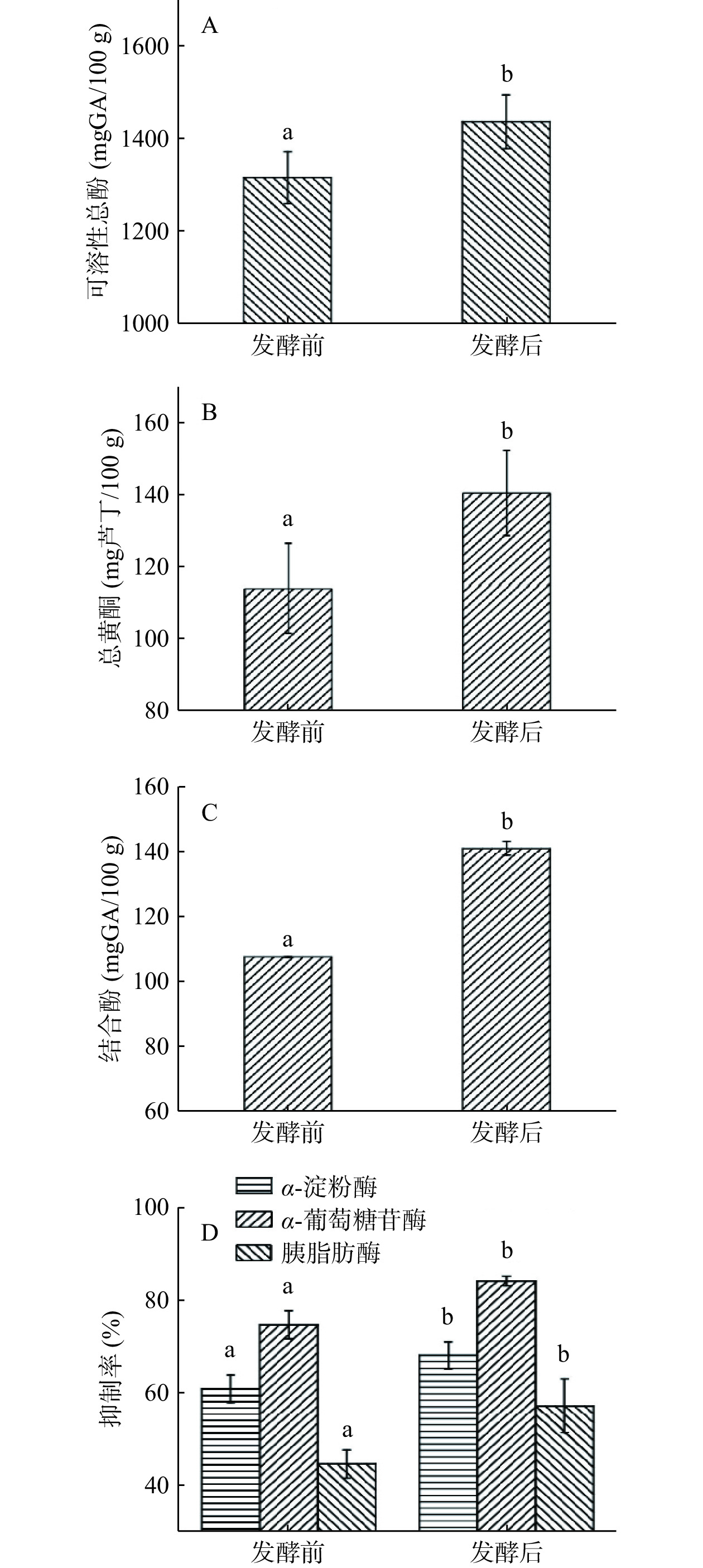
2.1 自然发酵前后青金桔可溶性总酚、总黄酮、结合酚及抑制α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶活性变化
α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶是人体中与消化相关的关键酶,对其活性的抑制可减少膳食中糖脂类物质的吸收,对预防Ⅱ型糖尿病、改善肥胖具有促进作用[20]。自然发酵对青金桔可溶性总酚、总黄酮、结合酚及抑制α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶活性的影响结果见图1。由图1可知,自然发酵可使可溶性总酚、总黄酮、结合酚含量及对α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶的抑制率均显著上升(P<0.05),其中总酚含量、总黄酮、结合酚分别提升9.20%、23.68%、31.18%,α-淀粉酶、α-葡萄糖酶及胰脂肪酶抑制率分别提升11.90%、12.64%、28.50%。本次实验结果与Kim等[21]、董玉婷等[22]研究结果一致。发酵过程中酵母、乳酸菌等微生物,可合成、释放纤维素酶、β-糖苷酶等水解酶,断裂酚类与植物细胞壁结构物质间、糖类及肽类间的化学键,促使不溶性结合态多酚转化为可溶性多酚,缀合态多酚转化为游离态多酚,增加可溶性总酚含量、提升其功能活性[12,17]。本研究中发酵后结合酚含量没有因转化为可溶性酚类而降低,反而呈现显著增加(P<0.05)。其原因可能是发酵等加工使植物细胞壁结构被破坏,结合酚更容易被提取,此结果也与Lou等[7]、Multari等[17]研究结果一致。
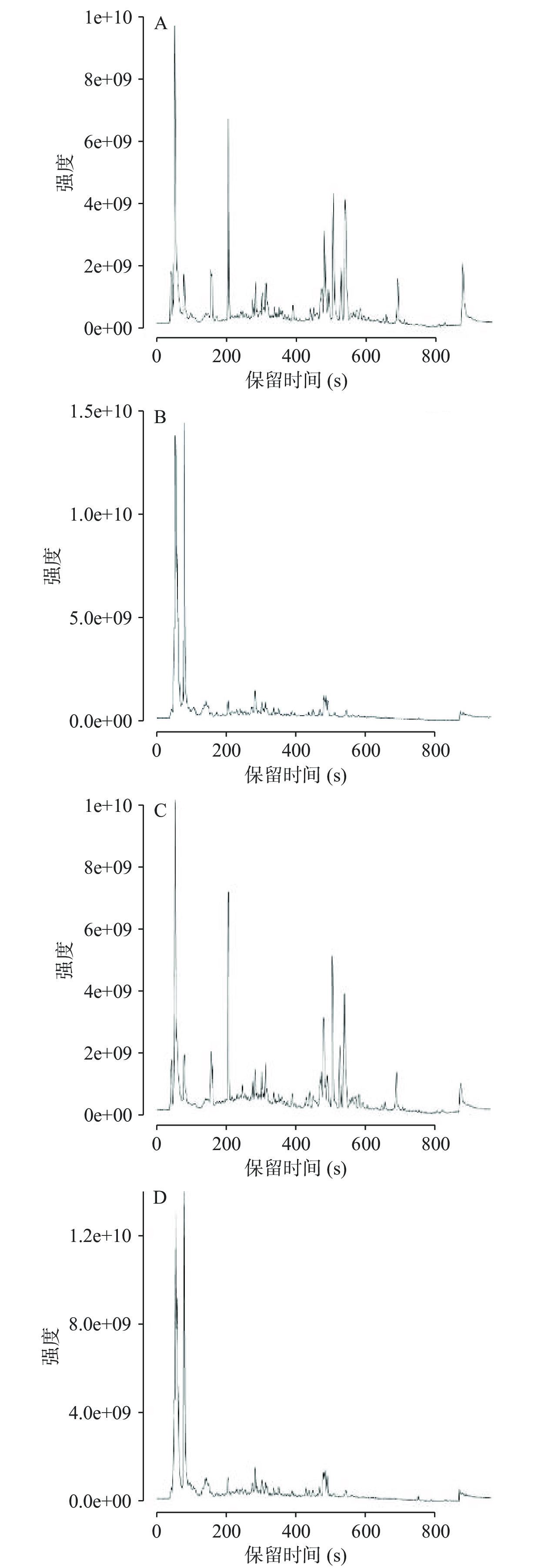
2.2 自然发酵前后青金桔酚类物质的鉴定
基于UPLC-Q Exactive Orbitrap-MS对自然发酵前后青金桔酚类物质进行测定,利用HMDB、Metlin、massbank、mzclound及自建数据库对自然发酵前后青金桔酚类物质进行定性,发酵前后总离子流图如图2,鉴定到的酚类物质种类结果见表1。在正、负离子模式下从自然发酵青金桔中共检测出52种酚类物质,与未发酵青金桔酚类物质种类一致,即自然发酵未改变酚类物质种类。青金桔酚类物质中,黄酮类物质种类最多,达到了18种,其次为酚酸类8种,二氢黄酮类7种,香豆素类6种,二氢査耳酮类5种,黄酮醇类2种,异黄酮、木质素类及花青素类均为1种,其他酚类3种。Roowi等[23]基于HPLC-PDA-MS2对青金桔中酚类物质进行了定性,确定了根皮素-3',5'-二-C-β-葡萄糖苷、橙皮苷、维采宁-2等7种酚类物质;Lou等[7]对不同溶剂提取的青金桔酚类进行了测定,共检测到类黄酮物质6种,酚酸类物质5种。本次实验结果涵盖了已报道青金桔中所有的酚类物质种类[1],并首次在青金桔中发现了异鼠李素、牡荆素、枇杷苷等30种酚类物质。
表 1 自然发酵前后青金桔中酚类物质种类Table 1. Types of phenols in Citrus microcarpa before and after natural fermentation序号 类别 物质名称 保留时间(min) 分子量 母离子(m/z) MS/MS(m/z) CAS号 发酵前 发酵后 首次报道 1 黄酮类 桔皮素 8.985 372.12 373.13 [M+H]+ 373.13,
343.08481-53-8 + + 否 2 黄酮类 芹菜素 6.92 270.06 271.06
[M+H]+271.06 520-36-5 + + 否 3 黄酮类 芹菜素-7-O-β-D-吡喃葡萄糖苷 4.97 432.11 433.11
[M+H]+433.11,
271.06578-74-5 + + 否 4 黄酮类 香叶木素 5.32 300.07 301.07
[M+H]+301.07,
286.05520-34-3 + + 否 5 黄酮类 异鼠李素 6.16 316.06 317.06
[M+H]+317.06,
302.04480-19-3 + + 是 6 黄酮类 山奈酚 7.05 286.05 287.05
[M+H]+287.05 520-18-3 + + 是 7 黄酮类 木犀草素 6.31 286.05 287.05
[M+H]+287.05 491-70-3 + + 是 8 黄酮类 川陈皮素 8.41 402.13 403.13
[M+H]+403.13,
373.09478-01-3 + + 否 9 黄酮类 荭草苷 4.35 448.11 449.11
[M+H]+449.11,
329.0728608-75-5 + + 是 10 黄酮类 牡荆素 4.58 432.11 433.11
[M+H]+433.11,
283.063681-93-4 + + 是 11 黄酮类 地奥司明 6.19 608.16 607.16
[M-H]−607.16,
299.05520-34-3 + + 否 12 黄酮类 枇杷苷 3.84 596.16 595.16
[M-H]−595.16,
355.0813463-28-0 + + 是 13 黄酮类 岩豆素 8.32 344.08 343.08
[M-H]−343.08,
313.03152743-19-6 + + 是 14 黄酮类 西宁素 5.04 372.11 371.11
[M-H]−371.11,
59.012306-27-6 + + 是 15 黄酮类 三叶草素 4.344 448.09 447.09
[M-H]−447.09,
61.9823627-87-4 + + 是 16 黄酮类 维采宁-2 4.002 594.15 593.15
[M-H]−593.15,
353.0623666-13-9 + + 否 17 黄酮类 牡荆素-2"-O-鼠李糖苷 4.57 578.17 579.17
[M+H]+579.17,313.07 64820-99-1 + + 是 18 黄酮类 柠檬黄素 5.12 346.07 347.07
[M+H]+347.07,
332.05489-33-8 + + 是 19 二氢黄酮类 橙皮素 4.96 302.08 303.08
[M+H]+303.08,
153.08520-33-2 + + 否 20 二氢黄酮类 橙皮苷 5.31 610.18 609.18
[M-H]−609.18,301.07 520-26-3 + + 否 21 二氢黄酮类 黄柏甙 7.45 518.17 517.17
[M-H]−517.17
,168.0452589-11-4 + + 是 22 二氢黄酮类 新橙皮苷 5.199 610.19 611.09
[M+H]+303.08 13241-33-3 + + 否 23 二氢黄酮类 金柑苷 13.71 592.27 593.27
[M+H]+593.27,
533.2520633-93-6 + + 是 24 二氢黄酮类 Isomargaritene 5.17 592.18 593.18
[M+H]+327.08 64271-11-0 + + 是 25 二氢黄酮类 Margaritene 5.50 592.18 593.18
[M+H]+327.08,
297.0764271-10-9 + + 是 26 二氢査耳酮 柚皮素 5.005 272.07 273.07
[M+H]+273.07,
153.01480-41-1 + + 否 27 二氢査耳酮 根皮素 5.49 274.09 275.09
[M+H]+107.04 60-82-2 + + 是 28 二氢査耳酮 柚皮苷 5.07 610.19 611.19
[M+H]+303.08 10236-47-2 + + 否 29 二氢査耳酮 根皮苷 5.48 436.12 435.12
[M-H]−273.07 60-81-1 + + 是 30 二氢査耳酮 根皮素-3',5'-二-C-β-葡萄糖苷 4.714 598.18 597.18
[M-H]−357.09 357401-40-2 + + 否 31 酚酸类 2-羟基肉桂酸 5.61 164.03 163.03
[M-H]−119.04 583-17-5 + + 是 32 酚酸类 咖啡酸 4.27 180.03 179.03
[M-H]−179.03,
135.04501-16-6 + + 否 33 酚酸类 绿原酸 3.8 354.08 353.08
[M-H]−191.05 327-97-9 + + 否 34 酚酸类 丁香酚 6.11 164.07 163.07
[M-H]−119.04 97-53-0 + + 是 35 酚酸类 芥子酸 5.096 224.06 223.06
[M-H]−223.06,
208.037362-37-0 + + 否 36 酚酸类 没食子酸 2.26 170.02 171.02
[M+H]+111.00 149-91-7 + + 否 37 酚酸类 龙胆酸 0.78 211.85 212.85
[M+H]+212.85 25351-24-0 + + 否 38 酚酸类 没食子酸 2.26 170.02 171.02
[M+H]+111.00,
139.00149-91-7 + + 否 39 香豆素类 7-羟基香豆素 11.9 162.03 163.03
[M+H]+163.03 93-35-6 + + 是 40 香豆素类 香豆素 5.36 146.04 147.04
[M+H]+91.05 91-64-5 + + 否 41 香豆素类 秦皮乙素 5.31 178.03 179.03
[M+H]+133.10 305-01-1 + + 是 42 香豆素类 甲氧沙林 7.42 216.04 217.04
[M+H]+217.04,
202.02298-81-7 + + 是 43 香豆素类 东莨菪碱 5.19 192.04 193.04
[M+H]+193.04,
133.0292-61-5 + + 是 44 香豆素类 秦皮苷 3.85 370.08 369.08
[M-H]−125.02 524-30-1 + + 是 45 黄酮醇类 槲皮素 6.36 302.04 301.03
[M-H]−151.00 117-39-5 + + 否 46 黄酮醇类 芦丁 4.64 610.15 609.15
[M-H]−609.15,
300.02153-18-4 + + 否 47 异黄酮类 鱼藤酮 9.078 394.15 395.15
[M+H]+395.15,
365.0683-79-4 + + 是 48 花青素类 花青素鼠李葡糖苷 4.74 594.16 595.16
[M+H]+287.05 18719-76-1 + + 是 49 木脂素类 牛蒡子苷 7.948 534.20 533.20
[M-H]−61.98 20362-31-6 + + 是 50 其他 雌酮 5.22 270.17 271.17
[M+H]+271.17 53-16-7 + + 是 51 其他 芥子酰基菜果酸酯 4.993 340.07 339.07
[M-H]−223.06 76656-81-0 + + 是 52 其他 异土大黄苷 5.12 420.13 419.13
[M-H]−213.09 32727-29-0 + + 是 注:“+”表示该酚类物质在相应样品中被检测到;“−”表示该酚类物质在相应样品中未被检测到。 2.3 自然发酵前后青金桔酚类物质差异性分析
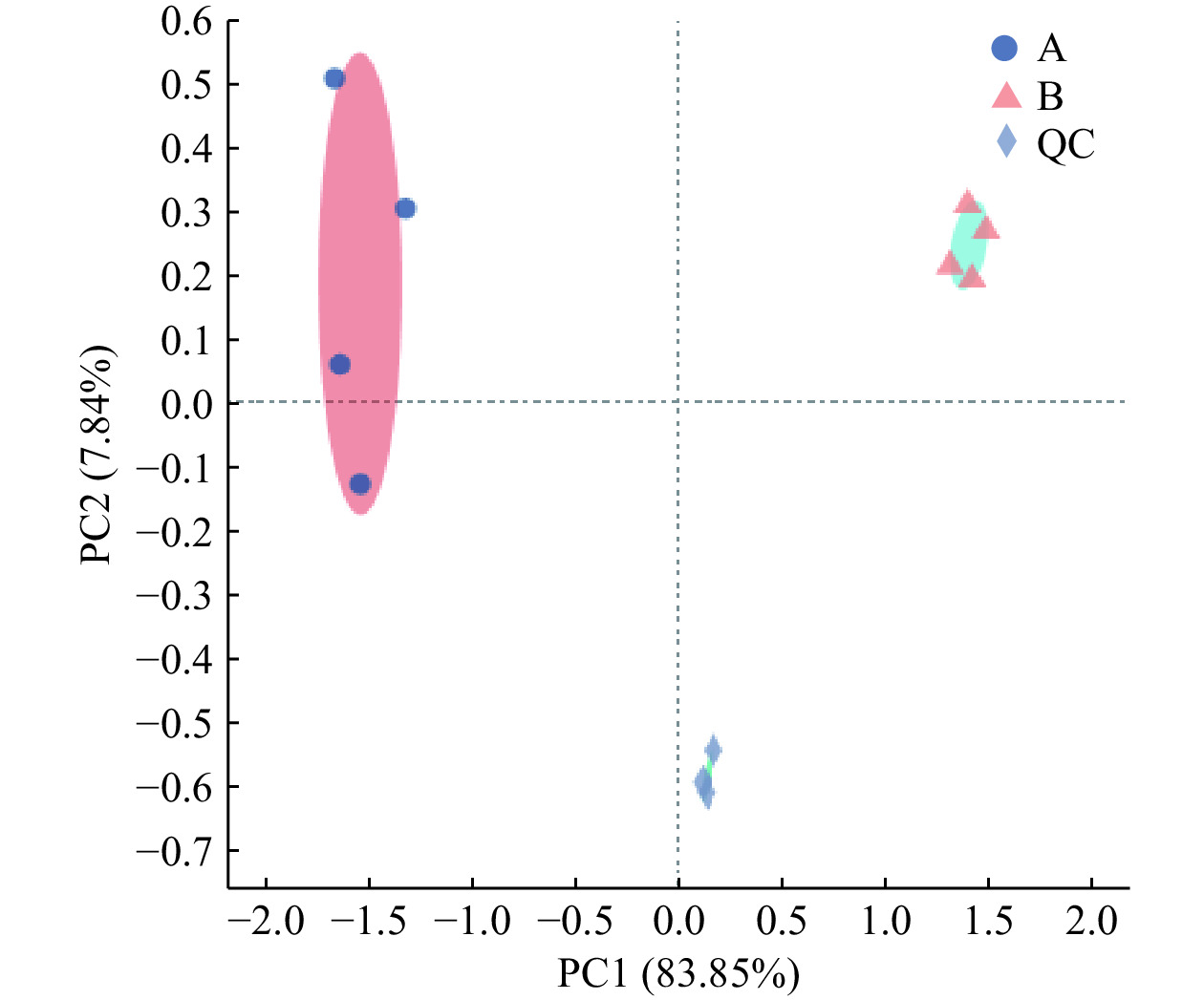
2.3.1 青金桔酚类物质主成分分析
主成分分析(principal component analysis,PCA)得分图可反映样品的相似性程度,图中样品越聚集,表明样品相似性越强。由图3可知,质控样(quality control samples,QC)样品聚集性较高,表明仪器设备运行稳定、实验方法可靠、数据质量高。A、B组样品聚集程度都较高,其中A组样品分布于PCA图中左上角,B组样品分布于右上角,且第一主成分(PC1)和第二主成分(PC2)的解释率分别为83.85%、7.84%,两者累计贡献率达到91.69%。因此,A、B组中各组内样品间重复性较好,A、B组间样品差异显著,自然发酵处理可有效改变青金桔酚类物质组成。
2.3.2 自然发酵前后青金桔酚类差异代谢物的筛选与分析
以PLS-DA模型中变量影响投影值(variable influence on projection,VIP)>1、差异倍数(fold change)>1或<0.5且P<0.05为标准,对自然发酵前后青金桔中酚类差异代谢物进行筛选,其结果见表2。由表2可知,自然发酵后共有10种酚类物质发生显著变化,占全部酚类物质种类的19.23 %,其中包括5种黄酮类、3种香豆素类、2种酚酸类。差异代谢物中,除甲氧沙林下调外,其余9种物质均上调,根据FC值可以看出,山奈酚上调倍数最大,达到13.82,其次为芹菜素(10.99)、咖啡酸(5.02)、三叶草素(3.06)、芥子酸(2.55)、东莨菪碱(2.17)、7-羟基香豆素(1.24)、川陈皮素(1.15)、牡荆素(1.07)。
表 2 自然发酵前后青金桔中显著差异的酚类物质Table 2. Significant difference of phenolic substances in Citrus microcarpa before and after natural fermentation类别 物质名称 VIP-PLS-
DA值FC(B/
A)值P值 显著上调(up)
或下调(down)酚酸类 咖啡酸 3.18 5.02 <0.01 up 芥子酸 1.34 2.55 <0.01 up 黄酮类 三叶草素 1.01 3.06 <0.01 up 芹菜素 1.14 10.99 <0.01 up 山奈酚 1.42 13.82 <0.01 up 川陈皮素 12.85 1.15 <0.01 up 牡荆素 2.05 1.07 <0.01 up 香豆素类 7-羟基香豆素 1.43 1.24 <0.01 up 甲氧沙林 1.28 0.02 <0.01 down 东莨菪碱 1.27 2.17 <0.01 up 注:VIP:variable influence on projection,为变量影响投影值;FC:fold change,差异倍数;P<0.01表示极显著。 Hu等[12]对固态发酵条件下不同菌种发酵柑橘果渣后酚类物质变化情况进行了测定,发现植物乳杆菌P10、枯草芽孢杆菌BF2等单独或混合发酵均能使得糖苷类黄酮如柚皮苷、橙皮苷及苷元类黄酮如橙皮素、柚皮素、川陈皮素等含量显著增加。这一结果与本研究基本一致。而Kim等[21]采用自然发酵剂对柑橘副产物进行液体发酵时,仅橙皮素、柚皮素等苷元类黄酮增加,而芦丁、柚皮苷等糖苷类黄酮减少。这可能与发酵方式及微生物所产酶种类有关,采用固态发酵或半固态发酵时,发酵基质等流动性差,微生物只能利用周边营养物质,故迫使其多产纤维素酶、木聚糖酶等[24],促进结合态多酚与植物细胞壁结构物质分离,糖苷类、苷元类酚类物质均增加。而液体发酵过程中,微生物可能优先产β-糖苷酶等,促使糖苷类黄酮上与葡萄糖等糖类物质链接的O-糖苷或C-糖苷等断裂,糖苷类黄酮转化为苷元类黄酮,导致糖苷类黄酮减少,苷元类黄酮增加[25]。
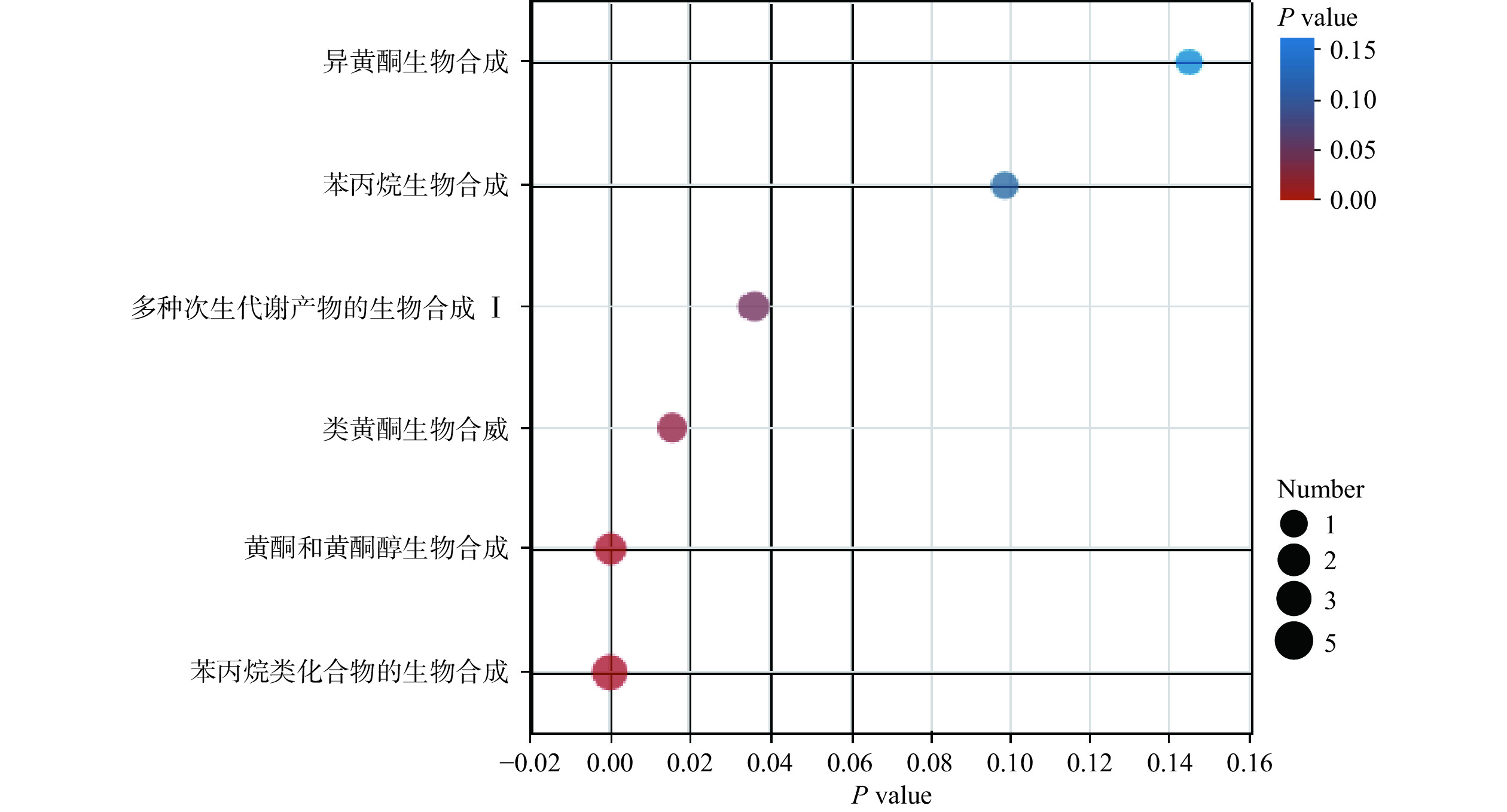
2.3.3 青金桔酚类差异代谢物通路富集分析
为明确哪些代谢通路在自然发酵过程中对青金桔酚类物质变化产生影响,本研究对自然发酵前后青金桔中酚类差异代谢物的代谢通路进行了富集分析,具体的代谢通路及相应的代谢物见图4及表3。图4中每个气泡表示一条代谢通路,气泡的大小代表该通路中富集到差异代谢物种类的多少,气泡越大,表示该通路中酚类差异代谢物种类越多。气泡所在位置和颜色表示P值大小,P值越小,颜色越红,富集程度越显著。由图4及表3可知,自然发酵影响青金桔酚类物质变化的代谢通路有6条,其中显著富集的有4条,分别为苯丙烷类化合物的生物合成通路、黄酮和黄酮醇生物合成通路、类黄酮生物合成通路及多种次生代谢产物的生物合成Ⅰ通路。该研究结果与张子洁等[26]研究结果一致。
表 3 显著差异酚类物质参与的代谢途径Table 3. Metabolic pathways involved in significant differences of phenolic substances代谢途径 KEGG编号 差异代谢物名称 异黄酮生物合成 map00943 芹菜素 苯丙烷生物合成 map00940 咖啡酸;芥子酸 类黄酮生物合成 map00941 芹菜素;山奈酚;牡荆素 多种次生代谢产物的生物合成Ⅰ map00999 7-羟基香豆素;甲氧沙林;东莨菪碱 黄酮和黄酮醇生物合成 map00944 芹菜素;山奈酚;牡荆素;三叶草素 苯丙烷类化合物的生物合成 map01061 7-羟基香豆素;芹菜素;山奈酚;东莨菪碱;咖啡酸;芥子酸 植物中酚类物质以糖代谢中部分中间体为前体物质,经由莽草酸途径产生苯丙氨酸,再经苯丙烷代谢途径产生香豆酰-CoA、黄酮代谢途径合成査耳酮、二氢查耳酮。二氢查耳酮作为其他黄酮类化合物的主要前体物质,经过不同的分支合成途径,最终生成黄酮、黄酮醇、异黄酮、黄烷酮和花青素等[27]。本研究富集到的显著代谢通路中包含了苯丙烷代谢途径、黄酮代谢途径及其分支代谢通路,涉及到酚类代谢差异物质有7-羟基香豆素、芹菜素、山奈酚、东莨菪碱、咖啡酸、芥子酸、牡荆素、三叶草素。本研究中未富集到莽草酸途径,可能是其核心代谢物质莽草酸、香豆酰-CoA等作为非酚类物质未被鉴定。
因此,除多种次生代谢产物的生物合成Ⅰ通路因涉及甲氧沙林降解而可能引起可溶性总酚下降外,苯丙烷类化合物的生物合成通路、黄酮和黄酮醇生物合成通路、类黄酮生物合成通路等都与自然发酵过程中青金桔酚类物质增加有关。
2.4 青金桔酚类差异代谢物与生物活性相关性研究
α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶作为主要存在于小肠中影响人体糖脂类物质消化、吸收的关键酶,抑制其活性对防止肥胖、改善糖尿病等代谢紊乱症具有显著作用。本研究利用Spearman相关系数分析了青金桔中酚类差异代谢物与其抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性间的互作关系。相关性分析热图见图5。由图5可知,除甲氧沙林外,其余9种差异代谢物均与可溶性总酚含量及抑制消化相关酶活性呈正相关。其中,7种酚类差异代谢物与抑制胰脂肪酶活性呈显著正相关(相关系数>0.6且P<0.05),物质分别为川陈皮素、芹菜素、咖啡酸、山奈酚、7-羟基香豆素、芥子酸、东莨菪碱;6种酚类差异代谢物与抑制α-葡萄糖苷酶活性呈显著正相关(相关系数>0.7且P<0.05),物质分别为川陈皮素、芹菜素、咖啡酸、山奈酚、牡荆素、三叶草素;6种酚类差异代谢物与抑制α-淀粉酶活性呈显著正相关(相关系数>0.6且P<0.05),物质分别为川陈皮素、芹菜素、咖啡酸、山奈酚、牡荆素、东莨菪碱。而以上10种酚类差异代谢物与可溶性总酚含量均未表现出显著相关性(P>0.05)。
本研究中川陈皮素、芹菜素、咖啡酸、山奈酚等四种酚类对抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性均呈显著正相关(P<0.05),由此可推测以上四种物质对消化相关酶活性具有一定抑制作用。相关研究表明,芹菜素[28]、山柰酚[28]、咖啡酸[29]对胰脂肪酶抑制的IC50值分别为4.53×10−4 mol/L、2.29×10−4 mol/L、0.88 mg/mL。酚类物质主要通过与酶结合,诱导酶结构发生改变,从而发挥抑制作用。酚类物质种类不同,其与酶结合的作用力也不同。Yan等[30]研究发现川陈皮素主要通过氢键与胰脂肪酶结合,而芹菜素与胰脂肪酶结合的主要驱动力是范德华力和氢键,山柰酚[28]、咖啡酸[29]为疏水作用力;芹菜素对α-淀粉酶、α-葡萄糖苷酶抑制的IC50值分别为21.66、1.43×10−5 mmol/L,抑制类型均为非竞争抑制,与α-淀粉酶、α-葡萄糖苷酶之间仅有一个或一类结合位点[31]。以上研究证实,川陈皮素、芹菜素、咖啡酸、山奈酚等均能有效抑制消化相关酶活性,但其在青金桔多酚中对消化相关酶具体抑制率的贡献大小及是否对消化相关酶活性存在协同抑制作用等仍需进一步研究。
3. 结论
本研究基于UPLC-Q Exactive Orbitrap-MS代谢组学研究了自然发酵对青金桔酚类物质变化及其抑制α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶活性的影响。结果表明:自然发酵可促进青金桔中可溶性总酚、总黄酮释放,显著提升以上三种消化相关酶抑制率(P<0.05);青金桔中共检测到酚类物质52种,自然发酵未改变酚类物质种类,但可使川陈皮素、咖啡酸、牡荆素等9种酚类物质含量显著增加(P<0.01),其中川陈皮素、芹菜素、咖啡酸、山奈酚等四种酚类差异代谢物对抑制以上三种消化相关酶活性呈显著正相关(P<0.05)。因此,自然发酵可作为青金桔加工的一种有效手段。青金桔中酚类物质种类较多,含量相差较大,下一步将探讨酚类物质在发酵过程中绝对含量的变化情况,及川陈皮素、芹菜素等对α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶的具体抑制率的贡献大小及协同抑制效果。
-
表 1 自然发酵前后青金桔中酚类物质种类
Table 1 Types of phenols in Citrus microcarpa before and after natural fermentation
序号 类别 物质名称 保留时间(min) 分子量 母离子(m/z) MS/MS(m/z) CAS号 发酵前 发酵后 首次报道 1 黄酮类 桔皮素 8.985 372.12 373.13 [M+H]+ 373.13,
343.08481-53-8 + + 否 2 黄酮类 芹菜素 6.92 270.06 271.06
[M+H]+271.06 520-36-5 + + 否 3 黄酮类 芹菜素-7-O-β-D-吡喃葡萄糖苷 4.97 432.11 433.11
[M+H]+433.11,
271.06578-74-5 + + 否 4 黄酮类 香叶木素 5.32 300.07 301.07
[M+H]+301.07,
286.05520-34-3 + + 否 5 黄酮类 异鼠李素 6.16 316.06 317.06
[M+H]+317.06,
302.04480-19-3 + + 是 6 黄酮类 山奈酚 7.05 286.05 287.05
[M+H]+287.05 520-18-3 + + 是 7 黄酮类 木犀草素 6.31 286.05 287.05
[M+H]+287.05 491-70-3 + + 是 8 黄酮类 川陈皮素 8.41 402.13 403.13
[M+H]+403.13,
373.09478-01-3 + + 否 9 黄酮类 荭草苷 4.35 448.11 449.11
[M+H]+449.11,
329.0728608-75-5 + + 是 10 黄酮类 牡荆素 4.58 432.11 433.11
[M+H]+433.11,
283.063681-93-4 + + 是 11 黄酮类 地奥司明 6.19 608.16 607.16
[M-H]−607.16,
299.05520-34-3 + + 否 12 黄酮类 枇杷苷 3.84 596.16 595.16
[M-H]−595.16,
355.0813463-28-0 + + 是 13 黄酮类 岩豆素 8.32 344.08 343.08
[M-H]−343.08,
313.03152743-19-6 + + 是 14 黄酮类 西宁素 5.04 372.11 371.11
[M-H]−371.11,
59.012306-27-6 + + 是 15 黄酮类 三叶草素 4.344 448.09 447.09
[M-H]−447.09,
61.9823627-87-4 + + 是 16 黄酮类 维采宁-2 4.002 594.15 593.15
[M-H]−593.15,
353.0623666-13-9 + + 否 17 黄酮类 牡荆素-2"-O-鼠李糖苷 4.57 578.17 579.17
[M+H]+579.17,313.07 64820-99-1 + + 是 18 黄酮类 柠檬黄素 5.12 346.07 347.07
[M+H]+347.07,
332.05489-33-8 + + 是 19 二氢黄酮类 橙皮素 4.96 302.08 303.08
[M+H]+303.08,
153.08520-33-2 + + 否 20 二氢黄酮类 橙皮苷 5.31 610.18 609.18
[M-H]−609.18,301.07 520-26-3 + + 否 21 二氢黄酮类 黄柏甙 7.45 518.17 517.17
[M-H]−517.17
,168.0452589-11-4 + + 是 22 二氢黄酮类 新橙皮苷 5.199 610.19 611.09
[M+H]+303.08 13241-33-3 + + 否 23 二氢黄酮类 金柑苷 13.71 592.27 593.27
[M+H]+593.27,
533.2520633-93-6 + + 是 24 二氢黄酮类 Isomargaritene 5.17 592.18 593.18
[M+H]+327.08 64271-11-0 + + 是 25 二氢黄酮类 Margaritene 5.50 592.18 593.18
[M+H]+327.08,
297.0764271-10-9 + + 是 26 二氢査耳酮 柚皮素 5.005 272.07 273.07
[M+H]+273.07,
153.01480-41-1 + + 否 27 二氢査耳酮 根皮素 5.49 274.09 275.09
[M+H]+107.04 60-82-2 + + 是 28 二氢査耳酮 柚皮苷 5.07 610.19 611.19
[M+H]+303.08 10236-47-2 + + 否 29 二氢査耳酮 根皮苷 5.48 436.12 435.12
[M-H]−273.07 60-81-1 + + 是 30 二氢査耳酮 根皮素-3',5'-二-C-β-葡萄糖苷 4.714 598.18 597.18
[M-H]−357.09 357401-40-2 + + 否 31 酚酸类 2-羟基肉桂酸 5.61 164.03 163.03
[M-H]−119.04 583-17-5 + + 是 32 酚酸类 咖啡酸 4.27 180.03 179.03
[M-H]−179.03,
135.04501-16-6 + + 否 33 酚酸类 绿原酸 3.8 354.08 353.08
[M-H]−191.05 327-97-9 + + 否 34 酚酸类 丁香酚 6.11 164.07 163.07
[M-H]−119.04 97-53-0 + + 是 35 酚酸类 芥子酸 5.096 224.06 223.06
[M-H]−223.06,
208.037362-37-0 + + 否 36 酚酸类 没食子酸 2.26 170.02 171.02
[M+H]+111.00 149-91-7 + + 否 37 酚酸类 龙胆酸 0.78 211.85 212.85
[M+H]+212.85 25351-24-0 + + 否 38 酚酸类 没食子酸 2.26 170.02 171.02
[M+H]+111.00,
139.00149-91-7 + + 否 39 香豆素类 7-羟基香豆素 11.9 162.03 163.03
[M+H]+163.03 93-35-6 + + 是 40 香豆素类 香豆素 5.36 146.04 147.04
[M+H]+91.05 91-64-5 + + 否 41 香豆素类 秦皮乙素 5.31 178.03 179.03
[M+H]+133.10 305-01-1 + + 是 42 香豆素类 甲氧沙林 7.42 216.04 217.04
[M+H]+217.04,
202.02298-81-7 + + 是 43 香豆素类 东莨菪碱 5.19 192.04 193.04
[M+H]+193.04,
133.0292-61-5 + + 是 44 香豆素类 秦皮苷 3.85 370.08 369.08
[M-H]−125.02 524-30-1 + + 是 45 黄酮醇类 槲皮素 6.36 302.04 301.03
[M-H]−151.00 117-39-5 + + 否 46 黄酮醇类 芦丁 4.64 610.15 609.15
[M-H]−609.15,
300.02153-18-4 + + 否 47 异黄酮类 鱼藤酮 9.078 394.15 395.15
[M+H]+395.15,
365.0683-79-4 + + 是 48 花青素类 花青素鼠李葡糖苷 4.74 594.16 595.16
[M+H]+287.05 18719-76-1 + + 是 49 木脂素类 牛蒡子苷 7.948 534.20 533.20
[M-H]−61.98 20362-31-6 + + 是 50 其他 雌酮 5.22 270.17 271.17
[M+H]+271.17 53-16-7 + + 是 51 其他 芥子酰基菜果酸酯 4.993 340.07 339.07
[M-H]−223.06 76656-81-0 + + 是 52 其他 异土大黄苷 5.12 420.13 419.13
[M-H]−213.09 32727-29-0 + + 是 注:“+”表示该酚类物质在相应样品中被检测到;“−”表示该酚类物质在相应样品中未被检测到。 表 2 自然发酵前后青金桔中显著差异的酚类物质
Table 2 Significant difference of phenolic substances in Citrus microcarpa before and after natural fermentation
类别 物质名称 VIP-PLS-
DA值FC(B/
A)值P值 显著上调(up)
或下调(down)酚酸类 咖啡酸 3.18 5.02 <0.01 up 芥子酸 1.34 2.55 <0.01 up 黄酮类 三叶草素 1.01 3.06 <0.01 up 芹菜素 1.14 10.99 <0.01 up 山奈酚 1.42 13.82 <0.01 up 川陈皮素 12.85 1.15 <0.01 up 牡荆素 2.05 1.07 <0.01 up 香豆素类 7-羟基香豆素 1.43 1.24 <0.01 up 甲氧沙林 1.28 0.02 <0.01 down 东莨菪碱 1.27 2.17 <0.01 up 注:VIP:variable influence on projection,为变量影响投影值;FC:fold change,差异倍数;P<0.01表示极显著。 表 3 显著差异酚类物质参与的代谢途径
Table 3 Metabolic pathways involved in significant differences of phenolic substances
代谢途径 KEGG编号 差异代谢物名称 异黄酮生物合成 map00943 芹菜素 苯丙烷生物合成 map00940 咖啡酸;芥子酸 类黄酮生物合成 map00941 芹菜素;山奈酚;牡荆素 多种次生代谢产物的生物合成Ⅰ map00999 7-羟基香豆素;甲氧沙林;东莨菪碱 黄酮和黄酮醇生物合成 map00944 芹菜素;山奈酚;牡荆素;三叶草素 苯丙烷类化合物的生物合成 map01061 7-羟基香豆素;芹菜素;山奈酚;东莨菪碱;咖啡酸;芥子酸 -
[1] LOU S N, HO C T. Phenolic compounds and biological activities of small-size citrus:Kumquat and calamondin[J]. Journal of Food And Drug Analysis,2017,25(1):162−175. doi: 10.1016/j.jfda.2016.10.024
[2] SAINI R K, RANJIT A, SHARMA K, et al. Bioactive compounds of citrus fruits:A review of composition and health benefits of carotenoids, flavonoids, limonoids, and terpenes[J]. Antioxidants,2022,11(2):239. doi: 10.3390/antiox11020239
[3] HUANG C H, HSIAO S Y, LIN Y H, et al. Effects of fermented citrus peel on ameliorating obesity in rats fed with high-fat diet[J]. Molecules,2022,27(24):8966. doi: 10.3390/molecules27248966
[4] ZENG S L, LI S Z, XIAO P T, et al. Citrus polymethoxyflavones attenuate metabolic syndrome by regulating gut microbiome and amino acid metabolism[J]. Science Advances,2020,6(1):eaax6208. doi: 10.1126/sciadv.aax6208
[5] WANG F, ZHAO C Y, YANG M K, et al. Four citrus flavanones exert atherosclerosis alleviation effects in ApoE–/–Mice via different metabolic and signaling pathways[J]. Journal of Agricultural and Food Chemistry 2021, 69(17):5226-5237.
[6] LOU S N, HSU Y S, HO C T. Flavonoid compositions and antioxidant activity of calamondin extracts prepared using different solvents[J]. Journal of Food and Drug Analysis,2014,22(3):290−295. doi: 10.1016/j.jfda.2014.01.020
[7] LOU S N, LIN Y S, HSU Y S, et al. Soluble and insoluble phenolic compounds and antioxidant activity of immature calamondin affected by solvents and heat treatment[J]. Food Chemistry,2014,161:246−253. doi: 10.1016/j.foodchem.2014.04.009
[8] 张红建, 梁爱文, 王青松, 等. 青金桔籽油螺旋压榨工艺及其理化特性研究[J]. 中国粮油学报,2021,36(12):65−63. [ZHANG H J, LIANG A W, WANG Q S, et al. Screw pressing technology and physical and chemical properties of green kumquat seed oil[J]. Journal of the Chinese Cereals and Oils Association,2021,36(12):65−63.] ZHANG H J, LIANG A W, WANG Q S, et al. Screw pressing technology and physical and chemical properties of green kumquat seed oil[J]. Journal of the Chinese Cereals and Oils Association, 2021, 36(12): 65−63.
[9] ZHANG L, LIU S, CHEN Y, et al. Metatranscriptomic approach reveals the functional and enzyme dynamics of core microbes during noni fruit fermentation[J]. Food Research International,2021,141:109999. doi: 10.1016/j.foodres.2020.109999
[10] ZOU Y, ZHANG H J, ZHENG L H. Physicochemical characteristics of calamondin (Citrus microcarpa) from Hainan[J]. Asian Agricultural Research,2020,12(12):58−62.
[11] CONIGLIO R O, DÍAZ G V, BARUA R C, et al. Enzyme-assisted extraction of phenolic compounds and proteins from sugarcane bagasse using a low-cost cocktail from Auricularia fuscosuccinea[J]. International Journal of Food Science & Technology,2021,57(2):1114−1121.
[12] HU X, ZENG J R, SHEN F, et al. Citrus pomace fermentation with autochthonous probiotics improves its nutrient composition and antioxidant activities[J]. LWT-Food Science and Technology,2022,157:113076. doi: 10.1016/j.lwt.2022.113076
[13] 段宙位, 窦志浩, 何艾, 等. 青金桔皮中多酚的提取及其抗氧化性研究[J]. 食品工业科技,2015,36(10):244−248. [DUAN Z W, DOU Z H, HE A, et al. Extraction and antioxidant activity of polyphenols from green kumquat peel[J]. Science and Technology of Food Industry,2015,36(10):244−248.] DUAN Z W, DOU Z H, HE A, et al. Extraction and antioxidant activity of polyphenols from green kumquat peel[J]. Science and Technology of Food Industry, 2015, 36(10): 244−248.
[14] LONG P P, WEN M C, GRANATO D, et al. Untargeted and targeted metabolomics reveal the chemical characteristic of pu-erh tea (Camellia assamica) during pile-fermentation[J]. Food Chemistry,2020,311:125895. doi: 10.1016/j.foodchem.2019.125895
[15] RODRÍGUEZ C C, VÁZQUEZ V, MIGUES I, et al. Flavonoids and limonoids profiles variation in leaves from mandarin cultivars and its relationship with alternate bearing[J]. Agronomy,2022,12(1):121. doi: 10.3390/agronomy12010121
[16] WANG F, CHEN L, CHEN H P, et al. Analysis of flavonoid metabolites in citrus peels (Citrus reticulata "Dahongpao") using UPLC-ESI-MS/MS[J]. Molecules,2019,24(15):2680. doi: 10.3390/molecules24152680
[17] MULTARI S, GUZZON R, CARUSO M, et al. Alcoholic fermentation of citrus flavedo and albedo with pure and mixed yeast strains:Physicochemical characteristics and phytochemical profiles[J]. LWT-Food Science and Technology,2021,144:111133. doi: 10.1016/j.lwt.2021.111133
[18] FU W, ZHAO G, LIU J. Effect of preparation methods on physiochemical and functional properties of yeast β-glucan[J]. LWT-Food Science and Technology,2022,160:113284. doi: 10.1016/j.lwt.2022.113284
[19] PODSĘDEK A, MAJEWSKA I, REDZYNIA M, et al. In vitro inhibitory effect on digestive enzymes and antioxidant potential of commonly consumed fruits[J]. Journal of Agricultural Food Chemisstry,2014,62(20):4610−4617. doi: 10.1021/jf5008264
[20] BENAYAD O, BOUHRIM M, TIJI S, et al. Phytochemical profile, α-glucosidase, and α-amylase inhibition potential and toxicity evaluation of extracts from Citrus aurantium (L) peel, a valuable by-product from Northeastern Morocco[J]. Biomolecules,2021,11(11):1555. doi: 10.3390/biom11111555
[21] KIM S S, PARK K J, AN H J, et al. Phytochemical, antioxidant, and antibacterial activities of fermented Citrus unshiu byproduct[J]. Food Science and Biotechnology,2017,26(2):461−466. doi: 10.1007/s10068-017-0063-9
[22] 董玉婷, 蔡宏浩, 李志朋, 等. 乳杆菌发酵提高坛紫菜的抗氧化和抑制糖脂代谢关键酶活性[J]. 食品科学,2022,43(10):162−171. [DONG Y T, CAI H H, LI Z P, et al. Lactobacillus fermentation improves the antioxidant activity of porphyra haitanensis and its inhibitory activity on key enzymes of glycolipid metabolism[J]. Food Science,2022,43(10):162−171.] DONG Y T, CAI H H, LI Z P, et al. Lactobacillus fermentation improves the antioxidant activity of porphyra haitanensis and its inhibitory activity on key enzymes of glycolipid metabolism[J]. Food Science, 2022, 43(10): 162−171.
[23] ROOWI S, CROZIER A. Flavonoids in tropical citrus species[J]. Journal of Agricultural and Food Chemistry,2011,59(22):12217−12225. doi: 10.1021/jf203022f
[24] XUE P, LIAO W, CHEN Y, et al. Release characteristic and mechanism of bound polyphenols from insoluble dietary fiber of navel orange peel via mixed solid-state fermentation with Trichoderma reesei and Aspergillus niger[J]. LWT-Food Science and Technology,2022,161:113387. doi: 10.1016/j.lwt.2022.113387
[25] 唐富豪, 滕建文, 韦保耀, 等. 基于非靶向代谢组学评价传统发酵对客家酸芥菜酚类化合物组成的影响[J]. 食品与发酵工业,2021,47(8):128−133. [TANG F H, TENG J W, WEI B Y, et al. Evaluation of the influence of traditional fermentation on the composition of phenolic compounds in Hakka pickled mustard greens based on non-targeted metabolomics[J]. Food and Fermentation Industries,2021,47(8):128−133.] TANG F H, TENG J W, WEI B Y, et al. Evaluation of the influence of traditional fermentation on the composition of phenolic compounds in Hakka pickled mustard greens based on non-targeted metabolomics[J]. Food and Fermentation Industries, 2021, 47(8): 128−133.
[26] 张子洁, 唐鳗秋, 夏玙, 等. 基于代谢组学分析四川黄酒麦曲制曲发酵过程中黄酮类物质的代谢[J]. 食品科技,2022,47(7):250−255. [ZHANG Z J, TANG M Q, XIA Y, et al. Metabolic analysis of flavonoids furing Koji making and fermentation of Sichuan yellow wine wheat Koji based on metabonomics[J]. Food Science and Technology,2022,47(7):250−255.] ZHANG Z J, TANG M Q, XIA Y, et al. Metabolic analysis of flavonoids furing Koji making and fermentation of Sichuan yellow wine wheat Koji based on metabonomics[J]. Food Science and Technology, 2022, 47(7): 250−255.
[27] 林春草, 陈大伟, 戴均贵. 黄酮类化合物合成生物学研究进展[J]. 药学学报,2022,57(5):1322−1335. [LIN C C, CHEN D W, DAI J G. Advances of synthetic biology of flavonoids[J]. Acta Pharmaceutica Sinica,2022,57(5):1322−1335.] LIN C C, CHEN D W, DAI J G. Advances of synthetic biology of flavonoids[J]. Acta Pharmaceutica Sinica, 2022, 57(5): 1322−1335.
[28] 黎沙. 基于光谱法结合分子模拟技术研究黄酮化合物对胰脂肪酶的抑制作用机制[D]. 南昌:南昌大学, 2021. [LI S. Study on the inhibitory effect of flavonoids on pancreatic lipase by spectroscopy combined with molecular simulation technology[D]. Nanchang:Nanchang University, 2021.] LI S. Study on the inhibitory effect of flavonoids on pancreatic lipase by spectroscopy combined with molecular simulation technology[D]. Nanchang: Nanchang University, 2021.
[29] 范金波, 王晓露, 姜海静, 等. 荧光光谱法研究咖啡酸与胰脂肪酶相互作用[J]. 食品工业科技,2017,38(2):152−155. [FAN J B, WANG X L, JIANG H J, et al. Study on the interaction between caffeic acid and pancreatic lipase by fluorescence spectroscopy[J]. Science and Technology of Food Industry,2017,38(2):152−155.] FAN J B, WANG X L, JIANG H J, et al. Study on the interaction between caffeic acid and pancreatic lipase by fluorescence spectroscopy[J]. Science and Technology of Food Industry, 2017, 38(2): 152−155.
[30] YAN T C, YUE Z X, GU Y X, et al. Screening of lipase inhibitors in citrus fruits by electrophoretically-mediated microanalysis combined with molecular docking[J]. Journal of Food Composition and Analysis,2022,105:104185. doi: 10.1016/j.jfca.2021.104185
[31] 杨继晨. 黄酮类化合物对α-淀粉酶/α-葡萄糖苷酶的抑制机制及其构效关系研究[D]. 天津:天津大学, 2021. [YANG J C. Studies on inhibitory mechanism and structure-activity relationship of flavonoid compounds against α-amylase/α-glucosidase[D]. Tianjin:Tianjin University, 2021.] YANG J C. Studies on inhibitory mechanism and structure-activity relationship of flavonoid compounds against α-amylase/α-glucosidase[D]. Tianjin: Tianjin University, 2021.
-
期刊类型引用(15)
1. 刘荣倩,杨申明,李新会,王振吉,彭润,解健翠. 百香果壳总三萜提取工艺优化及抗氧化性能评价. 饲料工业. 2025(01): 118-126 .  百度学术
百度学术
2. 景炳年,李宁洁,魏磊,谢晓阳,刘雨晴,王学方,王韬,王伟. 连翘三萜酸提取工艺优化及抗氧化活性研究. 中国食品添加剂. 2025(03): 64-74 .  百度学术
百度学术
3. 黄瑜,张锡宇,赵海桃,石统帅,邱隽蒙,符群. 沙棘叶提取物的体外抗氧化及乙酰胆碱酯酶抑制能力. 精细化工. 2024(02): 391-400 .  百度学术
百度学术
4. 温舒然,马占山,詹冬玲. 灵芝三萜提取工艺的优化. 吉林大学学报(理学版). 2024(02): 452-463 .  百度学术
百度学术
5. 岳洪霞,胡娜,隆海燕,王洪伦,栾广祥. 响应面法优化超声辅助提取蕨麻总三萜工艺研究. 中国野生植物资源. 2024(03): 28-33+66 .  百度学术
百度学术
6. 杨洪飞,卢雨菲,葛婷婷,王洁琼,陈祺,孟丽媛,要辉,闵清. 星点设计-效应面法优化超声提取桂籽中三萜化合物的工艺研究. 湖北科技学院学报(医学版). 2024(03): 214-220 .  百度学术
百度学术
7. 曹柏营,杨海蛟,侯宇,王家利,乔新宇,陈英伟,刘馨阳. 蓝靛果花青素抗氧化作用及机制. 食品研究与开发. 2024(19): 53-59 .  百度学术
百度学术
8. 张剑林,张亮亮,姜露熙,裴龙英,王寒博,孙博,梁睿武,房丹丹. 基于人工神经网络优化黑木耳红枣发酵乳及其抗氧化分析. 食品研究与开发. 2023(05): 141-147 .  百度学术
百度学术
9. 沈柯辰,宋亚茹,高琳,张仁堂. 红枣固态发酵黑化前后苯甲酸及农药残留含量比较分析. 食品研究与开发. 2023(05): 177-183 .  百度学术
百度学术
10. 刘树萍,陆家慧,张佳美,彭秀文,苏晓文,石长波. 奇亚籽胶提取工艺优化及其理化性质. 食品研究与开发. 2023(22): 53-60 .  百度学术
百度学术
11. 林瑞,杜秋旻,李永春,闫美霖,何家丽,苗晶囡,徐丹,邱军强. 黄药子中黄独乙素提取工艺研究. 吉林医药学院学报. 2022(02): 91-94 .  百度学术
百度学术
12. 李金金,孟琦,崔馨燕,石汝杰,吴应梅,杨玲,周浓. 响应面法优化地参三萜酸提取工艺及抗氧化活性分析. 南方农业学报. 2022(08): 2261-2271 .  百度学术
百度学术
13. 刘嘉鑫,陈小梅,曾慧,王淑美,向丽敏. 响应面法优化蒲桃籽中三萜类化合物的提取工艺及其抗氧化活性分析. 食品工业科技. 2022(23): 192-199 .  本站查看
本站查看
14. 周海旭,苏同超,李姝,冉军舰,李波,高晗,余梦薇,薛静丽,李婧瑜,李晓晴,李忠海. 樟叶木脂素的提取纯化及其抗氧化性、抗癌活性. 食品工业科技. 2021(13): 170-178 .  本站查看
本站查看
15. 王吉宇,李成文,徐彦靖,于青,刘楠,刘东春. 响应面法优化藏红花素碱水解制备反式藏红花酸工艺. 食品工业科技. 2021(23): 176-183 .  本站查看
本站查看
其他类型引用(9)





 下载:
下载:

 下载:
下载:



