Research on the Antibacterial Mechanism of Lauroyl Arginate Ethyl against Listeria monocytogenes
-
摘要: 本文拟研究月桂酰精氨酸乙酯(lauroyl arginate ethyl,LAE)对单增李斯特菌(Listeria monocytogenes)的失活机制。采用二倍稀释法测定LAE对L. monocytogenes的最小抑菌浓度(minimum antibacterial concentration,MIC)。通过测定细胞形态、细胞膜完整性、胞内ATP水平、细胞膜电位、细胞表面疏水性及胞内活性氧(reactive oxygen species,ROS)水平等指标,揭示LAE失活L. monocytogenes的作用机制。结果表明,LAE对L. monocytogenes的MIC值为10 μg/mL。与未处理组相比,经终浓度为40 μg/mL的LAE处理10 min后,L. monocytogenes细胞形态发生明显皱缩,胞外核酸和蛋白质水平分别升高了1.64和15.39倍(P<0.05),表明细胞膜通透性显著增强(P<0.05),且细胞膜发生去极化,细胞表面疏水性显著增强(P<0.05);胞内ATP水平降低了92.40%(P<0.05);胞内活性氧水平升高了77.27%(P<0.05)。此外,添加抗氧化剂谷胱甘肽和N-乙酰-L-半胱氨酸均能显著降低LAE的抑菌活性(P<0.05)。综上表明,LAE能够有效失活L. monocytogenes,这可能与其损伤细胞膜和诱导氧化应激等有关。该研究为LAE在食品保鲜中的实际应用提供了理论依据。Abstract: This work aimed to investigate the inactivation mechanism of lauroyl arginate ethyl (LAE) against Listeria monocytogenes. The antibacterial activity of LAE against L. monocytogenes was evaluated by measuring the minimum antibacterial concentration (MIC). Then, the antibacterial mechanism of LAE against L. monocytogenes was investigated by measuring the cell morphology, cell membrane integrity, intracellular ATP level, cell membrane potential, cell surface hydrophobicity, and intracellular reactive oxygen species (ROS) level. The results showed that LAE could effectively inhibit the growth of L. monocytogenes with a MIC value of 10 μg/mL. After LAE treatment at a final concentration of 40 μg/mL for 10 min, the cell morphology of L. monocytogenes shrank obviously, the levels of extracellular nucleic acid and protein significantly (P<0.05) increased by 1.64- and 15.39-fold, respectively, as compared with the control cells, indicating a significant enhancement of membrane permeability. After LAE treatment at a final concentration of 40 μg/mL for 10 min, the cell membrane was depolarized and the cell surface hydrophobicity was significantly enhanced (P<0.05). The intracellular level of ATP decreased by 92.40% (P<0.05), while the intracellular ROS level increased by 77.27% (P<0.05) compared with the control cells. In addition, glutathione and N-acetyl-L-cysteine could significantly (P<0.05) reduce the antibacterial activity of LAE against L. monocytogenes. In summary, LAE can effectively inactivate L. monocytogenes, which may be associated with the damage of cell membrane and oxidative stress. This study provides a theoretical basis for the practical application of LAE in food preservation.
-
单增李斯特菌(Listeria monocytogenes)是属于厚壁菌门李斯特菌属的革兰氏阳性短杆菌,是一种能引起人畜共患病的食源性致病菌。L. monocytogenes能够在低温、高盐和低氧等条件下生长,广泛存在于乳制品、肉和肉制品、水产品等食品中[1−2]。L. monocytogenes具有较强的致病性,可引起动物和人类败血症、脑膜炎、流产、围产期感染和胃肠炎等,造成严重的健康危害和经济损失[3−4]。因此,控制食品加工过程中的L. monocytogenes污染尤为重要。
月桂酰精氨酸乙酯(lauroyl arginate ethyl,LAE)是一种阳离子型表面活性剂,对细菌、霉菌和酵母均具有良好的抗菌活性[5]。研究表明,LAE具有很高的安全性,在体内可分解为月桂酸、L-精氨酸和乙醇。其中,月桂酸主要存在于天然含饱和脂肪的食物中,在体内可以进入脂肪酸代谢;L-精氨酸可通过尿素循环、三羧酸循环等途径最终分解为尿素和CO2[6]。2005年,美国食品药品监督管理局将LAE列为一般公认安全的食品添加剂;2011年,国际食品法典委员会将LAE列入《食品添加剂通用法典标准》中,不仅可以用于多种食品,还可用于蘑菇、豆类、坚果等生鲜农产品[7]。截至目前,LAE已被欧盟、加拿大等批准用于调味饮料、沙拉、奶酪和肉制品等的保鲜[8]。研究发现,LAE能够有效降低食品表面微生物的数量。例如,与对照组相比,经LAE处理后,接种于生菜表面的大肠杆菌及鸡肉表面的沙门氏菌分别降低了3.5 lg CFU/cm2和1.54 lg CFU/g[9−10]。目前的研究主要集中于LAE抑菌活性评价及在食品保鲜领域的应用,但对其抑菌机制的研究尚不充分。
因此,本研究通过研究LAE对L. monocytogenes细胞形态、细胞膜完整性、ATP水平、细胞膜电位、细胞表面疏水性以及胞内活性氧(reactive oxygen species,ROS)等的影响,阐明LAE失活L. monocytogenes的作用机制,以期为LAE在食品保鲜领域的实际应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
单增李斯特菌(L. monocytogenes ATCC 15313) 购自美国标准菌种保藏中心;大豆酪蛋白胨琼脂培养基(tryptic soy agar,TSA)、大豆酪蛋白胨液体培养基(tryptic soy broth,TSB) 北京奥博星生物技术有限责任公司;LAE、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 上海麦克林生化科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)、谷胱甘肽(glutathione,GSH)、十六烷、碘化丙啶(propidium iodide,PI) 上海阿拉丁生化科技股份有限公司;双(1,3-二巴比妥酸)三次甲基氧烯洛尔((bis-(1,3-dibutylbarbituric acid)pentamethine oxonol),DiBAC4(3))、2,7-二氯荧光素二乙酸酯(2,7-dichlorodi-hydrofluorescein diacetate,DCFH-DA) 上海源叶生物科技有限公司。
SW-CJ-1FD型超净工作台 苏州安泰空气技术有限公司;5424R型高速冷冻离心机 德国Eppendorf公司;THZ-103B型恒温培养摇床 上海一恒科学仪器有限公司;Bioscreen C全自动微生物生长曲线系统 芬兰Oy Growth Curves Ab公司;Regulus8100型高分辨冷场发射扫描电镜 日本Hitachi公司;Tecan Spark 20M型多功能微孔板读数仪 瑞士Tecan公司;NanoDrop 2000型超微量分光光度计 美国Thermo Fisher Scientific公司;T6型紫外分光光度计 北京普析通用仪器责任有限公司。
1.2 实验方法
1.2.1 菌悬液制备
用无菌接种环挑取L. monocytogenes单菌落接种于50 mL无菌TSB液体培养基中,并于37 ℃、150 r/min摇床培养12 h。所得菌液于4 ℃、3500×g离心5 min,弃上清,收集菌体。随后用0.85%(w/v)无菌生理盐水清洗菌体2次,离心,条件同上。最后,将所得菌体用0.85%无菌生理盐水重悬后并混匀,调整OD600 nm值介于0.20~0.25,制成活菌数约为108 CFU/mL的菌悬液,备用。
1.2.2 LAE最小抑菌浓度和生长曲线测定
采用微量肉汤二倍稀释法测定LAE对L. monocytogenes的最小抑菌浓度(minimum inhibition concentration,MIC)[11]。用TSB将L. monocytogenes菌悬液稀释至106 CFU/mL,备用。分别取100 μL不同浓度的LAE溶液加入到100孔板中,然后各加入100 μL菌液,使LAE的终浓度分别为0.625、1.25、2.5、5、10、20、40和80 μg/mL并充分混匀。将培养板置于全自动生长曲线系统并于37 ℃培养24 h,并测定OD600 nm。绘制生长曲线,以细菌生长被抑制的最低抑菌浓度作为MIC。在测定MIC的基础上,从不同浓度的孔中分别吸取100 μL的培养液涂布于TSA平板上,并于37 ℃培养24 h后进行计数,以无菌落的培养基所对应的最低LAE浓度作为最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.2.3 细胞形态观察
采用高分辨冷场发射扫描电镜观察LAE处理对L. monocytogenes细胞形态的影响[12]。L. monocytogenes菌悬液经终浓度为4×MIC的LAE处理10 min后,离心收集菌体,并于4 ℃下在戊二醛溶液中固定4 h,收集菌体并清洗3次;分别用10%~100%(v/v)乙醇溶液逐级洗脱10 min,收集菌体;加入乙酸异戊酯置换乙醇10 min,重复置换2次,收集菌体滴到硅片上,于室温下晾干过夜;将干燥好的样品放至贴有导电胶的载物台上,并于20 mA条件下对表面喷金处理40 s,然后采用高分辨冷场发射扫描电镜对细胞形态进行观察并拍照,以无菌水处理的L. monocytogenes细胞作为对照组。
1.2.4 细胞膜完整性评价
1.2.4.1 细胞膜通透性评价
采用PI荧光探针评价LAE处理对L. monocytogenes细胞膜通透性的影响[13]。L. monocytogenes菌悬液分别经终浓度0.5×MIC、1×MIC、2×MIC和4×MIC的LAE处理10 min后,离心收集菌体,并重悬于800 μL 0.85%的无菌生理盐水中;加入200 µL的PI储备液(15 µmol/L)并混匀,于室温避光反应10 min,离心同上,弃上清液。菌体用pH7.2的无菌磷酸盐缓冲液(sterile phosphate-buffered saline,PBS)洗涤2次,最后重悬于1 mL PBS中。采用多功能微孔板读数仪测定荧光强度,激发波长为485 nm,发射波长为635 nm,以未处理的样品作为空白对照。PI相对荧光强度的计算公式如下:
PI相对荧光强度(%)=F1F0×100 (1) 式中:F1为LAE处理组L. monocytogenes细胞PI荧光强度;F0为对照组细胞PI荧光强度。
1.2.4.2 胞外核酸和蛋白质水平测定
参考王博华等[14]的方法测定LAE处理对L. monocytogenes胞外核酸和蛋白质水平的影响。L. monocytogenes菌悬液分别经终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC的LAE处理10 min后,于4 ℃、12000×g离心2 min,采用超微量分光光度计测定上清液中核酸(260 nm)和蛋白质(280 nm)水平。
1.2.5 胞内ATP水平测定
采用ATP检测试剂盒测定经不同浓度LAE(终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC)处理10 min后L. monocytogenes细胞内ATP水平,结果用相对发光单位(relative light unit,RLU)表示。
1.2.6 细胞膜电位测定
L. monocytogenes菌悬液分别经不同浓度的LAE(终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC)处理10 min后,于4 ℃、12000×g离心2 min,收集菌体。所得菌体与500 μL的DiBAC4(3)溶液(5 μg/mL)和500 μL的EDTA溶液(8 mmol/L)混合均匀,置于37 ℃避光孵育15 min,离心同上,弃上清。菌体用PBS洗涤2次,最后重悬于1 mL PBS中。采用多功能微孔板读数仪测定荧光强度,激发波长为488 nm,发射波长为525 nm,以未处理的样品作为空白对照[15]。DiBAC4(3)相对荧光强度的计算公式如下:
DiBAC4(3)相对荧光强度(%)=F1F0×100 (2) 式中:F1为LAE处理组L. monocytogenes细胞DiBAC4(3)荧光强度;F0为对照组细胞DiBAC4(3)荧光强度。
1.2.7 细胞表面疏水性测定
采用微生物黏着碳氢化合物法测定L. monocytogenes细胞表面的疏水性[16]。取3 mL不同浓度的LAE溶液与3 mL L. monocytogenes菌悬液等体积混合,使LAE终浓度分别为0.5×MIC、1×MIC、2×MIC和4×MIC,于37 ℃水浴锅中孵育10 min后,用分光光度计测量其600 nm处的吸光度(记为A0);随后取3 mL上述菌液与400 μL十六烷混合,涡旋振荡2 min,静置15 min后取下层水相测量其OD600 nm值(记为A1),对照组为无菌水。用十六烷对细胞吸附率表示L. monocytogenes细胞表面疏水性,计算公式如下:
十六烷吸附率(%)=(1−A1A0)×100 (3) 1.2.8 LAE诱导L. monocytogenes氧化应激作用评价
1.2.8.1 细胞内活性氧水平测定
采用ROS检测试剂盒测定LAE对L. monocytogenes细胞内ROS水平的影响[17]。L. monocytogenes菌悬液分别经不同浓度的LAE(终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC)处理10 min后,于4 ℃、12000×g离心2 min,收集菌体。然后加入DCFH-DA储备液(终浓度为50 μmol/L),并于37 ℃避光培养30 min,菌体用PBS洗涤2次,最后重悬于1 mL PBS中。采用多功能微孔板读数仪测定荧光强度,激发波长为488 nm,发射波长为525 nm,以未处理的样品作为对照组。DCF相对荧光强度的计算公式如下:
DCF相对荧光强度(%)=F1F0×100 (4) 式中:F1为LAE处理组L. monocytogenes细胞DCF荧光强度;F0为对照组细胞DCF荧光强度。
1.2.8.2 抗氧化剂对LAE失活L. monocytogenes效果的影响
通过添加GSH或NAC,评价ROS在LAE失活L. monocytogenes细胞中的作用[8]。L. monocytogenes菌悬液分别经LAE、GSH、NAC、LAE+GSH或LAE+NAC处理10 min,LAE、GSH和NAC的终浓度分别为4×MIC、8 mmol/L和4 mmol/L。经生理盐水梯度稀释后,吸取100 μL稀释液均匀涂布于TSA平板,并于37 ℃培养48 h后进行菌落计数,结果表示为lg CFU/mL。
1.3 数据处理
每个处理均3个重复组,结果表示为平均值±标准差(Standard deviation,SD)。采用SPSS 21.0(Version 21.0, IBM 公司)进行单因素方差分析(one-way ANOVA),各组间采用LSD多重比较进行差异显著性分析,P<0.05表示具有显著性差异。采用Prism软件(Graphpad 8.0)绘图。
2. 结果与分析
2.1 LAE处理对L. monocytogenes的抑制作用
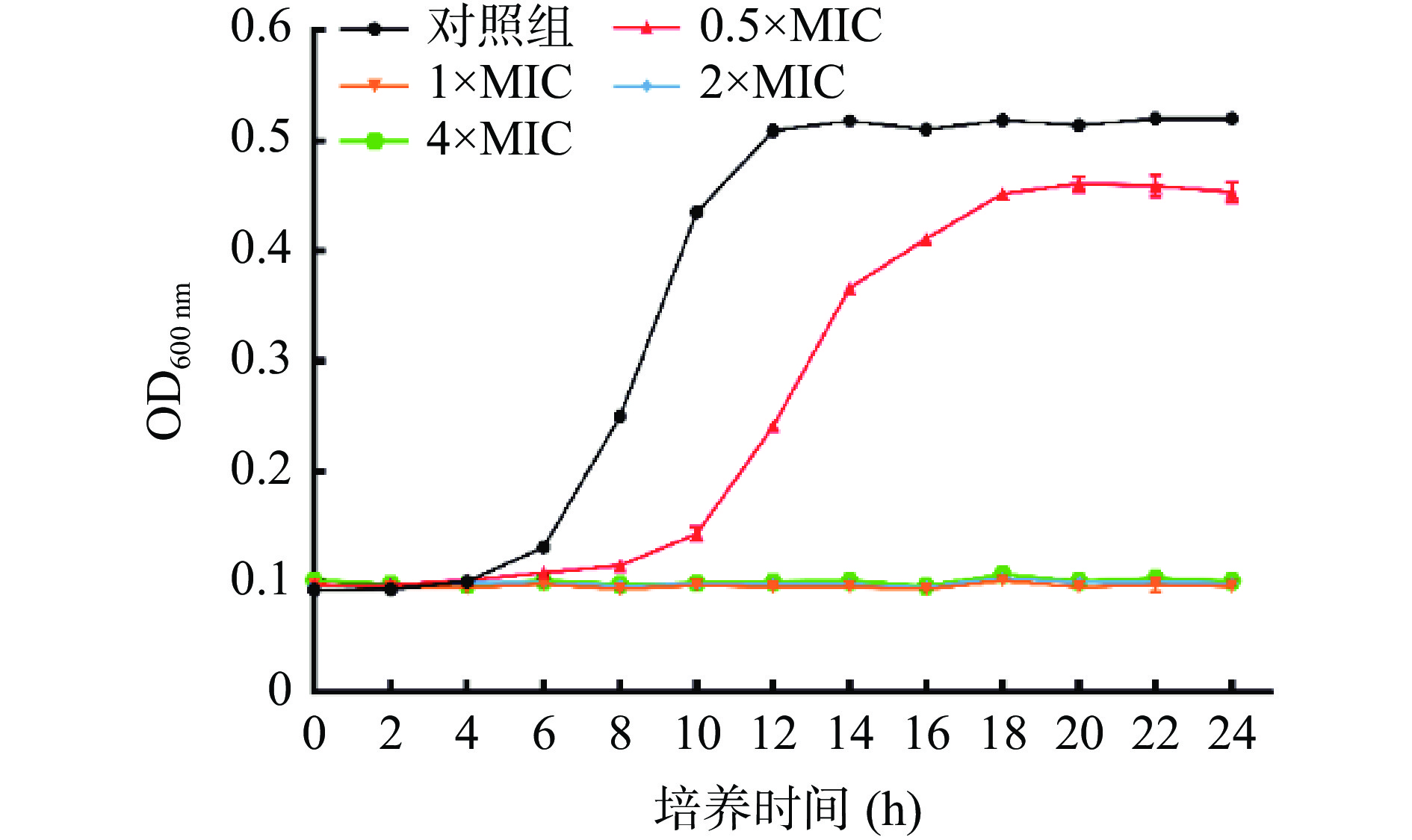
首先采用微量肉汤二倍稀释法测得LAE对L. monocytogenes的MIC为10 μg/mL,MBC为20 μg/mL。不同浓度LAE对L. monocytogenes生长的影响见图1。
由图1可知,培养24 h后,对照组样品的OD600 nm值由初始的0.093升高至0.520;与对照组相比,当LAE浓度为0.5×MIC时,处理组样品OD600 nm下降至0.454,表明LAE能够抑制L. monocytogenes的增殖。当LAE浓度为1×MIC、2×MIC和4×MIC时,菌液OD600 nm值未发生明显升高,说明浓度大于1×MIC的LAE能够完全抑制L. monocytogenes的生长。以上结果表明,LAE对L. monocytogenes具有良好的抑制作用。
2.2 LAE处理对L. monocytogenes细胞形态的影响
采用场发射扫描电镜评价LAE处理对L. monocytogenes细胞形态的影响,结果见图2。
如图2a所示,对照组L. monocytogenes细胞形态正常,表面较为平整光滑;经终浓度为4×MIC的LAE处理10 min后,L. monocytogenes细胞表面变得粗糙,皱缩现象明显,部分细胞甚至出现孔洞和塌陷等变化,并且部分细胞表面附着有堆积物且菌体之间发生粘连(图2b),这可能与胞内物质泄漏有关。与本研究结果类似,Becerril等[18]研究发现,经浓度为25 μg/mL的LAE处理5 min后,大肠杆菌O157:H7细胞表面发生皱缩,细胞膜上存在明显的破裂和孔洞。上述结果表明,LAE处理能够改变L. monocytogenes细胞形态,破坏细胞膜的结构和功能,进而抑制菌体正常生长甚至导致其失活。
2.3 LAE处理对L. monocytogenes细胞膜完整性的影响
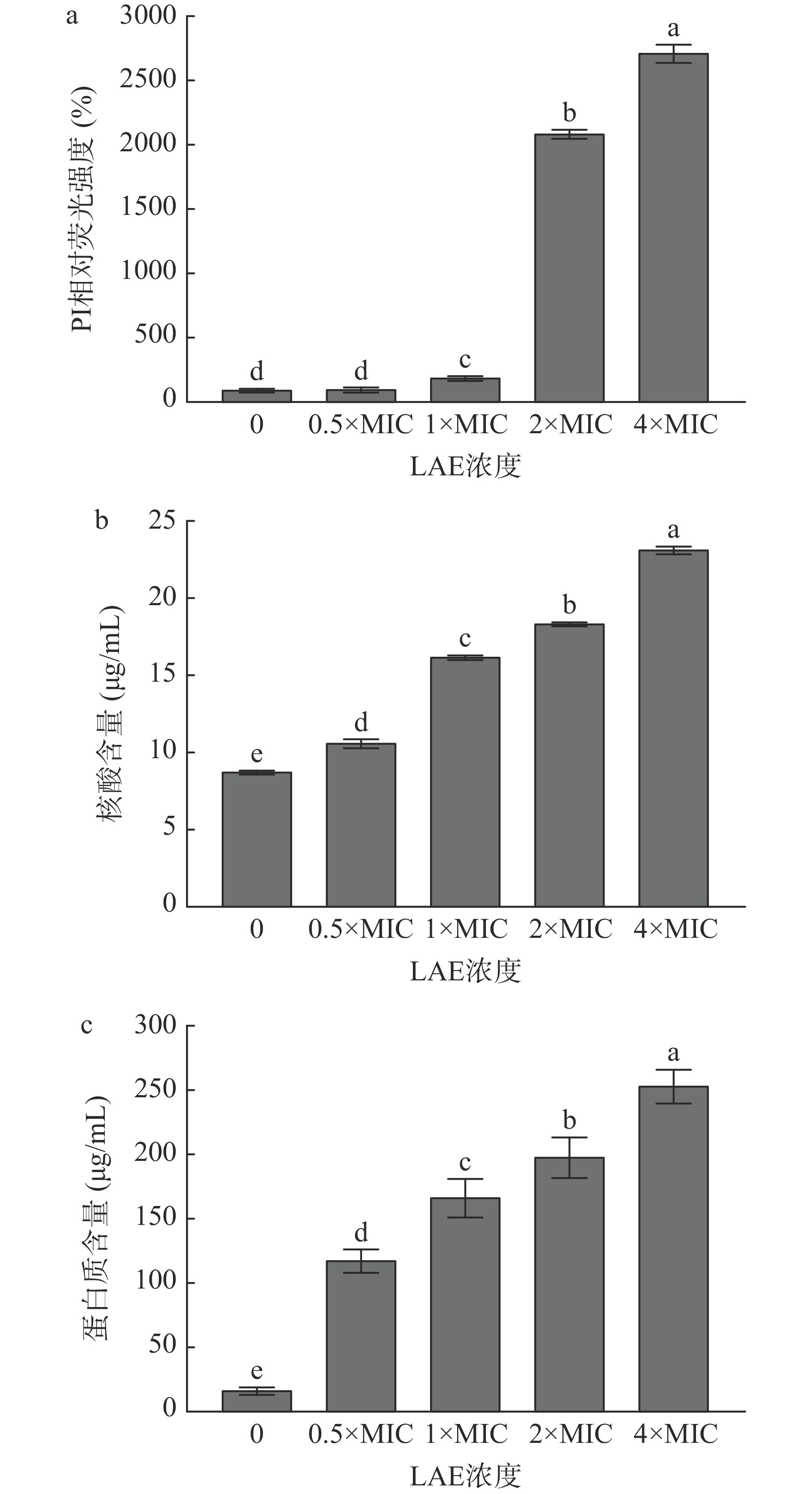
细胞膜为细菌提供了适合生存的稳定内环境。当细菌细胞膜通透性遭到损伤时,微生物的正常代谢和能量转换会受到干扰[19]。PI是一种带正电荷的疏水性核酸染料,只能进入细胞膜发生损伤的细胞,并与核酸结合后产生红色荧光[20−21]。如图3a所示,与对照组相比,经终浓度为0.5至4×MIC的LAE处理10 min后,L. monocytogenes细胞中PI荧光强度分别升高了0.06、0.94、19.86和26.14倍(P<0.05)。上述结果表明LAE处理破坏了L. monocytogenes的细胞膜完整性。
为进一步探讨LAE对L. monocytogenes对细胞膜完整性的影响,研究了LAE处理后L. monocytogenes胞外核酸和蛋白质水平的变化情况。核酸、蛋白质等大分子物质是细胞的重要组成成分,参与调控微生物生长、繁殖、遗传和代谢等生命活动[22]。当细菌细胞膜受到损伤时,胞内的核酸、蛋白质等生物大分子会泄漏到细胞外。因此,可通过检测上清液中核酸和蛋白质的水平来判断细胞膜的损伤情况。如图3b和图3c所示,与对照组相比,L. monocytogenes胞外核酸和蛋白质水平随LAE处理浓度的增加而显著升高(P<0.05)。经终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC的LAE处理10 min后,L. monocytogenes胞外核酸水平分别升高了0.21、0.85、1.10和1.64倍(P<0.05),胞外蛋白质水平分别升高了6.15、9.12、12.03和15.39倍(P<0.05)。类似地,Xu等[23]研究发现,经终浓度为1至4×MIC的LAE处理24 h后,果胶杆菌胞外核酸和胞外蛋白质水平均显著升高。综上所述,LAE处理能够损伤L. monocytogenes细胞膜,增强细胞膜通透性,造成核酸和蛋白质等胞内物质泄漏到细胞外,进而影响细胞正常代谢,最终导致菌体死亡。
2.4 LAE处理对L. monocytogenes细胞内ATP水平的影响
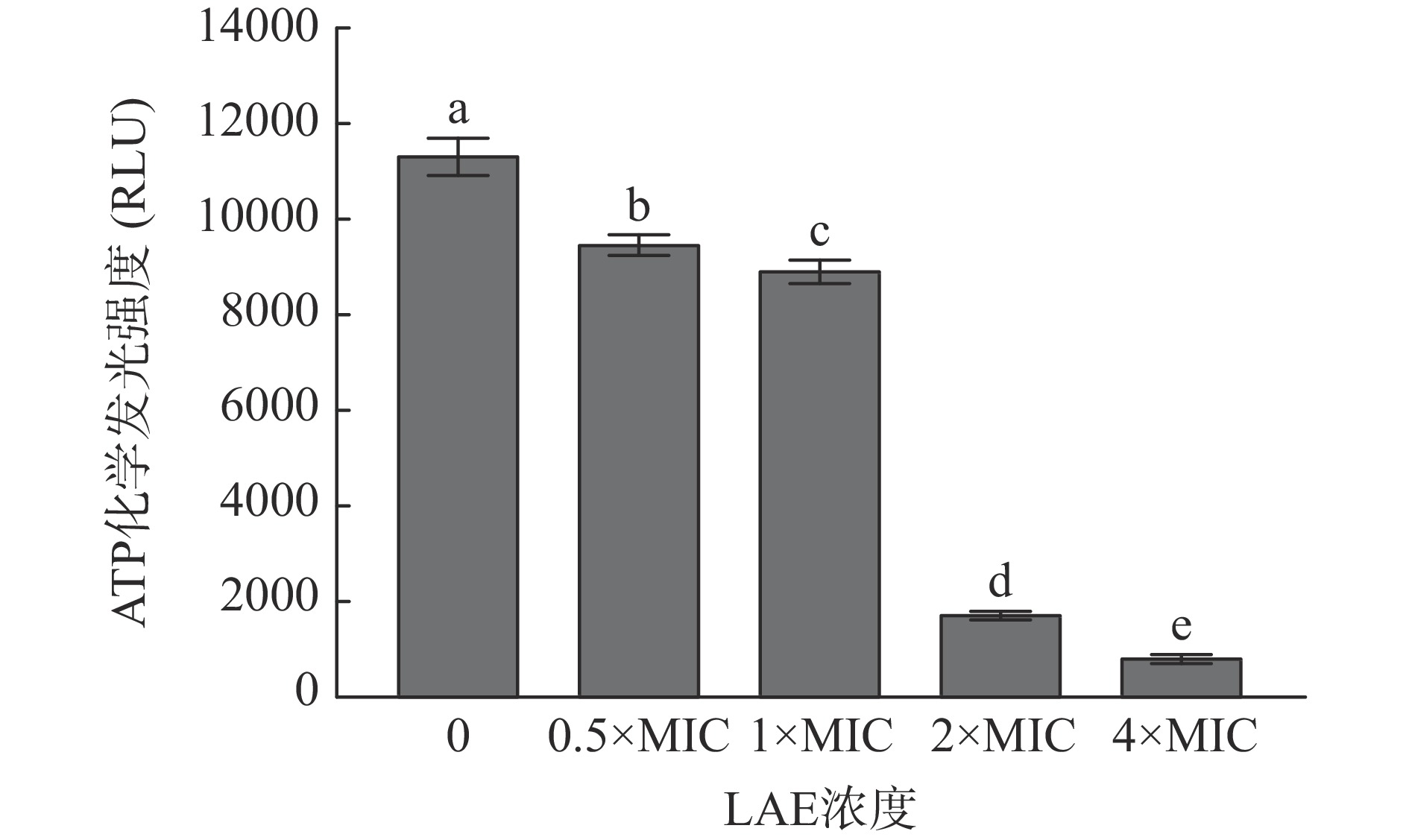
ATP可维持细菌的正常能量代谢,参与能量转换、营养输送及大分子合成等生理代谢活动[24]。当细胞受到外界刺激时,胞内ATP水平会随之变化,进而影响其正常代谢活动[25]。LAE处理对L. monocytogenes细胞内ATP水平的影响见图4。
由图4可知,LAE处理后L. monocytogenes细胞内的ATP化学发光强度显著降低。经终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC的LAE处理10 min后,L. monocytogenes胞内ATP化学发光强度较对照组分别降低了16.52%、21.55%、84.68%和92.40%(P<0.05)。Lin等[26]研究发现,与对照组相比,经抗菌剂ε-聚赖氨酸处理后,L. monocytogenes细胞内ATP化学发光强度发生明显下降,这可能是由于ε-聚赖氨酸破坏了L. monocytogenes细胞膜结构,促使细胞破裂和崩解,导致细胞内ATP泄漏。研究表明,胞内ATP水平的降低可能与ATP合成速率降低、ATP水解速率升高、细胞膜通透性增强等有关[27]。因此,LAE可能通过影响胞内ATP合成和水解速率、提高细胞膜通透性等途径降低胞内ATP水平,最终导致L. monocytogenes死亡。
2.5 LAE处理对L. monocytogenes细胞膜电位的影响
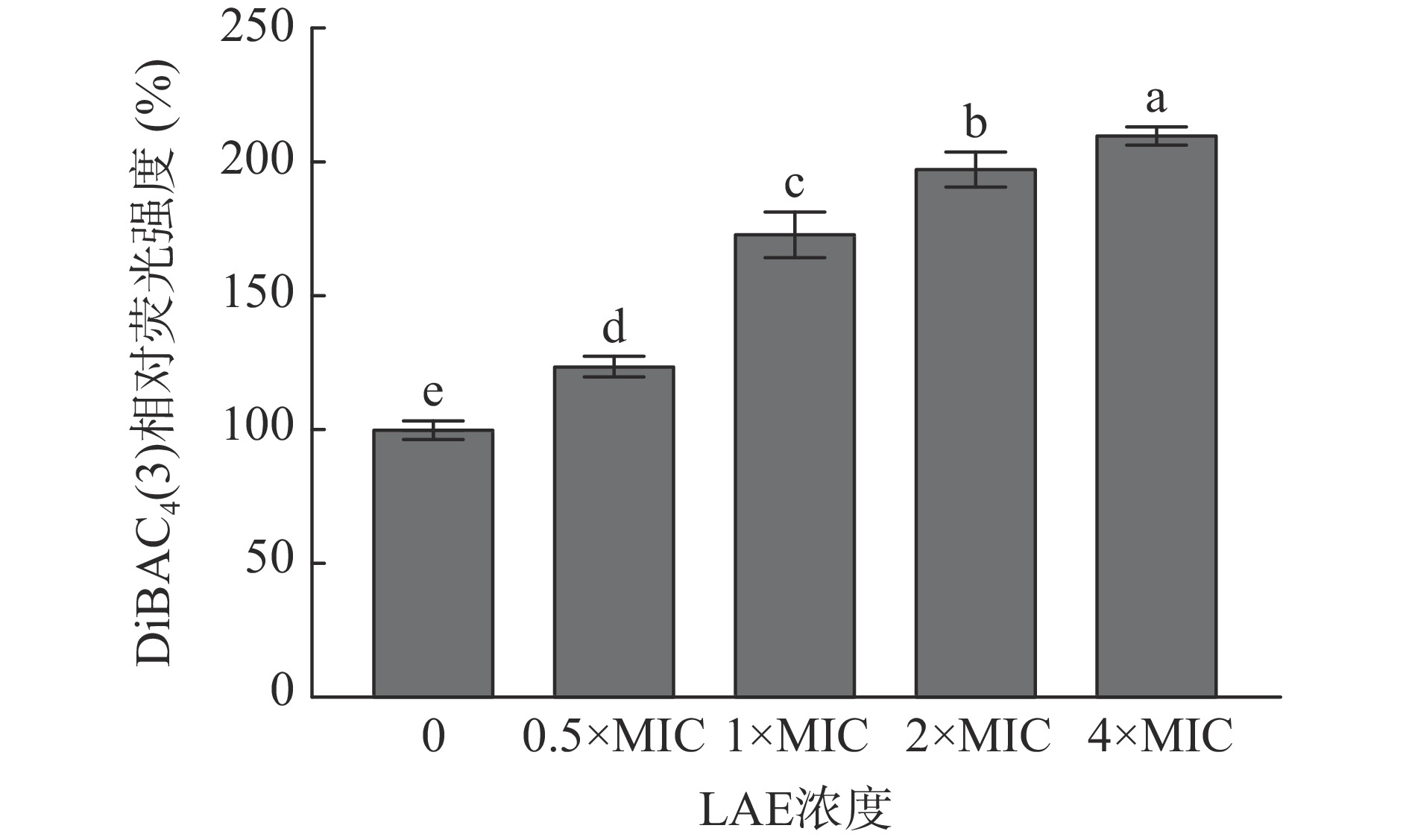
细胞膜电位是由细胞内外不同浓度离子产生的电势差,参与并调节细菌跨膜运输、细胞分裂和ATP合成等多种生理功能[28]。正常细胞的膜电位是呈现内负外正的状态,当微生物受到刺激时会引发Na+迅速内流,使细胞膜内负电荷减少,进而使膜电位变为内正外负,此过程被称为细胞膜的去极化[29]。DiBAC4(3)常用于检测细胞膜电位变化的亲脂性阴离子荧光染料。DiBAC4(3)进入去极化细胞后,会与细胞内脂质成分结合,从而使胞内荧光强度增强[28]。采用DiBAC4(3)荧光探针评价LAE处理对L. monocytogenes细胞膜电位的影响,结果见图5。
由图5可知,L. monocytogenes经LAE处理后,其细胞内DiBAC4(3)相对荧光强度随LAE添加浓度的升高而逐渐增强(P<0.05),说明细胞膜电位发生去极化。该结果与细胞膜通透性的变化趋势相一致。研究表明,细胞膜发生去极化会影响胞内K+、Na+、Ca2+等的离子通道,进而导致细菌细胞膜内外电势差增加,对细胞造成不可逆的损伤,最终诱导细胞死亡[25,30−31]。综上所述,细胞膜可能是LAE失活L. monocytogenes的主要作用靶点。
2.6 LAE处理对L. monocytogenes细胞表面疏水性的影响
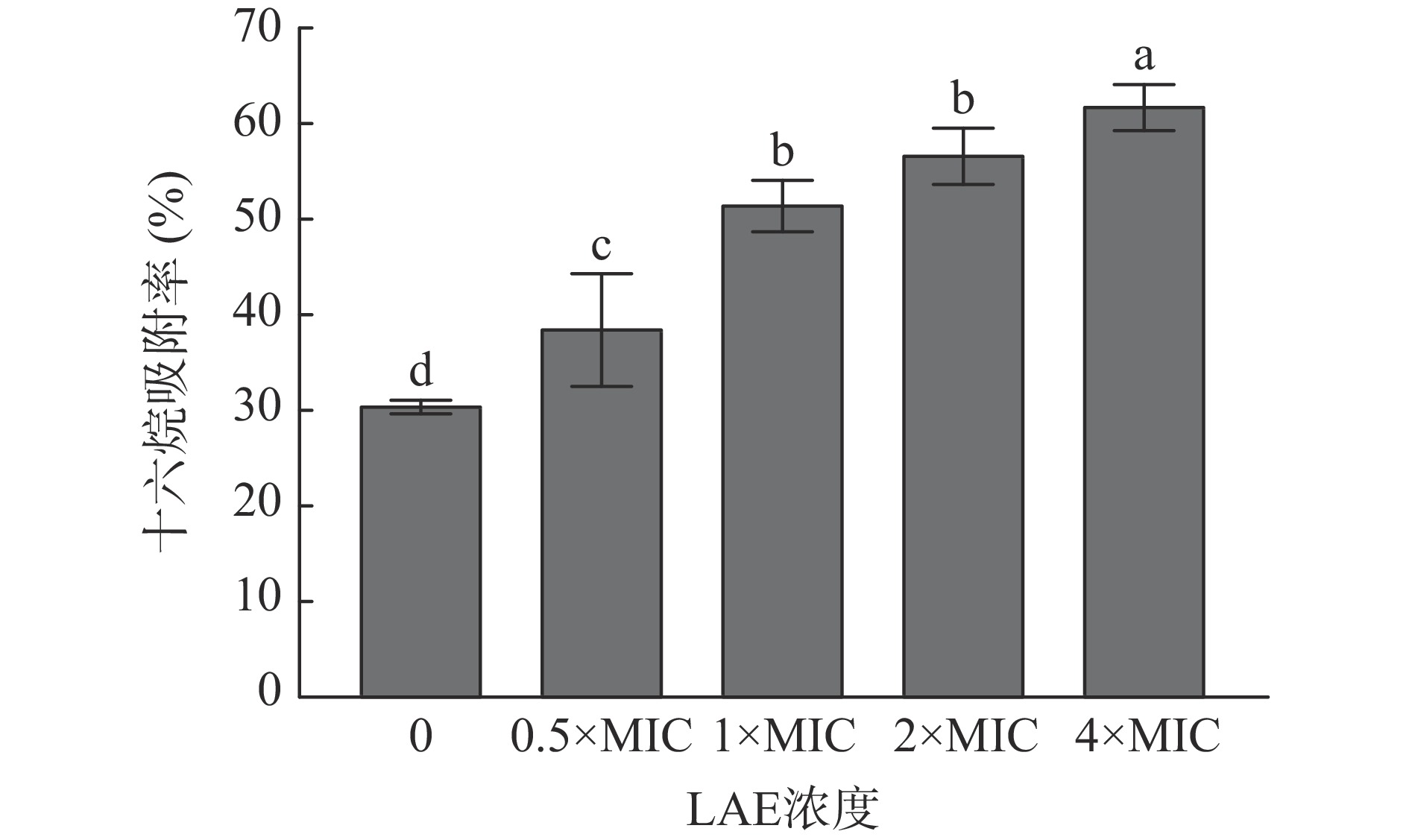
细胞表面疏水性是决定细菌非特异性黏附到其他物质及界面的影响因素,也影响细菌对营养物质的吸收及其生长代谢过程等[16]。通过研究十六烷对L. monocytogenes细胞吸附率的变化评价LAE处理对L. monocytogenes细胞表面疏水性的影响,结果见图6。
由图6可知,经不同浓度LAE处理10 min后,对照组中十六烷对L. monocytogenes细胞吸附率仅为30.55%,而终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC的LAE处理组分别为38.62%、51.67%、56.85%和61.94%。以上结果说明经LAE处理后,L. monocytogenes细胞表面疏水性明显升高(P<0.05)。蒋思雨等[32]研究发现LAE能够明显增强大肠杆菌的细胞表面疏水性。LAE具有两亲性,其结构中的L-精氨酸侧链上因存在有带正电荷的胍基使其具有亲水性,而月桂酸中的十二烷脂肪链烃使其具有疏水性。推测LAE分子首先以带正电荷的胍基与细菌表面带负电荷的基团相接触,然后其疏水性的十二烷脂肪链烃尾部附着于细菌表面,因此使细胞表面的疏水性提高[32]。此外,Liu等[33]发现二氢杨梅素对副溶血弧菌的杀菌效果与细菌表面疏水性增加成正相关,其表面疏水性影响抑菌效果。综上所述,LAE处理能够提高L. monocytogenes细胞表面疏水性,使细菌更容易粘附于疏水性物质表面。因此,在今后的研究中,可将LAE应用于高水分食品(如肉制品、水产品、乳制品等)以抑制食品表面微生物的附着。
2.7 LAE处理诱导L. monocytogenes发生氧化应激
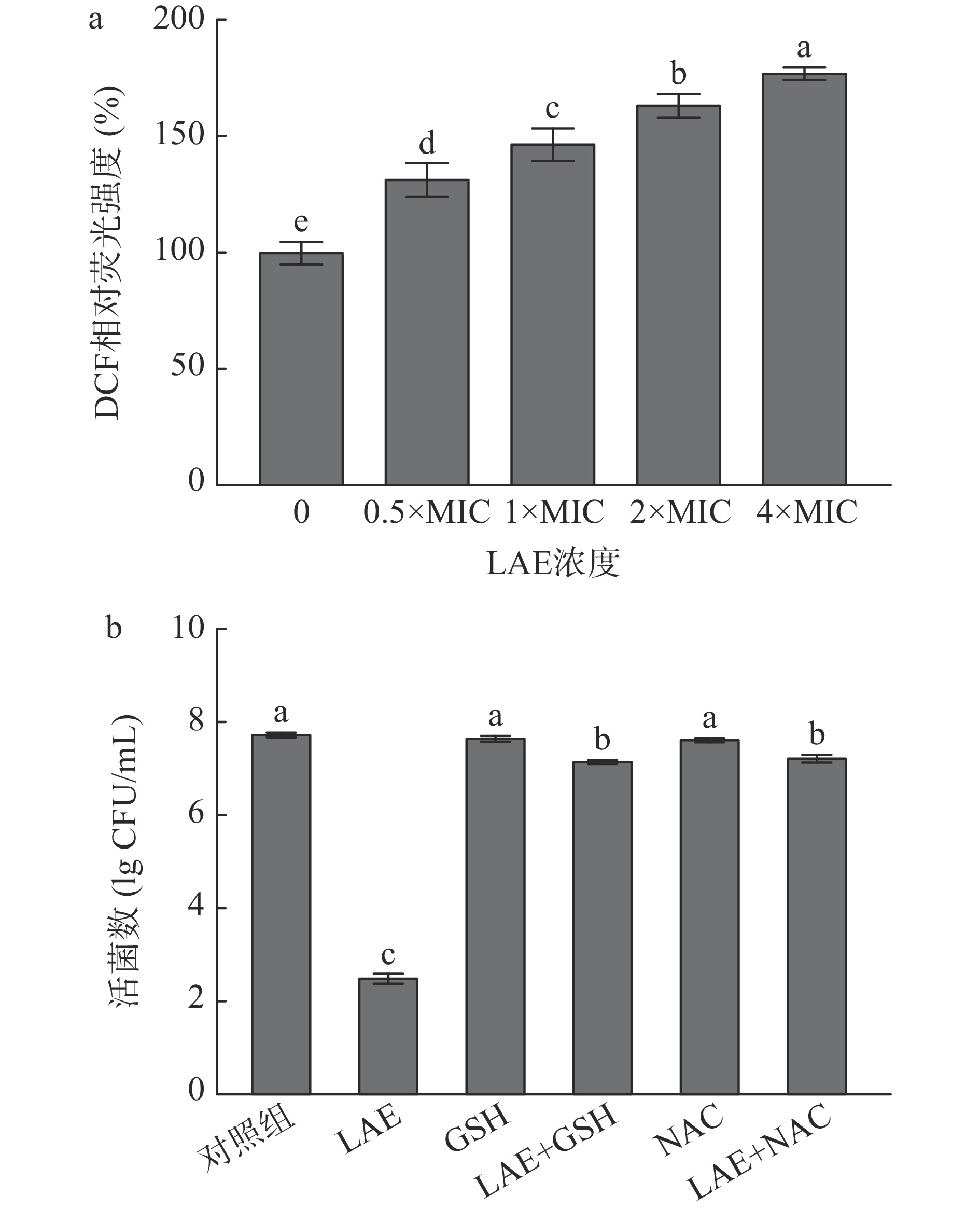
ROS是细胞进行正常有氧代谢的副产物,参与细胞信号传导并维持细胞的正常生理活性。胞内ROS过度积累会造成细胞发生氧化损伤甚至死亡[34]。因此,测定胞内ROS水平变化是评价细胞发生氧化应激现象的重要手段。DCFH-DA是一种常用于评价胞内ROS水平的探针。DCFH-DA本身不会产生荧光,当进入细胞后,可以被胞内的酯酶水解生成2',7'-二氯二氢荧光素(dichlorodihydrofluorescein,DCFH),而DCFH能够被胞内ROS快速氧化生成有绿色荧光的2',7'-二氯荧光素(2',7'-dichlorofluorescein,DCF)[35−36]。采用DCFH-DA探针评价LAE处理对L. monocytogenes胞内ROS水平的影响。如图7a所示,LAE处理组L. monocytogenes细胞内DCF相对荧光强度随其添加浓度的升高而显著增强(P<0.05)。与对照组相比,经终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC的LAE处理10 min后,L. monocytogenes细胞内DCF相对荧光强度分别升高了31.82%、46.97%、63.64%和77.27%(P<0.05)。Zhao等[6]也发现,经终浓度为10~50 μg/mL的LAE处理10 min后,大肠杆菌O157:H7胞内DCF荧光强度较对照组提高111.1%~214.9%。
为进一步揭示氧化应激在LAE失活L. monocytogenes中的作用,评价添加外源性抗氧化剂GSH和NAC对LAE失活L. monocytogenes效果的影响[6,37]。如图7b所示,经终浓度为4×MIC的LAE处理10 min后,L. monocytogenes由初始的7.75 lg CFU/mL降低至2.53 lg CFU/mL;与对照组相比,经终浓度分别为8 mmol/L的GSH或4 mmol/L的NAC处理10 min后,L. monocytogenes未发生显著变化(P>0.05)。与LAE单独处理组相比,在GSH或NAC存在下,LAE(终浓度为4×MIC)对L. monocytogenes的杀灭效果显著降低(P<0.05)。上述结果与Zhao等[6]的报道一致,其研究发现经50 μg/mL的LAE处理10 min后,大肠杆菌O157:H7数量降低了约4.4 lg CFU/mL,而当抗氧化剂抗坏血酸存在时,大肠杆菌O157:H7细胞与初始值未发生显著变化(P>0.05)。综上所述,LAE处理诱导了L. monocytogenes细胞中ROS的积累,并引发氧化应激反应,进而造成脂质、蛋白质和核酸等胞内物质发生氧化损伤,最终造成细胞死亡。
3. 结论
本研究从细胞水平上探讨了LAE失活L. monocytogenes的作用机制。结果表明,LAE处理能够有效失活L. monocytogenes,且失活效果随LAE添加浓度的升高而增强。研究发现,LAE可能是通过改变L. monocytogenes细胞形态、提高细胞膜通透性、降低胞内ATP水平、促进细胞膜去极化、提高细胞表面疏水性和诱导细胞氧化应激等途径来发挥其抑菌作用。在今后的研究中,应综合运用代谢组学、蛋白质组学、转录组学等方法深入阐释LAE失活食源性病原菌的分子机制,系统评价LAE对果蔬、肉制品、水产品等食品营养和感官品质的影响,推动LAE在食品保鲜领域的实际应用。
-
-
[1] FAGERLUND A, LANGSRUD S, MØRETRØ T. Microbial diversity and ecology of biofilms in food industry environments associated with Listeria monocytogenes persistence[J]. Current Opinion in Food Science,2020,37:171−178.
[2] OSEK J, LACHTARA B, WIECZOREK K. Listeria monocytogenes in foods—From culture identification to whole-genome characteristics[J]. Food Science & Nutrition,2022,10(9):2825−2854.
[3] MATLE I, MBATHA K R, MADOROBA E. A review of Listeria monocytogenes from meat and meat products:Epidemiology, virulence factors, antimicrobial resistance and diagnosis[J]. Onderstepoort Journal of Veterinary Research,2020,87(1):1−20.
[4] 李银辉, 张红敏, 孟媛媛, 等. 金华火腿中单增李斯特菌的风险评估[J]. 食品工业科技,2023,44(16):270−279. [LI Y H, ZHANG H M, MENG Y Y, et al. Risk assessment of Listeria monocytogenes in Jinhua ham[J]. Science and Technology of Food Industry,2023,44(16):270−279.] LI Y H, ZHANG H M, MENG Y Y, et al . Risk assessment of Listeria monocytogenes in Jinhua ham[J]. Science and Technology of Food Industry,2023 ,44 (16 ):270 −279 .[5] KASHIRI M, LÓPEZ-CARBALLO G, HERNÁNDEZ-MUÑOZ P, et al. Antimicrobial packaging based on a LAE containing zein coating to control foodborne pathogens in chicken soup[J]. International Journal of Food Microbiology,2019,306:108272. doi: 10.1016/j.ijfoodmicro.2019.108272
[6] ZHAO D B, WANG S D, HU Y S, et al. Insight into the antibacterial activity of lauric arginate against Escherichia coli O157:H7:Membrane disruption and oxidative stress[J]. LWT-Food Science and Technology,2022,162:113449. doi: 10.1016/j.lwt.2022.113449
[7] MA Q M, DAVIDSON P M, ZHONG Q X. Properties and potential food applications of lauric arginate as a cationic antimicrobial[J]. International Journal of Food Microbiology,2020,315:108417. doi: 10.1016/j.ijfoodmicro.2019.108417
[8] EFSA F P, YOUNES M, AQUILINA G, et al. Safety of ethyl lauroyl arginate (E 243) as a food additive in the light of the new information provided and the proposed extension of use[J]. EFSA Journal,2019,17(3):e05621.
[9] NÜBLING S, WOHLT D, SAILE N, et al. Antimicrobial effect of lauroyl arginate ethyl on Escherichia coli O157:H7 and Listeria monocytogenes on red oak leaf lettuce[J]. European Food Research and Technology,2017,243(5):879−887. doi: 10.1007/s00217-016-2802-1
[10] HAWKINS J L, VIMINI B, SCHWARZ J G, et al. Application of antimicrobial agents via commercial spray cabinet to inactivate Salmonella on skinless chicken meat[J]. Journal of Food Protection,2016,79(4):569−573. doi: 10.4315/0362-028X.JFP-15-248
[11] 李玮玮, 蔡天舒, 冀霞, 等. 香芹酚和月桂酰精氨酸乙酯盐酸盐联用对荧光假单胞菌抑菌作用的研究[J]. 食品研究与开发,2022,43(13):37−44. [LI W W, CAI T S, JI X, et al. Activity of carvacrol and ethyl-Nα-lauroyl-L-arginate hydrochloride against Pseudomonas fluorescens[J]. Food Research and Development,2022,43(13):37−44.] LI W W, CAI T S, JI X, et al . Activity of carvacrol and ethyl-Nα-lauroyl-L-arginate hydrochloride against Pseudomonas fluorescens[J]. Food Research and Development,2022 ,43 (13 ):37 −44 .[12] 张艺林, 刘静飞, 任梦梦, 等. 微高压CO2对 Pseudomonas deceptionensis CM2的杀菌效应研究[J]. 轻工学报,2022,37(5):24−31. [ZHANG Y L, LIU J F, REN M M, et al. The bactericidal effect of petit-high pressure CO2 on Pseudomonas deceptionensis CM2[J]. Journal of Light Industry,2022,37(5):24−31.] ZHANG Y L, LIU J F, REN M M, et al . The bactericidal effect of petit-high pressure CO2 on Pseudomonas deceptionensis CM2[J]. Journal of Light Industry,2022 ,37 (5 ):24 −31 .[13] XIANG Q S, KANG C D, NIU L Y, et al. Antibacterial activity and a membrane damage mechanism of plasma activated water against Pseudomonas deceptionensis CM2[J]. LWT-Food Science and Technology,2018,96:395−401. doi: 10.1016/j.lwt.2018.05.059
[14] 王博华, 薛冬, 董闪闪, 等. 介质阻挡放电等离子体对单增李斯特菌的杀灭效果及作用机制研究[J]. 轻工学报,2023,38(3):17−24,54. [WANG B H, XUE D, DONG S S, et al. Study on the killing effect and mechanism of dielectric barrier discharge plasma against Listeria monocytogenes[J]. Journal of Light Industry,2023,38(3):17−24,54.] WANG B H, XUE D, DONG S S, et al . Study on the killing effect and mechanism of dielectric barrier discharge plasma against Listeria monocytogenes[J]. Journal of Light Industry,2023 ,38 (3 ):17 −24,54 .[15] XING K, XING Y, LIU Y F, et al. Fungicidal effect of chitosan via inducing membrane disturbance against Ceratocystis fimbriata[J]. Carbohydrate Polymers,2018,192:95−103. doi: 10.1016/j.carbpol.2018.03.053
[16] 肖怀秋, 李玉珍, 林亲录, 等. 金属抗菌肽SIF4对金黄色葡萄球菌细胞通透性的影响机制[J]. 食品与生物技术学报,2023,42(2):97−103. [XIAO H Q, LI Y Z, LIN Q L, et al. Mechanism of metal antimicrobial peptide SIF4 against Staphylococcus aureus cell permeability[J]. Journal of Food Science and Biotechnology,2023,42(2):97−103.] XIAO H Q, LI Y Z, LIN Q L, et al . Mechanism of metal antimicrobial peptide SIF4 against Staphylococcus aureus cell permeability[J]. Journal of Food Science and Biotechnology,2023 ,42 (2 ):97 −103 .[17] LIU X, LI Y F, WANG S D, et al. Synergistic antimicrobial activity of plasma-activated water and propylparaben:Mechanism and applications for fresh produce sanitation[J]. LWT-Food Science and Technology,2021,146:111447. doi: 10.1016/j.lwt.2021.111447
[18] BECERRIL R, MANSO S, NERIN C, et al. Antimicrobial activity of lauroyl arginate ethyl (LAE), against selected food-borne bacteria[J]. Food Control,2013,32(2):404−408. doi: 10.1016/j.foodcont.2013.01.003
[19] CAREY A B, ASHENDEN A, KÖPER I. Model architectures for bacterial membranes[J]. Biophysical Reviews,2022,14(1):111−143. doi: 10.1007/s12551-021-00913-7
[20] ZHANG C L, YANG G J, SHEN P P, et al. Inactivation mechanism of slightly acidic electrolyzed water on Bacillus cereus spores[J]. Food Microbiology,2022,103:103951. doi: 10.1016/j.fm.2021.103951
[21] LUO K Y, ZHAO P Y, HE Y F, et al. Antibacterial effect of oregano essential oil against Vibrio vulnificus and its mechanism[J]. Foods,2022,11(3):403. doi: 10.3390/foods11030403
[22] ALAVI M, KARIMI N. Biosynthesis of Ag and Cu NPs by secondary metabolites of usnic acid and thymol with biological macromolecules aggregation and antibacterial activities against multi drug resistant (MDR) bacteria[J]. International Journal of Biological Macromolecules,2019,128:893−901. doi: 10.1016/j.ijbiomac.2019.01.177
[23] XU X H, JIANG Z L, FENG F Q, et al. Mechanisms of N α -lauroyl arginate ethyl ester against Penicillium digitatum and Pectobacterium carotovorum subsp. carotovorum[J]. Journal of Food Science and Technology,2018,55(9):3675−3682. doi: 10.1007/s13197-018-3296-6
[24] HAN Y J, SUN Z C, CHEN W X. Antimicrobial susceptibility and antibacterial mechanism of limonene against Listeria monocytogenes[J]. Molecules,2019,25(1):33. doi: 10.3390/molecules25010033
[25] NIU L Y, ZHANG Y L, JIE M S, et al. Synergetic effect of petit-high pressure carbon dioxide combined with cinnamon ( Cinnamomum cassia) essential oil against Salmonella typhimurium[J]. International Journal of Food Science & Technology,2022,57(5):2954−2967.
[26] LIN L, GU Y L, LI C Z, et al. Antibacterial mechanism of ε-Poly-lysine against Listeria monocytogenes and its application on cheese[J]. Food Control,2018,91:76−84. doi: 10.1016/j.foodcont.2018.03.025
[27] 李玉珍, 肖怀秋, 刘淼, 等. 金属抗菌肽SIF4对大肠杆菌呼吸代谢与能量代谢的抑制机理[J]. 食品科学,2023,44(17):36−42. [LI Y Z, XIAO H Q, LIU M, et al. Inhibitory mechanism of metal antimicrobial peptide SIF4 on respiratory metabolism and energy metabolism of Escherichia coli[J]. Food Science,2023,44(17):36−42.] LI Y Z, XIAO H Q, LIU M, et al . Inhibitory mechanism of metal antimicrobial peptide SIF4 on respiratory metabolism and energy metabolism of Escherichia coli[J]. Food Science,2023 ,44 (17 ):36 −42 .[28] BENARROCH J M, ASALLY M. The microbiologist's guide to membrane potential dynamics[J]. Trends in Microbiology,2020,28(4):304−314. doi: 10.1016/j.tim.2019.12.008
[29] CHEN J, GOPALAKRISHNAN S, LAKE M R, et al. Application of large-scale transient transfection to cell-based functional assays for ion channels and GPCRs[J]. Methods in Enzymology,2010,485:293−309.
[30] BAI F T, GUO D, WANG Y Y, et al. The combined bactericidal effect of nisin and thymoquinone against Listeria monocytogenes in tryptone soy broth and sterilized milk[J]. Food Control,2022,135:108771. doi: 10.1016/j.foodcont.2021.108771
[31] HOSSAIN F, MOGHAL M M R, ISLAM M Z, et al. Membrane potential is vital for rapid permeabilization of plasma membranes and lipid bilayers by the antimicrobial peptide lactoferricin B[J]. Journal of Biological Chemistry,2019,294(27):10449−10462. doi: 10.1074/jbc.RA119.007762
[32] 蒋思雨, 郝刚, 唐善虎, 等. 月桂酰精氨酸乙酯的抑菌活性[J]. 现代食品科技,2022,38(10):109−116. [JIANG S Y, HAO G, TANG S H, et al. Antibacterial activity of ethyl lauroyl arginine ester[J]. Modern Food Science and Technology,2022,38(10):109−116.] JIANG S Y, HAO G, TANG S H, et al . Antibacterial activity of ethyl lauroyl arginine ester[J]. Modern Food Science and Technology,2022 ,38 (10 ):109 −116 .[33] LIU D, PANG W C, DING L J, et al. An insight into the inhibitory activity of dihydromyricetin against Vibrio parahaemolyticus[J]. Food Control,2016,67:25−30. doi: 10.1016/j.foodcont.2016.02.030
[34] WANG G M, FENG H Q, JIN W H, et al. Long-term antibacterial characteristics and cytocompatibility of titania nanotubes loaded with Au nanoparticles without photocatalytic effects[J]. Applied Surface Science,2017,414:230−237. doi: 10.1016/j.apsusc.2017.04.053
[35] ZWOLAK I, WNUK E, ŚWIECA M. Identification of potential artefacts in in vitro measurement of vanadium-induced reactive oxygen species (ROS) production[J]. International Journal of Environmental Research and Public Health,2022,19(22):15214. doi: 10.3390/ijerph192215214
[36] SUGIMOTO M, KO R, GOSHIMA H, et al. Formononetin attenuates H2O2-induced cell death through decreasing ROS level by PI3K/Akt-Nrf2-activated antioxidant gene expression and suppressing MAPK-regulated apoptosis in neuronal SH-SY5Y cells[J]. Neurotoxicology,2021,85:186−200. doi: 10.1016/j.neuro.2021.05.014
[37] LI S, LI Y X, CHEN G W, et al. Restraining reactive oxygen species in Listeria monocytogenes promotes the apoptosis of glial cells[J]. Redox Report,2017,22(4):190−196. doi: 10.1080/13510002.2016.1173327
-
期刊类型引用(0)
其他类型引用(4)





 下载:
下载:

 下载:
下载:



