Research Progress on the Application of Low Eutectic Solvents in Extraction of Plant Polysaccharides
-
摘要: 传统多糖提取使用的有机和无机溶剂,普遍存在提取时间长,溶剂消耗量大、提取效率低和一定的污染问题,探索新型安全溶剂成为多糖提取的热点问题。低共熔溶剂(low eutectic solvent,DES)作为一种新兴绿色溶剂,具有多种传统有机溶剂不具备的溶剂特性,近年来在植物多糖提取领域得到广泛应用。本文综述了DES的组成、主要性质、合成方法及影响其性质的重要因素,同时总结论述了DES在茶多糖、中草药多糖和果皮果胶等植物多糖提取中的应用研究进展。相较于传统的水和酸碱法提取,DES提取条件相对温和且能耗更低,提取的植物多糖具有更高的提取率和纯度,而且多糖的生物活性和生物完整性更好,进一步阐述了DES在植物多糖提取中的应用局限性和潜力,旨在为DES在植物多糖提取相关研究提供思路借鉴和理论参考。Abstract: The traditional organic and inorganic solvents used for polysaccharide extraction generally have long extraction time, large solvent consumption, low extraction efficiency and certain pollution problems, and the exploration of new safe solvents has become a hot issue in polysaccharide extraction. As an emerging green solvent, low eutectic solvent (DES) has a variety of solvent characteristics that traditional organic solvents do not possess, and has been widely used in the field of plant polysaccharide extraction in recent years. In this paper, the composition, main properties, synthesis method and important factors affecting the properties of DES are reviewed, and the progress of the application of DES in the extraction of plant polysaccharides such as tea polysaccharides, herbal polysaccharides and peel pectin are summarized.Compared with traditional water and acid-base extraction, the extraction conditions of DES are relatively mild and the energy consumption is lower. The extracted plant polysaccharides have higher extraction rate and purity, and the biological activity and biocompleteness of polysaccharides are better. The limitations and potentials of DES in plant polysaccharide extraction are further elaborated, aiming to provide ideas and theoretical references for the research related to the extraction of plant polysaccharides by DES.
-
多糖一般是指由10个或者10个以上的单糖通过糖苷键连接而成的大分子物质[1],其广泛存在于人们日常食用的谷物、果蔬、食用菌和中草药中。食源性多糖由于诸多保健和药理功能活性,在近几十年逐渐成为天然产物研究中的热点,现已被应用于食品、饮料、医药和化妆品等领域的研究和应用中[2]。植物资源是人类生存和发展的重要基础,其中食用植物和药用植物是我们日常生活中最重要的植物资源。随着近年来中医药和保健食品的快速发展,大量植物源特别是中草药中活性物质及功效研究更加深入,其中以植物多糖研究最为广泛。现代研究已经证实中草药中的多糖是其重要的功效物质[3],因此通过提取植物中的多糖对其结构及活性进行深入研究,对于中医药的现代化发展及食药同源战略具有重要意义。
传统植物多糖提取主要采用水提法、酸提法和碱提法等,水提法操作简单、成本较低,但提取时间长且提取率较低,酸碱提法常用于含有酸性基团或酸性多糖提取,可以促进多糖溶解、缩短提取时间,不过容易破坏多糖的糖苷键和空间结构。当前基于传统溶剂的辅助提取方法包括酶辅助提取、超声辅助提取、微波辅助提取、亚临界提取和超临界提取等,这些辅助方法使得提取效率显著提升[4],同时也伴随着多糖的降解和更高的提取成本。随着多糖的研究不断深入,高效、安全、绿色的多糖提取方式是其低能耗与高应用价值的重要前提,传统溶剂提取法主要以水、盐酸、硫酸、硝酸、氢氧化钠和乙醇等作为溶剂,通常需要较大的溶剂用量,提取过程容易造成溶剂的浪费且具有一定的安全隐患和环境污染问题。近年来,低共熔溶剂(low eutectic solvent,DES)因其较低的成本、优良的提取效果和可降解性被广泛研究。
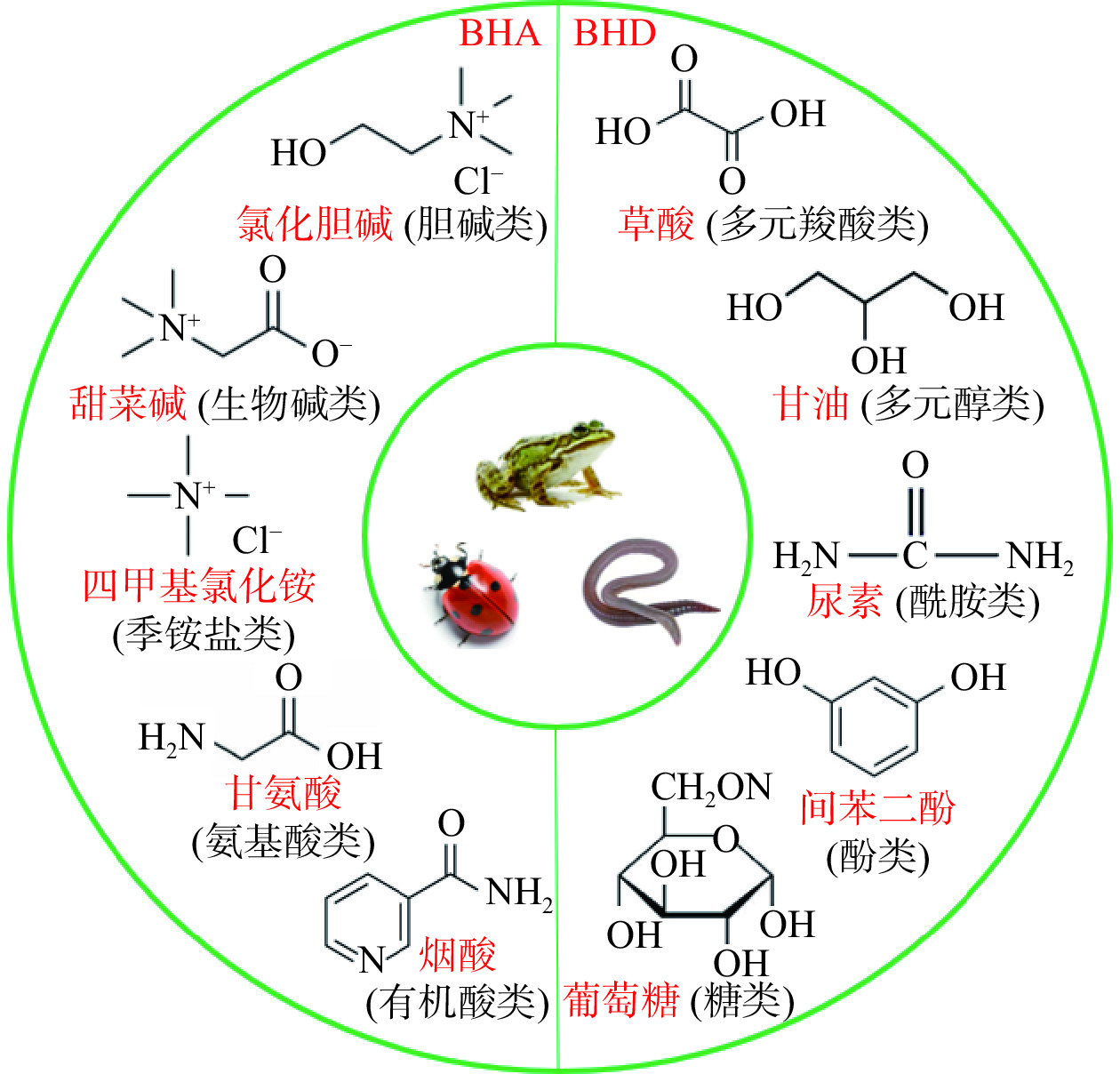
DES是指由一定量的氢键受体(Hydrogen-bonded acceptor,BHA)和氢键供体(Hydrogen bond donor,BHD)按一定比例混合以后经过加热形成更低熔点的粘稠、透明液体,合成以后会形成强大的氢键网络,使多糖的体系溶解度变大并导致DES具有较高的粘度[5],因此在提取过程中往往需要水的介入。2011年首次在一些强耐寒动物(蠕虫、瓢虫、青蛙)体内发现该体系并命名为天然低共熔溶剂(Natural low eutectic solvent, NADES),主要是由糖类、氨基酸、有机酸、酰胺类和胆碱类衍生物组成[6](图1),在多糖提取研究中所使用的基本都是这类DES。相较于传统溶剂,DES的生产成本低、合成方法简单、在提取过程中可以避免因过高的温度和不适的酸碱性对多糖结构和活性产生不利影响;其化学性质稳定且无毒无害易降解,被认为是传统溶剂和离子溶剂(ionic solvent,IL)的优良替代品。DES作为新型绿色溶剂可多次重复提取仍保持稳定的理化性质[7],NADES甚至可以直接作为添加剂或配方加入食品中,因此从食源性多糖的提取效率、产物纯度和安全性方面衡量都是较为理想的溶剂体系,在提取过程中加入一定的辅助条件可以显著提高提取效率,比如超声波、微波和酶辅助等,其中超声波辅助需要的溶剂量少且复现性好,应用最为广泛。不过目前基于DES对多糖的提取工作仅限于实验室研究,难以通过合成大量DES进行工业化提取生产。
本文阐述了DES的组成、合成方法和主要性质特点,探讨了DES性质的主要影响因素,对该法在植物多糖及果胶类物质的提取研究进行了一定的总结,并分析了目前DES应用的一些挑战及解决前景,以期为植物多糖的高效提取提供新的思路和理论基础。
1. 低共熔溶剂概况
DES是由一定摩尔比的氢键受体BHA(如季铵盐)和BHD(如酰胺、有机酸、糖类和多元醇等)组合而成的两组分或多组分混合物,熔点显著低于单个组分的熔点[8]。水本身较强的氢键效应可以作为重要的组成部分[9],氢键相互作用强度会直接影响DES的理化性质和和溶解性。在DES中加入少量水,除了可以增大溶解度、调节pH和粘度外,还具有缩短制备时间、降低制备温度等作用[10]。
加热法是制备DES最简便的方法之一,将配制的DES置于密闭容器在一定温度下加热,直至形成均一透明的溶液或胶体,经干燥后备用[11];研磨法就是将两组分或者多组分置于研钵中,在室温下充分研磨,最终形成澄澈的液体[12];真空蒸发法是将所有组分(粘度较大)都溶解在甲醇或者水溶液中,随后经真空减压蒸发除去溶剂,直至恒重[13];冷冻干燥法是将所有组分用超纯水稀释,达到含水量5wt%左右时,经真空冷冻干燥除去这部分水,获得透明胶体[14]。微波和超声波合成法是将所有组分混合物封装后经微波辐照或超声波处理,然后静置形成均匀稳定的体系,其中冷冻干燥法、蒸发法和研磨法操作简便,超声波和微波辅助合成法快速高效,因为微波辐射会与溶剂体系发生相互作用并引起偶极旋转,HBD和HBA组分发生碰撞产生介电加热,迅速升温显著缩短了合成时间;超声波产生的空化效应能够加速HBD和HBA组分之间的相互反应和溶解[15−16],具体合成操作如图2所示。不过目前制备DES最常用的方法还是加热搅拌,因为它易于操作且成本较低,在合成过程中更容易调节条件,这主要是考虑到一些热不稳定性组分的合成。
2. 低共熔溶剂的性质及其影响因素
2.1 低共熔溶剂的性质
DES与IL相比具有更特殊的性质,主要包括熔点、粘度、pH、毒性和生物降解性,而这些性质大部分可以通过改变溶剂的组分或摩尔比来调节,BHA和BHD之间的氢键相互作用和范德华力是导致熔点降低的主要因素[17],所有DES的熔点都显著低于单一纯组分,其中熔点低于50 ℃的DES因其安全性和低成本被广泛研究应用。有研究发现BHD的链长和摩尔比的上升对熔点影响相对较大,而且体系中的阴离子含量也会对熔点产生显著影响,这是造成胆碱盐类-尿素体系较低熔点的主要原因[18]。
DES纯组分普遍具有较高的粘度,这种高粘度特性是广泛的氢键分布造成的[19],而高粘度则会阻碍流动、影响传质,因此粘度是多糖提取操作中重要的控制因素。使用高纯度的DES直接提取多糖非常困难,而制备低粘度的DES具有严苛的条件,因此需要加入一定量的水或升高温度来降低粘度、增大传质能力,但过少的氢键分布会造成DES的稳定性变差,加入适量无机盐也可以有效降低DES的粘度[20]。此外,DES的酸碱性也是应用中非常重要的控制因素,BHA和BHD本身的酸碱性和比例就决定了DES的酸碱性。Abbott等[21]在氯化胆碱-甘油体系中加入一定量的氯离子后碱性增强,氯化胆碱-尿素体系也具有较强的碱性,而氯化胆碱与马来酸、柠檬酸组成的DES表现为高酸性。Jablonsky等[22]通过对体系pH行为的研究发现,升温时pH表现为线性降低,相较于醇基DES,酸基DES的pH的下降更为明显,进一步证明了BHD对体系的pH有更大影响。
Hayyan等[23]首次提出DES的毒性问题,分别研究了氯化胆碱与尿素、乙二醇、三甘醇和甘氨酸体系对部分细菌和小虾的细胞毒性,发现3种DES对细菌并无毒性,但是对于小虾的毒性高于无机盐和HBD本身,并且毒性在水中有所增强。DES的细胞毒性取决于化学组成、浓度和黏度等因素,研究发现基于氯化胆碱的DES的毒性普遍很低,但是基于一些金属盐物质的DES,对细菌和真菌都有很强的毒性[24]。大多数DES在体内或体外对细菌、真菌、病毒和动物表现出无毒或低毒性,但仍不能认为是绝对的安全体系。此外,DES的生物降解能力主要取决于组分,BHA和BHD本身较强的降解性会造成DES的高降解水平,这使得NADES的生物降解能力普遍高于其他类型的DES。氯化胆碱作为最常用的BHA,在14 d即可降解93%左右[25]。Zhao等[26]通过检测20种不同的以氯化胆碱为BHA的NADES的生物降解值,28 d时氯化胆碱-尿素体系的降解性最好(97.1%),酸基相较于醇基体系的降解性整体较差,加入水的糖基三元溶剂的降解水平可以达到90%以上。Radosevic等[27]研究了以氯化胆碱为HBA,甘油、葡萄糖和草酸为BHD的溶剂毒性和降解能力,结果得到当HBD为甘油和草酸时,最高和最低降解水平分别为96%和68%,而且毒性与降解性之间有很好的相关性。表明通过对DES的合理选择和设计,在得到所需溶剂的良好性质以外,还可以控制溶剂更好的毒理学水平。
2.2 低共熔溶剂性质的影响因素
2.2.1 含水量
大多数低DES是吸湿性混合物,很难实现完全干燥,在向DES中添加水时,应考虑水的双重作用,因为水可以同时与HBD和HBA相互作用形成更多氢键,而含水量过多会迅速削弱体系的氢键作用[28]。Hammond等[29]通过对氯化胆碱-尿素体系的水合物进行了微观表征,发现在较低含水量(42wt%)时,DES的整体氢键作用有所增强,结构更稳定;而含水量较高(83wt%)时,DES结构被破坏,取而代之的是水-水和DES-水相互作用,氢键作用急剧降低,溶剂变成了多组分的水溶液。Gabriele等[30]研究了3种醇基DES加入水后的理化性质,得到少量的水可以降低粘度、增强导电性和极性,采用傅里叶红外光谱和核磁共振法研究了水对DES纳米结构的影响,结果得到DES的两个组分之间存在较强的氢键相互作用,加水至50wt%左右,这种相互作用逐渐减弱,随后的水添加导致这种相互作用将近消失,直到含水量达到75wt%左右完全消失。
DES中氢键作用的减弱就会使粘度降低,从而改善提取时的物质流动状况,这会很大程度上提高溶剂的应用价值,在一定范围内,提取率与含水量成正比[31]。Dai等[10]研究了氯化胆碱-葡萄糖(摩尔比5:2)体系,其粘度在含水量为5wt%时下降到纯溶剂的1/3,添加10wt%的水以后,粘度降到原来的1/10。还有研究发现,氯化胆碱-尿素体系在30 ℃条件下加入10wt%的水可以使粘度降低80%以上,水含量的增加导致DES分子可以自由移动,流动性和扩散性都会增加;同时发现水的加入使得尿素-尿素、尿素-氯化胆碱的相互作用力明显下降[32],而且当尿素基DES吸收空气中的水分以后(5.5wt%),其熔点降低了15 ℃以上[33],说明水会一定程度降低DES的熔点,所以在DES合成和应用时要考虑含水量对熔点的影响。
2.2.2 温度
温度主要影响DES的粘度,随着温度的升高,DES的粘度随着剪切速率的增加而降低,因为DES在较高温度下具有较低的分子间作用力和膨胀、剪切效应,这对DES的整体结构有一定破环作用,也使DES的体系粘度趋向收敛于BHD纯组分粘度[34]。Dai等[10]进一步考察了葡萄糖、氯化胆碱和水(摩尔比为2:5:5)在20~60 ℃范围内制备的NADES的粘度变化,当温度升高到原来的两倍时,粘度降低到原来的1/3。还有研究发现当温度从30 ℃升高到90 ℃时,氯化胆碱-木糖(摩尔比为1:1)体系的粘度从100 Pa·s降低到0.5 Pa·s[35],而这种粘度变化对于活性物质的提取是更为有利的,表明DES在较宽的温度范围内仍能保持较强的稳定性,这一优良性质使DES的应用价值及潜能显著提高。
3. 低共熔溶剂在植物多糖提取中的应用研究进展
3.1 在茶多糖提取中的研究
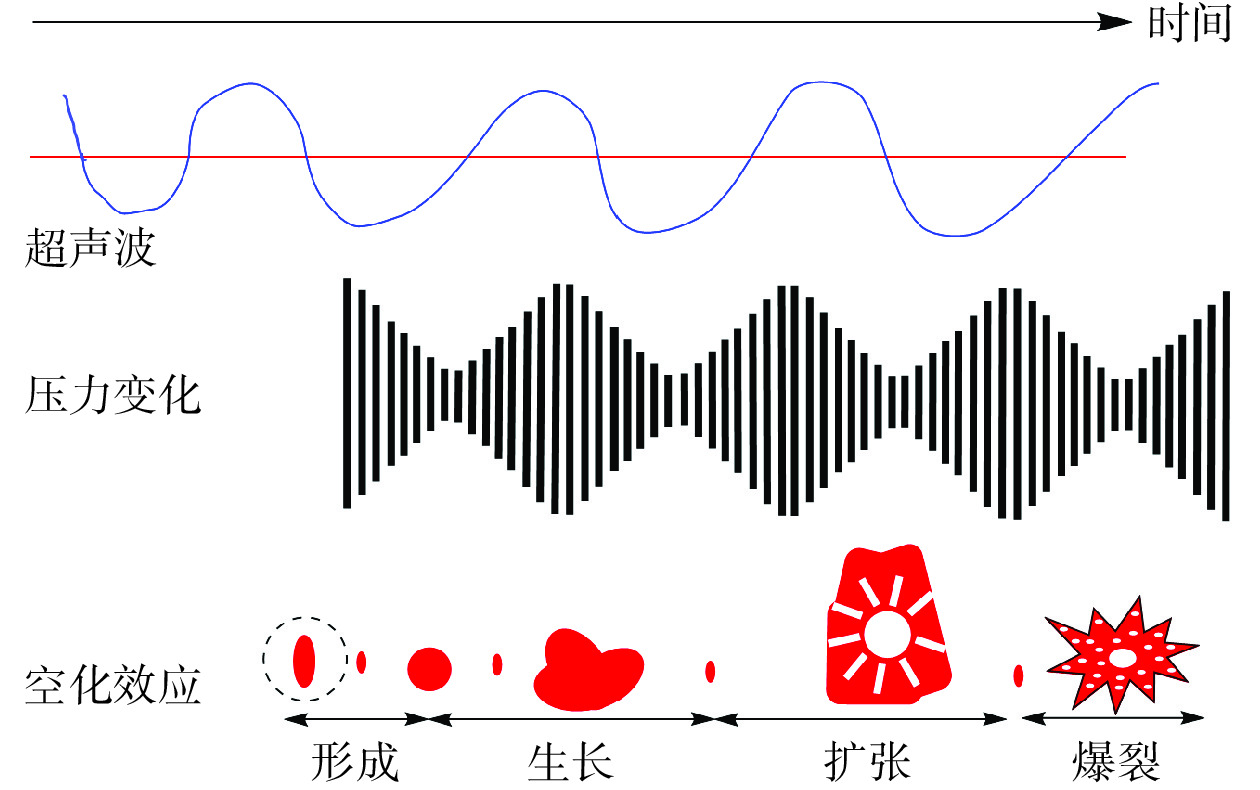
茶多糖是一种酸性糖蛋白,是一类蛋白质和多酚结合的具有生物活性的复合多糖,具有抗氧化和抗炎等活性。一般可以从茶的叶片、花和果实中提取得到,一般较为粗老茶叶中的多糖含量相对较高[36]。目前基于DES对茶多糖的提取研究较少,Xia等[37]将氯化胆碱分别与乙二醇、己二醇和1,4-丁二醇按摩尔比为1:2、1:2、1:4制得3种DES提取安吉白茶中的多糖,经超声辅助提取得到氯化胆碱-1,6-己二醇体系提取率最高(19.18%)且抗氧化活性最好,比水提多糖表现更好的α-葡萄糖苷酶抑制力和降血糖活性,碳水化合物含量更高(72.67%)但分子量更低,这是由超声波诱导多糖分子气泡的形成和破裂产生的空化效应所致[38](图3)。不同的超声波频率、时间对于多糖的结构与活性的影响也并不相同,超声波对多糖的结构具有一定的破坏作用,但超声波处理一般能够显著提高多糖的提取效率。黄秀红等[39]以氯化胆碱和甜菜碱作为BHA制备了6种DES提取乌龙茶多糖,其中甜菜碱-1,3丁二醇体系的提取效果更好,与传统水提法相比,DES提取的多糖得率、DPPH自由基和羟基自由基清除能力分别提高了20.22%、53.79%和32.65%,这对提高乌龙茶多糖的提取效率和抗氧化活性具有重要意义。
3.2 在中草药多糖提取中的研究
中草药是我国体系的重要组成部分,具有悠久的历史和广泛的应用,现代医学研究表明,中草药的诸多药用功能都源于其中的天然活性成分,而多糖就是重要成分之一,因此安全高效的多糖提取方法是其药理作用研究的必要手段。铁皮石斛在我国具有很长的药用历史,具有提高免疫、增强体质、改善心血管疾病和降糖降脂等功效,多糖是铁皮石斛的主要活性成分,《中国药典》规定铁皮石斛多糖含量不得低于25%,多糖含量越高则石斛的质量越好[40]。梁静[41]使用19种DES加入复合酶(纤维素酶和果胶酶)提取铁皮石斛多糖发现,氯化胆碱-丙三醇体系提取率最高(42%),提取效果好于不加酶的纯DES提取和传统热水提取法,所得粗多糖的纯度高达96.78%,这主要是由于酶对细胞壁的破坏作用促进了多糖的溶出,而有机强酸基DES的提取效果并不理想,因为强酸会加速多糖的水解[42]。糖类物质也是DES制备常用的BHD,有研究以紫皮石斛粉末中的多糖本身作为BHD,选择左旋肉碱作为BHA,基于低共熔溶剂系统(Low eutectic solvent system,DESys)结合化学机械法提取(chemical-mechanical extraction,MCE),在保留多糖理化性质的同时,DESys-MCE的提取效率显著优于传统提取方法,且不需要提前合成DES[43],简化了多糖的提取和分离过程。先前的研究也证明DESys比传统DES提取更有效,而且提取时间很短,这会显著降低提取过程中的能耗[44]。
黄精是百合科黄精属草本植物的干燥根茎,其味甘性平,具有健脾润肺和补肾益气等功效,包括黄精在内的多种百合科黄精属植物都属于传统药食同源性中药材。唐兰芳[45]筛选了氯化胆碱-1,4-丁二醇体系作为黄精多糖提取溶剂,提取率约为水提法的4倍,并且DES提取多糖的ABTS+、DPPH自由基清除能力、Fe3+还原能力、氧自由基吸收能力和抗糖基化能力均显著高于水提黄精多糖,氯化胆碱-尿素型DES提取得到的黄精多糖也得到相同的性质且与质量浓度呈量效关系[46],该型DES在重复提取第3次时提取率最高,较新鲜溶剂提高了83.9%,而且黄精多糖含量随重复次数增加呈先增加后趋于稳定,重复提取4~5次后多糖含量基本稳定,进一步结合超声酶解(纤维素和果胶酶)法提取柴胡多糖的研究也有类似发现[47],这是由于重复提取后DES的物理状态改变,比新鲜DES的流动性更强,对多糖分子的充分溶出与传质是更有利。
研究表明多糖的抗氧化和生物活性一般与提取条件、分子量大小和单糖组成有关[48]。刘旭等[49]进一步研究了不同温度条件下氯化胆碱-尿素型DES提取得到的黄精多糖的相对分子量和单糖组成等基本性质和体外抗氧化活性之间的关系,结果表明,相比于传统水提醇沉法,70 ℃时多糖得率最高为18%,提高了36%,相对分子量变小且半乳糖含量升高;提取的多糖相对分子量更小,且主要成分为葡萄糖,DES在70 ℃条件下提取的黄精多糖体外抗氧化能力明显高于传统水提醇沉法(4.3倍)和DES在100 ℃条件下(7.4倍)提取的黄精多糖,这可能与70 ℃条件下DES-多糖体系中较强的氢键效应和更低的分子量水平有关。尿素基DES提取得到玉竹(百合科黄精属)多糖的提取率达到29.03%,是热水浸提法的4.67倍[50],对糖基化终末产物(advanced glycation end products,AGEs)相对抑制率达到87.63%,AGEs的体内积累是引发糖尿病和其他慢性疾病的重要因素[51],从而揭示了该多糖在新型降糖保健食品的开发方面的应用潜力。酚酸和多糖是百合属植物中的主要活性物质,因其抗氧化活性和潜在的保健功效受到关注,Chen等[52]采用氯化胆碱-乙二醇型DES提取了卷丹百合(百合科)中多糖和酚酸类物质,实现了同时高效提取两种活性物质且提取时间显著变短,这种快速有效的提取方法有利于中草药主要成分的测定和质量评价,而乙二醇基DES对于千斤拨多糖的提取效果较差,1,3丁二醇基体系的提取效果更好,这主要是其内部空间位阻更小且醇基分支少,极性分布更适合于千斤拔多糖的溶解[53]。
近年来的深入研究表明多糖类物质是肠道微生物的有效调节因子,在保护宿主肠道微生态稳态中发挥关键作用,多糖可以通过增加肠道中的有益菌和减少有害菌来调节肠道菌群组成,改善菌群结构,参与肠道菌群的各种相互作用[54]。冯康琳[55]采用氯化胆碱-乙二醇型DES提取得到了荷叶多糖,多糖在体外粪便发酵过程中被肠道微生物降解和利用,显著增加了拟杆菌属、双歧杆菌属、巨单胞菌属和柯林斯氏菌属等有益菌的相对丰度,并显著降低了变形菌门和梭杆菌门等有害菌的相对丰度,同时荷叶多糖能够显著促进短链脂肪酸的产生,表明该型荷叶多糖可以有效调节肠道菌群,可作为促进肠道健康的潜在益生元,还有研究分别采用水提法、中温碱提法、DES提取法和高压均质辅助双酶法提取荷叶多糖发现,氯化胆碱-丙二醇体系提取率最高且与水提法相近,尿素基DES的提取率显著低于其他方法,但是,水提法和尿素基DES提取的多糖具有更好的益生元活性[56]。此外,经DES复合酶(纤维素酶、果胶酶、木瓜蛋白酶)辅助提取得到枸杞子多糖对DPPH自由基和羟基自由基有一定的清除能力,抑菌活性表明该多糖可以抑制大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的生长,特别是对大肠杆菌的抑制效果最好,表现为高敏感度[57],这为枸杞子在保健、药品领域的应用奠定了基础。
除此之外,研究发现,采用氯化胆碱-尿素体系提取结合分级醇沉法得到淮山多糖的提取率是水提法的5.11倍,该法对多糖的抗氧化活性有一定弱化作用,但是对抑制α-淀粉酶和抗糖基化能力有一定增强作用[58],相同的DES提取红枣多糖也能够显著提高提取率(2.46倍)[59],不过对恰玛古多糖的提取率比水提法虽有所上升,但是提取效果不如碱提法和超声辅助提取法,可能是BHD摩尔比太低导致体系氢键效应相对较低所致,尿素基DES提取的恰玛古多糖主要在铁离子螯合力和α-淀粉酶抑制方面有更好的作用效果[60]。孙悦等[61]研究发现,尿素和甘油基DES对甘草多糖的提取效果较差,异丙醇基DES的提取效果更好,这可能是异丙醇分子更小的空间位阻所致。值得一提的是,在他们关于鹰嘴豆活性物质提取研究中发现,氯化胆碱-柠檬酸体系既可以高效提取其中的多糖,也可以提取黄酮类物质,多糖和黄酮提取率分别为8.31%和2.49%[62]。还有研究发现氯化胆碱-乙二醇型DES可以同时提取得到五味子中的多糖和精油[63],这表明相同的DES改变提取条件就可以高效提取不同样本中的多糖或者相同样本中不同的目标物质。不过,关于DES对于不同天然产物都具有良好溶解性和提取选择性的内在机理并不明确。
尽管DES在多糖提取方面具有良好的应用前景,但其不易挥发性也给多糖与溶剂的回收带来困难,新兴的可切换DES可能具有解决这一难题的潜力,可切换DES就是可以通过改变外界条件(温度、pH和CO2等)实现亲疏水性的转变,控制提取过程为均相,提取结束以后为两相(水相和富含DES组分),从而实现多糖的提取分离和溶剂的回收利用[64−65],其中关于温度切换型DES(temperature-switchable DES,TS-DES)的研究相对较多,Tang等[66]从12中TS-DES中筛选得到丁卡因-月桂酸体系为提取枸杞多糖的最佳体系,最大提取率为465 mg/g,重复提取5次以后提取率保持在430 mg/g以上,而且重复提取后DES回收率达到80.5%。具体的茶和中草药多糖提取的DES组成及工艺参数如表1所示。
表 1 DES在茶和中草药多糖提取中的应用及工艺Table 1. Application and technology of DES in the extraction of polysaccharides from tea and Chinese herbs茶/药材 DES组成 摩尔比 辅助方法 工艺 参考 安吉白茶 氯化胆碱-1,6-己二醇 1:2 超声波 料液比1:30、含水量30%、提取温度25 ℃
提取时间40 min、提取率19.18%[36] 乌龙茶 甜菜碱-1,3-丁二醇 1:4 − 料液比 1:20、含水量 84 %、提取温度 61 ℃
提取时间80 min、提取率6.91%[39] 铁皮石斛 氯化胆碱-丙三醇 1:2 复合酶 料液比1:30、提取温度55 ℃、提取时间2 h
酶浓度6mg/mL、提取率44.63%[42] 紫皮石斛 左旋肉碱-石斛 − MCE 料液比0.16:1、含水量40%、左旋肉碱(0.003 moL/g)
振速4 m/s、提取时间80 s、提取率61.1%[43] 黄精 氯化胆碱-1,4丁二醇 1:4 − 料液比1:40、含水量 32%、提取温度 89 ℃
提取时间为 48 min、提取率33.81%[45] 氯化胆碱-尿素 1.2:1 − 料液比1:20、提取温度70 ℃、提取时间42 min
提取率18.5%[46] 氯化胆碱-草酸 1:1 − 料液比1:20、提取温度70 ℃、提取时间40 min
提取率18%[49] 玉竹 氯化胆碱-尿素 1:3 − 料液比 1:30、含 水 量 20%、提取温度 92 ℃
提取时间 41 min、提取率29.03%[50] 柴胡 氯化胆碱-尿素 3:1 超声波
复合酶料液比1:30、含水量20%、提取温度25 ℃、提取时间1 h
加酶量2.63%、pH4.89、超声功率200 W
提取率10.10%[47] 卷丹百合 氯化胆碱-乙二醇 1:2 − 料液比1:25、含水量20%、提取温度50 ℃
提取时间40 min、提取率31.51%[52] 千斤拔 氯化胆碱-1,3丁二醇 1:2 超声波 料液比1:10、含水量10%、提取温度70 ℃
提取温度40 min、提取率2.47%[53] 荷叶 氯化胆碱-乙二醇 1:3 − 料液比 1:30、含水 量 60%、提取温度 92 ℃
提取时间 126 min、提取率5.38%[55] 氯化胆碱-尿素 1:2 − 料液比1:30、提取温度90 ℃、提取时间2 h
提取率0.99%[56] 枸杞子 氯化胆碱-乙二醇 1:3 复合酶
微波料液比1:50、酶含量1.37%、微波功率550 W
酶解温度47 ℃、辐照时间6 min、酶解时间2.5 h
提取率6.45%[57] 丁卡因-月桂酸 1:1 − 料液比1:25、含水量 30%,提取温度35 ℃
提取时间70 min、提取率46.5%[66] 淮山 氯化胆碱-尿素 1:5 − 料液比1:40、含水量20%、提取温度 90 ℃
提取时间 40 min、提取率11.33%[58] 红枣 氯化胆碱-尿素 1:2 超声波 料液比 1:10、含水量 20%、提取温度 40 ℃
提取时间 30 min、提取率8.33%[59] 恰玛古 氯化胆碱-尿素 1:1.5 超声波 料液比1:20、含水量40%、提取温度40 ℃
提取时间30 min、提取率3.73%[60] 甘草 氯化胆碱-异丙醇 1:3 超声波 料液比 1:50、含水量40%、提取温度40 ℃
超声功率 250 W、提取时间 30 min
提取率8.31%[61] 鹰嘴豆 氯化胆碱-柠檬酸 3:1 微波 料液比1:15、含水量 20%、微波功率750 W
提取时间 2.5 min、提取率8.31%[62] 五味子 氯化胆碱-乙二醇 1:3 超声波
微波料液比1:30、含水量30%、超声功率550 W
微波功率250 W、超声提取时间40 min
微波提取时间20 min 、提取率8.56%[63] 注:表中料液比单位为g/mL;含酶量和含水量为质量百分含量。 3.3 在果胶提取中的应用
果胶是一种广泛存在于水果和蔬菜中的多糖,其组成有同质多糖和杂多糖两种类型,是植物细胞壁的重要组成部分,常作为酸性饮料的凝胶剂、增稠剂或稳定剂,除此之外,果胶可以调节肠道菌群的组成和多样性、预防动脉粥样硬化并抑制饮食诱导的肥胖[67]。果胶的理化性质和健康功能主要取决于其复杂的结构特征,其中水果皮层是植物果胶的重要来源之一。Chen等[68]筛选出甜菜碱-柠檬酸和氯化胆碱-苹果酸体系,用于提取芒果皮果胶,果胶提取率分别为27.62%和30.01%,显著高于盐酸提取法(13.17%),高强度超声功率提高了低酯果胶的得率,但降低了提取果胶的分子量和粒径,这是由于超声空化作用能够打破果胶多糖的糖苷键,从而产生更多低分子量的果胶[69]。而盐酸提取的果胶比两种DES提取的果胶或商业果胶具有更高的粘度特性,这有助于研究者掌握提取条件与所提果胶理化性质之间潜在联系,从而根据不同的应用要求选择合适的提取方法。
DES提取体系合成组分虽然具有广泛的选择性,但是只有极少部分经合成以后具有优良的提取效果,部分体系的提取效果也差于传统提取法,不同体系提取产物的理化性质也有一定的差异,因此在DES的设计与合成时需要考虑组分本身与实验条件对果胶提取过程的影响。El-gharbawy等[70]研究了超声辅助DES在提取柚子皮中的果胶得率和酯化度(DE,degree of esterification)的影响,结果表明,氯化胆碱-丙二酸和氯化胆碱-葡萄糖-水为最佳提取体系,两种DES的果胶得率均为94%左右,DE均值为52%,与糖基DES相比,酸基DES提取的果胶结构形貌更光滑,丙二酸体系提取的果胶在产量和结构方面比葡萄糖基DES更稳定,另有一些研究使用氯化胆碱-丙二酸体系高效提取了生育酚和花色苷类物质[71−72],表明该体系不仅可以高效提取果胶,也是其他各类活性物质提取的良好溶剂。Liew等[73]采用檬酸法和乳酸-葡萄糖-水型DES分别提取柚子皮果胶发现,DES提取的果胶得率最高为23.04%,而柠檬酸提取的得率达到了39.72%,柠檬酸提取的提取效果显著优于DES提取法,这是由于乳酸相对较弱的酸性和过量的水稀释削弱了体系氢键相互作用。研究发现,高温(≥80 ℃)相关酸性介质(pH接近2)有利于打破果胶所在细胞壁所需的水解条件,从而促进果胶的溶出与传质[74],因此在提取植物果胶时,DES的设计应该选取酸性较强的有机酸且考虑提取温度对体系pH的影响。
有研究比较了几种酸(有机和无机)在90 ℃下提取90 min的甜瓜果皮果胶提取率,得到果胶在羧酸中的提取是更有利的,其中柠檬酸最适合甜瓜果皮果胶的提取[75]。Benvenutti等[72]利用柠檬酸-葡萄糖-水体系提取了嘉宝果果皮中的果胶,发现该型DES合成时间较短(50 min),具有较低的pH(1.01)和粘度(298 K时为0.159 Pa·s),最高提取率为27.3%,比传统柠檬酸提取(9.7%)高出3倍,进一步结合亚临界水提取法提取,在水中加入DES作为提取改性剂,可以在更短的时间内实现更好的提取效果,这主要是在高压条件下DES粘度的降低,促进体系传质导致的,提取率比传统水提法高1.5~1.8倍,所得果胶的抗氧化能力和乳化稳定性都更强[76],说明具有低pH的柠檬酸型DES是提取果胶的良好溶剂,这也揭示了氯化胆碱-羧酸型DES在果胶提取方面的潜力。
一般DES的组分和摩尔比不仅会影响果胶提取率,而且改变果胶的一些理化性质和生物活性。Shafie等[77]以不同摩尔比的氯化胆碱-柠檬酸体系提取了木胡瓜中的果胶,最大得率为14.44%,达到最高得率长达2.5 h,这是由于DES溶液进入木胡瓜皮粉末中,逐步破坏细胞壁且溶解果胶,再从细胞壁扩散出来需要一定时间,体系的温度、pH和粘度都会影响这一过程,提取得到的木胡瓜多糖是一种高纯度的酸性杂多糖,表现出良好的持水性(3.70 g/g),持油性(2.40 g/g)和起泡性(133.33%),可作为一种新的天然药理聚合物或潜在的功能性食品成分,进一步研究发现,不同摩尔比的DES提取得到了不同分子支链结构的木胡瓜果胶,不同的多糖结构由于位阻效应影响了其溶解性、理化性质和功能特性,特别是增加DES中一水合柠檬酸的摩尔比时,多糖的酸性和总酚含量有所增加,而这与多糖的抗氧化活性密切相关[78]。具体的果胶提取的DES组成及工艺参数如表2所示。
表 2 DES在植物果胶提取中的应用及工艺Table 2. Application and technology of DES in plant pectin extraction样本 DES组成 摩尔比 辅助方法 最佳工艺/工艺 参考 芒果皮 甜菜碱-柠檬酸 1:2 超声波 料液比1:27、pH0.85、含水量70%
提取温度80 ℃、提取时间90 min
提取率27.62%[68] 氯化胆碱-苹果酸 料液比1:27、pH0.4、含水量70%
提取温度85 ℃、提取时间120 min
提取率30.01%柚子皮 氯化胆碱-丙二酸
氯化胆碱-葡萄糖-水1:1
2:5:2超声波 料液比1:40、pH<3.0、含水量 80%
提取温度80 ℃、提取时间60 min
提取率96.37%和71.49%[70] 乳酸-葡萄糖-水 6:1:6 − 料液比1:30、pH1.80、含水量13%
提取温度88 ℃、提取时间2.3 h
提取率23.04%[73] 嘉宝果皮 柠檬酸-葡萄糖-水 1:1:3 − 料液比1:30 、含水量80%、
提取温度80 ℃、提取时间2.5 h
提取率27.3%[72] 亚临界水 DES 含量8%、含水量92%
提取温度122 ℃、流速2 mL/min
提取率19.4%[76] 木胡瓜皮 氯化胆碱-水合
柠檬酸1:1 − DES含量3.74%、含水量96.26%
提取温度80 ℃、提取时间2.5 h
提取率14.70%[77] 注:料液比单位为g/mL;含水量和DES含量为质量百分含量。 4. 低共熔溶剂提取植物多糖的局限性
在大多数研究中,DES提取法的提取率均显著高于传统方法,这主要是由于已经开发了一系列成熟DES体系并优化了提取条件参数。在制备的DES体系中,只有少数具有较高的提取效率,而多数DES提取效果差的主要原因就是高粘度,目前,降低DES黏度的方法主要有两种,一是通过加入水、调节温度,虽然温度和含水量增加对粘度的改善作用显著,但是对氢键作用的削弱也非常明显,调节合适的含水量及温度来降低粘度需要大量的实验验证;二是开发低黏度体系,对DES的组分要求很高,需要考虑离子尺寸及空腔大小进行设计[79],开发难度大,但仍是新型DES潜力较大的研究方向。
当前基于DES提取多糖的提取效果研究很多,但针对于特异性提取研究很少,提取样本中的物质较多,无法明确是对多糖的特异性提取,比如前文中提到,氯化胆碱-尿素型DES对黄精、玉竹和淮山等的多糖都有很好的提取效果,而氯化胆碱-丙二酸体系不仅可以提取多糖和果胶,也可以提取得到生育酚和花色苷类物质,即相同的DES在不同的条件下可以提取得到不同样本中的多糖或其他活性物质,因此采用DES提取得到的多糖性质与提取条件关系密切,不同提取条件对于目标多糖的影响并不明确,通过DES对多糖的选择性提取还需要做大量研究。而且,DES的不易挥发性使其难以通过直接蒸发回收再利用,溶剂反向萃取、大孔树脂吸附和膜透析等方法虽然可以有效回收,但这使得提取后续操作更加复杂,提取成本也更高[80−81]。加大可切换溶剂的开发可能是解决这一难题的主要研究方向与突破口。
DES是具有可再生、廉价和绿色的可“设计”溶剂,这归因于它们良好的降解性、环境友好性和低毒或无毒性。前文中提到一些研究表明常用DES在细胞、真菌和动物(小虾)学水平都表现为无毒或低毒,但也有研究发现,氯化胆碱-尿素型DES对水螅的毒性强于单个组分[82]。因此DES的安全性还需要进一步的毒理学研究和更多动物实验,从而避免多糖提取过程中DES的残留可能对多糖品质和人体健康产生不利影响。
5. 结论与展望
近年来,DES在植物多糖提取领域得到广泛应用。DES具有环保、高效和易降解等优点,能够有效提高植物多糖的提取率和纯度,而且其良好的生物相容性和相对温和的提取条件可以显著提高多糖的溶解度和稳定性,与传统提取法相比,DES提取的植物多糖具有更好的生物活性和功能特性。DES也更加符合绿色提取的要求,其理化性质(极性、熔点、溶解度、密度、电导率和粘度等)具有较高的可调性,可以通过改变组分及摩尔比实现,具有更好的设计性的灵活性,未来可以利用分子模拟技术设计得到具有优良理化性质和选择性的DES应用于多糖的提取。此外,DES可以重复提取多次仍保持良好的提取效果,所以溶剂的回收再利用是非常必要的,可切换型DES的研究开发或是有效途径之一。值得一提的是,虽然DES普遍认为是安全的,但毒性评估显示,它们比其单个组分具有更高毒性的案例也存在,因此,对于DES的毒性和生物降解性的评估,特别是DES对生物体的影响,需要做更全面细胞学和动物学研究,以确定通过DES提取的植物多糖是否可以直接用于食品和医药领域,继续加大DES在多糖提取中的内在机理研究,探索其应用于工业生产的可能性,为植物多糖高效提取利用提供新的思路和理论依据。
-
表 1 DES在茶和中草药多糖提取中的应用及工艺
Table 1 Application and technology of DES in the extraction of polysaccharides from tea and Chinese herbs
茶/药材 DES组成 摩尔比 辅助方法 工艺 参考 安吉白茶 氯化胆碱-1,6-己二醇 1:2 超声波 料液比1:30、含水量30%、提取温度25 ℃
提取时间40 min、提取率19.18%[36] 乌龙茶 甜菜碱-1,3-丁二醇 1:4 − 料液比 1:20、含水量 84 %、提取温度 61 ℃
提取时间80 min、提取率6.91%[39] 铁皮石斛 氯化胆碱-丙三醇 1:2 复合酶 料液比1:30、提取温度55 ℃、提取时间2 h
酶浓度6mg/mL、提取率44.63%[42] 紫皮石斛 左旋肉碱-石斛 − MCE 料液比0.16:1、含水量40%、左旋肉碱(0.003 moL/g)
振速4 m/s、提取时间80 s、提取率61.1%[43] 黄精 氯化胆碱-1,4丁二醇 1:4 − 料液比1:40、含水量 32%、提取温度 89 ℃
提取时间为 48 min、提取率33.81%[45] 氯化胆碱-尿素 1.2:1 − 料液比1:20、提取温度70 ℃、提取时间42 min
提取率18.5%[46] 氯化胆碱-草酸 1:1 − 料液比1:20、提取温度70 ℃、提取时间40 min
提取率18%[49] 玉竹 氯化胆碱-尿素 1:3 − 料液比 1:30、含 水 量 20%、提取温度 92 ℃
提取时间 41 min、提取率29.03%[50] 柴胡 氯化胆碱-尿素 3:1 超声波
复合酶料液比1:30、含水量20%、提取温度25 ℃、提取时间1 h
加酶量2.63%、pH4.89、超声功率200 W
提取率10.10%[47] 卷丹百合 氯化胆碱-乙二醇 1:2 − 料液比1:25、含水量20%、提取温度50 ℃
提取时间40 min、提取率31.51%[52] 千斤拔 氯化胆碱-1,3丁二醇 1:2 超声波 料液比1:10、含水量10%、提取温度70 ℃
提取温度40 min、提取率2.47%[53] 荷叶 氯化胆碱-乙二醇 1:3 − 料液比 1:30、含水 量 60%、提取温度 92 ℃
提取时间 126 min、提取率5.38%[55] 氯化胆碱-尿素 1:2 − 料液比1:30、提取温度90 ℃、提取时间2 h
提取率0.99%[56] 枸杞子 氯化胆碱-乙二醇 1:3 复合酶
微波料液比1:50、酶含量1.37%、微波功率550 W
酶解温度47 ℃、辐照时间6 min、酶解时间2.5 h
提取率6.45%[57] 丁卡因-月桂酸 1:1 − 料液比1:25、含水量 30%,提取温度35 ℃
提取时间70 min、提取率46.5%[66] 淮山 氯化胆碱-尿素 1:5 − 料液比1:40、含水量20%、提取温度 90 ℃
提取时间 40 min、提取率11.33%[58] 红枣 氯化胆碱-尿素 1:2 超声波 料液比 1:10、含水量 20%、提取温度 40 ℃
提取时间 30 min、提取率8.33%[59] 恰玛古 氯化胆碱-尿素 1:1.5 超声波 料液比1:20、含水量40%、提取温度40 ℃
提取时间30 min、提取率3.73%[60] 甘草 氯化胆碱-异丙醇 1:3 超声波 料液比 1:50、含水量40%、提取温度40 ℃
超声功率 250 W、提取时间 30 min
提取率8.31%[61] 鹰嘴豆 氯化胆碱-柠檬酸 3:1 微波 料液比1:15、含水量 20%、微波功率750 W
提取时间 2.5 min、提取率8.31%[62] 五味子 氯化胆碱-乙二醇 1:3 超声波
微波料液比1:30、含水量30%、超声功率550 W
微波功率250 W、超声提取时间40 min
微波提取时间20 min 、提取率8.56%[63] 注:表中料液比单位为g/mL;含酶量和含水量为质量百分含量。 表 2 DES在植物果胶提取中的应用及工艺
Table 2 Application and technology of DES in plant pectin extraction
样本 DES组成 摩尔比 辅助方法 最佳工艺/工艺 参考 芒果皮 甜菜碱-柠檬酸 1:2 超声波 料液比1:27、pH0.85、含水量70%
提取温度80 ℃、提取时间90 min
提取率27.62%[68] 氯化胆碱-苹果酸 料液比1:27、pH0.4、含水量70%
提取温度85 ℃、提取时间120 min
提取率30.01%柚子皮 氯化胆碱-丙二酸
氯化胆碱-葡萄糖-水1:1
2:5:2超声波 料液比1:40、pH<3.0、含水量 80%
提取温度80 ℃、提取时间60 min
提取率96.37%和71.49%[70] 乳酸-葡萄糖-水 6:1:6 − 料液比1:30、pH1.80、含水量13%
提取温度88 ℃、提取时间2.3 h
提取率23.04%[73] 嘉宝果皮 柠檬酸-葡萄糖-水 1:1:3 − 料液比1:30 、含水量80%、
提取温度80 ℃、提取时间2.5 h
提取率27.3%[72] 亚临界水 DES 含量8%、含水量92%
提取温度122 ℃、流速2 mL/min
提取率19.4%[76] 木胡瓜皮 氯化胆碱-水合
柠檬酸1:1 − DES含量3.74%、含水量96.26%
提取温度80 ℃、提取时间2.5 h
提取率14.70%[77] 注:料液比单位为g/mL;含水量和DES含量为质量百分含量。 -
[1] TANG W, LIU D, YIN J Y, et al. Consecutive and progressive purification of food-derived natural polysaccharide:Based on material, extraction process and crude polysaccharide[J]. Trends in Food Science & Technology,2020,99:76−87.
[2] XUE H K, WANG W L, BIAN J Y, et al. Recent advances in medicinal and edible homologous polysaccharides:Extraction, purification, structure, modification, and biological activities[J]. International Journal of Biological Macromolecules,2022,222:1110−1126. doi: 10.1016/j.ijbiomac.2022.09.227
[3] ZENG P J, LI J, CHEN Y L, et al. The structures and biological functions of polysaccharides from traditional Chinese herbs[J]. Progress in Molecular Biology and Translational Science,2019,163:423−444.
[4] WANG W L, TAN J Q, NIMA L M, et al. Polysaccharides from fungi:A review on their extraction, purification, structural features, and biological activities[J]. Food Chemistry: X,2022,15:100414. doi: 10.1016/j.fochx.2022.100414
[5] HANSEN B B, SPITTLE S, CHEN B, et al. Deep eutectic solvents:A review of fundamentals and applications[J]. Chemical Reviews,2020,121(3):1232−1285.
[6] CHOI Y H, SPRONSEN J V, DAI Y, et al. Are natural deep eutectic solvents the missing link in understanding cellular metabolism and physiology?[J]. Plant Physiology,2011,156(4):1701−1705. doi: 10.1104/pp.111.178426
[7] ZHANG W, CHENG S, ZHAI X, et al. Green and efficient extraction of polysaccharides from Poria cocos F. A. Wolf by deep eutectic solvent[J]. Natural Product Communications, 2020, 15(2):54−56.
[8] OMAR K A, SADEGHI R. Physicochemical properties of deep eutectic solvents:A review[J]. Journal of Molecular Liquids,2022,360:119524. doi: 10.1016/j.molliq.2022.119524
[9] DUAN L, DOU L L, GUO L, et al. Comprehensive evaluation of deep eutectic solvents in extraction of bioactive natural products[J]. ACS Sustainable Chemistry & Engineering,2016,4(4):2405−2411.
[10] DAI Y, VAN SPRONSEN J, WITKAMP G J, et al. Natural deep eutectic solvents as new potential media for green technology[J]. Analytica Chimica Acta,2013,766:61−68. doi: 10.1016/j.aca.2012.12.019
[11] KURTULBAS E, PEKEL A G, BILGIN M, et al. Citric acid-based deep eutectic solvent for the anthocyanin recovery from Hibiscus sabdariffa through microwave-assisted extraction[J]. Biomass Conversion and Biorefinery, 2020:1−10.
[12] FLORINDO C, OLIVERIRA F S, REBELO L P N, et al. Insights into the synthesis and properties of deep eutectic solvents based on cholinium chloride and carboxylic acids[J]. ACS Sustainable Chemistry & Engineering,2014,2(10):2416−2425.
[13] PISANO P L, ESPINO M, ÁNGELES FERNANDEZ M, et al. Structural analysis of natural deep eutectic solvents, theoretical and experimental study[J]. Microchemical Journal,2018,143:252−258. doi: 10.1016/j.microc.2018.08.016
[14] NAM M W, ZHAO J, LEE M S, et al. Enhanced extraction of bioactive natural products using tailor-made deep eutectic solvents:Application to flavonoid extraction from Flos sophorae[J]. Green Chemistry,2015,17(3):1718−1727. doi: 10.1039/C4GC01556H
[15] WANG X S, WU Y F, LI J, et al. Ultrasound-assisted deep eutectic solvent extraction of echinacoside and oleuropein from Syringa pubescens Turcz.[J]. Industrial Crops and Products,2020,151:112442. doi: 10.1016/j.indcrop.2020.112442
[16] GOMEZ F J V, ESPINO M, FERNANDEZ M A, et al. A greener approach to prepare natural deep eutectic solvents[J]. Chemistry Select,2018,3(22):6122−6125.
[17] ABBOTT A P, BOOTHBY D, CAPPER G, et al. Deep eutectic solvents formed between choline chloride and carboxylic acids:Versatile alternatives to ionic liquids[J]. Journal of the American Chemical Society,2004,126(29):9142−9147. doi: 10.1021/ja048266j
[18] ABBOTT A P, CAPPER G, DAVIERS D L, et al. Novel solvent properties of choline chloride/urea mixtures[J]. Chemical Communications,2003(1):70−71. doi: 10.1039/b210714g
[19] QIN H, HU X T, WANG J W, et al. Overview of acidic deep eutectic solvents on synthesis, properties and applications[J]. Green Energy & Environment,2019,5(1):14−27.
[20] ABBOTT A P, HARRIS R C, RYDER K S, et al. Glycerol eutectics as sustainable solvent systems[J]. Green Chemistry,2011,13(1):82−90. doi: 10.1039/C0GC00395F
[21] ABBOTT A P, ALABDULLAH S, AL-MURSHEDI A, et al. Bronsted acidity in deep eutectic solvents and ionic liquids[J]. Faraday Discussions,2018(206):365−377.
[22] JABLONSKY M, ANDREA S, RUSS A, et al. The pH behavior of seventeen deep eutectic solvents[J]. Bioresources,2018,13(3):5042−5051. doi: 10.15376/biores.13.3.5042-5051
[23] HAYYAN M, HASHIM M A, HAYYAN A, et al. Are deep eutectic solvents benign or toxic?[J]. Chemosphere,2013,90(7):2193−2195. doi: 10.1016/j.chemosphere.2012.11.004
[24] JUNEIDI I, HAYYAN M, HASHIM M A. Evaluation of toxicity and biodegradability for choline-based deep eutectic solvents[J]. RSC Advances,2015,5:83636. doi: 10.1039/C5RA12425E
[25] WU K R, REN J, WANG Q, et al. Research progress on the preparation and action mechanism of natural deep eutectic solvents and their application in food[J]. Foods,2022,11(21):3528. doi: 10.3390/foods11213528
[26] ZHAO B Y, XU P, YANG F X, et al. Biocompatible deep eutectic solvents based on choline chloride:Characterization and application to the extraction of rutin from Sophora japonica[J]. ACS Sustainable Chemistry & Engineering,2015,3(11):2746−2755.
[27] RADOSEVIC K, BUBALO M C, SRCEK V G, et al. Evaluation of toxicity and biodegradability of choline chloride based deep eutectic solvents[J]. Ecotoxicology and Environmental Safety,2015,112:46−53. doi: 10.1016/j.ecoenv.2014.09.034
[28] ABBOTT A P, EDIER K J, PAGE A J. Deep eutectic solvents-the vital link between ionic liquids and ionic solutions[J]. The Journal of Chemical Physics,2021(15):155.
[29] HAMMOND O S, BOWRON D T, EDLER K J. The effect of water upon deep eutectic solvent nanostructure:An unusual transition from ionic mixture to aqueous solution[J]. Angewandte Chemie,2017,129(33):9914−9917. doi: 10.1002/ange.201702486
[30] GABRIELE F, CHIARNI M, GERMANI R, et al. Effect of water addition on choline chloride/glycol deep eutectic solvents:Characterization of their structural and physicochemical properties[J]. Journal of Molecular Liquids,2019,291:111301. doi: 10.1016/j.molliq.2019.111301
[31] DAI Y, WITKAMP G J, VERPOORTE R, et al. Natural deep eutectic solvents as a new extraction media for phenolic metabolites in Carthamus tinctorius L[J]. Analytical Chemistry,2013,85(13):6272−6278. doi: 10.1021/ac400432p
[32] SHAH D, MJALLI F S. Effect of water on the thermo-physical properties of reline:an experimental and molecular simulation based approach[J]. Physical Chemistry Chemical Physics,2014,16(42):23900−23907.
[33] MENG X, BALLERAT-BUSSEROLLES K, HUSSON P, et al. Impact of water on the melting temperature of urea+choline chloride deep eutectic solvent[J]. New Journal of Chemistry,2016,40(55):4492−4499.
[34] YAN Y C, RASHMI W, KHALID M, et al. Potential application of deep eutectic solvents in heat transfer application[J]. Journal of Engineering and Technological Science,2017,12:1−14.
[35] AROSO I M, PAIVA A, REIS R L, et al. Natural deep eutectic solvents from choline chloride and betaine–physicochemical properties[J]. Journal of Molecular Liquids,2017,241:654−661. doi: 10.1016/j.molliq.2017.06.051
[36] WANG Q, YANG X Y, ZHU C W, et al. Advances in the utilization of tea polysaccharides:Preparation, physicochemical properties, and health benefits[J]. Polymers,2022,14(14):2775. doi: 10.3390/polym14142775
[37] XIA B, LIU Q, SUN D, et al. Ultrasound-assisted deep eutectic solvent extraction of polysaccharides from Anji white tea:Characterization and comparison with the conventional method[J]. Foods,2023,12(3):588. doi: 10.3390/foods12030588
[38] DU B, JEEPIPALLI S P K, XU B. Critical review on alterations in physiochemical properties and molecular structure of natural polysaccharides upon ultrasonication[J]. Ultrasonics Sonochemistry,2022,90:106170. doi: 10.1016/j.ultsonch.2022.106170
[39] 黄秀红, 刘丽辰, 阮怿航, 等. 响应面优化低共熔溶剂提取乌龙茶多糖的研究[J]. 食品研究与开发,2020,41(11):96−103. [HUANG X H, LIU L C, RUAN Y H, et al. Optimization of deep eutectic solvents extraction of polysaccharides from Oolong Tea by response surface methodology[J]. Food Research and Development,2020,41(11):96−103.] doi: 10.12161/j.issn.1005-6521.2020.11.016 HUANG X H, LIU L C, RUAN Y H, et al. Optimization of deep eutectic solvents extraction of polysaccharides from Oolong Tea by response surface methodology[J]. Food Research and Development, 2020, 41(11): 96−103. doi: 10.12161/j.issn.1005-6521.2020.11.016
[40] 王治丹, 代云飞, 罗尚娟, 等. 铁皮石斛化学成分及药理作用的研究进展[J]. 华西药学杂志,2022,37(4):472−476. [WANG Z D, DAI Y F, LUO S J, et al. Research progress on chemical constituents and pharmacological effects of Dendrobium officinale[J]. West China Journal of Pharmaceutical Sciences,2022,37(4):472−476.] WANG Z D, DAI Y F, LUO S J, et al. Research progress on chemical constituents and pharmacological effects of Dendrobium officinale[J]. West China Journal of Pharmaceutical Sciences, 2022, 37(4): 472−476.
[41] 梁静. 基于深度共熔溶剂提取铁皮石斛多糖及其生物活性的评价[D]. 广州:华南理工大学, 2018. [LIANG J. Extraction and bioactivity of polysaccharides from Dendrobium officinale by deep eutectic solvents[D]. Guangzhou:South China University of Technology, 2018.] LIANG J. Extraction and bioactivity of polysaccharides from Dendrobium officinale by deep eutectic solvents[D]. Guangzhou: South China University of Technology, 2018.
[42] YANG M L, REN W J, LI G Y, et al. The effect of structure and preparation method on the bioactivity of polysaccharides from plants and fungi[J]. Food & Function,2022,13(22):12541−12560.
[43] LIU M, WANG S, BI W, et al. Plant polysaccharide itself as hydrogen bond donor in a deep eutectic system-based mechanochemical extraction method[J]. Food Chemistry,2023,399:133941. doi: 10.1016/j.foodchem.2022.133941
[44] LIU M, CAO D, BI W, et al. Extraction of natural products by direct formation of eutectic systems[J]. ACS Sustainable Chemistry & Engineering,2021,9(36):12049−12057.
[45] 唐兰芳. 黄精多糖低共熔溶剂提取工艺和特性研究及应用[D]. 长沙:湖南农业大学, 2021. [TANG L F. Study on extraction technology, characteristic of polysaccharides from Polygonatum sibiricum extracted by deep eutectic solvents and application[D]. Changsha:Hunan Agricultural University, 2021.] TANG L F. Study on extraction technology, characteristic of polysaccharides from Polygonatum sibiricum extracted by deep eutectic solvents and application[D]. Changsha: Hunan Agricultural University, 2021.
[46] 汪涛, 周新群, 孙君社, 等. 低共熔溶剂提取黄精多糖工艺优化及抗氧化活性研究[J]. 食品科学技术学报,2020,38(6):111−120. [WANG T, ZHOU X Q, SUN J S, et al. Study on optimal process and antioxidant activity of Polygonatum sibiricum polysaccharides extracted by deep eutectic solvents[J]. Journal of Food Science and Technology,2020,38(6):111−120.] doi: 10.3969/j.issn.2095-6002.2020.06.014 WANG T, ZHOU X Q, SUN J S, et al. Study on optimal process and antioxidant activity of Polygonatum sibiricum polysaccharides extracted by deep eutectic solvents[J]. Journal of Food Science and Technology, 2020, 38(6): 111−120. doi: 10.3969/j.issn.2095-6002.2020.06.014
[47] WANG N, LI Q. Study on extraction and antioxidant activity of polysaccharides from Radix Bupleuri by natural deep eutectic solvents combined with ultrasound-assisted enzymolysis[J]. Sustainable Chemistry and Pharmacy,2022,30:100877. doi: 10.1016/j.scp.2022.100877
[48] HUI H P, GAO W J. Physicochemical features and antioxidant activity of polysaccharides from Herba patriniae by gradient ethanol precipitation[J]. Arabian Journal of Chemistry,2022,15(5):103770. doi: 10.1016/j.arabjc.2022.103770
[49] 刘旭, 孟继坤, 葛鑫会, 等. 低共熔溶剂提取的黄精多糖性质分析[J]. 食品工业科技,2022,43(11):52−57. [LIU X, MENG J K, GE X H, et al. Properties of polysaccharides from Polygonatum sibiricum extracted with deep eutectic solvents[J]. Science and Technology of Food Industry,2022,43(11):52−57.] LIU X, MENG J K, GE X H, et al. Properties of polysaccharides from Polygonatum sibiricum extracted with deep eutectic solvents[J]. Science and Technology of Food Industry, 2022, 43(11): 52−57.
[50] 何瑞阳, 王锋, 苏小军, 等. 玉竹多糖低共熔溶剂提取工艺优化及其抗氧化和抗糖基化活性研究[J]. 食品与发酵工业,2022,48(8):190−198. [HE R Y, WANG F, SU X J, et al. Optimization of extraction process of Polygonatum odoratum polysaccharide by deep eutectic solvent and its antioxidant and anti glycosylation activities[J]. Food and Fermentation Industries,2022,48(8):190−198.] HE R Y, WANG F, SU X J, et al. Optimization of extraction process of Polygonatum odoratum polysaccharide by deep eutectic solvent and its antioxidant and anti glycosylation activities[J]. Food and Fermentation Industries, 2022, 48(8): 190−198.
[51] STEENBEKE M, DE DECKER I, MARCHAND S, et al. Dietary advanced glycation end products in an elderly population with diabetic nephropathy:An exploratory investigation[J]. Nutrients,2022,14(9):1818. doi: 10.3390/nu14091818
[52] CHEN L, YANG Y Y, ZHOU R, et al. The extraction of phenolic acids and polysaccharides from Lilium lancifolium Thunb. using a deep eutectic solvent[J]. Analytical Methods,2021,13(10):1226−1231. doi: 10.1039/D0AY02352C
[53] 熊苏慧, 夏伯候, 雷思敏, 等. 基于低共熔溶剂提取千斤拔多糖[J]. 湖南中医药大学学报,2018,38(9):1003−1008. [XIONG S H, XIA B H, LEI S M, et al. Extraction of polysaccharides from Moghania macrophylla based on deep eutectic solvents[J]. Journal of Hunan University of Traditional Chinese Medicine,2018,38(9):1003−1008.] XIONG S H, XIA B H, LEI S M, et al. Extraction of polysaccharides from Moghania macrophylla based on deep eutectic solvents[J]. Journal of Hunan University of Traditional Chinese Medicine, 2018, 38(9): 1003−1008.
[54] SONG Q Q, WANG Y K, HUANG L X, et al. Review of the relationships among polysaccharides, gut microbiota, and human health[J]. Food Research International,2021,140:109858. doi: 10.1016/j.foodres.2020.109858
[55] 冯康琳. 荷叶多糖的提取条件优化、结构表征、体外活性评价及其消化酵解特性的研究[D]. 雅安:四川农业大学, 2022. [FENG K L. Extraction conditions optimization, structural characterization, biological functions of polysaccharides from lotus leaves and its in vitro digestive and microbial fermentation characteristics [D]. Yaan:Sichuan Agricultural University, 2022.] FENG K L. Extraction conditions optimization, structural characterization, biological functions of polysaccharides from lotus leaves and its in vitro digestive and microbial fermentation characteristics [D]. Yaan: Sichuan Agricultural University, 2022.
[56] KE Y, LIN L Z, ZHAO M M. Lotus leaf polysaccharides prepared by alkaline water, deep eutectic solvent and high pressure homogenization-assisted dual enzyme extraction:A comparative study of structural features, prebiotic activities and functionalities[J]. Food Hydrocolloids,2023,143:108870. doi: 10.1016/j.foodhyd.2023.108870
[57] 于秋菊, 王晓丽. 复合酶辅助低共熔溶剂提取枸杞子多糖的工艺优化及活性研究[J]. 食品科技,2022,47(12):171−179. [YU Q J, WANG X L. Optimization and activity of complex enzyme assisted deep eutectic solvents of polysaccharide extraction from Lycium barbarum[J]. Food Science and Technology,2022,47(12):171−179.] YU Q J, WANG X L. Optimization and activity of complex enzyme assisted deep eutectic solvents of polysaccharide extraction from Lycium barbarum[J]. Food Science and Technology, 2022, 47(12): 171−179.
[58] 张锦钰. 低共熔溶剂提取淮山多糖及其结构、生物活性研究[D]. 长沙:湖南农业大学, 2020. [ZHANG J Y. Study on structure and bioactivity of polysaccharides extracted from Chinese Yam using deep eutectic solvents[D]. Changsha:Hunan Agricultural University, 2020.] ZHANG J Y. Study on structure and bioactivity of polysaccharides extracted from Chinese Yam using deep eutectic solvents[D]. Changsha: Hunan Agricultural University, 2020.
[59] 白冰瑶, 李泉岑, 马欣悦, 等. 响应面法优化超声辅助低共熔溶剂提取红枣多糖工艺[J]. 食品研究与开发,2022,47(18):122−129. [BAI B Y, LI Q C, MA X Y, et al. Optimization of ultrasound-assisted deep eutectic solvent extraction of polysaccharides from jujube[J]. Food Research and Development,2022,47(18):122−129.] BAI B Y, LI Q C, MA X Y, et al. Optimization of ultrasound-assisted deep eutectic solvent extraction of polysaccharides from jujube[J]. Food Research and Development, 2022, 47(18): 122−129.
[60] 白冰瑶, 付超, 张春兰, 等. 不同提取方法对恰玛古多糖生物活性的比较[J]. 食品科技,2022,47(3):214−223. [BAI B Y, FU C, ZHANG C L, et al. Comparison on bioactivity of Brassica rapa L. polysaccharides by different extraction methods[J]. Food Science and Technology,2022,47(3):214−223.] BAI B Y, FU C, ZHANG C L, et al. Comparison on bioactivity of Brassica rapa L. polysaccharides by different extraction methods[J]. Food Science and Technology, 2022, 47(3): 214−223.
[61] 孙悦, 何莲芝, 苏卓文, 等. 超声辅助低共熔溶剂提取甘草多糖的研究[J]. 食品研究与开发,2021,42(2):84−91. [SUN Y, HE L Z, SU Z W, et al. Ultrasonic-assisted deep eutectic solvent extraction of Glycyrrhiza polysaccharides[J]. Food Research and Development,2021,42(2):84−91.] SUN Y, HE L Z, SU Z W, et al. Ultrasonic-assisted deep eutectic solvent extraction of Glycyrrhiza polysaccharides[J]. Food Research and Development, 2021, 42(2): 84−91.
[62] 孙悦. 微波辅助低共熔溶剂提取鹰嘴豆中生物活性成分研究[D]. 石河子:石河子大学, 2020. [SUN Y. Microwave-assisted deep eutectic solvent extraction of bioactive components from chickpeas[D]. Shihezi:Shihezi University, 2020.] SUN Y. Microwave-assisted deep eutectic solvent extraction of bioactive components from chickpeas[D]. Shihezi: Shihezi University, 2020.
[63] LI J H, LI W, LUO S, et al. Alternate ultrasound/microwave digestion for deep eutectic hydro-distillation extraction of essential oil and polysaccharide from Schisandra chinensis (Turcz.) Baill[J]. Molecules,2019,24(7):1288. doi: 10.3390/molecules24071288
[64] LONGERAS O, GAUTIER A, BALLERAT-BUSSEROLLES K, et al. Deep eutectic solvent with thermo-switchable hydrophobicity[J]. ACS Sustainable Chemistry & Engineering,2020,8(33):12516−12520.
[65] LIU F J, XUE Z M, LAN X, et al. CO2 switchable deep eutectic solvents for reversible emulsion phase separation[J]. Chemical Communications,2021,57(5):627−630. doi: 10.1039/D0CC06963A
[66] TANG Z H, XU Y, CAI C Y, et al. Extraction of Lycium barbarum polysaccharides using temperature-switchable deep eutectic solvents:A sustainable methodology for recycling and reuse of the extractant[J]. Journal of Molecular Liquids,2023,383:122063. doi: 10.1016/j.molliq.2023.122063
[67] MORALES-MDEINA R, DRUSCH S, ACEVEDO F, et al. Structure, controlled release mechanisms and health benefits of pectins as an encapsulation material for bioactive food components[J]. Food & Function,2022,13(21):10870−10881.
[68] CHEN S J, XIAO L Y, LI S J, et al. The effect of sonication-synergistic natural deep eutectic solvents on extraction yield, structural and physicochemical properties of pectins extracted from mango peels[J]. Ultrasonics Sonochemistry,2022,86:106045. doi: 10.1016/j.ultsonch.2022.106045
[69] SENGAR A S, RAWSON A, MUTHIAH M, et al. Comparison of different ultrasound assisted extraction techniques for pectin from tomato processing waste[J]. Ultrasonics Sonochemistry,2020,61:104812. doi: 10.1016/j.ultsonch.2019.104812
[70] EL-GHARBAWY A A M, HAYYAN A, HAYYAN M, et al. Natural deep eutectic solvent-assisted pectin extraction from pomelo peel using sonoreactor:experimental optimization approach[J]. Processes,2019,7(7):416. doi: 10.3390/pr7070416
[71] ADBUAL HADI N, CHOO Y M, et al. Performance of choline-based deep eutectic solvents in the extraction of tocols from crude palm oil[J]. Journal of the American Oil Chemists’Society,2015,92(22):1709−1716.
[72] BENVENUTTI L, DEL PILAR SANCHEZ-CAMARGO A, ZIELINSKI A A F, et al. NADES as potential solvents for anthocyanin and pectin extraction from Myrciaria cauliflora fruit by-product:In silico and experimental approaches for solvent selection[J]. Journal of Molecular Liquids,2020,315:113761. doi: 10.1016/j.molliq.2020.113761
[73] LIEW S Q, NGOH G C, YUSOFF R, et al. Acid and deep eutectic solvent (DES) extraction of pectin from pomelo (Citrus grandis (L.) Osbeck) peels[J]. Biocatalysis and Agricultural Botechnology,2018,13:1−11. doi: 10.1016/j.bcab.2017.11.001
[74] ZIOGA M, TSOUKO E, MAINA S, et al. Physicochemical and rheological characteristics of pectin extracted from renewable orange peel employing conventional and green technologies[J]. Food Hydrocolloids,2022,132:107887. doi: 10.1016/j.foodhyd.2022.107887
[75] RAJI Z, KHODAIYAN F, REZAEI K, et al. Extraction optimization and physicochemical properties of pectin from melon peel[J]. International Journal of Biological Macromolecules,2017,98:709−716. doi: 10.1016/j.ijbiomac.2017.01.146
[76] BENVENUTTI L, ZIELINSKI A A F, FERREIRA S R S. Subcritical water extraction (SWE) modified by deep eutectic solvent (DES) for pectin recovery from a Brazilian berry by-product[J]. The Journal of Supercritical Fluids,2022,189:105729. doi: 10.1016/j.supflu.2022.105729
[77] SHAFIE M H, YUSOF R, GAN C Y. Deep eutectic solvents (DES) mediated extraction of pectin from Averrhoa bilimbi:Optimization and characterization studies[J]. Carbohydrate Polymers,2019,216:303−311. doi: 10.1016/j.carbpol.2019.04.007
[78] SHAFIE M H, GAN C Y. Could choline chloride-citric acid monohydrate molar ratio in deep eutectic solvent affect structural, functional and antioxidant properties of pectin?[J]. International Journal of Biological Macromolecules,2020,149:835−843. doi: 10.1016/j.ijbiomac.2020.02.013
[79] MR M B S, MR V S K, CHAUDHARY M, et al. A mini review on synthesis, properties and applications of deep eutectic solvents[J]. Journal of the Indian Chemical Society,2021,98(11):100210. doi: 10.1016/j.jics.2021.100210
[80] CUI Q, LIU J Z, WANG L T, et al. Sustainable deep eutectic solvents preparation and their efficiency in extraction and enrichment of main bioactive flavonoids from sea buckthorn leaves[J]. Journal of Cleaner Production,2018,184:826−835. doi: 10.1016/j.jclepro.2018.02.295
[81] CAO J, CHEN L Y, LI M H, et al. Two-phase systems developed with hydrophilic and hydrophobic deep eutectic solvents for simultaneously extracting various bioactive compounds with different polarities[J]. Green Chemistry,2018,20(8):1879−1886. doi: 10.1039/C7GC03820H
[82] HUANG Z L, WU B P, WEN Q, et al. Deep eutectic solvents can be viable enzyme activators and stabilizers[J]. Journal of Chemical Technology & Biotechnology,2014,89(12):1975−1981.





 下载:
下载:
 下载:
下载:



