Advances in the Rapid Detection of Foodborne Pathogens by Nucleic Acid Amplification Lateral Flow Assays
-
摘要: 食源性致病菌严重危害食品安全。传统的致病菌检测方法费时耗力,难以应对现代食品安全检测快速、简便的需求。分子生物学检测方法,如聚合酶链式反应法、等温核酸扩增法以及基于规律成簇间隔短回文重复序列的核酸检测技术等,已被广泛应用于食源性致病菌检测,为保障食品安全发挥了重要作用。近年来,联用核酸扩增检测技术和免疫层析技术成为食源性致病菌快速检测的研究热点。本文总结了核酸扩增和侧流层析试纸联用快速检测食源性致病菌的研究进展,重点讨论了其优缺点,并展望其未来发展方向,以期为食源性致病菌的检测和防控提供参考。Abstract: Foodborne pathogens remain a serious threat to food safety, while traditional assays are time-consuming and labor-intensive, and difficult to match with the rapid and simple requirements of modern food safety detection. Molecular biology-based assays, such as polymerase chain reaction, isothermal nucleic acid amplification, and clustered regularly interspaced short palindromic repeats-based nucleic acid detection technology, have been widely employed in the detection of foodborne pathogens, and play an important role in ensuring food safety. In recent years, the combination of nucleic acid amplification detection technology and immunochromatography technology has become a hotspot for rapidly detecting foodborne pathogens. Here, the research progress in the rapid detection of foodborne pathogens are summarized by combining nucleic acid amplification and lateral flow immunoassays, highlight their advantages and disadvantages, and provide a comprehensive outlook on this field. This review can provide a reference for detecting, preventing, and controlling foodborne pathogens.
-
根据世界卫生组织统计,全球每年有近十分之一的人因食物受污染而生病,而这些患食源性疾病的患者中70%是由致病性微生物所引起的[1−2]。常见的食源性致病菌包括大肠杆菌、金黄色葡萄球菌、沙门氏菌、单增李斯特菌等,对公共卫生安全埋下巨大隐患的同时也对食品产业和社会造成经济损失。全球多个国家都制定了各种食品基质中食源性致病菌限制标准,我国针对预包装食品和散装即食食品,也新发布了两项有关致病菌限量的食品安全国家标准,使得食源性致病菌检测的标准体系更加完善,分类更加细化。更加细致严格的标准维护了消费者食用时的公共卫生安全,而降低食源性致病菌对食品产业和社会造成的经济损失并从源头上解决问题,则需要准确、快速、高效的食源性致病菌检测方法。
目前,我国食源性致病菌检测主要依据GB 4789系列标准,检测方法以传统培养法为主,具有检测准确性高、结果可靠等优点,是食源性致病菌检测的金标准,但检测耗时长、费时费力,难以应对现代食品安全快速检测的要求。基于核酸扩增的分子生物学方法因其检测效率高、准确性强、特异性高被广泛应用于食源性致病菌检测中,主要包括聚合酶链式反应法(Polymerase chain reaction,PCR)、等温核酸扩增法、基于成簇规律间隔短回文重复序列及相关蛋白(Clustered regularly interspaced short palindromic repeats/crispr-associated protein,CRISPR/Cas)的检测技术等,但这些方法大多存在无法实现可视化、便携化检测等弊端。近年来,研究者们将核酸扩增与其他检测方法联用来改进和完善检测性能,其中和侧流层析试纸技术联用的研究最为广泛。侧流层析试纸检测技术具有操作简单、结果可视化、成本低廉等优点,在食源性致病菌现场快速检测中具有巨大的应用潜力。本文综述了多种基于核酸扩增-侧流层析试纸的检测体系及其在食源性致病菌检测中的应用进展,并提出该联用技术在食源性致病菌快速检测领域的发展方向,以期为食源性致病菌的检测和防控提供方法参考。
1. 基于PCR-侧流层析试纸检测食源性致病菌
PCR是基于核酸检测食源性致病菌最常用的技术手段,通过模拟生物机体内DNA的复制过程,经过变性-退火-延伸的循环,使得DNA分子在生物体外扩增,基于目标菌的保守基因设计引物使其具有特异性,从而有效鉴定目标菌[3]。PCR技术灵敏度高、特异性强、快速简便,并因其可以用来检测一些难以培养或人工无法培养的微生物,检测范围和能力都占有优势,在食源性致病菌检测中得到广泛应用,主要包括单重PCR、多重PCR及荧光定量PCR等方法。贾方芳等[4]针对兔源性沙门氏菌的invA基因设计两对引物,分别建立单重PCR检测方法,检出限分别为0.118、1.180 pg/µL,准确率达100%,实验结果表明,合理的引物设计与选择直接影响PCR检测方法灵敏度,是PCR检测方法的基石;王仕成[5]建立了同时检测牛乳中金黄色葡萄球菌、无乳链球菌、大肠杆菌、停乳链球菌、的多重PCR检测方法,检测灵敏度分别为1、1、1 pg/µL及100 fg/µL,节省了大量检测时间,提高了检测效率,可以有效降低检测成本;陈秀琴等[6]建立了大肠杆菌O157:H7、沙门氏菌和金黄色葡萄球菌的多重荧光定量PCR检测方法,可有效避免普通多重PCR产物之间的交叉污染。然而,上述方法检测结果的呈现需要电泳、配套紫外或荧光检测等,存在检测时间较长、不便于现场检测等弊端,如何快速方便的对PCR检测结果进行判读成为需要解决的实际问题。2022年10月1日,中华人民共和国海关总署颁布了SN/T 5439-2022《出口食品中食源性致病菌快速检测方法 PCR-试纸条法》,首次建立了PCR-试纸条法检测大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌等7种常见食源性致病菌的行业标准[7−13],食源性致病菌PCR-侧流层析试纸联用检测方法成为研究热点,根据侧流层析试纸中标记物的不同,主要有PCR-金标层析试纸和PCR-荧光层析试纸。
1.1 PCR-金标层析试纸检测方法
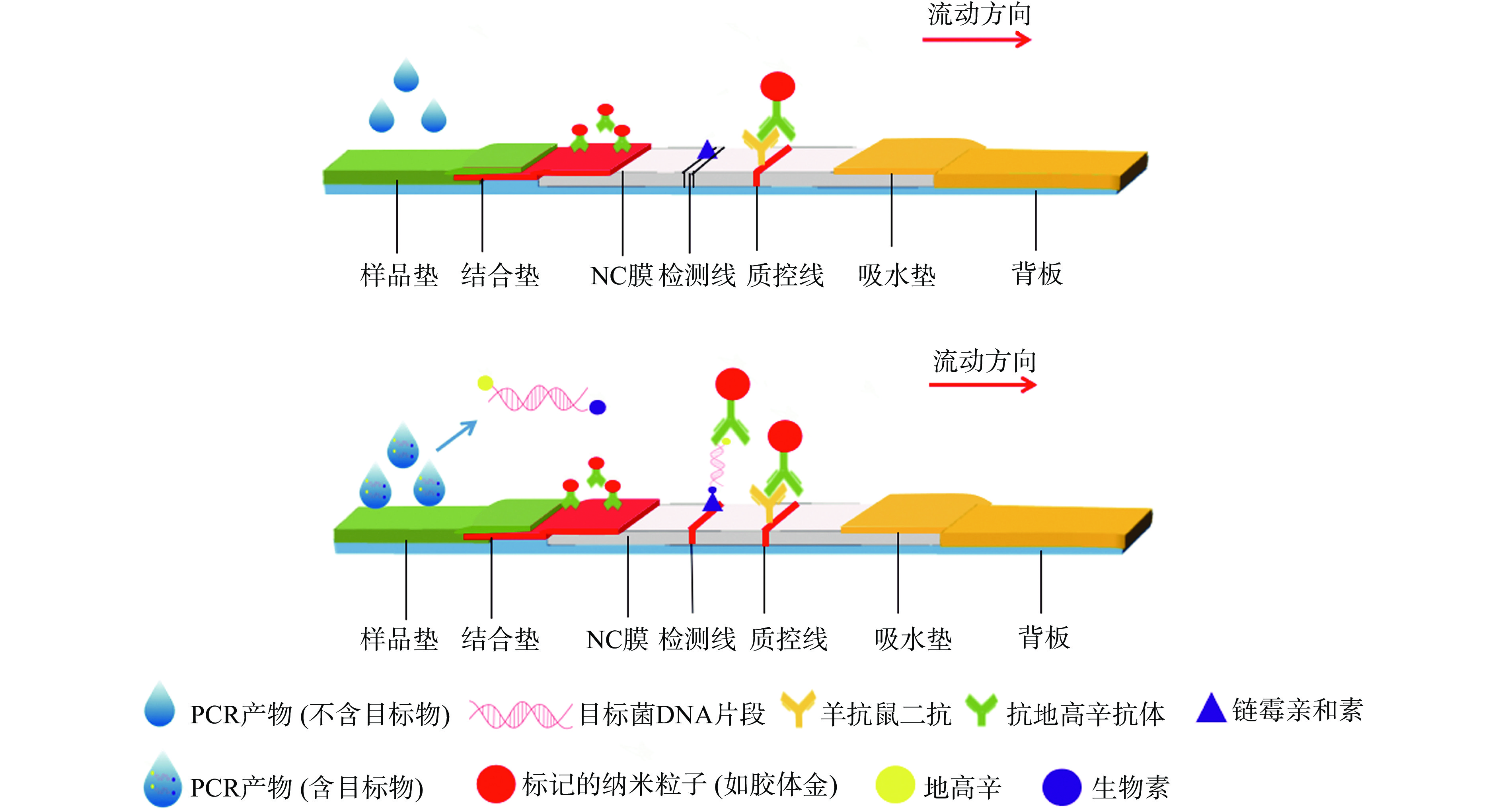
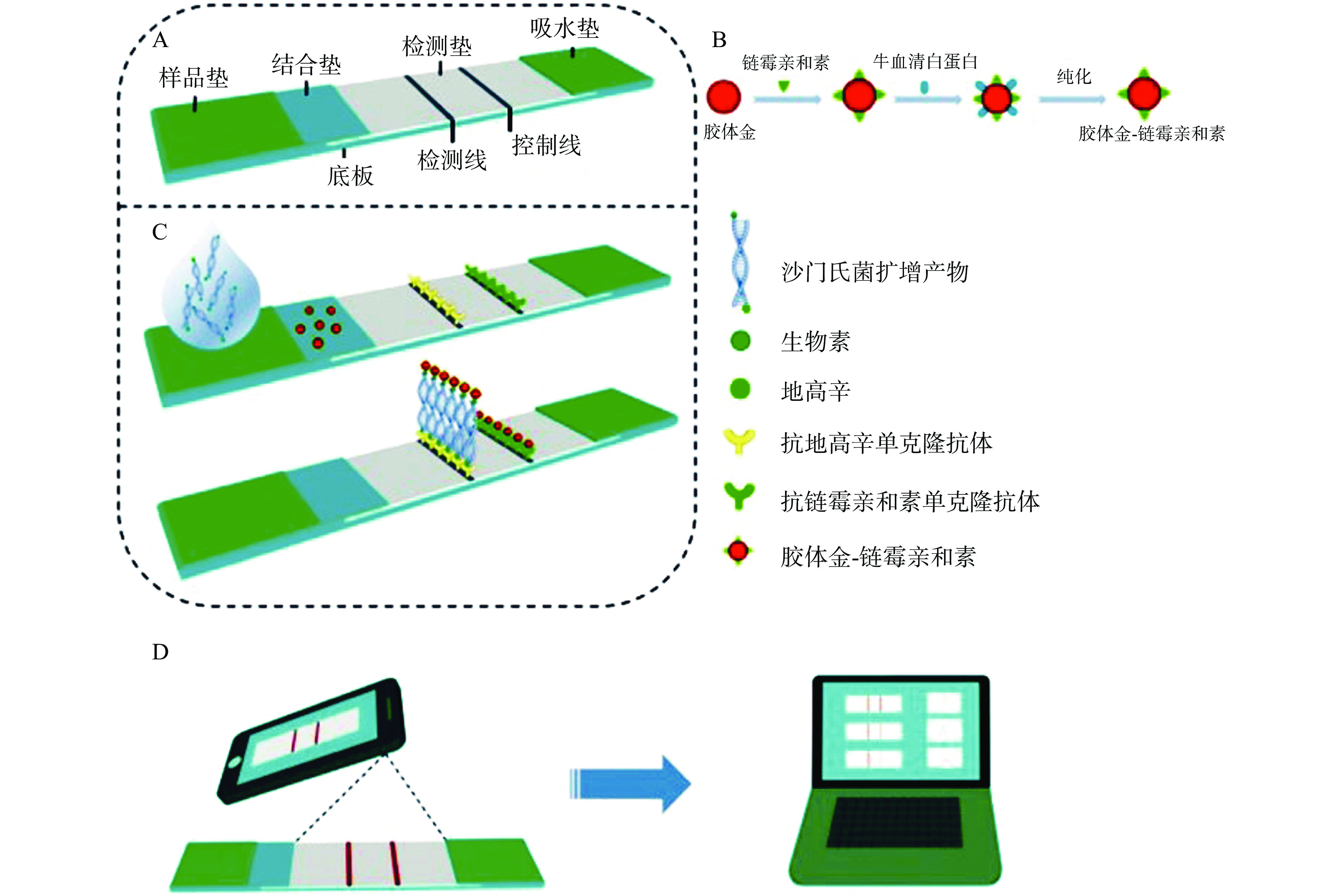
以胶体金为标记物的胶体金试纸条在PCR-侧流层析试纸中应用最为广泛,PCR产物在试纸条上结果呈现常依据双抗夹心法原理进行设计[14−15],如图1所示,首先在上下游PCR引物两端分别修饰生物素和地高辛,金纳米粒子作为标记物标记抗地高辛抗体制备金标抗体,并预先喷涂在结合垫上。检测线(T线)上固定链霉亲和素,质控线(C线)上固定羊抗鼠二抗。当待测样本中有目标菌时,PCR扩增产物为一端标记生物素,另一端标记地高辛的双螺旋DNA,待测物流经结合垫时通过地高辛抗原抗体识别作用形成金标-PCR扩增产物复合物,到达T线时通过生物素-链霉亲和素特异结合作用形成红色条带,剩余的金标-PCR扩增产物复合物继续层析到达C线被羊抗鼠二抗结合,此时T线和C线均显示出红色条带,即为阳性结果;当待测样本中没有目标菌时,则PCR扩增产物不存在,T线因无法捕捉胶体金而不显色,C线通过羊抗鼠二抗结合抗地高辛抗体来捕捉金粒子得以显色,即为阴性结果;通过试纸条上T线的有无可实现食源性致病菌的定性检测。
基于此原理制备的PCR-金标层析试纸条,可以用于对食源性致病菌的早期检测和流行病学筛查[16],避免染料及紫外光对实验员造成的危害并可实现现场检测[17]。Singh等[18]利用5’-荧光素氨基磷酸酯(Fluorescein aminophosphate,FAM)和生物素对耶尔森菌的特异性上下游引物进行标记,建立的PCR-金标层析试纸可用于检测人血样本中的耶尔森菌,灵敏度可达104 CFU/mL。陈诗胜等[19]利用异硫氰酸荧光素(Fluorescein isothiocyanate isomer I,FITC)和地高辛对上下游引物的5’端进行标记,以抗FITC抗体标记胶体金颗粒,在T线和C线上分别固定抗地高辛抗体和羊抗鼠二抗,分别研制出无乳链球菌、金黄色葡萄球菌、大肠杆菌和停乳链球菌的PCR-金标层析试纸条,除大肠杆菌外,其他3种菌的试纸条均比凝胶电泳法的检测灵敏度提高了10倍,表明PCR-金标试纸法可适用于食源性致病菌的筛查和检测,并能显著提高检测灵敏度。
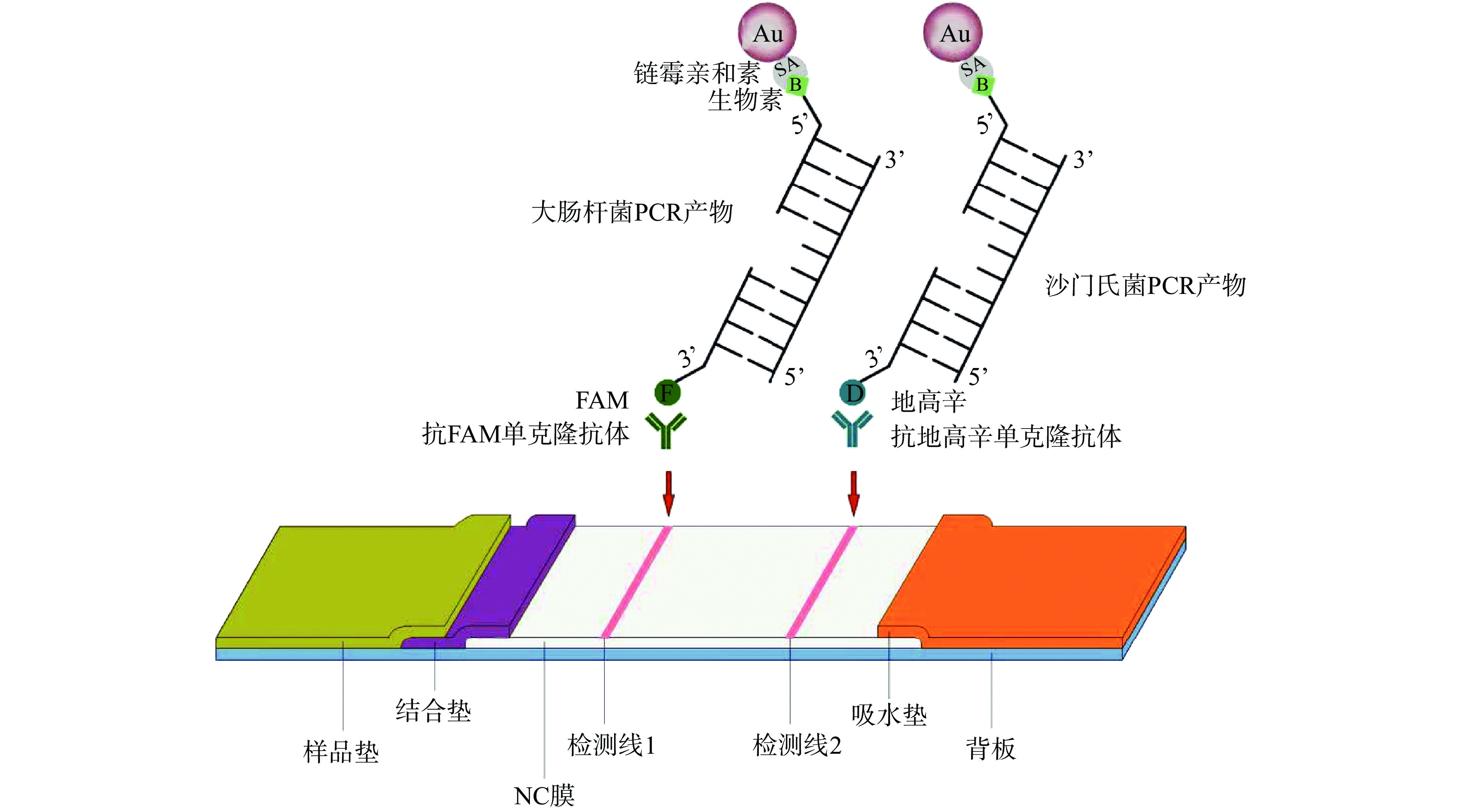
为应对多种食源性致病菌的同时检测,Nor等[20]针对井水样中三种不同类型的沙门氏菌建立了多重PCR-金标层析试纸法,利用内标排除假阴性的可能,结果表明,580份水样利用多重PCR-金标层析试纸法共检测出15份样本呈伤寒沙门氏菌阳性,而传统培养法和PCR-凝胶电泳法只检测出1份阳性样本,多重PCR-金标层析试纸法的致病菌检出率和检测效率更高。侯巧华[21]首先建立了大肠杆菌和沙门氏菌双重PCR检测体系,根据PCR扩增产物分别设计两对特异性DNA探针,一条探针5’标记生物素,另一条探针的3’分别标记FAM和地高辛,将双重PCR扩增产物和两组探针混合均匀95 ℃处理5 min,56 ℃处理3 min互补结合,进行试纸条双重检测(如图2),若检测线1显色,表明样品中含有大肠杆菌;若检测线2显色,表明样品中含有沙门氏菌;若检测线1、2均显色,则同时含有大肠杆菌和沙门氏菌,该方法检测灵敏度可达10 CFU/mL,证明了PCR-金标层析试纸在食源性致病菌多重检测中的应用潜力。另外,为消除死菌DNA对PCR检测结果的干扰,避免死菌引起假阳性,Kim等[22]针对大肠杆菌O157:H7的stx2基因和鼠伤寒沙门氏菌的his操纵子基因分别设计特异性引物,上游引物5’分别标记地高辛和FAM,下游引物3’标记生物素,结合单氮化丙啶(Propidine mononitride,PMA)抑制PCR中死细菌DNA扩增的特点,建立了同步检测活的大肠杆菌O157:H7和鼠伤寒沙门氏菌的mPCR-双重层析试纸检测方法,对大肠杆菌O157:H7和鼠伤寒沙门氏菌的检测限分别为102、101 CFU/25 g,且不需要培养富集即可直接检测致病菌。PCR-金标层析试纸条操作简单、应用范围广,可实现可视化检测,对食源性致病菌现场检测的普及具有重要意义。
1.2 PCR-荧光层析试纸法
荧光微球(Fluorescentmicrosphere,FMs)是一种发射光谱类的新型标记物,形态结构相对稳定,分散性好、偶联效率高,常通过在微球内部螯合稀土元素等微小颗粒或利用物理、化学方法在微球表面标记荧光物质制备,受外界能量刺激激发荧光,根据荧光强度的变化定量检测待测物[23]。以荧光微球为标记物制备的荧光层析试纸,检测原理同金标层析试纸条类似,且可以消除背景干扰,进一步提高检测灵敏度。滕军[24]针对大肠杆菌O157:H7的毒力基因rfb设计特异性引物,在上下游引物分别修饰FITC和生物素,FMs标记抗FITC抗体,T线上固定链霉亲和素,C线上固定羊抗鼠二抗,建立PCR-荧光层析试纸检测方法,其灵敏度达到3 CFU/mL,比传统的PCR凝胶电泳方法检测限降低100倍,比PCR-金标层析试纸条的检测限降低10倍,检测时间由30 min缩减为10~15 min。
荧光微球在实际检测中往往会受到食品基质的干扰,时间分辨荧光微球是一种特殊功能的荧光微球,其内部包埋了稀土镧系元素,在紫外光下发射特殊的荧光,比普通荧光斯托克斯位移大且荧光寿命延长5~6个数量级,通过时间延迟和波长的分辨,可以有效消除样品中本底荧光、激发光等非特异性荧光的干扰,进一步提高灵敏度。冯瑶[25]制备了胶体金试纸条和时间分辨荧光层析试纸条用于B族链球菌的检测,检测灵敏度分别为105、103 CFU/mL,表明时间分辨荧光层析试纸条灵敏度较胶体金试纸条更高。Wang等[26]利用镧系荧光微球标记抗大肠杆菌O157:H7单克隆抗体,制备了大肠杆菌O157:H7时间分辨荧光层析试纸条,降低了肉制品中本底荧光对检测结果的影响,灵敏度高、抗干扰能力强,视觉检测限为104 CFU/mL,结合试纸条阅读器其检测限低至102 CFU/mL。然而目前报道的食源性致病菌时间分辨荧光层析试纸均为基于抗原抗体免疫分析,利用时间分辨荧光微球制备PCR-时间分辨荧光层析试纸条或将成为提高食源性致病菌检测灵敏度的新方向。
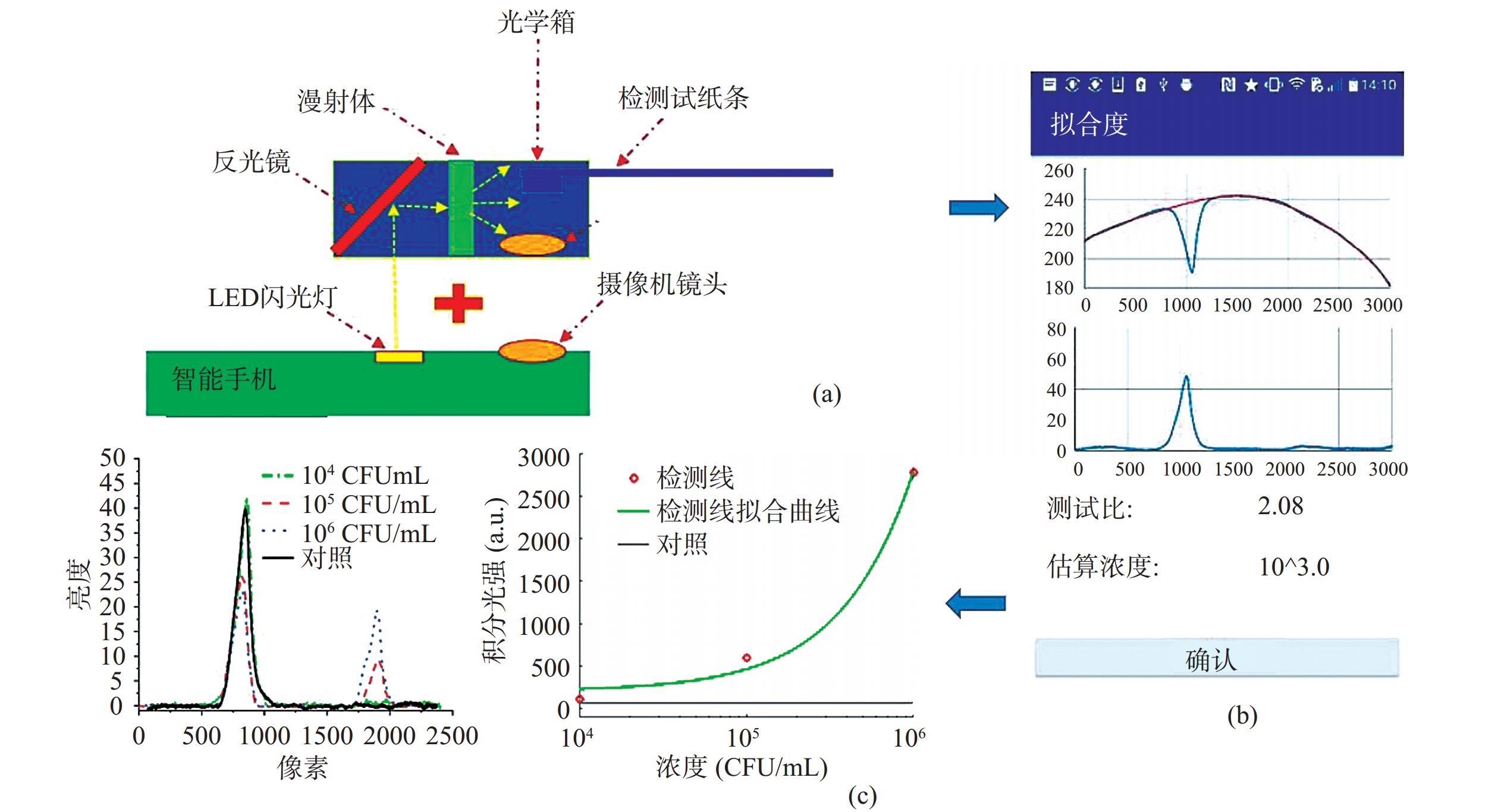
PCR-侧流层析试纸条通常只能实现对目标物的定性或半定量分析,结合读数装置如智能手机上的分析软件可实现定量分析(图3)。智能手机成像能力强,体积小便于携带,通过智能手机拍照,结合读数装置的视觉识别技术,将光学信号转化为数字信号,借助智能手机软件的计算能力定量分析数据,可以有效避免因光照强度、肉眼偏差等客观与主观因素对检测结果的误判。Jung等[27]开发了一个智能手机内部应用程序,采用灰度化模式处理图像,有效提取试纸条上的显色信息,成功检测出牛肉中104 CFU/mL和菠菜中105 CFU/mL的大肠杆菌O157:H7,表明借助智能手机可实现侧流层析试纸条定量检测,为试纸条检测结果的判定提供了一种更加客观准确的方法。王月[28]基于PCR核酸修饰技术结合核酸试纸条,建立了鼠伤寒沙门氏菌PCR-侧流层析试纸检测方法,利用智能手机对试纸条进行拍照后使用Image J和Origin软件进行统计分析,通过T线和C线峰面积的比值即可确定出不同浓度菌液在试纸条上颜色信号的变化,检测结果与琼脂糖检测结果一致,检测限可达233 CFU/mL,有效解决了肉眼难以判别试纸条显色浅、条带模糊的难题,保障实验精确性。
PCR法作为分子检测的黄金标准,重复性好、灵敏度高、适用性广,但需要电泳、显色等步骤,对仪器依赖性强,难以进行现场检测。将PCR和侧流层析试纸技术相结合并进一步改进和优化,可以较好解决此类问题。PCR-金标层析试纸法、PCR-荧光层析试纸法都可用于快速高效地检测食源性致病菌,金标层析试纸法易受基质干扰,不稳定因素多,灵敏度受限。相对而言,荧光层析试纸法更为稳定,因发射光谱的多样性可以实现多指标的同时检测,灵敏度也比金标层析试纸要高。但若只是需要简单的定性,金标层析试纸不需要仪器设备,成本低,用肉眼即可判别,且胶体金几乎可以标记所有蛋白分子,更加便于推广普及。
2. 基于等温核酸扩增-侧流层析试纸检测食源性致病菌
等温核酸扩增技术是一种在恒定温度下扩增核酸的分子学检测技术,相比于PCR,等温核酸扩增技术反应时间短,对精密仪器及实验室场所的依赖少,仅需凭借简单的热源或水浴锅辅助即可实现核酸扩增,在降低成本上有显著优势。主要包括环介导扩增(Loop-mediated isothermal amplification,LAMP)、重组酶聚合酶扩增(Recombinase polymerase amplification,RPA)、交叉引物扩增(Crossing priming amplification,CPA)、滚环扩增(Rolling circle amplification,RCA)以及解旋酶依赖性扩增(Helicase-dependent amplification,HDA)等技术,5种技术的区别如表1所示,RCA及HDA反应时间相对较长,LAMP及CPA对引物的需求更大,RPA在反应时间、反应温度及所需引物上都有很大优势,在食源性致病菌检测方面具有很好的发展潜力。
2.1 LAMP-层析试纸法
LAMP是目前研究最多的一种等温核酸扩增技术,通过针对靶基因的6个区域设计4种特异性引物扩增核酸,已被广泛应用于食源性致病菌的检测。近年来,研究者常将其与可视化层析试纸条结合应用来提升检测灵敏度[34]。Zhang等[35]直接将LAMP微反应管连接到侧流层析试纸条上,简化设备操作,避免气溶胶产生,成功检测出样品中低至10 fg的沙门氏菌基因组DNA。Jiang等[36]利用多重LAMP结合层析试纸法,在57 min内实现了婴幼儿配方奶粉中3种食源性致病菌的同时检测,检出限小于10 CFU/mL。Wen等[37]采用免疫磁珠对目标菌进行富集,利用PMA鉴别死菌活菌,建立LAMP-金标层析试纸法实现了对生菜中的E. coli O157:H7活菌进行检测。
上述LAMP-层析试纸研究中主要以胶体金为标记物,往往存在稳定性不高、灵敏度低、易受外界干扰等缺点。纳米酶是一类既有纳米材料的独特性能又有催化功能的模拟酶[38]。目前纳米酶可模拟的催化活性主要包括类过氧化物酶活性、类过氧化氢酶活性、类超氧化物歧化酶活性、类氧化酶活性、类核酸酶活性及类蛋白酶活性等,且一种纳米酶可以同时拥有多种天然酶的活性,如氧化铁纳米酶同时兼具过氧化物酶和过氧化氢酶两种活性。随着纳米材料的兴起,纳米酶材料的种类也越来越多,应用于层析试纸条的有金属氧化物、贵金属、碳材料及金属有机框架材料等。纳米酶利用生物效应催化天然酶底物显色,可以增强试纸条检测信号,有效解决了传统胶体金免疫试纸条检测灵敏度低的问题,具有催化效率高、稳定、低成本和可规模化制备的特点[39],以纳米酶为标记物制备层析试纸条,分散性更好、灵敏度更高,发展潜力广阔。
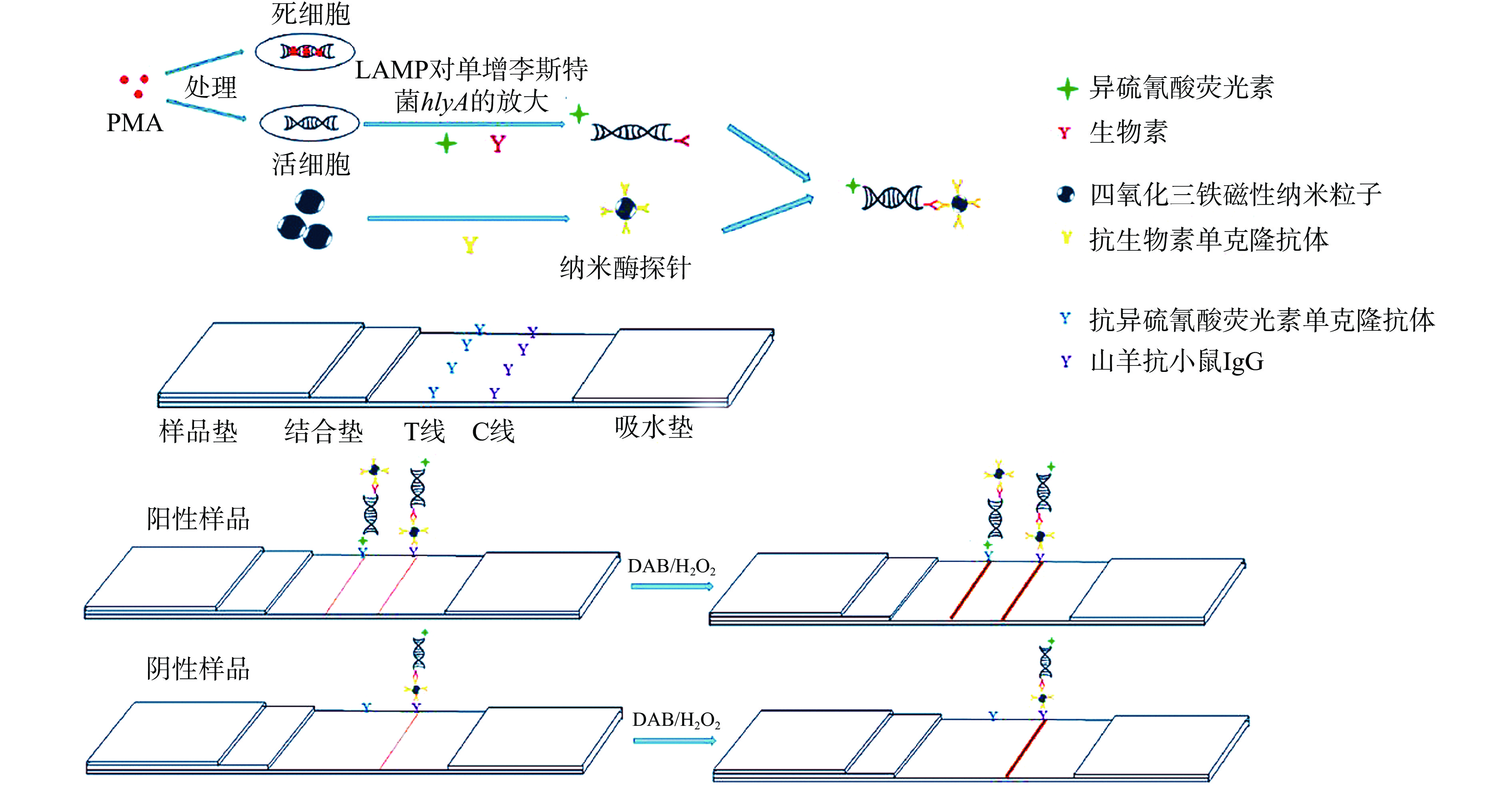
Zhang等[40]利用贵金属纳米酶与3,3'-二氨基联苯胺/过氧化氢(DAB/H2O2)酶促底物之间的酶促反应来放大检测信号,以Fe3O4纳米酶代替胶体金作为标记物对侧流层析试纸进行酶修饰,针对阪崎克罗诺杆菌的ompA基因设计LAMP引物,其中内引物FIP的5’端修饰生物素,BIP的5’端修饰FITC,试纸条的T线和C线分别包被1 mg/mL抗FITC抗体和抗小鼠IgG,结合PMA区别死菌活菌特点,建立了一种基于PMA、LAMP-纳米酶层析试纸的连续级联纳米酶生物传感器,可在1 h内实现10 CFU/mL阪崎克罗诺杆菌活菌的检测,有效提高了免疫层析试纸的灵敏度。此外,在食品生产、加工、流通过程中,常常有一些食源性致病菌附着于器物表面形成生物被膜,腐蚀仪器设备,对环境抵抗力强不易去除,引发二次污染,对食品安全造成潜在危害。对此,Shi等[41]针对单增李斯特菌hlyA基因设计LAMP引物,其中FIP引物的5’端修饰FITC,BIP引物的5’端修饰生物素,利用Fe3O4做为标记物偶联抗生物素抗体制备纳米酶探针,结合PMA抑制死菌DNA扩增的特点,研制出PMA-LAMP-纳米酶层析试纸(图4),用于检测不锈钢器具及生菜中的单增李斯特菌生物被膜,检测限分别为1.164×101、1.021×101 CFU/mL,对大肠杆菌O157:H7、沙门氏菌、志贺氏菌等无交叉反应,所研制的纳米酶层析试纸具有灵敏度高、特异性强等特点。
2.2 RPA-层析试纸法
RPA技术以T4噬菌体核酸复制机制为原理,在三种关键蛋白与DNA聚合酶、聚集剂及盐类分子等物质的共同作用下实现对DNA特定区域的指数扩增[42],该技术对设备要求低,不需DNA解链过程,是继LAMP后应用最为广泛的等温核酸扩增技术。与LAMP相比,RPA更适合多路复用,实现多核酸扩增,结合侧流层析试纸条进一步实现对扩增产物的可视化判别。
葛志毅等[43]根据布鲁氏菌特异基因的保守序列设计引物和RPA探针,用生物素修饰下游引物,FAM修饰RPA探针,38 ℃反应10 min后进行试纸条检测,检测布鲁氏菌敏感性能达到10−5(8拷贝),与实时荧光定量PCR检测结果符合率高,特异性良好,操作简单快速,可实现布鲁氏菌的野外现场检测。Fu等[44]分别利用地高辛和生物素修饰肠炎沙门氏菌的特异性上下游引物,在金纳米表面包被链霉亲和素制备金标复合物并喷涂在结合垫,在试纸条的T线固定抗地高辛抗体,C线固定抗链霉亲和素抗体,借助RPA扩增目标核酸片段后,利用试纸条呈现等温扩增结果(图5),该方法检出限为91.4 CFU/mL,具有定量快、成本低、可快速保存每个样品数据等优点。厉佳丽[45]针对金黄色葡萄球菌、副溶血性弧菌和沙门氏菌分别设计了三种特异性RPA引物,上游引物分别使用生物素、羧基荧光素、Cy5进行标记,下游引物均标记地高辛,以抗地高辛单克隆抗体标记胶体金,优化多重RPA反应体系,结合胶体金读数仪实现金黄色葡萄球菌、副溶血性弧菌和沙门氏菌的同时快速检测,检测限可达10 CFU/mL,实现了实际样本中食源性致病菌多靶标同步快速定性定量检测,极大提升检测效率。
2.3 CPA-层析试纸法
LAMP在反应中会产生未知大小扩增子的长结构,使检测过程复杂化,易发生假阳性和背景扩增反应。CPA技术是一种新型的等温扩增技术,受到研究者们的广泛关注,具有高度特异性及敏感性,能够快速靶扩增[46]。如图6A所示[47],其原理是通过4/5条引物双交叉扩增/单交叉扩增核苷酸序列,反应依赖于甜菜碱、交叉引物和Bst DNA聚合酶。
目前CPA技术的发展仍受限于结果的高效判读和可视化显示,如图6B所示[48],将核酸层析试纸引入CPA法中可以打破这种限制。向勇[49]针对铜绿假单胞菌的特异性基因oprI设计1组5’端标记FAM和生物素的CPA交叉扩增引物,在62 ℃恒温扩增45 min后,使用核酸检测试纸条进行可视化检测,其灵敏度是常规PCR检测方法的100倍,同时CPA的密闭管设计能有效避免气溶胶污染,保证结果直观客观,特别适用于户外和基层医疗单位,是检测铜绿假单胞菌的理想系统。Wang等[50]基于印第安纳肠炎沙门氏菌设计了6条引物,包括2条置换引物、2条交叉引物和2条检测引物,2条检测引物的5’端分别用生物素和6-FAM标记,63 ℃水浴扩增1 h后,将CPA扩增产物滴加于一次性核酸试纸,检测灵敏度为8.997 fg/µL,比实时荧光PCR高10倍,比常规PCR高100倍,在预防印第安肠炎沙门氏菌中表现出巨大潜力;刘敏[51]以蜡样芽孢杆菌基因组为模板,用1对外引物、1对交叉引物及2条分别用FITC和生物素标记的探针,在63 ℃恒温扩增60 min,结合核酸试纸条判定检测结果,建立的CPA-层析试纸检测蜡样芽孢杆菌的方法特异性强,可用于进出境口岸现场蜡样芽胞杆菌的快速筛查。
2.4 RCA-层析试纸法
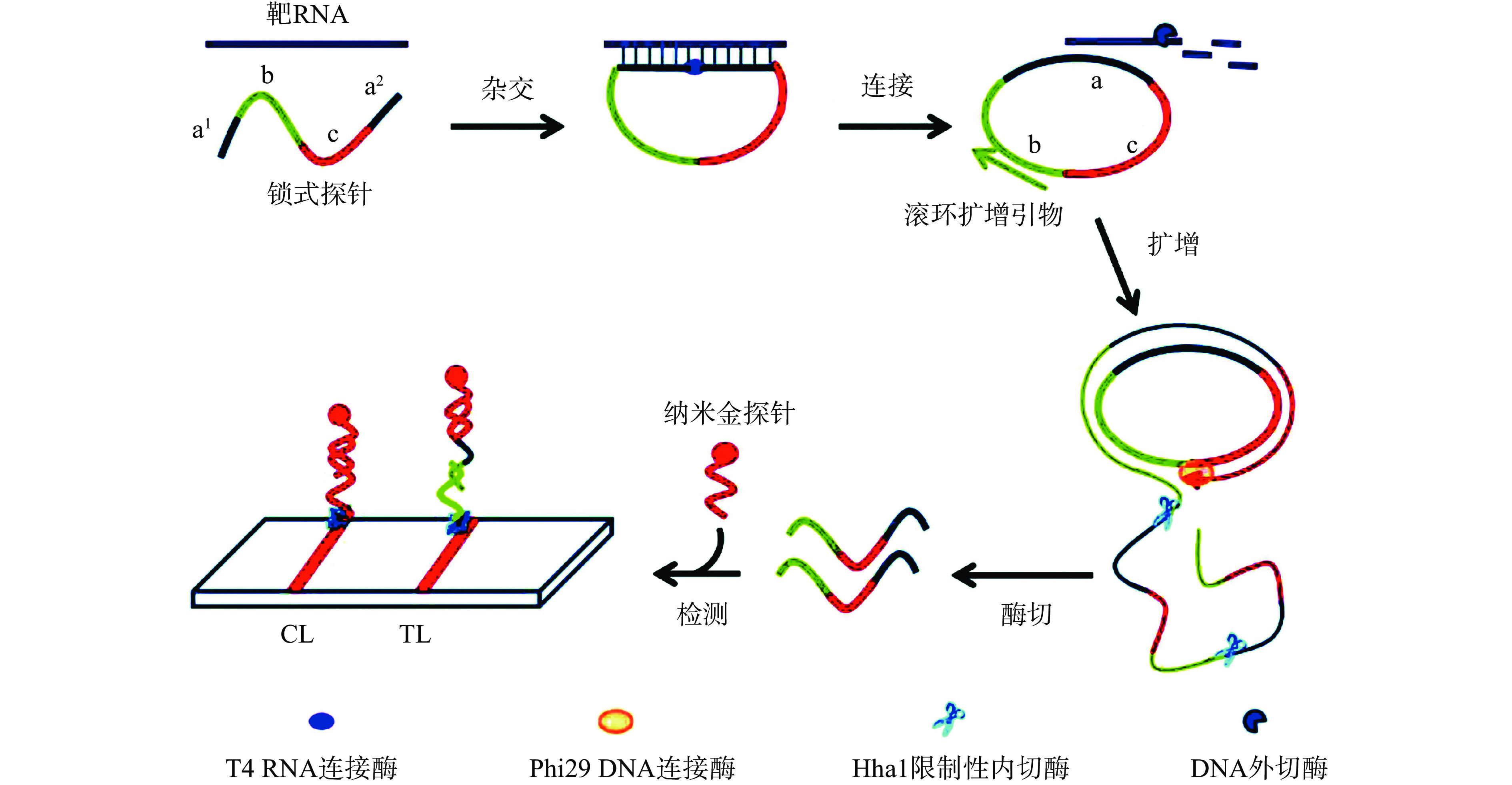
RCA是一种简单高效的体外核酸扩增技术,是借鉴自然界中环状病原生物体DNA分子滚环式复制方式发展出的一种恒温扩增技术[52],和LAMP和CPA相比,在引物设计上相对简单。Qin等[53]针对海洋卡顿藻建立了双探针滚环扩增体系,结合试纸条实现检测结果的可视化,其对海洋卡顿藻DNA的检出限为8.3×10−3 ng/µL,为其他藻类可视化快速检测提供方法借鉴,如Liu等[54]利用相同原理成功建立了双探针滚环扩增-层析试纸法并应用于剧毒卡尔藻的快速检测。在食源性致病菌检测方面,RCA-层析试纸法的研究还较少。黄梦琪等[55]建立了基于RCA的纸基显色传感器的单增李斯特菌hly A mRNA可视化检测平台,如图7所示,设计的锁式探针5’和3’分别和基因组目标序列RNA完全互补配对,当存在待检测的RNA时,连接酶就会特异性连接5’和3’,使开环的探针闭合成为一个封闭的环状结构,以此结构为模板,通过RCA对单增李斯特菌的hly A mRNA进行特异性扩增,将扩增后的单链产物进一步利用Hhal核酸内切酶特异性切割该单链核酸,形成与锁式探针长度相同的核酸单链片段,不经过预变性杂交即可直接借助试纸条检测,最优实验条件下检测限低至100 pg/μL总RNA,该方法检测时间短,检测成本低,不依赖大型仪器,整个反应过程在恒温下即可完成,显示出RCA-层析试纸法在食源性致病菌检测中的优势。
2.5 HDA-层析试纸
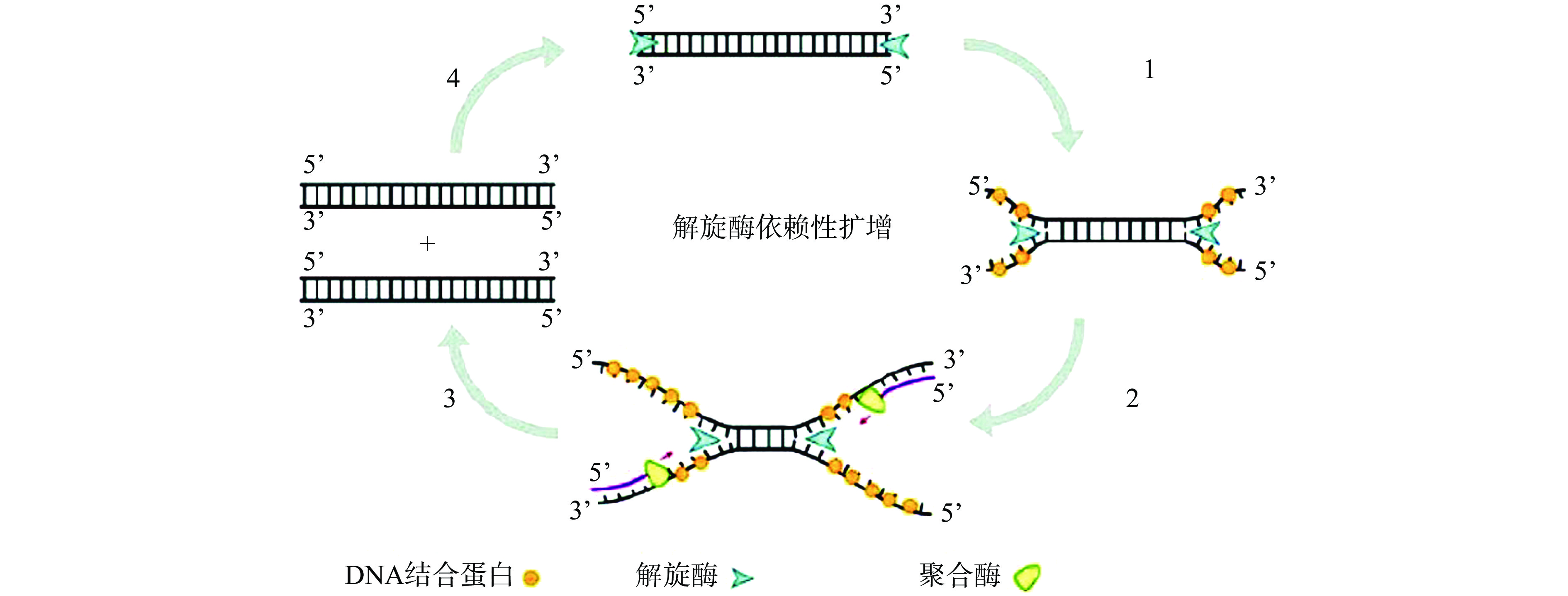
HDA利用解旋酶、单链DNA结合蛋白等组分模拟体内DNA复制过程,替代PCR过程中变性-退火-延伸的热循环过程[56],从而实现DNA体外恒温扩增的技术(如图8)[57],和其他恒温扩增技术相比,扩增过程简单,检测流程简单,通常利用电泳、荧光、电化学等方法对HAD扩增产物进行检测[58]。目前,利用HDA检测食源性致病菌的研究鲜有报道,而将HDA和层析试纸联用的研究更为少见。王赞等[59]以沙门氏菌invA基因为目的基因设计特异性引物,优化建立HDA反应体系,扩增产物进行电泳检测,可直接快速检测发酵乳中沙门氏菌污染,检出限为2.6×102 CFU/g,该方法灵敏度高、特异性良好,但在简单性和高通量检测方面仍有不足;Du等[60]首次将依赖嗜热解旋酶恒温扩增(Thermophilic helicase-dependent amplification,tHDA)和免疫层析试纸相结合用于沙门氏菌检测,正向引物5’端用地高辛修饰,反向引物5’端用生物素修饰,在引物浓度85 nmol/L,反应温度64 ℃,MgSO4浓度3.5 mmol/L,dNTP浓度0.5 mmol/L的最优条件下进行tHDA扩增,扩增产物利用胶体金层析试纸条可以实现可视化检测,检测限可达到3.1×101 CFU/mL,和常规PCR法相比有效简化了检测步骤。
综上,将等温核酸扩增技术和侧流层析试纸条技术相结合,已成功应用于各种食源性致病菌的快速检测中,具有检测成本低、精密度高、定量快、可实现现场快速检测等优点,推广应用潜力大。相比于PCR法,等温核酸扩增技术对温度的要求及检测成本都有所降低,不同的等温核酸扩增技术结合免疫层析试纸条的效果也有所不同。LAMP-层析试纸在食源性致病菌中的应用最广泛,但与普通胶体金层析试纸条结合应用时,存在标记物稳定性差、易受外界干扰等缺点,将其与纳米酶为标记物的层析试纸结合,可提高其检测稳定性,还可以通过催化作用增强显色信号,进一步提高灵敏度,具有很大发展潜力。在食源性致病菌多重LAMP检测体系中,多对引物存在容易导致引物之间的交叉反应,多重LAMP-层析试纸检测特异性有待提升;RPA-层析试纸则更适合进行多核酸扩增,常用作多种菌的同时检测,检测效率高;CPA-层析试纸能够实现快速靶扩增,检测特异性高;RCA-层析试纸及HDA-层析试纸在引物设计方面相对简单,但目前应用于食源性致病菌的研究还较少,在未来可以为食源性致病菌的检测提供更加准确、高通量检测平台。
3. 基于CRISPR/Cas-侧流层析试纸法
CRISPR-Cas是细菌体内基于RNA介导的核酸酶切割清除外源核酸的适应性免疫防御系统,CRISPR阵列由一串重复DNA序列和一个间隔序列组成,主要包括适应、表达、干扰3个阶段,在表达过程中会产生多种Cas蛋白,通过Cas核酸酶实现对外源核酸的切割,从而达到防御目的[61]。基于CRISPR-Cas系统具有识别和切割特定核酸序列的特点,不仅可以进行高效地基因编辑,还可以进行基因检测,特别是Cas3、Cas12、Cas13和Cas14蛋白的反式切割活性的发现[62],将CRISPR/Cas系统和等温核酸扩增、侧流层析试纸、比色法、荧光法、电化学法等技术相结合开发了许多高灵敏、快速、可视化检测方法[63],其中CRISPR/Cas系统和侧流层析试纸的结合应用最为引人瞩目,成为近年来病原菌检测领域的研究热点,为食源性致病菌检测提供了新的思路。
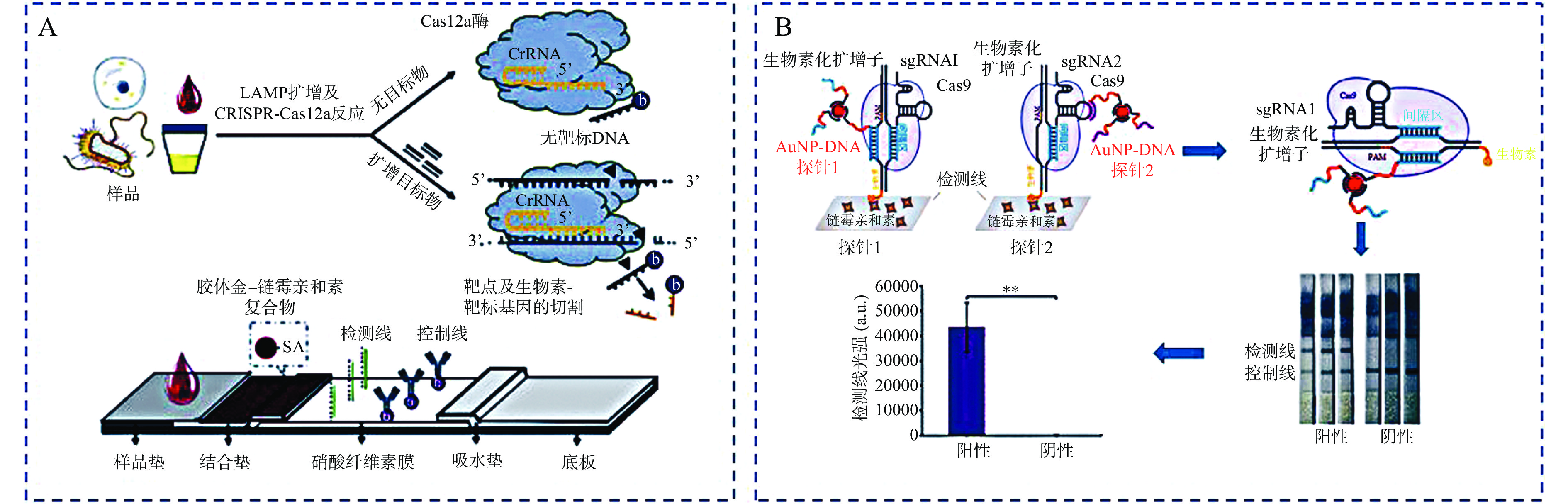
病原菌核酸检测中常用的Cas核酸酶主要包括两类:一类是可以切割RNA链的Cas13a和Cas13b;一类是可以切割DNA链的Cas12a和Cas14。Cas12a和Cas13除了切割靶向核酸序列之外,还可以切割其他核酸序列,利用这种附加核酸酶特性,结合PCR或等温核酸扩增技术实现病原菌核酸快速检测,而可以切割双链DNA的主要是CRISPR/Cas12a和CRISPR/Cas9系统,和试纸条结合实现检测结果呈现如图9所示,报告探针标记和试纸条上T线、C线的标记类似于PCR-侧流层析试纸条法的检测原理。Mukama等[64]报道了一种基于LAMP和CRISPR/Cas12系统的核酸免疫层析试纸条,实现铜绿假单胞菌酰基转移酶基因的高灵敏和高特异性检测,研究人员首先在65 ℃下LAMP扩增靶标基因,产生的扩增片段与Cas12特异性识别激活其反式切割活性,产生大量带有生物素标记的ssDNA;合成AuNP-链霉亲和素(Streptomyces avicllrdi,SA)探针并固定在试纸条的金标垫上,试纸条T线上固定ssDNA的互补系列,生物素标记的抗体固定在C线上,当靶标DNA存在时,AuNP-SA探针和生物素标记的ssDNA首先形成AuNP-SA-biotin-ssDNA探针,修饰ssDNA互补系列的T线捕获上述探针,多余的AuNP-SA探针与C线上的生物素结合,T、C线同时显色;而没有靶标DNA时不会产生ssDNA片段,T线不显色,AuNP-SA探针直接和C线上生物素结合而显色。该方法检测快速、成本低,在纯样品和复杂样品中均可检测低至单拷贝的铜绿假单胞菌酰基转移酶基因,抗基质干扰能力强。另外,为降低检测成本,Zhou等[65]以荧光量子点为信号探针标记链霉亲和素,设计生物素-核酸探针与试纸条T线上固定的捕获探针互补识别,C线上固定牛血清白蛋白(BSA)修饰的生物素探针,基于RAA结合CRISPR/Cas12a系统,开发出一种新型荧光增强免疫层析试纸条,当存在靶DNA时,RAA产生的扩增产物激活Cas12a的反式切割活性,使得体系中的生物素-核酸探针被降解,无法和T线上的捕获探针形成互补,T线上没有荧光信号;反之,当没有靶DNA时,生物素-核酸探针和T线上的捕获探针形成互补,再通过链霉亲和素和生物素作用将量子点截留在T线产生荧光信号,所研制的试纸条对金黄色葡萄球菌基因组DNA的检测限低至75 amol/L,对培养液中金黄色葡萄球菌的检测限为5.4×102 CFU/mL,实现金黄色葡萄球菌的快速高效检测。
和Cas12和Cas13蛋白反式切割活性不同,CRISPR/Cas9系统是由RNA引导的内切酶,通过顺式切割完成对靶序列的识别及切割,且Cas9蛋白的脱靶率低、细胞毒性低、靶向能力更强[66]。Wang等[67]以CRISPR/Cas9系统被特异性靶标识别激活后产生的非靶向单链作为探针杂交的模板,设计和构建了一种新的金标核酸试纸条技术,实现1 h内对靶基因高灵敏、高特异的裸眼可视化检测。如图9b所示,该检测方法首先设计并制备了两种AuNP-DNA探针,其DNA序列包含一个标记区、一个核酸杂交区和一个信号探针杂交区。使用生物素化引物对基因组样品进行RPA扩增,将生物素化的扩增产物与Cas9/sgRNA1短暂孵育结合,当有靶标DNA存在时,生成的生物素化扩增产物-Cas9/sgRNA1复合物滴加到试纸条上,随着毛细管作用在试纸条上进行迁移,当到达金标结合垫时,和其上标记的AuNP-DNA探针通过核酸杂交形成Cas9/sgRNA1-生物素化扩增产物-AuNP-DNA探针复合物,流经T线时被预先包被的链霉亲和素通过生物素-亲和素作用捕获,T线产生红色色带;多余的AuNP-DNA探针在C线上和预包被的DNA探针杂交而被捕获,C线显色;当不存在靶标DNA时,只有C线显色而T线不显色。相较于普通免疫层析试纸法,CRISPR/Cas9-层析试纸在使用特异性引物进行基因扩增后,采用专门设计的Cas9/sgRNA系统进行二次识别,可以消除扩增反应产生的引物二聚体的干扰,使得CRISPR/Cas9-层析试纸在保持高灵敏度的同时还具有高特异性,几乎不会出现背景信号干扰,因此即使在检测非常低浓度的目标物时,也可以辨别检测结果。
CRISPR/Cas系统同侧流层析技术的结合,呈现出高灵敏度、高特异性的特点,目前检测食源性致病菌主要利用CRISPR/Cas12和CRISPR/Cas9系统,CRISPR/Cas12因其反式切割活性和精确的靶向功能,在CRISPR/Cas-侧流层析试纸中得到广泛应用。CRISPR/Cas9相较于CRISPR/Cas12可以缩短检测步骤,更适合开发多功能的基因检测平台。CRISPR/Cas-侧流层析试纸在核酸诊断领域仍处于初级阶段,还面临许多挑战,如CRISPR/Cas系统均需预先扩增靶标核酸,操作步骤较为繁琐;反式切割活性具有随意性,对实现定量和多重检测的难度较大;现有Cas蛋白大部分依赖于前间隔序列邻近基序序列发挥作用,对靶标序列的选择受到限制等。为解决上述问题,CRISPR/Cas-侧流层析试纸将会通过丰富Cas蛋白种类、结合微流控单细胞富集等技术来提高其自动化程度,朝着更加智能化、便携化发展。
4. 结论
食源性致病菌是引发食源性疾病的重要原因,控制食源性致病菌、保障食品安全离不开快速检测技术的发展。基于核酸扩增的检测技术在食源性致病菌检测中发挥着重要作用。PCR仍是目前食源性致病菌检测中最成熟的技术,等温核酸扩增技术在微生物检测中日趋成熟,弥补了PCR对应用场景和仪器的依赖,具有检测快速、灵敏、便捷等特点,尤其适合在基层或偏远地区进行现场快速检测,是食源性致病菌核酸检测领域发展的主要方向。但和PCR相比,等温核酸扩增引物设计复杂、难度大,缺乏相应的设计软件,需要筛选优化合理引物,且更容易因气溶胶污染导致出现假阳性结果,检测灵敏度和荧光定量PCR相比仍有一定差距。等温核酸扩增与CRISPR/Cas系统结合可实现检测信号二次放大,有效提升检测灵敏度,在食源性致病菌快速检测方面得到了一些应用,但主要针对单一致病菌,需要和多重核酸扩增技术、多重层析试纸技术结合来提高检测通量,实现多目标联合检测。
基于核酸扩增-侧流层析试纸的食源性致病菌检测方法,以核酸杂交为识别机理,利用标记物与其抗体特异识别和层析作用在试纸条上呈现检测结果,综合了核酸检测的高灵敏性和层析试纸简单方便的特点,成为食源性致病菌快速检测领域的研究热点。随着科学技术的不断进步与发展,在实际应用驱动下,生物材料、物理科学、化学材料、医学诊断等多学科融合交叉发展,综合利用免疫识别、核酸扩增、纳米材料信号放大等方法,核酸扩增-层析试纸检测食源性致病菌将会向更灵敏、更便利、多元化、高通量检测的方向不断提升与完善,推动食源性致病菌可视化现场检测的进一步发展。
-
-
[1] 张偲偲, 刘兴泉, 杨媚婷, 等. 食源性致病菌现场即时检测技术研究进展[J]. 分析化学,2021,49(10):1631−1639. [ZHANG S S, LIU X Q, YANG M T, et al. Recent advances in point-of-care diagnosis for foodborne pathogens[J]. Analytical Chemistry,2021,49(10):1631−1639.] ZHANG S S, LIU X Q, YANG M T, et al . Recent advances in point-of-care diagnosis for foodborne pathogens[J]. Analytical Chemistry,2021 ,49 (10 ):1631 −1639 .[2] 凌超. 食源性致病菌检测分析技术的研究进展[J]. 食品安全导刊, 2019(26):22−23. [LING C. Research progress on detection and analysis technology of foodborne pathogens [J]. China Food Safety Magazine 2019(26):22−23.] LING C. Research progress on detection and analysis technology of foodborne pathogens [J]. China Food Safety Magazine 2019(26): 22−23.
[3] 李其美, 周邦荫, 颜李秀. PCR技术在食品检测中的应用[J]. 食品科技,2021(27):128−129. [LI Q M, ZHOU B M, YAN L X. Application of PCR in food detection[J]. Food Science and Technology,2021(27):128−129.] LI Q M, ZHOU B M, YAN L X . Application of PCR in food detection[J]. Food Science and Technology,2021 (27 ):128 −129 .[4] 贾方芳, 张自强, 张倩文, 等. 兔源性沙门氏菌PCR检测方法的建立[J]. 中国养兔杂志,2023,253(1):10−13. [JIA F F, ZHANG Z Q, ZHANG Q W, et al. Establishment of PCR detection method for rabbit Salmonella[J]. Chinese Journal of Rabbit Farming,2023,253(1):10−13.] JIA F F, ZHANG Z Q, ZHANG Q W, et al . Establishment of PCR detection method for rabbit Salmonella[J]. Chinese Journal of Rabbit Farming,2023 ,253 (1 ):10 −13 .[5] 王仕成. 奶牛乳房炎四种主要致病菌多重PCR检测方法的建立与应用[D]. 呼和浩特:内蒙古农业大学, 2020. [WANG S C. Multiplex PCR assay for detecting four major mastitis-causing pathogens in milk[D]. Hohhot:Inner Mongolia Agricultural University, 2020.] WANG S C. Multiplex PCR assay for detecting four major mastitis-causing pathogens in milk[D]. Hohhot: Inner Mongolia Agricultural University, 2020.
[6] 陈秀琴, 林甦, 郑敏, 等. 生鲜肉中3种食源性致病菌Taqman多重荧光定量PCR检测方法的建立[J]. 福建畜牧兽医,2021,43(3):22−26. [CHEN X Q, LIN S, ZHENG M, et al. Establishment of a multiplex Taqman real-time PCR assay for the simultaneous detection of three foodborne pathogens in fresh meat[J]. Journal of Animal Husbandry and Veterinary Medicine Fujian,2021,43(3):22−26.] doi: 10.3969/j.issn.1003-4331.2021.03.008 CHEN X Q, LIN S, ZHENG M, et al . Establishment of a multiplex Taqman real-time PCR assay for the simultaneous detection of three foodborne pathogens in fresh meat[J]. Journal of Animal Husbandry and Veterinary Medicine Fujian,2021 ,43 (3 ):22 −26 . doi: 10.3969/j.issn.1003-4331.2021.03.008[7] SN/T 5439.1-2022 出口食品中食源性致病菌快速检测方法 PCR-试纸条法 第1部分:沙门氏菌[S]. 北京:中华人民共和国海关总署, 2022. [SN/T 5439.1-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 1:Salmonella[S]. Beijing:General Administration of Customs of the People’s Republic of China, 2022.] SN/T 5439.1-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 1: Salmonella[S]. Beijing: General Administration of Customs of the People’s Republic of China, 2022.
[8] SN/T 5439.2-2022 出口食品中食源性致病菌快速检测方法 PCR-试纸条法 第2部分:金黄色葡萄球菌[S]. 北京:中华人民共和国海关总署, 2022. [SN/T 5439.2-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 2:Staphylococcus aureus[S]. Beijing:General Administration of Customs of the People’s Republic of China, 2022.] SN/T 5439.2-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 2: Staphylococcus aureus[S]. Beijing: General Administration of Customs of the People’s Republic of China, 2022.
[9] SN/T 5439.3-2022 出口食品中食源性致病菌快速检测方法 PCR-试纸条法 第3部分:副溶血性弧菌[S]. 北京:中华人民共和国海关总署, 2022. [SN/T 5439.3-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 3:Vibrio parahaemolyticus[S]. Beijing:General Administration of Customs of the People’s Republic of China, 2022.] SN/T 5439.3-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 3: Vibrio parahaemolyticus[S]. Beijing: General Administration of Customs of the People’s Republic of China, 2022.
[10] SN/T 5439.4-2022 出口食品中食源性致病菌快速检测方法 PCR-试纸条法 第4部分:克罗诺杆菌[S]. 北京:中华人民共和国海关总署, 2022. [SN/T 5439.4-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 4:Clostridium spp[S]. Beijing:General Administration of Customs of the People’s Republic of China, 2022.] SN/T 5439.4-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 4: Clostridium spp[S]. Beijing: General Administration of Customs of the People’s Republic of China, 2022.
[11] SN/T 5439.5-2022出口食品中食源性致病菌快速检测方法 PCR试纸条法 第5部分:产志贺毒素大肠埃希氏菌及大肠埃希氏菌[S]. 北京:中华人民共和国海关总署, 2022. [SN/T 5439.5-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 5:Shiga toxin-producing Escherichia coli and Escherichia coli[S]. Beijing:General Administration of Customs of the People’s Republic of China, 2022.] SN/T 5439.5-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 5: Shiga toxin-producing Escherichia coli and Escherichia coli[S]. Beijing: General Administration of Customs of the People’s Republic of China, 2022.
[12] SN/T 5439.6-2022 出口食品中食源性致病菌快速检测方法 PCR-试纸条法 第6部分:空肠弯曲菌[S]. 北京:中华人民共和国海关总署, 2022. [SN/T 5439.6-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 6:Campylobacter jejuni[S]. Beijing:General Administration of Customs of the People’s Republic of China, 2022.] SN/T 5439.6-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 6: Campylobacter jejuni[S]. Beijing: General Administration of Customs of the People’s Republic of China, 2022.
[13] SN/T 5439.7-2022 出口食品中食源性致病菌快速检测方法 PCR-试纸条法 第7部分:单核细胞增生李斯特氏菌[S]. 北京:中华人民共和国海关总署, 2022. [SN/T 5439.7-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 7:Listeria monocytogenes[S]. Beijing:General Administration of Customs of the People’s Republic of China, 2022.] SN/T 5439.7-2022 Method for rapid detection of foodborne pathogens in export food-PCR-test strip method Part 7: Listeria monocytogenes[S]. Beijing: General Administration of Customs of the People’s Republic of China, 2022.
[14] RAY M, ACHARY K G, NAYAK S, et al. Development of a colloidal gold strip-based immol/lunochromatographic assay for rapid detection of Fusarium oxysporum in ginger[J]. Journal of the Science of Food and Agriculture,2019,99(14):6155−6166. doi: 10.1002/jsfa.9859
[15] 孙萌, 郜晶, 秦雪怡, 等. 核酸试纸条检测方法研究进展[J]. 中国生物工程杂志,2022,42(12):69−78. [SUN M, GAO J, QIN X Y, et al. Research progress of nucleic acid test strip detection methods[J]. China Biotechnology,2022,42(12):69−78.] SUN M, GAO J, QIN X Y, et al . Research progress of nucleic acid test strip detection methods[J]. China Biotechnology,2022 ,42 (12 ):69 −78 .[16] 刘志科, 杨宁宁, 徐明国, 等. 鸡白痢沙门氏菌胶体金免疫层析快速检测试纸条的研制及初步应用[J]. 河南科技学院学报(自然科学版),2018,46(1):39−48. [LIU Z K, YANG N N, XU M G, et al. Development and primary application of colloidal gold immol/lunochromatography test strip for rapid detection of Salmonella pullorum[J]. Journal of Henan Institute of Science and Technology (Natural Science Edition),2018,46(1):39−48.] doi: 10.3969/j.issn.1008-7516.2018.01.008 LIU Z K, YANG N N, XU M G, et al . Development and primary application of colloidal gold immol/lunochromatography test strip for rapid detection of Salmonella pullorum[J]. Journal of Henan Institute of Science and Technology (Natural Science Edition),2018 ,46 (1 ):39 −48 . doi: 10.3969/j.issn.1008-7516.2018.01.008[17] 陈峥嵘. 犬瘟热病毒AS-PCR核酸试纸条的研究[D]. 武汉:华中农业大学, 2019. [CHEN Z R. Studiy on AS-PCR nucleic acid strip of canine distemper virus[D]. Wuhan:Huazhong Agricultural University, 2019.] CHEN Z R. Studiy on AS-PCR nucleic acid strip of canine distemper virus[D]. Wuhan: Huazhong Agricultural University, 2019.
[18] SINGH R, PAL V, KUMAR M, TRIPATHI N K, et al. Development of a PCR-lateral flow assay for rapid detection of Yersinia pestis, the causative agent of plague[J]. Acta Tropica,2021,220:105958−105964. doi: 10.1016/j.actatropica.2021.105958
[19] 陈诗胜, 张正荣, 任建鸾, 等. 奶牛乳房炎四种致病菌PCR核酸免疫层析试纸条快速检测方法的建立及应用[J]. 中国兽医科学,2020,50(3):283−293. [CHEN S S, ZHANG Z R, REN J L, et al. Establishment and application of PCR nucleic acid immol/lunochromatographic strip for rapid detection of four pathogenic bacteria in dairy cow mastitis[J]. Chinese Veterinary Science,2020,50(3):283−293.] CHEN S S, ZHANG Z R, REN J L, et al . Establishment and application of PCR nucleic acid immol/lunochromatographic strip for rapid detection of four pathogenic bacteria in dairy cow mastitis[J]. Chinese Veterinary Science,2020 ,50 (3 ):283 −293 .[20] NOR A Z, SALWANI H, NORAIN HASLINIE H, et al. The evaluation of a multiplex PCR-DNA dipstick assay with culture method and EZ Typhi carrier DNA assay to detect Salmonella typhi in well water samples[J]. Asian Pacific Journal of Cancer Prevention,2014,4(3):243−252.
[21] 侯巧华. 基于LCR、PCR核酸试纸条检测食源性致病菌方法的研究[D]. 长春:吉林农业大学, 2016. [HOU Q H. The research on detection of food-borne pathogenic bacteria by nucleic acid dipstick assay based on LCR and PCR[D]. Changchun:Jilin Agricultural University, 2016.] HOU Q H. The research on detection of food-borne pathogenic bacteria by nucleic acid dipstick assay based on LCR and PCR[D]. Changchun: Jilin Agricultural University, 2016.
[22] KIM J H, OH S W. A colorimetric lateral flow assay based on multiplex PCR for the rapid detection of viable Escherichia coli O157:H7 and Salmonella typhimurium without enrichment[J]. LWT-Food Science and Technology,2021,152:112242−112247. doi: 10.1016/j.lwt.2021.112242
[23] LEIGH S A, BRANTON S L, EVANS J D, et al. Fluorescent microspheres as a positive indicator in an intratracheal infection model[J]. Journal of Microbiol Methods,2020,172:105886−105892. doi: 10.1016/j.mimet.2020.105886
[24] 滕军. 食品中大肠杆菌O157:H7和空肠弯曲菌快速检测新方法研究[D]. 合肥:合肥工业大学, 2019. [TENG J. Study of novel rapid detection methods of Escherichia coli O157:H7 and Campylobacter jejuni in food[D]. Hefei:Hefei University of Technology, 2019.] TENG J. Study of novel rapid detection methods of Escherichia coli O157: H7 and Campylobacter jejuni in food[D]. Hefei: Hefei University of Technology, 2019.
[25] 冯遥. B族链球菌新型免疫层析检测试纸条研发及性能评价[D]. 广州:广州医科大学, 2019. [FENG Y. Development and performance evaluation of a new immol/Lunochromatographic test strip for group B. streptococcus[D]. Guangzhou:Guangzhou Medical University, 2019.] FENG Y. Development and performance evaluation of a new immol/Lunochromatographic test strip for group B. streptococcus[D]. Guangzhou: Guangzhou Medical University, 2019.
[26] WANG Q, LONG M, LÜ C, et al. Lanthanide-labeled fluorescent-nanoparticle immol/lunochromatographic strips enable rapid and quantitative detection of Escherichia coli O157:H7 in food samples[J]. Food Control,2020,109:106894−106903. doi: 10.1016/j.foodcont.2019.106894
[27] JUNG Y, HEO Y, LEE J J, et al. Smartphone-based lateral flow imaging system for detection of food-borne bacteria E. coli O157:H7[J]. Journal of Microbiological Methods,2019,168:105800−105825.
[28] 王月. 基于PCR核酸修饰技术结合核酸试纸条的鼠伤寒沙门氏菌检测方法研究[D]. 大庆:黑龙江八一农垦大学, 2018. [WANG Y. Detection method of Salmonella typhimurium based on PCR nucleic acid modification technology combined with nucleic acid test strips[D]. Daqing:Heilongjiang Bayi Agricultural University, 2018.] WANG Y. Detection method of Salmonella typhimurium based on PCR nucleic acid modification technology combined with nucleic acid test strips[D]. Daqing: Heilongjiang Bayi Agricultural University, 2018.
[29] 董晶, 卢鑫, 郭威, 等. 等温扩增技术在食源性致病菌检测中的研究进展[J]. 食品与发酵工业,2021,47(8):256−260. [DONG J, LU X, GUO W, et al. Research progress on isothermal amplification technology in the detection of foodborne pathogens[J]. Food and Fermentation Industries,2021,47(8):256−260.] DONG J, LU X, GUO W, et al . Research progress on isothermal amplification technology in the detection of foodborne pathogens[J]. Food and Fermentation Industries,2021 ,47 (8 ):256 −260 .[30] 钟海霞, 周寒嫣, 罗欢, 等. 等温扩增技术在食源性致病菌检测中的研究进展[J]. 食品工业科技,2019,40(7):362−367. [ZHONG H X, ZHOU H Y, LUO H, et al. Research progress of isothermal amplification in the detection of pathogenic bacteria in food[J]. Science and Technology of Food Industry,2019,40(7):362−367.] ZHONG H X, ZHOU H Y, LUO H, et al . Research progress of isothermal amplification in the detection of pathogenic bacteria in food[J]. Science and Technology of Food Industry,2019 ,40 (7 ):362 −367 .[31] 刘巨, 梁涛波, 许恒毅. 滚环扩增介导的核酸信号放大策略在生物传感器中的应用研究进展[J]. 分析测试学报,2020,39(12):1556−1566. [LIU J, LIANG T B, XU H Y. Advance on application of rolling circle amplification-mediated nucleic acid signal amplification strategy in biosensors[J]. Journal of Instrumental Analysis,2020,39(12):1556−1566.] doi: 10.3969/j.issn.1004-4957.2020.12.019 LIU J, LIANG T B, XU H Y . Advance on application of rolling circle amplification-mediated nucleic acid signal amplification strategy in biosensors[J]. Journal of Instrumental Analysis,2020 ,39 (12 ):1556 −1566 . doi: 10.3969/j.issn.1004-4957.2020.12.019[32] 黄梦琦, 李婧姝, 邱孺, 等. 交叉引物恒温扩增技术(CPA)研究进展[J]. 民营科技,2018(9):78−79. [HUANG M Q, LI J S, QIU R, et al. Advances in cross primer isothermal amplification (CPA)[J]. Private technology,2018(9):78−79.] HUANG M Q, LI J S, QIU R, et al . Advances in cross primer isothermal amplification (CPA)[J]. Private technology,2018 (9 ):78 −79 .[33] 姜志勇, 文华康, 渠洋, 等. RPA检测方法研究进展[J]. 海洋与渔业,2022(1):114−115. [JIANG Z Y, WEN H K, QU Y, et al. Research progress of RPA detection methods[J]. Marine Fisheries,2022(1):114−115.] JIANG Z Y, WEN H K, QU Y, et al . Research progress of RPA detection methods[J]. Marine Fisheries,2022 (1 ):114 −115 .[34] 高威芳, 章礼平, 朱鹏. 等温扩增技术及其结合CRISPR在微生物快速检测中的研究进展[J]. 生物技术通报,2020,36(5):22−31. [GAO W F, ZHANG L P, ZHU P. Advances of isothermal amplification technology and its combined CRISPR in rapid microbial detection[J]. Biotechnology Bulletin,2020,36(5):22−31.] GAO W F, ZHANG L P, ZHU P . Advances of isothermal amplification technology and its combined CRISPR in rapid microbial detection[J]. Biotechnology Bulletin,2020 ,36 (5 ):22 −31 .[35] ZHANG Y, FARWIN A, YING J Y. Directly interface microreaction tube and test strip for the detection of Salmonella in food with combined isothermal amplification and lateral flow assay[J]. Food Microbiology,2022,107:104062−104068. doi: 10.1016/j.fm.2022.104062
[36] JIANG Y, CHEN S, ZHAO Y, et al. Multiplex loop-mediated isothermal amplification-based lateral flow dipstick for simultaneous detection of 3 food-borne pathogens in powdered infant formula[J]. Journal of Dairy Science,2020,103(5):4002−4012. doi: 10.3168/jds.2019-17538
[37] WEN Y Y, TAN Y J, ZHAO L C, et al, Rapid on-site detection of viable Escherichia coli O157:H7 in lettuce using immol/lunomagnetic separation combined with PMAxx-LAMP and nucleic acid lateral flow strip [J]. Microchemical Journal, 2022, 178:107348−107357.
[38] 周梦婕, 李小盼, 代荣阳, 等. 免疫层析试纸条检测技术的研究进展[J]. 检验医学与临床,2019,16(22):3382−3386. [ZHOU M J, LI X P, DAI R Y, et al. Research progress of immol/Lunochromatographic test strip detection technology[J]. Laboratory Medicine Clinical,2019,16(22):3382−3386.] doi: 10.3969/j.issn.1672-9455.2019.22.048 ZHOU M J, LI X P, DAI R Y, et al . Research progress of immol/Lunochromatographic test strip detection technology[J]. Laboratory Medicine Clinical,2019 ,16 (22 ):3382 −3386 . doi: 10.3969/j.issn.1672-9455.2019.22.048[39] 袁琳, 陆冬筱, 李金华. 基于纳米酶的比色生物传感器在生物医学检测中的应用[J]. 生物化学与生物物理进展,2023,50(7):1638−1650. [YUAN L, LU D X, LI J H. Application of colorimetric biosensor based on nanozyme in biomedical detection[J]. Progress in Biochemistry and Biophysics,2023,50(7):1638−1650.] YUAN L, LU D X, LI J H . Application of colorimetric biosensor based on nanozyme in biomedical detection[J]. Progress in Biochemistry and Biophysics,2023 ,50 (7 ):1638 −1650 .[40] ZHANG L, CHEN Y, CHENG N, et al. Ultrasensitive detection of viable Enterobacter sakazakii by a continual cascade nanozyme biosensor[J]. Analytical Chemistry,2017,89(19):10194−10200. doi: 10.1021/acs.analchem.7b01266
[41] SHI D L, SHI H. Combining loop-mediated isothermal amplification and nanozyme-strip for ultrasensitive and rapid detection of viable Listeria monocytogenes cells and biofilms[J]. LWT-Food Science and Technology,2022,154:112641−112649. doi: 10.1016/j.lwt.2021.112641
[42] 唐豪, 赵子惠, 张登基, 等. 重组酶聚合酶扩增技术结合胶体金试纸条检测新城疫病毒方法的建立及应用[J]. 中国兽医科学,2023,53(3):298−303. [TANG H, ZHAO Z H, ZHANG D J, et al. Establishment and application of recombinant enzyme polymerase amplification combined with colloidal gold test strip for detection of Newcastle disease virus[J]. Chinese Veterinary Science,2023,53(3):298−303.] TANG H, ZHAO Z H, ZHANG D J, et al . Establishment and application of recombinant enzyme polymerase amplification combined with colloidal gold test strip for detection of Newcastle disease virus[J]. Chinese Veterinary Science,2023 ,53 (3 ):298 −303 .[43] 葛志毅, 周建华, 尚佑军, 等. 一种侧流试纸结合FAM重组酶聚合酶扩增(RPA)诊断布鲁氏菌感染的方法[J]. 中国人兽共患病学报,2019,35(10):905−908. [GE Z Y, ZHOU J H, SHANG Y J, et al. Lateral flow test strips combined with FAM recombinase polymerase amplification (RPA) for the diagnosis of Brucella in fection[J]. Chinese Journal of Veterinary Science,2019,35(10):905−908.] GE Z Y, ZHOU J H, SHANG Y J, et al . Lateral flow test strips combined with FAM recombinase polymerase amplification (RPA) for the diagnosis of Brucella in fection[J]. Chinese Journal of Veterinary Science,2019 ,35 (10 ):905 −908 .[44] FU Q, YUAN L, CAO F, et al. Lateral flow strip biosensor based on streptavidin-coated gold nanoparticles with recombinase polymerase amplification for the quantitative point-of-care testing of Salmonella[J]. Microchemical Journal,2021,171:106859−106867. doi: 10.1016/j.microc.2021.106859
[45] 厉佳丽. 食源性致病菌多重重组酶聚合酶扩增快速检测技术研究[D]. 杭州:中国计量大学, 2020. [LI J L. Study on multiplex recombinase polymerase amplification method for rapid detection of foodborne pathogens[D]. Hangzhou:China Jiliang University, 2020.] LI J L. Study on multiplex recombinase polymerase amplification method for rapid detection of foodborne pathogens[D]. Hangzhou: China Jiliang University, 2020.
[46] 丛秋实, 师东方. 鸡肠炎沙门氏菌可视化交叉引物等温扩增检测技术的建立及初步应用[J]. 中国预防兽医学报,2021,43(11):1171−1177. [CONG Q S, SHI D F. Establishment and preliminary application of visual cross-primer isothermal amplification detection technology for Salmonella enteritidis in chickens[J]. Chinese Journal of Preventive Veterinary Medicine,2021,43(11):1171−1177.] doi: 10.3969/j.issn.1008-0589.202105023 CONG Q S, SHI D F . Establishment and preliminary application of visual cross-primer isothermal amplification detection technology for Salmonella enteritidis in chickens[J]. Chinese Journal of Preventive Veterinary Medicine,2021 ,43 (11 ):1171 −1177 . doi: 10.3969/j.issn.1008-0589.202105023[47] 白志军, 胡林, 李魁彪, 等. 交叉引物恒温扩增法检测甲型H1N1流感病毒及临床应用[J]. 中国人兽共患病学报,2015,31(3):208−211,215. [BAI Z J, HU L, LI K B, et al. Establishment of cross priming amplification for influenza a virus (H1N1) and its clinical application[J]. Chinese Journal of Veterinary Science,2015,31(3):208−211,215.] doi: 10.3969/cjz.j.issn.1002-2694.2015.03.004 BAI Z J, HU L, LI K B, et al . Establishment of cross priming amplification for influenza a virus (H1N1) and its clinical application[J]. Chinese Journal of Veterinary Science,2015 ,31 (3 ):208 −211,215 . doi: 10.3969/cjz.j.issn.1002-2694.2015.03.004[48] 王伟. 基于交叉引物等温扩增结合胶体金免疫层析试纸卡快速鉴别鸽子雌雄的方法建立[D]. 新乡:河南科技学院, 2022. [WANG W. Novel approach to rapidly identify the gender of the pigeon by using cross-priming amplification with immunochromatographic strip[D]. Xinxiang:Henan University of Science and Technology, 2022.] WANG W. Novel approach to rapidly identify the gender of the pigeon by using cross-priming amplification with immunochromatographic strip[D]. Xinxiang: Henan University of Science and Technology, 2022.
[49] 向勇. 种禽场铜绿假单胞菌的流行特点及其CPA检测方法的建立[D]. 广州:华南农业大学, 2019. [XIANG Y. Epidemiological investigation of Peudomonas aeruginosa in breeding poultry field and rapid detection of PA by cross priming amplification[D]. Guangzhou:South China Agricultural University, 2019.] XIANG Y. Epidemiological investigation of Peudomonas aeruginosa in breeding poultry field and rapid detection of PA by cross priming amplification[D]. Guangzhou: South China Agricultural University, 2019.
[50] WANG Y X, ZHANG A Y, YANG Y Q, et al. Sensitive and rapid detection of Salmonella enterica serovar Indiana by cross priming amplification[J]. Journal of Microbiological Methods,2018(153):24−30.
[51] 刘敏. 交叉引物等温扩增-核酸试纸条技术检测蜡样芽孢杆菌[J]. 食品安全导刊,2018(33):185−186. [LIU M. Detection of Bacillus cereus by cross-primer isothermal amplification-nucleic acid test strip technology[J]. Chinese Food Safety Magazine,2018(33):185−186.] LIU M . Detection of Bacillus cereus by cross-primer isothermal amplification-nucleic acid test strip technology[J]. Chinese Food Safety Magazine,2018 (33 ):185 −186 .[52] 王冲, 宋亚宁, 梁煜, 等. 滚环扩增技术在食品安全检测中的研究进展[J]. 食品安全质量检测学报,2021,12(2):423−429. [WANG C, SONG Y N, LIANG Y, et al. Progress of rolling amplification amplification in food safety detection[J]. Journal of Food Safety and Food Quality,2021,12(2):423−429.] WANG C, SONG Y N, LIANG Y, et al . Progress of rolling amplification amplification in food safety detection[J]. Journal of Food Safety and Food Quality,2021 ,12 (2 ):423 −429 .[53] QIN Y, ZHANG C, LIU F, et al. Establishment of double probes rolling circle amplification combined with lateral flow dipstick for rapid detection of Chattonella marina[J]. Harmful Algae,2020,97:101857−101867. doi: 10.1016/j.hal.2020.101857
[54] LIU F, ZHANG C, ZHENG H, et al. Rapid and sensitive detection of Karlodinium veneficum by a novel double-nick rolling circle amplification[J]. Environmental Science and Pollution Research,2021,28(31):42570−42582. doi: 10.1007/s11356-021-13673-4
[55] 黄梦琪, 刘芳, 周小明. 基于滚环扩增技术的纸基显色传感器用于致病菌快速检测[J]. 激光生物学报,2017,26(6):527−533. [HUNG M Q, LIU F, ZHOU X M. Rapid and isothermal paper-based gene-sensing of viable pathogens with rolling circle amplification[J]. Acta Laser Biology Sinica,2017,26(6):527−533.] doi: 10.3969/j.issn.1007-7146.2017.06.009 HUNG M Q, LIU F, ZHOU X M . Rapid and isothermal paper-based gene-sensing of viable pathogens with rolling circle amplification[J]. Acta Laser Biology Sinica,2017 ,26 (6 ):527 −533 . doi: 10.3969/j.issn.1007-7146.2017.06.009[56] 刘迪, 滕新栋, 闫吉辉. 解旋酶依赖性扩增技术研究进展[J]. 口岸卫生控制,2022,27(1):44−47. [LIU D, TENG X D, YAN J H. Research progress of helicase-dependent amplification technology[J]. Port Health Control,2022,27(1):44−47.] doi: 10.3969/j.issn.1008-5777.2022.01.011 LIU D, TENG X D, YAN J H . Research progress of helicase-dependent amplification technology[J]. Port Health Control,2022 ,27 (1 ):44 −47 . doi: 10.3969/j.issn.1008-5777.2022.01.011[57] 张培培, 吴洋, 王玲, 等. 设计特定序列的引物提高依赖解旋酶恒温扩增效率[J]. 中国生物化学与分子生物学报,2018,34(7):747−753. [ZHANG P P, WU Y, WANG L, et al. Primers with designed terminal sequence improved efficiency of helicase-dependent DNA amplification[J]. Chinese Journal of Biochemistry Molecular Biology,2018,34(7):747−753.] ZHANG P P, WU Y, WANG L, et al . Primers with designed terminal sequence improved efficiency of helicase-dependent DNA amplification[J]. Chinese Journal of Biochemistry Molecular Biology,2018 ,34 (7 ):747 −753 .[58] MOON Y J, LEE S Y, OH S W. A review of isothermal amplification methods and food-origin inhibitors against detecting food-borne pathogens[J]. Foods,2022,11(3):322−337. doi: 10.3390/foods11030322
[59] 王赞, 李献, 王慧, 等. 发酵乳中沙门氏菌依赖解旋酶恒温基因扩增快速检测方法的建立[J]. 乳业科学与技术,2021,44(4):6−10. [WANG Z, LI X, WANG H, et al. Helicase-dependent isothermal DNA amplification for rapid detection of Salmonella in fermented milk[J]. Journal of Dairy Science Technology,2021,44(4):6−10.] WANG Z, LI X, WANG H, et al . Helicase-dependent isothermal DNA amplification for rapid detection of Salmonella in fermented milk[J]. Journal of Dairy Science Technology,2021 ,44 (4 ):6 −10 .[60] DU X J, ZHOU T J, LI P, et al. A rapid Salmonella detection method involving thermophilic helicase-dependent amplification and a lateral flow assay[J]. Molecular and Cellular Probes,2017(5):4−36.
[61] 黄璐琦, 孙旭飞, 苑宁, 等. CRISPR/Cas生物传感器检测食源性病原体的研究进展[J]. 中国食品学报,2022,22(10):378−390. [HUANG L Q, SUN X F, YUAN N, et al. Research progress of CRISPR/Cas biosensor for detection of foodborne pathogens[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(10):378−390.] HUANG L Q, SUN X F, YUAN N, et al . Research progress of CRISPR/Cas biosensor for detection of foodborne pathogens[J]. Journal of Chinese Institute of Food Science and Technology,2022 ,22 (10 ):378 −390 .[62] 卜祥逢, 蒋静, 薛俊欣, 等. CRISPR-Cas12a在食源性致病菌检测中的应用[J]. 食品安全质量检测学报,2022,13(14):4479−4486. [BU X F, JIANG J, XUE J X, et al. Application of CRISPR-Cas12a in detection of foodborne pathogens[J]. Journal of Food Safety and Quality,2022,13(14):4479−4486.] doi: 10.3969/j.issn.2095-0381.2022.14.spaqzljcjs202214009 BU X F, JIANG J, XUE J X, et al . Application of CRISPR-Cas12a in detection of foodborne pathogens[J]. Journal of Food Safety and Quality,2022 ,13 (14 ):4479 −4486 . doi: 10.3969/j.issn.2095-0381.2022.14.spaqzljcjs202214009[63] 寇秀颖, 周宝青, 陈玲, 等. CRISPR/Cas系统在食源性致病菌快速检测新技术的研究进展[J]. 食品科学,2023,44(7):313−323. [KOU X Y, ZHOU B Q, CHEN L, et al. Research progress of CRISPR/Cas system in rapid detection of foodborne pathogens[J]. Food Science,2023,44(7):313−323.] doi: 10.7506/spkx1002-6630-20220316-195 KOU X Y, ZHOU B Q, CHEN L, et al . Research progress of CRISPR/Cas system in rapid detection of foodborne pathogens[J]. Food Science,2023 ,44 (7 ):313 −323 . doi: 10.7506/spkx1002-6630-20220316-195[64] MUKAMA O, WU J H, LI Z Y, et al. An ultra-sensitive and specific point-of-care CRISPR/Cas12 based lateral flow biosensor for the rapid detection of nucleic acids[J]. Biosensors and Bioelectronics,2020,159:112143. doi: 10.1016/j.bios.2020.112143
[65] ZHOU B Q, YE Q H, LI F, et al. CRISPR/Cas12a based fluorescence enhanced lateral flow biosensor for detection of Staphylococcus aureus[J]. Sensors and Actuators B-chemical,2022,351:130906−130916. doi: 10.1016/j.snb.2021.130906
[66] 余咏诗, 刘辉. CRISPR-Cas9技术修饰乳酸杆菌的研究进展[J]. 食品工业科技,2022,43(21):461−470. [YU Y H, LIU H. Research progress on CRISPR-Cas9 technology to modify lactobacillus[J]. Science and Technology of Food Industry,2022,43(21):461−470.] YU Y H, LIU H . Research progress on CRISPR-Cas9 technology to modify lactobacillus[J]. Science and Technology of Food Industry,2022 ,43 (21 ):461 −470 .[67] WANG X, XIONG E, TIAN T, et al. Clustered regularly interspaced short palindromic repeats/Cas9-mediated lateral flow nucleic acid assay[J]. ACS Nano,2020,14(2):2497−2508. doi: 10.1021/acsnano.0c00022
-
期刊类型引用(1)
1. 周双,梅雪娜,王少伟,杨红梅,于京华,张彦. 基于纳米酶的纸基比色传感器在即时检测领域的应用研究进展. 化学学报. 2025(02): 170-183 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



