Effect of Ultrasound Treatment on Structural and Physicochemical Properties of Emodin-Casein Complexes
-
摘要: 大黄素是一种天然疏水性物质,常通过一定的基质负载以提高其水溶性和生物利用度。本文以酪蛋白胶束为载体,通过超声技术(频率20 kHz,振幅30%)制备了大黄素-酪蛋白复合物微胶囊,采用荧光光谱、红外光谱、扫描电镜技术表征了复合物的结构;分析了复合物的热分解特性和抗氧化特性,并评估了模拟胃肠消化过程中复合物中大黄素的释放特性。结果表明,当大黄素添加量为8~10 μg/mg时,1~3 min超声处理对复合物荧光值影响不大。另外,超声处理对复合物的红外光谱及表面形貌影响不大。然而,同一大黄素添加量下,超声1 min时大黄素-酪蛋白复合物的DPPH自由基清除活性最低,但其ABTS+自由基清除活性最高。而且,1 min超声处理改善了复合物中大黄素的释放速率,5 min超声处理后复合物中大黄素的释放率最低。研究结果可为超声处理技术在大黄素-酪蛋白复合物结构及性能调控中的应用提供参考依据。Abstract: Emodin was one of the hydrophobic active molecules, the solubility bioavailability of which was improved by loading in a certain matrix. In this study, the microcapsules of emodin-casein complexes were prepared with casein as matrix with ultrasound treatment. The structural properties of the complexes were analyzed by fluorescence spectroscopy, Fourier transform infrared spectroscopy, scanning electron microscopy. The thermal properties, DPPH and ABTS+ free radical scavenging activities of the complexes were measured. In addition, the release profiles of emodin from the complexes were evaluated by simulated gastrointestinal digestion experiment. The results showed that the ultrasound treatment within 1~3 min duration had not significant effect on the fluorescence properties of the complexes with the addition of emodin at 8~10 μg/mg. Furthermore, there were no significant effect of ultrasound treatment on the FTIR spectra and morphology of emodin-casein complexes. In addition, the DPPH free radical scavenging activity of the complexes had the lowest value with 1 min-ultrasound treatment, but the highest value of ABTS+ free radical scavenging activity among other samples with the same emodin addition. The release rate of emodin from the emodin-casein complexes during simulated gastrointestinal digestion was improved by 1 min-ultrasound treatment, but retarded by 5 min-ultrasound treatment. The results would provide references for the application of ultrasound treatment in the properties' regulation of emodin-casein complexes.
-
Keywords:
- emodin /
- casein micelle /
- ultrasound treatment /
- morphology /
- digestion
-
大黄素(Emodin,E)是蒽醌类化合物,是廖科植物中的常见成分,也是我国传统中草药大黄的主要活性成分[1]。研究表明,大黄素具有抗氧化、抑菌、抗炎的功效[2−5]。但是,大黄素是疏水性物质,水溶性差,生物利用度较低,因而在制药行业的应用受到限制[6]。近年来,为了改善疏水性活性分子的水溶性和生物利用度,常以大分子为基质,通过非共价作用将活性分子负载,进而制成微胶囊、乳液、凝胶等制剂。其中,微胶囊因制备工艺简单而备受关注[6]。蛋白质为天然大分子,营养价值高,且可通过非共价作用自发结合活性小分子,是活性分子载体常见基质;其中,乳蛋白因来源广泛而成为研究热点。活性小分子与乳蛋白间易于形成非共价作用,如大黄素与β-乳球蛋白之间以静电作用力自发结合,大黄酸和大黄酚与β-乳球蛋白均以疏水性相互作用自发结合[7]。
酪蛋白胶束(Micellar casein,MC)是牛乳中酪蛋白的天然存在形态,是一种纳米级超分子聚集体,其结构独特,具有疏水内部和亲水表面[8]。研究发现,酪蛋白胶束对多种活性分子具有较高的亲和力,与黑米花色苷通过范德华力、氢键结合,二者结合常数为5.394×104 L/mol[9];与紫薯花色苷通过范德华力、氢键相互作用结合,结合常数高达105 L/mol[10]。本团队前期研究发现,酪蛋白胶束与咖啡酸、咖啡酸苯乙酯均可通过疏水相互作用结合,形成的复合物热稳定性和DPPH自由基清除活性高于游离活性分子[11]。另外,酪蛋白胶束对大黄素具有较高的亲和力,其结合常数高于103 L/mol[12]。
为了进一步提高蛋白质与活性分子间的相互作用,常采用超声波辅助技术;超声波处理通过空化作用、机械搅拌、微射流等物理作用,不仅可改善蛋白质的结构及性质,而且可促进蛋白质与小分子结合[13−14]。据报道,高强度超声处理改善了乳清蛋白、酪蛋白的溶解度[15−16]。本团队前期研究发现,超声波处理改善了酪蛋白胶束的溶解性和消化性,且改善作用与超声波处理时间有关[17]。有文献指出,超声波预处理改变了大豆分离蛋白的空间结构,增加了其在pH12下与儿茶素的结合量,且复合物的溶解度、起泡性、泡沫稳定性及抗氧化能力均有所增加[13]。可见,超声处理对蛋白质与活性分子复合物的性质具有一定的影响。然而,超声处理对大黄素-酪蛋白复合物的结构及性质的影响研究鲜有报道。
本文以酪蛋白胶束为载体,在超声波处理下制备大黄素-酪蛋白复合物,分析复合物结构、形貌及热分解特性,解析超声波处理对复合物抗氧化性和胃肠模拟消化性的影响规律。以期为超声波技术在大黄素-酪蛋白复合物制备中的应用提供参考依据。
1. 材料与方法
1.1 材料与仪器
酪蛋白胶束 实验室自制,蛋白质含量为82.77%±1.32%(质量分数);大黄素、胃蛋白酶(1500 U/mg)、胰蛋白酶(>2500 U/mg)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH) 购自上海麦克林生化科技有限公司;其他试剂均为分析纯。
UV-1780双光束紫外可见分光光度计 岛津仪器公司;NAI-GZJ型实验室小型喷雾干燥机 上海那艾精密仪器有限公司;RF-5301PC荧光分光光度计、S-3400N扫描电子显微镜 日本日立仪器有限责任公司;Nicolet iS50型FTIR光谱仪 美国赛默飞世尔科学公司;STA 449 F5型TG-DSC热分析仪 德国耐驰仪器制造有限公司;SFX550超声处理仪(20 kHz,探头直径12.7 mm) 美国布兰森超声波公司。
1.2 实验方法
1.2.1 大黄素-酪蛋白复合物的制备
称取适量酪蛋白胶束,加入适量pH6.8浓度为0.05 moL/L的磷酸盐缓冲液,在37 ℃恒温水浴中磁力搅拌,制得终浓度为20 g/L的酪蛋白胶束溶液,冷藏备用。准确称取一定质量的大黄素,加入无水乙醇,将溶液在涡旋仪上震荡5 min,制得终浓度为2 mg/mL的大黄素溶液,避光保存。
取100 mL酪蛋白胶束溶液,并按一定比例加入大黄素溶液,制备大黄素与酪蛋白胶束质量比分别为0、4、8、10 μg/mg的混合液;其中大黄素浓度为0 μg/mg的样品为对照组。将混合液涡旋混匀1 min后置于25 ℃水浴中,将超声波探头置于样品中心处,分别超声处理0、1、2、3、4、5 min,超声振幅为30%、脉冲开启时间5 s、关闭时间1 s,即得超声处理后的大黄素-酪蛋白复合物。
将超声处理后的复合物样品进行喷雾干燥,进口温度为130 ℃,雾化压力0.1 MPa,固定撞针间隔时间1 s,撞针执行时间1 s,物料流量为200 mL/h,获得大黄素-酪蛋白复合物微胶囊粉末。
1.2.2 荧光光谱分析
准确称取适量样品粉末,溶于去离子水,配成2 mg/mL的溶液;参考本团队前期研究方法[11],采用荧光分光光度计在室温下测定上述复合物的荧光光谱,激发波长设定为280 nm,发射光谱采集范围为290~700 nm,激发波长与发射波长狭缝均为5 nm。
1.2.3 FTIR分析
将复合物粉末置于ATR元件,通过FTIR仪测定其红外光谱,选择分辨率为4 cm−1,透射模式下扫描500~4000 cm−1之间的红外光谱。
1.2.4 热重及差示扫描量热(TG-DSC)分析
参照Qin等[11]的方法,准确称取4~6 mg样品,以同规格空坩埚作为参比,测定复合物在25~500 ℃区间内热稳定性,升温速率5 ℃/min。
1.2.5 SEM分析
取适量复合物粉末置于铜台上的导电胶条表面,小心涂抹使其分散为薄层,喷金后采用扫描电子显微镜观察,电压12.0 kV,放大倍数为500。
1.2.6 抗氧化性分析
1.2.6.1 DPPH自由基清除活性
制备浓度为0.1 mmol/L的DPPH储备液;制备浓度为0.2 mg/mL的复合物样品水溶液。将2 mL DPPH储备液与2 mL复合物溶液均匀混合,室温避光静置20 min,测定混合液在517 nm处吸光度,记为A1;将2 mL无水乙醇与2 mL复合物溶液均匀混合,吸光度记为A2;将2 mL DPPH储备液与2 mL磷酸盐缓冲液均匀混合,吸光度记为A0。DPPH自由基清除能力计算如下[18]:
DPPH自由基清除率(%)=[1−A1−A2A0]×100 (1) 1.2.6.2 ABTS+自由基清除活性
制备7.4 mmol/L的ABTS原液和2.6 mmol/L的过硫酸钾原液,将二者混合均匀并避光保存12 h;用pH7.4的磷酸盐缓冲液稀释至734 nm处吸光度值为0.70±0.02,获得ABTS储备液。将3 mL ABTS储备液与300 μL浓度为2 mg/mL的复合物溶液均匀混合后,室温下于暗室中静置6 min,测定混合液在734 nm处吸光度。ABTS+自由基清除能力计算如下:
ABTS+自由基清除率(%)=(1−AsA0)×100 (2) 式中,A0为ABTS储备液与磷酸盐缓冲液混合后的吸光度;As为ABTS储备液与复合物溶液混合后的吸光度。
1.2.7 体外模拟胃肠消化性分析
取100 mg喷干样品,分散于2.0 mL模拟胃液(由2 g/L NaCl、7 mL HCl和3.2 g/L胃蛋白酶组成,pH为1.2)中,并装入透析袋(1000 Da分子量)中;将透析袋放置在含有75 mL无酶胃液和75 mL无水乙醇组成的混合物的烧杯中,用保鲜膜密封;然后在37 ℃、100 r/min的摇床中孵育2 h。之后将透析袋中溶液pH调至7.5后加入4 mL模拟肠液(由6.8 g/L KH2PO4、10 g/L胰蛋白酶组成,pH为7.5)。将透析袋放置在含有75 mL无酶肠液和75 mL无水乙醇组成的混合物的烧杯中,在37 ℃、100 r/min的摇床中继续孵育22 h。在每个特定时间点收集3 mL透析袋外释放介质,并添加等体积新鲜介质。采用紫外-可见分光光度计在430 nm处测定透析液的吸光值,用同一释放介质中绘制的大黄素标准曲线计算大黄素浓度(y=88.18x−0.0089,R2=0.9992),进而采用下式计算释放率:
释放率(%)=(m/m0)×100 (3) 式中,m为消化液中的大黄素含量,mg;m0为100 mg喷干样品中大黄素含量,mg。
1.3 数据处理
所有数据至少为3次试验结果,数据以均值±标准偏差表示;采用Origin 9.0软件作图;采用SPSS 19.0进行单因素方差分析,数据间差异显著分析采用Duncan法,以P<0.05认为具有显著性差异。
2. 结果与分析
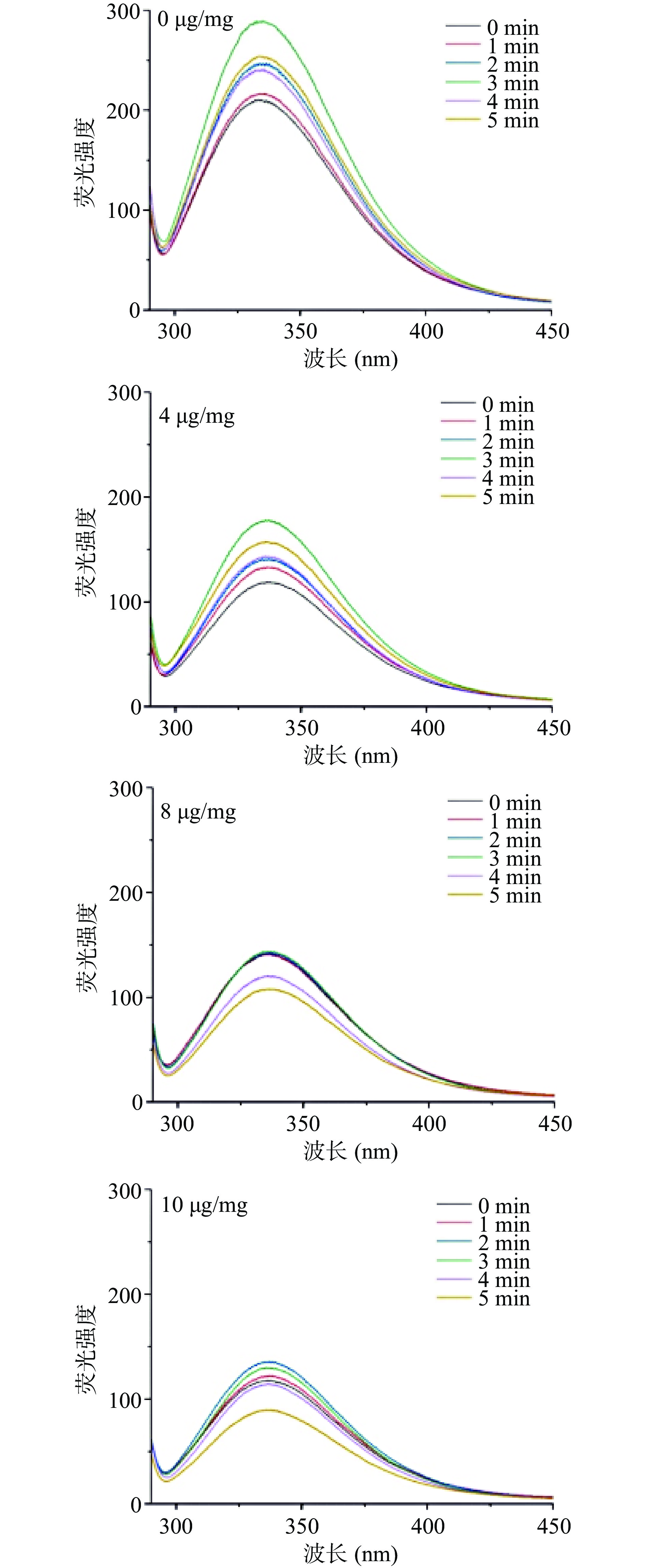
2.1 大黄素-酪蛋白复合物的荧光光谱分析
大黄素-酪蛋白的荧光光谱见图1。由图1可以看出,未添加大黄素的酪蛋白样品最大发射波长为336.8 nm;经过不同时间超声处理后,酪蛋白的最大发射波长没有发生变化。文献[19]指出,当蛋白质的最大发射波长在335~350 nm时,色氨酸处于疏水微环境;最大发射波长在350~353 nm时,色氨酸暴露于亲水性环境中。也就是说,酪蛋白的色氨酸残基处于疏水环境中,且超声处理没有显著改变色氨酸微环境。但是,随着超声处理时间的延长,酪蛋白最大荧光强度先升高再降低,且超声处理后样品的荧光强度均高于未处理样品。这是因为超声波产生的空化作用破坏了酪蛋白聚集体,使其溶解性增强,因此荧光强度增大[14,20]。就单一酪蛋白而言,3 min超声处理的样品荧光值最大,之后有所降低,这可能是因为长时间超声处理导致酪蛋白分子之间、残留的乳清蛋白及其他物质与酪蛋白之间发生结合所致[21]。
加入大黄素后,同一超声处理时间下,大黄素添加量越多,复合物最大荧光强度越低,说明大黄素对酪蛋白荧光产生了猝灭作用,与本团队前期研究结果一致[12],但其最大发射波长未发生明显变化。当大黄素添加量为4 μg/mg(酪蛋白)时,超声处理对样品最大荧光值的影响规律与游离酪蛋白基本一致,表现为3 min处理后复合物荧光值最大,5 min处理后的复合物荧光值次之。然而,当大黄素添加量进一步增加时,5 min超声处理后复合物的荧光值最小,1~3 min超声处理对复合物荧光值影响不大。由此可见,大黄素的添加改变了超声波对酪蛋白的作用。当大黄素添加量较少时,其与酪蛋白结合后对酪蛋白结构影响很小,因此超声处理对酪蛋白荧光值的影响规律与单一酪蛋白基本一致。当大黄素添加量为8~10 μg/mg时,其结合于酪蛋白分子上,改变了酪蛋白分子链组成和分子间相互作用。此外,短时间超声处理增强了大黄素与酪蛋白的结合作用。综上所述,1~3 min超声处理对大黄素-酪蛋白复合物荧光值影响不大。
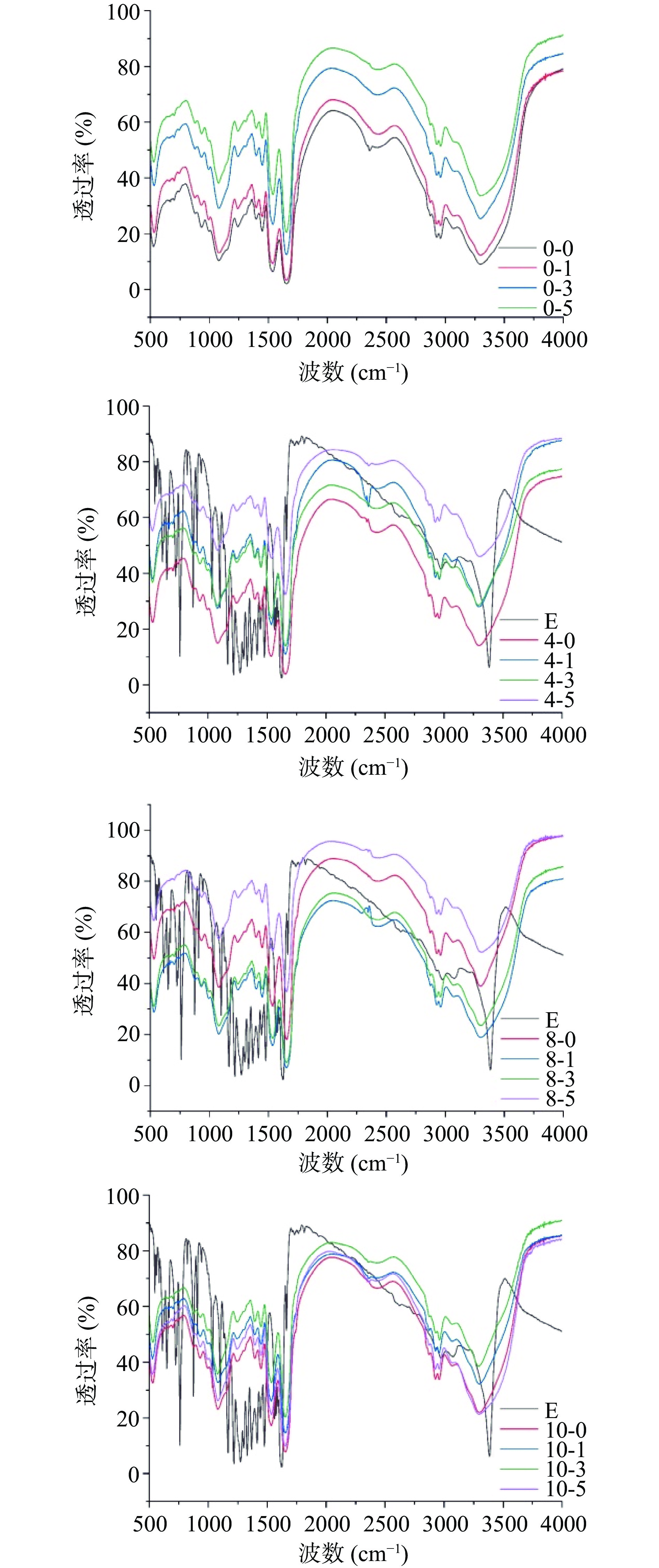
2.2 大黄素-酪蛋白复合物的FTIR分析
大黄素-酪蛋白的红外光谱见图2,其中2 min和4 min超声处理样品红外谱图与其他样品无明显差异,因此以下在讨论中省略。其中,MC的特征吸收峰出现在1634和1520 cm−1,分别对应酰胺Ⅰ带和酰胺Ⅱ带[11]。大黄素红外谱图中,3378 cm−1附近为羟基的伸缩振动吸收峰;2977 cm−1为亚甲基的反对称伸缩振动吸收峰;1618 cm−1为羰基伸缩振动吸收峰;1475 cm−1附近为芳香环骨架伸缩振动、C-H弯曲振动以及C-O伸缩振动[22]。就单一酪蛋白而言,随着超声时间的延长,其红外谱图未发生明显变化,也就是说未产生新的官能团,说明超声处理未引起酪蛋白基团间的化学反应。另外,酪蛋白的酰胺Ⅰ带和酰胺Ⅱ带位置未发生明显变化,说明超声处理未显著改变酪蛋白的空间结构,与荧光光谱分析结果一致。
添加大黄素后,复合物的红外谱图与酪蛋白红外谱图一致,证实了大黄素被包埋在酪蛋白微胶囊内部。本团队前期研究表明,酪蛋白胶束具有较高的结构稳定性,低浓度的葛根素、黄豆苷元等分子结合不会显著改变其结构,且可被包埋于微胶囊内部[23];本文研究结果与该研究结论一致。另外,随着超声时间的延长,大黄素-酪蛋白复合物的红外谱图未发生明显变化,且其酰胺Ⅰ带和Ⅱ带出峰位置未明显改变。也就是说,超声处理不明显改变大黄素-酪蛋白复合物结构。
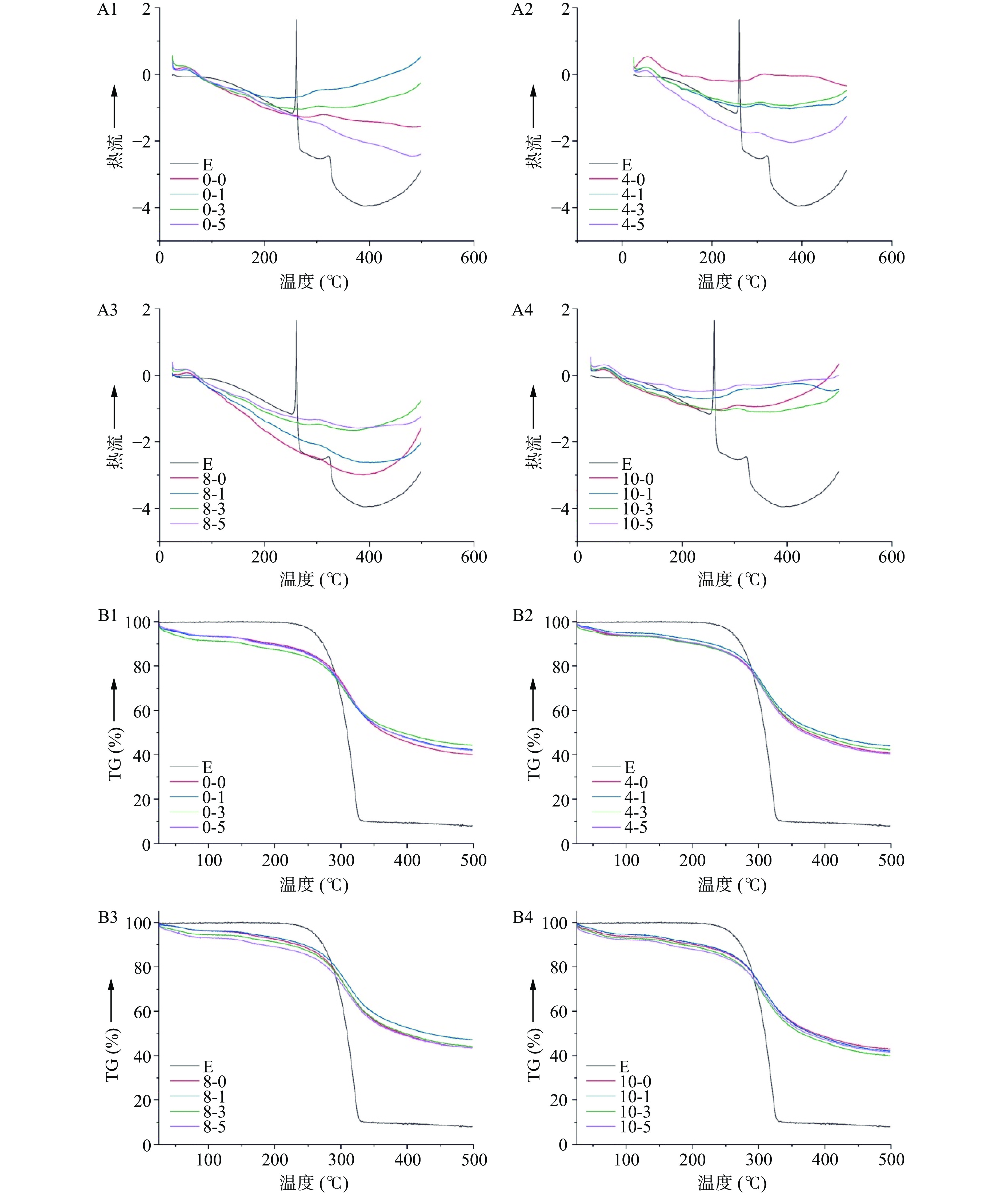
2.3 大黄素-酪蛋白复合物的DSC-TG分析
大黄素-酪蛋白复合物的DSC曲线如图3A所示。由图3A可以看出,游离大黄素在260 ℃出现一个尖锐的吸热峰,为其分解所致。与酪蛋白形成复合物后,大黄素的特征吸热峰消失,复合物表现出与游离酪蛋白相似的DSC特征曲线;其中,在50~100 ℃之间均存在一个明显的吸热峰,这是由于少量水分蒸发所致;在305 ℃附近,复合物出现较小的吸热峰,为蛋白质的热分解峰。就单一酪蛋白而言,超声处理对其DSC曲线改变较为明显。然而,当大黄素添加量达到10 μg/mg时,不同时间超声处理后复合物的DSC曲线较为接近。可见,大黄素的结合削弱了超声波对酪蛋白的作用,这与荧光分析结果一致。
图3B为大黄素-酪蛋白复合物的TG曲线。由图3B可知,大黄素的失重主要出现在240~320 ℃之间,为其热分解所致。酪蛋白表现为持续失重,其最大失重出现在240~320 ℃之间,为其热分解所致,与DSC曲线变化趋势一致。大黄素-酪蛋白复合物的失重曲线与游离酪蛋白一致,说明大黄素的添加不改变酪蛋白的热分解特性,可能是因为其添加量较少。另外,超声处理后各复合物的TG曲线与未处理组基本一致,说明超声处理不改变酪蛋白的失重特性。本团队前期研究发现,超声处理提高了酪蛋白胶束的热变性温度,但不影响其失重曲线,本研究结果与前期研究结果一致[17]。
2.4 大黄素-酪蛋白复合物的形貌分析
采用扫描电镜观察大黄素-酪蛋白复合物的形貌,如图4所示。由图4可以看出,大黄素-酪蛋白复合物与酪蛋白形貌一致,为褶皱葡萄干状,与文献[24]报道一致。就单一酪蛋白而言,3 min超声处理使其粒径趋于均匀,也就说是,3 min超声处理削弱了酪蛋白的聚集;5 min超声样品呈现粒度增大趋势。这与荧光分析结果一致。
与大黄素结合后,复合物粒径较单一酪蛋白粒径小,且粒度更为均匀,可能是因为大黄素与酪蛋白结合后,削弱了溶液中酪蛋白胶束间的聚集作用,从而使其喷干物粒径减小且更加均匀。5 min超声后,大黄素-酪蛋白复合物粒径变得十分均匀。由此可见,超声处理有利于促进大黄素-酪蛋白复合物粒径趋于均匀。文献报道,短时间超声处理降低了酪蛋白粒径,本文与其研究结果一致[16,25]。
2.5 大黄素-酪蛋白复合物的抗氧化性分析
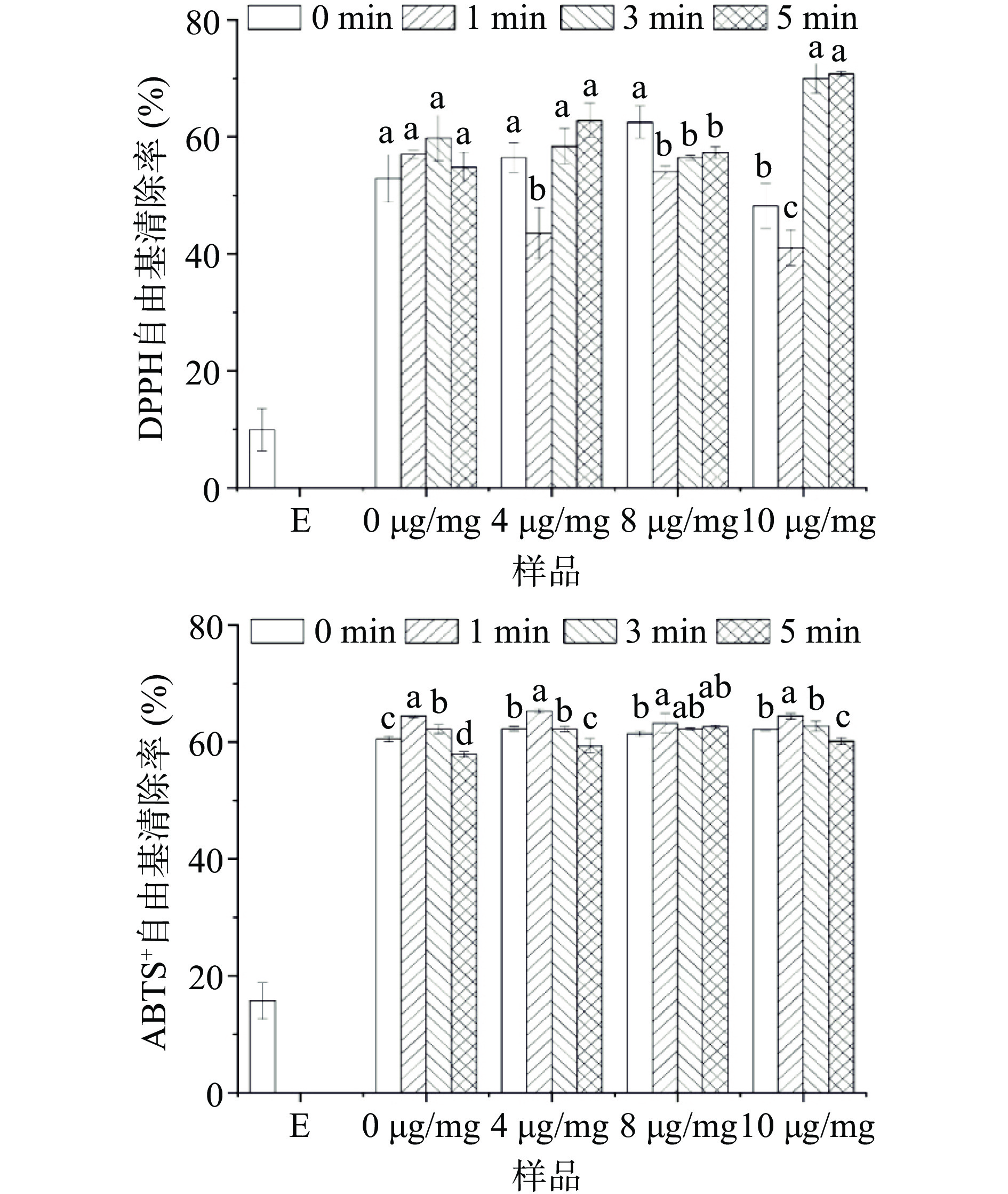
游离大黄素及其与酪蛋白形成的复合物的DPPH、ABTS+自由基清除能力如图5所示。
由图5可以看出,游离大黄素和酪蛋白均具有一定的DPPH自由基清除力。不同时间超声处理对酪蛋白的DPPH自由基清除力影响不显著(P>0.05)。结合大黄素后,复合物的DPPH自由基清除活性与超声时间有关。三种大黄素添加量下,超声1 min后,复合物的DPPH自由基清除活性最低,这可能是因为超声1 min促进了大黄素与酪蛋白的结合,掩蔽了大黄素和酪蛋白的活性基团,从而降低了其自由基清除活性。
当超声时间进一步延长时,复合物的DPPH自由基清除活性有所升高;其中,大黄素添加量为10 μg/mg时,复合物的DPPH自由基清除活性显著升高(P<0.05),这可能是因为长时间超声导致大黄素与酪蛋白结合程度降低,而游离大黄素具有一定的抗氧化性,因此复合体系的抗氧化性升高。
游离大黄素及其与酪蛋白的复合物对ABTS+自由基的清除能力如图5所示。由图可以看出,游离大黄素和酪蛋白均具有一定的ABTS+自由基清除活性,但二者形成的复合物的ABTS+自由基清除活性与单一酪蛋白相当。就单一酪蛋白而言,超声1 min后,其ABTS+自由基清除活性升高,这是因为超声空化作用削弱了酪蛋白的聚集,增加了其溶解性[26]。当超声时间继续延长时,复合物的ABTS+自由基清除活性降低,这可能是超声处理改变了活性基团的微环境,从而使其难以发挥ABTS+自由基清除活性。
综上所述,超声时间对大黄素-酪蛋白复合物的DPPH、ABTS+自由基清除活性具有显著影响。
2.6 大黄素-酪蛋白复合物的体外模拟消化分析
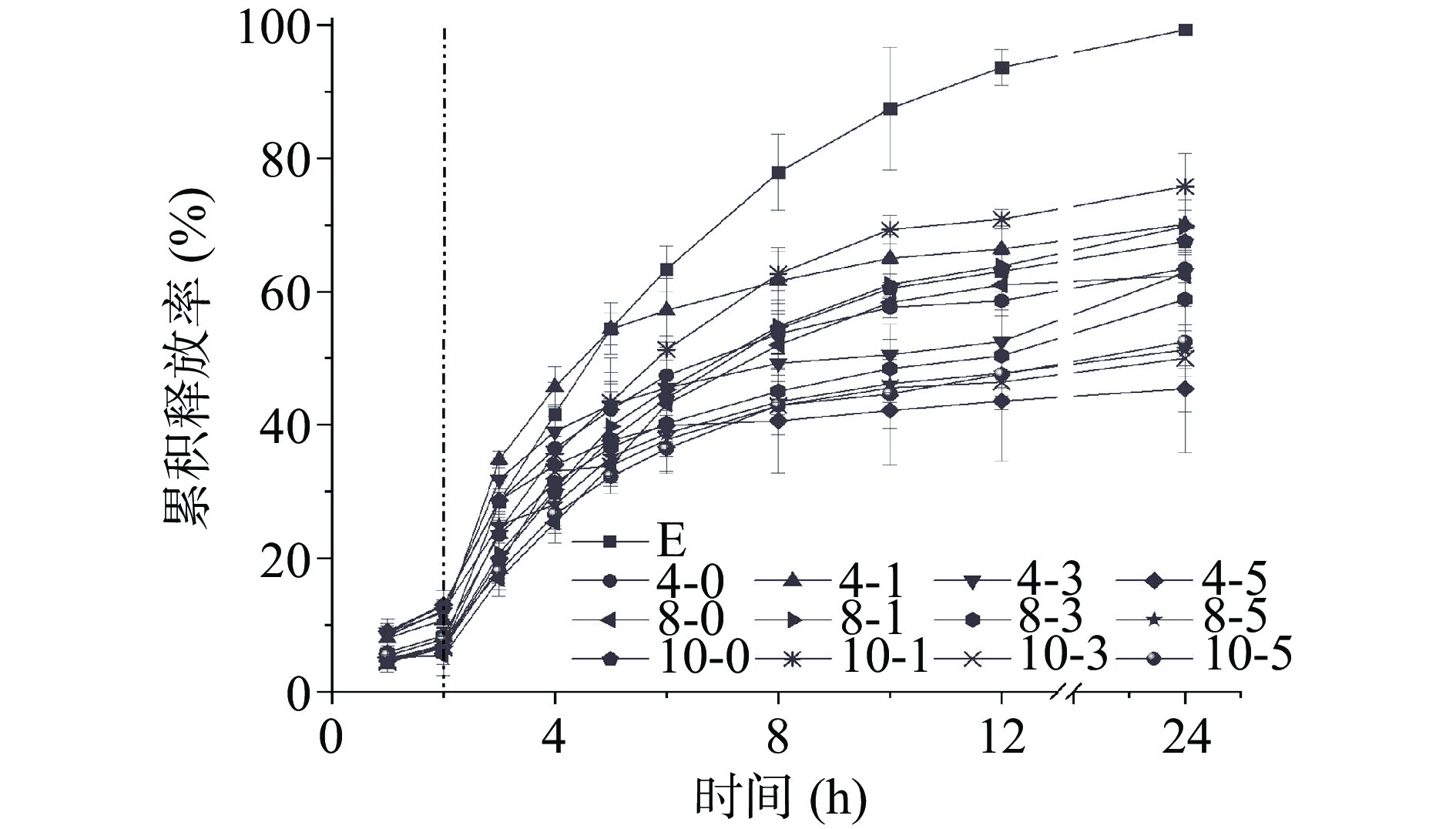
体外模拟消化过程中,游离大黄素的释放曲线如图6所示。由图可以看出,在模拟胃液中,游离大黄素与复合物中的大黄素释放率均较低,2 h累积释放率在10%左右,这是因为复合物在胃液酸性条件下形成沉淀,溶解较慢所致。模拟肠液消化过程中,大黄素添加量为4 μg/mg的复合物超声1 min后,大黄素的4 h累积释放率高于其他样品,这可能是因为短时间超声促进了大黄素与酪蛋白的结合,使大黄素分散性及溶解性变好,且大黄素结合于酪蛋白表面,更易于扩散至透析液中。消化4 h后,游离大黄素的累积释放率高于其他样品,其12 h累积释放率为93.64%±2.68%。
总体而言,肠液消化过程中,大黄素累积释放率与超声时间有关。消化10 h后,超声1 min样品中大黄素的累积释放率最高,其次为未超声样品;而超声5 min样品中大黄素的累积释放率最低。这可能是由于1 min超声削弱了酪蛋白的聚集,增加了大黄素与酪蛋白的结合作用,使得大黄素的分散性和溶解性改善,从而使其释放率增加[26]。超声5 min后,部分大黄素可能进入酪蛋白胶束内部,结合的更为紧密,难以释放;此外,长时间超声可能削弱大黄素与酪蛋白的结合,降低了大黄素的溶解性,使其难以扩散至透析液,具体机理有待进一步深入研究。本团队前期研究发现,酪蛋白结合降低了葛根素和黄豆苷元的模拟消化释放率,本文研究结果与其一致[23]。
3. 结论
以酪蛋白胶束为载体,通过超声处理制备了不同负载量大黄素-酪蛋白复合物微胶囊,系统研究了超声处理时间对复合物结构及性质的影响。荧光分析结果表明,超声处理时间对大黄素-酪蛋白复合物荧光的影响规律与大黄素结合量有关,但其对复合物红外光谱影响不大,且不显著改变复合物的失重特性。1 min超声处理改善了大黄素-酪蛋白复合物的ABTS+自由基清除活性,但削弱了其DPPH自由基清除能力。另外,超声处理时间对大黄素的模拟消化释放率具有影响,其中1 min超声处理改善了复合物中大黄素的释放速率,5 min超声处理后复合物中大黄素的释放率降低。综上所述,适度超声处理不改变大黄素-酪蛋白复合物结构,但有助于改善其抗氧化性,并可实现大黄素-酪蛋白复合物中大黄素的模拟消化释放速率的有效调控。经酪蛋白负载后,大黄素在体内的代谢途径及生物活性仍有待深入研究,以期更好地支撑酪蛋白作为活性分子负载基质的应用价值。
-
-
[1] 刘诚, 郑艳艳, 洪芳, 等. 大黄素衍生物的合成及抗癌活性[J]. 高等学校化学学报,2013,34(6):1408−1415. [LIU Cheng, ZHENG Yanyan, HONG Fang, et al. Synthesis and anticancer activity evaluation of derivatives of emodin[J]. Chemical Journal of Chniese University,2013,34(6):1408−1415.] LIU Cheng, ZHENG Yanyan, HONG Fang, et al . Synthesis and anticancer activity evaluation of derivatives of emodin[J]. Chemical Journal of Chniese University,2013 ,34 (6 ):1408 −1415 .[2] BAE U J, SONG M Y, JANG H Y, et al. Emodin isolated from Rheum palmatum prevents cytokine-induced β-cell damage and the development of type 1 diabetes[J]. Journal of Functional Foods,2015,16:9−19. doi: 10.1016/j.jff.2015.04.016
[3] 张春玲, 梁超, 王宝爱, 等. 大黄素通过调控HMGB1/TLR4/NF- κB信号通路对老年脑出血模型大鼠炎症因子的影响[J]. 中国免疫学杂志,2022,38(24):2992−2996. [ZHANG Chunling, LIANG Chao, WANG Baoai, et al. Emodin regulates HMGB1/TLR4/NF- κB signaling pathway and affects inflammatory factors in rats with cerebral hemorrhage in elderly[J]. Chinese Journal of Immunology,2022,38(24):2992−2996.] ZHANG Chunling, LIANG Chao, WANG Baoai, et al . Emodin regulates HMGB1/TLR4/NF-κB signaling pathway and affects inflammatory factors in rats with cerebral hemorrhage in elderly[J]. Chinese Journal of Immunology,2022 ,38 (24 ):2992 −2996 .[4] 王帅兵, 熊良伟, 季振南. 大黄素对嗜水气单胞菌的抑菌作用及其机制[J]. 中国兽医杂志,2023,59(3):140−146. [WANG Shuaibing, XIONG Liangwei, JI Zhennan. Antibacterial effect and mechanism of Emodin on Aeromonas hydrophila[J]. Chinese Journal of Veterinary Medicine,2023,59(3):140−146.] WANG Shuaibing, XIONG Liangwei, JI Zhennan . Antibacterial effect and mechanism of Emodin on Aeromonas hydrophila[J]. Chinese Journal of Veterinary Medicine,2023 ,59 (3 ):140 −146 .[5] 郑湘, 吴周全, 符国伟, 等. 大黄素对CFA诱导小鼠炎性痛的治疗作用及机制[J]. 南京医科大学学报(自然科学版),2022,42(10):1364−1370,1401. [ZHENG X, WU Z Q, FU G W, et al. Therapeutic effect and mechanism of emodin on CFA induced inflammatory pain in mice[J]. Journal of Nanjing Medical University (Natural Sciences),2022,42(10):1364−1370,1401.] ZHENG X, WU Z Q, FU G W, et al . Therapeutic effect and mechanism of emodin on CFA induced inflammatory pain in mice[J]. Journal of Nanjing Medical University (Natural Sciences),2022 ,42 (10 ):1364 −1370,1401 .[6] XU H X, LU Y Q, ZHANG T T, et al. Characterization of binding interactions of anthraquinones and bovine beta-lactoglobulin[J]. Food Chemistry, 2019, 281:28-35.
[7] ZHONG Y J, ZHAO J C, DAI T T, et al. The effect of whey protein-puerarin interactions on the formation and performance of protein hydrogels[J]. Food Hydrocolloids,2021,113:106444. doi: 10.1016/j.foodhyd.2020.106444
[8] SMITH G N, BROK E, CHRISTIANSEN M V, et al. Casein micelles in milk as sticky spheres[J]. Soft Matter,2020,16(43):9955−9963. doi: 10.1039/D0SM01327G
[9] 赵焕焦. 黑米花色苷与三种蛋白质相互作用的研究[D]. 天津:天津科技大学, 2017. [ZHAO H J. Study on the interaction of Black Rice anthocyanins with three proteins[D]. Tianjin:Tianjin University of Science and Technology, 2017.] ZHAO H J. Study on the interaction of Black Rice anthocyanins with three proteins[D]. Tianjin: Tianjin University of Science and Technology, 2017.
[10] GONG S X, YANG C Y, ZHANG J H, et al. Study on the interaction mechanism of purple potato anthocyanins with casein and whey protein[J]. Food Hydrocolloids,2020,111(2):106223.
[11] QIN J J, YANG M, WANG Y C, et al. Interaction between caffeic acid/caffeic acid phenethyl ester and micellar casein[J]. Food Chemistry,2021,349(5):129154.
[12] YANG M, WEI Y M, ASHOKKUMAR M, et al. Effect of ultrasound on binding interaction between emodin and micellar casein and its microencapsulation at various temperatures[J]. Ultrasonics Sonochemistry,2020,62:104861. doi: 10.1016/j.ultsonch.2019.104861
[13] 代世成, 连子腾, 马林智, 等. 超声预处理对大豆分离蛋白-儿茶素非共价/共价复合物结构及功能的影响[J]. 食品科学,2022,43(1):102−110. [DAI Shicheng, LIAN Ziteng, MA Linzhi, et al. Effect of ultrasonic pretreatment on the structure and function of soybean protein isolate-Catechin non-covalent/covalent complexes[J]. Food Science,2022,43(1):102−110.] DAI Shicheng, LIAN Ziteng, MA Linzhi, et al . Effect of ultrasonic pretreatment on the structure and function of soybean protein isolate-Catechin non-covalent/covalent complexes[J]. Food Science,2022 ,43 (1 ):102 −110 .[14] SHANMUGAM A, CHANDRAPALA J, ASHOKKUMAR M. The effect of ultrasound on the physical and functional properties of skim milk[J]. Innovative Food Science & Emerging Technologies,2012,16:251−258.
[15] JAMBRAK A R, MASON T J, LELAS V, et al. Ultrasonic effect on physicochemical and functional properties of α-lactalbumin[J]. LWT-Food Science and Technology,2010,43(2):254−262. doi: 10.1016/j.lwt.2009.09.001
[16] ZHANG R, PANG X, LU J, et al. Effect of high intensity ultrasound pretreatment on functional and structural properties of micellar casein concentrates[J]. Ultrasonics Sonochemistry, 2018, 47:10−16.
[17] YANG M, ZENG Q B, WANG Y C, et al. Effect of ultrasound pretreatment on the physicochemical properties and simulated gastrointestinal digestibility of micellar casein concentrates[J]. LWT-Food Science and Technology,2021,136:110319. doi: 10.1016/j.lwt.2020.110319
[18] JI W, YANG F M, YANG M. Effect of change in pH, heat and ultrasound pre-treatments on binding interactions between quercetin and whey protein concentrate[J]. Food Chemistry,2022,384:132508. doi: 10.1016/j.foodchem.2022.132508
[19] LIU Y, GUO R. pH-dependent structures and properties of casein micelles[J]. Biophysical Chemistry,2008,136(2-3):67−73. doi: 10.1016/j.bpc.2008.03.012
[20] 张瑞华, 张书文, 刘鹭, 等. 超声处理对酪蛋白胶束粉加工特性的影响[J]. 食品科学,2017,38(19):81−86. [ZHANG Ruihua, ZHANG Shuwen, LIU Lu, et al. Effect of ultrasound pretreatment on functional properties of micellar casein concentrate[J]. Food Science,2017,38(19):81−86.] ZHANG Ruihua, ZHANG Shuwen, LIU Lu, et al . Effect of ultrasound pretreatment on functional properties of micellar casein concentrate[J]. Food Science,2017 ,38 (19 ):81 −86 .[21] 薛海燕, 操歌, 贺宝元, 等. 超声处理对牛乳酪蛋白结构及抗原性的影响[J]. 食品科学,2019,40(23):123−129. [XUE Haiyan, CAO Ge, HE Baoyuan, et al. Effect of ultrasonic treatment on the structure and antigenicity of bovine caseins[J]. Food Science,2019,40(23):123−129.] XUE Haiyan, CAO Ge, HE Baoyuan, et al . Effect of ultrasonic treatment on the structure and antigenicity of bovine caseins[J]. Food Science,2019 ,40 (23 ):123 −129 .[22] 单家明, 孟岩, 李焐仪, 等. FT-IR和HPLC对不同产地大黄药材的鉴别分析[J]. 井冈山大学学报(自然科学版),2021,42(4):96−102. [SHAN Jiaming, MENG Yan, LI Wuyi, et al. Identification and analysis of Rhubarb medical materials from different habitats by FT-IR and HPLC[J]. Journal of Jinggangshan University (Natural Science),2021,42(4):96−102.] SHAN Jiaming, MENG Yan, LI Wuyi, et al . Identification and analysis of Rhubarb medical materials from different habitats by FT-IR and HPLC[J]. Journal of Jinggangshan University (Natural Science),2021 ,42 (4 ):96 −102 .[23] WANG Y C, YANG M, QIN J J, et al. Interactions between puerarin/daidzein and micellar casein[J]. Journal of Food Biochemistry,2022,46:e14048.
[24] TAN S, EBRAHIMI A, LANGRISH T. Controlled release of caffeine from tablets of spray-dried casein gels[J]. Food Hydrocolloids,2019,88:13−20. doi: 10.1016/j.foodhyd.2018.09.038
[25] SILVA M, ZISU B, CHANDRAPALA J. Influence of low-frequency ultrasound on the physico-chemical and structural characteristics of milk systems with varying casein to whey protein ratios[J]. Ultrasonics Sonochemistry,2018,49:268−276. doi: 10.1016/j.ultsonch.2018.08.015
[26] WU S N, LI G T, XUE Y, et al. Solubilisation of micellar casein powders by high-power ultrasound[J]. Ultrasonics Sonochemistry,2020,67:105131. doi: 10.1016/j.ultsonch.2020.105131
-
期刊类型引用(4)
1. 胥晴,原居林,倪蒙,邹松保,刘梅,顾志敏. 生态净养对淡水养殖鱼类肌肉品质影响的研究进展. 水产科学. 2024(01): 152-162 .  百度学术
百度学术
2. 王彦花,王成,刘晓星,郭婷钰. 烹饪处理对虾肉品质及重金属含量的影响研究. 农产品加工. 2024(06): 55-59+63 .  百度学术
百度学术
3. 王博,纪北文,聂竹兰,马春花,张蝶燕,冉永明. 残次红枣发酵饲料对克氏原螯虾生长性能、肌肉品质的影响. 饲料研究. 2024(22): 46-51 .  百度学术
百度学术
4. 齐懿涵,倪荣,马晓璐,李丹丹,张振,郭雪松. 壳聚糖复合涂膜对青虾煮制后食用品质的影响. 食品工业. 2022(02): 34-38 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:

 下载:
下载:



