Optimization of Extraction Process of Anthocyanins from Purple-fleshed Potatoes and Its Stability and Antioxidant Activity
-
摘要: 以甜菜碱为氢键受体,有机酸、糖基和醇基分别为氢键供体制备天然绿色的低共熔溶剂,基于微波辅助提取法,通过单因素实验并结合响应面分析对紫马铃薯花色苷提取工艺进行优化。主要考察了微波时间、微波功率、溶剂含水量、溶剂摩尔比对紫马铃薯花色苷含量的影响。同时比较低共熔溶剂与常规溶剂提取对紫马铃薯花色苷在不同温度、光照条件下的稳定性,以及DPPH、ABTS+、OH自由基清除率评价体外抗氧化能力。结果表明,以甜菜碱和柠檬酸制备酸性低共熔溶剂,摩尔比1:2.1,含水量为28.6%,在微波功率800 W,微波时间28 s条件下,紫马铃薯花色苷含量可达到228.658±1.241 mg/100 g,较常规提取工艺含量提高了56.92%。此外通过低共熔溶剂提取所得花色苷在不同光照、温度条件下稳定性均显著提高。其中太阳光对紫马铃薯花色苷影响最大,避光情况下低共熔溶剂提取花色苷保存率可达90%以上,常规溶剂提取花色苷保存率为82.78%,此外,花色苷含量也随着温度的增加不断降低,二者保存率均明显下降。抗氧化能力结果表明,低共熔溶剂提取所得花色苷抗氧化能力更强,其清除自由基能力IC50值均小于常规溶剂提取。DPPH自由基清除能力IC50值从45.95 μg/mL降至41.54 μg/mL;ABTS+自由基清除能力IC50值从17.81 μg/mL至11.30 μg/mL;OH自由基清除能力IC50值从162.00 μg/mL至22.44 μg/mL。因此紫色马铃薯花色苷含量、稳定性和抗氧化活性与其提取溶剂的选择密切相关,本提取工艺的研究为紫马铃薯花色苷的利用开发提供了新思路。Abstract: The natural deep eutectic solvent (DES) was prepared by using betaine as hydrogen bond acceptor and organic acid, sugar group and alcohol group as hydrogen bond donor. Based on microwave-assisted extraction method, the extraction process of purple-fleshed potatoes anthocyanins (PPA) was optimized by single factor experiment combined with response surface analysis. The effects of microwave time, microwave power, solvent water content and solvent molar ratio on the extraction content of PPA were investigated. Moreover, the stability of PPA under different temperature and light conditions, and the free radical scavenging rates of DPPH, ABTS+ and OH were compared with conventional solvents to determine the antioxidant capacity in vitro. The results showed that the acidic deep eutectic solvent with betaine and citric acid (molar ratio of 1:2.1) and a water content of 28.6%, under the conditions of microwave power of 800 W and microwave time of 28 s, the extraction content of PPA could reach 228.658±1.241 mg/100 g, which was 56.92% higher than that of the conventional extraction process. In addition, the stability of PPA obtained by DES was significantly improved under different light and temperature conditions. The sunlight had the biggest effect on the PPA. The results showed that the preservation rate of PPA could reach more than 90% in the case of light avoidance, while the preservation rate of conventional solvent extraction was only 82.78%. Moreover, the content of anthocyanins would decrease continuously with the increase of temperature, and the preservation rate of both decreased significantly. Antioxidant capacity results demonstrated that the antioxidant capacity of PPA obtained from DES was stronger, and the values of IC50 for different radical scavenging capacity were less than the conventional solvent extraction. The IC50 values of DPPH radical scavenging capacity ranged from 45.95 μg/mL to 41.54 μg/mL, ABTS+ radical scavenging capacity IC50 values from 17.81 μg/mL to 11.30 μg/mL, OH radical scavenging capacity IC50 values from 162.00 μg/mL to 22.44 μg/mL. Therefore, the content, stability and antioxidant activity of PPA are closely related to the extraction solvent, and our extraction process provides a new idea for the utilization and development of purple-fleshed potatoes anthocyanins.
-
紫马铃薯起源于安第斯山脉,近年来引入中国[1],由于富含花色苷活性物质使其呈现出紫皮紫瓤[2]。紫马铃薯花色苷(Purple-fleshed potatoes anthocyanins,PPA)作为食品天然活性物质,是一种水溶性天然色素[3],以糖苷键与多糖结合而成[4],广泛应用于功能膳食开发中[5]。研究表明,花色苷不仅可以赋予食品诱人的色泽,在维持身体健康方面也发挥着重要作用,例如抗炎、调节血压、降血糖血脂等,有助于多种疾病的预防[6−7]。目前人们对天然活性物质的需求日益增长,紫马铃薯花色苷可作为良好的天然食品色素来源[8]。但由于花色苷在加工提取过程中极其不稳定,容易受到提取环境的影响,因此,如何高效地提取花色苷成为该产业所面临的重要问题。
目前在国内外研究中,紫马铃薯花色苷的主要提取方法为常规溶剂浸提(Conventional solvent extraction,CSE),通常采用水浴加热与乙醇溶剂进行提取[9]。随着食品加工技术发展,更加有效的加工辅助技术开始运用于花色苷的提取,例如超声辅助提取(Ultrasonic assisted extraction,UAE)、微波辅助提取(Microwave assisted solvent extraction,MSE)、酶法和脉冲电场法等。这些新型加工技术可以有效地破坏细胞壁膜,缩短提取时间,提高花色苷含量[10]。如Xu等[11]通过响应面优化PPA微波提取条件,在微波功率700 W,料液比15:1,酸化乙醇溶液(0.3% HCl)条件下,得到紫马铃薯花色苷含量为74.66 mg/100 g。Zhu等[12]通过采用58%乙醇溶剂(pH2.5),在超声时间为40 min条件下提取PPA,得到花色苷含量93.52 mg/100 g。但由于常规提取溶剂易挥发导致提取物不稳定不利于产品开发。同时不同提取溶剂也会影响花色苷得率、成分结构以及生物活性[13]。因此,提取溶剂对花色苷功能活性及生产应用具有很大影响。低共熔溶剂提取法(Deep eutectic solvent,DES)作为当前的热点研究,通过制备新一代绿色环保高效低共熔混合物[14],由氢受体与供体通过氢键相互作用,其具有不易挥发、环保和易制备等优点[15],其不仅绿色环保,还能提高花色苷的生物利用度[16−17]。如Da Silva等[18]构建三元低共熔溶剂氯化胆碱/丙三醇/柠檬酸(1:4:1)进行提取,使得蓝莓酚类化合物提取量达76%。目前关于紫马铃薯花色苷低共熔溶剂提取研究,以及不同提取方法对PPA生物利用度对比研究较少。
因此,本研究以紫马铃薯总花色苷含量为指标,比较不同紫马铃薯干燥方式、不同提取溶剂、不同辅助技术对其影响。为紫马铃薯产业实际生产加工提供理论依据。并对所得最大花色苷含量工艺进行响应面优化,确定紫马铃薯花色苷提取的最佳工艺条件。同时在相同提取条件下,比较不同溶剂对于紫马铃薯花色苷提取物稳定性和抗氧化活性的影响,以此扩展紫马铃薯花色苷在食品、化妆品和医药行业的应用。
1. 材料与方法
1.1 材料与仪器
紫马铃薯 西藏凌云生物科技开发有限公司提供;DL-苹果酸、乳酸、无水甜菜碱 上海叶源生物科技有限公司;无水柠檬酸、无水葡萄糖、丙三醇 天津市津东天正精细化学试剂厂;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、2,2-联苯基-1-苦基肼基(DPPH) 上海市麦克林生物科技有限公司;过硫酸钾、三氯化铁等其他常见试剂均为分析纯。
TGL-22S高速冷冻离心机 四川蜀科仪器有限公司;MKX-H1C1A实验室微波炉 青岛麦克威微波创新科技有限公司;DF-101S集热式恒温加热磁力搅拌器 上海力辰仪器有限公司;UV-2700紫外可见光分光度计 日本岛津有限公司;PHS-3E型pH计 上海仪电科学仪器股份有限公司;Multiskan FC全波长酶标仪 赛默飞世尔科技公司;DV-III 型粘度计 美国博勒飞有限公司;101型电热鼓风干燥箱 北京科伟永兴仪器有限公司;L3.5AB柜式热泵干燥机 成都一恒科技有限公司;Lab-1A-80真空冷冻干燥机 北京博医康实验仪器有限公司。
1.2 实验方法
1.2.1 样品前处理
取无腐烂、无破损的新鲜紫马铃薯、洗净去皮,切成约0.5 cm片状。将预处理后的紫马铃薯切片均匀平铺在样品盘上,分别用热风干燥(Hot air drying,HAD)、热泵干燥(Heat pump drying,HPD)设备在40 ℃下干燥样品,隔2 h取出紫马铃薯切片样品称重,直至干燥恒重[19]。同时,将紫马铃薯切片于−80 ℃下预冻,使用真空冷冻干燥(Vacuum freeze drying,VFD)设备干燥36 h至恒重。上述不同干燥方式制得样品,采用液氮研磨粉碎过100目筛。得到三种不同制备方法的紫马铃薯冻干粉末,并于4 ℃、干燥、封闭环境下避光储存。
1.2.2 比较不同处理方式对紫马铃薯花色苷含量的影响
1.2.2.1 干燥方式对PPA含量的影响
将紫马铃薯热风干燥粉末、紫马铃薯热泵干燥粉末、紫马铃薯冷冻干燥粉末作为提取原料。定量称取不同干燥方式制备所得紫马铃薯粉于离心管中,采用崔倩[20]的方法,稍加修改。根据1:40(g/mL)的料液比,加入70%的乙醇溶剂,在40 ℃恒温提取60 min,冷却至室温后离心10 min(8000 r/min)。测定上清液中PPA的含量。以花色苷含量为指标,选择最佳的紫马铃薯干燥方法。
1.2.2.2 不同提取方法对PPA含量的影响
选择最佳的紫马铃薯干燥方式,采用不同方法提取紫马铃薯花色苷。CSE:根据1.2.2.1中方法进行。UAE:采用于雅静等[21]的方法,稍加修改;按照1:45(g/mL)的料液比加入70%乙醇溶液。在30 ℃的初始超声温度条件下,超声功率80 W超声提取20 min,冷却至室温后10000 r/min下离心10 min,取上清液,测定其中 PPA 的含量。MSE:采用韩东等[22]的方法,略有改动;根据 1:50(g/mL)的料液比,加入70%的乙醇溶剂,在微波功率700 W下利用微波仪提取30 s,取出后冷却至室温后,离心10 min(10000 r/min)。测定PPA含量。以PPA含量为指标,选择最佳的紫马铃薯花色苷提取方式。
1.2.3 DES的制备及理化性质
由于甜菜碱是一种可进行生物降解且价格低无毒害的中性分子[23],故由甜菜碱作为氢键受体,与氢键供体由不同种类的醇基、糖基和酸基组成。按照摩尔比准确称量于锥形瓶中,在70 ℃水浴下进行磁力搅拌至形成无色透明的均匀液体,密封后置于室温下保存备用[24]。DES的种类及摩尔比如表1所示。
表 1 五种低共熔溶剂种类及摩尔比Table 1. Five types of deep eutectic solvents and molar ratios编号 溶剂构成 摩尔比 氢键受体 氢键供体 DES-1 甜菜碱 乳酸 1:3 DES-2 甜菜碱 柠檬酸 1:2 DES-3 甜菜碱 苹果酸 1:2 DES-4 甜菜碱 丙三醇 1:3 DES-5 甜菜碱 葡萄糖 1:2 其中DES-1~DES-3为基于有机酸所制备的酸性低共熔溶剂,DES-4和DES-5分别以丙三醇和葡萄糖作为醇基和糖基。在含水量为30%(质量分数)时,取所制备不同种类DES 溶剂25 mL,采用粘度计及pH计,在室温下测定粘度和pH,探究其理化性质。
1.2.4 DES的选择
按照1.2.2.2中选出的最佳方法提取紫马铃薯花色苷。将DES作为提取溶剂,以PPA含量为指标,选择最佳的DES。
1.2.5 单因素实验设计
以最佳DES为提取溶剂,紫马铃薯花色苷含量为评价指标,固定DES溶剂摩尔比1:2,DES溶剂含水量30%,料液比1:50,微波功率700 W,微波时间50 s进行实验。分别考察DES的摩尔比(2:1、1:1、1:2、1:3、1:4);DES的含水量(10%、20%、30%、40%、50%);料液比(1:30、1:40、1:50、1:60、1:70 g/mL);微波功率(500、600、700、800、900 W);微波时间(10、30、50、70、90 s)对花色苷含量的影响。
1.2.6 响应面优化试验设计
根据单因素实验结果,采用响应面试验的方法优化微波辅助DES提取紫马铃薯花色苷工艺,Box-Behnken试验设计见表2。采用Box-Behnken Design设计4因素3水平的响应面工艺优化试验方案,对紫马铃薯花色苷提取工艺参数进行优化。
表 2 响应面试验因素水平Table 2. Factors and levels of response surface methodology水平 因素 A-微波
时间(s)B-微波
功率(W)C-DES
含水量(%)D-DES
摩尔比−1 10 700 20 1:1 0 30 800 30 1:2 1 50 900 40 1:3 1.2.7 总花色苷含量的测定
采用pH示差法测定花色苷含量[25]。根据公式(1)计算花色苷含量,花色苷含量以紫马铃薯花色苷提取液中含有的矢车菊素-3-葡萄糖苷当量来表示。
花色苷含量(mg/100g)=A×Mw×DF×Vε×L×Wt×100 (1) 式中: Mw—矢车菊素-3-葡萄糖苷的摩尔质量(449.2 g/moL);A—花色苷吸光度,A=(A535pH1.0−A700pH1.0)−(A535pH4.5−A700pH4.5);DF—稀释倍数;V—提取液体积(mL);ε—矢车菊素-3-葡萄糖苷的摩尔消光系数(26900 L/mol·cm);L—比色皿宽度(cm);Wt—样品质量(g)。
1.2.8 PPA稳定性评价指标
以紫马铃薯花色苷的保存率为评价指标,通过测定不同条件下花色苷含量变化,进行稳定性分析,PPA保存率计算公式(2)如下:
保存率(%)=C1C0×100 (2) 式中:C1—保存后花色苷含量;C0—保存前花色苷含量。
1.2.9 紫马铃薯花色苷稳定性及生物活性的研究
根据响应面优化所得最佳工艺条件下,分别采用不同提取溶剂:70%乙醇溶液(EtOH)以及最佳低共熔溶剂进行提取,对不同提取溶剂所得PPA稳定性及抗氧化活性进行比较。
1.2.9.1 不同光照对PPA稳定性的影响
分别取不同提取溶剂所得PPA提取液样品3份各10 mL,分别置于避光、自然光和太阳光下放置共8 d,每隔1 d进行测定,共平行测定8次,测定其吸光度值并计算PPA保存率。
1.2.9.2 不同温度对PPA稳定性的影响
分别取不同提取溶剂所得PPA提取液样品6份各10 mL,分别于4、20、40、60、80、100 ℃放置共8 h,每隔1 h进行测定,共平行测定8次,测定其吸光度值并计算PPA保存率。
1.2.9.3 PPA对DPPH自由基清除能力测定
参考Wang等[26]方法,稍加修改进行测定。首先取不同提取溶剂所得PPA提取液,配制成不同梯度溶液(50、100、150、200、160、250、300 μg/mL)。将DPPH试剂(0.5 mmol/L)分别与不同梯度样品溶液1:1混合处理。于35 ℃恒温培养箱中,避光反应30 min。用酶标仪在517 nm处测吸光度,记为样品组A1;用无水乙醇代替DPPH溶液,测得吸光度为对照组A2;用无水乙醇代替样品为空白对照,测得吸光度为A3;按照公式计算DPPH自由基清除率,D-异抗坏血酸VC配制成与PPA溶液相同梯度溶液为阳性对照。
DPPH自由基清除率(%)=(1−A1−A2A3)×100 1.2.9.4 PPA对ABTS+自由基清除能力测定
参考Meng等[27]实验方法,稍加修改测定。将7.4 mmol/L ABTS溶液与4.5 mmol/L过硫酸钾溶液等比例混合,避光下反应12~16 h制得ABTS储备液。再用无水乙醇稀释ABTS溶液,使其在734 nm处的吸光值为0.700±0.02。取0.1 mL样品溶液(50~300 μg/mL)和3 mL的ABTS储备液,混匀30 s后,室温下避光反应6 min,在734 nm处用酶标仪测定吸光值为A1;用无水乙醇代替ABTS工作液做样品空白对照,测得吸光度为A2;用无水乙醇代替样品溶液,测得吸光度为A0。按照公式计算ABTS+自由基清除率,VC为阳性对照。
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 1.2.9.5 PPA对OH自由基清除能力测定
参考Samsonowicz 等[28]的方法加以修改。按顺序依次加入1 mL FeSO4溶液(9 mmol/L)、1 mL水杨酸溶液(9 mmol/L),再加入适量PPA提取液(50~300 μg/mL)和去离子水,最后加入1 mL H2O2溶液(8.8 mmol/L)混合,使反应体系总体积为15 mL。在37 ℃下避光反应30 min后,在510 nm下测定吸光度。OH自由基清除能力按照公式计算,以VC作为阳性对照。式中A0为不加样品的空白对照组吸光度;A1为样品组吸光度;A2为不加显色剂组的吸光度。
OH自由基清除率(%)=(A0−(A1−A2)A0)×100 1.3 数据处理
采用Microsoft office excel 2019、Design expert 10.0.3软件进行数据处理;运用GraphPad Prism 9.0进行数据图的绘制。
2. 结果与分析
2.1 不同干燥方式和提取方法对紫马铃薯花色苷含量影响比较
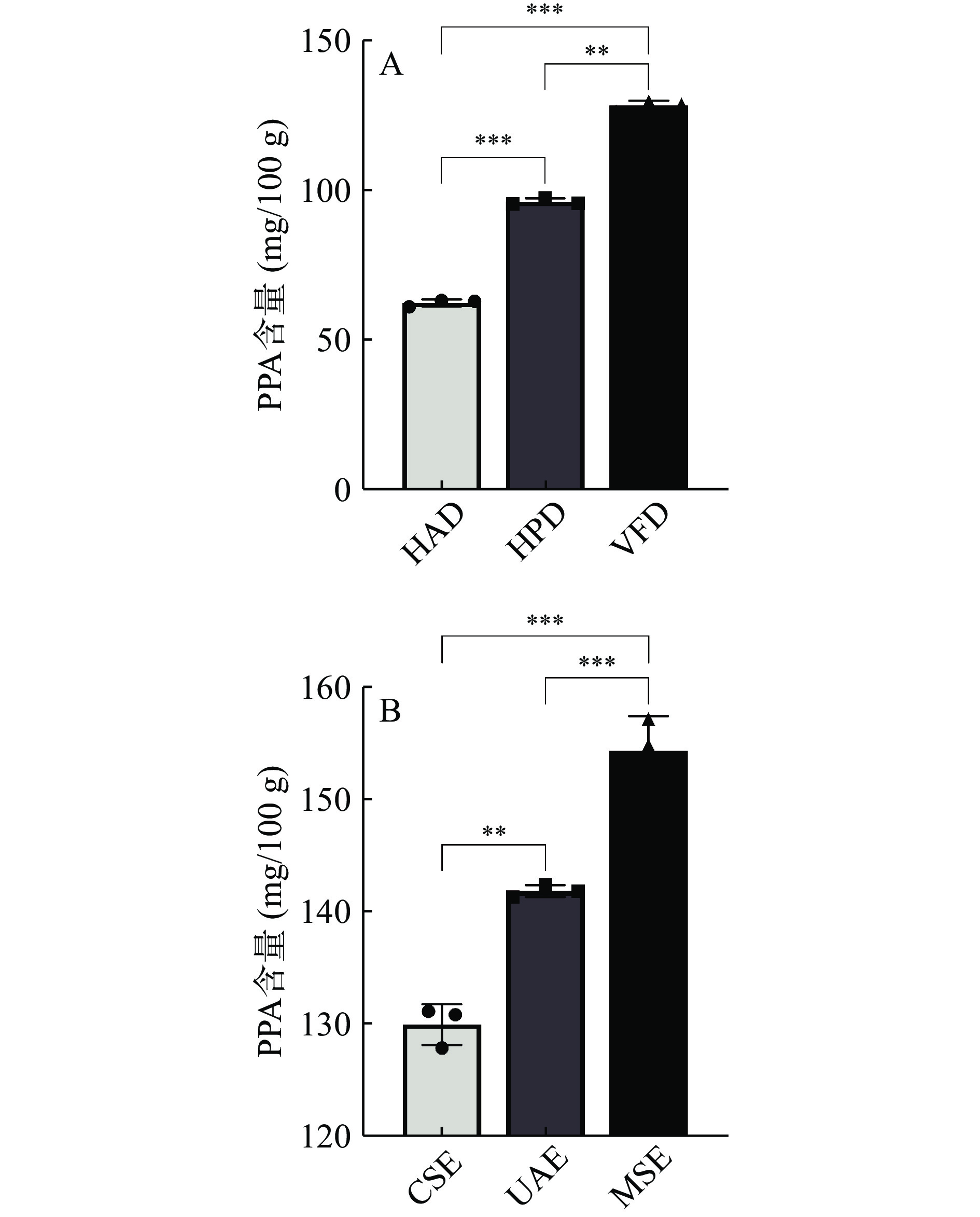
为了评价不同干燥方式对紫马铃薯花色苷含量影响,在相同提取条件下,比较不同干燥方式HAD、HPD、VFD对PPA含量的影响。结果如图1(A)所示,采用VFD所得的紫马铃薯冻干粉提取花色苷,所得PPA含量最高,为130.15±1.27 mg/100 g(P<0.01)。这是由于PPA结构不稳定,在高温加热情况下很容易发生降解。Martynenko等[29]通过对蓝莓进行热处理,探究蓝莓花色苷热降解动力学变化,结果显示花色苷对热极为敏感,加热过程中其含量显著降低。而在VFD整个干燥过程中紫马铃薯一直处于低温真空的状态,对于易降解的花色苷破坏较小,使其有效保留。比较不同提取方法CSE、MSE、UAE对PPA提取含量的影响。由图1(B)可以看出,采用微波辅助提取紫马铃薯花色苷效果最佳。在微波辐射的作用下,花色苷细胞通过离子迁移引起分子运动[30]在内部快速产生热能,导致细胞组织破裂,得到PPA含量为154.65±3.10 mg/100 g(P<0.01),且用时最短。
2.2 不同种类DES对紫马铃薯花色苷含量的影响
2.2.1 DES的选择及理化性质
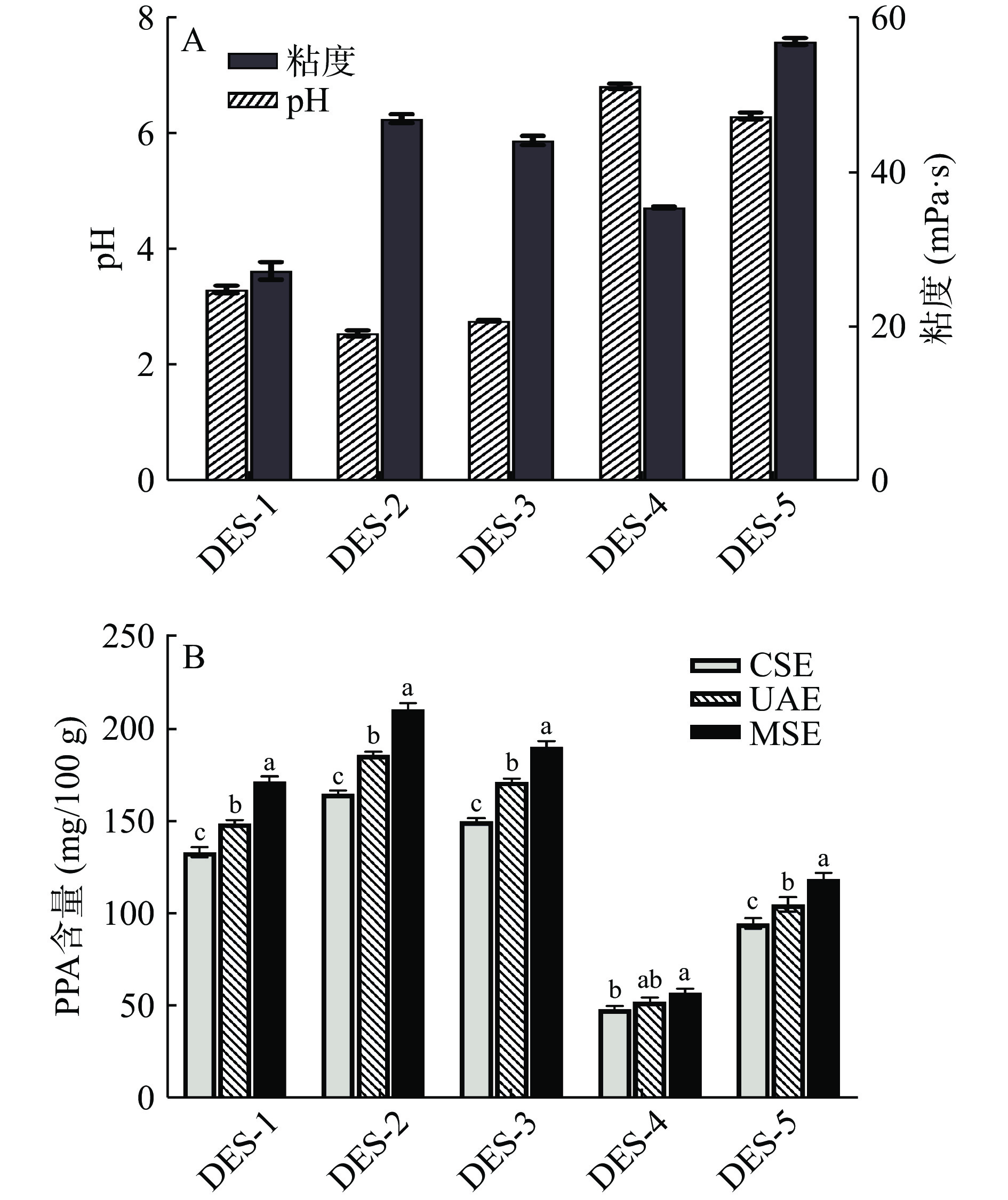
不同DES体系对PPA的含量影响也不同。从图2(A)五种DES理化性质图可以看出,采用有机酸基所制备的DES比醇基和糖基制备的DES具有更低的pH,其中采用柠檬酸所制备的溶剂pH最小,同时以葡萄糖制备的低共熔溶剂粘度最大。从图2(B)可知,采用有机酸基所制备的DES对PPA的含量高于糖基和醇基制备的DES(P<0.05)。这是由于在酸性条件下花色苷更稳定。同时羧基可以增强低共熔溶剂组分间氢键相互作用,从而提高提取含量[31]。因此,本研究选择甜菜碱和柠檬酸所制备的DES-2作为提取溶剂。
![]() 图 2 不同DES溶剂的理化性质(A)和不同DES溶剂对PPA含量的影响(B)注:不同小写字母代表同一提取溶剂下不同提取方法之间具有显著差异(P<0.05);图3同。Figure 2. Physicochemical properties of different DES (A) and effect of different DES on the content of PPA (B)
图 2 不同DES溶剂的理化性质(A)和不同DES溶剂对PPA含量的影响(B)注:不同小写字母代表同一提取溶剂下不同提取方法之间具有显著差异(P<0.05);图3同。Figure 2. Physicochemical properties of different DES (A) and effect of different DES on the content of PPA (B)2.2.2 不同提取溶剂比较
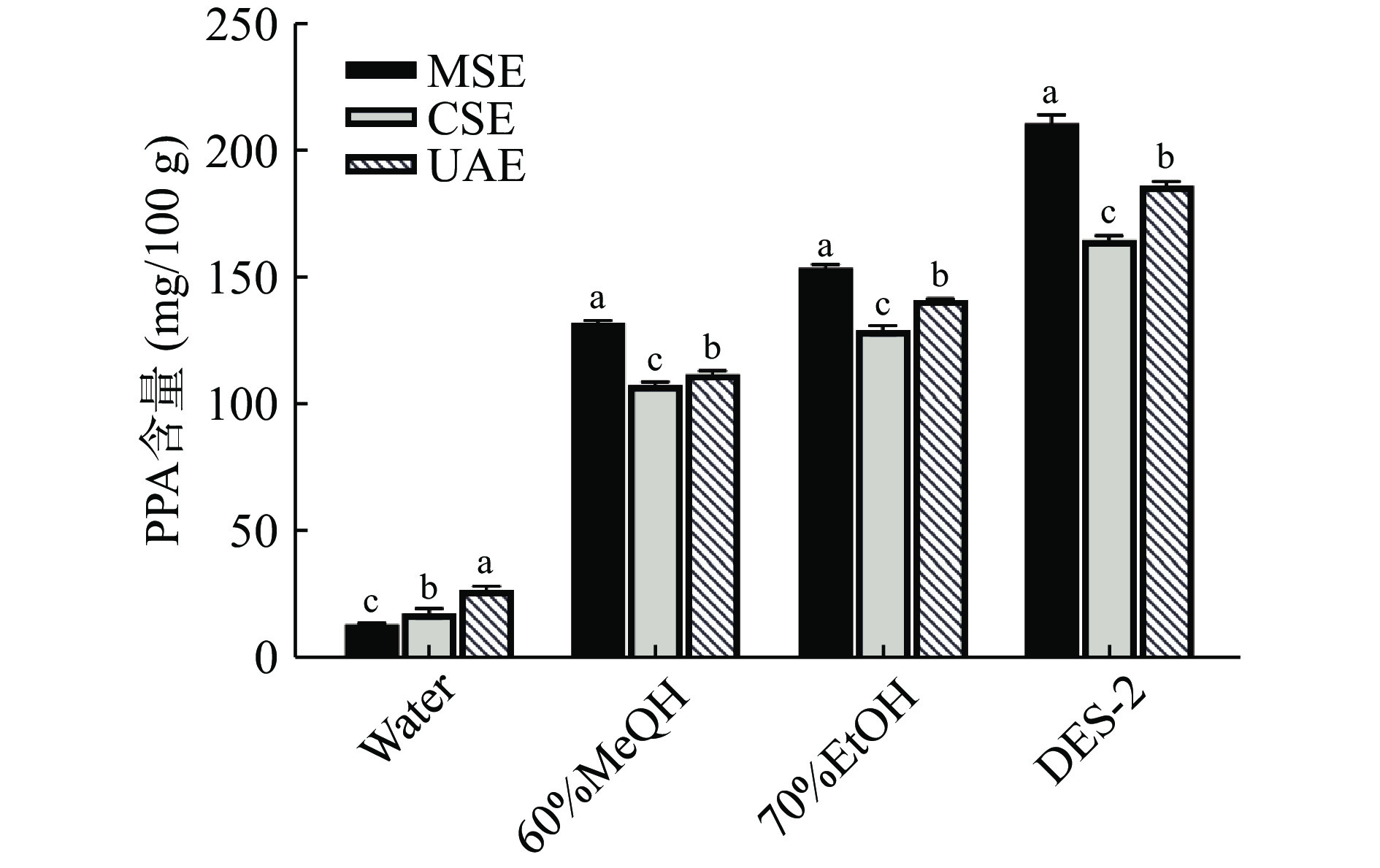
将纯水、60%甲醇、70%乙醇溶液在1.2.2.2三种不同提取方法下,比较不同提取溶剂对PPA含量影响。同时,与最佳低共熔溶剂进行比较。结果如图3所示,可以看出三种不同提取方法下,DES-2作为提取溶剂所得紫马铃薯花色苷含量高于其他溶剂,这与Bi等[32]采用氯化胆碱-乳酸低共熔溶剂提取桑葚花色苷效果一致,花色苷提取含量显著高于乙醇溶液。在微波辅助条件下,DES-2提取PPA含量最高为211.73±3.35 mg/100 g。同时所制得低共熔溶剂安全性高、挥发性低,绿色环保。
2.3 单因素实验结果
2.3.1 DES的摩尔比
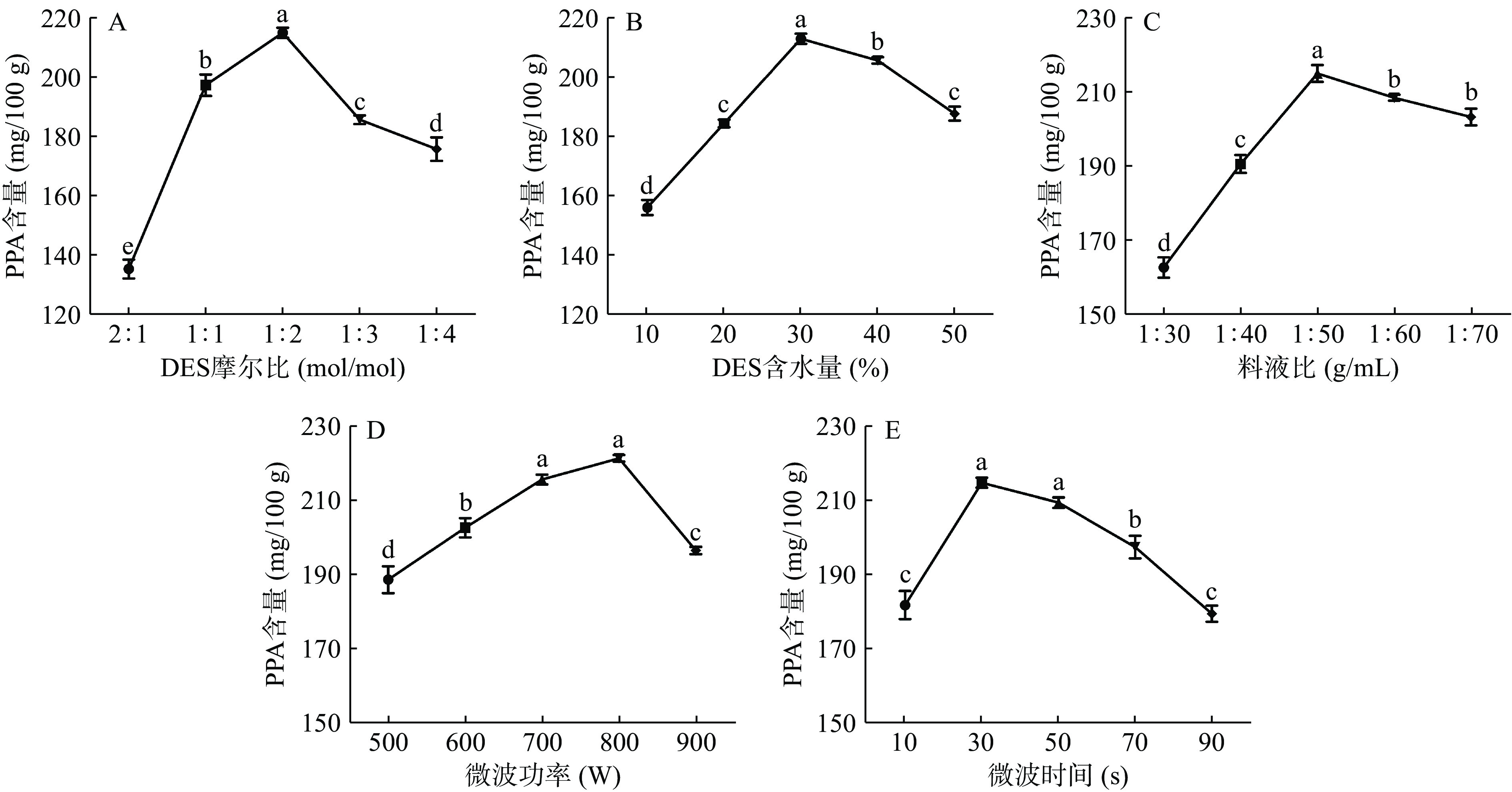
本研究考察不同摩尔比对紫马铃薯花色苷含量的影响。如图4(A)所示,当甜菜碱-柠檬酸体系摩尔比从2:1到1:2时,PPA含量逐渐增高。但当摩尔比达到1:3时,花色苷含量开始下降。这可能是由于氢键受体体系浓度不断降低,导致与提取物之间的可结合的氢键数量不断减少,从而导致含量降低[33]。因此,甜菜碱和柠檬酸所组成的最佳DES摩尔比为1:2。
2.3.2 DES的含水量
由于低共熔溶剂粘度偏大,一般需在制备过程中添加适量水以此降低粘度,提高传质速率。本研究考察了不同含水量(10%、20%、30%、40%和 50%)的低共熔溶剂对PPA含量的影响。如图4(B)所示,当含水量为30%时溶剂体系结构变化不大,但其粘度降低、使得极性增强[34],PPA含量最高为212.70±1.75 mg/100 g。但随着含水量不断增大,会造成氢键受体和氢键供体之间相互作用,从而导致DES分子结构受到破坏,使得PPA含量下降[35]。因此,DES的最佳含水量为30%。
2.3.3 料液比
由图4(C)可知,随着液料比的增加,紫马铃薯花色苷含量增加,当液料比超过1:50后呈下降趋势。可能是由于DES溶剂的增加,增大PPA的传质,使PPA含量显著增加(P<0.05)。但随着PPA在DES溶剂中溶解达到饱和后,同时DES体系粘度不断增大,导致紫马铃薯花色苷含量下降。因此,最佳料液比为1:50。
2.3.4 微波功率
由图4(D)可知,当微波功率从500 W增加到800 W时,PPA含量不断提高,但随着微波功率继续提高后,PPA含量反而下降。这可能是由于当微波功率不断升高,微波同时会产生较大的热能,使得PPA出现热降解[36]。因此,选择800 W为最佳微波功率。
2.3.5 微波时间
考察了不同微波时间(10、30、50、70、90 s)对PPA含量的影响。由图4(E)可知,微波时间为30 s时,PPA含量最高,但当微波时间不断增加时,含量下降。这可能是由于短时微波就能使细胞壁裂解,PPA溶出含量升高。但随着微波时间的增加,由于机械效应,导致微波温度大幅度升高,花色苷发生热降解。因此,微波时间选择为30 s。
2.4 微波辅助提取花色苷响应面优化试验结果
2.4.1 响应面试验结果及方差分析
为了确定最佳提取PPA工艺条件,以微波时间、微波功率、DES含水量、DES摩尔比4个因素作为主要影响因素,同时以紫马铃薯花色苷提取含量为响应值进行四因素三水平响应面试验。响应曲面优化试验设计与结果如表3所示。
表 3 响应曲面优化试验设计与结果Table 3. Design and results of response surface experiment试验号 A-微波
时间(s)B-微波
功率(W)C-DES
含水量(%)D-DES
摩尔比PPA含量
(mg/100 g)1 10 700 30 1:2 195.568 2 50 700 30 1:2 198.446 3 10 900 30 1:2 202.666 4 50 900 30 1:2 187.81 5 30 800 20 1:1 198.837 6 30 800 40 1:1 201.818 7 30 800 20 1:3 209.595 8 30 800 40 1:3 198.077 9 10 800 30 1:1 201.59 10 50 800 30 1:1 194.252 11 10 800 30 1:3 206.618 12 50 800 30 1:3 200.942 13 30 700 20 1:2 188.342 14 30 900 20 1:2 217.752 15 30 700 40 1:2 213.468 16 30 900 40 1:2 180.56 17 10 800 20 1:2 202.075 18 50 800 20 1:2 199.486 19 10 800 40 1:2 196.73 20 50 800 40 1:2 183.821 21 30 700 30 1:1 205.364 22 30 900 30 1:1 198.146 23 30 700 30 1:3 207.147 24 30 900 30 1:3 200.103 25 30 800 30 1:2 229.154 26 30 800 30 1:2 225.25 27 30 800 30 1:2 229.36 28 30 800 30 1:2 228.284 29 30 800 30 1:2 225.909 设微波时间、微波功率、DES含水量和DES摩尔比分别为A、B、C、D,以PPA含量为响应值进行多元回归拟合,得到二次多项回归方程:YPPA含量=227.59−3.37A−1.77B−3.47C+1.87D−4.43AB−2.58AC+0.42AD−15.58BC+0.044BD−3.62CD−17.1A2−13.92B2−14.53C2−10.54D2。回归方程方差分析结果见表4。
表 4 PPA含量模型及回归系数的回归分析结果Table 4. Results of regression analysis of PPA content model and regression coefficients来源 离差平方和 自由度 均方 F值 P值 显著性 模型 4918.77 14 351.34 66.97 <0.0001 ** A-微波时间 136.62 1 136.62 26.04 0.0002 ** B-微波功率 37.8 1 37.8 7.2 0.0178 * C-DES含水量 144.3 1 144.3 27.5 0.0001 ** D-DES摩尔比 42.09 1 42.09 8.02 0.0133 * AB 78.62 1 78.62 14.99 0.0017 ** AC 26.63 1 26.63 5.07 0.0408 * AD 0.69 1 0.69 0.13 0.7222 ns BC 970.88 1 970.88 185.05 <0.0001 ** BD 7.57E-03 1 7.57E-03 1.44E-03 0.9702 ns CD 52.56 1 52.56 10.02 0.0069 ** A2 1895.77 1 1895.77 361.34 <0.0001 ** B2 1257.72 1 1257.72 239.73 <0.0001 ** C2 1368.7 1 1368.7 260.88 <0.0001 ** D2 719.93 1 719.93 137.22 <0.0001 ** 残差 73.45 14 5.25 失拟项 59.09 10 5.91 1.65 0.3337 ns 纯误差 14.36 4 3.59 总和 4992.23 28 R2=0.9853 R2Adj=0.9706 R2Pre=0.9273 注:P<0.05为显著,用*表示,P<0.01为极显著,用**表示,P>0.05为不显著,用ns表示。 由表4可知,该模型差异极显著(P<0.0001),决定系数R2为0.9853,说明模型拟合程度优良,能较为直观地拟合试验结果。失拟项不显著(P>0.05),说明模型误差较小,校正决定系数R2Adj为0.9706,说明模型的相关性和解释度都很好,可以用此模型进行理论分析和预测。分析各因素对PPA含量的影响可知,一次项微波时间、DES含水量对PPA含量影响极显著(P<0.01),微波功率、DES摩尔比对PPA含量具有显著影响(P<0.05)。4个影响因素中,对PPA含量影响次序为C>A>D>B,最大的为DES含水量,其次为微波时间,而后为DES摩尔比,影响最小的为微波功率。二次项A2、B2、C2、D2对PPA含量的影响极显著(P<0.01),说明四个因素对PPA含量具有非线性的影响。交互项BC、AB、CD对PPA含量影响极显著(P<0.01),AC对PPA含量影响显著(P<0.05)。
2.4.2 提取工艺响应面分析与优化
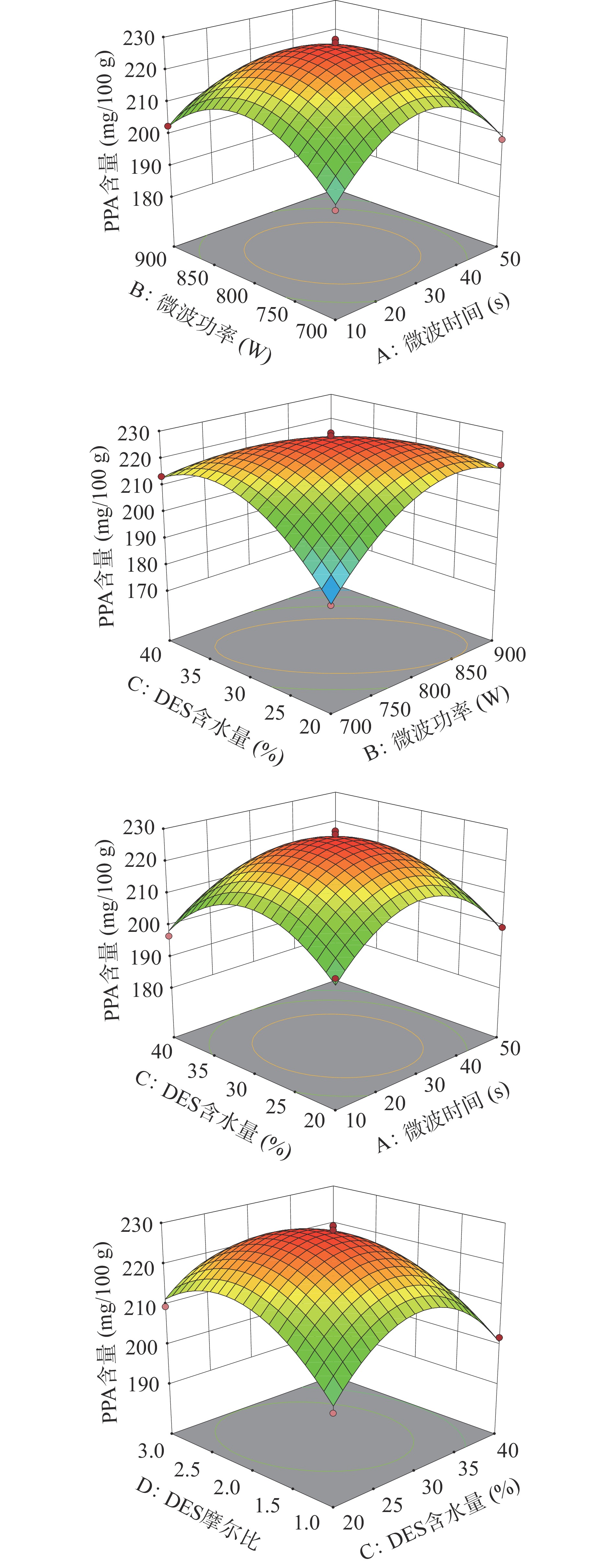
通过3D响应面图可以较为直观地反映出DES含水量、DES摩尔比、微波时间及微波功率变量交互作用对紫马铃薯花色苷含量的影响。根据3D响应面形状,曲面越陡,说明两因素交互作用越显著,此模型存在最大值稳定点,紫马铃薯花色苷含量的最大值出现在中间点[37]。
如图5所示,AB、AC、BC和CD的3D响应面图下方的等高线图形呈较为扁的椭圆形与方差分析相吻合,交互作用显著。随着不同因素增加过程中,PPA含量也呈先增加后降低的趋势,符合方差分析结果。
2.4.3 最佳工艺条件的验证实验
以紫马铃薯花色苷含量最大值为优化目标,由Design-Expert 10.0.3软件对试验进行优化,得到预测PPA含量为228.067 mg/100 g,四个因素的预测值分别为微波时间28.201 s、微波功率为802.912 W、DES含水量28.594%、DES摩尔比为1:2.111,为了确定该模型的准确性,采用优化后的参数进行验证实验,为方便操作,条件参数设为微波时间28.0 s、微波功率为800 W、DES含水量28.6%、DES摩尔比为1:2.1,该条件下重复实验3次,测得PPA含量平均值为228.658±1.241 mg/100 g,较模型预测值差异不大,说明该模型优化得到的工艺参数可靠。同时与传统浸提工艺(CES)相比,PPA含量提高了56.92%(P<0.01)。
2.5 不同提取溶剂对紫马铃薯花色苷生物活性的影响
2.5.1 环境条件对紫马铃薯花色苷稳定性影响
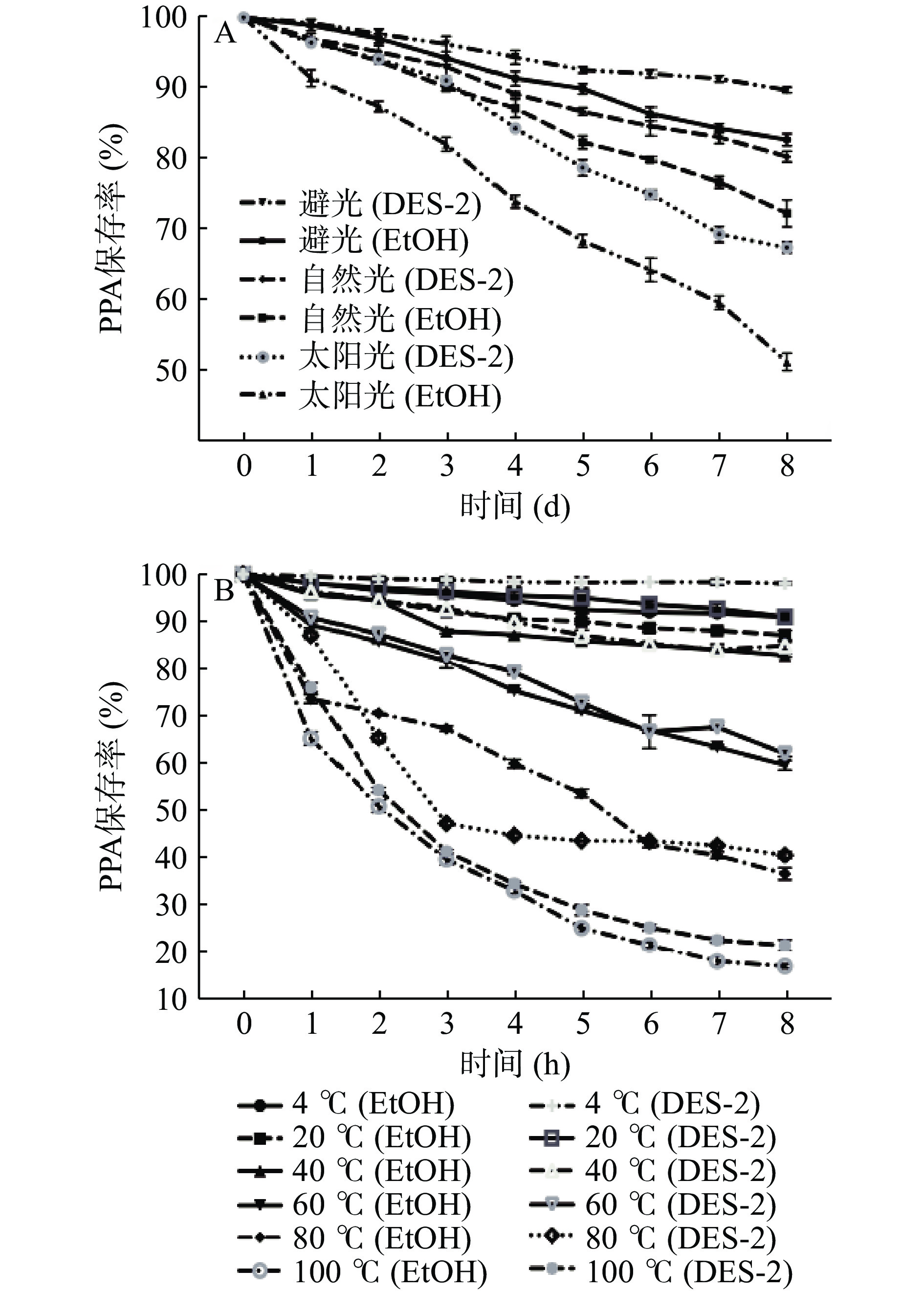
根据最佳工艺条件,采用70%乙醇溶液(EtOH)和最优低共熔溶剂体系:甜菜碱/柠檬酸(DES-2)对PPA进行提取,探究不同提取溶剂对PPA稳定性影响。光照条件对PPA稳定性的影响见图6A,可以看出在避光条件下储存5 d后,不同溶剂体系提取所得PPA均相对稳定,保存率维持在90%以上。自然光下PPA提取液降解速率较慢,但采用EtOH提取所得PPA样品下降趋势高于DES-2。太阳光直射对PPA保存率影响最大,长时间光照使不同溶剂提取所得PPA都出现明显降解。这与张海霞等[38]结论一致,研究认为长时间光照会导致花色苷炭骨架结构改变,导致花色苷降解,但短时间光照对花色苷影响不大。温度条件对其稳定性的影响见图6B,在不同温度环境下,PPA保存率与温度呈反比。储存在4、20 ℃时,DES提取所得PPA放置8 h后保存率均在90%以上,但采用EtOH提取所得PPA在20 ℃条件下保存率降至86.04%。随着温度的提升PPA稳定性不断降低,且采用EtOH提取所得样品保存率明显低于DES-2体系。其下降趋势与Condurache等[39]的研究相似,以10 ℃的间隔80~130 ℃下加热紫茄皮提取物,花青素总含量随着温度的升高而大幅度下降。以上分析可得DES提取所得PPA在不同光照、温度环境条件下,稳定性均优于EtOH体系,因此在食品加工贮藏过程中,紫马铃薯花色苷应保持在低温避光条件下以提高稳定性,为PPA实际应用加工条件选择提供理论参考。
2.5.2 紫马铃薯花色苷抗氧化活性研究
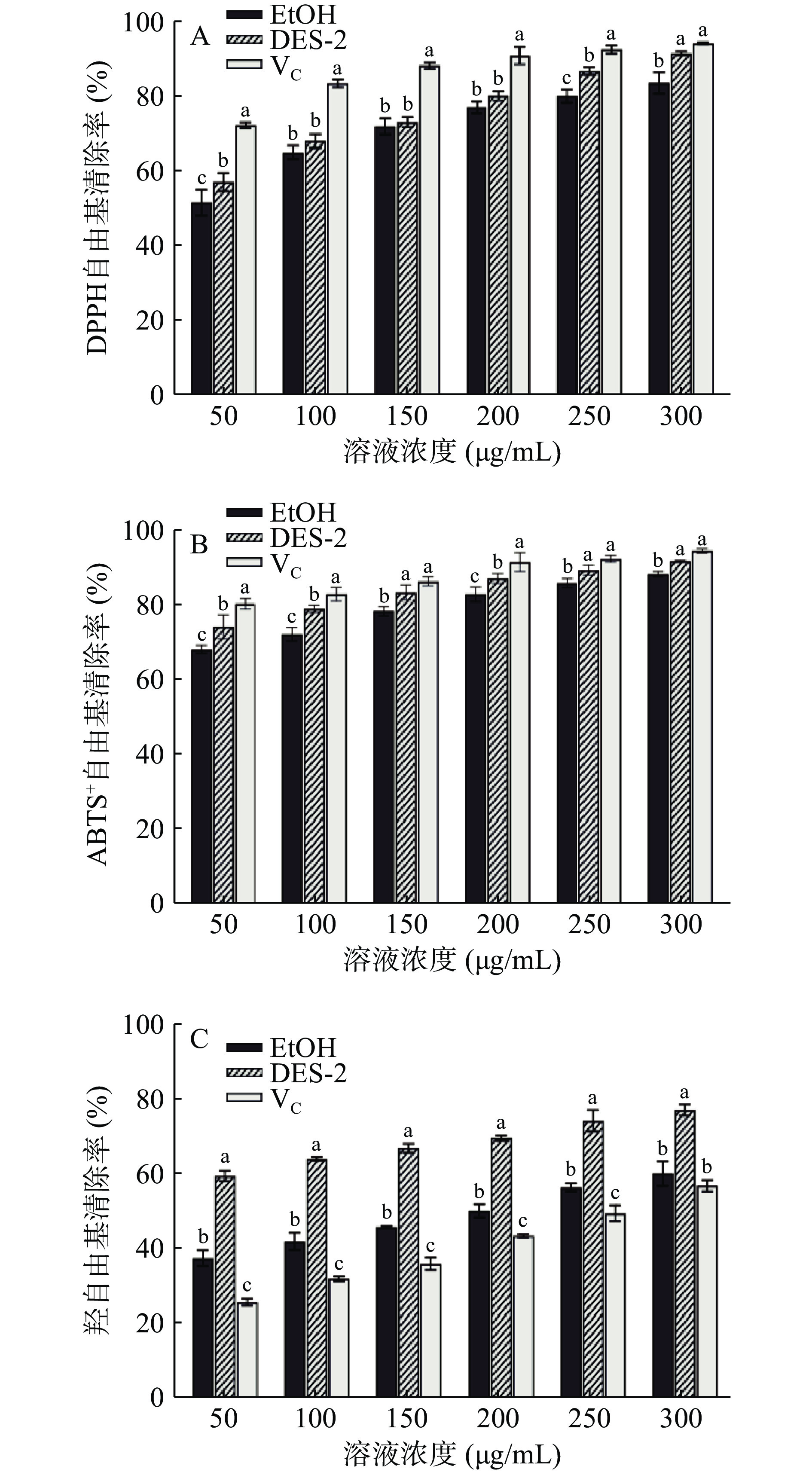
探究不同提取溶剂(EtOH/DES-2)对PPA体外抗氧化活性的影响。从图7A中看出,不同溶剂提取所得PPA清除DPPH自由基能力与其浓度都呈正比关系,随着浓度的增大而增强。但VC抗氧化能力稍强于PPA,当质量浓度为300 μg/mL时,EtOH、DES-2和VC的自由基清除能力分别为84.20%、92.12%和94.86%。从图7B可以看出当不同溶剂提取所得PPA浓度从50 μg/mL上升到300 μg/mL时,DES-2所得样品对ABTS+自由基清除率从74.50%增加至92.08%,EtOH所得样品对ABTS+自由基清除率从68.37%增加至88.61%,两者均与浓度呈正比。如图7C所示,在不同溶剂提取所得PPA样品浓度为50 µg/mL时,清除率均优于VC。当样品浓度达到300 μg/mL时,EtOH和DES-2溶剂提取所得样品对羟自由基的清除率分别为60.25%和77.53%。通过计算得到不同样品对自由基清除能力的IC50如表5所示。因此可以得出,通过微波辅助DES-2提取所得的PPA抗氧化活性优于常规溶剂提取。
表 5 抗氧化能力IC50值分析结果Table 5. Results of IC50 analysis of antioxidant capacity样品 IC50(μg/mL) DPPH抗氧化能力 ABTS抗氧化能力 OH抗氧化能力 EtOH 45.95 17.81 162.00 DES-2 41.54 11.30 22.44 VC 19.24 7.20 251.30 3. 结论
本研究通过比较花色苷含量,确定紫马铃薯干燥方式、花色苷提取方法以及溶剂的选择。通过响应面优化微波辅助低共熔溶剂提取紫马铃薯花色苷工艺。在最优工艺条件下,与常规溶剂提取比较所得花色苷生物活性。该法通过甜菜碱/柠檬酸为氢键受体与供体制备酸性低共熔溶剂,在最优条件下所得紫马铃薯花色苷含量达228.658±1.241 mg/100 g。通过考察稳定性影响,同时与常规浸提相比,DES-2提取所得紫马铃薯花色苷稳定性更好。在不同光照下对紫马铃薯花色苷影响最大为太阳光,避光情况下紫马铃薯花色苷保存率可达90%以上。随着温度的升高,紫马铃薯花色苷的降解速度明显加快。抗氧化能力结果显示,通过DES-2提取所得花色苷的DPPH自由基清除能力IC50值为41.54 μg/mL,ABTS+自由基清除能力IC50值为11.30 μg/mL,OH自由基清除能力IC50值为22.44 μg/mL,均强于通过常规溶剂提取。因此研究表明,溶剂选择不仅对紫马铃薯花色苷含量产生影响,同时对紫马铃薯花色苷生物活性也会产生一定影响,本研究制备的低共熔溶剂可有效提升花色苷生物利用度,为后续花色苷产品的开发提供研究基础。但目前的研究对花色苷的结构成分变化尚有不足,花色苷降解过程中结构的改变有待探究,在接下来的研究中,对采用不同溶剂方法提取所得花色苷进行组分鉴定及成分分析,为合理开发紫马铃薯花色苷资源提供科学依据。
-
图 2 不同DES溶剂的理化性质(A)和不同DES溶剂对PPA含量的影响(B)
注:不同小写字母代表同一提取溶剂下不同提取方法之间具有显著差异(P<0.05);图3同。
Figure 2. Physicochemical properties of different DES (A) and effect of different DES on the content of PPA (B)
表 1 五种低共熔溶剂种类及摩尔比
Table 1 Five types of deep eutectic solvents and molar ratios
编号 溶剂构成 摩尔比 氢键受体 氢键供体 DES-1 甜菜碱 乳酸 1:3 DES-2 甜菜碱 柠檬酸 1:2 DES-3 甜菜碱 苹果酸 1:2 DES-4 甜菜碱 丙三醇 1:3 DES-5 甜菜碱 葡萄糖 1:2 表 2 响应面试验因素水平
Table 2 Factors and levels of response surface methodology
水平 因素 A-微波
时间(s)B-微波
功率(W)C-DES
含水量(%)D-DES
摩尔比−1 10 700 20 1:1 0 30 800 30 1:2 1 50 900 40 1:3 表 3 响应曲面优化试验设计与结果
Table 3 Design and results of response surface experiment
试验号 A-微波
时间(s)B-微波
功率(W)C-DES
含水量(%)D-DES
摩尔比PPA含量
(mg/100 g)1 10 700 30 1:2 195.568 2 50 700 30 1:2 198.446 3 10 900 30 1:2 202.666 4 50 900 30 1:2 187.81 5 30 800 20 1:1 198.837 6 30 800 40 1:1 201.818 7 30 800 20 1:3 209.595 8 30 800 40 1:3 198.077 9 10 800 30 1:1 201.59 10 50 800 30 1:1 194.252 11 10 800 30 1:3 206.618 12 50 800 30 1:3 200.942 13 30 700 20 1:2 188.342 14 30 900 20 1:2 217.752 15 30 700 40 1:2 213.468 16 30 900 40 1:2 180.56 17 10 800 20 1:2 202.075 18 50 800 20 1:2 199.486 19 10 800 40 1:2 196.73 20 50 800 40 1:2 183.821 21 30 700 30 1:1 205.364 22 30 900 30 1:1 198.146 23 30 700 30 1:3 207.147 24 30 900 30 1:3 200.103 25 30 800 30 1:2 229.154 26 30 800 30 1:2 225.25 27 30 800 30 1:2 229.36 28 30 800 30 1:2 228.284 29 30 800 30 1:2 225.909 表 4 PPA含量模型及回归系数的回归分析结果
Table 4 Results of regression analysis of PPA content model and regression coefficients
来源 离差平方和 自由度 均方 F值 P值 显著性 模型 4918.77 14 351.34 66.97 <0.0001 ** A-微波时间 136.62 1 136.62 26.04 0.0002 ** B-微波功率 37.8 1 37.8 7.2 0.0178 * C-DES含水量 144.3 1 144.3 27.5 0.0001 ** D-DES摩尔比 42.09 1 42.09 8.02 0.0133 * AB 78.62 1 78.62 14.99 0.0017 ** AC 26.63 1 26.63 5.07 0.0408 * AD 0.69 1 0.69 0.13 0.7222 ns BC 970.88 1 970.88 185.05 <0.0001 ** BD 7.57E-03 1 7.57E-03 1.44E-03 0.9702 ns CD 52.56 1 52.56 10.02 0.0069 ** A2 1895.77 1 1895.77 361.34 <0.0001 ** B2 1257.72 1 1257.72 239.73 <0.0001 ** C2 1368.7 1 1368.7 260.88 <0.0001 ** D2 719.93 1 719.93 137.22 <0.0001 ** 残差 73.45 14 5.25 失拟项 59.09 10 5.91 1.65 0.3337 ns 纯误差 14.36 4 3.59 总和 4992.23 28 R2=0.9853 R2Adj=0.9706 R2Pre=0.9273 注:P<0.05为显著,用*表示,P<0.01为极显著,用**表示,P>0.05为不显著,用ns表示。 表 5 抗氧化能力IC50值分析结果
Table 5 Results of IC50 analysis of antioxidant capacity
样品 IC50(μg/mL) DPPH抗氧化能力 ABTS抗氧化能力 OH抗氧化能力 EtOH 45.95 17.81 162.00 DES-2 41.54 11.30 22.44 VC 19.24 7.20 251.30 -
[1] AHMED S, ZHOU X, PANG Y, et al. Genetic diversity of potato genotypes estimated by starch physicochemical properties and microsatellite markers[J]. Food Chemistry,2018,257:368−375. doi: 10.1016/j.foodchem.2018.03.029
[2] 赵晶, 郝金伟, 李萌, 等. 紫马铃薯与百香果复合果蔬汁饮料[J]. 食品工业,2019,40(9):56−61. [ZHAO J, HAO J W, LI M, et al. Purple potato and passion fruit composite fruit and vegetable juice[J]. Food Industry,2019,40(9):56−61.] ZHAO J, HAO J W, LI M, et al . Purple potato and passion fruit composite fruit and vegetable juice[J]. Food Industry,2019 ,40 (9 ):56 −61 .[3] 李安, 刘小雨, 张惟广. 发酵及贮藏条件对蓝莓果酒花色苷稳定性的影响及其抗氧化性研究[J]. 中国酿造,2020,39(2):146−151. [LI A, LIU X Y, ZHANG W G. Study on the stability and antioxidant capacity of blueberry wine anthocyanins under fermentation and storage conditions[J]. China Brewing,2020,39(2):146−151.] doi: 10.11882/j.issn.0254-5071.2020.02.027 LI A, LIU X Y, ZHANG W G . Study on the stability and antioxidant capacity of blueberry wine anthocyanins under fermentation and storage conditions[J]. China Brewing,2020 ,39 (2 ):146 −151 . doi: 10.11882/j.issn.0254-5071.2020.02.027[4] 朱玉洁. 葡聚糖凝胶柱层析富集黑果枸杞总花色苷工艺及其抗氧化性研究[J]. 食品研究与开发,2020,41(7):12−18. [ZHU Y J. Study on the enrichment of total anthocyanins from black goji berry by glucan gel column chromatography and its antioxidant capacity[J]. Food Research and Development,2020,41(7):12−18.] doi: 10.12161/j.issn.1005-6521.2020.07.003 ZHU Y J . Study on the enrichment of total anthocyanins from black goji berry by glucan gel column chromatography and its antioxidant capacity[J]. Food Research and Development,2020 ,41 (7 ):12 −18 . doi: 10.12161/j.issn.1005-6521.2020.07.003[5] STEVENS L J, KUCZEK T, BURGESS J R, et al. Mechanisms of behavioral, atopic, and other reactions to artificial food colors in children[J]. Nutrition Reviews,2013,71(5):268−281. doi: 10.1111/nure.12023
[6] YOUSUF B, GUL K, WANI A A, et al. Health benefits of anthocyanins and their encapsulation for potential use in food systems:A review[J]. Critical Reviews in Food Science and Nutrition,2016,56(13):2223−2230. doi: 10.1080/10408398.2013.805316
[7] DENEV P, CÍ M, KRATCHANOVA M, et al. Black chokeberry ( Aronia melanocarpa) polyphenols reveal different antioxidant, antimicrobial and neutrophil-modulating activities[J]. Food Chemistry,2019,284:108−117. doi: 10.1016/j.foodchem.2019.01.108
[8] WEBER F, BOCH K, SCHIEBER A. Influence of copigmentation on the stability of spray dried anthocyanins from blackberry[J]. LWT - Food Science and Technology,2017,75:72−77. doi: 10.1016/j.lwt.2016.08.042
[9] HEINONEN J, FARAHMANDAZAD H, VUORINEN A, et al. Extraction and purification of anthocyanins from purple-fleshed potato[J]. Food and Bioproducts Processing,2016,99:136−146. doi: 10.1016/j.fbp.2016.05.004
[10] CAI Z, QU Z, LAN Y, et al. Conventional, ultrasound-assisted, and accelerated-solvent extractions of anthocyanins from purple sweet potatoes[J]. Food Chemistry,2016,197:266−272. doi: 10.1016/j.foodchem.2015.10.110
[11] XU Z, GAO Y, SHI S, LIU X. Study on the extraction of pigment from purple sweet potato powder by microwave-assisted technique[J]. Food Science,2005,26:234−239.
[12] ZHU Z, GUAN Q, KOUBAA M, et al. HPLC-DAD-ESI-MS2 analytical profile of extracts obtained from purple sweet potato after green ultrasound-assisted extraction[J]. Food Chemistry,2017,215:391−400. doi: 10.1016/j.foodchem.2016.07.157
[13] JOKIOJA J, LINDERBORG K M, KORTESNIEMI M, et al. Anthocyanin-rich extract from purple potatoes decreases postprandial glycemic response and affects inflammation markers in healthy men[J]. Food Chemistry,2020,310:125797. doi: 10.1016/j.foodchem.2019.125797
[14] ZANNOU O, KOCA I, ALDAWOUD T M S, et al. Recovery and stabilization of anthocyanins and phenolic antioxidants of roselle ( Hibiscus sabdariffa L.) with hydrophilic deep eutectic solvents[J]. Molecules,2020,25(16):3715. doi: 10.3390/molecules25163715
[15] POPOVIC B M, MICIC N, POTKONJAK A, et al. Novel extraction of polyphenols from sour cherry pomace using natural deep eutectic solvents-ultrafast microwave-assisted NADES preparation and extraction[J]. Food Chemistry,2022,366:130562−130562. doi: 10.1016/j.foodchem.2021.130562
[16] YAN X Y, CAI Z H, ZHAO P Q, et al. Application of a novel and green temperature-responsive deep eutectic solvent system to simultaneously extract and separate different polar active phytochemicals from Schisandra chinensis (Turcz.) Baill[J]. Food Research International,2023,165:112541−112541. doi: 10.1016/j.foodres.2023.112541
[17] OLAWUYI I F, PARK J J, LEE W Y. Preparation and film properties of carboxymethyl cellulose from leafstalk waste of okra:Comparative study of conventional and deep eutectic solvent pulping methods[J]. Food Hydrocolloids,2023,138:108464−108464. doi: 10.1016/j.foodhyd.2023.108464
[18] DA SILVA D T, SMANIOTTO F A, COSTA I F, et al. Natural deep eutectic solvent (NADES):A strategy to improve the bioavailability of blueberry phenolic compounds in a ready-to-use extract[J]. Food Chemistry,2021,364:130370−130370. doi: 10.1016/j.foodchem.2021.130370
[19] 仇干, 李雨杰, 王丹凤, 等. 紫马铃薯片真空微波干燥动力学及工艺优化[J]. 上海交通大学学报(农业科学版),2018,36(2):70−75,82. [QIU G, LI Y J, WANG D F, et al. Vacuum microwave drying kinetics and process optimization of purple sweet potato slices[J]. Journal of Shanghai Jiaotong University (Agricultural Science),2018,36(2):70−75,82.] doi: 10.3969/J.ISSN.1671-9964.2018.02.012 QIU G, LI Y J, WANG D F, et al . Vacuum microwave drying kinetics and process optimization of purple sweet potato slices[J]. Journal of Shanghai Jiaotong University (Agricultural Science),2018 ,36 (2 ):70 −75,82 . doi: 10.3969/J.ISSN.1671-9964.2018.02.012[20] 崔倩. 紫马铃薯花色苷的提取纯化和结构鉴定[D]. 杭州:浙江大学, 2011. [CUI Q. Study on purple potato anthocyanins extraction, isolation and identification[D]. Hangzhou:Zhejiang University, 2011.] CUI Q. Study on purple potato anthocyanins extraction, isolation and identification[D]. Hangzhou: Zhejiang University, 2011.
[21] 于雅静, 单虹宇, 孔露, 等. 响应面法优化玫瑰花色苷超声辅助提取工艺[J]. 食品工业科技,2018,39(13):173−179. [YU Y J, SHAN H Y, KONG L, et al. Optimization of ultrasound-assisted extraction of rose anthocyanins by response surface methodology[J]. Science and Technology of Food Industry,2018,39(13):173−179.] doi: 10.13386/j.issn1002-0306.2018.13.031 YU Y J, SHAN H Y, KONG L, et al . Optimization of ultrasound-assisted extraction of rose anthocyanins by response surface methodology[J]. Science and Technology of Food Industry,2018 ,39 (13 ):173 −179 . doi: 10.13386/j.issn1002-0306.2018.13.031[22] 韩东, 李建颖, 孙怡, 等. 黑果腺肋花楸花色苷微波辅助提取工艺优化[J]. 食品研究与开发,2022,43(13):59−65. [HAN D, LI J Y, SUN Y, et al. Optimization of microwave-assisted extraction of anthocyanins from black fruited gland ribbed Sorbus[J]. Food Research and Development,2022,43(13):59−65.] HAN D, LI J Y, SUN Y, et al . Optimization of microwave-assisted extraction of anthocyanins from black fruited gland ribbed Sorbus[J]. Food Research and Development,2022 ,43 (13 ):59 −65 .[23] XIA N, XIONG L, BI S, et al. Development of biocompatible DES/NADES as co-solvents for efficient biosynthesis of chiral alcohols[J]. Bioprocess and Biosystems Engineering,2020,43:1987−1997. doi: 10.1007/s00449-020-02387-5
[24] OOMEN W W, BEGINES P, MUSTAFA N R, et al. Natural deep eutectic solvent extraction of flavonoids of Scutellaria baicalensis as a replacement for conventional organic solvents[J]. Molecules (Basel, Switzerland),2020,25(3):617−617. doi: 10.3390/molecules25030617
[25] 于世莹, 王文秀, 马倩云, 等. 紫马铃薯花色苷的提取、纯化及其稳定性研究[J]. 食品工业科技,2020,41(21):156−163. [YU S Y, WANG W X, MA Q Y, et al. Extraction, purification and stability study of anthocyanins from purple sweet potato[J]. Science and Technology of Food Industry,2020,41(21):156−163.] doi: 10.13386/j.issn1002-0306.2020030003 YU S Y, WANG W X, MA Q Y, et al . Extraction, purification and stability study of anthocyanins from purple sweet potato[J]. Science and Technology of Food Industry,2020 ,41 (21 ):156 −163 . doi: 10.13386/j.issn1002-0306.2020030003[26] WANG Y, JIA J, REN X, et al. Extraction, preliminary characterization and in vitro antioxidant activity of polysaccharides from Oudemansiella radicata mushroom[J]. International Journal of Biological Macromolecules,2018,120:1760−1769. doi: 10.1016/j.ijbiomac.2018.09.209
[27] MENG L, ZHU J, MA Y, et al. Composition and antioxidant activity of anthocyanins from Aronia melanocarpa cultivated in Haicheng, Liaoning, China[J]. Food Bioscience,2019,30(C):106102−106102.
[28] SAMSONOWICZ M, REGULSKA E, KARPOWICZ D, et al. Antioxidant properties of coffee substitutes rich in polyphenols and minerals[J]. Food Chemistry,2019,278:101−109. doi: 10.1016/j.foodchem.2018.11.057
[29] MARTYNENKO A, CHEN Y. Degradation kinetics of total anthocyanins and formation of polymeric color in blueberry hydrothermodynamic (HTD) processing[J]. Journal of Food Engineering,2016,171(4):44−51.
[30] NAVAS M J, JIMÉNEZ-MORENO A M, BUENO J M, et al. Analysis and antioxidant capacity of anthocyanin pigments. Part IV:Extraction of anthocyanins[J]. Critical Reviews in Analytical Chemistry,2012,42(4):313−342. doi: 10.1080/10408347.2012.680343
[31] ALI A R. Review on extraction of phenolic compounds from natural sources using green deep eutectic solvents[J]. Journal of Agricultural and Food Chemistry,2021,69(3):878−912. doi: 10.1021/acs.jafc.0c06641
[32] BI Y H, CHI X W, ZHANG R, et al. Highly efficient extraction of mulberry anthocyanins in deep eutectic solvents:Insights of degradation kinetics and stability evaluation[J]. Innovative Food Science & Emerging Technologies,2020,66:102512.
[33] SKARPALEZOS D, DETSI A. Deep eutectic solvents as extraction media for valuable flavonoids from natural sources[J]. Applied Sciences,2019,9(19):4169−4169. doi: 10.3390/app9194169
[34] BERTOLO M R V, MARTINS V C A, PLEPIS A M G, et al. Utilization of pomegranate peel waste:Natural deep eutectic solvents as a green strategy to recover valuable phenolic compounds[J]. Journal of Cleaner Production,2021,327:129471−129471. doi: 10.1016/j.jclepro.2021.129471
[35] BOSILJKOV T, DUJMI F, CVJETKO BUBALO M, et al. Natural deep eutectic solvents and ultrasound-assisted extraction:Green approaches for extraction of wine lees anthocyanins[J]. Food and Bioproducts Processing,2017,102:195−203. doi: 10.1016/j.fbp.2016.12.005
[36] SHANG X, ZHANG M, HU J, et al. Chemical compositions, extraction optimizations, and in vitro bioactivities of flavonoids from perilla leaves ( Perillae folium) by microwave-assisted natural deep eutectic solvents[J]. Antioxidants,2022,12(1):104−104. doi: 10.3390/antiox12010104
[37] HADAVI R, JAFARI S M, KATOUZIAN I. Nanoliposomal encapsulation of saffron bioactive compounds; characterization and optimization[J]. International Journal of Biological Macromolecules,2020,164:4046−4053. doi: 10.1016/j.ijbiomac.2020.09.028
[38] 张海霞, 包良, 王晓兰, 等. 紫色马铃薯花青素的提取和稳定性评价[J]. 食品研究与开发,2021,42(11):103−108. [ZHANG H X, BAO L, WANG X L, et al. Extraction and stability evaluation of anthocyanins from purple sweet potato[J]. Food Research and Development,2021,42(11):103−108.] doi: 10.12161/j.issn.1005-6521.2021.11.017 ZHANG H X, BAO L, WANG X L, et al . Extraction and stability evaluation of anthocyanins from purple sweet potato[J]. Food Research and Development,2021 ,42 (11 ):103 −108 . doi: 10.12161/j.issn.1005-6521.2021.11.017[39] CONDURACHE N N, CROITORU C, ENACHI E, et al. Eggplant peels as a valuable source of anthocyanins:Extraction, thermal stability and biological activities[J]. Plants,2021,10(3):577. doi: 10.3390/plants10030577
-
期刊类型引用(1)
1. 范佳倩,宫春宇,王岩,吴红艳,王拓一. 液态发酵制备玉米须粗多糖的理化特性及其抗氧化活性分析. 食品与发酵工业. 2024(21): 128-135 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



