Probiotic Characteristics of Lactic Acid Bacteria Isolated from the Intestinal Tract of Mothers and Infants in Hotan, Xinjiang
-
摘要: 本研究以新疆和田地区维吾尔族母婴粪便为样品源,对其中乳酸菌(Lactic acid bacteria)进行分离鉴定。测定乳酸菌菌株对腹泻致病菌抑菌性能,及抑菌乳酸菌菌株的体外益生特征实验。依据groEL功能基因测序从19对母婴样本分离出属于15个种的113株乳酸菌,其中优势种是唾液联合乳杆菌(Ligilactobacillus salivarius)和香肠伴生乳杆菌(Companilactobacillus farciminis)。从113株乳酸菌菌株中筛选得到29株菌株对6种腹泻致病菌都有抑制效果,其中,香肠伴生乳杆菌HTb36X-2通过4 h的模拟胃肠液处理后存活率最高达69.50%;罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)HTb34X5-6、HTb34X5-1自聚性最高与疏水性最高,其疏水性分别为31.67%和29.00%,自聚性分别为81.32%和70.91%;并结合抑菌菌株的抗生素耐药性和碳源代谢能力,最终筛选出香肠伴生乳杆菌HTb36X-2,副干酪乳酪杆菌(Lacticaseibacillus paracasei)HTb6X-6,干酪乳酪杆菌(Lacticaseibacillus casei)17X-4、17X-5,罗伊氏粘液乳杆菌HTb34X-5-1、HTb34X-5-6,发酵粘液乳杆菌(Limosilactobacillus fermentum)10D12-2 共7株作为潜在益生菌菌株,为开发具有抗腹泻功能的优良益生菌株及产品奠定前期基础。Abstract: In this study, the lactic acid bacteria from the feces of Uygur mother-infant pairs in Hotan, Xinjiang, was isolated and identified. The bacteriostatic performance of the isolates for diarrhea pathogenic bacteria was assessed, and the probiotic properties were investigated in vitro. According to the groEL gene sequencing, 113 isolates of lactic acid bacteria representing 15 species were isolated from 19 mother-infant pairs, with Ligilactobacillus salivarius and Companilactobacillus farciminis being the dominant species, and 29 strains had inhibition effect on all the 6 pathogenic bacteria were screened from all strains. Among the strains with antibacterial activity, Companilactobacillus farciminis HTb36X-2 had the highest survival rate of 69.50% after being treated with simulated gastrointestinal juices for 4 h. Limosilactobacillus reuteri HTb34X5-6 and HTb34X5-1 had the highest auto-aggregation and hydrophobicity, with the hydrophobicity of 31.67% and 29.00%, and auto-aggregation of 81.32% and 70.91%, respectively. Combined with antibiotic resistance and carbohydrate metabolism of all 29 strains, a total of 7 strains of Companilactobacillus farciminis HTb36X-2, Lacticaseibacillus paracasei HTb6X-6, Lacticaseibacillus casei 17X-4, 17X-5, Limosilactobacillus reuteri HTb34X-5-1, HTb34X-5-6, Limosilactobacillus fermentum 10D12-2 were screened as potential probiotics, which might take a foundation for the development of probiotic and products with anti-diarrhea function.
-
Keywords:
- lactic acid bacteria /
- groEL /
- antibacterial activity /
- probiotic properties /
- probiotic
-
腹泻是儿童疾病中的一种常见类型,腹泻类型包括胃源性腹泻、肠源性腹泻以及感染性腹泻,在这三种类型中感染性腹泻最为常见[1]。据报道,沙门氏菌、致病性大肠杆菌和弯曲杆菌等致病菌引起的感染性腹泻是婴儿生病甚至死亡的主要原因[2]。益生菌是指在摄入一定的数量后,可以在人体肠道内存活并定植,进一步影响肠道内已有菌群的生长,从而调节宿主的健康的一类微生物。研究表明,益生菌能够抑制肠道致病菌的生长和活性,其中最常见的就是利用乳酸菌进行腹泻的治疗[3−4]。
乳酸菌(Lactic acid bacteria,LAB)是一种异质性的革兰氏阳性细菌,被认为是最常见和最典型的含有益生菌菌株的细菌菌群,其与人类生活息息相关,它们主要调节宿主的内部环境,从而对宿主的健康发挥重要作用[5−6]。乳酸菌的抑菌作用与其代谢产物密切相关,不同乳酸菌的代谢产物不同抑菌效果不同。研究报道,乳酸菌发酵过程产生的有机酸可以与某些成分结合来破坏细胞膜稳定性,达到抑菌作用[7],如Bergsson等[8]研究发现,脂肪酸可以穿透致病细胞,并跟其质膜结合,改变膜的通透性,达到抑菌效果;乳酸菌还可以通过其自身在生长繁殖过程中与病原微生物争夺结合位点和营养物质从而达到抑菌效果[9]。乳酸菌因其抑菌效果被广泛应用医药领域,但是也存在一些问题,如抑菌效果低和抑菌活性不稳定等[10],筛选具有良好抑菌活性和临床应用的乳酸菌是开发乳酸菌治疗药物的基础。
新疆独特的地理气候与人文饮食习惯,造就了丰富的益生菌菌株资源,基于此,本研究以新疆和田地区维吾尔族母婴粪便为样品源,对其中乳酸菌进行分离鉴定。测定乳酸菌菌株的致病菌抑菌性能,开展抑菌乳酸菌菌株的模拟胃肠液耐受性、抗生素耐药性、疏水性与自凝聚性、碳水化合物代谢等体外益生特征实验,从而筛选出具有潜在益生特性的抑菌乳酸菌,以期通过后期体内实验,为开发适应区域人群的高活性益生乳酸菌及产品奠定相关前期基础。
1. 材料与方法
1.1 材料与仪器
试验所采集的样品来自新疆和田地区,有19对健康的维吾尔族母亲及其婴儿参与了本次研究。在研究开始前,所有成年参与者和所有参与研究的婴儿的父母或监护人都签署了书面知情同意书。根据以下入选标准招募的志愿者:a.志愿者近期无胃肠道不适史;b.至少6个月内未服用抗生素或影响肠道微生物的药物;c.不服用益生菌产品。提前联系好志愿者,记录志愿者年龄、性别、身高体重和饮食习惯等基本信息。在每个无菌粪便容器中收集粪便样品(3 g左右),采集样品后置于−4 ℃车载冰箱保存,采样结束后快速运回实验室,置于−20 ℃冰箱保存备用。
指示菌 购买自中国工业微生 物菌种保藏管理中心,见表1;Taq Plus Master Mix(2×) 南京诺唯赞生物科技股份有限公司;0.22 μm微孔滤膜 上海兴亚净化材料厂;抗生素药片、二甲苯 北京索宝莱科技有限公司;供试碳源 上海源叶生物科技有限公司;胃蛋白酶(500 U/mg)、胰蛋白酶(75 U/mg)、牛胆盐 北京博奥拓科技有限公司;其余试剂均为分析纯或进口试剂。所用培养基配方见表2。
表 1 致病菌与培养基Table 1. Pathogenic bacteria and culture medium菌种 培养基 产肠毒素大肠埃希氏菌(Escherichia coli ETEC O78:K80) CICC 10421 营养肉汁琼脂 鼠伤寒沙门氏菌(Salmonella enterica subsp. enterica serovar Typhimurium) CICC 10420 营养肉汁琼脂 出血性大肠埃希氏菌(Escherichia coli EHEC O157:H7) CICC 21530 营养肉汁琼脂 单核细胞性李斯特菌(Listeria monocytogenes) CGMCC 1.9136 LS1 PYG培养基 血清型肠炎沙门氏菌(Salmonella enterica subsp. enterica) CGMCC 1.9136 SM1 TSA培养基 致泻大肠埃希氏菌(Escherichia coli EPEC O127:K63) CICC 10411 营养肉汁琼脂 表 2 培养基配方Table 2. Media formula培养基名称 成分(含量) LAMVAB培养基 牛肉膏(8 g/L)、蛋白胨(10 g/L)、葡萄糖(20 g/L)、磷酸氢二钾(2 g/L)、琼脂(20 g/L)、溴甲酚绿(0.05 g/L)、
柠檬酸氢二铵(2 g/L)、硫酸锰(0.05 g/L)、吐温-80(1 mL/L)、酵母浸粉(5 g/L)、L-半胱氨酸盐酸盐(0.5 g/L)、
盐酸万古霉素(0.02 g/L)、硫酸镁(0.2 g/L)、无水乙酸钠(5 g/L),调节pH至5.0PYG培养基 蛋白胨(10 g/L)、酵母提取物(5 g/L)、葡萄糖(1 g/L)、琼脂(15 g/L),调节pH至6.8 营养肉汁琼脂 蛋白胨(5 g/L)、牛肉膏(3 g/L)、NaCl(5 g/L)、琼脂(20 g/L),调节pH至7.0 TSA 培养基 胰蛋白胨(15 g/L)、大豆蛋白胨(5 g/L)、NaCl(5 g/L)、琼脂(15 g/L)、调节pH至7.2 MRS培养基 牛肉膏(10 g/L)、蛋白胨(10 g/L)、葡萄糖(20 g/L)、磷酸氢二钾(2 g/L)、琼脂(20 g/L)、溴甲酚绿(0.05 g/L)、
柠檬酸氢二铵(2 g/L)、硫酸锰(0.05 g/L)、吐温-80(1 mL/L)、酵母浸粉(5 g/L)、硫酸镁(0.58 g/L)、无水乙酸钠(5 g/L)DG520厌氧培养箱 英国DWS公司;Fresco 21高速冷冻离心机 Thermo Scientific公司;TP professionalPCR仪 德国Biometra公司;PowerPac Universal水平电泳仪、Gel DOC XR凝胶成像系统 美国BioRad公司;HX-2Y细胞破碎仪 天津市欧诺仪器仪表有限公司公司;EON多功能酶标仪 美国Biotek公司;vortex-6涡旋仪 其林贝尔仪器制造有限公司。
1.2 实验方法
1.2.1 乳酸菌的分离鉴定
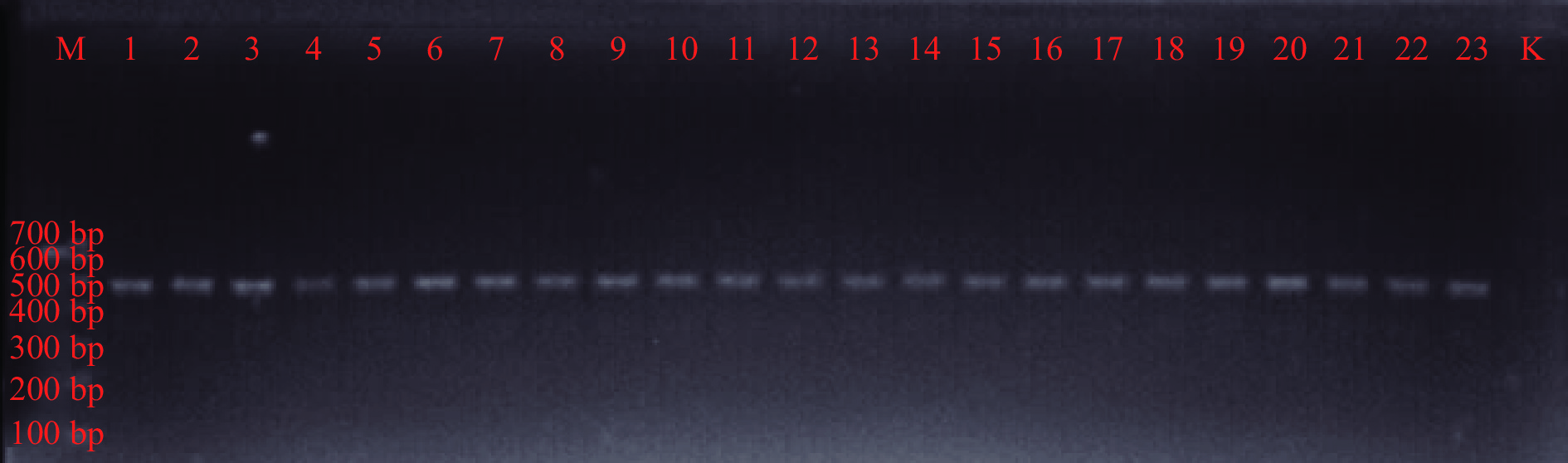
从粪便样本中分离出候选乳酸菌,为提高应变分离的多样性,采用直接稀释法与平板扩散法,将1 g粪便样品接种到9 mL MRS肉汤中,使用涡旋仪充分混匀2 min,并用无菌生理盐水连续稀释样品至10−3、10−4、10−5,将不同稀释度的悬液(100 μL)均匀涂布于LAMVAB琼脂培养基,厌氧环境中37 ℃培养24~48 h。根据培养物的形态、大小、颜色、观察特征,每个平板取8~10个菌落,每个样品取25~30个菌落,镜检至纯。菌株DNA的提取依据CTAB法并稍作修改进行[11],采用引物Lac-groEL-F(5’-TCCGATTACGAYCGYGAGAAGCT-3’)和Lac-groEL-R(5’- CSGCYTCGGTSGTCAGGAACAG-3’)对分离株按照表3进行groEL基因的种级PCR扩增[12],PCR反应扩增条件如下:预变性:95 ℃,8 min;变性:95 ℃ 40 s;退火:60 ℃、40 s;延伸:72 ℃,40 s;30次循环;终延伸:72 ℃,8 min。经琼脂糖凝胶电泳后得到500 bp左右的清晰单一条带。将扩增产物送至江苏金唯智生物有限公司进行测序,测序结果提交至GenBank数据库中进行序列同源性比对(BLAST),比对相似值大于98%初步确定菌种物种。采用MEGA 6.0软件构建系统发育进化树[13]。
表 3 基于groEL基因的种间PCR扩增Table 3. Interspecific PCR amplification based on groEL genePCR扩增体系成分 用量(μL) Premix Taq(2×) 12.5 Lac-groEL-F(20 μmol/L) 0.5 Lac-groEL-R(20 μmol/L) 0.5 DNA模板(30~60 ng) 3 ddH2O 8.5 1.2.2 具有抑菌活性乳酸菌的筛选
将乳酸菌以2%的接种量接种到 MRS 液体培养基中,在37 ℃下培养18 h后,离心(4 ℃,10000 r/min,5 min),取上清液。用0.22 μm微孔滤膜过滤上清液,并将上清液储存于4 ℃条件备用。将6种不同的指示菌(表1)按2%的接种量分别接种于对应的PYG培养基、营养肉汁琼脂、TSA 培养基中,37 ℃恒温培养18 h。用牛津杯法测定菌株的抑菌活性[14],取指示菌100 μL(约108 CFU/mL)涂布于对应的琼脂培养基表面,将无菌牛津杯平行放置于平板中,在牛津杯中加入200 μL待测样品,在4 ℃冰箱预扩散6 h后,37 ℃恒温培养24 h,观察抑菌圈大小并测量其直径。
1.2.3 抑菌乳酸菌的抑菌物质测定
用过滤除菌的NaOH溶液(1 mol/L)调节发酵上清液 pH至6.0,相同pH的MRS作为对照,在牛津杯中加入200 μL发酵上清液, 4 ℃预扩散6 h后将平板置于37 ℃恒温培养箱中,培养24 h,观察并测量抑菌圈直径。
1.2.4 抑菌乳酸菌的益生特性分析
1.2.4.1 模拟胃肠液耐受性
人工模拟胃肠液需新鲜配制。125 mmol/L NaCl、7 mmol/L KCl、45 mmol/L NaHCO3和3 g/L胃蛋白酶(500 U/mg),用盐酸调节pH2.5,经0.22 μm滤膜过滤后制备成模拟胃液;45 mmol/L NaCl、1 g/L胰蛋白酶(75 U/mg)、3 g/L牛胆盐,用1 mol/L NaOH调至pH8.0,经0.22 μm滤膜过滤后制备成模拟肠液;乳酸菌菌株在37 ℃厌氧培养箱中培养过夜,离心菌液(8000 r/min,5 min,4 ℃),弃上清液留菌体沉淀,重悬于MRS液体培养基中使其菌液密度调节为1×109 CFU/mL,加入等体积人工胃液(3 g/L胃蛋白酶)或人工肠液(1 g/L胰蛋白酶、3 g/L牛胆盐),37 ℃ 恒温培养箱中培养0、4 h,培养后进行梯度稀释,取合适的稀释液涂布于MRS平板上,37 ℃静置培养48 h,活菌计数。计算公式如下:
存活率(%)=N1/N×100 式中:N1模拟胃液或肠液处理4 h后的活菌数(CFU/mL);N为模拟胃液或肠液处理0 h的活菌数(CFU/mL)。
1.2.4.2 菌株的疏水性与自凝聚性
通过测定微生物对二甲苯的亲和力来评价各菌株的细胞表面疏水性[15−16]。乳酸菌菌株在MRS中培养16 h后,离心(6000 r/min,10 min)收集菌体,用pH7.2的无菌磷酸盐缓冲液(PBS)洗涤菌体两次,并在同一缓冲液中重悬。用酶标仪测定悬液的光密度OD600(A0)。然后将1 mL二甲苯加入到3 mL乳酸菌悬浮液中,涡旋混合2 min,37 ℃静置1 h,水相与二甲苯相分离。除去水相,用酶标仪测量水相OD600(A1)。细胞疏水性的百分比按下面公式计算:
疏水性(%)=(1−A1/A0)×100 乳酸菌菌株在MRS中培养16 h后,用PBS(pH7.2)洗涤两次,重新悬浮在同一缓冲液中并稀释至OD600=0.6±0.1。取稀释液200 μL,加PBS至2 mL,涡旋10 s后用酶标仪测定OD600(A0)。取2 mL细菌悬液旋涡10 s,随后于37 ℃恒温培养,于2、4 h处分别取样菌悬液上清液200 μL,加PBS至2 mL,涡旋10 s后用酶标仪测定OD600(At)。细胞自聚性的百分比按下面公式计算:
自聚性(%)=(1−At/A0)×100 式中:At表示分别在2 h与4 h处的OD600吸光值,A0表示0 h处的OD600吸光值。
1.2.4.3 抗生素敏感性试验
采用纸片扩散法(K-B法)测定抑菌乳酸菌菌株对10种抗生素的敏感性[17]。吸取100 µL(约108 CFU/mL)活化后乳酸菌菌悬液,使用无菌棉签将其均匀涂布于MRS琼脂平板表面,用无菌镊子将药片轻轻贴于其上,37 ℃培养24 h,检测抑菌圈直径,每种抗生素做3个平行。结果参照实验室标准协会(CLSI)进行耐药性能评估,见表4。
表 4 药敏纸片标准Table 4. Criteria of drug sensitive paper抗生素种类 含量(μg/片) 判断标准(mm) 耐药 中度敏感 敏感 庆大霉素(CN) 10 ≤13 14~17 ≥18 苯唑西林(OX) 10 ≤13 14~17 ≥18 米洛环素(MH) 30 ≤13 14~17 ≥18 青霉素(P) 10 ≤13 14~17 ≥18 氨苄西林(AMP) 10 ≤13 14~17 ≥18 左氧氟沙星(LEV) 5 ≤13 14~16 ≥17 环丙沙星(CIP) 10 ≤15 16~20 ≥21 磺胺甲恶唑(RL) 25 ≤16 17~19 ≥20 克林霉素(DA) 10 ≤14 15~20 ≥21 红霉素(E) 10 ≤13 14~22 ≥23 1.2.4.4 碳水化合物代谢试验
抑菌乳酸菌活化后以2%接种量接种于MRS液体培养基中,37 ℃厌氧培养18 h,无菌条件下离心(10000×g,5 min,4 ℃)弃上清液,用无菌生理盐水将菌体洗涤2次后,重悬于1 mL生理盐水中。以2%的接种量将菌悬液接种到含有不同碳源(葡萄糖、木糖、果糖、半乳糖、阿拉伯糖、甘露糖、低聚果糖、低聚木糖、低聚半乳糖、低聚异麦芽糖)的改良MRS液体培养基中,以葡萄糖为阳性对照,不添加碳源为阴性对照,测定0 h的OD600吸光度值OD1。37 ℃厌氧培养18 h后测定OD600吸光度值OD2,最终OD600=OD2-OD1。参照王明芳等[18]定义OD600<0.15为不生长,0.15≤OD600≤0.35为有限生长,OD600>0.35为生长良好。
1.3 数据处理
所有实验平行三次,使用软件Excel 2021处理实验数据,结果以平均值±标准偏差表示。使用Origin 2022绘制图表并分析。在NCBI数据库中使用BLAST分析基因序列的序列同源性,使用MEGA 6.0绘制系统发育树。
2. 结果与分析
2.1 乳酸菌的分离鉴定
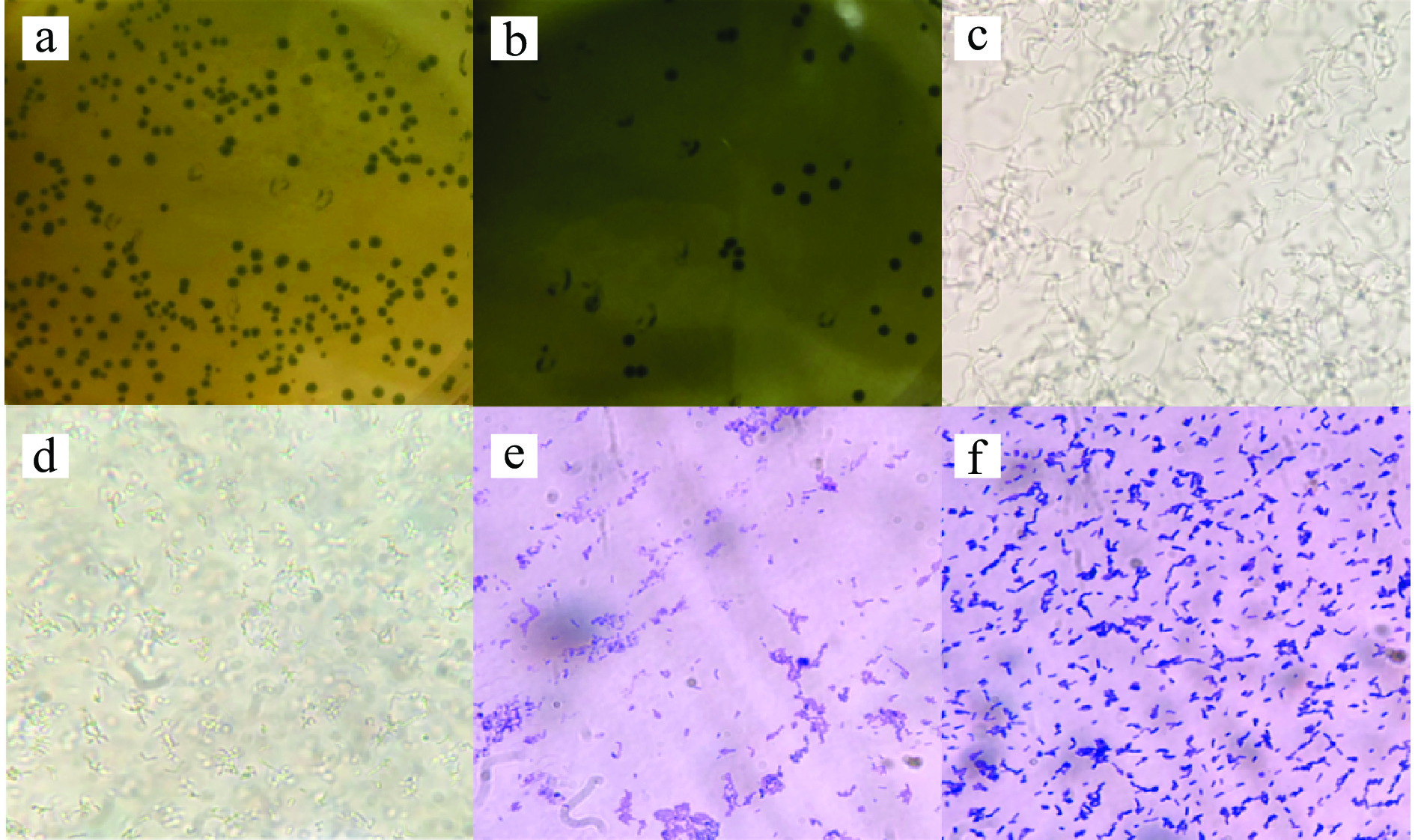
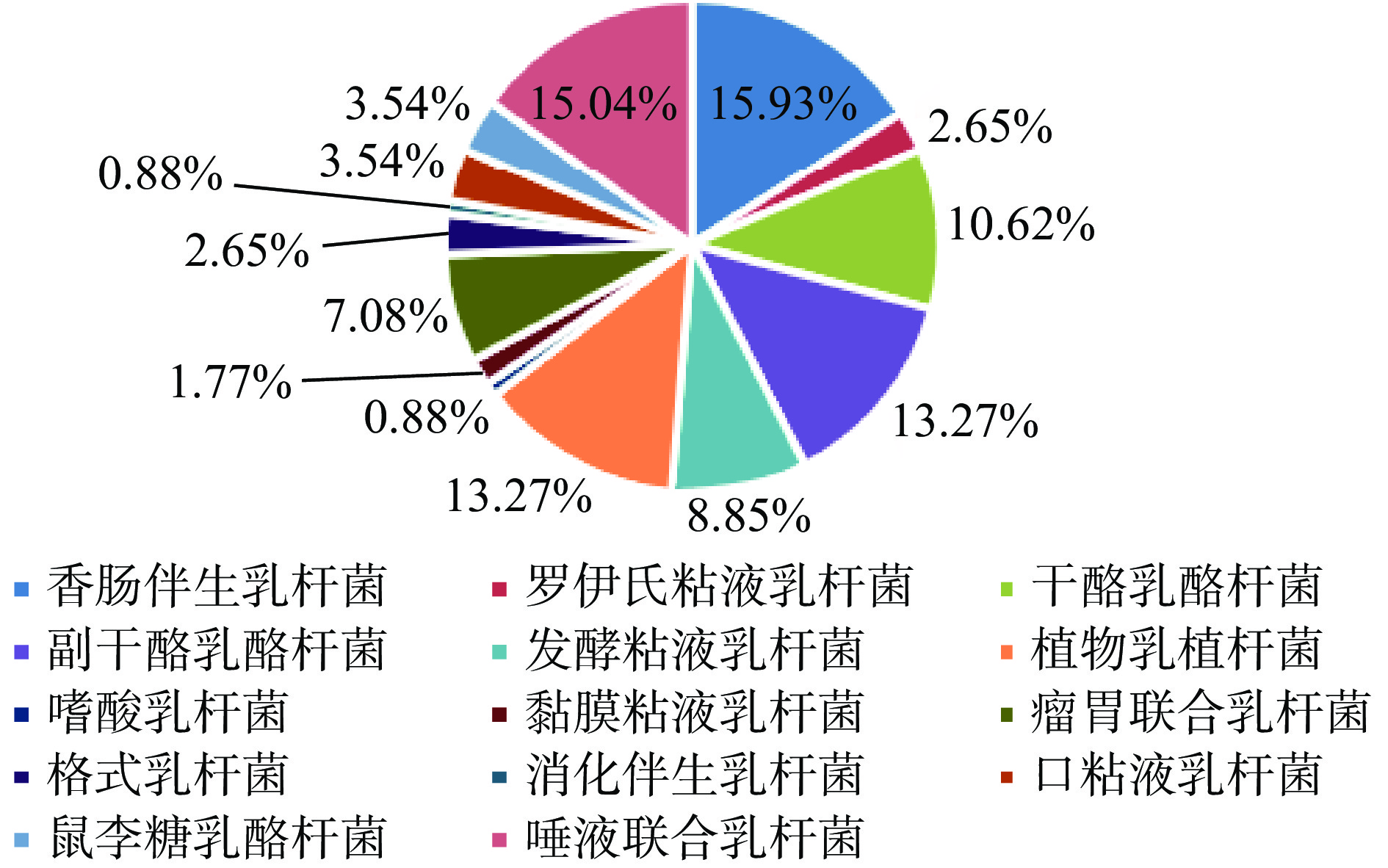
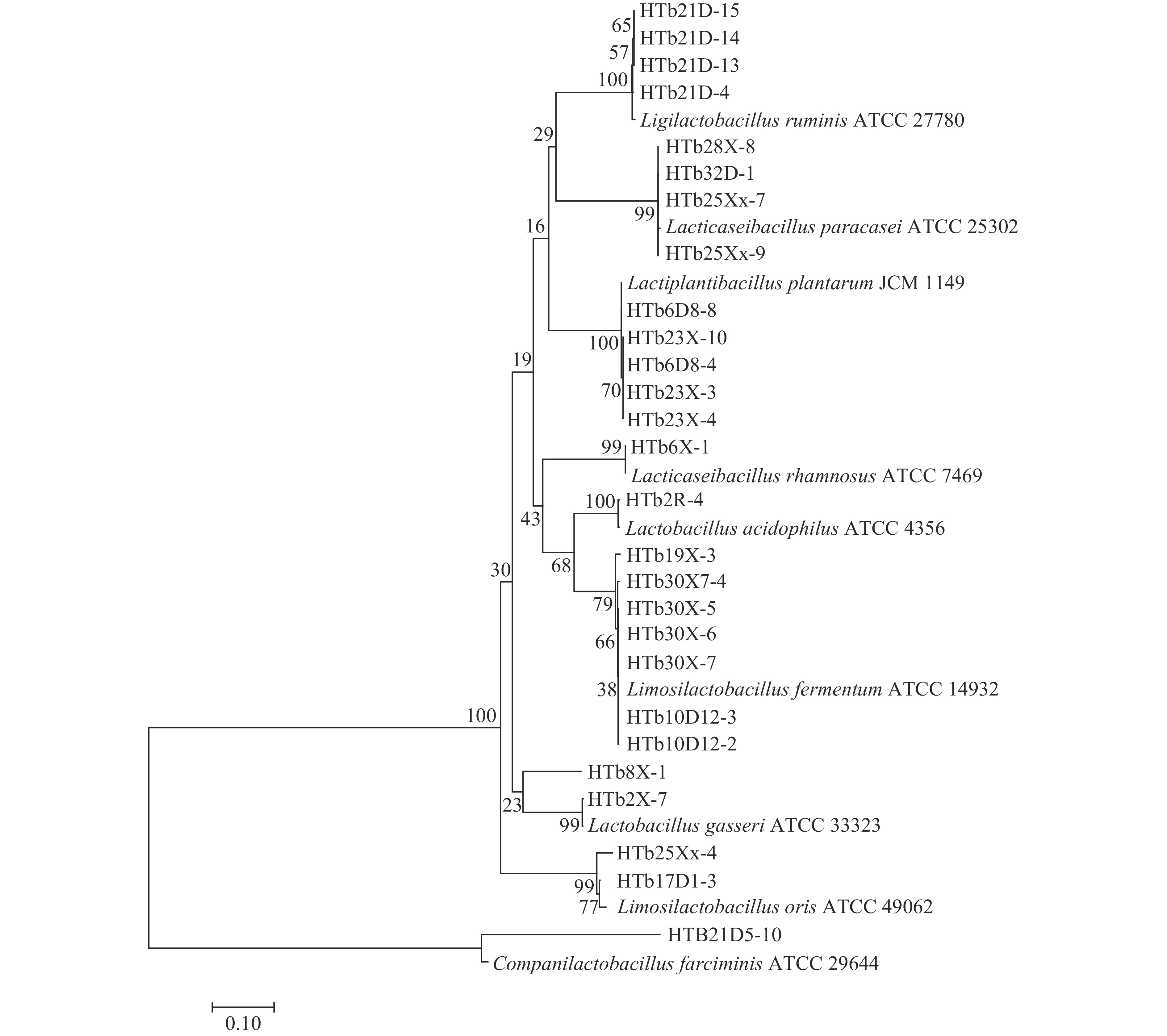
乳酸菌在自然界中广泛存在,主要从肉类、发酵食品、土壤和人类和动物肠道等基质中分离出来。然而,与从其他基质中分离出来的乳酸菌相比,来自人类肠道的乳酸菌具有适应胃肠道环境和能够长时间定殖等优点[19]。表型和基因型相结合的方法已成为鉴定和评估目标微生物群落物种组成的首选方法[20]。本研究对新疆和田地区维吾尔族来源的母婴粪便中乳酸菌进行分离鉴定,部分菌株菌落形态及镜检、革兰氏染色见图1,大多数菌落中间是半透明的,边缘规则,没有褶皱,少数菌落表面相对暗淡粗糙,边缘不规则,镜下检查菌落形态均匀,细胞形态呈杆状(长、短)、圆形(椭圆)。提取疑似乳酸菌DNA后,选择合适的程序进行PCR扩增,部分疑似乳酸菌的groEL基因扩增结果如图2所示,在500 bp有明显条带,对扩增产物进行测序,通过BLAST比对测序结果。从19对母婴样本中共分离出113株乳酸菌,分属于14个种,如图3所示,其中所占百分比最多的是唾液联合乳杆菌(Ligilactobacillus salivarius)和香肠伴生乳杆菌(Companilactobacillus farciminis),所占比例分别为15.04%和15.93%,因此,这两种乳酸菌是母婴肠道的优势菌群。部分菌株groEL基因序列构建系统发育树见图4。
2.2 乳酸菌的抑菌活性分析
通过分析从母婴粪便中分离出的113株乳酸菌对6种常见病原体的抑菌活性,共筛选出29株具有良好抑菌活性的乳酸菌进行后续研究,部分菌株的牛津杯实验结果如图5所示,抑菌菌株的抑菌活性见表5。本次试验的结果表明所试菌株至少对3种肠道致病菌有抑制作用,所有菌株均表现出致病菌Escherichia coli 10411和Escherichia coli 10421的抑菌活性,5株干酪乳酪杆菌HTb17X-5、HTb10D-3、HTb8X4-6、HTb17X-4、HTb8X-8,4株副干酪乳酪杆菌 HTb28X-10、HTb32D-1、HTb25Xx-9、HTb6X-6,6株植物乳植杆菌HTb6D8-8、HTb6D8-3、HTb6D8-4、HTb23X-3、HTb23X-4、HTb23X-10,5株香肠伴生杆菌HTb21D5-10、HTb36X-2、HTb9X1-1、HTb20X6-1、HTb8X-5,1株鼠李糖乳酪杆菌HTb6X-1,2株口粘液乳杆菌HTb17D1-3、HTb25Xx-4,1株格式乳杆菌HTb2X-7,2株罗伊氏粘液乳杆菌HTb34X5-1、HTb34X5-6,3株发酵粘液乳杆菌HTb30X-6、HTb19X-3、HTb10D12-2共29株对使用的所有病原菌均具有抑制活性,其中干酪乳酪杆菌HTb10D-3对肠道致病菌Escherichia coli 10411、Escherichia coli 21530、Salmonella enterica subsp. enterica serovar Typhimurium 10420和Salmonella enterica subsp. enterica SM1的抑菌活性最强。尹杨燕等[7]筛选出植物乳植杆菌GX20200417-1可作为潜在的益生菌用于动物饲料的生产,菌株对于大肠杆菌、金黄色葡萄球菌、沙门氏菌的抑菌圈直径分别为16、14、15 mm,低于本研究中菌株的抑菌活性。因此筛选出的具有抑菌活性的菌株可作为潜在的抑菌益生菌。
表 5 29株抑菌乳酸菌的抑菌活性分析Table 5. Antibacterial activity analysis of 29 strains of lactic acid bacteria with antibacterial activity试验菌株 抑菌圈直径(mm) 致泻大肠埃
希氏菌10411产肠毒素大肠埃
希氏菌10421出血性大肠埃
希氏菌21530鼠伤寒沙门
氏菌10420血清型肠炎
沙门氏菌SM1单核细胞性
李斯特菌LS1干酪乳酪杆菌
(Lacticaseibacillus casei)HTb10D-3 25.73±0.25 22.63±0.48 25.68±0.58 22.64±0.76 21.24±0.59 10.12±0.73 HTb8X4-6 23.40±0.04 22.68±0.34 18.68±0.11 16.46±0.37 15.40±0.39 14.9±0.00 HTb17X-4 20.68±0.31 17.03±0.20 18.83±0.24 15.30±0.01 17.11±0.05 18.55±0.15 HTb17X-5 21.12±0.47 18.7±0.16 22.53±0.46 17.06±0.16 19.29±0.15 11.66±0.23 HTb8X-8 21.18±0.17 22.20±0.45 26.23±0.25 20.64±0.85 17.79±0.57 13.27±0.18 副干酪乳酪杆菌
(Lacticaseibacillus paracasei)HTb25Xx-9 20.99±0.73 18.63±0.40 22.98±0.35 19.18±0.98 17.64±0.29 18.61±0.06 HTb32D-1 17.58±0.00 17.66±0.19 20.86±0.04 15.02±0.26 10.64±0.28 16.31±0.54 HTb28X-10 20.59±0.38 20.99±0.41 19.76±0.57 17.68±0.25 12.71±0.35 21.12±0.01 HTb6X-6 22.97±0.23 20.69±0.01 20.00±0.04 16.66±0.15 17.92±0.01 17.90±0.04 植物乳植杆菌
(Lactiplantibacillus plantarum)HTb23X-3 21.76±0.32 18.45±0.10 20.44±0.02 14.70±0.38 17.35±0.42 17.03±0.01 HTb6D8-4 22.83±0.40 18.12±0.19 19.91±0.14 11.03±0.09 20.68±0.15 15.95±0.57 HTb6D8-3 24.92±0.56 20.52±0.19 19.02±0.41 19.55±0.30 14.68±0.57 11.50±0.48 HTb23X-4 22.96±0.58 23.27±0.07 19.88±0.23 18.36±0.00 15.09±0.06 12.32±0.14 HTb6D8-8 20.40±0.04 16.79±0.28 22.28±0.57 20.12±0.49 17.88±0.73 20.01±0.47 HTb23X-10 21.93±0.25 22.07±0.15 20.13±0.13 19.03±0.07 15.57±0.55 16.83±0.44 香肠伴生乳杆菌
(Companilactobacillus farciminis)HTb9X1-1 23.83±0.23 19.22±0.52 15.98±0.06 16.44±0.25 16.83±0.44 15.76±0.23 HTb20X6-1 20.86±0.00 22.26±0.06 22.66±0.01 22.89±0.17 24.43±0.35 12.33±0.12 HTb21D5-10 21.48±0.13 20.23±0.15 21.06±0.08 11.80±0.02 20.91±0.36 16.15±0.04 HTb36X-2 21.03±0.15 23.76±0.04 18.24±0.23 17.56±0.30 16.09±0.34 21.41±0.27 HTb8X-5 24.67±0.09 20.71±0.13 24.23±0.12 16.97±0.24 15.70±0.13 20.31±0.25 鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus) HTb6X-1 19.73±0.19 21.56±0.00 17.07±0.10 15.38±0.44 14.05±0.24 17.50±0.27 口粘液乳杆菌(Limosilactobacillus oris) HTb25Xx-4 23.33±0.02 21.65±0.18 20.53±0.08 17.17±0.46 15.96±0.35 13.22±0.48 HTb17D1-3 23.46±0.26 20.49±0.04 19.68±0.25 21.84±0.00 13.80±0.31 13.10±0.08 格氏乳杆菌(Lactobacillus gasseri) HTb2X-7 23.15±0.27 24.39±0.08 22.76±0.27 21.92±0.05 16.14±0.25 20.02±0.60 罗伊氏粘液乳杆菌( Limosilactobacillus reuteri) HTb34X5-1 23.67±0.45 19.54±0.07 21.43±0.50 15.18±0.55 12.53±0.18 15.57±0.55 HTb34X5-6 19.48±0.19 18.90±0.26 19.54±0.32 21.31±0.36 20.59±0.55 12.58±0.02 干酪乳酪杆菌(Lacticaseibacillus casei) HTb10D12-2 21.54±0.25 20.07±0.03 16.51±0.31 13.37±0.36 12.17±0.00 15.81±0.22 HTb30X-6 18.09±0.10 20.07±0.15 20.05±0.12 8.29±0.08 11.65±0.21 18.21±0.19 HTb19X-3 19.32±0.20 14.08±0.17 18.7±0.16 12.47±0.23 10.42±0.12 17.54±0.33 注:所有抑菌圈直径数据均为扣除牛津杯外径后,牛津杯外径为8 mm。 2.3 抑菌菌株的抑菌物质测定
进入肠道的乳酸菌,可以通过分泌短链脂肪酸、丁酸、丙酸等酸类,多糖类和细菌素等物质来抑制肠道致病菌[21]。Yin等[22]从青贮饲料中分离到1株干酪乳酪杆菌RS1对金黄色葡萄球菌和大肠杆菌均有抑制作用,可能是在其生长过程中产生大量酸物质,酸物质使其周围的培养基pH较低,达到抑制致病菌的效果,抑菌物质为代谢过程中产生的酸物质。本实验用筛选得到的抑菌菌株发酵液上清进行抑菌实验,以验证其酸代谢物为抑菌物质。抑菌菌株的抗菌活性随着pH的增加而降低,表6结果显示当上清pH调到6.0后29株抑菌乳酸菌中只有3株菌对个别致病菌有弱抑菌作用,说明所试乳酸菌的抑菌物质为代谢过程中产生的酸物质。
表 6 抑菌乳酸菌的抑菌物质分析Table 6. Analysis of antibacterial substances of lactic acid bacteria with antibacterial activity试验菌株 致泻大肠埃希
氏菌10411产肠毒素大肠埃
希氏菌10421出血性大肠埃
希氏菌21530鼠伤寒沙门
氏菌10420血清型肠炎沙门
氏菌SM1单核细胞性
李斯特菌LS1HTb9X1-1 14.54±0.13 7.37±0.07 − − 9.15±0.40 − HTb6D8-3 − − 9.67±0.15 − − − HTb23X-3 − 8.37±0.04 8.72±0.14 8.07±0.08 − − 注:“−”表示扣除牛津杯外径后抑菌圈直径小于5,抑菌直径单位为mm,牛津杯外径为8 mm。 2.4 抑菌菌株在人工模拟胃肠液中的存活率
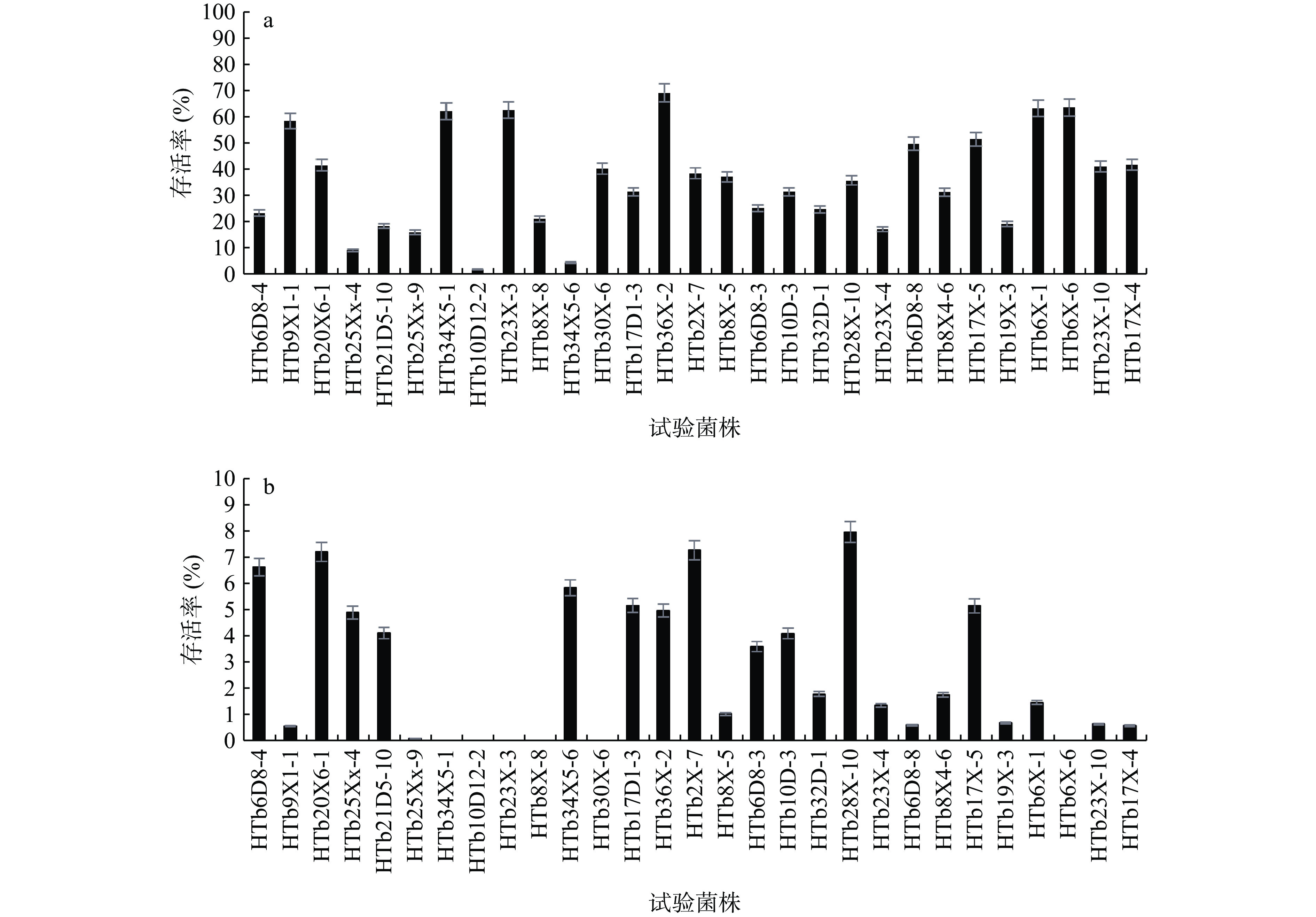
益生菌发挥作用必须在通过胃的应激状态(pH1.5~3.0,3 h)并进入肠道[23]。因此,对胃蛋白酶与胰蛋白酶的耐受性以及对胆盐的耐受性评估,是乳酸菌菌株作为益生菌食品补充剂开发候选物的选择标准[24]。抑菌乳酸菌在模拟胃肠液的存活率如图6所示。图6(a)结果表明,所有抑菌菌株通过pH2.5的模拟胃液处理4 h后存活率明显降低,其中香肠伴生乳杆菌HTb36X-2的存活率最高,为69.50%。从母婴粪便中分离的6株乳酸菌在低pH条件下有较高的存活率(存活率为50%以上),分别为 HTb9X1-1、HTb34X5-1、HTb23X-3、HTb36X-2、HTb6X-1、HTb6X-6。图6(b)结果表明通过模拟肠液处理4 h后,试验菌株存活率下降特别明显,其中三株菌HTb20X6-1、HTb2X-7和HTb28X-10有较高的存活率,存活率分别为7.25%、7.32%和8.00%。抑菌菌株在模拟胃肠液的存活率低于Sui等[25]研究报道的植物乳植杆菌NF4在模拟胃液与模拟肠液下4 h的存活率,分别为83.63%与36.98%,但是本研究经模拟胃液或模拟肠液分别处理4 h后活菌数均大于106 CFU/mL。本研究的菌株在模拟胃液下保持一定的存活率,但在模拟肠液条件下丧失生存能力,可能是受到胆盐和胰蛋白酶的影响,因为高浓度的胆盐具有溶解膜脂的能力,导致细胞渗漏死亡[26]。此外,菌株对模拟胃肠液的耐受能力表明对酸或胆汁浓度的耐受机制主要取决于特定菌株或物种,并可能对某些细菌蛋白产生抗性[27−28]。
2.5 抑菌菌株的疏水性与自聚性分析
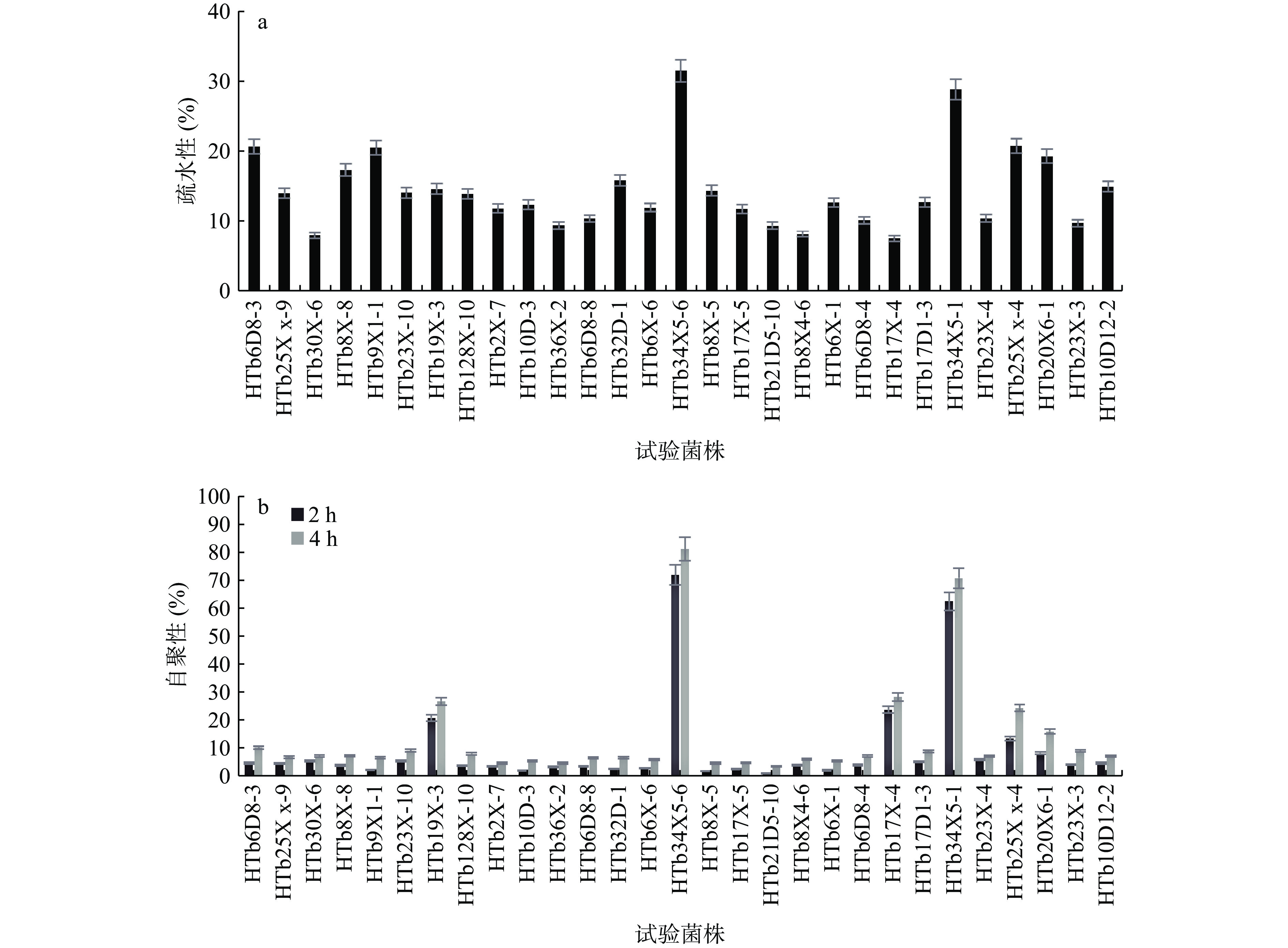
肠道表面的粘附和定殖是益生菌菌株在大肠中发挥有益作用的重要条件,益生菌的自聚集性和疏水性与肠道上皮细胞的粘附性呈正相关,自聚性和疏水性越高,益生菌粘附肠上皮细胞的能力越强,从而促进健康益处[15,29]。因此本实验对上述具有良好抑菌性能的29株菌株进行了疏水性和自凝聚实验评价,图7实验结果表明所有试验菌株的疏水性都在7%~32%之间,其中菌株HTb34X5-6和HTb34X5-1的疏水性最高,分别为31.67%和29.00%(图7a)。图7(b)所示,试验菌株4 h的自凝聚能力在3%~81%,其中菌株HTb34X5-6和HTb34X5-1在4 h的自凝聚能力最高,分别为 81.32%和70.91%。Wang等[30]研究表明,干酪乳酪杆菌 ZX633具有良好的益生特性,可以作为潜在的益生菌,其自聚性与疏水性分别为15.32%与33.48%,本研究中菌株HTb34X5-6和HTb34X5-11相比之下表现出更高的疏水性与自聚性。本研究中菌株之间表现出不同的疏水性,可能归因于其细胞壁中亲水性或疏水性成分的变化[15,27]。虽然所有试验菌株都表现出一定的自聚集能力,但自聚集程度有所不同,且自聚集性随着时间的推移而增加,这可能与细胞表面的蛋白质成分之间的相互作用有关[31]。
2.6 抑菌菌株的耐药性分析
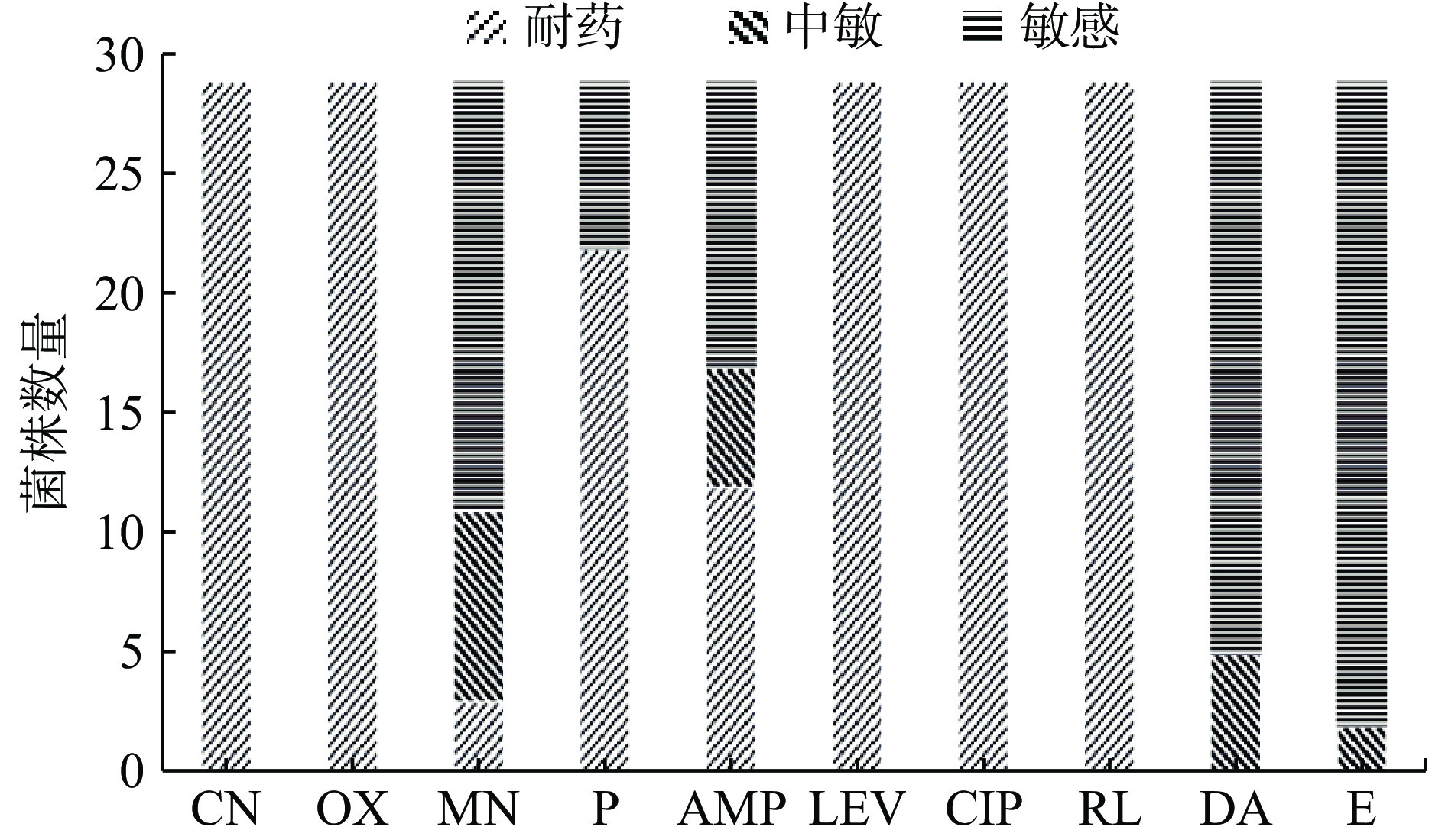
菌株耐药基因可能出现迁移,而耐药基因向病原菌的迁移会导致超级病菌的出现。因此,为了验证菌株耐药性,本研究利用纸片琼脂扩散法研究了29株抑菌乳酸菌对常见临床抗生素的耐药性(图8)。从图中可看出,所试菌株对左氧氟沙星、环丙沙星、庆大霉素、磺胺甲恶唑、苯唑西林具有耐药性,对青霉素、红霉素、米诺环素、氨苄西林和克林霉素表现出中度敏感或敏感性,其中副干酪乳酪杆菌HTb6X-6,罗伊氏粘液乳杆菌HTb34X5-6、HTb34X5-1,干酪乳酪杆菌HTb17X-5、HTb17X-4,发酵粘液乳杆菌HTb10D12-2对5种抗生素表现出中度敏感或敏感性。总体而言,干酪乳酪杆菌 HTb8X4-6、HTb10D-3、 HTb8X-8对大多数抗生素耐药。所试菌株表现出对氨基糖苷类(庆大霉素)和喹喏酮类(环丙沙星与左氧氟沙星)均有耐药,可能归因于菌株细胞中缺乏特定抗生素的靶位,Delgado等[32]研究表明,从人类粪便分离的乳酸菌对喹喏酮类(环丙沙星)具有耐药性,且研究表明大部分乳酸菌对氨基糖苷类耐药,与本实验结果一致,细微的差异可以归因于品系和物种的特异性[33]。虽然普遍认为耐药性通常是自身内在染色体编码的、不具有转移性[34],但对人体仍存在一定潜在危害,众多野生型乳酸菌均具有一种或多种抗生素耐受现象,本研究的菌株还对β-内酰胺类(青霉素与苯唑西林)与磺胺类(磺胺甲恶唑)抗生素具有耐药性。所试菌株对红霉素、米诺环素、氨苄西林和克林霉素表现出不耐药,可能是抗生素能抑制乳酸菌细胞壁合成酶活性,从而使菌体破裂死亡[35]。结果表明不同菌株对不同种类抗生素的敏感性不同,证实了其具有一定的安全性,符合益生菌的筛选标准。
2.7 抑菌菌株的碳水化合物代谢分析
乳酸菌能利用不同宿主的不同饮食来源的糖类是其能在肠道内定植的主要因素之一。本研究对29株抑菌乳酸菌代谢12种糖的能力进行了研究(表7)。由表可知,除了麦芽糊精与菊糖外,菌株能在其余10种糖中生长良好。发酵粘液乳杆菌HTb10D12-2、HTb30X-6,伴生香肠乳杆菌HTb8X-5、HTb6X-1,植物乳植杆菌HTb23X-3、 HTb6D8-8、HTb6D8-3,口粘液乳杆菌HTb17D1-3,副干酪乳酪杆菌HTb32D-1、干酪乳酪杆菌HTb8X-8代谢糖能力最优,能代谢所有的供试糖。Yuan等[36]从海南黎族、新疆维吾尔族粪便中筛选得到64株副干酪乳酪杆菌,并研究其碳源利用能力,结果表明同一民族的菌株的糖代谢能力相似,且对于菊粉的代谢能力不强,与本研究的结果一致。菌株能代谢不同碳源可能是其具有能分解糖类的各种酶,具体的机制有待进一步的研究。
表 7 抑菌乳酸菌的糖代谢发酵谱Table 7. Sugar metabolism and fermentation of lactic acid bacteria with antibacterial activity试验菌株 葡萄糖 半乳糖 果糖 甘露糖 阿拉伯糖 木糖 低聚果糖 低聚木糖 低聚半乳糖 低聚异麦芽糖 菊糖 麦芽糊精 HTb19X-3 + + + + + + + + + + + − HTb6D8-4 + + + + + + + + + + + − HTb2X-7 + + + + + + + + + + + − HTb25Xx-9 + + + + + + + + + + + − HTb10D12-2 + + + + + + + + + + + + HTb10D-3 + + + + + + + + + + + − HTb8X-5 + + + + + + + + + + + + HTb8X4-6 + + + + + + + + + + − − HTb23X-3 + + + + + + + + + + + + HTb23X-4 + + + + + + + + + + + − HTb23X-10 + + + + + + + + + + − + HTb34X5-1 + + + + + + + + + + + − HTb6X-1 + + + + + + + + + + + + HTb9X1-1 + + + + + + + + + + + − HTb34X5-6 + + + + + + + + + + + − HTb17D1-3 + + + + + + + + + + + + HTb25Xx-4 + + + + + + + + + + − + HTb36X-2 + + + + + + + + + + − − HTb20X6-1 + + + + + + + + − + + − HTb30X-6 + + + + + + + + + + + + HTb8X-8 + + + + + + + + + + + + HTb17X-5 + + + + + + + + + + + − HTb17X-4 + + + + + + + + + + + − HTb6D8-3 + + + + + + + + + + + + HTb21D5-10 + + + + + + + + + + − − HTb6D8-8 + + + + + + + + + + + + HTb28X-10 + + + + + + + + + + + − HTb6X-6 + + + + + + + + + + + − HTb32D-1 + + + + + + + + + + + + 注:“−”表示不生长或有限生长,“+”表示生长良好。 3. 结论
本研究对维吾尔族母婴对样本中乳酸菌进行分离鉴定,并筛选具有抑菌活性的乳酸菌,对具有抑菌作用的29株菌株进行益生特性试验及安全性分析,最终筛选出香肠伴生乳杆菌HTb36X-2,副干酪乳酪杆菌HTb6X-6,干酪乳酪杆菌17X-4、17X-5,罗伊氏粘液乳杆菌HTb34X5-1、HTb34X5-6,发酵粘液乳杆菌10D12-2共7株菌株具有良好的抑菌效果、较好的胃肠液耐受性、较强的疏水性与自凝聚能力,可作为潜在益生菌菌株,为新疆特色产品的开发和益生菌的应用奠定理论基础,但还需要对具有潜在益生特性的菌株进行体内实验和临床实验进一步验证。
-
表 1 致病菌与培养基
Table 1 Pathogenic bacteria and culture medium
菌种 培养基 产肠毒素大肠埃希氏菌(Escherichia coli ETEC O78:K80) CICC 10421 营养肉汁琼脂 鼠伤寒沙门氏菌(Salmonella enterica subsp. enterica serovar Typhimurium) CICC 10420 营养肉汁琼脂 出血性大肠埃希氏菌(Escherichia coli EHEC O157:H7) CICC 21530 营养肉汁琼脂 单核细胞性李斯特菌(Listeria monocytogenes) CGMCC 1.9136 LS1 PYG培养基 血清型肠炎沙门氏菌(Salmonella enterica subsp. enterica) CGMCC 1.9136 SM1 TSA培养基 致泻大肠埃希氏菌(Escherichia coli EPEC O127:K63) CICC 10411 营养肉汁琼脂 表 2 培养基配方
Table 2 Media formula
培养基名称 成分(含量) LAMVAB培养基 牛肉膏(8 g/L)、蛋白胨(10 g/L)、葡萄糖(20 g/L)、磷酸氢二钾(2 g/L)、琼脂(20 g/L)、溴甲酚绿(0.05 g/L)、
柠檬酸氢二铵(2 g/L)、硫酸锰(0.05 g/L)、吐温-80(1 mL/L)、酵母浸粉(5 g/L)、L-半胱氨酸盐酸盐(0.5 g/L)、
盐酸万古霉素(0.02 g/L)、硫酸镁(0.2 g/L)、无水乙酸钠(5 g/L),调节pH至5.0PYG培养基 蛋白胨(10 g/L)、酵母提取物(5 g/L)、葡萄糖(1 g/L)、琼脂(15 g/L),调节pH至6.8 营养肉汁琼脂 蛋白胨(5 g/L)、牛肉膏(3 g/L)、NaCl(5 g/L)、琼脂(20 g/L),调节pH至7.0 TSA 培养基 胰蛋白胨(15 g/L)、大豆蛋白胨(5 g/L)、NaCl(5 g/L)、琼脂(15 g/L)、调节pH至7.2 MRS培养基 牛肉膏(10 g/L)、蛋白胨(10 g/L)、葡萄糖(20 g/L)、磷酸氢二钾(2 g/L)、琼脂(20 g/L)、溴甲酚绿(0.05 g/L)、
柠檬酸氢二铵(2 g/L)、硫酸锰(0.05 g/L)、吐温-80(1 mL/L)、酵母浸粉(5 g/L)、硫酸镁(0.58 g/L)、无水乙酸钠(5 g/L)表 3 基于groEL基因的种间PCR扩增
Table 3 Interspecific PCR amplification based on groEL gene
PCR扩增体系成分 用量(μL) Premix Taq(2×) 12.5 Lac-groEL-F(20 μmol/L) 0.5 Lac-groEL-R(20 μmol/L) 0.5 DNA模板(30~60 ng) 3 ddH2O 8.5 表 4 药敏纸片标准
Table 4 Criteria of drug sensitive paper
抗生素种类 含量(μg/片) 判断标准(mm) 耐药 中度敏感 敏感 庆大霉素(CN) 10 ≤13 14~17 ≥18 苯唑西林(OX) 10 ≤13 14~17 ≥18 米洛环素(MH) 30 ≤13 14~17 ≥18 青霉素(P) 10 ≤13 14~17 ≥18 氨苄西林(AMP) 10 ≤13 14~17 ≥18 左氧氟沙星(LEV) 5 ≤13 14~16 ≥17 环丙沙星(CIP) 10 ≤15 16~20 ≥21 磺胺甲恶唑(RL) 25 ≤16 17~19 ≥20 克林霉素(DA) 10 ≤14 15~20 ≥21 红霉素(E) 10 ≤13 14~22 ≥23 表 5 29株抑菌乳酸菌的抑菌活性分析
Table 5 Antibacterial activity analysis of 29 strains of lactic acid bacteria with antibacterial activity
试验菌株 抑菌圈直径(mm) 致泻大肠埃
希氏菌10411产肠毒素大肠埃
希氏菌10421出血性大肠埃
希氏菌21530鼠伤寒沙门
氏菌10420血清型肠炎
沙门氏菌SM1单核细胞性
李斯特菌LS1干酪乳酪杆菌
(Lacticaseibacillus casei)HTb10D-3 25.73±0.25 22.63±0.48 25.68±0.58 22.64±0.76 21.24±0.59 10.12±0.73 HTb8X4-6 23.40±0.04 22.68±0.34 18.68±0.11 16.46±0.37 15.40±0.39 14.9±0.00 HTb17X-4 20.68±0.31 17.03±0.20 18.83±0.24 15.30±0.01 17.11±0.05 18.55±0.15 HTb17X-5 21.12±0.47 18.7±0.16 22.53±0.46 17.06±0.16 19.29±0.15 11.66±0.23 HTb8X-8 21.18±0.17 22.20±0.45 26.23±0.25 20.64±0.85 17.79±0.57 13.27±0.18 副干酪乳酪杆菌
(Lacticaseibacillus paracasei)HTb25Xx-9 20.99±0.73 18.63±0.40 22.98±0.35 19.18±0.98 17.64±0.29 18.61±0.06 HTb32D-1 17.58±0.00 17.66±0.19 20.86±0.04 15.02±0.26 10.64±0.28 16.31±0.54 HTb28X-10 20.59±0.38 20.99±0.41 19.76±0.57 17.68±0.25 12.71±0.35 21.12±0.01 HTb6X-6 22.97±0.23 20.69±0.01 20.00±0.04 16.66±0.15 17.92±0.01 17.90±0.04 植物乳植杆菌
(Lactiplantibacillus plantarum)HTb23X-3 21.76±0.32 18.45±0.10 20.44±0.02 14.70±0.38 17.35±0.42 17.03±0.01 HTb6D8-4 22.83±0.40 18.12±0.19 19.91±0.14 11.03±0.09 20.68±0.15 15.95±0.57 HTb6D8-3 24.92±0.56 20.52±0.19 19.02±0.41 19.55±0.30 14.68±0.57 11.50±0.48 HTb23X-4 22.96±0.58 23.27±0.07 19.88±0.23 18.36±0.00 15.09±0.06 12.32±0.14 HTb6D8-8 20.40±0.04 16.79±0.28 22.28±0.57 20.12±0.49 17.88±0.73 20.01±0.47 HTb23X-10 21.93±0.25 22.07±0.15 20.13±0.13 19.03±0.07 15.57±0.55 16.83±0.44 香肠伴生乳杆菌
(Companilactobacillus farciminis)HTb9X1-1 23.83±0.23 19.22±0.52 15.98±0.06 16.44±0.25 16.83±0.44 15.76±0.23 HTb20X6-1 20.86±0.00 22.26±0.06 22.66±0.01 22.89±0.17 24.43±0.35 12.33±0.12 HTb21D5-10 21.48±0.13 20.23±0.15 21.06±0.08 11.80±0.02 20.91±0.36 16.15±0.04 HTb36X-2 21.03±0.15 23.76±0.04 18.24±0.23 17.56±0.30 16.09±0.34 21.41±0.27 HTb8X-5 24.67±0.09 20.71±0.13 24.23±0.12 16.97±0.24 15.70±0.13 20.31±0.25 鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus) HTb6X-1 19.73±0.19 21.56±0.00 17.07±0.10 15.38±0.44 14.05±0.24 17.50±0.27 口粘液乳杆菌(Limosilactobacillus oris) HTb25Xx-4 23.33±0.02 21.65±0.18 20.53±0.08 17.17±0.46 15.96±0.35 13.22±0.48 HTb17D1-3 23.46±0.26 20.49±0.04 19.68±0.25 21.84±0.00 13.80±0.31 13.10±0.08 格氏乳杆菌(Lactobacillus gasseri) HTb2X-7 23.15±0.27 24.39±0.08 22.76±0.27 21.92±0.05 16.14±0.25 20.02±0.60 罗伊氏粘液乳杆菌( Limosilactobacillus reuteri) HTb34X5-1 23.67±0.45 19.54±0.07 21.43±0.50 15.18±0.55 12.53±0.18 15.57±0.55 HTb34X5-6 19.48±0.19 18.90±0.26 19.54±0.32 21.31±0.36 20.59±0.55 12.58±0.02 干酪乳酪杆菌(Lacticaseibacillus casei) HTb10D12-2 21.54±0.25 20.07±0.03 16.51±0.31 13.37±0.36 12.17±0.00 15.81±0.22 HTb30X-6 18.09±0.10 20.07±0.15 20.05±0.12 8.29±0.08 11.65±0.21 18.21±0.19 HTb19X-3 19.32±0.20 14.08±0.17 18.7±0.16 12.47±0.23 10.42±0.12 17.54±0.33 注:所有抑菌圈直径数据均为扣除牛津杯外径后,牛津杯外径为8 mm。 表 6 抑菌乳酸菌的抑菌物质分析
Table 6 Analysis of antibacterial substances of lactic acid bacteria with antibacterial activity
试验菌株 致泻大肠埃希
氏菌10411产肠毒素大肠埃
希氏菌10421出血性大肠埃
希氏菌21530鼠伤寒沙门
氏菌10420血清型肠炎沙门
氏菌SM1单核细胞性
李斯特菌LS1HTb9X1-1 14.54±0.13 7.37±0.07 − − 9.15±0.40 − HTb6D8-3 − − 9.67±0.15 − − − HTb23X-3 − 8.37±0.04 8.72±0.14 8.07±0.08 − − 注:“−”表示扣除牛津杯外径后抑菌圈直径小于5,抑菌直径单位为mm,牛津杯外径为8 mm。 表 7 抑菌乳酸菌的糖代谢发酵谱
Table 7 Sugar metabolism and fermentation of lactic acid bacteria with antibacterial activity
试验菌株 葡萄糖 半乳糖 果糖 甘露糖 阿拉伯糖 木糖 低聚果糖 低聚木糖 低聚半乳糖 低聚异麦芽糖 菊糖 麦芽糊精 HTb19X-3 + + + + + + + + + + + − HTb6D8-4 + + + + + + + + + + + − HTb2X-7 + + + + + + + + + + + − HTb25Xx-9 + + + + + + + + + + + − HTb10D12-2 + + + + + + + + + + + + HTb10D-3 + + + + + + + + + + + − HTb8X-5 + + + + + + + + + + + + HTb8X4-6 + + + + + + + + + + − − HTb23X-3 + + + + + + + + + + + + HTb23X-4 + + + + + + + + + + + − HTb23X-10 + + + + + + + + + + − + HTb34X5-1 + + + + + + + + + + + − HTb6X-1 + + + + + + + + + + + + HTb9X1-1 + + + + + + + + + + + − HTb34X5-6 + + + + + + + + + + + − HTb17D1-3 + + + + + + + + + + + + HTb25Xx-4 + + + + + + + + + + − + HTb36X-2 + + + + + + + + + + − − HTb20X6-1 + + + + + + + + − + + − HTb30X-6 + + + + + + + + + + + + HTb8X-8 + + + + + + + + + + + + HTb17X-5 + + + + + + + + + + + − HTb17X-4 + + + + + + + + + + + − HTb6D8-3 + + + + + + + + + + + + HTb21D5-10 + + + + + + + + + + − − HTb6D8-8 + + + + + + + + + + + + HTb28X-10 + + + + + + + + + + + − HTb6X-6 + + + + + + + + + + + − HTb32D-1 + + + + + + + + + + + + 注:“−”表示不生长或有限生长,“+”表示生长良好。 -
[1] DONOVAN S M, RAO G. Health benefits of yogurt among infants and toddlers aged 4 to 24 months:A systematic review[J]. Nutrition Reviews,2019,77(7):478−486. doi: 10.1093/nutrit/nuz009
[2] AFUM T, ASANDEM D A, ASARE P, et al. Diarrhea-causing bacteria and their antibiotic resistance patterns among diarrhea patients from Ghana[J]. Frontiers in Microbiology,2022,13:894319. doi: 10.3389/fmicb.2022.894319
[3] Sun X Q, KONG J, ZHU S T, et al. A systematic review and meta-analysis:The therapeutic and preventive effect of Limosilactobacillus reuteri DSM 17, 938 addition in children with diarrhea[J]. BMC Gastroenterology,2023,23(1):141. doi: 10.1186/s12876-023-02778-4
[4] CHEN K, JIN S S, MA Y, et al. Adjunctive efficacy of Lactis XLTG11 for acute diarrhea in children:A randomized, blinded, placebo-controlled study[J]. Nutrition,2023,111:112052. doi: 10.1016/j.nut.2023.112052
[5] CALERO-MEDINA L, JIMENEZ-CASQUET M J, HERAS-GONZALEZ L, et al. Dietary exposure to endocrine disruptors in gut microbiota:A systematic review[J]. Science of the Total Environment,2023,886:163−191.
[6] ZHENG D, WANG Z, SUI L, et al. Lactobacillus johnsonii activates porcine monocyte derived dendritic cells maturation to modulate cellular immune response[J]. Cytokine,2021,144:155581. doi: 10.1016/j.cyto.2021.155581
[7] 尹杨燕, 潘艳, 李小宁, 等. 1株植物乳杆菌的生物学特性及体外抑菌活性研究[J]. 中国畜牧兽医,2023,50(2):666−673. [YIN Y Y, PAN Y, LI X N, et al. Study on biological characteristics and antibacterial activity in vitro of a Lactiplantibacillus plantarum strain[J]. China Animal Husbandry and Veterinary Medicin,2023,50(2):666−673.] doi: 10.16431/j.cnki.1671-7236.2023.02.024 YIN Y Y, PAN Y, LI X N, et al . Study on biological characteristics and antibacterial activity in vitro of a Lactiplantibacillus plantarum strain[J]. China Animal Husbandry and Veterinary Medicin,2023 ,50 (2 ):666 −673 . doi: 10.16431/j.cnki.1671-7236.2023.02.024[8] BERGSSON G, ARNFINNSSON J, STEINGRÍMSSON O, et al. In vitro killing of Candida albicans by fatty acids and monoglycerides[J]. Antimicrobial Agents and Chemotherapy,2001,45(11):3209−3212. doi: 10.1128/AAC.45.11.3209-3212.2001
[9] YANG H, HEWES D, SALAHEEN S, et al. Effects of blackberry juice on growth inhibition of foodborne pathogens and growth promotion of Lactobacillus[J]. Food Control,2014,37:15−24. doi: 10.1016/j.foodcont.2013.08.042
[10] WANG L, ZHANG H, REHMAN M U, et al. Antibacterial activity of Lactiplantibacillus plantarum isolated from Tibetan yaks[J]. Microbial Pathogenesis,2018,115:293−298. doi: 10.1016/j.micpath.2017.12.077
[11] KAN Z, LUO B, CAI J, et al. Genotyping and plant-derived glycan utilization analysis of Bifidobacterium strains from mother-infant pairs[J]. BMC Microbiology,2020,20(1):277. doi: 10.1186/s12866-020-01962-w
[12] XIE M, PAN M, JIANG Y, et al. GroEL gene-based phylogenetic analysis of Lactobacillus species by high-throughput sequencing[J]. Genes,2019,10(7):27.
[13] TAMURA K, STECHER G, PETERSON D, et al. MEGA6:Molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,2013,30(12):2725−2729. doi: 10.1093/molbev/mst197
[14] ZHANG Y, WU Y T, ZHENG W, et al. The antibacterial activity and antibacterial mechanism of a polysaccharide from cordyceps cicadae[J]. Journal of Functional Foods,2017,38:273−279. doi: 10.1016/j.jff.2017.09.047
[15] ANGMO K, KUMARI A, SAVITRI, et al. Probiotic characterization of lactic acid bacteria isolated from fermented foods and beverage of Ladakh[J]. LWT,2016,66:428−435. doi: 10.1016/j.lwt.2015.10.057
[16] REN D, LI C, QIN Y, et al. In vitro evaluation of the probiotic and functional potential of Lactobacillus strains isolated from fermented food and human intestine[J]. Anaerobe,2014,30:1−10. doi: 10.1016/j.anaerobe.2014.07.004
[17] JIN Y, LUO B, CAI J, et al. Evaluation of indigenous lactic acid bacteria of raw mare milk from pastoral areas in Xinjiang, China, for potential use in probiotic fermented dairy products[J]. Journal of Dairy Science,2021,104(5):48−65.
[18] 王明芳, 陈丽澜, 张雪玲, 等. 人源分离长双歧杆菌长亚种的体外益生特性分析[J]. 食品科学,2023,11:1−14. [WANG M F, CHEN L L, ZHANG X L, et al. Probiotic characteristics of human-residential B. longum subsp. longum strains[J]. Food Science,2023,11:1−14.] doi: 10.7506/spkx1002-6630-20230609-079 WANG M F, CHEN L L, ZHANG X L, et al . Probiotic characteristics of human-residential B. longum subsp. longum strains[J]. Food Science,2023 ,11 :1 −14 . doi: 10.7506/spkx1002-6630-20230609-079[19] HUANG R, WU F, ZHOU Q, et al. Lactobacillus and intestinal diseases:Mechanisms of action and clinical applications[J]. Microbiological Research,2022,260:127019. doi: 10.1016/j.micres.2022.127019
[20] KESMEN Z, YETIMAN A E, GULLUCE A, et al. Combination of culture-dependent and culture-independent molecular methods for the determination of lactic microbiota in Sucuk[J]. International Journal of Food Microbiology,2012,153(3):428−435. doi: 10.1016/j.ijfoodmicro.2011.12.008
[21] VAN ZYL W F, DEANE S M, DICKS L M T. Molecular insights into probiotic mechanisms of action employed against intestinal pathogenic bacterie[J]. Gut Microbes,2020,12(1):283−339.
[22] YIN J Y, LIU Q J, TIAN Q F, et al. Isolation, identification and biological characteristics of a strain of Lacticaseibacillus paracasei[J]. China Animal Husbandry and Veterinary Medicine,2021,48(2):516−524.
[23] HUANG Y, ADAMS M C. In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria[J]. International Journal of Food Microbiology,2004,91(3):253−264. doi: 10.1016/j.ijfoodmicro.2003.07.001
[24] USMAN, HOSONO A. Bile tolerance, taurocholate deconjugation, and binding of cholesterol by Lactobacillus gasseri strains[J]. Journal of Dairy Science,1999,82(2):243−268. doi: 10.3168/jds.S0022-0302(99)75229-X
[25] SUI Y, LIU J, LIU Y, et al. In vitro probiotic characterization of Lactobacillus strains from fermented tangerine vinegar and their cholesterol degradation activity[J]. Food Bioscience,2021,39:100−143.
[26] BEGLEY M, GAHAN C G M, HILL C. The interaction between bacteria and bile[J]. FEMS Microbiology Reviews,2005,29(4):625−651. doi: 10.1016/j.femsre.2004.09.003
[27] AYYASH M, ABUSHELAIBI A, AL-MAHADIN S, et al. In-vitro investigation into probiotic characterisation of Streptococcus and Enterococcus isolated from camel milk[J]. LWT,2018,87:78−87.
[28] LI M, WANG Y, CUI H, et al. Characterization of lactic acid bacteria isolated from the gastrointestinal tract of a wild boar as potential probiotics[J]. Frontiers in Veterinary Science,2020,7:49−67. doi: 10.3389/fvets.2020.00049
[29] REUBEN R C, ROY P C, SARKAR S L, et al. Characterization and evaluation of lactic acid bacteria from indigenous raw milk for potential probiotic properties[J]. Journal of Dairy Science,2020,103(2):1223−1237. doi: 10.3168/jds.2019-17092
[30] WANG X, WANG W, LÜ H, et al. Probiotic potential and wide-spectrum antimicrobial activity of lactic acid bacteria isolated from infant feces[J]. Probiotics Antimicrob Proteins,2021,13(1):90−101. doi: 10.1007/s12602-020-09658-3
[31] ZIELIŃSKA D, ŁEPECKA A, OŁDAK A, et al. Growth and adhesion inhibition of pathogenic bacteria by live and heat-killed food-origin Lactobacillus strains or their supernatants[J]. FEMS Microbiology Letters,2021,368(5):23−39.
[32] DELGADO S, AB FLÓREZ, MAYO B. Antibiotic susceptibility of Lactobacillus and Bifidobacterium species from the human gastrointestinal tract[J]. Current Microbiology,2005,50(4):202−207. doi: 10.1007/s00284-004-4431-3
[33] 张一爽. 副干酪乳杆菌抗生素耐药性分析及蛋白酶活性评价[D]. 哈尔滨:哈尔滨工业大学, 2021. [ZHANG Y S. Evaluation of antibiotic resistance and proteolytic ability of Lacticaseibacillus paracasei strains[D]. Harbin:Harbin Institute of Technology, 2021.] ZHANG Y S. Evaluation of antibiotic resistance and proteolytic ability of Lacticaseibacillus paracasei strains[D]. Harbin: Harbin Institute of Technology, 2021.
[34] CAGGIA C, DE A M, PITINO I, et al. Probiotic features of Lactobacillus strains isolated from Ragusano and Pecorino Siciliano cheeses[J]. Food Microbiology,2015,50:109−117. doi: 10.1016/j.fm.2015.03.010
[35] LI L Z, GE H J, GU D, et al. The role of two-component regulatory system in β-lactam antibiotics resistance[J]. Microbiological Research,2018,215:126−129. doi: 10.1016/j.micres.2018.07.005
[36] YUAN L, ZHANG X, LUO B, et al. Ethnic specificity of species and strain composition of Lactobacillus populations from mother–infant pairs, uncovered by multilocus sequence typing[J]. Frontiers in Microbiology,2022,13:26−49.
-
期刊类型引用(5)
1. 沃佳美雪,徐晓敏,贾素霞,胡文凯,卢芳,刘树民. 整合16S rRNA测序技术和代谢组学探究白鲜皮对斑马鱼幼鱼的肝毒性机制. 中草药. 2025(01): 177-190 .  百度学术
百度学术
2. 王启民,赵威,黄婉佳. 真武汤加减治疗糖尿病肾病用药规律研究. 河南中医. 2024(07): 1006-1011 .  百度学术
百度学术
3. 沈嘉淼,蔡军涛,李杰明,吕帅宜,胡玉龙,董春红. 中药多糖防治肾损伤作用机制的研究进展. 中国药科大学学报. 2024(04): 454-462 .  百度学术
百度学术
4. 熊志伟,王云,曹华斌,彭成诚,杨帆,代雪艳,幸程鸿,刘灵莉,李静妮,胡爱明. 钼、镉联合暴露介导氧化应激和铁死亡致绵羊肾损伤. 畜牧兽医学报. 2024(12): 5802-5812 .  百度学术
百度学术
5. 杨佳佳,杨玉兰. 基于数据挖掘探析中医药治疗脾肾阳虚型慢性肾功能衰竭用药规律. 中医临床研究. 2024(35): 99-104 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:

 下载:
下载:
