Polydopamine Nanomaterials and Their Applications in Food Field
-
摘要: 聚多巴胺(polydopamine,PDA)是一种由多巴胺(dopamine,DA)单体在碱性条件下氧化聚合生成的生物聚合物,具有多种独特的理化性质,如粘附性、金属离子螯合和生物相容性等。近年来,PDA在生物医药、材料学及食品科学等研究领域广受关注。本文总结现有报道中PDA的酶氧化、电聚合及化学氧化等制备途径,综述其聚合机理从共价聚合到超分子聚集体的演变。基于PDA的自聚合特性,对已发现的多种PDA纳米结构进行分类,总结了PDA纳米涂层、纳米颗粒、纳米胶囊、介孔及多孔纳米结构等在功能性包装、固定化酶、污染物检测和活性物质递送等食品科学领域中的应用最新进展,并对其中尚存在的问题和研究方向进行了展望,以期为PDA的进一步研究提供参考。Abstract: Polydopamine (PDA) is discovered as a biopolymer that obtained by oxide polymerization of dopamine (DA) in alkaline environment. PDA has unique characteristics such as exceptional adhesiveness, metal chelation, and excellent biocompatibility. In recent years, PDA has been extensively utilized in various area such as biomedicine, materials science and food technology, etc. In present work, different methods of PDA preparation are summarized such as enzymatic oxidation, electro-polymerization and chemical oxidation, and the mechanism of PDA polymerization is discussed using covalent polymerization and supermolecule aggregates. Accordingly, the different self-polymerized PDA nanostructures are classified as nano-coating, nanoparticles, nano-capsules, mesoporous and porous PDA to analysis their advances in functional food packaging, immobilized enzyme, food detection and active substance delivery. In addition, the existing problems and research directions are prospected in order to provide reference for further research of PDA.
-
Keywords:
- polydopamine /
- nanomaterial /
- self-polymerization /
- food /
- application
-
PDA是一种复杂的生物高分子聚合物,主要由DA通过氢键、共价键、π-π相互作用等快速氧化自聚合形成。2007年,Lee等[1]研制了在包括有机、无机在内的各种类型材料表面形成具有粘附性的多功能PDA涂层,自此PDA作为一种新型材料受到了科研工作者们的广泛关注。PDA具有多种独特且丰富的理化性质,例如PDA表面含有大量的酚羟基、胺基和亚胺基等活性官能团,这些官能团的存在使PDA可以作为二次反应平台,对所需材料进一步进行表面功能化修饰[2−3]。为了克服纳米粒子因小尺寸效应引起的团聚问题,将PDA和功能性物质包覆在纳米粒子表面制备纳米复合材料是提高其分散性的有效方法[4]。利用PDA对多组分聚合物之间良好的结构亲和力,PDA可以用作聚合物共混物中的相容剂,增强复合材料的相容性[5]。基于分子中具有丰富的π-π共轭结构,PDA及其衍生物,如PDA纳米空心胶囊、介孔纳米粒子和核-壳纳米粒子,还可以通过π-π堆积、氢键作用以及范德华作用有效地搭载各种生物分子,实现活性物质在食品加工过程中的靶向递送和控制性释放[6]。PDA还具有生物降解性、抗氧化性和紫外线阻隔性能等优异特性,使之成为制备活性食品包装材料的理想填充物,可用于改善食品包装材料性能,从而延长食品货架期[5]。最重要的是,PDA具有良好的生物相容性和低细胞毒性,这为其在食品领域中的应用提供了重要条件[7]。由于PDA具有上述多种优良特性,PDA在食品领域已有多种应用,包括食品保鲜包装材料制备、滤膜加工、酶固定化等。
近年来,人们对PDA及其衍生纳米结构的制备、功能化以及在环境、能源、生物医学领域的应用进行了较为全面的综述[8−10]。尽管PDA纳米结构在食品领域中的应用研究已得到了快速发展,其中PDA纳米材料修饰传感器用于食品安全快速检测已有相关综述发表,但是PDA纳米材料在更多食品领域的相关应用尚缺乏全面的综述。因此,本文的目的是填补这一空白,首先讨论PDA的不同制备方法及其聚合机理,其次总结不同结构特点的PDA纳米材料在食品科学多领域中应用的最新进展。最后,对PDA纳米材料未来进一步开发和利用中可能产生的机遇和挑战进行展望。
1. PDA的制备方法及聚合机理
1.1 制备方法
目前,酶氧化法、电聚合法和溶液氧化法是制备PDA的主要方法。酶氧化法是一种以酶作为催化剂合成聚合物,且合成过程较为绿色的方法。在生物体内,L-酪氨酸经过酪氨酸酶等一系列酶的作用后将会被催化氧化形成黑色素大分子聚合体。类似地,Li等[11]利用脲酶催化尿素水解释放出大量的OH−离子,通过调节反应介质pH的增加,成功诱导DA聚合成尺寸可调的聚多巴胺纳米粒子(polydopamine nanoparticles,PDA NPs),且所得PDA NPs的大小与尿素的浓度有关。Li等[12]在酸性条件下采用漆酶催化法促进DA的聚合,其中DA的氧化速率在很大程度上取决于漆酶、O2的浓度和pH。除了酶催化,DA单体在电催化的作用下可发生电聚合反应形成聚合物PDA。Wang等[13]通过DA的电聚合在具有复杂三维形状的金属基材表面形成了连续光滑的电聚合聚多巴胺(electropolymerized poly(dopamine),ePDA)。与传统方法相比,电化学法表现出更高的沉积速率,由于ePDA只能在电极-溶液界面处形成,DA得到了更加充分的利用。尽管电聚合法制备PDA的过程较简单,但是导电材料是发生表面电聚合的必须条件,这是电聚合法固有的局限性。
溶液氧化法因反应过程温和、无需苛刻的反应条件和复杂的仪器设备,是制备PDA时最常用的方法。Bernsmann等[14]将DA单体置于碱性溶液中,利用其与空气中氧气接触后发生的自发氧化和聚合成功制备出了PDA。从溶液颜色的变化,即从无色变为浅褐色最终呈现深棕色,便可直观地观察到自聚合反应的发生。Della Vecchia等[15]研究了Tris、磷酸盐和碳酸氢盐缓冲液对PDA聚合和颗粒形态的影响发现,与磷酸盐和碳酸氢盐缓冲液相比,Tris缓冲液(pH8.5)可用于有效调节PDA生长。此外,改变反应发生的温度、pH、反应物浓度等条件,同样可以调控所形成PDA纳米材料的结构形态和尺寸[3]。然而,溶液氧化法大多是在碱性介质中制备PDA,这对碱敏性材料具有不利影响,并且DA较为缓慢的聚合速度将会导致PDA在反应容器底部聚集。
1.2 聚合机理
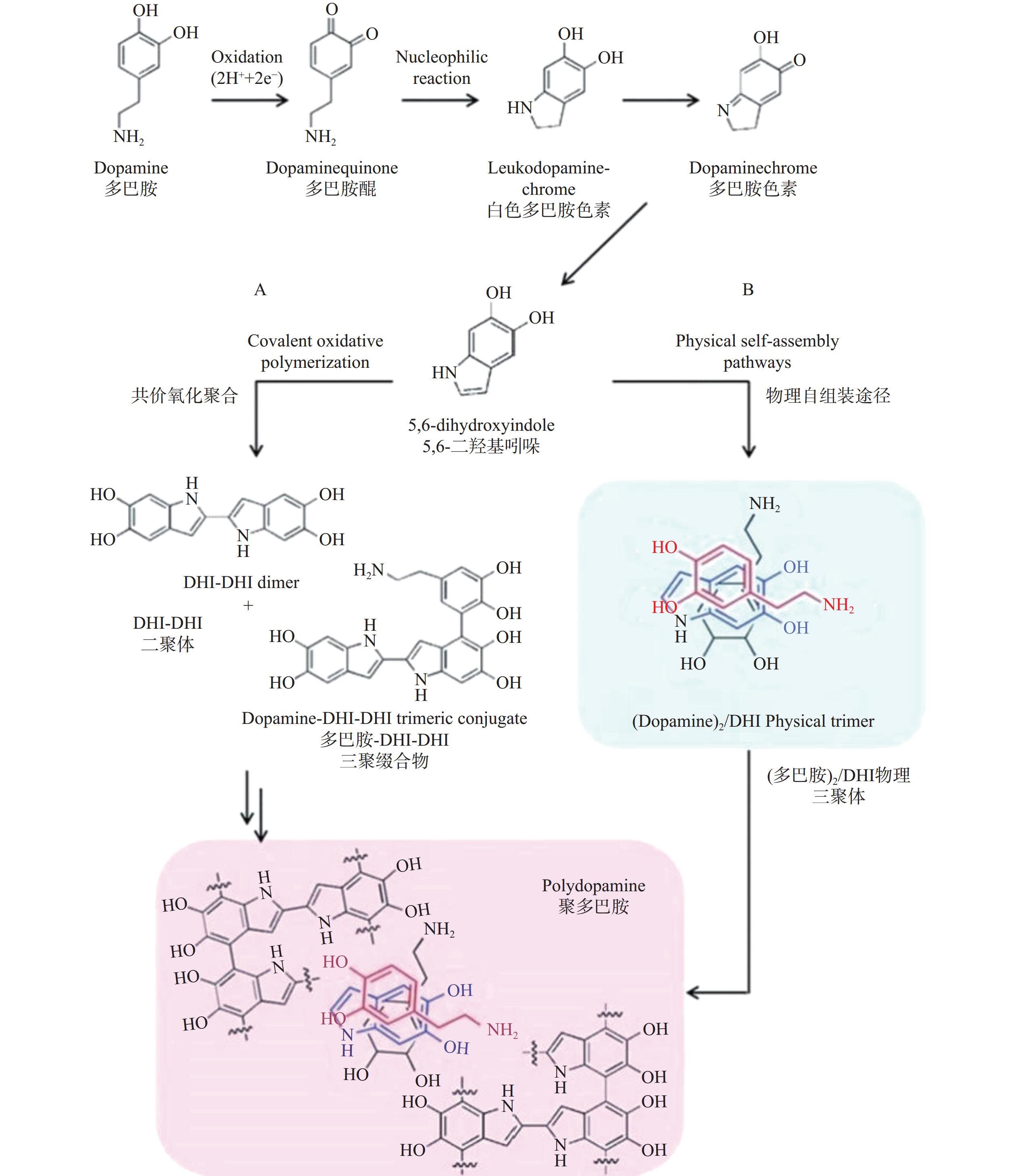
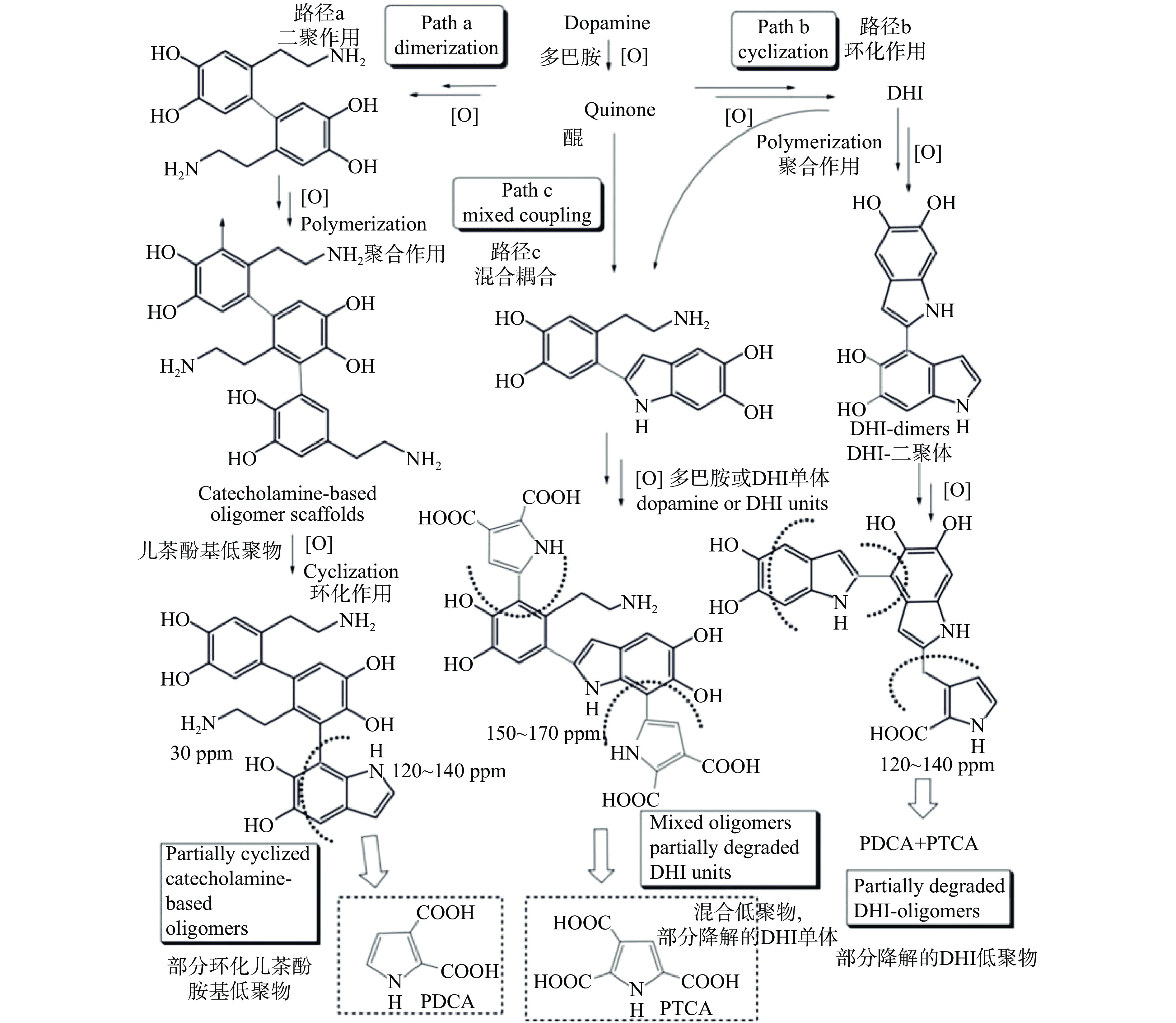
在研究初期,人们认为PDA的形成过程类似于黑色素(melanin)在生物体内的合成途径[16]。即在碱性条件下,DA单体首先被环境中存在的氧气氧化为多巴胺醌,随后在1,4-迈克尔加成反应下分子内环化,所得产物进一步氧化和重排得到5,6-二羟基吲哚(5,6-dihydroxyindole,DHI),且部分DHI被氧化形成5,6-吲哚醌(5,6-indolequinone,IDQ)。DHI和IDQ随后发生支化反应形成低聚物,并通过反歧化反应最终生成共价聚合物PDA,因此,早期部分研究中PDA也被称为纳米黑色素。但该合成路径仅通过红外光谱进行了初步分析及验证,缺乏进一步的实验证实。
随着研究的逐渐深入,PDA形成机理的新构想不断被提出。不同于“黑色素”模型的共价键理论,Dreyer等[17]认为PDA是一种超分子聚集体而非共价聚合物,由DA单体氧化聚合的最终产物——DHI和IDQ,仅通过氢键、π-π堆积等非共价作用力相结合。而Hong等[18]提出,PDA是在两种不同途径共同作用下形成的(如图1),即DHI进行的共价氧化聚合与部分DA单体和DHI之间发生的非共价自组装。Vecchia课题组[19]认为在PDA形成初期共价键发挥着关键作用,而当不同聚合程度低聚物形成之后非共价键占据重要地位。目前,由于DA单体的氧化聚合路线以及形成的一系列氧化中间体较复杂,如图2所示,PDA的结构和聚合机理尚未被完全阐明。
2. PDA纳米材料的分类
从PDA的自聚合性质和表面丰富的活性基团出发,不同的诱导基质使得PDA呈现出多种多样的纳米结构形态,主要包括PDA纳米涂层、PDA纳米粒子、PDA纳米空心胶囊、PDA介孔纳米粒子及PDA核-壳纳米粒子等。
2.1 PDA纳米涂层
PDA因其本身具有超强的粘附性能,可以在几乎所有材料的表面形成薄膜,引起了诸多研究学者极大的关注。在固-液界面制备PDA涂层是最经典、常用的PDA涂层制备方式。Lee等[1]通过将各种无机和有机材料(贵金属、氧化物和陶瓷等)在DA水溶液中简单浸涂,于所有材料表面形成了薄PDA涂层。最近也有关于在气-液界面处制备PDA膜的报道,Ponzio等[20]在静态环境下于空气-水界面处制备出了无需支撑物的PDA膜层,通过Langmuir-Schaeffer技术可以将PDA薄膜沉积在亲水性或疏水性衬底上,这一研究为PDA纳米涂层的制备开辟了一条新道路。
PDA涂层可以在多种材料表面形成,而动力学缓慢是PDA涂层形成的一个关键缺点,随着研究的深入,越来越多的方法被用于加快PDA涂层的制备。Zhang等[21]和Zhu等[22]分别开发了CuSO4/H2O2和FeCl3/H2O2两种体系,在促进DA单体快速聚合的同时提高了涂层的稳定性。Duan等[23]将过碘酸钠(NalO4)作为DA聚合过程中的氧化剂,5 min内即可在奥克托今(HMX)晶体表面形成PDA涂层。Lee等[24]通过微波辐射产生自由基并升高温度,加快了DA的热加速自由基聚合。PDA的工艺参数对涂层的质量和性能有较大影响,适当调整涂覆时间、温度、DA浓度等实验因素,有利于形成具有优异性能的PDA涂层。
2.2 PDA纳米粒子
目前已有多种方法合成PDA纳米粒子,控制所形成粒子的大小和形态是制备PDA纳米粒子的关键所在。pH、缓冲溶液、氧化剂、DA单体和反应物浓度、反应温度和时间等是影响DA聚合过程的因素,当在反应过程中对上述因素中的一个或多个进行调整时,可获得不同大小和形态的PDA粒子。Ho等[25]研究发现PDA纳米粒子的粒径与DA溶液的初始pH密切相关,且随着pH的增加而增大。尽管PDA的制备通常是在碱性条件下进行,但现有研究表明,酸性或中性条件下也可以制备出PDA纳米粒子。Zheng等[26]首次使用溶液氧化法在强酸性(pH1)条件下合成了PDA纳米粒子的聚集体,这意味着PDA的形成不再依赖于基本的碱性环境。
张弘弢等[27]分别以氢氧化钠(NaOH)溶液、三羟甲基氨基甲烷(tris)缓冲液、氨水、磷酸缓冲液作为制备PDA纳米粒子的反应介质(pH8.5),成功制备了在上述相应溶液中具有良好分散性的稳定的球状PDA纳米粒子。由于不同反应介质产生的外加化合物与DA之间形成不同的相互作用,DA单体氧化自聚合反应速率及所形成PDA粒子大小不同。此外,Wu等[28]还研究了DA:NaOH摩尔比、DA浓度、反应时间、反应温度以及氧化剂类型对PDA纳米粒子粒径的影响。结果表明,较多氢氧根离子(OH−)或强氧化剂的存在促进了PDA的成核,导致PDA纳米粒子具有更小的粒径。在一定范围内,随着DA浓度增加或反应时间延长,PDA纳米粒子的核心不断增长,粒径不断增加。而较高的反应温度不仅加快了PDA粒子的成核,还促进了DA单体的扩散。尽管多项研究已经表明,通过调整pH、DA单体浓度、反应物浓度等因素,PDA粒子的大小和形态会发生相应的变化,但是多数研究结果只是反映了某些因素对PDA形成影响的趋势。因此,明确PDA形成的机理是获得PDA纳米粒子最佳制备条件的前提。
2.3 PDA纳米空心胶囊
PDA的中空结构是由PDA层包围中空腔体构成,其制备主要依赖于DA单体在各种牺牲模板上聚合后模板的去除。常用的模板可分为硬模板和软模板,在为最终产物提供适当的形状和结构方面,两种模板均发挥着重要的作用。二氧化硅(SiO2)是使用最多的硬模板,Postma等[29]通过DA在弱碱性溶液中的自发氧化聚合而自聚合到SiO2粒子上,随后利用氢氟酸蚀刻核心SiO2粒子获得PDA的中空结构,其厚度和直径可分别通过调整聚合反应的时间和SiO2粒子的大小来控制。与无孔的SiO2模板相比,使用介孔SiO2模板所获得的中空结构更加完整,折叠较少。除SiO2外,聚苯乙烯[30]、姜黄素晶体[31]、DNA纳米结构[32]等也被用作牺牲核,采用类似的方法构建PDA中空结构。尽管采用硬模板法能够制备出具有均一粒径的中空PDA,但硬模板的去除涉及酸和有机试剂等刺激性化学试剂的使用,不仅危害了环境,也极大地限制了材料的应用。
Cui等[33]以二甲基二乙氧基硅烷(DMDES)乳液作为软模板,PDA在DMDES乳液表面沉积后经乙醇去除模板获得单分散的中空PDA。控制DMDES乳液的缩合时间或浓度可以制备出具有精确粒径(400 nm至2.4 μm)和壳厚度(10至30 nm)的微胶囊。随后,四氢呋喃-缓冲液混合物[34]、聚甲基丙烯酸乙酯[35]、Pickering乳液[36]等用作软模板也有相关报道。与硬模板相比,软模板的去除避免了有毒有害试剂的使用,且在乳液液滴中预装载磁性纳米粒子、疏水性药物和量子点可以将这些材料封装在聚合物胶囊中。但相应地,乳液的前期制备及表面活性剂的使用是软模板法需要改进的方面。随着研究的不断深入,PDA纳米空心胶囊的制备已不再依赖于模板的存在,这使得PDA纳米胶囊更易于获得[37−38]。
2.4 PDA介孔纳米粒子
介孔结构是一类孔径介于2~50 nm之间的多孔结构,与实心PDA纳米粒子相比,具有介孔结构的PDA纳米粒子拥有更大的比表面积,更强的吸附及装载能力。一般来说,介孔结构的制备需要成孔剂的参与,通常选用有机聚合物。例如,Tang等[39]以高分子量二嵌段聚合物聚苯乙烯-聚环氧乙烷(PS-b-PEO)的胶束为软模板,DA单体聚合并与PS-b-PEO胶束进一步共组装,高温碳化后导致具有超大介孔结构的N掺杂介孔碳球的形成。Chen等[40]以三嵌段共聚物普朗尼克F127(Pluronic F127)和1,3,5-三甲苯(TMB)形成的水包油型微乳液体系作为溶液中的有机模板,获得了粒径和孔径可调的介孔PDA粒子。在调控介孔孔径大小方面,模板法主要是通过控制无机物与软模板之间的组装形式来获得具有孔隙结构的PDA介孔纳米粒子,双模板法合成具有特殊孔隙结构的纳米粒子为其他介孔材料的合成提供了参考。
由于DA分子可有效地与大多数有机和无机表面结合,适当控制乳液液滴和原位形成的介孔结构PDA粒子之间的相互作用,可能为通过岛形核和各向异性生长模式形成不对称介孔粒子提供机会。Guan等[41]利用乳液诱导界面各向异性组装策略,在TMB/水界面形成由嵌段共聚物F127/TMB/PDA复合胶束组装的岛状介孔结构PDA粒子,连续的协同自组装自粒子内部径向驱动介孔的定向生长,合成了直径约210 nm具有径向介孔的碗状不对称介孔PDA粒子。
2.5 PDA核-壳纳米粒子
由于PDA表面存在大量活性官能团且具有强大的粘附特性,可通过共价结合和/或非共价结合与不同性质基底表面作用,因而,PDA被广泛用于其他各种纳米结构的功能化和/或涂层。Feng等[42]在没有任何额外试剂或处理的情况下,以Ag+为氧化剂和金属纳米粒子的来源,DA作为还原剂和单体,通过Ag+氧化聚合DA单体一步合成核-壳Ag@PDA纳米复合材料。Si等[43]首先通过溶剂热法合成了羧基功能化的Fe3O4纳米粒子,DA单体加入后-COO-H3N-离子对的形成使得大部分单体被吸附在粒子表面,随后DA在其表面的原位聚合制备了PDA包覆的具有单分散性的Fe3O4@PDA纳米复合材料,避免了裸露Fe3O4纳米粒子的团聚。由于PDA涂层表面含有大量的活性邻苯二酚和氨基,可以通过还原金属离子将金属纳米粒子引入到各种基底上。Xie等[44]提出了Fe3O4@PDA-Ag核-壳微球结构,其中PDA作为还原剂,为贵金属盐(AgNO3)在PDA表面上的原位还原成Ag纳米粒子提供了模板。
金属-有机框架材料(metal-organic frameworks,MOFs)是一类具有多种独特性能的多孔材料,Tu等[45]以沸石咪唑酯-8(ZIF-8)为核心,利用PDA表面的儿茶酚基团与金属离子的螯合作用于ZIF-8表面进行涂层,制备了具有明确核-壳结构的ZIF-8@PDA粒子,实现了金属离子(Zn2+)的控制性释放。除上述金属、Fe3O4及MOFs材料,聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid))纳米粒子用作制备核-壳型结构PDA粒子的核心材料也有报道。Zhu等[46]对D-α-生育酚聚乙二醇聚琥珀酸酯-聚丙交酯纳米粒子(TPGS-PLA/NPs)进行PDA表面改性,随后将半乳糖胺缀合在制备的纳米粒子(pD-TPGS-PLA/NPs)上,通过配体介导的内吞作用,增强了应用时的靶向性。
3. PDA在食品中的应用
纳米材料是否具有良好的生物相容性是保证人体健康和安全的前提。Lin等[7]以HeLa细胞为试验对象,研究了中空介孔PDA纳米粒子(hollow mesoporous polydopamine nanospheres,H-MPDANSs)的体外细胞毒性,结果显示当H-MPDANSs浓度高达100 μg/mL时,孵育48 h后,细胞存活率仍保持在82%以上,证实了H-MPDANSs在100 μg/mL以下具有良好的生物相容性。Wu等[47]对PDA/Ag纳米复合粒子进行体外细胞毒性试验发现,PDA/Ag纳米复合粒子对HEK293T人胚胎肾细胞没有明显的细胞毒性。此外,多次生物细胞和小鼠活体试验也证明了PDA具有较低的细胞毒性,且PDA已在生物医学领域被广泛用作药物载体。尽管PDA纳米复合材料在食品中的使用尚未有相应的标准,PDA在生物医学领域的广泛应用为其提供了参考。
PDA具有良好的金属离子螯合性、生物相容性、抗菌性等多种理化特性,这些特性为PDA纳米材料在食品领域中的广泛应用提供了有力的保证。到目前为止,PDA在食品领域中的应用已涉及多个方面,主要包括用于改性食品包装材料、开发食品功能性滤膜、固定及纯化食品工业用酶、检测食品中的污染物以及递送生物活性成分等。
3.1 改性食品包装材料
随着石油基材料所带来的生态环境问题日益突出,生物来源、可再生、可生物降解的聚合物逐渐成为了石油基食品包装材料的理想替代品。然而,生物聚合物包装材料的固有缺点,如机械性能较弱、耐水性较差、热稳定性较差等,限制了其在食品包装中的应用。目前,在生物聚合物中引入功能性纳米填料已被证明是改善生物聚合物基材料理化性能最有效的方法之一。PDA因其制备简便、无毒、环保、具有良好的紫外线阻隔和抗氧化功能,从诸多的功能性纳米填料中脱颖而出,成为了制备生物聚合物基功能性纳米复合材料的有力候选者[48]。Yu等[5]将PDA纳米粒子作为增容剂填充至聚乙烯醇/淀粉(PVA/ST)基质中,增强了PVA/ST/PDA共混薄膜的相容性、物理(抗拉伸强度、热稳定性和水蒸气阻隔性能)和功能特性(隔热和抗氧化),使PVA/ST/PDA纳米复合薄膜在活性食品包装中的适用性得到了较大的提升。
除了作为单一的功能性纳米填料,PDA还可参与其他纳米填料的表面功能化改性,从而赋予薄膜新的功能特性。Xu等[49]通过PDA修饰改善纤维素纳米晶体(CNCs)与聚乳酸(PLA)基体的相容性,并增强CNCs与PLA之间的界面附着力,从而改善了PDA/CNCs/PLA的力学性能。此外,PDA的存在使复合材料具有UV屏蔽性能,有望延长食品的货架期并应用于光敏食品的包装。Yilmaz等[50]采用不同浓度(0.25、0.5、1 mg/mL)的PDA包覆负载香芹酚的玉米醇溶蛋白纳米颗粒(CLZNPs)制备了CLZPNPs。与CLZNPs相比,CLZPNPs具有更好的稳定性、抗氧化和抗菌等生物活性,将其应用于食品包装可以在提高产品储存稳定性的基础上,有效控制各种食源性细菌病原体。Prabhakar等[48]使用聚乙烯醇(polyvinyl alcohol,PVA)、甘油(glycerol,GL)、ε-聚赖氨酸(epsilon-polylysine,ε-PL)和PDA制备了可生物降解的食品包装薄膜,薄膜中PDA的添加使聚合物链之间产生生物连接,这为微生物生物降解提供了剪切位点。PDA具有一定的抗菌活性、较强的抗氧化性和紫外线屏蔽性能,是制备功能性复合薄膜的理想填充材料。以PDA作为功能性填料制备复合薄膜,在解决塑料食品包装生物降解性差、食品微生物污染、光诱导食品变质等问题上具有巨大的潜力。
3.2 开发食品功能性滤膜
膜分离技术(membrane separation technology,MST)是一种可以对物质进行选择性分离浓缩的技术,具有工艺简单、节能、自动化程度高等优点,已被广泛应用于食品加工工业中以提高产品质量。由于PDA可沉积在各种材料表面且具有化学多样性,利用其对膜表面进行改性以提高膜本身的性能有利于提高MST在食品工业中的应用效率。例如,Wu等[51]利用PDA将MOFs粒子密封在聚丙烯腈(polyacrylonitrile,PAN)膜上并接枝带电聚合物,将具有高表面积的MOFs和多孔超滤膜结合作为一种新型吸附剂用以去除AFB1。其中,经PDA和海藻酸二醛(alginate dialdehyde,ADA)改性处理30 min后的MIL-100/PAN膜的ABF1去除率最高(达76.4%),并且采用简单的解吸工艺即可实现良好的重复利用。Zhang等[52]通过对聚偏二氟乙烯(polyvinylidene difluoride,PVDF)微滤(microfiltration,MF)进行多级表面修饰,即采用PDA涂层后将乳酸链球菌肽(nisin)作为天然防腐剂接枝到膜上,制备了一种食品功能性MF膜。该膜在过滤苹果汁中酸土脂环酸芽孢杆菌的同时完成细菌的杀灭,且在不同的膜清洗程序下仍保持稳定。
膜污染是MST在液体食品加工过程中大规模应用的主要限制,用PDA对膜进行改性从而改变污垢与膜之间的相互作用是减少污垢形成的有效途径。Barclay等[53]通过PDA层作为粘合剂将聚两性离子防污聚合物附着在聚醚砜超滤膜(polyethersulfone ultrafiltration membranes,PES UF)上,以减少脱脂牛奶过滤中的生物污染。研究表明,膜涂层有效地提高了膜表面的润湿性和光滑度,降低了蛋白质与膜之间的结合强度,同时保持了脱脂牛奶的通量。Xiong等[54]首次将PDA与陶瓷膜通过高温动态沉积法相结合,制备了一种耐高温、抗糖汁污染的改性陶瓷膜(high-temperature dynamic deposition ceramic membrane,HTDCM)。与原始膜(raw membrane,RM)相比,HTDCM表现出优异的热稳定性、化学稳定性、生物相容性和防污性能,澄清效果更好(>99%),渗透通量更高(193.75 LMH)。而杨强剑等[55]对不同孔径的PES UF膜和聚乙烯亚胺(PEI)、壳寡糖(CS)、氧化海藻酸钠(ADA)等不同聚合物接枝的PDA改性PES UF膜在甘蔗糖蜜澄清脱色中的应用效果进行评价发现,UF膜孔径的大小、膜表面的荷电性是控制污染形成的重要因素。在糖蜜的处理过程中,以ADA接枝的大孔UF膜有效降低了膜污染的产生。在食品工业中,MST的开发有望替代传统的低效分离技术应用于工业生产,PDA的修饰可以改变膜的亲疏水性、抗菌性以及改善膜的力学性能,制备高性能膜。由于PDA的聚合机理尚不清楚、纯DA溶液的自然沉积耗时长且效率低,开发一种温和、快速的方法加速DA的沉积是实现工业化应用需要克服的困难。
3.3 固定及纯化食品工业用酶
PDA具有良好的生物相容性且表面的儿茶酚基团很容易通过席夫碱反应与酶的胺基作用,使酶在简单温和的作用过程后即可被有效固定在PDA表面。由于传统的食品生产相关酶的分离纯化涉及一系列复杂的步骤,具有耗时、不环保、条件苛刻、低特异性或高成本等局限性,表面分子印迹技术(molecular imprinting technology,MIT)受到了越来越多的关注。PDA因其聚合步骤单一,不需要使用任何交联剂或引发剂,通常可以作为印迹层。Xu等[56]首次以石榴皮衍生的磁性介孔碳(magnetic mesoporous carbon,MPC)为载体,菠萝蛋白酶(bromelain,Br)分子作为生成Br印迹空腔的模板,制备了新型磁性介孔分子印迹聚合物(magnetic mesoporous molecularly imprinted polymers,MPMIPs)应用于Br的特异性识别和提取。试验结果表明Br@MPMIPs对Br具有良好的快速特异性吸附作用,吸附量高达135.96 mg/g,且可以重复使用至少6次。Amaly等[57]通过用PDA层涂覆羧基化聚乙烯醇-乙烯纳米纤维毡(EVOH-CCA NFM)制备了基于纳米纤维膜的表面分子印迹基质,用于选择性分离溶菌酶。除了具有较高的吸附能力(500 mg/mL)和可回收特性(5个循环),PDA对近红外(NIR)的光响应特性使得提取的溶菌酶在NIR作用下可以受控释放。
目前,与生产催化相关的多种酶已经被固定在经PDA改性的材料表面用于高效制备酯、肽、β-环糊精、寡聚右旋糖酐等物质,以满足食品工业化生产的需要。Asmat等[58]通过胺化PDA对多壁碳纳米管(MWCNTs)与磁性钴(Co)结合制备的磁性多壁碳纳米管进行表面功能化后,成功将皱假丝酵母脂肪酶(CRL)固定在载体PDA@Co-MWCNT上。与游离的CRL相比,固定化CRL具有出色的耐热性、耐pH和回收性能,且其催化活性较之前提高了3倍,丁酸乙酯和乙酸异戊酯两种风味酯的产率分别高达78%和75%。而Yao等[59]通过共价键将CRL和梳棉状嗜热丝孢菌脂肪酶(TLL)共同固定在用PDA功能化的超顺磁性纳米球Fe3O4纳米粒子上,制备了富含甘油二酯(DAGs)、植物甾醇酯(Pes)和α-亚麻酸(ALA)的新型功能油。其中,两种脂肪酶的共固定产生了协同效应,导致更高含量功能成分的产生。这意味着,在用于食品工业生产时,可以将两种甚至两种以上的相关酶同时固定在载体材料表面,以提高目标物质的产率。
3.4 检测食品中的污染物
由于PDA具有丰富的吸附位点和官能团,在食品安全检测中,PDA功能化的复合材料已成功用于检测食品样品中存在的多种污染物,包括微生物、农药及兽药残留、重金属残留、食品添加剂等。在色谱分析过程中,PDA已作为吸附剂应用于食品样品的预处理中,其中PDA与目标物之间的氢键相互作用、π-π堆积和电荷转移在吸附过程中发挥了重要作用。Gao等[60]使用核壳型结构的PDA@Fe3O4 NPs作为吸附剂,结合聚合酶链式反应(polymerase chain reaction,PCR)和毛细管电泳(capillary electrophoresis,CE)开发了一种快速灵敏地检测食品中金黄色葡萄球菌的方法。结果表明,PDA@Fe3O4 NPs-PCR-CE可以在5.5 h内快速检测出自来水和稀释橙汁样品中的金黄色葡萄球菌,检测限低至102 CFU/mL,为快速检测食品中的病原菌提供了平台。Chai等[61]将Fe3O4@PDA NPs作为分散固相萃取(dispersive solid-phase extraction,D-SPE)的吸附剂对饮料样品中的四种代表性水溶性色素进行吸附和预浓缩。研究证明了磁性D-SPE-HPLC在分析实际食品样品中合成着色剂的可行性和可靠性。
除了作为样品预处理的吸附剂,PDA还可以作为传感器构建的基质。Bonyadi等[62]以日落黄(sunset yellow,SY)为模板,使用表面印迹技术合成了SiO2@MIP-PDA NPs。碳糊电极(carbon paste electrode,CPE)表面被NPs进一步修饰后成功用于测定果汁饮料、果冻粉、奶酪零食等样品中的SY。与其他传感器相比,该传感器不仅具有灵敏度高、选择性好、重现性好和稳定性好等优点,其检测线较低,线性动态范围较宽,对SY具有特异性。Scarano等[63]首次利用Au NPs@PDA对UV-Vis聚苯乙烯比色皿进行改进,基于局部表面等离子体共振(localized surface plasmon resonance,LSPR)测定啤酒麦汁中的可发酵糖。结果显示,PDA的厚度与光学特性之间存在线性相关性,通过增加PDA层的厚度可以有效调节Au NPs的LSPR机制。Tian等[64]设计了一种使用金属-PDA框架(metal-polydopamine framework,MPF)作为标记物的横向流动测定法(lateral flow assay,LFA),用于视觉层面高灵敏度检测四环素(tetracycline,TET)。MPF-LFA已成功应用于牛奶、虾、鱼和鸡肉等样品中的TET检测,检测限为0.045 ng/mL。与传统的基于Au NPs的LFA相比,MPF-LFA的灵敏度和回收率均得到了极大的提高。在食品污染物检测中,PDA既可作为吸附剂用于样品前处理,也可修饰电极表面用于定量测定,其应用显著提高了单一有害物质的检测灵敏度,降低了检测限,使食品中痕量污染物的检测更加精确可靠。而在实际应用过程中,食品中往往不止含有一种污染物,因此,在现有技术的基础上进一步开发可以同时检测出多种污染物的传感技术可成为研究方向之一。
3.5 递送生物活性成分
为了实现生物活性成分的高效靶向递送,提高其应用过程中的安全性和有效性,以PDA为代表的生物相容性聚合物的出现为开发PDA纳米递送载体提供了研究思路。Li等[65]利用PDA和酪蛋白(casein)包覆玉米醇溶蛋白颗粒(zein),构建了一种核壳纳米复合材料(RES-ZPCs)用于白藜芦醇(resveratrol,RES)的递送,其中PDA提高了RES-ZPCs的稳定性和抗氧化活性。任丹丹等[66]以介孔PDA(MPDA)作为纳米载体负载阿霉素(doxorubicin,Dox),随后包裹血小板膜(PLTM)制备了PLTM-Dox@MPDA纳米粒子,该纳米复合材料对Dox具有较高的载药率,能够有效地靶向输送Dox。
Lin等[7]通过调节TMB和F127的比重合成了空心介孔PDA纳米球(H-MPDANSs),H-MPDANSs可以高效负载Dox(负载率高达66%),且NIR照射的酸性pH条件下能够控制Dox的释放。Sun等[67]制备了一种NIR介导的铜-没食子酸-肉桂醛-PDA纳米棒(Cu-GA-CA-PDA NRs),除了控制CA的释放,PDA在808 nm NIR照射下具有的光热转换能力赋予了该纳米棒光热杀菌的特性,实现了协同抗菌。目前,PDA纳米材料已被用作多种生物活性成分的载体,基于其优异的光热转换性能、pH敏感性以及良好的生物相容性,PDA纳米载体的“保护”提高了活性物质本身的稳定性、靶向性、可控释放能力甚至是协调抗菌能力,因此PDA纳米材料是一种有前景的纳米载体。
4. 总结与展望
由于PDA形成过程中的氧化聚合路径和中间产物组分较复杂,PDA的结构和聚合机理尚不清楚,因此无法精确控制PDA的聚合过程,这极大限制了PDA在工业生产中的应用。为克服上述应用局限,对PDA的反应动力学及中间体结构进行深入探究以明确PDA的合成机制是必要的。PDA纳米材料的制备往往需要经过多次洗涤离心除杂,过程中涉及酸、碱、强氧化剂或有毒有害组分的使用,且原材料DA的价格相对较高,因而从可持续发展和节能的角度出发,研究工艺简单、绿色、经济的PDA制备方法是至关重要的。
到目前为止,PDA已经作为涂层、纳米粒子、微胶囊、介孔纳米粒子等应用于各个生产和生活领域。由于具有不同形貌特征的PDA纳米材料将呈现出不同的物理化学性质,在上述结构形态的基础上,构建纳米管、二维PDA纳米片等多种形式的PDA纳米复合材料将进一步拓展PDA在包括但不限于食品、生物医学、能源等众多领域中的应用。此外,基于PDA作为药物载体在生物医学领域的广泛应用,PDA纳米材料有望成为食品领域中生物活性物质的载体,以解决生物活性物质普遍存在的溶解性差、稳定性低、生物利用度低等缺点。
-
[1] LEE H, DELLATORE S M, MILLER W M, et al. Mussel-inspired surface chemistry for multifunctional coatings[J]. Science,2007,318(5849):426−430. doi: 10.1126/science.1147241
[2] LEE H A, MA Y F, ZHOU F, et al. Material-independent surface chemistry beyond polydopamine coating[J]. Accounts of Chemical Research,2019,52(3):704−713. doi: 10.1021/acs.accounts.8b00583
[3] CHENG W, ZENG X W, CHEN H Z, et al. Versatile polydopamine platforms:Synthesis and promising applications for surface modification and advanced nanomedicine[J]. Acs Nano,2019,13(8):8537−8565. doi: 10.1021/acsnano.9b04436
[4] DU L Y, WANG X D, LIU T T, et al. Magnetic solid-phase extraction of organophosphorus pesticides from fruit juices using NiFe2O4@polydopamine@Mg/Al-layered double hydroxides nanocomposites as an adsorbent[J]. Microchemical Journal,2019,150:104128. doi: 10.1016/j.microc.2019.104128
[5] YU J L, WEI D, LI S Y, et al. High-performance multifunctional polyvinyl alcohol/starch based active packaging films compatibilized with bioinspired polydopamine nanoparticles[J]. International Journal of Biological Macromolecules,2022,210:654−662. doi: 10.1016/j.ijbiomac.2022.04.221
[6] LEE H, RHO J, MESSERSMITH P B. Facile conjugation of biomolecules onto surfaces via mussel adhesive protein inspired coatings[J]. Advanced Materials,2009,21(4):431−434. doi: 10.1002/adma.200801222
[7] LIN K P, GAN Y, ZHU P D, et al. Hollow mesoporous polydopamine nanospheres:Synthesis, biocompatibility and drug delivery[J]. Nanotechnology,2021,32(28):285602. doi: 10.1088/1361-6528/abf4a9
[8] ZHENG P, DING B B, LI G. Polydopamine-incorporated nanoformulations for biomedical applications[J]. Macromolecular Bioscience,2020,20(12):2000228. doi: 10.1002/mabi.202000228
[9] WANG Z, ZOU Y, LI Y W, et al. Metal-containing polydopamine nanomaterials:Catalysis, energy, and theranostics[J]. Small,2020,16(18):1907042. doi: 10.1002/smll.201907042
[10] 刘娜, 曹强, 肖雨诗, 等. 基于多巴胺及其衍生物的传感器在食品快速检测中的研究进展[J]. 食品科学,2021,42(5):332−339. [LIU N, CAO Q, XIAO Y S, et al. Research progress of sensors based on dopamine and its derivatives in the rapid detection of food[J]. Food Science,2021,42(5):332−339.] doi: 10.7506/spkx1002-6630-20200310-164 LIU N, CAO Q, XIAO Y S, et al . Research progress of sensors based on dopamine and its derivatives in the rapid detection of food[J]. Food Science,2021 ,42 (5 ):332 −339 . doi: 10.7506/spkx1002-6630-20200310-164[11] LI N, WANG H B, THIA L, et al. Enzymatic-reaction induced production of polydopamine nanoparticles for sensitive and visual sensing of urea[J]. Analyst,2015,140(2):449−455. doi: 10.1039/C4AN01900H
[12] LI F, YU Y, WANG Q, et al. Polymerization of dopamine catalyzed by laccase:Comparison of enzymatic and conventional methods[J]. Enzyme and Microbial Technology,2018,119:58−64. doi: 10.1016/j.enzmictec.2018.09.003
[13] WANG J L, LI B C, LI Z J, et al. Electropolymerization of dopamine for surface modification of complex-shaped cardiovascular stents[J]. Biomaterials,2014,35(27):7679−7689. doi: 10.1016/j.biomaterials.2014.05.047
[14] BERNSMANN F, BALL V, ADDIEGO F, et al. Dopamine-melanin film deposition depends on the used oxidant and buffer solution[J]. Langmuir,2011,27(6):2819−2825. doi: 10.1021/la104981s
[15] DELLA VECCHIA N F, LUCHINI A, NAPOLITANO A, et al. Tris buffer modulates polydopamine growth, aggregation, and paramagnetic properties[J]. Langmuir,2014,30(32):9811−9818. doi: 10.1021/la501560z
[16] LIU B, BURDINE L, KODADEK T. Chemistry of periodate-mediated cross-linking of 3,4-dihydroxylphenylalanine-containing molecules to proteins[J]. Journal of the American Chemical Society,2006,128(47):15228−15235. doi: 10.1021/ja065794h
[17] DREYER D R, MILLER D J, FREEMAN B D, et al. Elucidating the structure of poly(dopamine)[J]. Langmuir,2012,28(15):6428−6435. doi: 10.1021/la204831b
[18] HONG S, NA Y S, CHOI S, et al. Non-covalent self-assembly and covalent polymerization co-contribute to polydopamine formation[J]. Advanced Functional Materials,2012,22(22):4711−4717. doi: 10.1002/adfm.201201156
[19] DELLA VECCHIA N F, AVOLIO R, ALFE M, et al. Building-block diversity in polydopamine underpins a multifunctional eumelanin-type platform tunable through a quinone control point[J]. Advanced Functional Materials,2013,23(10):1331−1340. doi: 10.1002/adfm.201202127
[20] PONZIO F, PAYAMYAR P, SCHNEIDER A, et al. Polydopamine films from the forgotten air/water interface[J]. Journal of Physical Chemistry Letters,2014,5(19):3436−3440. doi: 10.1021/jz501842r
[21] ZHANG C, OU Y, LEI W X, et al. CuSO4/H2O2-induced rapid deposition of polydopamine coatings with high uniformity and enhanced stability[J]. Angewandte Chemie-International Edition,2016,55(9):3054−3057. doi: 10.1002/anie.201510724
[22] ZHU J Y, TSEHAYE M T, WANG J, et al. A rapid deposition of polydopamine coatings induced by iron (III) chloride/hydrogen peroxide for loose nanofiltration[J]. Journal of Colloid and Interface Science,2018,523(1):86−97.
[23] DUAN S Y, WANG D H, JIANG Q P, et al. Oxidant-accelerated polydopamine modification process for the fast fabrication of PDA on HMX with improved mechanical stability[J]. Propellants Explosives Pyrotechnics,2021,46(5):751−757. doi: 10.1002/prep.202000095
[24] LEE M, LEE S H, OH I K, et al. Microwave-accelerated rapid, chemical oxidant-free, material-independent surface chemistry of poly(dopamine)[J]. Small,2017,13(4):1600443. doi: 10.1002/smll.201600443
[25] HO C C, DING S J. The pH-controlled nanoparticles size of polydopamine for anti-cancer drug delivery[J]. Journal of Materials Science-Materials in Medicine,2013,24(10):2381−2390. doi: 10.1007/s10856-013-4994-2
[26] ZHENG W C, FAN H L, WANG L, et al. Oxidative self-polymerization of dopamine in an acidic environment[J]. Langmuir,2015,31(42):11671−11677. doi: 10.1021/acs.langmuir.5b02757
[27] 张弘弢, 蒋金泓, 莫梦婷, 等. 反应介质对聚多巴胺纳米粒子制备的影响[J]. 功能高分子学报,2014,27(4):413−418. [ZHANG H T, JIANG J H, MO M T, et al. Effect of reaction medium on preparation of polydopamine nanoparticles[J]. Journal of Functional Polymers,2014,27(4):413−418.] ZHANG H T, JIANG J H, MO M T, et al . Effect of reaction medium on preparation of polydopamine nanoparticles[J]. Journal of Functional Polymers,2014 ,27 (4 ):413 −418 .[28] WU M, WANG T, MULLER L, et al. Adjustable synthesis of polydopamine nanospheres and their nucleation and growth[J]. Colloids and Surfaces a-Physicochemical and Engineering Aspects,2020,603:125196.
[29] POSTMA A, YAN Y, WANG Y J, et al. Self-polymerization of dopamine as a versatile and robust technique to prepare polymer capsules[J]. Chemistry of Materials,2009,21(14):3042−3044. doi: 10.1021/cm901293e
[30] LIN C Y, FU J W, LIU S J. Facile preparation of au nanoparticle-embedded polydopamine hollow microcapsule and its catalytic activity for the reduction of methylene blue[J]. Journal of Macromolecular Science Part a-Pure and Applied Chemistry,2019,56(12):1104−1113. doi: 10.1080/10601325.2019.1658526
[31] XUE J H, ZHENG W C, WANG L, et al. Scalable fabrication of polydopamine nanotubes based on curcumin crystals[J]. Acs Biomaterials Science & Engineering,2016,2(4):489−493.
[32] ZHANG M Z, WANG S S, LI L J, et al. Digital numbers constructed by fine patterned polydopamine on DNA templates[J]. Macromolecular Rapid Communications,2021,42(21):2100441. doi: 10.1002/marc.202100441
[33] CUI J W, WANG Y J, POSTMA A, et al. Monodisperse polymer capsules:Tailoring size, shell thickness, and hydrophobic cargo loading via emulsion templating[J]. Advanced Functional Materials,2010,20(10):1625−1631. doi: 10.1002/adfm.201000209
[34] NI Y Z, JIANG W F, TONG G S, et al. Preparation of polydopamine nanocapsules in a miscible tetrahydrofuran-buffer mixture[J]. Organic & Biomolecular Chemistry,2015,13(3):686−690.
[35] JIANG W W, ZHANG X Y, LUAN Y F, et al. Using gamma-ray polymerization-induced assemblies to synthesize polydopamine nanocapsules[J]. Polymers,2019,11(11):1754. doi: 10.3390/polym11111754
[36] TANG C X, LI Y Z, PUN J, et al. Polydopamine microcapsules from cellulose nanocrystal stabilized Pickering emulsions for essential oil and pesticide encapsulation[J]. Colloids and Surfaces a-Physicochemical and Engineering Aspects,2019,570:403−413.
[37] SUN Y Z, DAVIS E. Bowl-shaped polydopamine nanocapsules:Control of morphology via template-free synthesis[J]. Langmuir,2020,36(32):9333−9342. doi: 10.1021/acs.langmuir.0c00790
[38] AMIN D R, HIGGINSON C J, KORPUSIK A B, et al. Untemplated resveratrol-mediated polydopamine nanocapsule formation[J]. Acs Applied Materials & Interfaces,2018,10(40):34792−34801.
[39] TANG J, LIU J, LI C L, et al. Synthesis of nitrogen-doped mesoporous carbon spheres with extra-large pores through assembly of diblock copolymer micelles[J]. Angewandte Chemie-International Edition,2015,54(2):588−593. doi: 10.1002/anie.201407629
[40] CHEN F, XING Y X, WANG Z Q, et al. Nanoscale polydopamine (PDA) meets pi-pi interactions:An interface-directed coassembly approach for mesoporous nanoparticles[J]. Langmuir,2016,32(46):12119−12128. doi: 10.1021/acs.langmuir.6b03294
[41] GUAN B Y, YU L, LOU X W. Formation of asymmetric bowl-like mesoporous particles via emulsion-induced interface anisotropic assembly[J]. Journal of the American Chemical Society,2016,138(35):11306−11311. doi: 10.1021/jacs.6b06558
[42] FENG J J, ZHANG P P, WANG A J, et al. One-step synthesis of monodisperse polydopamine-coated silver core-shell nanostructures for enhanced photocatalysis[J]. New Journal of Chemistry,2012,36(1):148−154. doi: 10.1039/C1NJ20850K
[43] SI J Y, YANG H. Preparation and characterization of bio-compatible Fe3O4@Polydopamine spheres with core/shell nanostructure[J]. Materials Chemistry and Physics,2011,128(3):519−524. doi: 10.1016/j.matchemphys.2011.03.039
[44] XIE Y J, YAN B, XU H L, et al. Highly regenerable mussel-inspired Fe3O4@Polydopamine-Ag core-shell microspheres as catalyst and adsorbent for methylene blue removal[J]. Acs Applied Materials & Interfaces,2014,6(11):8845−8852.
[45] TU Y X, LEI C F, DENG F, et al. Core-shell ZIF-8@polydopamine nanoparticles obtained by mitigating the polydopamine coating induced self-etching of MOFs:Prototypical metal ion reservoirs for sticking to and killing bacteria[J]. New Journal of Chemistry,2021,45(19):8701−8713. doi: 10.1039/D1NJ00461A
[46] ZHU D W, TAO W, ZHANG H L, et al. Docetaxel (DTX)-loaded polydopamine-modified TPGS-PLA nanoparticles as a targeted drug delivery system fore the treatment of liver cancer[J]. Acta Biomaterialia,2016,30(2):144−154.
[47] WU C J, ZHANG G X, XIA T, et al. Bioinspired synthesis of polydopamine/Ag nanocomposite particles with antibacterial activities[J]. Materials Science & Engineering C-Materials for Biological Applications,2015,55:155−165.
[48] PRABHAKAR P, SEN R K, MAYANDI V, et al. Mussel-inspired chemistry to design biodegradable food packaging films with antimicrobial properties[J]. Process Safety and Environmental Protection,2022,162:17−29. doi: 10.1016/j.psep.2022.03.033
[49] XU Y Z, ZHENG D Y, CHEN X J, et al. Mussel-inspired polydopamine-modified cellulose nanocrystal fillers for the preparation of reinforced and UV-shielding poly (lactic acid) films[J]. Journal of Materials Research and Technology-Jmr & T,2022,19:4350−4359.
[50] YILMAZ M T, AKMAN P K, BOZKURT F, et al. An effective polydopamine coating to improve stability and bioactivity of carvacrol-loaded zein nanoparticles[J]. International Journal of Food Science and Technology,2021,56(11):6011−6024. doi: 10.1111/ijfs.15296
[51] WU Q, FAN J X, CHEN X R, et al. Sandwich structured membrane adsorber with metal organic frameworks for aflatoxin B1 removal[J]. Separation and Purification Technology,2020,246:116907. doi: 10.1016/j.seppur.2020.116907
[52] ZHANG J Y, LI S H, WANG W J, et al. Bacteriocin assisted food functional membrane for simultaneous exclusion and inactivation of alicyclobacillus acidoterrestris in apple juice[J]. Journal of Membrane Science,2021,618:118741. doi: 10.1016/j.memsci.2020.118741
[53] BARCLAY T G, HEGAB H M, MICHELMORE A, et al. Multidentate polyzwitterion attachment to polydopamine modified ultrafiltration membranes for dairy processing:Characterization, performance and durability[J]. Journal of Industrial and Engineering Chemistry,2018,61:356−367. doi: 10.1016/j.jiec.2017.12.035
[54] XIONG Y S, LI W, LU H Q, et al. Polydopamine-modified ceramic membrane for filtering brown sugar redissolved syrup:Characterisation, experiments, and advanced modelling[J]. Journal of Membrane Science,2022,657:120607. doi: 10.1016/j.memsci.2022.120607
[55] 杨强剑, 罗建泉, 郭世伟, 等. 聚醚砜超滤膜处理糖蜜中的膜污染控制[J]. 膜科学与技术,2019,39(6):94−102. [YANG Q J, LUO J Q, GUO S W, et al. Membrane pollution control in molasses treated by polyether sulfone ultrafiltration membrane[J]. Membrane Science and Technology,2019,39(6):94−102.] YANG Q J, LUO J Q, GUO S W, et al . Membrane pollution control in molasses treated by polyether sulfone ultrafiltration membrane[J]. Membrane Science and Technology,2019 ,39 (6 ):94 −102 .[56] XU X Y, LIU R L, GUO P Q, et al. Fabrication of a novel magnetic mesoporous molecularly imprinted polymer based on pericarpium granati-derived carrier for selective absorption of bromelain[J]. Food Chemistry,2018,256(Aug.1):91−97.
[57] AMALY N, EL-MOGHAZY A Y, SUN G. Fabrication of polydopamine-based NIR-light responsive imprinted nanofibrous membrane for effective lysozyme extraction and controlled release from chicken egg white[J]. Food Chemistry,2021,357(Sep.30):129613.
[58] ASMAT S, ANWER A H, HUSAIN Q. Immobilization of lipase onto novel constructed polydopamine grafted multiwalled carbon nanotube impregnated with magnetic cobalt and its application in synthesis of fruit flavours[J]. International Journal of Biological Macromolecules,2019,140:484−495. doi: 10.1016/j.ijbiomac.2019.08.086
[59] YAO G H, WANG X J, YANG M L, et al. Co-immobilization of bi-lipases on magnetic nanoparticles as an efficient catalyst for synthesis of functional oil rich in diacylglycerols, phytosterol esters and alpha-linolenic acid[J]. LWT-Food Science and Technology,2020,129(9):109522.
[60] GAO X M, YAO X, ZHONG Z T, et al. Rapid and sensitive detection of Staphylococcus aureus assisted by polydopamine modified magnetic nanoparticles[J]. Talanta,2018,186:147−153. doi: 10.1016/j.talanta.2018.04.046
[61] CHAI W B, WANG H J, ZHANG Y, et al. Preparation of polydopamine-coated magnetic nanoparticles for dispersive solid-phase extraction of water-soluble synthetic colorants in beverage samples with HPLC analysis[J]. Talanta,2016,149:13−20. doi: 10.1016/j.talanta.2015.11.026
[62] BONYADI S, GHANBARI K. Development of highly sensitive and selective sensor based on molecular imprinted polydopamine-coated silica nanoparticles for electrochemical determination of sunset yellow[J]. Microchemical Journal,2021,167:116322.
[63] SCARANO S, PASCALE E, PALLADINO P, et al. Determination of fermentable sugars in beer wort by gold nanoparticles@polydopamine:A layer-by-layer approach for localized surface plasmon resonance measurements at fixed wavelength[J]. Talanta,2018,183:24−32. doi: 10.1016/j.talanta.2018.02.044
[64] TIAN Y M, BU T, ZHANG M, et al. Metal-polydopamine framework based lateral flow assay for high sensitive detection of tetracycline in food samples[J]. Food Chemistry,2021,339(Mar.1):127854.
[65] LI S M, LI Z X, PANG J F, et al. Polydopamine-mediated carrier with stabilizing and self-antioxidative properties for polyphenol delivery systems[J]. Industrial & Engineering Chemistry Research,2018,57(2):590−599.
[66] 任丹丹, 吴梦, 肖天钰, 等. 血小板膜伪装介孔聚多巴胺纳米药物传递系统的制备及应用[J]. 精细化工,2021,38(7):1430−1435,1493. [REN D D, WU M, XIAO T Y, et al. Preparation and application of platelet membrane camouflaged mesoporous polydopamine nanodrug delivery system[J]. Fine Chemicals,2021,38(7):1430−1435,1493.] REN D D, WU M, XIAO T Y, et al . Preparation and application of platelet membrane camouflaged mesoporous polydopamine nanodrug delivery system[J]. Fine Chemicals,2021 ,38 (7 ):1430 −1435,1493 .[67] SUN X, LI L, ZHANG H, et al. Near-infrared light-regulated drug-food homologous bioactive molecules and photothermal collaborative precise antibacterial therapy nanoplatform with controlled release property[J]. Advanced Healthcare Materials,2021,10(16):e2100546. doi: 10.1002/adhm.202100546





 下载:
下载:
 下载:
下载:
