Rapid Identification of Three Foodborne Pathogens in Ready-to-Eat Bulk Foods by Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry
-
摘要: 本研究旨在利用基质辅助激光解吸电离飞行时间质谱法(Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry,MALDI-TOF MS)快速检测并鉴定散装即食食品中的沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌3种食源性致病菌。通过对点样方式、前处理方式、不同培养基及培养时间等各项实验条件的优化筛选确定最佳方法,并考察其检测限和稳定性,同时用所建立的方法与多重PCR法、VITEK 2等生化鉴定法进行结果比对,比较三者鉴定结果的一致性,最后进行批量食品样本检测来探寻MALDI-TOF MS鉴定法在散装即食食品中的适用性。结果表明,三种目标菌同一批次及不同传代次数的鉴定得分均大于95%,变异系数均小于2%,所建立的方法重复性和稳定性良好,且检测限为105 CFU/mL,MALDI-TOF MS菌株鉴定结果与多重PCR法、生化鉴定法结果高度一致,且比二者检测用时更短,更加特异高效;在点样方式上,相较于夹心法与混合干滴法,三种覆盖法点样平均鉴定得分更高,均为99.9%,其中1 µL+1 µL覆盖法点样可获得的平均峰数目更多,特征峰更复杂且强度更高;而在前处理方式上,甲酸乙腈法与其他两种菌体处理方法相比可获得更多的出峰量和更高的峰强度,平均鉴定得分均在98%以上,且与数据库中图谱匹配度更高。综上所述,MALDI-TOF MS法在致病菌鉴定方面不仅灵敏特异、准确快速,且操作简便、结果直观,作为国标法的有力补充,为食源性致病菌的分析鉴定与分型溯源提供了新思路。
-
关键词:
- 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS) /
- 散装即食食品 /
- 沙门氏菌 /
- 金黄色葡萄球菌 /
- 蜡样芽孢杆菌
Abstract: The matrix-assisted laser desorption ionization-time of flight mass spectrometry (MALDI-TOF MS) diagnostic tool was used to rapidly detect and identify three foodborne pathogens, Salmonella, Staphylococcus aureus and Bacillus cereus in ready-to-eat bulk foods in this study. The best method was identified by optimizing and screening various experimental conditions such as spot sampling method, pre-treatment method, different media and culture time, and its detection limit and stability were evaluated. Meanwhile, the established method was compared with multiplex PCR and the other biochemical identification methods such as VITEK 2 to contrast the consistency of the three identification results. Finally, batch food sample testing was carried out to explore the applicability of using MALDI-TOF MS to test ready-to-eat bulk foods. Results indicated that all the identification scores of the three bacteria were higher than 95% for the same batch and different passages, with a coefficient of variation of less than 2%. It demonstrated that the established method had good repeatability and stability, and the detection limit was 105 CFU/mL. The results of strain identification by MALDI-TOF MS were highly consistent with those of multiplex PCR and biochemical identification methods. Moreover, the MALDI-TOF MS method was more specific and efficient. Regarding spot sampling, the three covering methods showed higher average identification scores than the sandwich and mixed methods, all of which scored 99.9%. The 1 μL+1 μL covering method spot sampling approach obtained higher average peak numbers, and more complex and stronger characteristic peaks. Regarding pre-treatment, the formic-acid-acetonitrile method obtained a higher peak volume and peak intensity than other bacterial treatment methods, with an average identification score of 98% or higher. At the same time, the matching degree with the database spectrum was higher. In summary, MALDI-TOF MS method was not only sensitive, specific, accurate and rapid in foodborn pathogen identification, but also had simple operation and intuitive in results. As a powerful supplement to the national standard method, it provided a viable alternative for analysing, identifying and typing foodborne pathogens. -
散装即食食品是提供给消费者可以直接食用的非预包装食品(含预先包装但需要计量称重的散装即食食品),主要包括热处理散装即食食品、部分或未经热处理的散装即食食品和其他散装即食食品三大类[1]。近年来,随着外卖、社区团购的兴起,食品生产加工模式与销售方式发生改变的同时,人们的膳食行为与饮食习惯也在悄然改变。超市和菜场里随处可见的盒装预制菜等散装即食食品都已经过烹煮、烫热,无需再对其进行额外加工处理即可食用,既省去了繁琐的包装,售卖方便,食用也更加便捷,备受生产者与消费者的推崇[2]。但是与预包装食品不同的是,这类散装即食食品并没有经过严格的出厂检验,卫生安全条件难以保证,在制作和销售过程中,加工人员与食品的接触、器具的混用等因素很容易导致微生物的二次污染,更增加了食源性疾病的潜在风险[3−6]。通常,在一些散装熟肉制品和凉拌菜中较易检出沙门氏菌,感染后轻则呕吐腹泻,重则引起急性肠胃炎、败血症等疾病[7−9];另外散装豆制品、生鲜沙拉等也常被金黄色葡萄球菌污染,其产生的肠毒素不易被高温破坏,通过食物入侵人体后易引起急性肠胃炎[10−12];尤其像寿司、饭团、炒饭等散装米饭制品则是蜡样芽孢杆菌感染的重灾区,多在夏秋季高发,其所分泌的腹泻毒素或呕吐毒素污染食物而被人误食后,轻则呕吐腹泻,重则可导致死亡[13−15]。因此,建立散装即食食品中多种食源性致病菌的快速有效的检测方法极为重要。
基质辅助激光解吸电离飞行时间质谱(Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry,MALDI-TOF MS)技术是近几年发展起来的一种新型软电离质谱鉴定手段[16−18]。它的工作原理是将菌体蛋白打碎成一些特异性的碎片,通过质荷比的采集可获取致病菌特异性肽蛋白指纹图谱,将其与数据库中的标准图谱进行比对后,便可鉴定到属、种甚至亚种水平[19−22]。MALDI-TOF MS作为一种基于蛋白质检测的微生物快速鉴定手段发展迅速,它的主要优势在于:a.操作便捷,对操作人员要求不高,只需简单的几步操作便可实现对微生物的复杂鉴定;b.鉴定快速,点样靶板上机后通常只需数十分钟便可得到鉴定结果;c.准确高效,相较于传统生化鉴定法准确率更高[23−26]。近年来,随着MALDI-TOF MS技术的快速发展,国内外很多学者都针对各种食品基质中的食源性致病菌展开了适用性研究,如史方等[27]针对即食食品中大肠埃希氏菌O157:H7建立了致病菌快速检测管技术联合基质辅助激光解吸电离飞行时间质谱法,灵敏度可达51 CFU/mL;李滨洲等[28]将MALDI-TOF MS运用于生鲜猪肉检验过程中大肠杆菌与沙门氏菌的分离鉴定,共检出6种在HE和EMB培养基上与沙门氏菌/大肠杆菌菌落特征类似的肠杆菌科其他细菌;赵宏等[29]建立了免疫富集联合基质辅助激光解吸电离飞行时间质谱法检测牛奶、鸡蛋中沙门氏菌的方法,将浓度为3 CFU/mL的沙门氏菌特异性富集后选择性增菌9 h即可被MALDI-TOF MS准确鉴定;周千渝等[30]利用基质辅助激光解吸电离飞行时间质谱快速检测并鉴定从生鲜蔬菜中分离到的5种致病菌且灵敏度为106 CFU/mL。在我国,将MALDI-TOF MS技术运用于食品安全领域的研究虽尚处于初步探索阶段,但针对多种食源性致病菌的检测研究也已有不少,然而大多数均是针对预包装食品或是初级农产品,预包装食品感染致病菌的风险较低,生鲜猪肉等初级农产品并非即食食品,必须经过高温烹煮后食用,因此也不易感染致病菌,而对于潜伏在我们身边的那些并没有经过食品出厂检验、卫生安全条件难以保证且食源性潜在风险极大的散装即食食品却鲜有研究。
针对常见食源性致病菌的检测,传统的国标法涉及到前增菌、选择性增菌、生化试验和血清分型鉴定等多个步骤,通常需要4~6 d,检测周期冗长且操作复杂繁琐,已无法满足日常检测和暴发检测的需求[31−33]。近年来,散装即食食品的大量涌现、食源性疾病的日益多发和人们食品安全意识的不断增强,都对致病菌检测方法的快速、灵敏、特异等方面提出了更高的要求。2022年3月7日,GB 31607-2021《食品安全国家标准 散装即食食品中致病菌限量》正式实施,本文及时地将基质辅助激光解吸电离飞行时间质谱技术应用于散装即食食品的快速检测研究中,以沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌为模式菌,通过对点样方式、前处理方式、不同培养基及培养时间等各项实验条件的优化筛选确定最佳方法,并考察其检测限和稳定性,最后进行批量食品样本检测来探寻MALDI-TOF MS技术在散装即食食品中的适用性,以期为食源性致病菌的快速筛查与食品质量安全的有效保障提供新思路。
1. 材料与方法
1.1 材料与仪器
缓冲蛋白胨水(BPW)、亚希酸盐胱氨酸增菌液(SC)、四硫磺酸钠煌绿增菌液(TTB)基础、亚硫酸铋琼脂(BS)、木糖赖氨酸脱氧胆盐(XLD)琼脂、Baird-Parker培养基基础、BHI肉汤、营养琼脂(NA)、平板计数琼脂(PCA)、胰蛋白胨大豆琼脂(TSA)、胰酪胨大豆多黏菌素肉汤基础、甘露醇卵黄多黏菌素琼脂基础(MYP) 北京陆桥技术股份有限公司;哥伦比亚血琼脂 法国科玛嘉公司;三氟乙酸(TFA)、无水乙醇、甲酸、乙腈、α-氰基-4-羟基肉桂酸(CHCA) 美国Sigma公司;Ezup柱式细菌基因组DNA抽提试剂盒、琼脂糖、4S GelRed核酸染料 生工生物工程(上海)股份有限公司;Multiplex PCR Assay Kit试剂盒、DL1000 DNA Marker(100~1000 bp)、6×Loading Buffer 宝生物工程(大连)有限公司;标准菌株 保藏于舟山市食品药品检验检测研究院内,详见表1。
表 1 实验菌株信息Table 1. Strains for experiment编号 名称 来源 ATCC8739 大肠埃希氏菌 中国药品生物制品检定所 CMCC50041 肠炎沙门氏菌 中国药品生物制品检定所 ATCC11778 蜡样芽孢杆菌 美国菌种保藏中心 ATCC26112 金黄色葡萄球菌 中国药品生物制品检定所 R160747 金黄色葡萄球菌 2016年3月餐饮中毒样品R160747中分离 W152001 金黄色葡萄球菌 2015年10月食品样本中分离 W170130 金黄色葡萄球菌 2017年2月食物中毒样品W170130中分离 R140715 金黄色葡萄球菌 2014年12月食品样本中分离 B089 金黄色葡萄球菌 2014年省局能力验证样品B089中分离 VITEK MS全自动快速微生物质谱系统、VITEK 2 ComPact全自动微生物鉴定及药敏分析系统 法国生物梅里埃公司;NanoDrop one核酸蛋白分析仪、Legend Micro17型高速台式离心机 美国Thermo Fisher Scientific公司;My Cycler型PCR扩增仪、Mini-PROTEAN Tetra型垂直电泳仪、Gel Doc XR型凝胶成像系统 美国BIO-RAD公司。
1.2 实验方法
1.2.1 菌株培养与纯化
将表1中所列菌株均接种于BHI肉汤中增殖培养,其中沙门氏菌和金黄色葡萄球菌于36 ℃培养18 h,蜡样芽孢杆菌则于30 ℃培养48 h,再划线接种于NA琼脂平板,36 ℃培养24 h[34−36],平板上纯化菌落用于后续MALDI-TOF MS和生化鉴定。
1.2.2 MALDI-TOF MS检测
1.2.2.1 点样方式的优化
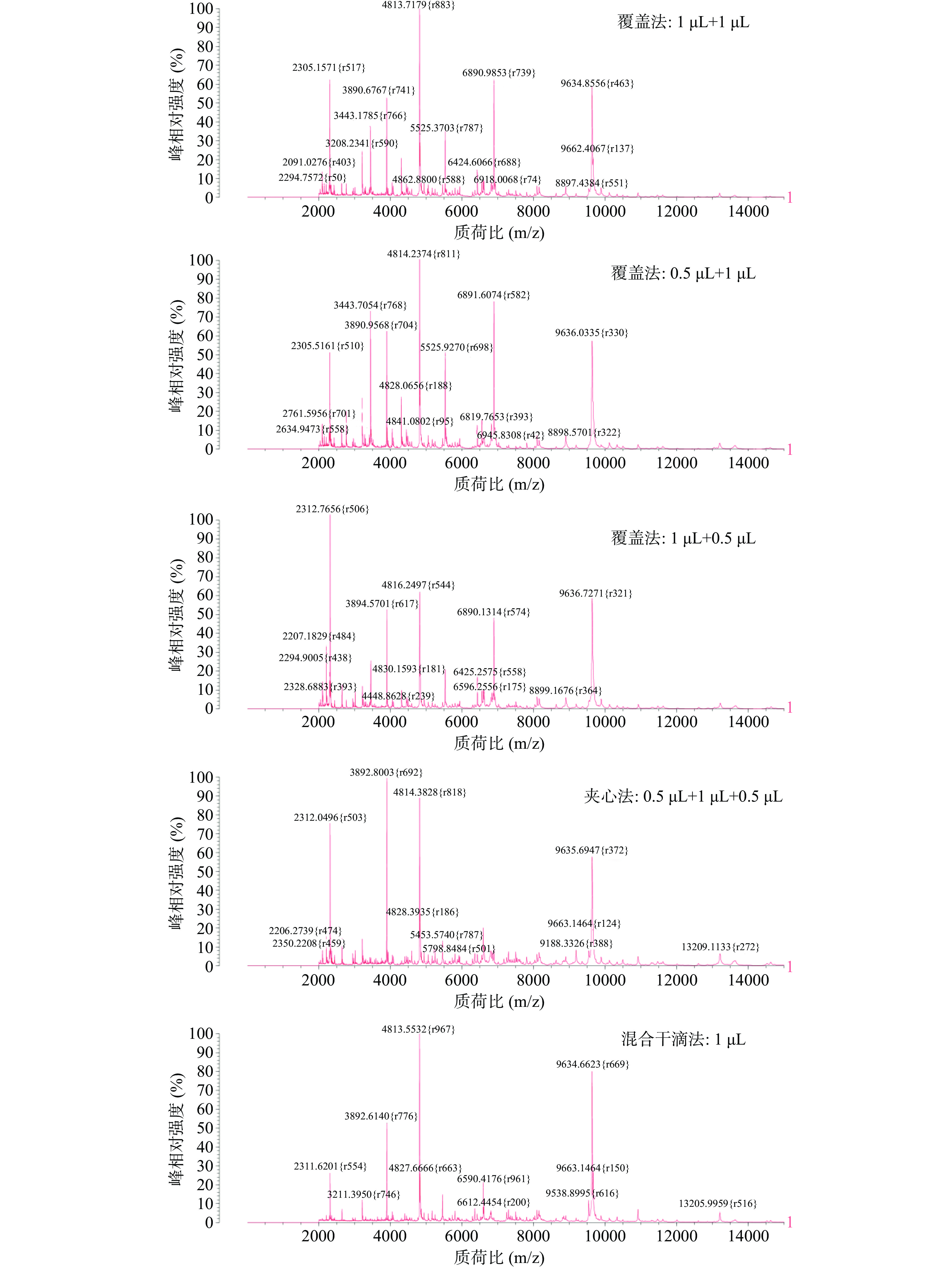
是否能获得重复性好且稳定的微生物特征性质谱图,取决于微生物样品与基质液是否形成共结晶,共结晶越均匀则重复性越好[29],因此点样方式的优化也十分关键。以金黄色葡萄球菌为模式菌考察以下不同点样方式及点样比例对质谱结果的影响。每种点样方法及比例重复点样4次,分析鉴定结果的一致性。
a.覆盖法:移取经最优方法前处理后的上清液至靶板,待自然干燥后覆盖CHCA基质液,室温干燥后上机检测,上清液及基质液的点样量分别为1 µL+1 µL、0.5 µL+1 µL、1 µL+0.5 µL。
b.夹心法:先取0.5 µL基质液点样,室温干燥后覆以1 µL样液,自然晾干后再覆盖0.5 µL基质液。
c.混合干滴法:在点样前先将样液与基质液等比例混合,再取1 µL混合液进行点样,待自然干燥后上机检测。
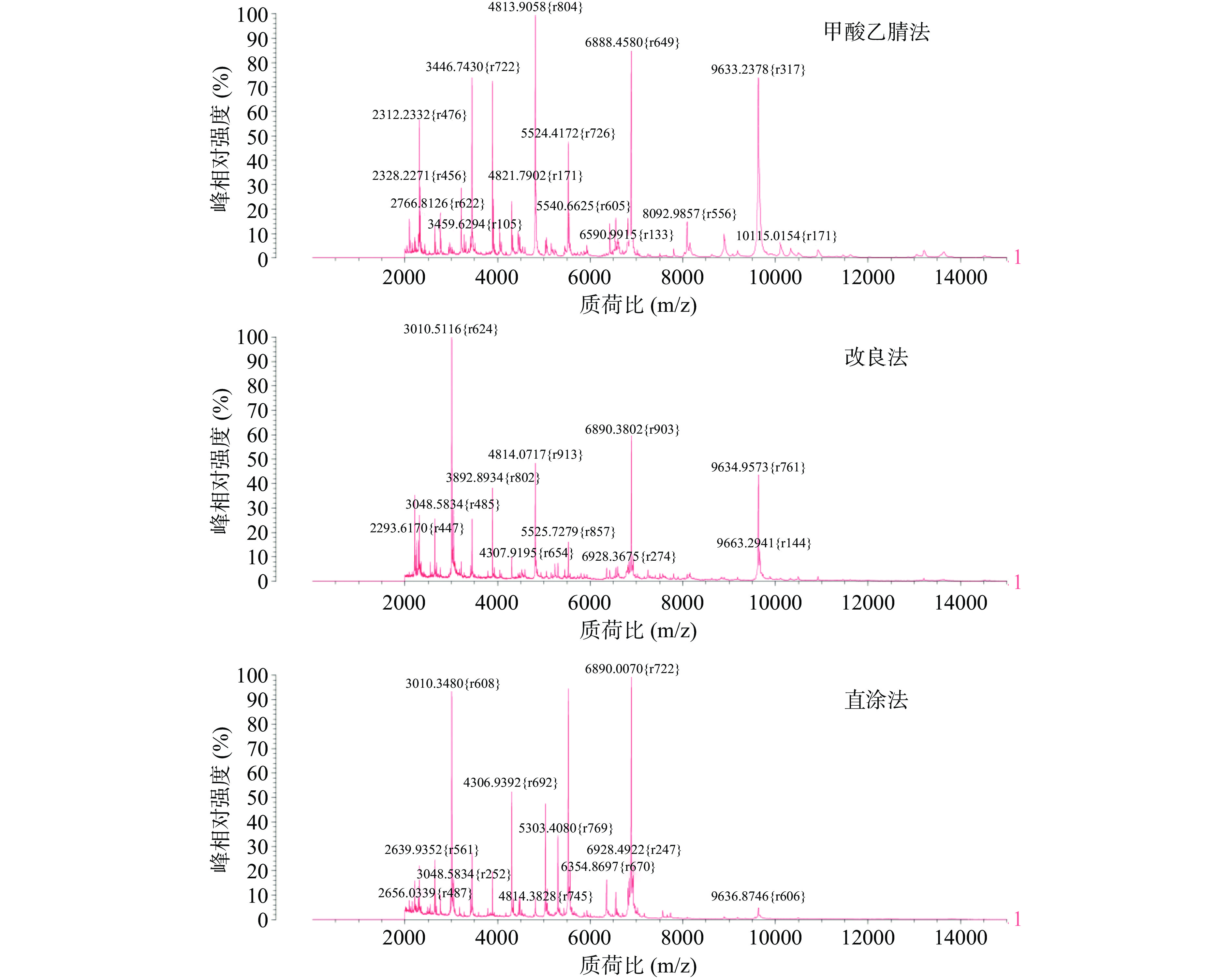
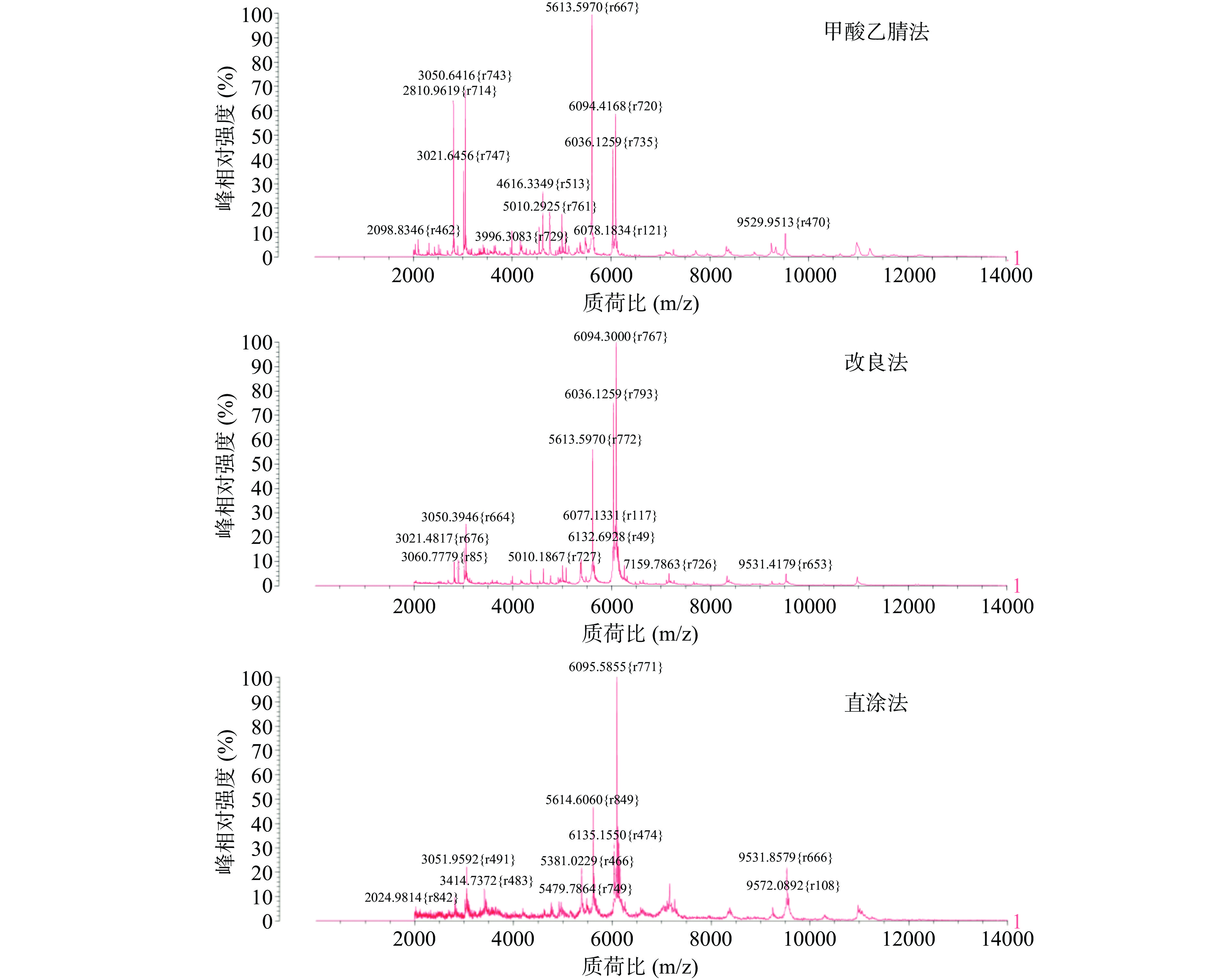
1.2.2.2 不同前处理方式的选择
样品前处理效果的优劣直接影响质谱图谱的采集质量,进而会对后续菌种鉴定的结果带来直接影响,不同的前处理方法对不同致病菌蛋白质的提取及纯化效果存在差异[37−38]。通过参考诸多文献[39−43],针对沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌三种致病菌,本实验分别采用最具代表性的三种前处理方式,分别是直涂法、改良法和甲酸乙腈法来对菌体进行破壁前处理,每种处理方式重复点样4次,考察不同前处理方式对鉴定结果的影响。
a.直涂法:用接种环从营养琼脂平板上挑取单菌落均匀涂抹在靶板孔位中,并覆盖1 µL基质液,待自然干燥后上机检测。
b.改良法:同直涂法取单菌落均匀涂板后,滴加1 µL的70%甲酸,待室温晾干后覆以1 µL基质液,再次晾干后上机检测。
c.甲酸乙腈法:从营养琼脂平板上挑取5~10 mg单菌落样本,在300 µL灭菌超纯水中涡旋混匀1 min;再加入900 µL无水乙醇,混匀后12000 r/min离心2 min弃上清,重复一次直至完全除去乙醇溶液;加入50 µL 70%的甲酸溶液破壁10 min;再加入50 µL乙腈吹打混匀,12000 r/min离心2 min后吸出上清;取1 µL上清液至靶板晾干,并加1 µL基质液涂覆,室温干燥后上机检测。
1.2.2.3 不同培养基及培养时间的优化
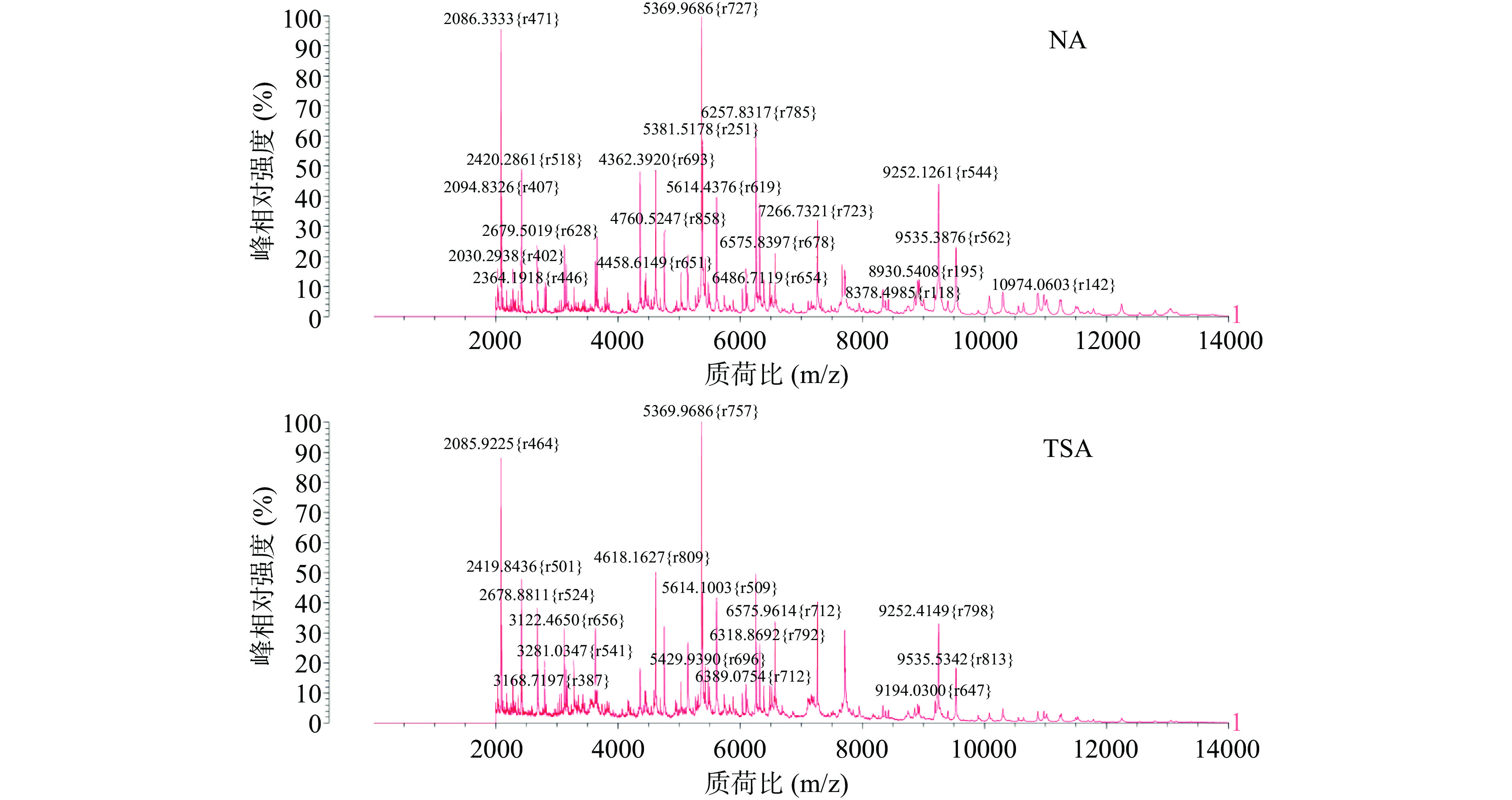
以革兰氏阴性菌沙门氏菌CMCC50041和革兰氏阳性菌金黄色葡萄球菌ATCC26112标准菌株为模式菌,考察不同培养基及培养时间对质谱鉴定结果的影响。将沙门氏菌分别接种于TSA、NA、BS、XLD、HE五种培养基,36 ℃培养24 h,金黄色葡萄球菌则接种于PCA、NA、TSA三种非选择性培养基上,分别在36 ℃培养24、48、72 h后,以最优前处理方式提取蛋白后采用最佳点样方式进行点样,并上机检测。每个处理平行点样8次,考察鉴定结果的一致性。
1.2.2.4 检测限试验
将过夜培养的沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌的纯菌液分别用超纯水10倍递增稀释至10−8浓度,同时倾注营养琼脂进行菌落计数,每个稀释度的菌液各取1 mL,12000 r/min离心2 min后弃上清,采用最优前处理方式沉淀菌体并点样分析,每个稀释度重复处理三次,通过分析各个致病菌不同稀释度的鉴定结果以测试其检测限。
1.2.2.5 稳定性试验
将沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌分别在36 ℃培养24 h条件下进行传代三次,每次传代后各自挑取三个菌落平行样上机检测,通过对比三种目标菌同一批次及不同批次的鉴定结果,以评价MALDI-TOF MS检测的稳定性。
1.2.2.6 不同来源的金黄色葡萄球菌的鉴定分析
不同来源的致病菌可能存在一定地域及宿主差异,在其蛋白组成和表现形式上也可能截然不同,本实验以金黄色葡萄球菌为模式菌,通过从餐饮中毒样本、食品检测样本、能力验证样本中分离出的五株金黄色葡萄球菌以及一株标准菌株进行MALDI-TOF MS鉴定,分析对比图谱峰型,比较不同来源的金黄色葡萄球菌在蛋白表现上的差异以及MALDI-TOF MS鉴定的准确度及可靠性。
1.2.3 多重PCR检测比对
1.2.3.1 模板DNA提取
取1 mL过夜培养的菌液加入1.5 mL离心管中,12000 r/min离心5 min,弃上清;加入1 mL PBS缓冲液,12000 r/min离心5 min后,弃上清;再加入150 µL双蒸水,振荡混匀;100 ℃煮沸10 min后12000 r/min离心10 min,并将上清液转移至新的离心管中,−20 ℃保存备用。
1.2.3.2 多重PCR扩增
将沙门氏菌、金黄色葡萄球菌、蜡样芽孢杆菌的DNA模板等体积混合后进行多重PCR反应,反应体系与反应程序分别见表2和表3。
表 2 多重PCR反应体系(50 µL)Table 2. Multiplex PCR reaction system (50 µL)体系组分 体系用量(µL) 2×Mix 25 各上游引物(10 µmol/L) 2 各下游引物(10 µmol/L) 2 混合DNA模板 6 ddH2O 7 表 3 单重PCR反应程序Table 3. Single PCR reaction procedure反应温度(℃) 反应时间 循环次数 94 10 min 1 94 30 s 30 58 30 s 72 45 s 72 10 min 1 4 ∞ 1 1.2.3.3 多重PCR产物电泳检测
将沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌三种致病菌随机进行两两组合,采用优化过的多重PCR反应体系进行PCR扩增,并对扩增产物进行电泳,用凝胶成像仪分析电泳结果。
1.2.4 生化鉴定比对
1.2.4.1 国标法生化鉴定
挑取1.2.1中纯培养的金黄色葡萄球菌单菌落接种至5 mL BHI,36 ℃培养24 h后进行血浆凝固酶试验,每瓶冻干血浆中加入0.5 mL无菌生理盐水至完全溶解后,加入0.3 mL BHI培养物,振荡摇匀,置于36 ℃培养,每半小时观察一次,观察6 h;挑取1.2.1中纯培养的蜡样芽孢杆菌单菌落进行过氧化氢酶试验、动力试验、硝酸盐还原试验、酪蛋白分解试验、溶菌酶耐性试验、V-P试验等生化试验,并观察结果。
1.2.4.2 VITEK 2生化鉴定
挑取1.2.1中纯培养的沙门氏菌单菌落制成0.5麦氏浊度的菌悬液,用GN鉴定卡片进行上机检测。
1.2.5 食品样品的致病菌检测
在本地不同超市、门市店和农贸市场随机购买散装即食食品样本100份,每份样品均无菌采样500 g,2 h内带回实验室检测,其中酱卤肉30份,豆制品15份,米饭制品20份,凉拌菜20份,生鲜沙拉15份,分别无菌取样25 g并添加225 mL增菌液,充分均质混匀后,沙门氏菌和金黄色葡萄球菌放入36 ℃培养箱增菌18 h,蜡样芽孢杆菌则于30 ℃培养48 h。
按照GB 4789.4-2016《食品微生物学检验 沙门氏菌检验》、GB 4789.10-2016《食品微生物学检验 金黄色葡萄球菌检验》、GB 4789.14-2014《食品微生物学检验 蜡样芽孢杆菌检验》对样品中沙门氏菌、金黄色葡萄球菌、蜡样芽孢杆菌进行分离培养,当各自的选择性培养基上出现可疑菌落时,对目标菌进行纯化分离后利用MALDI-TOF MS法上机检测。
1.3 数据处理
为确保检测结果的可靠性,每次试验前需选取标准菌株大肠埃希氏菌ATCC8739作为质控菌株进行校准,并设置仪器参数为:线性正离子模式,收集质荷比范围(m/z):2000~20000 u,激光频率48 Hz,每孔采样率100次,加速电压20.00 kV。在检测器中放入已点样靶板,打开LaunchPad软件,选择RuO Mode进行待测样本的质谱分析,将采集的样本质谱图导入到SARAMIS数据库中,根据每个特征峰的离子质量及相对强度与标准数据库中的超级图谱和参考图谱进行比对分析,软件根据不同特征峰所分配权重的不同进行计算并给出相应的鉴定分值,可信度结果以百分数表示,并根据可信度不同标识为不同颜色,具体鉴定结果判定见表4。
表 4 鉴定结果判读Table 4. Interpretation of identification results可信度 分值 颜色 意义 99.9% ≥1000 深绿色 鉴定结果可信 90~99.8% 900~999 浅绿色 鉴定结果可信度较高 80~89.9% 800~899 黄色 可能的菌属或菌种鉴定 75~79% 750~799 白色 可能的菌属鉴定 75%以下 <750 白色 无匹配结果 75~99.9% >750 红色 有杂菌污染或鉴定结果可信度较低 2. 结果与分析
2.1 MALDI-TOF MS检测
2.1.1 最佳点样方式的选择
以不同点样方式及比例进行点样的金黄色葡萄球菌所得图谱见图1。其中三种覆盖法点样平均鉴定得分均为99.9%,夹心法与混合干滴法平均鉴定得分均小于95%,平均峰数目分别为303、321,虽峰数较多,但多为杂峰,且基线噪音较大、峰强度较低,而三种覆盖法点样所获得的平均峰数目分别为312、301、264,基线平滑,信噪比较高,当样液与基质液以1 µL+1 µL点样时,峰数目更多,特征峰更复杂且强度更高,因此后续试验最终选择覆盖法1 µL+1 µL进行点样。
2.1.2 不同前处理方式对鉴定结果的影响
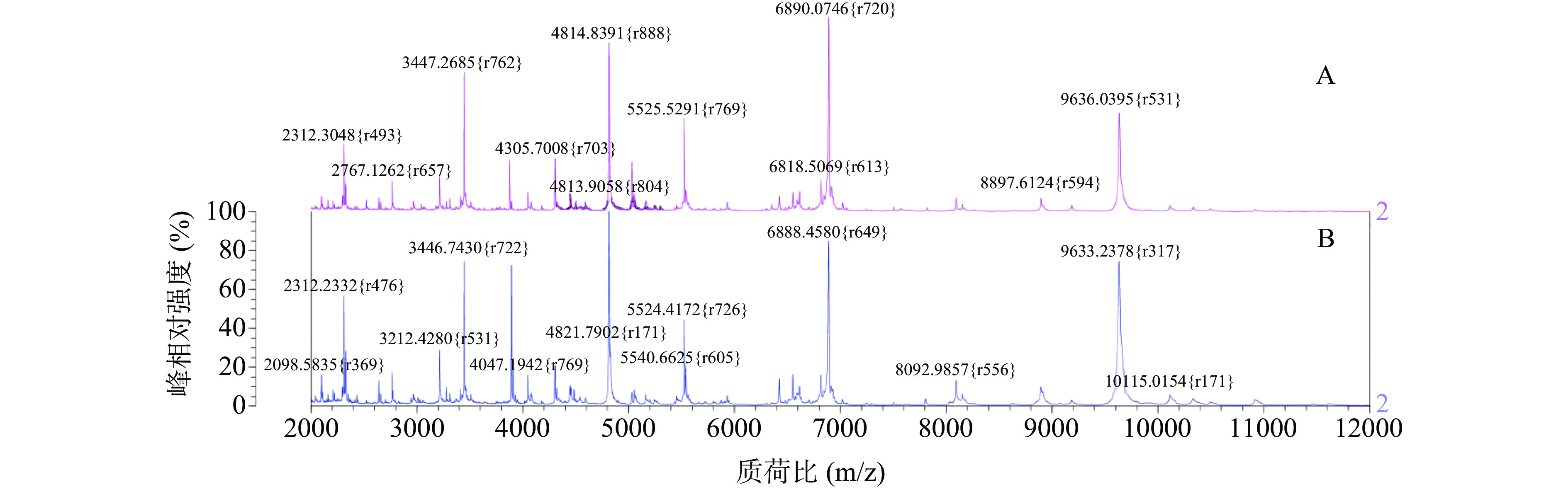
经甲酸乙腈法处理过的沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌的平均鉴定得分均在98%以上,经改良法处理过的三种致病菌的平均鉴定得分分别为92.1%、98.3%、89.3%,而使用直涂法直接上机鉴定的三种致病菌的平均得分分别为84%、98%、87.3%。
虽都得到较准确鉴定,但是由图2可知,同一种致病菌的三种处理方式下的各峰强度仍稍有差异,金黄色葡萄球菌经甲酸乙腈处理后整体出峰点更多,离子峰更密集,峰强度更高,在质荷比约为4813、6888、9633、3446 m/z处显现多个高强度特征峰。
由图3可知,沙门氏菌经改良法和直涂法处理后特征峰数量相较于甲酸乙腈法有所减少,特别是在质荷比约3050、3021 m/z处峰强度极低,出峰不理想,特别是直涂法,不仅背景噪音大,而且出现多峰合并和杂峰干扰的情况,而甲酸乙腈法的图谱中图形更加复杂,离子峰也更加密集陡峭。
而在图4中,三种不同前处理方式的区别在蜡样芽孢杆菌的图谱中可以观察得更直观,改良法与直涂法由于菌体处理不干净导致背景噪音大、曲线漂浮严重、基线稳定性差,虽然看似出峰较多,但是多为杂峰,且出现多峰合并现象,峰型很不理想,而甲酸乙腈法则背景干净、基线十分平滑,平均峰数目为304,在质荷比5395 m/z处出现最强离子峰,不仅质谱峰数量多、图形光滑,且出峰点清晰、峰型平稳、没有杂峰干扰和多峰合并现象。
由试验结果可知,甲酸提取法相较于其他两种方法可获得更多的峰数量和更高的峰强度,不仅信噪比高,且与数据库中的图谱匹配度更高,因此后续试验决定使用准确性和置信度更高的甲酸乙腈法对菌体进行前处理。
2.1.3 不同培养基及培养时间对鉴定结果的影响
由表5和图5可知,沙门氏菌在NA和TSA这两种非选择性培养基上可得到大于99%的平均鉴定得分,且变异系数均小于1%,出峰量多且峰型陡峭,最强离子峰相似,均在质荷比约5369、2086、6257 m/z等处出现多个高强度特征峰;而在BS、XLD、HE这三种选择性培养基上虽也得到准确鉴定,但是平均得分相较于前者较低且变异系数更高。尤其是BS和HE培养基,多数离子峰出峰保守,峰型较缓,且出现杂峰干扰现象。总体而言,非选择性培养基可为目标菌的复壮提供更全面的营养,因而相较于选择性培养基可获得置信度更高的鉴定得分。
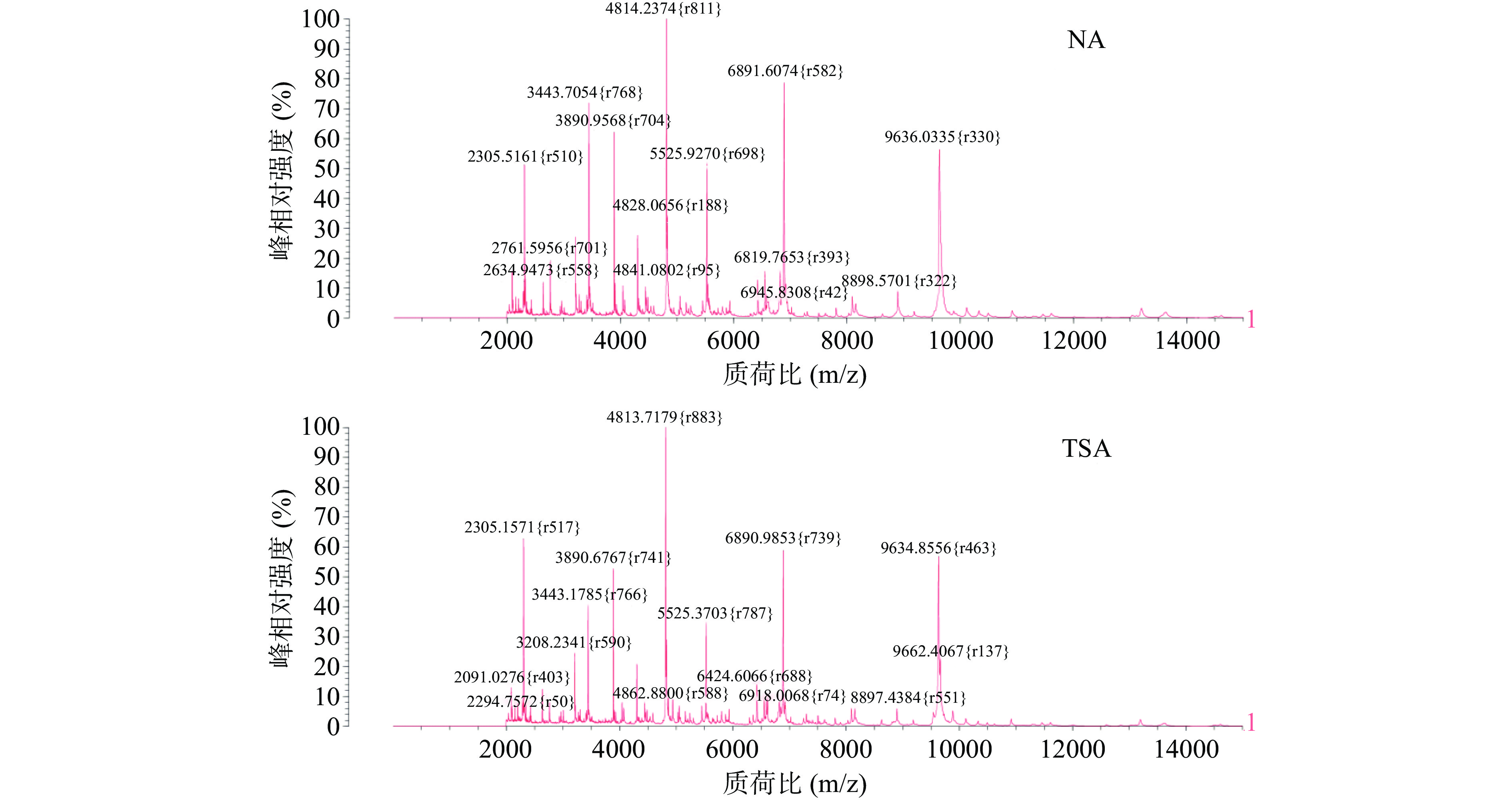
表 5 沙门氏菌经不同培养基培养后的鉴定得分(%)Table 5. Identification scores of Salmonella on different media (%)点样次数 培养基 TSA NA BS XLD HE 1 99.8 99.9 93.5 97.7 92.1 2 97.5 99.9 95.9 98.2 91.8 3 98.3 99.8 95.0 96.3 91.5 4 99.0 99.0 98.1 98.8 94.0 5 98.7 99.9 97.6 98.4 87.9 6 99.9 98.1 92.9 97.0 92.7 7 99.2 98.0 96.8 97.7 89.3 8 99.7 99.2 96.0 96.2 93.6 平均得分(%) 99.01 99.23 95.73 97.54 91.61 CV(%) 0.84 0.81 1.93 0.98 2.27 由表6和图6可知,将金黄色葡萄球菌接种于NA和TSA培养基并于36 ℃培养24 h后,均可得到完美鉴定,平均得分均为99.9%,两者特征峰出峰量相似,峰型陡峭且最强离子峰位置并无明显差异,约在质荷比2305、4814、6890、9634 m/z显现多个高强度特征峰,而用PCA并以相同时间培养的目标菌质谱图上平均峰数目有所减少,峰型平缓且峰强度普遍较低,可见相比于PCA,使用NA和TSA培养基可获得置信度更高的鉴定结果。
表 6 金黄色葡萄球菌经不同培养条件培养后的鉴定得分(%)Table 6. Identification scores of Staphylococcus aureus in different cultivation conditions (%)点样次数 培养基 PCA NA TSA 24 h 48 h 72 h 24 h 48 h 72 h 24 h 48 h 72 h 1 98.2 96.0 82.5 99.9 98.5 93.1 99.9 97.5 87.2 2 95.7 92.1 76.2 99.9 99.9 98.2 99.9 99.0 94.1 3 99.9 99.7 95.8 99.9 99.9 95.8 99.9 99.9 90.3 4 98.0 94.5 81.9 99.9 99.9 91.0 99.9 99.9 91.5 5 93.6 91.0 78.0 99.9 98.9 86.5 99.9 96.9 83.3 6 99.9 99.9 95.1 99.9 99.9 92.7 99.9 98.0 87.9 7 97.1 95.2 80.0 99.9 98.1 84.0 99.9 95.2 77.8 8 98.4 98.0 83.7 99.9 99.9 92.3 99.9 99.9 93.0 平均得分(%) 97.6 95.8 84.15 99.9 99.38 91.7 99.9 98.29 88.14 CV(%) 2.18 3.43 8.78 0 0.76 5.03 0 1.74 6.16 随着培养时间的延长,质谱图的匹配性逐渐降低,目标菌在培养48 h和72 h后,不论是哪一种培养基,平均得分均有所下滑,特别是PCA在72 h后平均得分降至84.15%,变异系数达到了8.78%,不仅基线噪音大、出现多峰合并,且在若干个离子峰处出现峰型偏移,整体峰型不理想。
过长的培养时间可使细菌进入稳定期和衰亡期,稳定期时的菌体会产生大量的代谢产物,而衰亡期时菌体则易发生自溶现象,细菌合成的蛋白很可能与对数期合成的蛋白不同,导致部分特征峰的缺失[44],因而当菌株培养时间过长时,图谱的匹配率降低,鉴定结果的准确性也随之下降,经分析,选择NA培养基培养24 h作为后续试验菌株的培养条件。
2.1.4 检测限试验结果
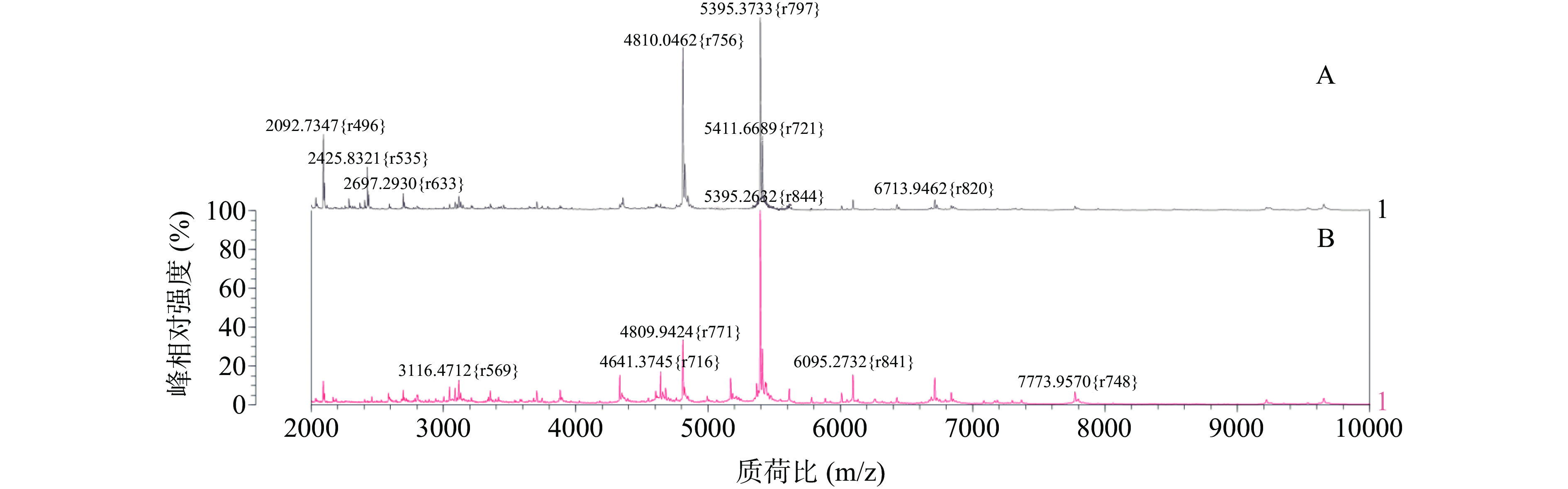
根据平板计数的结果,再乘以稀释倍数可算出沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌初始菌液浓度分别为4×108、2×108、3×107 CFU/mL,由表7试验结果可知,当沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌菌液浓度分别处于4×108~4×105、2×108~2×105、3×107~3×105 CFU/mL时,鉴定结果较准确,而当菌液浓度降至105 CFU/mL以下时,无法得到鉴定结果,虽然通过观察图7和图8可知,当目标菌在104~102 CFU/mL菌浓度时,依然有多个出峰点,如沙门氏菌在质荷比约2093、2426 m/z等处出现离子峰,而蜡样芽孢杆菌在菌液浓度稀释至106 CFU/mL时最强离子峰5395 m/z消失,而降至低浓度102 CFU/mL时仍在质荷比约2092、2425 m/z等处峰型显现,分析原因可能有两种,一是确实仍有少量菌体蛋白检出,二是在前处理步骤挑取菌落时,可能刮取到些许培养基,而培养基中多含有蛋白质或多糖等其他物质,因此可能会显现少量离子峰,但是总体蛋白量太少无法准确匹配数据库,置信度极低,因此确定三种目标菌的检测限分别为4×105、2×105、3×105 CFU/mL。
表 7 检测限试验结果Table 7. Results of the detection limit沙门氏菌浓度
(CFU/mL)鉴定得分
(%)金黄色葡萄球菌浓度
(CFU/mL)鉴定得分
(%)蜡样芽孢杆菌浓度
(CFU/mL)鉴定得分
(%)108 99.9 108 99.9 107 98.2 107 97.4 107 96.9 106 85.5 106 84.1 106 87.3 105 72.1 105 78.0 105 76.6 104 0 104 0 104 0 103 0 2.1.5 稳定性试验结果
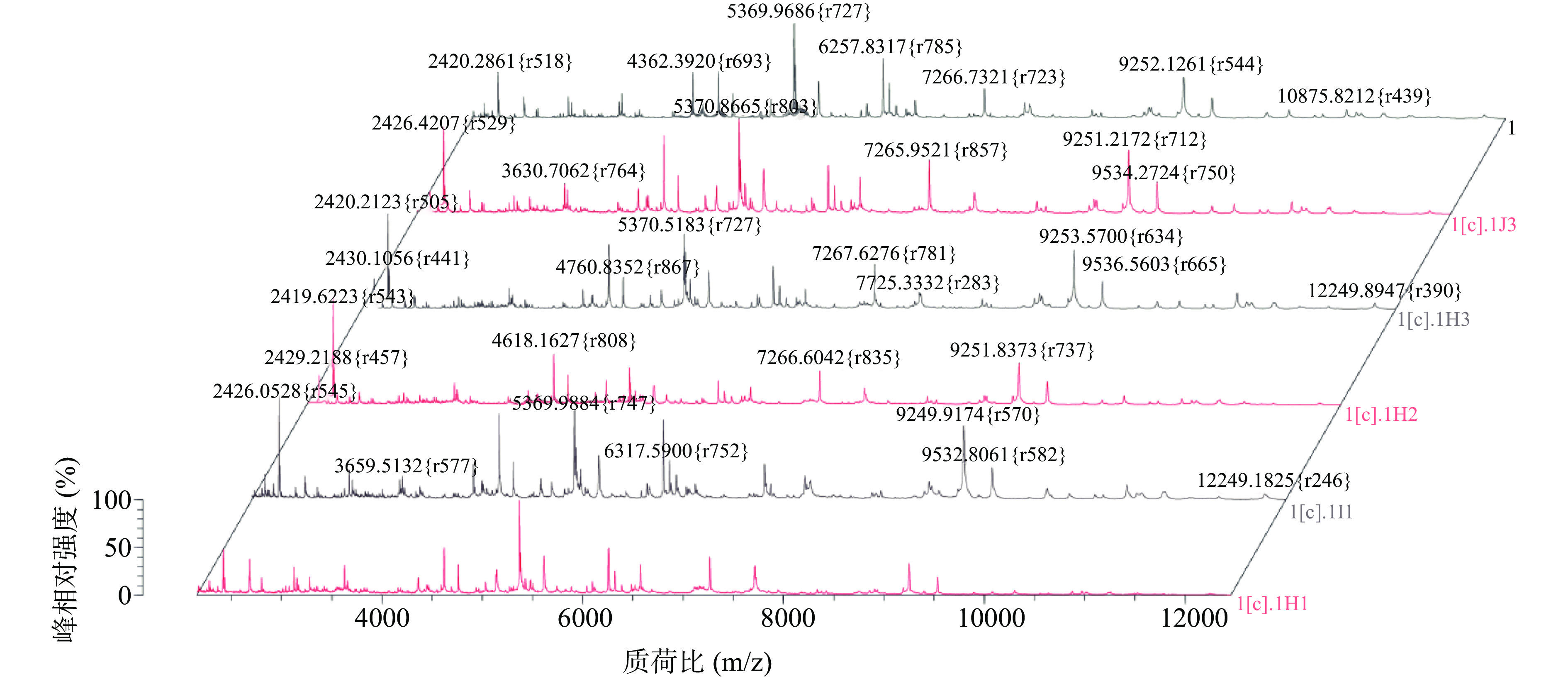
由表8试验结果可知,同一批次的三个菌落平行样之间鉴定结果异常接近,且不同传代次数的鉴定结果也高度一致,得分均大于95%,变异系数均小于2%,尤其是金黄色葡萄球菌,不论是同一批次或是不同批次鉴定得分完全一致,均为99.9%,且图谱之间相似度极高。因篇幅所限,以沙门氏菌为例,图9只列出了同一批次沙门氏菌的不同传代次数的六张质谱图,由图谱可见,六者出峰量相似,均在质荷比2420、5369、7266、9251 m/z处离子峰强度增强,其余质荷比处线型平滑,无杂峰干扰,与数据库图谱匹配性较高,可见该方法具有良好的重复性和稳定性。
表 8 稳定性试验结果Table 8. Results of the detection stability平行样 不同传代次数的鉴定得分(%) 沙门氏菌 金黄色葡萄球菌 蜡样芽孢杆菌 1 2 3 1 2 3 1 2 3 1 99.9 99.9 98.4 99.9 99.9 99.9 98.2 95.5 97.8 2 99.9 97.1 99.0 99.9 99.9 99.9 98.0 96.2 95.0 3 99.2 98.7 98.9 99.9 99.9 99.9 99.9 96.9 97.4 平均得分(%) 99.67 98.57 98.77 99.9 99.9 99.9 98.7 96.2 96.73 CV(%) 0.41 1.43 0.33 0 0 0 1.06 0.73 1.57 2.1.6 对不同来源的金黄色葡萄球菌的鉴定与分析结果
按照最佳前处理方式对六株不同来源的金黄色葡萄球菌进行MALDI-TOF MS检测,获得六株菌株的质谱鉴定结果和不同蛋白指纹图谱,详见图10。
除了W170130鉴定得分为86%外,其余鉴定得分均为99.9%,通过分析对比不同离子峰型及原始数据,得出六株目标菌主要的离子峰集中在质荷比2312、3446、4813、6888、9633 m/z附近,可能是金黄色葡萄球菌的特异性生物标志峰。其中B089和W152001整体峰型与ATCC26112较相似,出峰点清晰,峰型陡峭且密集,均在4814、6889 m/z处出现两波最强离子峰,而R160747和W170130则峰型保守,峰数目较少且峰强度偏低,尤其是W170130整体峰型偏缓,各个离子峰之间强度差异不显著,或许是某些蛋白未完全溶出导致特征峰缺失而影响最终鉴定得分较低,而在R140715中虽然多个高强度特征峰与ATCC26112相似,出峰点清晰且丰度较高,但是在质荷比4814、6890、9636 m/z等处出现多个特征峰的明显左移。
2.2 多重PCR比对结果
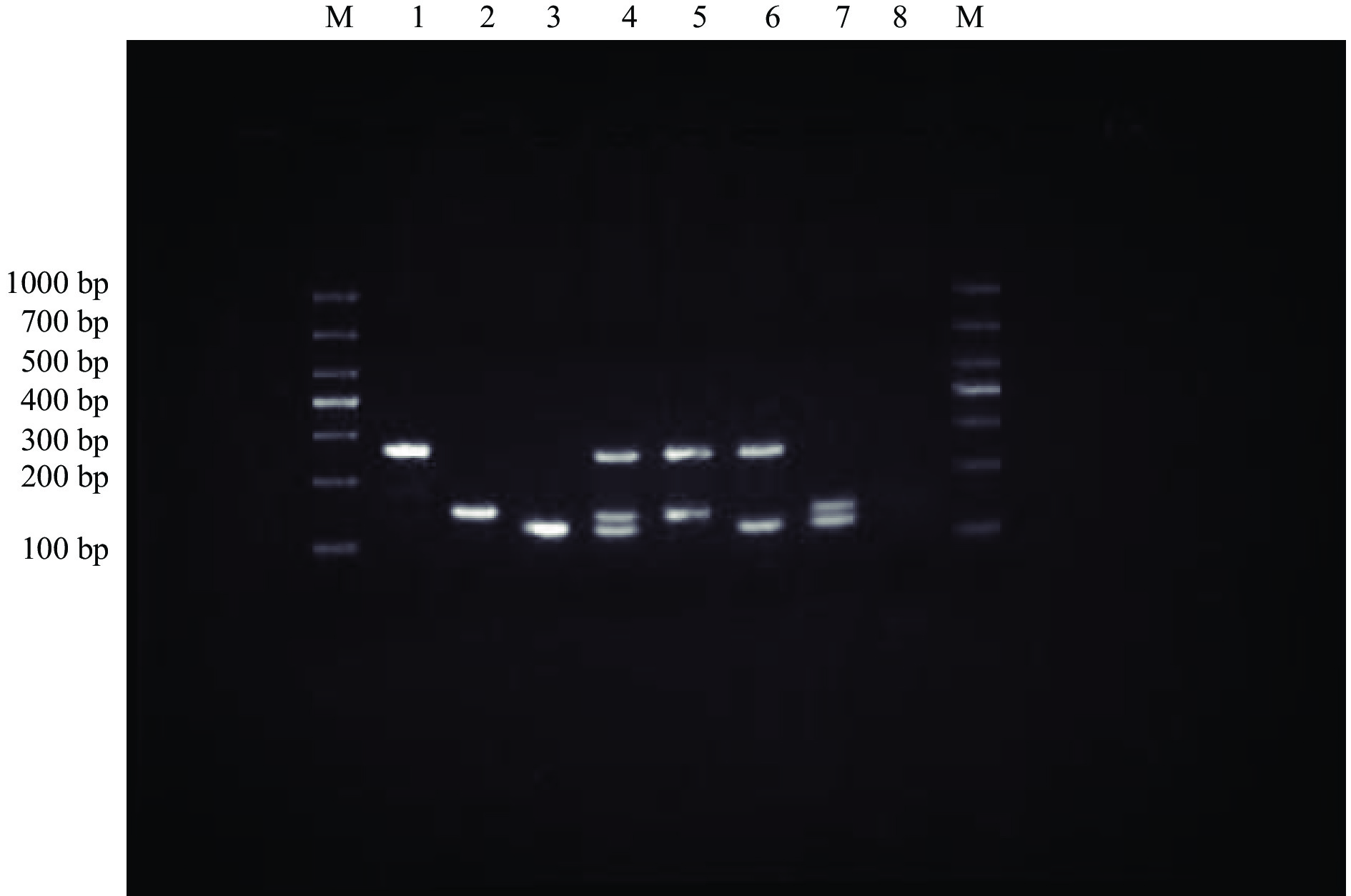
将三种致病菌随机两两组合,采用优化过的多重PCR反应体系进行PCR扩增,由图11可知,多重PCR反应均能特异性地扩增出目的片段,扩增片段大小分别为沙门氏菌273 bp、金黄色葡萄球菌164 bp、蜡样芽孢杆菌139 bp,扩增产物与预期片段大小一致,表明多重PCR法可用于同时检测沙门氏菌、金黄色葡萄球菌、蜡样芽孢杆菌三种致病菌中的一种或几种。
2.3 生化鉴定比对
2.3.1 国标法生化鉴定结果
金黄色葡萄球菌试验株血浆凝固酶0.5 h后呈现凝固,即判定为阳性;蜡样芽孢杆菌试验株过氧化氢酶、硝酸盐还原、酪蛋白分解、溶菌酶耐性、卵黄反应、V-P试验均为阳性,有动力,在TSSB平板上为不透明、似白色毛玻璃状,有草绿色溶血环的浅灰色菌落,而在NA平板上呈粗糙山谷状生长形态。
2.3.2 VITEK 2生化鉴定结果
GN鉴定卡可对革兰氏阴性菌的64项生化指标进行鉴定,沙门氏菌试验株鉴定结果为98%概率为Salmonella group,主要生化试验结果见表9。
表 9 沙门氏菌生化试验Table 9. Biochemical test for Salmonella生化试验详情 2 APPA − 3 ADO − 4 PyrA − 5 IARL − 7 dCEL − 9 BGAL − 10 H2S + 11 BNAG − 12 AGLTp − 13 dGLU + 14 GGT − 15 OFF + 17 BGLU − 18 dMAL + 19 dMAN + 20 dMNE + 21 BXYL − 22 BAlap − 23 ProA − 26 LIP − 27 PLE − 29 TyrA + 31 URE − 32 dSOR + 33 SAC − 34 dTAG − 35 dTRE + 36 CIT + 37 MNT − 39 5KG + 40 ILATk + 41 AGLU − 42 SUCT + 43 NAGA − 44 AGAL + 45 PHOS + 46 GlyA − 47 ODC + 48 LDC + 53 IHISa − 56 CMT + 57 BGUR − 58 O129R + 59 GGAA − 61 IMLTa − 62 ELLM − 64 ILATa − 2.4 食品样本的检测结果
从100份散装即食食品样本中共分离得到24株目标菌,其中沙门氏菌4株,金黄色葡萄球菌14株,蜡样芽孢杆菌6株,在五大类食品样本中,酱卤肉等食品均存在至少被一种致病菌污染的情况,沙门氏菌检出率最低,主要存在于凉拌菜和酱卤肉制品中,熟肉制品由于营养丰富,更适合沙门氏菌的生长繁殖;金黄色葡萄球菌检出率最高,凉拌菜、寿司、生鲜沙拉等食品样本均受到金黄色葡萄球菌不同程度的污染,其中在寿司食品样本中污染量最高,为1600 CFU/g,超出GB 31607《散装即食食品中致病菌限量》规定的限量值(≤1000 CFU/g)。据文献报道[45],当食品中该菌的含量低于103 CFU/g时一般不产生肠毒素,而当其含量高于103 CFU/g时,因其菌体大量生长繁殖,会产生肠毒素,100 ℃加热30 min不被破坏。成人仅食用100 ng肠毒素即可引起食物中毒,建议尽量少食凉拌菜、寿司、生鲜沙拉等生食、半生食食品。
蜡样芽孢杆菌主要于寿司等米面制品中检出,因散装米面制品在售卖时常常暴露于空气中,人员密集加上环境湿润,成了蜡样芽孢杆菌污染的重灾区,本次检测结果显示共有6份寿司样本检出蜡样芽孢杆菌,其中最高污染量为280 CFU/g,虽未达到国标中规定的最大限量10000 CFU/g[1],但是也有可能带来食物中毒的风险,出现呕吐、腹泻等症状[6,46]。综上所述,在五大类散装即食食品中均有致病菌检出,具体目标菌检出情况见表10。
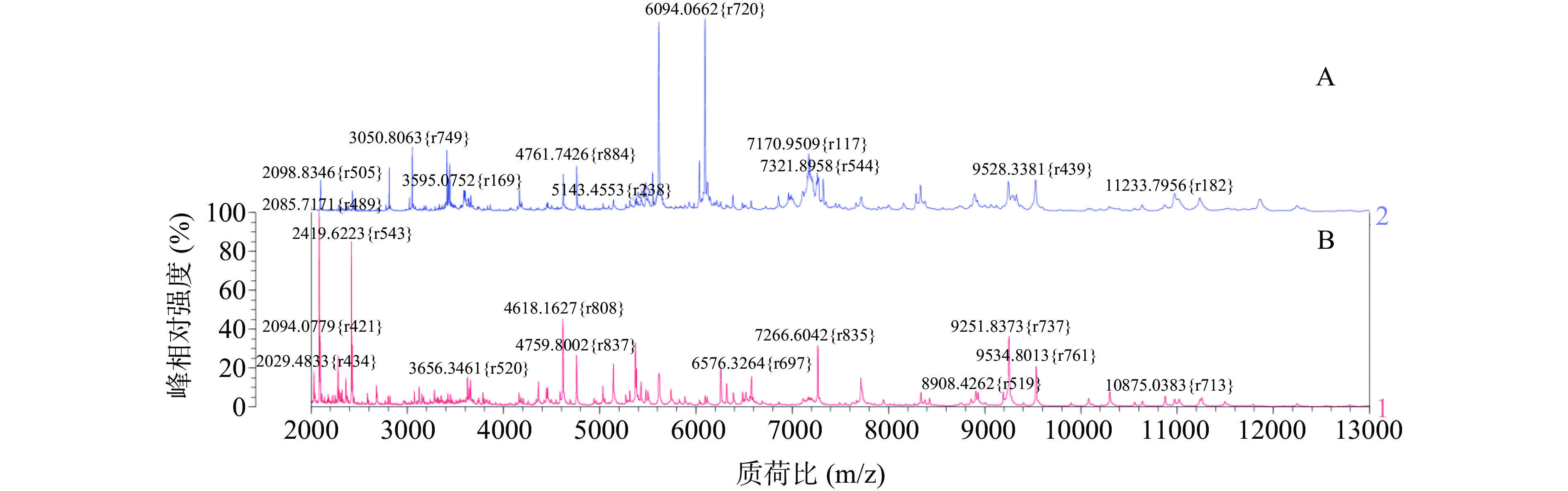
表 10 目标菌检出情况Table 10. Detection of target bacteria样品名称 数量 阳性检出率(%) 沙门氏菌 金黄色葡萄球菌 蜡样芽孢杆菌 酱卤肉 30 3.33(1/30) 10.00(3/30) 0.00(0/30) 豆制品 15 0.00(0/15) 6.67(1/15) 0.00(0/15) 寿司 20 0.00(0/20) 25(5/20) 30(6/20) 生鲜沙拉 15 6.67(1/15) 13.33(2/15) 0.00(0/15) 凉拌菜 20 10(2/20) 15(3/20) 0.00(0/20) 总计 100 4.00(4/100) 14.00(14/100) 6.00(6/100) 从不同散装即食食品样本中分离到的三种致病菌的质谱图见图12~图14。沙门氏菌样品分离株与标准菌株不同,其在质荷比6094 m/z附近出现两波最强离子峰,其余出峰点强度较低,峰型偏缓,基线轻微漂浮,信噪比偏低,与标准菌株均在质荷比2098、4761、7266、9528 m/z附近显现主要离子峰;蜡样芽孢杆菌样品分离株整体出峰量较少且强度偏低,质荷比主要在4810、5395 m/z两处相应的峰强度增强,与标准菌株相比峰数目相似,整体出峰保守,峰型极缓,且均在质荷比5395 m/z处出现最强离子峰;金黄色葡萄球菌分离株与标准菌株特征峰出峰量相似度极高,峰型陡峭且离子峰高度密集,两者均在质荷比2312、3447、4813、6890、9636 m/z等多处显现高强度特征峰,从对比图可见,或由于金黄色葡萄球菌肽段种类多且复杂程度高,特征峰数目多且强度较高,因此相较于沙门氏菌与蜡样芽孢杆菌,质谱鉴定得分普遍较高。通过三株样品中的分离目标菌的质谱图与相关标准菌株的质谱图进行对比可见,虽然不同的特征峰强度稍显差异,但是整体峰型走势相似度极高,且各特征峰的离子质量均在误差范围之内。
3. 讨论与结论
传统检测方法不仅操作繁琐、费时费力,对食物中毒的信息诊断滞后,而且在平板菌落的挑取过程中,若相关检测人员缺乏经验或并未熟悉各种致病菌的菌落形态和生化特性的话,很容易出现肉眼判断误差,造成错判漏检,已难以满足食源性疾病时效性与准确性的要求,特别是在大批量的食品样本检测过程中,这种缺点体现地更加明显。比如在用国标法对某些致病菌进行检测时或需要6~7 d才能观察结果,因为它依赖于致病菌繁殖到可见菌落的能力;此外当细菌进入活的不可培养状态(Viable but nonculturable state,VBNC)时,其无法正常在培养基上生长而形成肉眼可见的菌落而导致无法从污染样品中分离到致病菌或大大低估该致病菌的数量[33]。而MALDI-TOF MS是一种基于蛋白质检测的新型微生物鉴定手段,由于每种微生物都是由独特的蛋白质组成,蛋白质约占细胞干重的50%,表达均由遗传性状决定,受到外界环境的影响较小[17],因此蛋白质的不同种类可以作为微生物鉴定的生物标志物[19]。MALDI-TOF MS不仅所需辅助试剂较少,操作便捷,检测时间较短且准确高效,数据也有利于鉴定分析,作为国标法的有力补充,为食源性致病菌的鉴定、分型、溯源等提供了新的选择[47],但其鉴定结果受样品处理方法、数据库完善程度等因素的影响[48−49]。而是否能获得重复性好且稳定的微生物特征性质谱图,则取决于微生物样品与基质液是否形成共结晶,共结晶越均匀则重复性越好[49],因此点样方式和前处理方式的优化都十分关键。
相较于夹心法和混合干滴法,覆盖法点样可获得的平均峰数目更多,信噪比较高,特征峰更复杂且强度更高。而在前处理方式上,由于革兰氏阳性菌的细胞壁含有肽聚糖和磷壁酸,一般厚度较厚,使用直涂法无法充分破坏肽聚糖,而不完全的菌体裂解可能导致蛋白质的流失,从而影响鉴定结果,因此直涂法往往由于菌体处理不干净导致背景噪音大、基线稳定性差,有多峰合并和杂峰干扰现象,而甲酸提取法不论是处理革兰氏阴性菌还是革兰氏阳性菌,相较于其他两种方法可获得更多的出峰量和更高的峰强度,且与数据库中图谱匹配度更高。
质谱图中的每个谱峰均来源于致病菌细胞膜或细胞壁上的蛋白质经过激光解吸后发射的信号,由于不同种、属间的致病菌都有自己特有的表面特征蛋白,因此可得到不同的特征性谱峰[49],但利用直涂法和改良法进行前处理时给予的信息较少,不能完全反映菌体的结构特征,而甲酸提取法则是将菌体的细胞壁破碎进行全菌体制备,因而更容易获得致病菌的特征谱峰。
MALDI-TOF MS法在致病菌鉴定方面不仅灵敏、稳定、特异,且操作简便、结果直观,但如果图谱采集效果不佳,则会严重影响数据的分析,进而对后续菌种鉴定的结果带来直接影响,而对质谱图谱的采集质量产生干扰的因素有很多,比如样品在前处理时若培养基成分洗涤不净,则培养基中蛋白质成分经固定析出后,会出现大量低能量端背景信号,从而干扰图谱的采集;在点样时待样液自然干燥后必须尽快覆以基质液,否则易造成蛋白质氧化,不利于图谱采集;在用甲酸乙腈法进行样品处理时,必须让乙醇充分挥发,否则会影响蛋白的溶出,导致图谱采集信号较弱。MALDI-TOF MS在血清分型、细菌多位点序列分型等细菌分型、蛋白组学等方面的研究已受到越来越多的关注,本文也通过对沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌的蛋白指纹图谱特征峰的比对分析,为后续挖掘这三种目标菌的具体蛋白生物标志物的研究工作奠定了基础。MALDI-TOF MS技术不仅为食源性致病菌的分析鉴定与分型溯源提供了思路,也为食品检验检测工作的高效有序展开奠定了良好基础,可极大地确保食品质量、预警食品安全,也将更全面地为人民群众“舌尖上的安全”保驾护航,为食品安全放心工程添砖加瓦,为食品安全共治格局提供强有力的技术支撑。
-
表 1 实验菌株信息
Table 1 Strains for experiment
编号 名称 来源 ATCC8739 大肠埃希氏菌 中国药品生物制品检定所 CMCC50041 肠炎沙门氏菌 中国药品生物制品检定所 ATCC11778 蜡样芽孢杆菌 美国菌种保藏中心 ATCC26112 金黄色葡萄球菌 中国药品生物制品检定所 R160747 金黄色葡萄球菌 2016年3月餐饮中毒样品R160747中分离 W152001 金黄色葡萄球菌 2015年10月食品样本中分离 W170130 金黄色葡萄球菌 2017年2月食物中毒样品W170130中分离 R140715 金黄色葡萄球菌 2014年12月食品样本中分离 B089 金黄色葡萄球菌 2014年省局能力验证样品B089中分离 表 2 多重PCR反应体系(50 µL)
Table 2 Multiplex PCR reaction system (50 µL)
体系组分 体系用量(µL) 2×Mix 25 各上游引物(10 µmol/L) 2 各下游引物(10 µmol/L) 2 混合DNA模板 6 ddH2O 7 表 3 单重PCR反应程序
Table 3 Single PCR reaction procedure
反应温度(℃) 反应时间 循环次数 94 10 min 1 94 30 s 30 58 30 s 72 45 s 72 10 min 1 4 ∞ 1 表 4 鉴定结果判读
Table 4 Interpretation of identification results
可信度 分值 颜色 意义 99.9% ≥1000 深绿色 鉴定结果可信 90~99.8% 900~999 浅绿色 鉴定结果可信度较高 80~89.9% 800~899 黄色 可能的菌属或菌种鉴定 75~79% 750~799 白色 可能的菌属鉴定 75%以下 <750 白色 无匹配结果 75~99.9% >750 红色 有杂菌污染或鉴定结果可信度较低 表 5 沙门氏菌经不同培养基培养后的鉴定得分(%)
Table 5 Identification scores of Salmonella on different media (%)
点样次数 培养基 TSA NA BS XLD HE 1 99.8 99.9 93.5 97.7 92.1 2 97.5 99.9 95.9 98.2 91.8 3 98.3 99.8 95.0 96.3 91.5 4 99.0 99.0 98.1 98.8 94.0 5 98.7 99.9 97.6 98.4 87.9 6 99.9 98.1 92.9 97.0 92.7 7 99.2 98.0 96.8 97.7 89.3 8 99.7 99.2 96.0 96.2 93.6 平均得分(%) 99.01 99.23 95.73 97.54 91.61 CV(%) 0.84 0.81 1.93 0.98 2.27 表 6 金黄色葡萄球菌经不同培养条件培养后的鉴定得分(%)
Table 6 Identification scores of Staphylococcus aureus in different cultivation conditions (%)
点样次数 培养基 PCA NA TSA 24 h 48 h 72 h 24 h 48 h 72 h 24 h 48 h 72 h 1 98.2 96.0 82.5 99.9 98.5 93.1 99.9 97.5 87.2 2 95.7 92.1 76.2 99.9 99.9 98.2 99.9 99.0 94.1 3 99.9 99.7 95.8 99.9 99.9 95.8 99.9 99.9 90.3 4 98.0 94.5 81.9 99.9 99.9 91.0 99.9 99.9 91.5 5 93.6 91.0 78.0 99.9 98.9 86.5 99.9 96.9 83.3 6 99.9 99.9 95.1 99.9 99.9 92.7 99.9 98.0 87.9 7 97.1 95.2 80.0 99.9 98.1 84.0 99.9 95.2 77.8 8 98.4 98.0 83.7 99.9 99.9 92.3 99.9 99.9 93.0 平均得分(%) 97.6 95.8 84.15 99.9 99.38 91.7 99.9 98.29 88.14 CV(%) 2.18 3.43 8.78 0 0.76 5.03 0 1.74 6.16 表 7 检测限试验结果
Table 7 Results of the detection limit
沙门氏菌浓度
(CFU/mL)鉴定得分
(%)金黄色葡萄球菌浓度
(CFU/mL)鉴定得分
(%)蜡样芽孢杆菌浓度
(CFU/mL)鉴定得分
(%)108 99.9 108 99.9 107 98.2 107 97.4 107 96.9 106 85.5 106 84.1 106 87.3 105 72.1 105 78.0 105 76.6 104 0 104 0 104 0 103 0 表 8 稳定性试验结果
Table 8 Results of the detection stability
平行样 不同传代次数的鉴定得分(%) 沙门氏菌 金黄色葡萄球菌 蜡样芽孢杆菌 1 2 3 1 2 3 1 2 3 1 99.9 99.9 98.4 99.9 99.9 99.9 98.2 95.5 97.8 2 99.9 97.1 99.0 99.9 99.9 99.9 98.0 96.2 95.0 3 99.2 98.7 98.9 99.9 99.9 99.9 99.9 96.9 97.4 平均得分(%) 99.67 98.57 98.77 99.9 99.9 99.9 98.7 96.2 96.73 CV(%) 0.41 1.43 0.33 0 0 0 1.06 0.73 1.57 表 9 沙门氏菌生化试验
Table 9 Biochemical test for Salmonella
生化试验详情 2 APPA − 3 ADO − 4 PyrA − 5 IARL − 7 dCEL − 9 BGAL − 10 H2S + 11 BNAG − 12 AGLTp − 13 dGLU + 14 GGT − 15 OFF + 17 BGLU − 18 dMAL + 19 dMAN + 20 dMNE + 21 BXYL − 22 BAlap − 23 ProA − 26 LIP − 27 PLE − 29 TyrA + 31 URE − 32 dSOR + 33 SAC − 34 dTAG − 35 dTRE + 36 CIT + 37 MNT − 39 5KG + 40 ILATk + 41 AGLU − 42 SUCT + 43 NAGA − 44 AGAL + 45 PHOS + 46 GlyA − 47 ODC + 48 LDC + 53 IHISa − 56 CMT + 57 BGUR − 58 O129R + 59 GGAA − 61 IMLTa − 62 ELLM − 64 ILATa − 表 10 目标菌检出情况
Table 10 Detection of target bacteria
样品名称 数量 阳性检出率(%) 沙门氏菌 金黄色葡萄球菌 蜡样芽孢杆菌 酱卤肉 30 3.33(1/30) 10.00(3/30) 0.00(0/30) 豆制品 15 0.00(0/15) 6.67(1/15) 0.00(0/15) 寿司 20 0.00(0/20) 25(5/20) 30(6/20) 生鲜沙拉 15 6.67(1/15) 13.33(2/15) 0.00(0/15) 凉拌菜 20 10(2/20) 15(3/20) 0.00(0/20) 总计 100 4.00(4/100) 14.00(14/100) 6.00(6/100) -
[1] 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. GB 31607-2021食品安全国家标准 散装即食食品中致病菌限量[S]. 北京:中国标准出版社, 2021. [National Health Commission, State Market Regulatory Administration, GB 31607-2021 National standard for food safety Limit of pathogenic bacteria in ready-to-eat bulk food[S]. Beijing:Standards Press of China, 2021.] National Health Commission, State Market Regulatory Administration, GB 31607-2021 National standard for food safety Limit of pathogenic bacteria in ready-to-eat bulk food[S]. Beijing: Standards Press of China, 2021.
[2] 阮雁春. 散装食品中致病菌与卫生细菌指标检测技术研究[J]. 现代食品,2018,19(32):103−107. [RUAN Y C. Study on detection technology of pathogenic bacteria and sanitary bacteria in bulk food[J]. Modern Food,2018,19(32):103−107.] RUAN Y C . Study on detection technology of pathogenic bacteria and sanitary bacteria in bulk food[J]. Modern Food,2018 ,19 (32 ):103 −107 .[3] 郝鹏飞, 任静朝, 张光辉, 等. 新乡市2017~2018年即食食品微生物污染状况调查分析[J]. 中国初级卫生保健,2020,34(10):99−102. [HAO P F, REN J Z, ZHANG G H, et al. Analysis on microorganism pollution in ready-to-eat foods in Xinxiang City from 2017 to 2018[J]. Chinese Primary Health Care,2020,34(10):99−102.] doi: 10.3969/j.issn.1001-568X.2020.10.0030 HAO P F, REN J Z, ZHANG G H, et al . Analysis on microorganism pollution in ready-to-eat foods in Xinxiang City from 2017 to 2018[J]. Chinese Primary Health Care,2020 ,34 (10 ):99 −102 . doi: 10.3969/j.issn.1001-568X.2020.10.0030[4] 陶文靖, 胡素丽, 周琦, 等. 餐饮食品中致病菌的风险分析与控制[J]. 食品安全导刊,2020,16(14):36−40. [TAO W J, HU S L, ZHOU Q, et al. Risk analysis and control of pathogenic bacteria in catering food[J]. China Food Safety,2020,16(14):36−40.] TAO W J, HU S L, ZHOU Q, et al . Risk analysis and control of pathogenic bacteria in catering food[J]. China Food Safety,2020 ,16 (14 ):36 −40 .[5] WHO. Food Safety, a-Worldwide-Challenge[R]. Food Chain 2001, 2001.
[6] 孙献周, 于琪, 张巧. 食品中食源性致病菌污染现状及危害[J]. 河南医学高等专科学校学报,2021,33(3):335−339. [SUN X Z, YU Q, ZHANG Q, et al. Contamination status and harm of foodborne pathogens in food[J]. Journal of Henan Medical College,2021,33(3):335−339.] doi: 10.3969/j.issn.1008-9276.2021.03.022 SUN X Z, YU Q, ZHANG Q, et al . Contamination status and harm of foodborne pathogens in food[J]. Journal of Henan Medical College,2021 ,33 (3 ):335 −339 . doi: 10.3969/j.issn.1008-9276.2021.03.022[7] LIU J K, BAI L, LI W W, et al. Trends of foodborne diseases in China:Lessons from laboratory-based surveillance since 2011[J]. Frontiers of Medicine,2018,12(1):48−57. doi: 10.1007/s11684-017-0608-6
[8] 赵建梅, 李月华, 张青青, 等. 2008~2017年我国部分地区禽源沙门氏菌流行状况及耐药分析[J]. 中国动物检疫,2019,36(8):27−35. [ZHAO J M, LI Y H, ZHANG Q Q, et al. Analysis on the prevalence and antimicrobial resistance of poultry Salmonella in some regions of China during 2008 to 2017[J]. China Animal Health Inspection,2019,36(8):27−35.] doi: 10.3969/j.issn.1005-944X.2019.08.007 ZHAO J M, LI Y H, ZHANG Q Q, et al . Analysis on the prevalence and antimicrobial resistance of poultry Salmonella in some regions of China during 2008 to 2017[J]. China Animal Health Inspection,2019 ,36 (8 ):27 −35 . doi: 10.3969/j.issn.1005-944X.2019.08.007[9] 梁智安. 浅谈对食品安全国家标准微生物学检验方法的理解与应用[J]. 科技信息,2011(4):37−38. [LIANG Z A. A brief discussion on the understanding and application of national standard microbiology inspection method for food safety[J]. Scientific and Technological Information,2011(4):37−38.] doi: 10.3969/j.issn.1001-9960.2011.04.028 LIANG Z A . A brief discussion on the understanding and application of national standard microbiology inspection method for food safety[J]. Scientific and Technological Information,2011 (4 ):37 −38 . doi: 10.3969/j.issn.1001-9960.2011.04.028[10] 李兵兵, 刘靓, 李双殊, 等. 淮安市畜禽肉中金黄色葡萄球菌污染及其病原学特征分析[J]. 中国食品卫生杂志,2019,31(3):217−221. [LI B B, LIU L, LI S S, et al. Prevalence and characterization of Staphylococcus aureus in meats of animal origin in Huai’an[J]. Chinese Journal of Food Hygiene,2019,31(3):217−221.] LI B B, LIU L, LI S S, et al . Prevalence and characterization of Staphylococcus aureus in meats of animal origin in Huai’an[J]. Chinese Journal of Food Hygiene,2019 ,31 (3 ):217 −221 .[11] PROUDY I. Genotypic characterization of Enterobacter sakazakii isolates by PFGE, Box-PCR and sequencing of the fliC gene[J]. Journal of Applied Microbiology,2008,104(1):26−34.
[12] CHEN X, WU X, GAN M, et al. Rapid detection of staphylococcus aureus in dairy and meat foods by combination of capture with silica-coated magnetic nanoparticles and thermophilic helicase-dependent isothermal amplification[J]. Journal of Dairy Science,2015,98(3):1563−1570. doi: 10.3168/jds.2014-8828
[13] MARTLBAUER E, GRANUM P E. Bacillus cereus toxins[J]. Toxins,2021,13(5):295. doi: 10.3390/toxins13050295
[14] REN B B, LASAM G. A rare case of native mitral valve Bacillus cereus endocarditis culminating into a cerebrovascular infarction[J]. Cardiology Research,2018,9(3):173−175. doi: 10.14740/cr672w
[15] MAKINDE O M, ADETUNJI M C, EZEOKOLI O T, et al. Bacterial contaminants and their antibiotic susceptibility patterns in ready-to-eat foods vended in Ogun State, Nigeria[J]. Letters in Applied Microbiology,2020,72:187−195.
[16] 康招娣, 李红娜, 袁飞. 快速检测技术在食源性沙门氏菌检测中的应用研究进展[J]. 中国食品卫生杂志,2022,34(4):848−855. [KANG Z D, LI H N, YUAN F. Research progress on the application of rapid detection technology for foodborne Salmonella[J]. Chinese Journal of Food Hygiene,2022,34(4):848−855.] KANG Z D, LI H N, YUAN F . Research progress on the application of rapid detection technology for foodborne Salmonella[J]. Chinese Journal of Food Hygiene,2022 ,34 (4 ):848 −855 .[17] 尚玉婷, 叶青华, 刘振杰, 等. 微生物高通量快速检测技术研究进展[J]. 微生物学报,2021,48(8):2801−2814. [SHANG Y T, YE Q H, LIU Z J, et al. Research progress on high-throughput rapid detection technology of microorganism[J]. Microbiology China,2021,48(8):2801−2814.] SHANG Y T, YE Q H, LIU Z J, et al . Research progress on high-throughput rapid detection technology of microorganism[J]. Microbiology China,2021 ,48 (8 ):2801 −2814 .[18] RUSSELL A, SECREST J, SCHREEDER C. Stethoscopes as a source of hospital-acquired methicillin-resistant Staphylococcus aureus[J]. Journal of Perianesthesia Nursing,2012,27(2):82−87. doi: 10.1016/j.jopan.2012.01.004
[19] 闫雯倩, 陈企发, 夏炎. 基质辅助激光解析/电离飞行时间质谱(MALDI-TOF MS)在微生物鉴定中的应用[J]. 化学教育(中英文),2022,43(10):7−14. [YAN W Q, CHEN Q F, XIA Y. Application of matrix assisted laser desorption ionization time of flight mass spectrometry (MALDI-TOF MS) in microbial identification[J]. Chemical Education,2022,43(10):7−14.] YAN W Q, CHEN Q F, XIA Y . Application of matrix assisted laser desorption ionization time of flight mass spectrometry (MALDI-TOF MS) in microbial identification[J]. Chemical Education,2022 ,43 (10 ):7 −14 .[20] FENSELAU C, DEMIREV P A. Characterization of intact microorganisms by MALDI mass spectrometry[J]. Mass Spectrometry Reviews,2001,20(4):157−171. doi: 10.1002/mas.10004
[21] CHEN Y G, HUANG X C, WANG R Z, et al. The structure of a GFP-based antibody (fluorobody) to TLH, a toxin from Vibrio parahaemolyticus[J]. Acta Crystallographica Section F-Structural Biology Communications,2015,71(7):913−918. doi: 10.1107/S2053230X15008845
[22] TSAI Y, LIN T, CHOU H, et al. Shortening the time of the identification and antimicrobial susceptibility testing on positive blood cultures with MALDI-TOF MS[J]. Diagnostics,2021,11(8):1514. doi: 10.3390/diagnostics11081514
[23] 龚艳清, 陈信忠, 杨俊萍, 等. 基质辅助激光解吸电离飞行时间质谱在李斯特菌检测和鉴定中的应用[J]. 食品科学,2012,33(6):209−214. [GONG Y Q, CHEN X Z, YANG J P, et al. Detection and identification of Listeria species by matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. Food Science,2012,33(6):209−214.] GONG Y Q, CHEN X Z, YANG J P, et al . Detection and identification of Listeria species by matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. Food Science,2012 ,33 (6 ):209 −214 .[24] 吴丽娜, 王伟, 王萍, 等. 基质辅助激光解吸电离飞行时间质谱法对环境中芽孢杆菌的鉴定及溯源[J]. 食品安全质量检测学报,2022,13(9):2848−2854. [WU L N, WANG W, WANG P, et al. Identification and traceability of Bacillus in the environment by matrix-assisted laser desorption lionization-time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2022,13(9):2848−2854.] doi: 10.3969/j.issn.2095-0381.2022.9.spaqzljcjs202209017 WU L N, WANG W, WANG P, et al . Identification and traceability of Bacillus in the environment by matrix-assisted laser desorption lionization-time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2022 ,13 (9 ):2848 −2854 . doi: 10.3969/j.issn.2095-0381.2022.9.spaqzljcjs202209017[25] 杨祖顺, 汤晓召, 邹颜秋硕, 等. 基质辅助激光解吸/电离飞行时间质谱法溯源分析云南省肉制品中金黄色葡萄球菌[J]. 食品安全质量检测学报,2019,10(22):7494−7501. [YANG Z S, TANG X Z, ZOU Y Q S, et al. Traceability analysis of Staphylococcus aureus isolated from meat products in Yunnan Province by matrix assisted laser desorption/ionization time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2019,10(22):7494−7501.] YANG Z S, TANG X Z, ZOU Y Q S, et al . Traceability analysis of Staphylococcus aureus isolated from meat products in Yunnan Province by matrix assisted laser desorption/ionization time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2019 ,10 (22 ):7494 −7501 .[26] 李闽真, 郑盈翔, 叶玲清, 等. 基质辅助激光解吸电离飞行时间质谱法对金黄色葡萄球菌的鉴定效果[J]. 海峡预防医学杂志,2018,24(6):58−60. [LI M Z, ZHENG Y X, YE L Q, et al. Effectiveness of identification of Staphylococcus aureus by matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J]. Strait Journal of Preventive Medicine,2018,24(6):58−60.] LI M Z, ZHENG Y X, YE L Q, et al . Effectiveness of identification of Staphylococcus aureus by matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J]. Strait Journal of Preventive Medicine,2018 ,24 (6 ):58 −60 .[27] 史方, 李轲, 阴甜甜, 等, 致病菌快速检测管联合基质辅助激光解吸电离飞行时间质谱法鉴定即食食品中的大肠埃希氏菌O157:H7[J]. 食品安全质量检测学报, 2023, 14(1):253−260. [SHI F, LI K, YIN T T, et al. Identification of Escherichia coli O157:H7 in ready-to-eat food by rapid detection tube of pathogenic bacteria combined with matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. Journal of Food Safety and Quality, 2023, 14(1):253−260.] SHI F, LI K, YIN T T, et al. Identification of Escherichia coli O157:H7 in ready-to-eat food by rapid detection tube of pathogenic bacteria combined with matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. Journal of Food Safety and Quality, 2023, 14(1): 253−260.
[28] 李滨洲, 陈飞, 郭珍珍, 等. 基质辅助激光解吸电离飞行时间质谱技术分离鉴定生鲜猪肉中沙门氏菌/大肠杆菌类似菌[J]. 食品安全质量检测学报,2018,9(4):717−722. [LI B Z, CHEN F, GUO Z Z, et al. Isolation and identification of Salmonella/ Escherichia coli analogues in raw pork by matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J]. Journal of Food Safety and Quality,2018,9(4):717−722.] doi: 10.3969/j.issn.2095-0381.2018.04.006 LI B Z, CHEN F, GUO Z Z, et al . Isolation and identification of Salmonella/Escherichia coli analogues in raw pork by matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J]. Journal of Food Safety and Quality,2018 ,9 (4 ):717 −722 . doi: 10.3969/j.issn.2095-0381.2018.04.006[29] 赵宏, 杨柳, 赵良娟, 等. 免疫富集联合基质辅助激光解吸电离飞行时间质谱法测定牛奶、鸡蛋中的沙门氏菌[J]. 食品安全质量检测学报,2020,11(9):2936−2945. [ZHAO H, YANG L, ZHAO L J, et al. Determination of Salmonella in milk and eggs by immune enrichment and matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J]. Journal of Food Safety and Quality,2020,11(9):2936−2945.] ZHAO H, YANG L, ZHAO L J, et al . Determination of Salmonella in milk and eggs by immune enrichment and matrix-assisted laser desorption ionization time-of-flight mass spectrometry[J]. Journal of Food Safety and Quality,2020 ,11 (9 ):2936 −2945 .[30] 周千渝, 张延国, 黄成才, 等. 食源性致病菌MALDI-TOF MS检测方法的建立与应用[J]. 食品工业科技,2015,36(18):59−76. [ZHOU Q Y, ZHANG Y G, HUANG C C, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry for the identification and detection of foodborne pathogens[J]. Science and Technology of Food Industry,2015,36(18):59−76.] ZHOU Q Y, ZHANG Y G, HUANG C C, et al . Matrix-assisted laser desorption ionization-time of flight mass spectrometry for the identification and detection of foodborne pathogens[J]. Science and Technology of Food Industry,2015 ,36 (18 ):59 −76 .[31] 孙鸿燕. 四种食源性致病菌多重PCR检测方法的建立[D]. 长春:吉林大学, 2011. [SUN H Y. Establishment a multiplex PCR method for detection of four foodborne pathogens[D]. Changchun:Jilin University, 2011.] SUN H Y. Establishment a multiplex PCR method for detection of four foodborne pathogens[D]. Changchun: Jilin University, 2011.
[32] 马佳睿. 食源性金黄色葡萄球菌和沙门氏菌双重巢式PCR及双重LAMP检测方法的建立及应用[D]. 银川:宁夏大学, 2021. [MA J R. Establishment and application of double nested PCR and double LAMP detection methods to food-borne Staphylococcus aureus and Salmonella[D]. Yinchuan:Ningxia University, 2022.] MA J R. Establishment and application of double nested PCR and double LAMP detection methods to food-borne Staphylococcus aureus and Salmonella[D]. Yinchuan: Ningxia University, 2022.
[33] XU H S, ROBERTS N, SINGLETON F L, et al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment[J]. Microbial Ecology,1982,8(4):313−323. doi: 10.1007/BF02010671
[34] 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. GB 4789.4-2016食品安全国家标准 食品微生物学检验 沙门氏菌检验[S]. 北京:中国标准出版社, 2016. [National Health Commission, State Market Regulatory Administration, GB 4789.4-2016 National standard for food safety Microbiological examination of foodhygiene Examination of Salmonella[S]. Beijing:Standards Press of China, 2016.] National Health Commission, State Market Regulatory Administration, GB 4789.4-2016 National standard for food safety Microbiological examination of foodhygiene Examination of Salmonella[S]. Beijing: Standards Press of China, 2016.
[35] 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. GB 4789.10-2016食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验[S]. 北京:中国标准出版社, 2016. [National Health Commission, State Market Regulatory Administration, GB 4789.10-2016 National standard for food safety Microbiological examination of food hygiene Examination of Staphylococcus aureus[S]. Beijing:Standards Press of China, 2016.] National Health Commission, State Market Regulatory Administration, GB 4789.10-2016 National standard for food safety Microbiological examination of food hygiene Examination of Staphylococcus aureus[S]. Beijing: Standards Press of China, 2016.
[36] 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. GB 4789.14-2014食品安全国家标准食品微生物学检验蜡样芽孢杆菌检验[S]. 北京:中国标准出版社, 2014. [National Health Commission, State Market Regulatory Administration, GB 4789.14-2014 National standard for food safety Microbiological examination of foodhygiene Examination of Bacillus cereus[S]. Beijing:Standards Press of China, 2014.] National Health Commission, State Market Regulatory Administration, GB 4789.14-2014 National standard for food safety Microbiological examination of foodhygiene Examination of Bacillus cereus[S]. Beijing: Standards Press of China, 2014.
[37] JEONG S P, SOON H C, SANG M H, et al. The impact of protein extraction protocols on the performance of currently available MALDI-TOF mass spectrometry for identification of Mycobacterial clinical isolates cultured in liquid media[J]. Clinica Chimica Acta,2016,460:190−195. doi: 10.1016/j.cca.2016.06.039
[38] 徐淑菲, 孔繁德, 林双庆, 等. MALDI-TOF MS用于微生物鉴定的影响因素分析[J]. 中国动物检疫,2019,36(2):88−96. [XU S F, KONG F D, LIN S Q, et al. Influence factors analysis on MALDI-TOF MS in microorganism identification[J]. China Anim Health Inspect,2019,36(2):88−96.] doi: 10.3969/j.issn.1005-944X.2019.02.022 XU S F, KONG F D, LIN S Q, et al . Influence factors analysis on MALDI-TOF MS in microorganism identification[J]. China Anim Health Inspect,2019 ,36 (2 ):88 −96 . doi: 10.3969/j.issn.1005-944X.2019.02.022[39] 梁世周, 蔡文品, 曾云祥, 等. 三种前处理在基质辅助激光解析电离飞行时间质谱鉴定假丝酵母菌属种的应用比较[J]. 中国微生态学杂志,2020,32(10):1203−1209. [LIANG S Z, CAI W P, ZENG Y X, et al. Three pretreatments in the identification of Candida species by matrix-assisted laser desorption ionization time-of-flight mass spectrometry:A comparison[J]. Chinese Journal of Microecology,2020,32(10):1203−1209.] LIANG S Z, CAI W P, ZENG Y X, et al . Three pretreatments in the identification of Candida species by matrix-assisted laser desorption ionization time-of-flight mass spectrometry: A comparison[J]. Chinese Journal of Microecology,2020 ,32 (10 ):1203 −1209 .[40] 宋安华, 肖剑, 陈楷. 几种不同血清型沙门氏菌生化结果及基质辅助激光解吸电离飞行时间质谱离子峰的差异性分析[J]. 食品安全质量检测学报,2019,10(16):5436−5442. [SONG A H, XIAO J, CHEN K. Biochemical results of several different serotypes of Salmonella and divergence analysis of matrix-assisted laser desorption ionization time-of-flight mass spectrometry ion peaks[J]. Journal of Food Safety and Quality,2019,10(16):5436−5442.] doi: 10.3969/j.issn.2095-0381.2019.16.036 SONG A H, XIAO J, CHEN K . Biochemical results of several different serotypes of Salmonella and divergence analysis of matrix-assisted laser desorption ionization time-of-flight mass spectrometry ion peaks[J]. Journal of Food Safety and Quality,2019 ,10 (16 ):5436 −5442 . doi: 10.3969/j.issn.2095-0381.2019.16.036[41] 甘辛, 王晓菲, 闫韶飞, 等. 聚合酶链式反应和基质辅助激光解吸电离飞行时间质谱方法鉴定克罗诺杆菌[J]. 中国食品卫生杂志,2021,33(2):144−148. [GAN X, WANG X F, YAN S F, et al. Application of polymerase chain reaction and matrix-assisted laser desorption/ionization time of flight mass spectrometry methods in Cronobacter rapid identification[J]. Chinese Journal of Food Hygiene,2021,33(2):144−148.] GAN X, WANG X F, YAN S F, et al . Application of polymerase chain reaction and matrix-assisted laser desorption/ionization time of flight mass spectrometry methods in Cronobacter rapid identification[J]. Chinese Journal of Food Hygiene,2021 ,33 (2 ):144 −148 .[42] 吴福平, 吴瑜凡, 崔思宇, 等. MALDI-TOF MS方法快速鉴定食品中空肠弯曲菌的技术研究[J]. 工业微生物,2022,52(1):15−19. [WU F P, WU Y F, CUI S Y, et al. Rapid identification of Campylobacter jejuni in food by MALDI-TOF MS method[J]. Industrial Microbiology,2022,52(1):15−19.] doi: 10.3969/j.issn.1001-6678.2022.01.003 WU F P, WU Y F, CUI S Y, et al . Rapid identification of Campylobacter jejuni in food by MALDI-TOF MS method[J]. Industrial Microbiology,2022 ,52 (1 ):15 −19 . doi: 10.3969/j.issn.1001-6678.2022.01.003[43] 彭志兰, 林吉恒, 黄朱梁, 等. 基质辅助激光解析电离-飞行时间质谱法快速鉴定餐饮食品中的空肠弯曲菌[J]. 食品安全质量检测学报,2020,11(9):2975−2979. [PENG Z L, LIN J H, HUANG Z L, et al. Rapid detection and identification of Campylobacter jejuni in food and beverage by matrix-assisted laser analytical ionization-time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2020,11(9):2975−2979.] PENG Z L, LIN J H, HUANG Z L, et al . Rapid detection and identification of Campylobacter jejuni in food and beverage by matrix-assisted laser analytical ionization-time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2020 ,11 (9 ):2975 −2979 .[44] 种婷, 董慧明, 刘霓, 等. 基质辅助激光解吸电离飞行时间质谱法检测副溶血性弧菌[J]. 食品安全质量检测学报,2022,13(6):1866−1871. [CHONG T, DONG H M, LIU N, et al. Detection of Vibrio parahaemolyticus by matrix assisted laser desorption ionization time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2022,13(6):1866−1871.] doi: 10.3969/j.issn.2095-0381.2022.6.spaqzljcjs202206021 CHONG T, DONG H M, LIU N, et al . Detection of Vibrio parahaemolyticus by matrix assisted laser desorption ionization time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2022 ,13 (6 ):1866 −1871 . doi: 10.3969/j.issn.2095-0381.2022.6.spaqzljcjs202206021[45] 孔祥瑞, 王洪柱. 金黄色葡萄球菌检测方法的研究进展[J]. 中国乳业,2017(190):72−74. [KONG X R, WANG H Z. Research progress on detection methods of Staphylococcus aureus[J]. China Dairy,2017(190):72−74.] KONG X R, WANG H Z . Research progress on detection methods of Staphylococcus aureus[J]. China Dairy,2017 (190 ):72 −74 .[46] BERTHOLD-PLUTA A, PLUTA A, GARBOWSKA M. The effect of selected factors on the survival of Bacillus cereus in the human gastrointestinaltract[J]. Microbial Pathogenesis,2015(82):7−14.
[47] BAR-MEIR M, BERLINER E, KASHAT L, et al. The utility of MALDI-TOF MS for outbreak investigation in the neonatal intensive care unit[J]. European Journal of Pediatrics,2020,179(12):1843−1849. doi: 10.1007/s00431-020-03696-3
[48] 杨伟玮, 汪曣, 孙传强. 数据处理和分析方法在MALDI-TOF MS鉴定微生物中的应用[J]. 中国微生态学杂志,2018,30(3):368−373. [YANG W W, WANG Y, SUN C Q. Application of data processing and analytical methods in MALDI-TOF MS identification of microorganisms[J]. Chinese Journal of Microecology,2018,30(3):368−373.] YANG W W, WANG Y, SUN C Q . Application of data processing and analytical methods in MALDI-TOF MS identification of microorganisms[J]. Chinese Journal of Microecology,2018 ,30 (3 ):368 −373 .[49] 戴颖欣, 李敏. MALDI-TOF MS在临床微生物检验中的应用[J]. 检验医学,2015,30(2):102−107. [DAI Y X, LI M. Application of MALDI-TOF MS technology in clinical microbial determination[J]. Laboratory Medicine,2015,30(2):102−107.] doi: 10.3969/j.issn.1673-8640.2015.02.002 DAI Y X, LI M . Application of MALDI-TOF MS technology in clinical microbial determination[J]. Laboratory Medicine,2015 ,30 (2 ):102 −107 . doi: 10.3969/j.issn.1673-8640.2015.02.002 -
期刊类型引用(4)
1. 董雪,姜利,岳涛,王鹏,汤有宏. MALDI-TOF MS技术识别白酒酿造微生物的可行性探讨. 酿酒. 2025(01): 132-135 .  百度学术
百度学术
2. 樊启明,叶玉华,杨春艳. 食品安全背景下食品检测存在的问题及对策. 食品安全导刊. 2024(09): 187-189 .  百度学术
百度学术
3. 朱诗语,许云飞. 某市动物性食品中食源性致病菌的分离鉴定和致病性分析. 食品安全导刊. 2024(21): 81-83+88 .  百度学术
百度学术
4. 王艺凯,侯颖,杨帆,任宇捷,杨菲,李运涛,邱烨,刘鑫. MALDI-TOF MS验证与综合评价. 中国口岸科学技术. 2024(08): 18-27 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:




 下载:
下载:



