Optimization of Solanum lyratum Crude Polysaccharide Extraction Process Using Response Surface Methodology and Analysis ofIts In Vitro Antioxidant Activity
-
摘要: 为了优化白英多糖的提取工艺,探究其体外抗氧化活性,本研究采用响应面法对白英多糖的超声提取工艺进行优化:通过单因素实验探究提取温度、提取时间、料液比3个因素对白英多糖得率的影响;在此基础上,采用响应面法优化提取工艺,同时应用红外光谱对白英多糖结构进行分析,并检测其体外抗氧化活性。结果表明,白英多糖的最佳提取工艺为:料液比为1:57 g/mL、提取时间58 min、提取温度65 ℃,在此条件下白英多糖得率为7.54%±0.12%。红外光谱分析表明白英多糖具有典型的多糖结构。白英多糖对DPPH和ABTS+自由基的半抑制浓度(IC50)分别为1.104、1.408 mg/mL,表明其具有良好的体外抗氧化活性。本研究为白英多糖的开发利用提供了理论依据。Abstract: To optimize the extraction process of polysaccharide form Solanum lyratum and investigate its in vitro antioxidative activity. In this study, response surface methodology was employed to optimize the ultrasonic-assisted extraction process of polysaccharides from Solanum lyratum. Single-factor experiments were conducted to explore the effects of three factors: Extraction temperature, extraction time, and solid-liquid ratio on the yield. Fourier transform infrared spectroscopy (FTIR) was used to analyze the structure of Solanum lyratum polysaccharide, and in vitro antioxidant activity was investigated. The results showed that the optimal extraction conditions were the material-liquid ratio of 1:57 g/mL, the extraction time of 58 min, and the extraction temperature of 65 ℃. Under these conditions, the yield of polysaccharides was 7.54%±0.12%. Fourier transform infrared spectroscopy of the extracted polysaccharides exhibited a typical polysaccharide absorbance. Moreover, the half-maximal inhibitory concentrations (IC50) of polysaccharides against DPPH and ABTS+ free radicals were 1.104 and 1.408 mg/mL, respectively, indicating significant in vitro antioxidant activity. The results of this study provided a theoretical foundation for the further development and utilization of Solanum lyratum polysaccharides.
-
白英(Solanum lyratum Thunb.)为茄科草质藤本,又名山甜菜、白毛藤、排风草。白英以全草及根入药,具有祛风利湿、清热解毒、抗肿瘤等功效[1],是临床上常用抗癌中草药[2−4],可用于制作保健食品[5]。白英多糖是白英的主要活性成分,具有抑菌[6]、抗癌[7−8]、增强免疫力[9]等药理活性。目前,白英多糖的提取工艺多采用传统方法,王林江等[10]通过石油醚回流脱脂、乙醇回流除去单糖和低聚糖,采用沸水浸提法提取白英多糖。杨惠麟等[11]通过乙醇超声波提取去除单糖等小分子物质,采用加热回流法提取白英多糖。Wu等[12]采用沸水抽提同时进行机械搅拌的方法提取白英多糖。上述方法皆采用沸水提取白英多糖,不仅提取时间长,而且高温易造成多糖降解及失活[13],从而使提取率降低。超声波辅助提取是通过超声波的机械效应及空化效应,使植物细胞壁破碎,有利于有效成分的溶出,目前已被广泛运用于天然活性物质的提取。Chen等[14]采用不同方法提取山楂多糖发现沸水抽提山楂多糖平均得率为5.88%±0.19%,超声波提取山楂多糖平均得率为7.47%±0.05%。结果表明,就山楂多糖的提取而言,超声波法与沸水抽提法相比,具有提取速度快,提取率高,提取温度低等明显优势。目前暂无超声波法辅助提取白英多糖的报道。另外,有研究发现白英的醇提物具有一定的抗氧化作用[15],但白英的水提物的抗氧化活性未见报道。毛建山等[16]对白英多糖进行红外光谱检测,发现其具有可供氢官能团,这表明白英多糖具有潜在的抗氧化作用。因此,本研究采用超声波法提取白英多糖,通过响应面设计对白英多糖的提取工艺进行优化,并测定其抗氧化活性,旨为白英多糖的开发利用提供理论依据。
1. 材料与方法
1.1 材料与仪器
白英干品 购于安徽省亳州市亳源通中药材种植有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-二氮-双(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS) 合肥巴斯夫生物科技有限公司;抗坏血酸(VC) 天津登峰化学试剂厂;无水葡萄糖、苯酚、浓硫酸、乙醇等试剂均为分析纯。
KQ-100DE超声波清洗机 昆山市超声波仪器有限公司;ZT-2L旋转蒸发仪 郑州紫拓仪器设备有限公司;7200可见光分光光度计 尤尼柯(上海)仪器有限公司;SHZ-D循环水真空泵 郑州杜甫仪器厂;NanoDrop 2000超微量分光光度计 赛默飞世尔科技公司;Nicolet iS5傅里叶红外光谱仪 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 白英多糖的提取方法
1.2.1.1 白英粉末的前处理
将白英干品用小型粉碎机粉碎,过60目筛后按1:10比例加入95%乙醇超声提取1 h,去除其中的还原糖和杂质,过滤后烘干保存备用。
1.2.1.2 白英多糖的提取
称取白英全草粉末25.0 g,在预设超声条件下进行提取过滤后得提取液,减压浓缩至10 mL,将浓缩液通过活性炭脱色,收集脱色液。加入等体积6%三氯乙酸与脱色液混合,冷藏过夜后过滤,用10% NaOH调pH至中性,减压浓缩,向浓缩液中加入3倍体积的95%乙醇4 ℃静置2 h,5000 r/min离心5 min,取其沉淀,依次用丙酮、乙醚反复洗涤,60 ℃烘干至恒重得白英多糖[11]。
1.2.2 多糖得率的测定
参考张鹏等[17]报道的方法:配置0.1 mg/mL标准葡萄糖溶液,精密吸取标准葡萄糖溶液0、0.2、0.4、0.8、1.2、1.6 mL分别置于试管中,加蒸馏水至2.0 mL,加入5%苯酚溶液1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL,置沸水浴中加热15 min,取出冷却至室温,于490 nm处测定吸光值。以浓度(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,得出线性回归方程:y=11.848x+0.0244,R²=0.9993。取0.5 g白英粉末,在预设超声条件下进行提取,抽滤,滤液转移至100 mL容量瓶内定容,得供试品溶液。准确吸取供试品溶液0.2 mL,依照上述方法测定白英多糖浓度,并依据公式计算白英多糖得率:
白英多糖得率(%)=C×V×DW×100 式中:C表示白英多糖浓度,g/mL;V表示供试品溶液体积,mL;D表示稀释倍数;W表示白英粉末质量,g。
1.2.3 单因素实验
固定超声功率120 W,超声波频率40 kHz,料液比1:30 g/mL,提取时间30 min,提取温度20 ℃,分别探究料液比(1:20、1:40、1:60、1:80、1:100 g/mL),提取时间(20、30、40、50、60、80、100 min),提取温度(40、50、60、70、80 ℃)对白英多糖得率的影响。
1.2.4 响应面试验设计
根据单因素试验结果,以料液比(A)、提取时间(B)和提取温度(C)为变量,以白英多糖得率为响应值,设计三因素三水平试验,因素与水平设计见表1。
表 1 响应面试验设计因素与水平Table 1. Factors and levels used in response surface design因素 水平 −1 0 1 A:料液比(g/mL) 1:40 1:60 1:80 B:提取时间(min) 20 40 60 C:提取温度(℃) 60 70 80 1.2.5 白英多糖的紫外光谱分析
精确配制浓度为1 mg/mL白英多糖水溶液,以纯水作空白,进行全波长扫描(200~800 nm)。
1.2.6 白英多糖的红外光谱分析
称取2 mg白英多糖,加入适量的光谱纯KBr粉末研磨混匀压片,红外光谱仪扫描范围为400~4000 cm−1,初步分析白英多糖的官能团及结构。
1.2.7 白英多糖的抗氧化活性分析
1.2.7.1 白英多糖对DPPH自由基清除能力的测定
配制不同浓度的白英多糖溶液,各取2 mL与DPPH溶液(2 mL,0.2 mmol/L)混合,在室温下避光反应30 min。以无水乙醇为空白,Vc为阳性对照,在517 nm下测定吸光值[18],重复3次,按下式计算DPPH自由基清除率:
DPPH自由基清除率(%)=(1−As−AbA0)×100 式中:As为白英多糖溶液与DPPH溶液混合后的吸光值;Ab为白英多糖溶液与无水乙醇混合后的吸光值;A0为纯水与DPPH溶液混合后的吸光值。
1.2.7.2 白英多糖对ABTS自由基清除能力的测定
配制7.4 mmol/L ABTS二铵盐储备液和2.6 mmol/L K2S2O8储备液,将上述两种储备液各取1 mL混合,避光环境下室温放置12 h,用磷酸盐缓冲液(pH7.4)将上述混合液稀释至吸光度为0.70±0.02,此溶液即为ABTS+自由基工作液。配制不同浓度的白英多糖溶液,各取0.4 mL与4 mL ABTS自由基工作液在室温下避光反应6 min,在734 nm处测定吸光值,重复3次。以Vc为对照组,利用如下公式计算ABTS+自由基清除率[19−20]:
ABTS+自由基清除率(%)=(A0−A1A0)×100 式中:A0为纯水与ABTS工作液混合后的吸光值;A1为白英多糖溶液与ABTS工作液混合后的吸光值。
1.3 数据处理
采用Origin Pro 2022软件作图,通过Design Expert 13软件对响应面数据进行模型构建和方差分析,使用SPSS Statistics 23软件进行数据差异性分析。
2. 结果与分析
2.1 单因素实验结果分析
2.1.1 料液比对白英多糖得率的影响
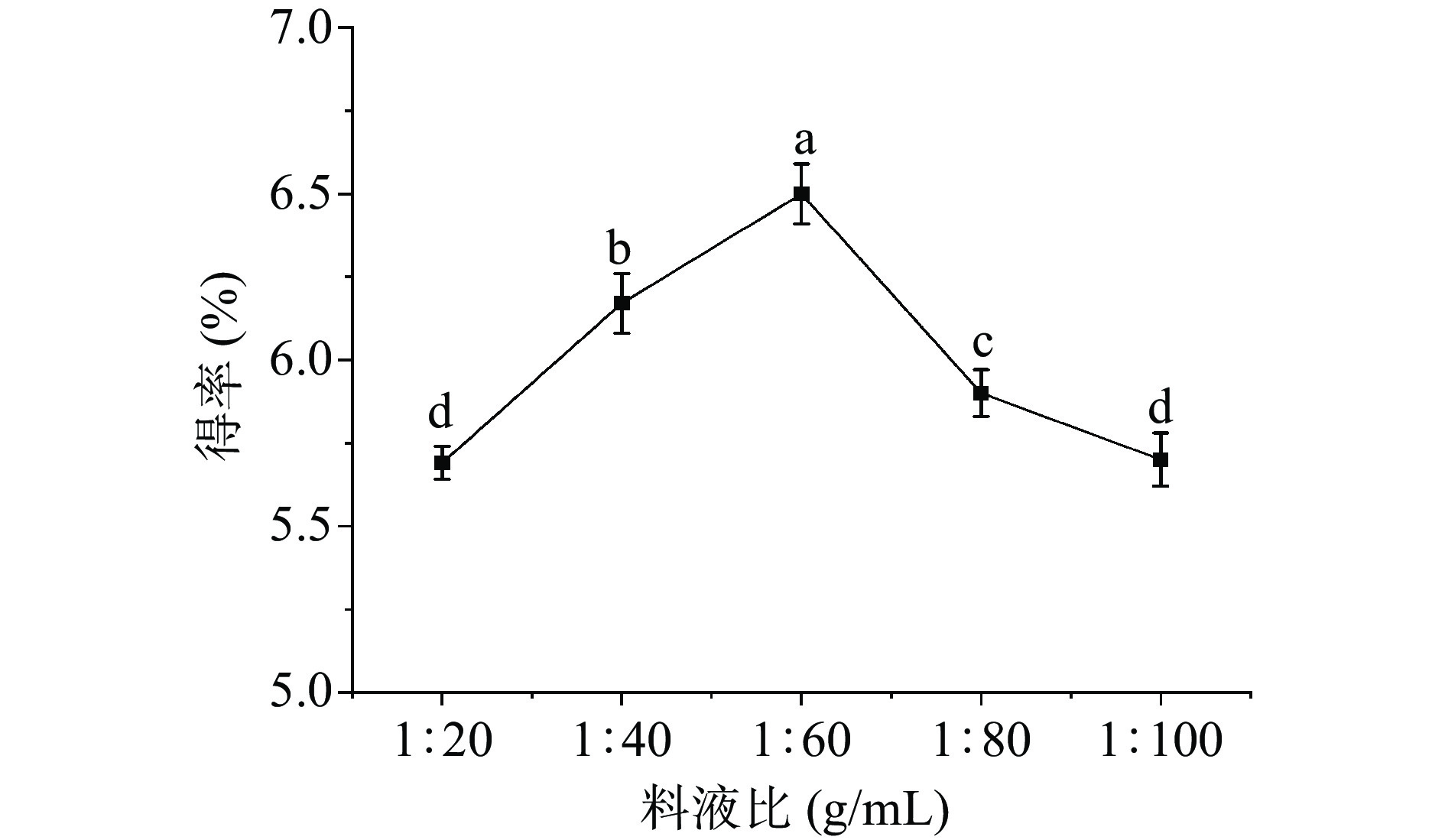
不同料液比对白英多糖得率的影响见图1。随着料液比的增大,白英多糖得率呈上升趋势,在1:60 g/mL时达到最大(6.50%±0.09%),之后白英多糖得率显著下降,可能是因为过多的水会使体系的单位空化能量降低,从而不利于白英多糖的溶出,导致多糖得率降低[21−22]。因此,响应面优化试验的料液比选择1:40、1:60、1:80 g/mL。
2.1.2 提取时间对白英多糖得率的影响
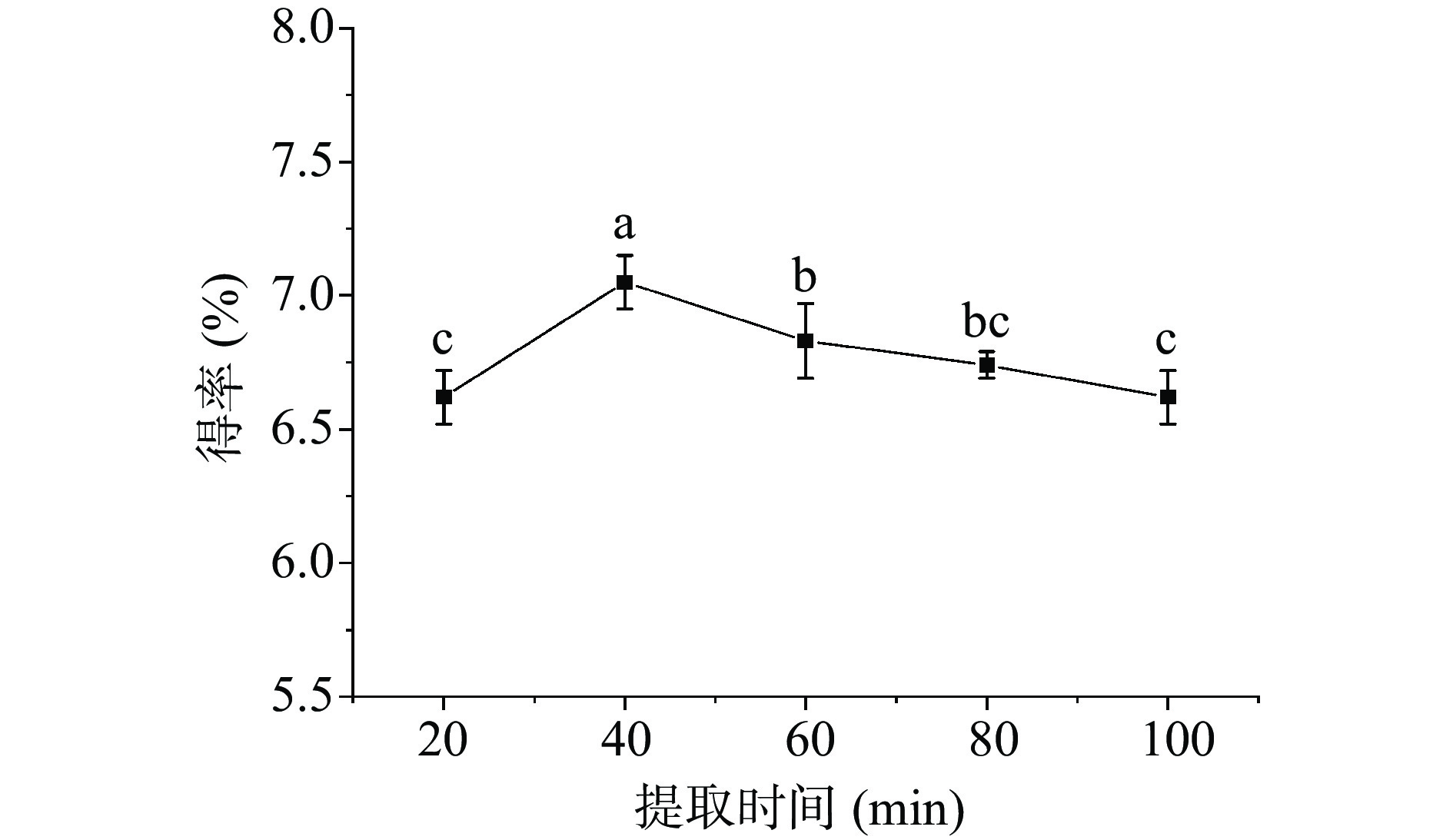
不同提取时间对白英多糖得率的影响见图2。在40 min时白英多糖得率达到最大(7.05%±0.10%),随着提取时间的延长,白英多糖得率缓慢下降,可能是因为多糖在超声时间过长后会被诱导降解,导致多糖得率下降[23]。因此,响应面试验的提取时间选择20、40、60 min。
2.1.3 提取温度对白英多糖得率的影响
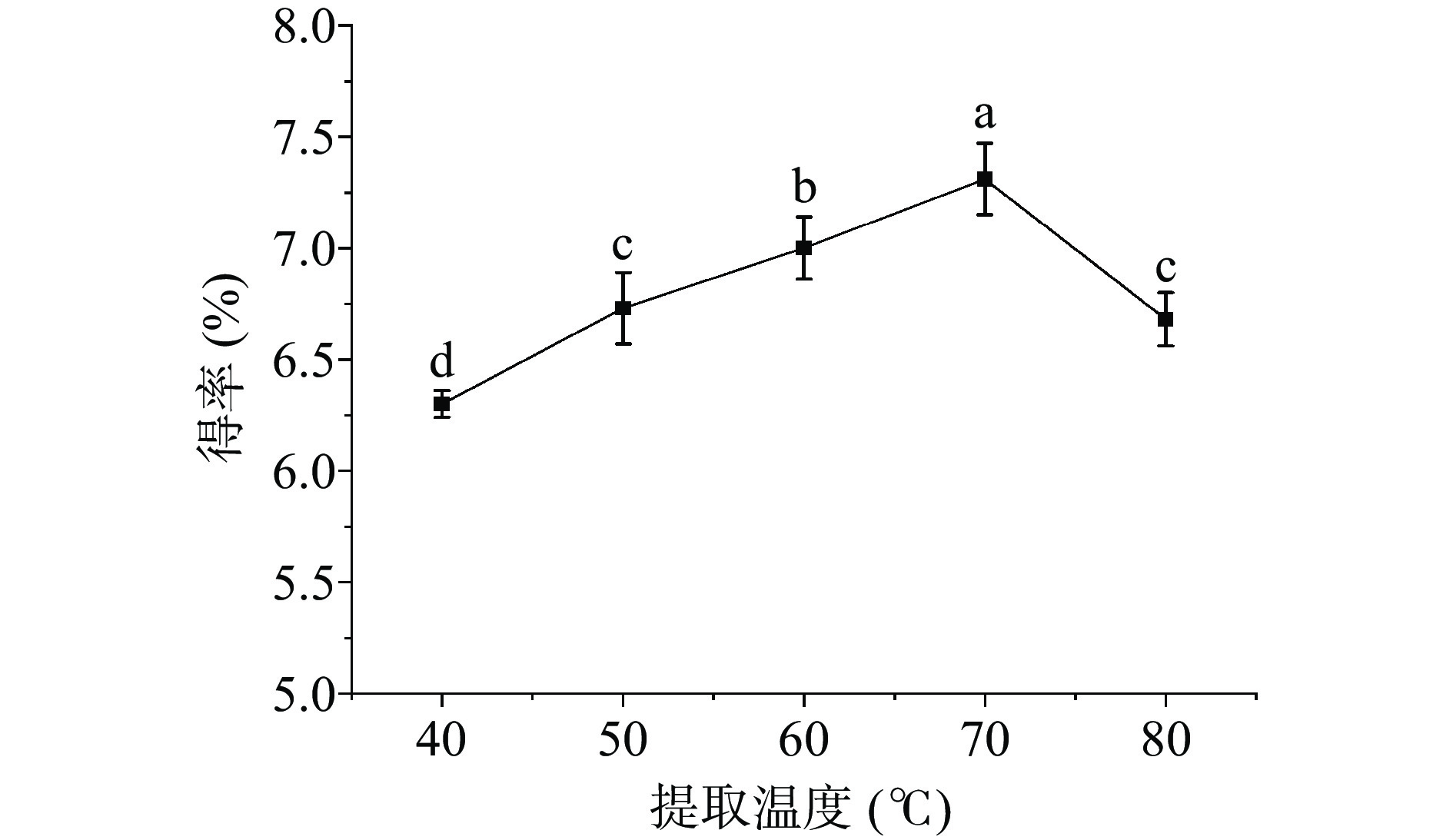
不同提取温度对白英多糖得率的影响见图3。随着提取温度升高,白英多糖的得率先上升后下降,提取温度为70 ℃时,白英多糖得率最高(7.31%±0.16%),这说明提取温度的升高会增加溶液体系内的分子热运动,有利于白英多糖的溶出;但提取温度过高,可能会使多糖糖苷键断裂,造成多糖水解从而导致得率降低[24]。因此,响应面试验的提取温度选择60、70、80 ℃。
2.2 响应面试验结果分析
2.2.1 响应面试验设计与结果
响应面试验设计及结果见表2。采用Design-Expert软件对实验数据进行二次多项拟合回归,所得模型:Y=7.13−0.1413A+0.24B−0.8688C−0.29AB−0.2425AC−0.31BC−0.2028A2−0.2602B2−1.18C2。从表3可以看出,该回归模型的P<0.0001,具有极显著差异,说明该模型具有较好的稳定性[25],失拟项P=0.8476>0.05,不显著,说明未知因素对实验结果干扰较小。模型决定系数(R2)=0.9801,调整决定系数(R2Adj)=0.9545,表明此模型拟合程度良好[26]。通过F值检验可以看出,温度对白英多糖得率影响最大,其次为时间,最后是料液比。
表 2 响应面试验设计及结果Table 2. Experimental design and results for response surface实验号 A料液比(g/mL) B提取时间(min) C提取温度(℃) Y得率(%) 1 1:80 40 80 4.55±2.65 2 1:60 40 70 6.97±0.16 3 1:60 20 60 6.03±1.75 4 1:60 60 80 4.72±1.35 5 1:40 40 80 5.18±1.91 6 1:60 40 70 7.29±0.90 7 1:60 40 70 7.31±0.47 8 1:60 20 80 4.93±2.08 9 1:80 40 60 6.79±0.54 10 1:80 20 70 6.47±0.77 11 1:40 20 70 6.31±1.06 12 1:80 60 70 6.44±0.82 13 1:40 40 60 6.45±1.37 14 1:40 60 70 7.44±1.62 15 1:60 60 60 7.06±0.83 16 1:60 40 70 6.77±0.34 17 1:60 40 70 7.30±0.37 表 3 回归模型的显著性检验及方差分析Table 3. Significance test and variance analysis of regression models来源 平方和 自由度 均值 F值 P值 显著性 模型 14.28 9 1.59 38.27 <0.0001 ** A 0.1596 1 0.1596 3.85 0.0906 B 0.4608 1 0.4608 11.11 0.0125 * C 6.04 1 6.04 145.59 <0.0001 ** AB 0.3364 1 0.3364 8.11 0.0248 * AC 0.2352 1 0.2352 5.67 0.0488 * BC 0.3844 1 0.3844 9.27 0.0187 * A² 0.1731 1 0.1731 4.17 0.0804 B² 0.2852 1 0.2852 6.88 0.0343 * C² 5.89 1 5.89 142.03 <0.0001 ** 残差 0.2903 7 0.0415 失拟项 0.0482 3 0.0161 0.2656 0.8476 纯误差 0.2421 4 0.0605 总和 14.57 16 R2=0.9801 RAdj2=0.9545 注:*代表差异显著,P<0.05;**代表差异极显著,P<0.01。 2.2.2 各因素响应面分析
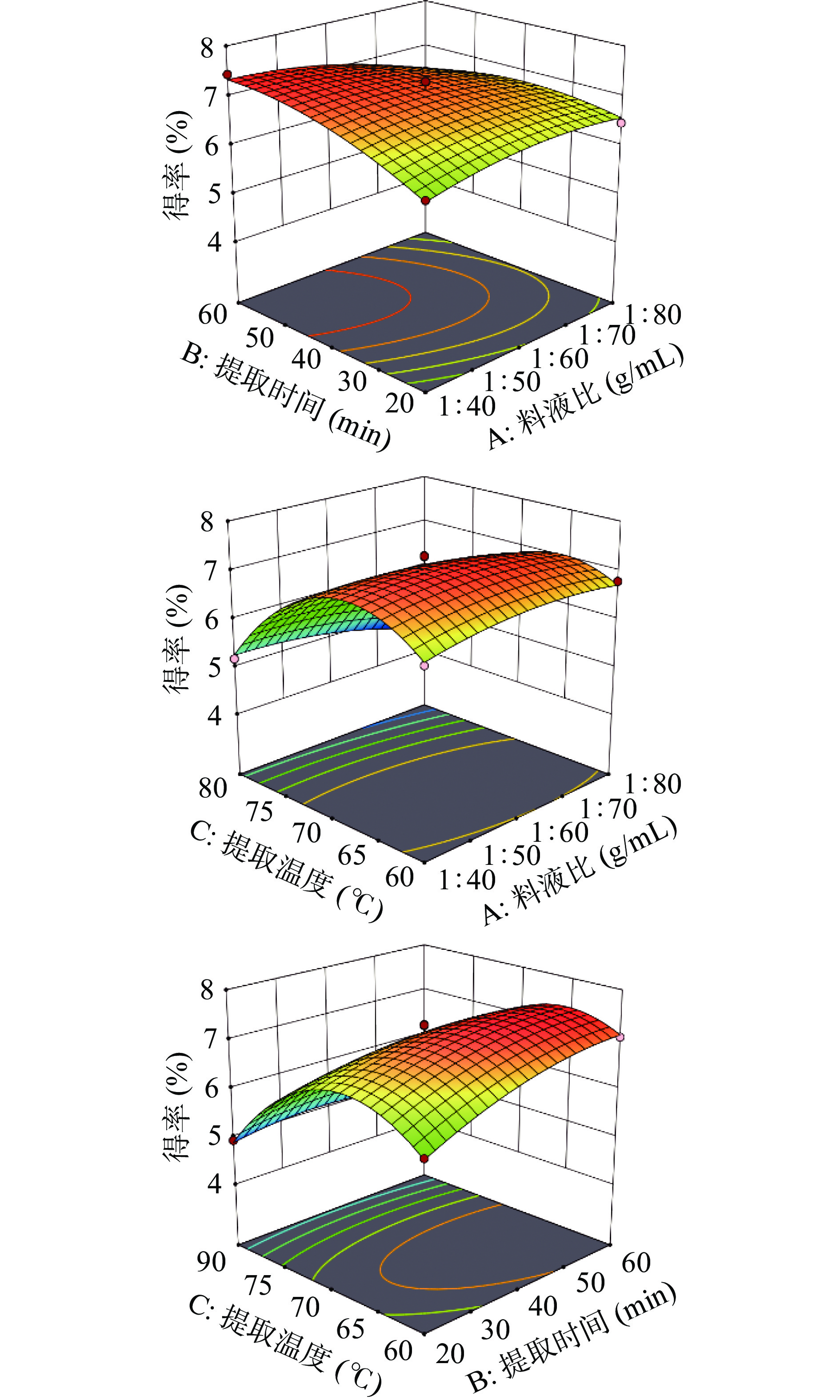
采用Design-Expert程序对响应面试验的结果作曲面图,同时分析各因素之间的交互作用。响应面图中曲面越弯曲表明研究因素对结果影响越大[27],等高线的形状呈椭圆形表明研究因素之间的交互作用影响显著,呈圆形则说明交互作用影响不显著[28]。由图4可知,温度与料液比和温度与时间的响应面曲面的弯曲程度较大且均向温度弯曲,其等高线图为椭圆形,说明这两种交互作用对白英多糖得率的影响显著,温度对于白英多糖提取的影响最为显著,与方差分析F值检验所得结果一致。
2.2.3 最优提取工艺验证
Design-Expert 软件给出的最优白英多糖提取条件为提取温度65.18 ℃、提取时间57.95 min、料液比1:57.15 g/mL,预测的得率为7.448%。根据实际操作可行性,调整提取温度65 ℃、提取时间58 min、料液比为1:57 g/mL,在此条件下白英多糖实测得率为7.54%±0.12%,与预测值差异较小。该结果与王林江等[10]、杨惠麟[11]、Wu等[12]用沸水抽提的结果(1.84%、0.96%、2.37%)相比有较大提升。与Wu等[12]的提取时间(5 h)相比有较大的优化。说明与沸水抽提法相比较,超声波辅助提取可有效提高白英多糖的得率,同时缩短提取时间。
2.3 白英粗多糖的紫外和傅里叶变换光谱分析
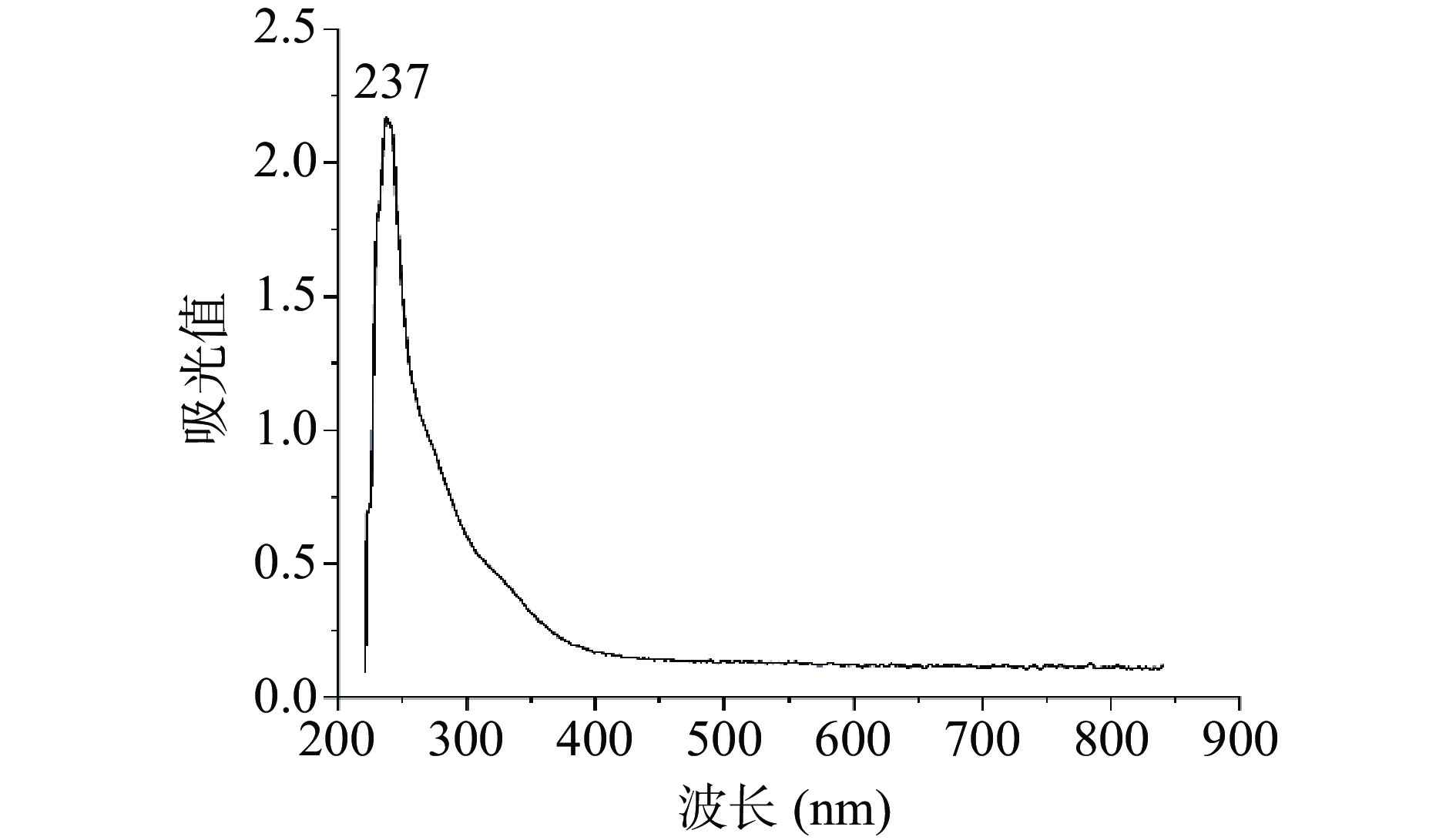
白英多糖紫外光谱图见图5。白英多糖样品在237 nm处有最大吸收峰,说明样品中可能含有不饱和羰基、羧基等[29]。在260和280 nm处没有明显的吸收峰,说明白英多糖提取物中的核酸和蛋白质已去除。
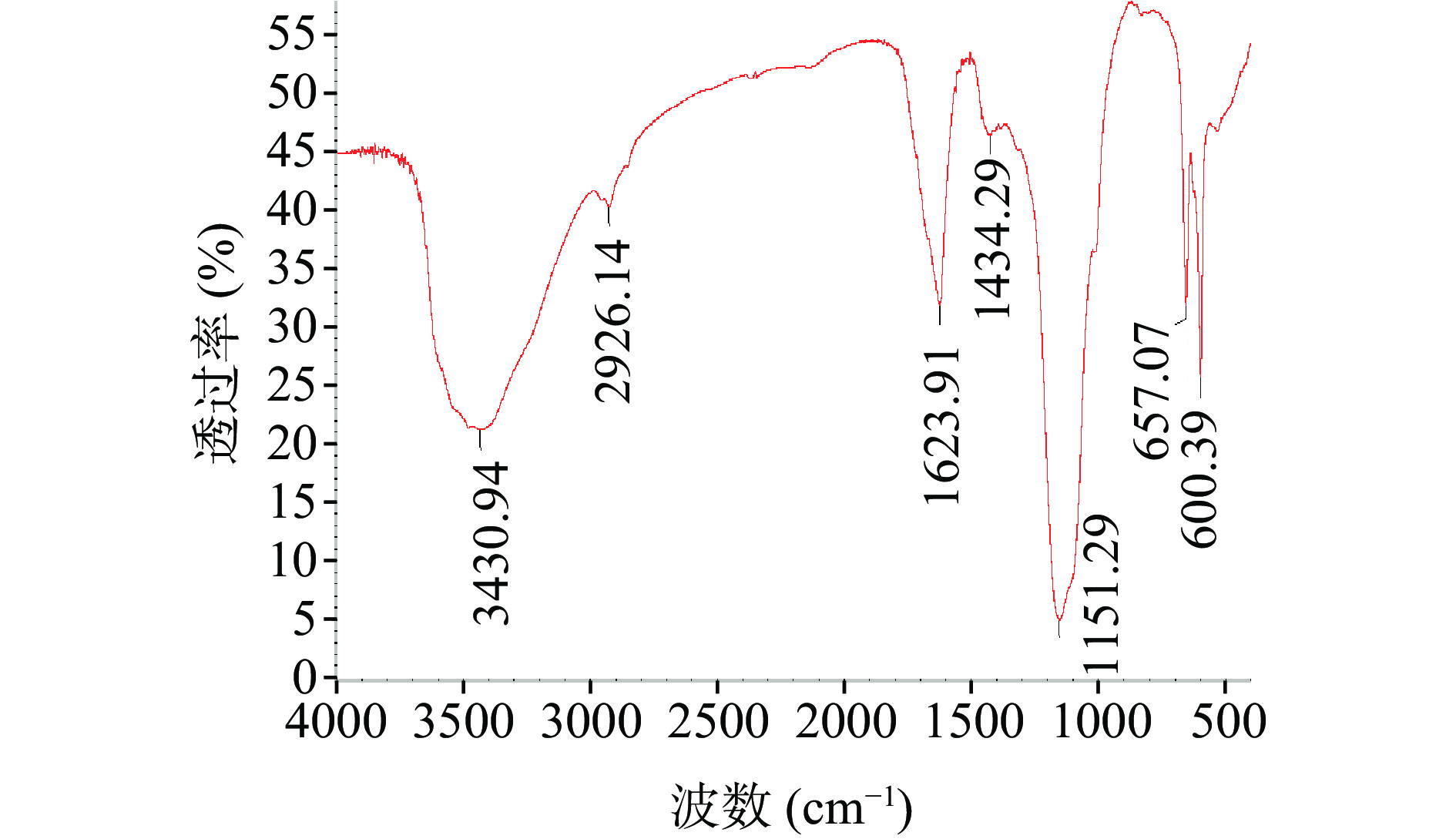
白英多糖的红外光谱结果见图6。3430.94 cm−1附近的宽而强的吸收峰是由O-H键的伸缩振动引起,此为多糖的特征吸收峰[30]。2926.14 cm−1处的吸收峰是由糖环上C-H键的对称伸缩振动引起[31],1623.91和1434.29 cm−1处的吸收峰为羧基和羰基引起,表明白英多糖中存在糖醛酸结构[32],1151.29 cm−1处的峰为糖苷键C-O-C的伸缩振动引起[33]。400~900 cm−1处有强吸收峰,表明存在吡喃糖环结构[34]。综上,红外光谱表明样品具有糖类化合物的特征峰,可以判断为糖类化合物。这与毛建山等[16]研究结果相似。
2.4 白英粗多糖的体外抗氧化活性分析
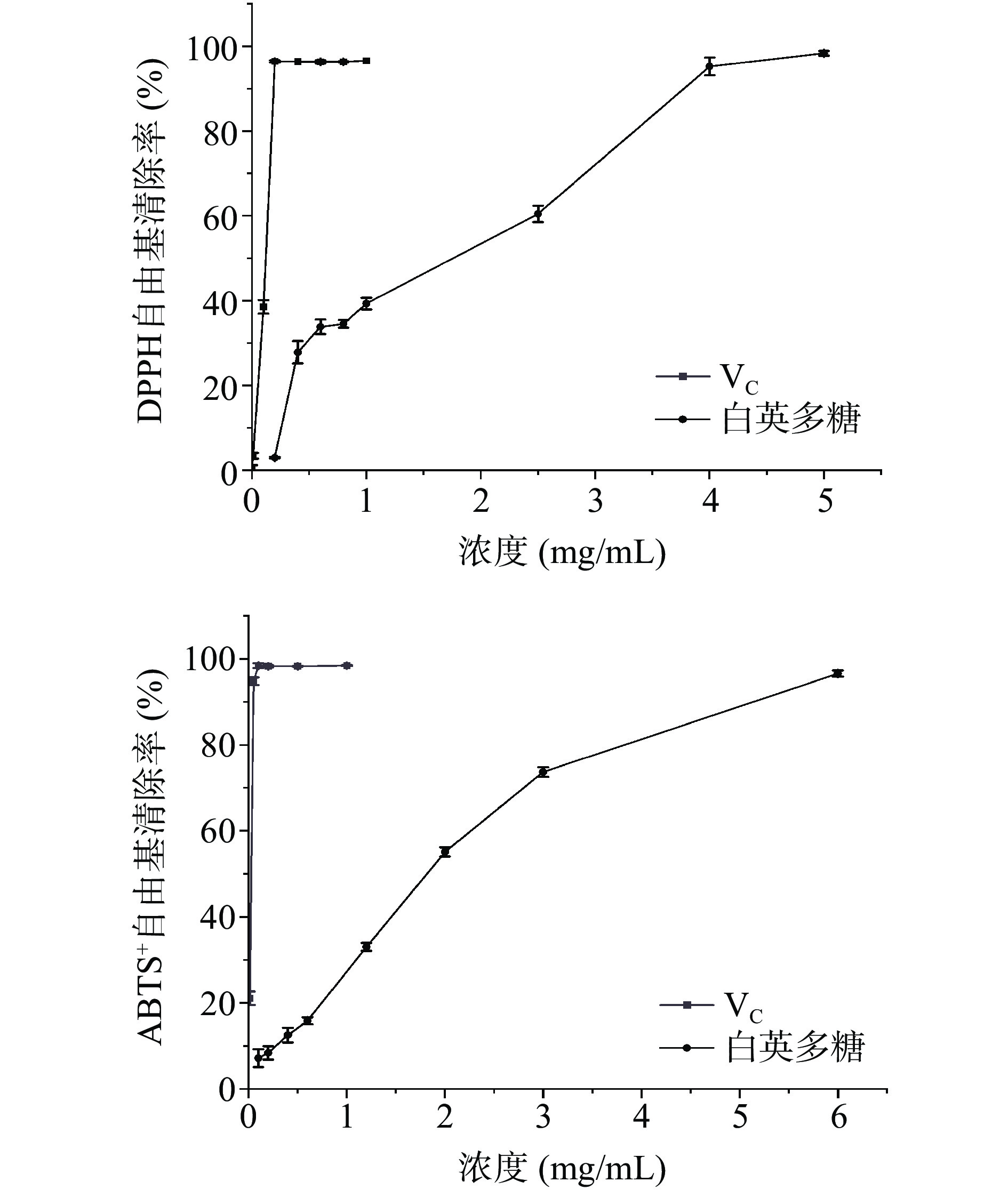
图7为白英多糖体外抗氧化活性结果。白英多糖在浓度0.2~5.0 mg/mL和0.1~6.0 mg/mL时分别具有较强的DPPH和ABTS+自由基清除活性,均呈现出明显的剂量效应关系。白英多糖浓度越高,其抗氧化能力越强;在浓度为5.0 mg/mL时其对DPPH自由基的清除率最大,达到98.35%±0.54%;在浓度为6.0 mg/mL时其对ABTS+自由基的清除率最大,为96.57%±0.79%。白英多糖对DPPH和ABTS+自由基的半抑制浓度(IC50)分别为1.104、1.408 mg/mL,表明白英多糖具有良好的体外抗氧化活性。
3. 结论
本研究采用超声波法辅助提取白英粗多糖,用苯酚-硫酸法测定白英粗多糖含量。在单因素实验的基础上,利用Box-Behnken响应面法优化试验设计,得到最佳的白英粗多糖提取工艺为:料液比1:57 g/mL、提取时间58 min、提取温度65 ℃。最后所得白英粗多糖得率为7.54%±0.12%,与预测值差距较小,说明该提取工艺稳定可靠。通过紫外和傅里叶变换红外光谱扫描发现,白英粗多糖具有典型的多糖光谱吸收峰,其中含有糖醛酸,说明白英多糖可能为酸性多糖。白英粗多糖对DPPH自由基和ABTS+自由基的半抑制浓度(IC50)分别为1.104、1.408 mg/mL,说明白英粗多糖具有良好的抗氧化活性。本研究为白英粗多糖的提取提供了一种高效的提取方法,为白英多糖的进一步开发提供了理论依据。但白英多糖的主要片段、单糖组成、分子量分布、构象仍有待进一步深入研究。
-
表 1 响应面试验设计因素与水平
Table 1 Factors and levels used in response surface design
因素 水平 −1 0 1 A:料液比(g/mL) 1:40 1:60 1:80 B:提取时间(min) 20 40 60 C:提取温度(℃) 60 70 80 表 2 响应面试验设计及结果
Table 2 Experimental design and results for response surface
实验号 A料液比(g/mL) B提取时间(min) C提取温度(℃) Y得率(%) 1 1:80 40 80 4.55±2.65 2 1:60 40 70 6.97±0.16 3 1:60 20 60 6.03±1.75 4 1:60 60 80 4.72±1.35 5 1:40 40 80 5.18±1.91 6 1:60 40 70 7.29±0.90 7 1:60 40 70 7.31±0.47 8 1:60 20 80 4.93±2.08 9 1:80 40 60 6.79±0.54 10 1:80 20 70 6.47±0.77 11 1:40 20 70 6.31±1.06 12 1:80 60 70 6.44±0.82 13 1:40 40 60 6.45±1.37 14 1:40 60 70 7.44±1.62 15 1:60 60 60 7.06±0.83 16 1:60 40 70 6.77±0.34 17 1:60 40 70 7.30±0.37 表 3 回归模型的显著性检验及方差分析
Table 3 Significance test and variance analysis of regression models
来源 平方和 自由度 均值 F值 P值 显著性 模型 14.28 9 1.59 38.27 <0.0001 ** A 0.1596 1 0.1596 3.85 0.0906 B 0.4608 1 0.4608 11.11 0.0125 * C 6.04 1 6.04 145.59 <0.0001 ** AB 0.3364 1 0.3364 8.11 0.0248 * AC 0.2352 1 0.2352 5.67 0.0488 * BC 0.3844 1 0.3844 9.27 0.0187 * A² 0.1731 1 0.1731 4.17 0.0804 B² 0.2852 1 0.2852 6.88 0.0343 * C² 5.89 1 5.89 142.03 <0.0001 ** 残差 0.2903 7 0.0415 失拟项 0.0482 3 0.0161 0.2656 0.8476 纯误差 0.2421 4 0.0605 总和 14.57 16 R2=0.9801 RAdj2=0.9545 注:*代表差异显著,P<0.05;**代表差异极显著,P<0.01。 -
[1] 乔曼华, 张林果. 白毛藤化学成分及其抗肿瘤活性[J]. 中成药,2022,44(9):2854−2861 doi: 10.3969/j.issn.1001-1528.2022.09.019 QIAO M H, ZHANG L G. Chemical constituents from Solanum lyratum and their antitumor activities[J]. Chinese Traditional Patent Medicine,2022,44(9):2854−2861. doi: 10.3969/j.issn.1001-1528.2022.09.019
[2] ZHANG C, LI Z M, WANG J, et al. Ethanol extracts of Solanum lyratum Thunb regulate ovarian cancer cell proliferation, apoptosis, and epithelial-to-mesenchymal transition (emt) via the ROS-mediated p53 pathway[J]. Journal of Immunology Research,2021,2021(Pt.2):5569354.
[3] 魏国栋, 高山. 白英的有效部位和药理作用研究进展[J]. 中国医药导报,2022,19(11):38−41 doi: 10.3969/j.issn.1673-7210.2022.11.yycyzx202211009 WEI G D, GAO S. Progress of effective parts and pharmacological action of Solanum lyratum Thunb[J]. China Medical Herald,2022,19(11):38−41. doi: 10.3969/j.issn.1673-7210.2022.11.yycyzx202211009
[4] LIU X, WANG F L, CHEN Y R, et al. Research progress on chemical components and pharmacological action of Solanum l yratum Thunb[J]. The Journal of Pharmacy and Pharmacology,2023,75(3):328−362. doi: 10.1093/jpp/rgac099
[5] TADAYOSHI Y. Pill preparation of specifically added Chinese herbal remedy of cinnamon bark and powdered hoelen and production thereof: JP, H03127736A[P]. 2023-08-31.
[6] 杨惠麟, 孙志良, 丁榕, 等. 白毛藤多糖的提取及体外抑菌试验[J]. 中兽医医药杂志,2005(4):24−25 doi: 10.3969/j.issn.1000-6354.2005.04.010 YANG H L, SUN Z L, DING R, et al. Extraction and in vitro antibacterial test of polysaccharides from Solanum lyratum[J]. Journal of Traditional Chinese Veterinary Medicine,2005(4):24−25. doi: 10.3969/j.issn.1000-6354.2005.04.010
[7] FENG Y Y, WANG W, LIU C H. Effect of Solanum lyratum polysaccharide on malignant behaviors of lung cancer cells by regulating the Circ_UHRF1/miR-513b-5p Axis[J]. Cellular and Molecular Biology (Noisy-le-Grand, France),2022,67(6):191−199. doi: 10.14715/cmb/2021.67.6.26
[8] 王婷婷, 郑学香, 曾真, 等. 白毛藤多糖通过调控miR-1270/CCNG2通路抑制肺癌细胞增殖、促进细胞凋亡的机制[J]. 中国老年学杂志,2021,41(19):4382−4387 doi: 10.3969/j.issn.1005-9202.2021.19.067 WANG T T, ZHENG X X, ZENG Z, et al. The mechanism of Solanum lyratum polysaccharide inhibiting lung cancer cell proliferation and promoting cell apoptosis by regulating the miR-1270/CCNG2 pathway[J]. Chinese Journal of Gerontology,2021,41(19):4382−4387. doi: 10.3969/j.issn.1005-9202.2021.19.067
[9] 张燕, 孙志良, 陈小军. 从组织学角度研究白毛藤多糖对鸡免疫器官的影响[J]. 畜牧兽医科技信息,2007(8):24−25 doi: 10.3969/j.issn.1671-6027.2007.08.019 ZHANG Y, SUN Z L, CHEN X J. Study on the effects of polysaccharides from Solanum lyratum on the immune organs of chicken from a histological perspective[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine,2007(8):24−25. doi: 10.3969/j.issn.1671-6027.2007.08.019
[10] 王林江, 雷倩, 马双良, 等. 不同产地白英中多糖含量的测定[J]. 时珍国医国药,2010,21(9):2176−2177 doi: 10.3969/j.issn.1008-0805.2010.09.020 WANG L J, LEI Q, MA X L, et al. Determination of polysaccharide content in Solanum lyratum from different producing areas[J]. Lishizhen Medicine and Materia Medica Research,2010,21(9):2176−2177. doi: 10.3969/j.issn.1008-0805.2010.09.020
[11] 杨惠麟. 白毛藤多糖的提取及其药效学的初步研究[D]. 长沙:湖南农业大学, 2006 YANG H L. Study on the extraction and pharmacodynamics of Solanum Lyratum Thunb polysaccharides[D]. Changsha:Hunan Agricultural University, 2006.
[12] WU Y L, PAN Y J, SUN C R. Isolation, purification and structural investigation of a water-soluble polysaccharide from Sola num lyratum Thunb[J]. International Journal of Biological Macromolecules,2005,36(4):241−245. doi: 10.1016/j.ijbiomac.2005.06.007
[13] YANG J, TONG Y P, ZHU K M, et al. Optimization of mechanochemical-assisted extraction and decoloration by resins of polysaccharides from petals of Crocus sativus L[J]. Journal of Food Processing and Preservation,2018,42(1):e13369.1−e13369.11.
[14] CHEN X, ZHANG H B, DU W Q, et al. Comparison of different extraction methods for polysaccharides from Crataegus pinnatifida Bunge[J]. International Journal of Biological Macromolecules,2020,150:1011−1019. doi: 10.1016/j.ijbiomac.2019.11.056
[15] KUO W W, HUANG C Y, CHUNG J G, et al. Crude extracts of Solanum lyratum protect endothelial cells against oxidized low-density lipoprotein-induced injury by direct antioxidant action[J]. Journal of Vascular Surgery,2009,50(4):849−860. doi: 10.1016/j.jvs.2009.06.046
[16] 毛建山, 吴亚林, 黄静, 等. 白毛藤多糖的分离、纯化和鉴定[J]. 中草药,2005(5):654−656 doi: 10.3321/j.issn:0253-2670.2005.05.006 MAO J S, WU Y L, HUANG J, et al. Isolation, purification, and identification of polysaccharides from Solanum lyratum[J]. Chinese Traditional and Herbal Drugs,2005(5):654−656. doi: 10.3321/j.issn:0253-2670.2005.05.006
[17] 张鹏, 花燕莹, 唐森, 等. 微波辅助提取龙葵果多糖及抗氧化活性研究[J]. 粮食与油脂,2021,34(10):74−78,91 doi: 10.3969/j.issn.1008-9578.2021.10.018 ZHANG P, HUA Y Y, TANG S, et al. Study on microwave-assisted extraction and antioxidant activity of polysaccharides from Solanum nigrum L. fruit[J]. Cereals & Oils,2021,34(10):74−78,91. doi: 10.3969/j.issn.1008-9578.2021.10.018
[18] 刘宇, 戴沅霖, 马越, 等. 金银花粗多糖提取工艺优化及其抗氧化活性评价[J]. 食品工业科技,2023,44(7):188−196 LIU Y, DAI Y L, MA Y, et al. Extraction process optimization and antioxidant activity evaluation of crude polysaccharides from Lonicera japonica[J]. Science and Technology of Food Industry,2023,44(7):188−196.
[19] LI X, OUYANG X, CAI R, er al. 3',8″-Dimerization enhances the antioxidant capacity of flavonoids:Evidence from acacetin and isoginkgetin[J]. Molecules,2019,24(11):2039. doi: 10.3390/molecules24112039
[20] MENG Q, CHEN Z, CHEN F, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from Hemerocallis citrina and the antioxidant activity study[J]. Journal of Food Science,2021,86(7):3082−3096. doi: 10.1111/1750-3841.15806
[21] GU J Y, ZHANG H H, ZHANG J X, et al. Optimization, characterization, rheological study and immune activities of polysaccharide from Sagittaria sagittifolia L[J]. Carbohydrate Polymers,2020,246:116595. doi: 10.1016/j.carbpol.2020.116595
[22] 李倩倩, 程婷婷, 刘涵, 等. 刺梨果多糖提取工艺优化及抗氧化活性研究[J]. 粮食与油脂,2022,35(11):104−108,113 doi: 10.3969/j.issn.1008-9578.2022.11.022 LI Q Q, CHEN T T, LIU H, et al. Study on the extraction technology and antioxidant activity of polysaccharides from Rosa roxburghii Tratt. fruit[J]. Cereals & Oils,2022,35(11):104−108,113. doi: 10.3969/j.issn.1008-9578.2022.11.022
[23] WANG Y Y, WANG X Y, XIONG Y, et al. Extraction optimization, separation and antioxidant activity of Luffa cylindrica polysaccharides[J]. Food and Bioproducts Processing,2019,116:98−104. doi: 10.1016/j.fbp.2019.04.014
[24] 李楠, 李桂芬, 刘亚琴, 等. 响应面法优化超声提取柳罐枣多糖及其光谱性质研究[J]. 中国食品添加剂,2022,33(5):57−63 LI N, LI G F, LIU Y Q, et al. Optimization of ultrasonic extraction of polysaccharides from Liuguan jujube by response surface methodology and analysis of its spectral properties[J]. China Food Additives,2022,33(5):57−63.
[25] 骆杨庆, 吴增林, 李升福, 等. 响应面法优化玉米浸液蛋白提取工艺及单细胞蛋白发酵的研究[J]. 食品工业科技,2022,43(10):231−237 LUO Y Q, WU Z L, LI S F, et al. Study on extraction process of corn steep liquor protein by response surface methodology and single cell protein fermentation[J]. Science and Technology of Food Industry,2022,43(10):231−237.
[26] 高丹丹, 郭鹏辉, 祁高展, 等. 响应面法优化薄荷全草总黄酮的提取工艺[J]. 食品工业科技,2015,36(2):299−303,322 doi: 10.13386/j.issn1002-0306.2015.02.056 GAO D D, GUO P H, QI G Z, et al. Optimization of extraction technology of total flavonoids from Mentha haplocalyx by response surface methodology[J]. Science and Technology of Food Industry,2015,36(2):299−303,322. doi: 10.13386/j.issn1002-0306.2015.02.056
[27] 张小辉, 卫梦尧, 杨永志, 等. 响应面法优化铁皮石斛多糖纯化工艺[J]. 食品工业科技,2021,42(16):177−184 ZHANG X H, WEI M Y, YANG Y Z, et al. Optimization of purification process of polysaccharides from Dendrobium officinale by response surface methodology[J]. Science and Technology of Food Industry,2021,42(16):177−184.
[28] 庞会娜, 董红影, 肖凤琴, 等. 响应面法优化葛根蛋白酶解工艺及其体外抗氧化特性分析[J]. 食品工业科技,2022,43(24):197−204 PANG H N, DONG H Y, XIAO F Q, et al. Optimization of enzymatic hydrolysis process of Pueraria protein by response surface methodology and its antioxidant properties in vitro[J]. Science and Technology of Food Industry,2022,43(24):197−204.
[29] WANG Y F, XIAN J H, XI X G, et al. Multi-fingerprint and quality control analysis of tea polysaccharides[J]. Carbohydrate Polymers,2013,92(1):583−590. doi: 10.1016/j.carbpol.2012.09.004
[30] HUANG H, HUANG G. Extraction, separation, modification, structural characterization, and antioxidant activity of plant polysaccharides[J]. Chemical Biology & Drug Design,2020,96(5):1209−1222.
[31] WANG X L, ZHANG Y F, LIU Z K, et al. Purification, characterization, and antioxidant activity of polysaccharides isolated from Cortex Periplocae[J]. Molecules,2017,22(11):1866. doi: 10.3390/molecules22111866
[32] QIN H N, HUANG L, TENG J W, et al. Purification, characterization, and bioactivity of Liupao tea polysaccharides before and after fermentation[J]. Food Chemistry,2021,353:129419. doi: 10.1016/j.foodchem.2021.129419
[33] TANG M Y, HOU F, WU Y W, et al. Purification, characterization and tyrosinase inhibition activity of polysaccharides from chestnut ( Castanea mollissima Bl.) kernel[J]. International Journal of Biological Macromolecules,2019,131:309−314. doi: 10.1016/j.ijbiomac.2019.03.065
[34] CAI W R, XIE L L, CHEN Y. Purification, characterization and anticoagulant activity of the polysaccharides from green tea[J]. Carbohydrate Polymers,2013,92(2):1086−1090. doi: 10.1016/j.carbpol.2012.10.057
-
期刊类型引用(14)
1. 邱月,王旭骅,谢雪华,丁玉庭,吕飞. 低温等离子体杀菌对肉品食用品质的影响规律与机制研究进展. 食品与发酵工业. 2024(06): 332-340 .  百度学术
百度学术
2. 吴家秀,郭雪滢,刘旭,赵玉华. 鲜食甘栗冷等离子体杀菌工艺优化及其品质分析. 食品科技. 2024(03): 25-33 .  百度学术
百度学术
3. 孙嘉莉,王英,敖羽,张文乐,张绍君,包晓玮. 沿面放电等离子体灭活苹果汁中耐高渗酵母的模型. 食品科学. 2024(08): 161-167 .  百度学术
百度学术
4. 杜曼婷,游紫燕,黄俐,李可,栗俊广,白艳红. 介质阻挡放电低温等离子体处理对宰后羊肉色泽和氧化稳定性的影响. 食品科学. 2024(13): 190-197 .  百度学术
百度学术
5. 刘爱民,仝潇洋,张怡,乔勇进. 浅议预制菜产业技术风险分析与对策. 农产品加工. 2024(22): 19-24 .  百度学术
百度学术
6. 徐迪莎,丁怡萱,廖月琴,贾俊琦,董儒仪,苏浩恩,张宾,林慧敏. 低温等离子体对蓝圆鲹在冷藏过程中的品质影响. 食品安全质量检测学报. 2023(13): 266-273 .  百度学术
百度学术
7. 程腾,薛冬,郑凯茜,相启森,白艳红. 冷等离子体处理对生鲜鸡胸肉杀菌效果及品质影响. 包装工程. 2023(13): 84-92 .  百度学术
百度学术
8. 程腾,薛冬,冯坤,吕静,相启森. 大气压冷等离子体在即食肉制品中的应用研究进展. 食品工业科技. 2023(15): 427-433 .  本站查看
本站查看
9. 应可沁,李子言,程序,钱婧,章建浩,严文静. 等离子体活化水作为解冻介质对牛肉杀菌效能及品质的影响. 食品工业科技. 2022(02): 338-345 .  本站查看
本站查看
10. 张关涛,张东杰,李娟,王洪江,金露达,关宇航,徐敏琳. 低温等离子体技术在食品杀菌中应用的研究进展. 食品工业科技. 2022(12): 417-426 .  本站查看
本站查看
11. 郭依萍,李冉,叶可萍,李仲情,陈永芳,张园园. 气调包装协同低温等离子体杀菌对狮子头保鲜效果的影响. 核农学报. 2022(09): 1815-1825 .  百度学术
百度学术
12. 岑南香,刘宸成,陈姑,桑晓涵,符婉丽,刘雅夫,王佳媚. 低温等离子体处理对羊肉脂质与蛋白质氧化性质的影响. 食品工业科技. 2022(14): 85-93 .  本站查看
本站查看
13. 姜竹茂,桑晓涵,潘芸芸,陈增鑫,王佳媚,位正鹏,杨青,王金梅. 低温等离子体对鲅鱼脂质与蛋白质氧化的影响. 食品与发酵工业. 2022(23): 217-224 .  百度学术
百度学术
14. 钱婧,王晨,严文静,章建浩. 天然精油协同等离子体对盐水鸭杀菌保鲜及脂质氧化的调控. 肉类研究. 2022(11): 23-28 .  百度学术
百度学术
其他类型引用(9)





 下载:
下载:
 下载:
下载:



