Research Progress of Glucansucrase from Lactic Acid Bacteria
-
摘要: 葡聚糖蔗糖酶(Glucansucrase)(EC.2.4.5.1)是一类α-转糖苷酶(Glucosyltransferase),主要由明串珠菌属(Leuconostoc)、链球菌属(Streptococcus)及乳杆菌属(Lactobacillus)等乳酸菌产生。葡聚糖蔗糖酶的结构和催化机制具有多样性,是生物合成胞外多糖的一种重要工具酶。本文主要综述了乳酸菌葡聚糖蔗糖酶的来源、分类、结构、反应机制,以及介绍培养基组成、培养条件对酶产量的影响,重点阐述葡聚糖蔗糖酶的优化方法、分离纯化过程及酶学性质,并对其发展趋势进行展望,以期为葡聚糖蔗糖酶在相关领域开展研究提供参考。Abstract: Glucansucrase (EC.2.4.5.1) is a class of α-glucosyltransferases, mainly produced by lactic acid bacteria such as Leuconostoc, Streptococcus and Lactobacillus. The structure and catalytic mechanism of glucansucrase are diverse, and it is an important tool enzyme for the biosynthesis of exopolysaccharide. This article mainly reviews the source, classification, structure and reaction mechanism of glucansucrase and the effects of medium composition, culture conditions on the production of glucansucrase, with a focus on the optimization methods, separation and purification processes, and enzymatic properties of glucansucrase, and prospects for its development trend. This article aims to provide reference for the research of glucansucrase in related fields.
-
Keywords:
- glucansucrase /
- structure /
- catalytic mechanism /
- optimization /
- isolation and purification /
- application
-
葡聚糖蔗糖酶(Glucansucrase)(EC.2.4.5.1)又称葡糖基转移酶(Glucosyltransferase,GTF),也称为蔗糖-6-葡糖基转移酶,是糖苷水解酶70(GH70)家族的一员[1]。葡聚糖蔗糖酶来源广泛,相较于动植物来源的葡聚糖蔗糖酶,微生物分泌的葡聚糖蔗糖酶具有成本低,易获得等优点,并且能够以蔗糖为底物合成分子量不同的葡聚糖和功能性低聚糖。乳酸菌作为公认安全的菌株,产生的葡聚糖蔗糖酶分子量在120~200 kDa左右,是目前生产α-葡聚糖和低聚糖的主要来源菌株。葡聚糖及低聚糖作为潜在的益生元,因卓越的生理功能被广泛应用于食品、医疗、化工等领域[2−3]。然而天然菌株葡聚糖蔗糖酶产量低、活性较弱,制约其在多种领域中的广泛应用,因此开发新技术和新方法来提高葡聚糖蔗糖酶的产量和活性是目前研究的热点。
根据催化产生葡聚糖的种类,葡聚糖蔗糖酶可分为右旋糖酐蔗糖酶(Dextransucrase,DSR)、变聚糖蔗糖酶(Mutansucrases,MSR)[4]、交替糖蔗糖酶(Alternansucrose,ASR)、淀粉蔗糖酶(Amylosucrase,AS)[5]和罗伊糖蔗糖酶(Reuteransucrases,RSR)[6]。能够产葡聚糖蔗糖酶的菌株包括:明串珠菌属(Leuconostoc)[7]、乳杆菌属(Lactobacillus)[8]、魏斯氏菌属(Weissella)[9]、链球菌属(Strptococcus)[10]、奈瑟氏菌属(Neisseria)[11]和双歧杆菌属(Bifidobacterium)[12]等,其中Leuconostoc是目前葡聚糖蔗糖酶的主要产生菌[13−15]。Leuconostoc为革兰氏阳性菌,菌落较小,有些菌株可形成荚膜,通常最佳生长温度为25 ℃,是一种广泛应用在乳制品中的乳酸菌。肠膜明串珠菌(Leuconostoc mesenteroide)作为Leuconostoc的主要种属,包含三个亚种:肠膜明串珠菌肠膜亚种(Leuconostoc mesenteroides subsp. mesenteroides)、肠膜明串珠菌乳脂亚种(Leuconostoc mesenteroides subsp. cremoris)和肠膜明串珠菌右旋葡聚糖亚种(Leuconostoc mesenteroides subsp. dextranicum)及Ln. mesenteroides subsp. suionicum[16]。
虽然乳酸菌葡聚糖蔗糖酶来源广泛,但不同种属来源的葡聚糖蔗糖酶在结构和功能上具有多样性,进而影响葡聚糖的生物合成过程及功能特性。到目前为止,乳酸菌葡聚糖的生物合成机制仍未得到解析,因此探究葡聚糖蔗糖酶的结构、催化机制及酶学特性,将有助于全面揭示乳酸菌葡聚糖的生物合成机制和构效关系,促进糖生物学的进一步发展。
1. 葡聚糖蔗糖酶的结构及催化机制
1.1 葡聚糖蔗糖酶的结构
葡聚糖蔗糖酶能够以蔗糖为底物合成不同分子量的α-葡聚糖,不同来源的葡聚糖蔗糖酶的结构具有高度的相似性。同GH13家族类似,GH70家族的酶体系构架含有(β/α)8管状结构[17−18],合成的多糖一般有两个特点:分子量大小基本在106 Da以上;糖单元通过不同的共价键连接在一起,如α-1,6、α-1,3、α-1,4、α-1,2等。由α-1,6键连接的多糖,称为右旋糖酐,能够合成右旋糖酐的右旋糖苷蔗糖酶主要存在于Leuconostoc中,其中Ln. mesenteroide葡萄糖蔗糖酶能够催化合成由α-1,6糖苷键连接的葡萄糖[19]。变形聚糖蔗糖酶首先在变形链球菌(Streptococcus mutans)AHT中被发现,经过它合成的变形聚糖具有α-1,3糖苷键[13]。Ln. mesenteroide NRRL B-1355分泌的交替蔗糖酶可催化由α-1,3和α-1,6糖苷键交替连接的糖的合成[20]。1990年科学家们成功在体外表达了高纯度的葡萄糖蔗糖酶,并建立出葡聚糖蔗糖酶的立体结构。葡聚糖蔗糖酶含有四个主要功能区:N端信号肽(SP)、N端可变区(VR)、N端催化结构域(CD)和位于C端的葡萄糖结合域(GBD)[21]。
a.N端信号肽区:N端信号肽区的存在是革兰氏阳性细菌的一个典型特征。大多数葡聚糖蔗糖酶分子的末端都有一个由32~38个氨基酸组成的信号肽。这个区域是高度保守的,不同来源的葡聚糖蔗糖酶的释放模式几乎相同[22]。
b.N端可变区域:在N端信号肽区之后的是一个由140~261个氨基酸残基组成的区域,因为这个区域具有高的变异性,人们推测它可能带有葡聚糖蔗糖酶所特有的序列。然而,也有报道说这个区域在蛋白质分子中不是特别重要[23]。
c.N端催化区:在N端可变区域之后的部分是一个高度保守的由950个左右的氨基酸残基组成的序列,称为N端催化区,能够进行蔗糖的催化水解作用。
d.C端葡萄糖结合域:葡聚糖蔗糖酶的末端存在的一个大约由500个氨基酸残基组成的葡萄糖结合域,包含几个同源的重复序列,这些重复序列的结构和数量随葡聚糖蔗糖酶的不同而变化[24]。
1.2 葡聚糖蔗糖酶的催化机制
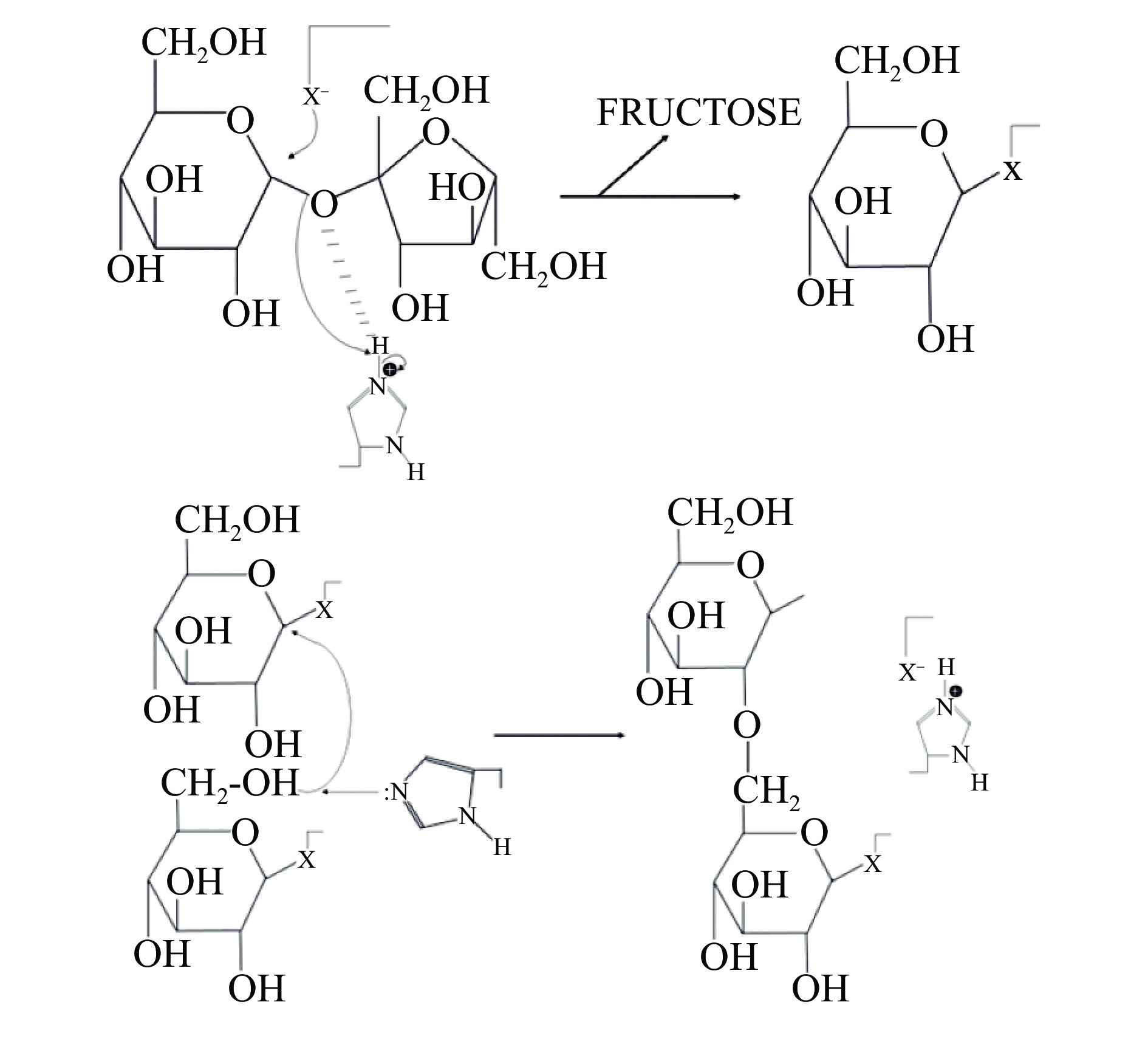
对于葡聚糖蔗糖酶催化机制,研究者们一直持有不同的观点,1974年Robyt等基于右旋糖酐蔗糖酶的催化反应提出了双位点插入机制,也叫做还原端延伸机制,在该机制中存在两个活性位点,一个位点形成葡糖基-酶中间体,另一个位点形成糖链-酶中间体,糖链-酶中间体中的C1位会攻击葡糖基的C6位,形成α-1,6糖苷键,从而使糖链得到延伸[25−26]。但该机制并没有探明如何利用氨基酸残基进行催化反应。随着研究的不断深入,研究人员对这一机制进行了更新和补充,重点关注氨基酸残基,主要是亲和性残基、酸碱催化残基和过渡态稳定残基[27]。在酶的催化反应过程中包括两个重要途径:首先,合成葡萄糖基。该步由谷氨酸催化形成一个β-D-葡萄糖苷酶结构,并且释放出果糖,它的过渡态稳定和残基稳定;其次:去质子化。通过去质子化将糖基分子转移到活性受体,攻击糖甘环的异头C1原子和天冬氨酸之间的共价键,保守的酪氨酸残基位于催化中心之外,这种口袋活性部位也存在于多糖核糖酶中[28]。此研究结果不仅从氨基酸水平上解释了葡聚糖蔗糖酶合成糖的机理,对研究葡聚糖蔗糖酶的结构也具有重要作用,葡聚糖蔗糖酶的催化机制如图1所示。
1.3 葡聚糖蔗糖酶的应用
乳酸菌分泌的葡聚糖蔗糖酶可催化胞外同源多糖如葡聚糖、果聚糖等的合成。经它合成分泌的右旋糖酐是凝胶柱的主要成分,在医学上也是一些药物的良好载体,在肝脏移植中是肝脏运输途中良好的保护液,它还能抗氧化、抗肿瘤,预防肿瘤的发生和恶化[29]。最近的报告表明,乳酸菌葡聚糖蔗糖酶合成的胞外多糖含有磷酸基团和硫酸基团等结构,已被证明具有抗炎作用[30]。乳酸菌葡聚糖作为一种新型的天然食品添加剂,能够调节肠道微生物的生长,应用在酸奶、奶酪和奶制甜点的工厂发酵生产中,对产品质地、口感、味道和最终产品的稳定性方面起着重要作用[31]。
葡聚糖蔗糖酶不仅能够水解蔗糖通过葡糖基转苷作用合成葡聚糖,还能通过酶合成法利用其具有的转糖基功能,在底物为高浓度的蔗糖时,通过调节反应条件葡聚糖蔗糖酶能合成一种既耐热又耐酸的低聚糖,功能性低聚糖不易被消化道分解,能够在肠道中发挥独特的生理功能[32]。通过酶合成法合成的低聚糖是一种潜在的益生元,具有改善糖尿病症状、减轻胰岛素抵抗、减少肠道炎症等益处,在营养保健等研究中受到广泛关注[33]。
2. 乳酸菌葡聚糖蔗糖酶产量优化
由于乳酸菌葡聚糖蔗糖酶产量较低,限制其工业化应用,因此提高乳酸菌葡聚糖蔗糖酶的产量是拓展其应用范围的基础。根据菌株特性及酶学性质,提高葡聚糖蔗糖酶的产量可以从不同的角度进行,首先筛选能够高产葡聚糖蔗糖酶的乳酸菌,丰富产酶菌株来源;其次,通过优化菌株产酶条件,提高酶的产量;再者,通过基因工程的方法构建工程菌株,例如利用基因敲除技术切断菌株分支代谢途径,利用基因克隆技术构建异源表达菌株等,对乳酸菌来说,不同的培养基组成可以导致合成的葡聚糖蔗糖酶的产量存在显著差异。本文通过对菌株产酶条件的优化以提高葡聚糖蔗糖酶产量的影响进行了总结,如表1所示。
表 1 培养基组成对葡聚糖蔗糖酶产量的影响Table 1. Effect of medium composition on yield of glucansucrase菌株 培养基组成 最适条件 最大产量 参考文献 P. pentosaceus 碳源 5%蔗糖 10.2 U/mL [35] Ln. mesenteroides DRP2-19 碳源 3%蔗糖 1.54 U/mL [36] Leuconostoc subsp. NW02 碳源 10%蔗糖 最大 [37] W. confusa 氮源 1.5%酵母提取物 6.4 U/mL [38] Lb. plantarum DM5 氮源 2.5%酵母提取物 3.3 U/mL [39] Ln. mesenteroides DRP2-19 无机盐 0.2 mmol/L的Ca2+ 2.62 U/mL [36] W. confusa 无机盐 1.5% K2HPO4 6.4 U/mL [38] Ln. mesenteroides 无机盐 0.6%乙酸钠 2.14 U/mL [42] 2.1 培养基组成对葡聚糖蔗糖酶产量的影响
对乳酸菌来说,不同的培养基组成可以导致合成的葡聚糖蔗糖酶的产量存在显著差异(表1)。碳源是影响乳酸菌产葡聚糖蔗糖酶的一个重要因素,乳酸菌利用糖类,例如葡萄糖、乳糖、蔗糖、甘露糖等作为碳源生产葡聚糖蔗糖酶[34]。Shukla等[35]研究不同碳源对戊糖片球菌(Pediococcus pentosaceus)CRAG3发酵产葡聚糖蔗糖酶的影响进行比较,发现浓度为5%的蔗糖作为碳源时葡聚糖蔗糖酶活性最高。先前的研究中,课题组通过单因素实验研究不同碳源对Ln. mesenteroide DRP2-19葡聚糖蔗糖酶产量的影响时发现,不同的碳源例如葡萄糖、果糖、蔗糖、半乳糖等对葡聚糖蔗糖酶的产量影响较大,当底物为3%蔗糖时,酶的活性提高了8.4%[36]。张皓等[37]从泡菜中筛选得到了一株产葡聚糖蔗糖酶的菌株Leuconostoc sp. NW02,发现其分泌的葡聚糖蔗糖酶在蔗糖浓度为8%时,菌株生长最好,蔗糖浓度为10%时,酶的产量最大。蔗糖不仅作为菌株生长代谢的碳源,同时作为葡聚糖蔗糖酶的诱导剂,诱导菌株分泌该酶。
氮源也是影响菌株产葡聚糖蔗糖酶的主要因素,Shukla等[38]探究了氮源对融合魏氏魏氏菌(Weissella confusa)葡聚糖蔗糖酶产量的影响,发现酵母提取物是菌株产葡聚糖蔗糖酶最有效的氮源,但高浓度的酵母提取物会抑制葡聚糖蔗糖酶的产生。此外,随着蛋白胨的浓度增加,葡聚糖蔗糖酶的含量先上升后下降。Das等[39]通过单因素实验研究了酵母提取物、蛋白胨和牛肉提取物等不同氮源对植物乳杆菌(Lactobacillus plantarum)DM5产葡聚糖蔗糖酶的影响。研究发现,酵母提取物是菌株产葡聚糖蔗糖酶的最有效氮源。这与其他报道一致,其中的酵母提取物在生产葡糖蔗糖酶过程中作为维生素和氨基酸补充剂的来源[40−41]。
无机盐是培养基中不可缺少的成分,是影响乳酸菌产葡聚糖蔗糖酶的主要因素。课题组在先前研究中,探究不同因素对Ln. mesenteroide DRP2-19的葡聚糖蔗糖酶的产量的影响,发现Zn2+、Cu2+、Co2+、Fe3+、Ca2+、Na+、K+能够促进Ln. mesenteroide DRP2-19葡聚糖蔗糖酶的产量,其中在0.2 mmol/L的Ca2+条件下,葡聚糖蔗糖酶的产量最高,而Hg2+会抑制葡聚糖蔗糖酶的产量[36]。Shukla等[38]研究发现,当培养基中乙酸钠的浓度低于0.05%,对葡聚糖蔗糖酶产量没有影响,当乙酸钠的浓度超过0.05%时,酶的产量降低,而Sawale等[42]报道乙酸钠能够促进Ln. mesenteroide产生葡聚糖蔗糖酶。磷酸盐是细菌良好的磷源,在培养基中常加入一些无机盐也可以调节培养基中的渗透压并在培养基中具有缓冲作用。同样,对于不同种类的磷酸盐,葡聚糖蔗糖酶的产量也不同。在0.6% K2HPO4下观察到葡聚糖蔗糖酶产量显著增加。在不同浓度的乙酸钠下记录的酶活性表明,当其浓度为0.6%时酶的产量最大。Shukla等[38]的试验也显示出了1.5%(w/v)的K2HPO4对葡聚糖蔗糖酶生产是最佳的,K2HPO4超过1.5%(w/v),葡聚糖蔗糖酶的产量下降。这些盐可能通过维持三维蛋白质结构,将酶的活性位点保持在稳定状态,从而提高葡聚糖蔗糖酶的产量[42]。
2.2 培养条件对葡聚糖蔗糖酶产量的影响
除了培养基组成之外,培养条件如pH、摇床转速、接种量、温度等都对乳酸菌葡聚糖蔗糖酶的产量有影响(表2)。先前研究中课题组发现,不同pH对菌株DRP2-19葡聚糖蔗糖酶的产量有不同的影响,在pH6.0条件下发酵30 h,葡聚糖蔗糖酶的产量最大。然而,酸性(pH<4.5)或碱性(pH>7)条件会抑制菌株产葡聚糖蔗糖酶[36]。赵博[43]在进行产葡聚糖蔗糖酶培养基条件优化中研究了培养基pH对菌株Ln. citreum B-2产酶能力的影响,发现在pH为6.0时葡聚糖蔗糖酶的酶活最高。这些研究证明偏中性环境可能更有利于菌株葡聚糖蔗糖酶的合成和积累。因此,通过调整培养基初始pH或控制发酵过程中pH可以有效影响葡聚糖蔗糖酶的产量,在培养过程中,通常向培养基中添加缓冲盐,使pH保持在菌种最适生长和代谢物积累的范围从而提高酶的产量。此外,pH的改变会影响葡聚糖蔗糖酶活性中心上必需基团的解离程度,从而影响葡聚糖蔗糖酶与底物的结合和催化作用,导致催化产物的含量发生改变。
表 2 培养条件对葡聚糖蔗糖酶产量的影响Table 2. Effect of culture conditions on yield of glucansucrase菌株 培养条件 最适条件 最大产量 参考文献 Ln. mesenteroides DRP2-19 pH 6.0 2.66 U/mL [36] Ln. citreum B-2 pH 6.0 3.69 U/mL [43] Ln. mesenteroides DRP2-19 摇床转速 100 r/min 2.84 U/mL [36] Ln. mesenteroides DRP105 摇床转速 120 r/min 4.03 U/mL [44] Ln. mesenteroides subsp. 接种量 4% 最大 [45] Ln. mesenteroides DRP105 接种量 5% 4.19 U/mL [44] Ln. mesenteroides DRP2-19 温度 25 ℃ 2.65 U/mL [36] Ln. mesenteroides DRP105 温度 30 ℃ 3.84 U/mL [44] 摇床转速不仅会影响菌株发酵过程中溶氧量,还可能导致细胞发生裂解。课题组先前研究了不同转速对菌株DRP105产生葡聚糖蔗糖酶产量的影响,结果表明菌株在120 r/min培养时,葡聚糖蔗糖酶产量最高,而在较低转速下,酶的产量下降[44],而菌株DRP2-19在100 r/min孵育时葡聚糖蔗糖酶的产量达到最大值[36]。接种量影响菌株生长代谢进程,菌株DRP105在接种量为4%时葡聚糖蔗糖酶的产量达到最大值[44]。刘欢[45]在研究乳酸菌产葡聚糖蔗糖酶的发酵条件时发现,当接种量为4%时,葡聚糖蔗糖酶的产量略高于其他条件。
温度是影响菌株产葡聚糖蔗糖酶的重要因素,乳酸菌生产葡聚糖蔗糖酶的最佳温度范围为20~40 ℃[36]。Du等[44]发现菌株DRP105在30 °C时葡聚糖蔗糖酶的活性最高。课题组先前研究发现,菌株DRP2-19生产葡聚糖蔗糖酶的最佳温度范围为25~30 ℃[36],这可能是由于不同菌株的最适生长条件不同,其生物合成代谢过程不同,从而影响葡聚糖蔗糖酶的分泌。
3. 葡聚糖蔗糖酶的分离纯化及酶学性质
3.1 葡聚糖蔗糖酶的分离纯化
在最适产酶条件下,菌株生长代谢产生并分泌分泌到细胞外葡聚糖蔗糖酶,通过收集发酵液上清、酶蛋白沉淀、透析、层析纯化和浓缩等多个步骤获得葡聚糖蔗糖酶纯品。用来沉淀葡聚糖蔗糖酶的方法包括硫酸铵沉淀、超滤法和聚乙二醇(PEG)沉淀等方法。硫酸铵沉淀也被称为盐沉淀,是最普遍用于沉淀葡聚糖蔗糖酶的方法,因为不同蛋白质溶解度不同,可利用不同浓度的盐溶液来达到沉淀不同蛋白质的目的,这种沉淀方法具有溶解度高,温度系数低,蛋白质不容易变性失活等优点[46]。聚乙二醇具有良好的水溶性并且与许多有机成分有良好的兼容性。但是聚乙二醇沉淀法易受到过量脂质、离心温度和pH变化的影响,且单独使用时非特异性结合程度高,常与其他方法结合使用[47]。获得粗酶后需要继续利用相关技术进一步分离纯化,例如凝胶过滤层析、离子交换层析、超滤浓缩等。Song等[48]通过聚乙二醇沉淀、离子交换色谱和凝胶过滤分离纯化Ln. citreum SK24.002葡聚糖蔗糖酶,酶的纯度为原来的13.2倍,回收率为8.7%,蛋白质的比活性为1.4 U/mg。马亚君[49]利用离子交换层析和Sepharose CL-6B凝胶层析等方法纯化葡聚糖蔗糖酶,最终得到纯酶的比酶活由0.15 U/mg提高到1.27 U/mg,纯化倍数为原来的8.64倍,蛋白回收率为8.69%。赵博[43]采用经过DEAE-Sepharose FF等纯化步骤处理Ln. citreum B-2葡聚糖蔗糖酶,最终酶活为(200.01±5.33)U/mL,纯化倍数最终可达(4.31±1.34)倍。Guzman等[50]将Ln. mesenteroides IBUN 91.2.98葡聚糖蔗糖酶固定在物葡聚糖中,并通过超滤浓缩和阴离子交换层析对酶进行纯化,纯化后的葡聚糖蔗糖酶的比活为335.1 U/mg。
3.2 葡聚糖蔗糖酶的酶学性质
葡聚糖蔗糖酶作为乳酸菌的初级代谢物产物,在发挥催化特性时易受到多种因素例如温度,pH,金属离子等的影响。
3.2.1 温度对酶活性的影响
温度不仅影响酶蛋白的活性和催化反应的速率,也会影响酶的稳定性。Das等[39]报道植物乳杆菌(Lactobacillus plantarum)葡聚糖蔗糖酶活性在27 ℃时最大,为2.71 U/mL,当温度升高到27 ℃以上时,酶活性降低,在20 ℃时,酶活性降低了35%,这可能是由于细胞生长速度较慢,从而导致酶产量降低。Song等[48]获得比活力为3.6 U/mg的Ln. citreum SK24.002葡聚糖蔗糖酶,其最适温度为45 ℃,在50 ℃孵育0.5 h后,葡聚糖蔗糖酶的残余活性约为40%。马亚君[49]在探究罗伊氏乳杆菌(Lactobacillus reuteri)葡聚糖蔗糖酶的酶学性质时发现,葡聚糖蔗糖酶的在25~45 ℃之间保持着较高的酶活,酶的相对活力保持在70%以上,这说明葡聚糖蔗糖酶在此温度范围能保持相对稳定的酶活。因为大多数酶的本质是蛋白质,超过最适温度,蛋白质就会变性失活,且活性不能恢复,所以在研究乳酸菌生产葡聚糖蔗糖酶时,确定适宜的培养温度是一个重要问题。
3.2.2 pH对酶活性的影响
葡聚糖蔗糖酶在pH4.5~5.5之间保持着较高的酶活。Zhao等[51]在研究Ln. citreum B-2葡聚糖蔗糖酶活性时发现,在pH6.0~8.0时,葡聚糖蔗糖酶的酶活力保持在原来的90%左右,随着pH的升高,葡聚糖蔗糖酶的活性逐渐降低。Song等[48]在研究pH对Ln. citreum SK24.002葡聚糖蔗糖酶活性的影响时发现,在pH5.0~6.0的范围内,葡聚糖蔗糖酶活性最大,酶活力均保持在原来的80%以上。张皓等[37]在研究Leuconostoc sp. NW02的葡聚糖蔗糖酶的酶学性质时发现该酶在pH7.5时为最适反应pH,在pH7.5~8.0的条件下保存1 h,酶活力降为原来的60%。可以看出,葡聚糖蔗糖酶在pH为弱酸性或中性条件下能保持较高的酶活性,具有更好的耐酸性。pH不仅影响酶蛋白的结构和稳定性,而且对酶和底物之间的解离状态产生影响。只有在一定pH范围内,酶才能表现较高的催化活性。
3.2.3 金属离子对酶活性的影响
金属离子与酶的活性中心作用进而对酶产生激活或抑制效应。先前研究发现,K+、Na+、Ca2+、Mn2+、Mg2+和Cr+对Ln. citreum B-2葡聚糖蔗糖酶具有明显的刺激作用,其中Ca2+和Mn2+可显著促进葡聚糖蔗糖酶的活性,其中Ca2+对酶活的促进作用达到了250%[51]。马亚君[49]在探究金属离子对葡聚糖蔗糖酶活性的影响时发现,Mg2+、Mn2+、Ni2+、Co2+、Ca2+、Fe2+和Zn2+能够提高葡聚糖蔗糖酶的活性,其中Ca2+对酶活的影响最大,酶活提高了接近4倍,此外Cu2+、Al3+和Fe3+对酶活有抑制作用。Song等[48]发现Ca2+、Mn2+和Co2+在内的几种双电荷离子激活Ln. citreum SK24.002葡聚糖蔗糖酶的活性,其中Mn2+存在下酶活提高了1.2倍,K+、Ba2+、Mg2+和Ni2+离子几乎不影响酶活性,而Zn2+、Cu2+、Fe2+、Fe3+和Al3+离子对酶有抑制作用,证明该酶是一种金属激活酶。Ca2+与酶的活性中心作用,是影响葡聚糖蔗糖酶活性的重要金属离子。
3.2.4 有机溶剂和化学抑制剂对酶活性的影响
有机溶剂和化学抑制剂也会在一定程度上抑制酶的活性,大多数有机溶剂可以通过破坏它们的结构,从而抑制酶活性。先前研究证明,有机溶剂除了苯对Ln. citreum B-2葡聚糖蔗糖酶的活性几乎没有影响之外,甲醇、乙醇、乙腈等均对葡聚糖蔗糖酶的活性有抑制作用[51]。Song等[48]探究有机溶剂对Ln. citreum SK24.002葡聚糖蔗糖酶的活性影响,发现除丙酮和正己烷存在外,葡聚糖蔗糖酶活性随着有机溶剂浓度的增加而降低。有机溶剂量增加不仅能够引起pH变化,还能改变酶的催化活性构象。Girard等[52]研究同样表明,Ln. mesenteroides NRRL B-512F葡聚糖蔗糖酶的活性与有机溶剂性质有关,20%乙腈,50%DMF、丙酮或乙醇和90%二甲基亚砜可以使酶活减少90%。表面活性剂和化学抑制剂可以通过影响氨基酸的结构而影响酶的活性,几乎所有的化学抑制剂和表面活性剂都对葡聚糖蔗糖酶的活性具有抑制作用,例如十二烷基硫酸钠、EDTA、SDS、DTT和β-ME,且随着化学抑制剂和表面活性剂浓度的增加,酶的活性急剧下降,在浓度为5 mmol/L和25 mmol/L时酶活极低[51]。研究表明,EDTA可以和一些金属离子形成稳定的络合物破坏酶的活性中心,然而是否会影响到葡聚糖蔗糖酶的催化特性进而影响到胞外多糖的合成,仍然是未来需要探究的问题。
4. 结论与展望
葡聚糖蔗糖酶催化蔗糖,产生具有良好生物活性和较高利用价值的糖类化合物,在糖生物学研究领域和制糖工艺中受到高度重视。从可再生原料中,通过自然反应可以生产各种类型的右旋糖酐、葡萄糖基化的寡糖和葡萄糖基化的衍生物,为葡聚糖蔗糖酶的结构和功能之间关系的研究以及蛋白质工程技术的不断发展提供了帮助,并且使葡聚糖蔗糖酶的功能得到了明显的开发和利用。新开发的葡聚糖蔗糖酶能够进行同类型的天然酶无法催化的反应,并具有新的特性,使这种催化工具能够用于生产更广泛的生物活性糖,如抗生素、激素、生物碱等。为了扩大葡聚糖蔗糖酶在生物合成中的应用,在今后的研究中可以利用基因工程方法改变酶的功能的突变基因,使其与现有工程乳酸菌的染色体DNA进行同源重组,从而找到具有葡聚糖蔗糖酶的有效工程乳酸菌。此外,还可以通过对葡聚糖蔗糖酶的氨基酸组成进行分析,改变酶蛋白的氨基酸组成,从中可以推测出催化过程中酶的结构和功能之间的关系。除了对酶在生物合成中的应用的探索外,另一个困难是缺乏关于酶系统动力学的知识,这对于快速和主动的酶工程设计是必要的,预测突变对酶结构和动力学的影响仍然是一项具有挑战性的任务。
-
表 1 培养基组成对葡聚糖蔗糖酶产量的影响
Table 1 Effect of medium composition on yield of glucansucrase
菌株 培养基组成 最适条件 最大产量 参考文献 P. pentosaceus 碳源 5%蔗糖 10.2 U/mL [35] Ln. mesenteroides DRP2-19 碳源 3%蔗糖 1.54 U/mL [36] Leuconostoc subsp. NW02 碳源 10%蔗糖 最大 [37] W. confusa 氮源 1.5%酵母提取物 6.4 U/mL [38] Lb. plantarum DM5 氮源 2.5%酵母提取物 3.3 U/mL [39] Ln. mesenteroides DRP2-19 无机盐 0.2 mmol/L的Ca2+ 2.62 U/mL [36] W. confusa 无机盐 1.5% K2HPO4 6.4 U/mL [38] Ln. mesenteroides 无机盐 0.6%乙酸钠 2.14 U/mL [42] 表 2 培养条件对葡聚糖蔗糖酶产量的影响
Table 2 Effect of culture conditions on yield of glucansucrase
菌株 培养条件 最适条件 最大产量 参考文献 Ln. mesenteroides DRP2-19 pH 6.0 2.66 U/mL [36] Ln. citreum B-2 pH 6.0 3.69 U/mL [43] Ln. mesenteroides DRP2-19 摇床转速 100 r/min 2.84 U/mL [36] Ln. mesenteroides DRP105 摇床转速 120 r/min 4.03 U/mL [44] Ln. mesenteroides subsp. 接种量 4% 最大 [45] Ln. mesenteroides DRP105 接种量 5% 4.19 U/mL [44] Ln. mesenteroides DRP2-19 温度 25 ℃ 2.65 U/mL [36] Ln. mesenteroides DRP105 温度 30 ℃ 3.84 U/mL [44] -
[1] HIEN P, PIJNING T, DIJKHUIZEN L, et al. Mutational analysis of the role of the glucansucrase gtf180-delta nactive site residues in product and linkage specificity with lactose as acceptor substrate[J]. Journal of Agricultural and Food Chemistry,2018,66(47):12544−12554. doi: 10.1021/acs.jafc.8b04486
[2] SYEDA B Z, AFSHEEN A. Boosting extracellular dextransucrase production by Weissella confusa by combining a statistical and randomized mutational approach during upstream fermentation processing[J]. Journal of Taibah University for Science,2022,16(1):1241−1253. doi: 10.1080/16583655.2022.2155449
[3] WANG J, SALEM D R, SANI R K. Extremophilic exopolysaccharides:A review and new perspectives on engineering strategies and applications[J]. Carbohydrate Polymers,2019,205:8−26. doi: 10.1016/j.carbpol.2018.10.011
[4] KIM M, JANG J K, PARK Y S. Production optimization, structural analysis, and prebiotic-and anti-inflammatory effects of gluco-oligosaccharides produced by Leuconostoc lactis SBC001[J]. Microorganisms,2021,9(1):200−218. doi: 10.3390/microorganisms9010200
[5] MOULIS C, ISABELLE A, REMAUD S M. GH13 amylosucrases and GH70 branching sucrases, atypical enzymes in their respective families[J]. Cellular and Molecular Life Sciences Cmls,2016,73(14):1−19.
[6] MIAO M, MA Y J, JIANG B, et al. Characterisations of Lactobacillus reuteri SK24.003 glucansucrase:Implications for α-gluco-poly and oligosaccharides biosynthesis[J]. Food Chemistry,2017,222(51):105−112.
[7] WANGPAIBOON K, SITTHIYOTHA T, CHUNSRIVIROT S, et al. Unravelling regioselectivity of Leuconostoc citreum ABK-1 alternansucrase by acceptor site engineering[J]. International Journal of Molecular Sciences,2021,22(6):3229−3246. doi: 10.3390/ijms22063229
[8] JIANG Y W, LI X X, PIJNING T, et al. Mutations in amino acid residues of Limosilactobacillus reuteri 121 gtfb 4, 6-alpha-glucanotransferase that affect reaction and product specificity[J]. Journal of Agricultural and Food Chemistry,2022,70(6):1952−1961. doi: 10.1021/acs.jafc.1c07618
[9] DE B P, FERRARA M, BAVARO A R, et al. Characterization of dextran produced by the food-related strain Weissella cibaria C43-11 and of the relevant dextransucrase gene[J]. Foods,2022,11(18):2819−2836. doi: 10.3390/foods11182819
[10] YUKINORI Y, YUI S, ARISU M, et al. Lemon myrtle extract inhibits lactate production by Streptococcus mutans[J]. Bioscience, Biotechnology, and Biochemistry,2021,85(10):2185−2190. doi: 10.1093/bbb/zbab147
[11] PARK M, CHANDRASEKARAN M, SANG Y, et al. Expression, purification, and characterization of a novel amylosucrase from Neisseria subflava[J]. International Journal of Biological Macromolecules:Structure, Function and Interactions, 2018, 109:160-166.
[12] KIM S Y, SEO D H, KIM S H, et al. Comparative study on four amylosucrases from Bifidobacterium species[J]. International Journal of Biological Macromolecules,2020,155:535−542. doi: 10.1016/j.ijbiomac.2020.03.176
[13] YAN M, WANG B H, XU X, et al. Molecular and functional study of a branching sucrase-like glucansucrase reveals an evolutionary intermediate between two subfamilies of the GH70 enzymes[J]. Applied and Environmental Microbiology,2018,121(26):810−817.
[14] DU R P, YU L S, SUN M, et al. Characterization of dextran biosynthesized by glucansucrase from Leuconostoc pseudomesenteroides and their potential biotechnological applications[J]. Antioxidants,2023,12(2):275−288. doi: 10.3390/antiox12020275
[15] WANG Y Y, SUN T, WANG Y Z, et al. Production and characterization of insoluble α-1,3-linked glucan and soluble α-1,6-linked dextran from Leuconostoc pseudomesenteroides G29[J]. Chinese Journal of Chemical Engineering,2021,39(11):211−218.
[16] 张志霞. 青藏高原部分地区不同分离样品肠膜明串珠菌的多位点序列分型研究[D]. 郑州:郑州大学, 2016. [ZHANG Z X. Multilocus sequence typing of different isolated samples of Leuconostoc mesenteroide from selected areas of the Tibetan Plateau[D]. Zhengzhou:Zhengzhou University, 2016.] ZHANG Z X. Multilocus sequence typing of different isolated samples of Leuconostoc mesenteroide from selected areas of the Tibetan Plateau[D]. Zhengzhou: Zhengzhou University, 2016.
[17] YU L S, QIAN Z G, GE J P, et al. Glucansucrase produced by lactic acid bacteria:structure, properties and applications[J]. Fermentation,2022,8(11):629−649. doi: 10.3390/fermentation8110629
[18] PIJNING T, ANDREJA V, KRALJ S, et al. Biochemical and crystallographic characterization of a glucansucrase from Lactobacillus reuteri 180[J]. Biocatalysis,2008,26(1-2):12−17. doi: 10.1080/10242420701789163
[19] 刘丽娜, 姜静, 赵丹. 微生物葡聚糖蔗糖酶的研究进展[J]. 生物技术,2020,30(5):504−510. [LIU L N, JIANG J, ZHAO D. Advances in the study of microbial glucansucrase[J]. Biotechnology,2020,30(5):504−510.] doi: 10.16519/j.cnki.1004-311x.2020.05.0079 LIU L N, JIANG J, ZHAO D . Advances in the study of microbial glucansucrase[J]. Biotechnology,2020 ,30 (5 ):504 −510 . doi: 10.16519/j.cnki.1004-311x.2020.05.0079[20] PASSERINI D, VUILLEMIN M, UFARTE L, et al. Inventory of the GH70 enzymes encoded by Leuconostoc citreum NRRL B-1299-identification of three novela-transglucosylases[J]. The Febs Journal,2015,282(11):12−21.
[21] PIJNING T, VUJICIC-ZAGAR A, KRALJ S, et al. Structure of the alpha-1,6/alpha-1,4-specific glucansucrase GTFA from Lactobacillus reuteri 121[J]. Acta Crystallographica Section F-Structural Biology Communications, 2012, 1448-1454.
[22] MONCHOIS V, WILLEMOT R M, REMAUD-SIMEON M, et al. Cloning and sequencing of a gene coding for a novel dextransucrase from Leuconostoc mesenteroides NRRL B-1299 synthesizing only α(1-6) and α(1-3) linkages[J]. Gene,1996,182:23−32. doi: 10.1016/S0378-1119(96)00443-X
[23] MONCHOIS V, ARGUELLO M, RUSSELL R. Isolation of an actibe catalytic core of streptococcus downei MF228 GTF-I glucosyltransferase[J]. Journal of Bacteriology,1999,181:2290−2292. doi: 10.1128/JB.181.7.2290-2292.1999
[24] 罗靳. 细菌右旋糖苷蔗糖酶基因的克隆与表达[D]. 北京:中国农业科学院, 2007. [LUO J. Cloning and expression of the bacterial dextrose sucrase gene[D]. Beijng:Chinese Academy of Agriculyutal Sciences, 2007.] LUO J. Cloning and expression of the bacterial dextrose sucrase gene[D]. Beijng: Chinese Academy of Agriculyutal Sciences, 2007.
[25] ROBYT J F, KIMBLE B K, WALSETH T F. The mechanism of dextransucrase action:direction of dextran biosynthesis[J]. Archives of Biochemistry and Biophysics,1974,165(2):634−640. doi: 10.1016/0003-9861(74)90291-4
[26] ROBYT J F. Mechanism of synthesis of glucan chain, branching, and acceptor-oligosaccharides by glucansucrases[J]. Journal of Applied Glycoscience,1995,42:53−67.
[27] ROBYT J F, YOON S H, MUKERJEA R. Dextransucrase and the mechanism for dextran biosynthesis[J]. Carbohydrate Research,2008,343(18):3039−3048. doi: 10.1016/j.carres.2008.09.012
[28] CLAVERIE M, CIOCI G, VUILLEMIN M, et al. Processivity of dextransucrases synthesizing very high molar mass dextran is mediated by sugar-binding pockets in domain V[J]. Journal of Biological Chemistry,2020,295(17):5602−5613. doi: 10.1074/jbc.RA119.011995
[29] 臧文晶, 刘丽娜, 赵丹. 肠膜明串珠菌HDE1的分离鉴定及其胞外多糖抗氧化和牛奶凝结特性研究[J]. 食品工业科技,2023,44(4):155−162. [ZANG W J, LIU L N, ZHAO D. Isolation and characterization of Leuconostoc mesenteroide HDE1 and its extracellular polysaccharide antioxidant and milk coagulation properties[J]. Science and Technology of Food Industry,2023,44(4):155−162.] ZANG W J, LIU L N, ZHAO D . Isolation and characterization of Leuconostoc mesenteroide HDE1 and its extracellular polysaccharide antioxidant and milk coagulation properties[J]. Science and Technology of Food Industry,2023 ,44 (4 ):155 −162 .[30] RAJOKA M, WU Y, MEHWISH H M, et al. Lactobacillus exopolysaccharides:New perspectives on engineering strategies, physiochemical functions, and immunomodulatory effects on host health[J]. Trends in Food Science and Technology,2020,103:10336−10348.
[31] 王烁, 姜静, 杜仁鹏, 等. 乳酸菌胞外多糖的生物合成、特性和应用[J]. 生物技术, 2022, 32(3):394-401. [WANG S, JIANG J, DU R P, et al, Biosynthesis, properties and applications of extracellular polysaccharides from Lactobacillus[J]. Biotechnology, 2022, 32(3):394-401.] WANG S, JIANG J, DU R P, et al, Biosynthesis, properties and applications of extracellular polysaccharides from Lactobacillus[J]. Biotechnology, 2022, 32(3): 394-401.
[32] ISPIRLI H, BOWMAN M J, SKORY C D, et al. Synthesis and characterization of cellobiose-derived oligosaccharides with bifidogenic activity by glucansucrase E81[J]. Food Bioscience,2021,44:1−7.
[33] 邹月, 黄金凤, 魏琴. 功能性低聚糖的研究进展及应用现状[J]. 中国调味品,2021,46(2):180−185. [ZOU Y, HUANG J F, WEI Q. Research progress and application status of functional oligosaccharides[J]. China Condiment,2021,46(2):180−185.] ZOU Y, HUANG J F, WEI Q . Research progress and application status of functional oligosaccharides[J]. China Condiment,2021 ,46 (2 ):180 −185 .[34] JIANG J, GUO S X, PING W X, et al. Optimization production of exopolysaccharide from Leuconostoc lactis L2 and its partial characterization[J]. International Journal of Biological Macromolecules,2020,159(18):630−639.
[35] SHUKLA R, GOYAL A. Optimization and scale-up of fermentation of glucansucrase and branched glucan by Pediococcus pentosaceus CRAG3 using Taguchi methodology in bioreactor[J]. Journal of Bio Science and Biotechnology,2012,1(1):73−82.
[36] DU R P, ZHAO F K, PAN L, et al. Optimization and purification of glucansucrase produced by Leuconostoc mesenteroides DRP2-19 isolated from Chinese sauerkraut[J]. Preparative Biochemistry and Biotechnology,2018,48(6):465−473. doi: 10.1080/10826068.2018.1466149
[37] 张皓, 祖航天, 胡杰, 等. 一种产碱性葡聚糖蔗糖酶菌株的筛选、鉴定及其合成低聚糖的研究[J]. 食品科技,2021,46(7):22−28. [ZHANG H, ZU H T, HU J, et al. Screening and identification of an alkaline glucansucrase producing strain and its synthesis of oligosaccharides[J]. Food Science and Technology,2021,46(7):22−28.] ZHANG H, ZU H T, HU J, et al . Screening and identification of an alkaline glucansucrase producing strain and its synthesis of oligosaccharides[J]. Food Science and Technology,2021 ,46 (7 ):22 −28 .[38] SHUKLA S, GOYAL A. Optimization of fermentation medium for enhanced glucansucrase and glucan production from Weissella confusa[J]. Brazilian Archives of Biology and Technology,2011,54(6):1117−1124. doi: 10.1590/S1516-89132011000600006
[39] DAS D, GOYAL A. Isolation, purification and functional characterization of glucansucrase from probiotic Lactobacillus plantarum DM5[J]. Journal of the Science of Food and Agriculture,2014,94(4):1715−1724.
[40] PURAMA R K, GOYAL A. Application of response surface methodology for maximizing dextransucrase production from Leuconostoc mesenteroides NRRL B-640 in a bioreactor[J]. Applied Biochemistry and Biotechnology,2008,151:182−192. doi: 10.1007/s12010-008-8165-8
[41] SINGH A, MAJUMDER A, GOYAL A. Artificial intelligence based optimization of exocellular glucansucrase production from Leuconostoc dextranicum NRRL B-1146[J]. Bioresource Technology,2008,99(17):8201−8206. doi: 10.1016/j.biortech.2008.03.038
[42] SAWALE S D, LELE S S. Statistical optimization of media for dextran production by Leuconostoc sp. isolated from fermented idli batter[J]. Food Science and Biotechnology,2010,19(2):471−478. doi: 10.1007/s10068-010-0066-2
[43] 赵博. 柠檬明串珠菌B-2葡聚糖蔗糖酶及其体外多糖合成[D]. 天津:天津大学, 2021. [ZHAO B. Leu. citreum B-2 glucansucrase and its polysaccharide synthesis in vitro[D]. Tianjin:Tianjin University, 2021.] ZHAO B. Leu. citreum B-2 glucansucrase and its polysaccharide synthesis in vitro[D]. Tianjin: Tianjin University, 2021.
[44] DU R P, XING H W, ZHOU Z J, et al. Isolation, characterisation and fermentation optimisation of glucansucrase-producing Le uconostoc mesenteroides DRP105 from sauerkraut with improved preservation stability[J]. International Journal of Food Science and Technology,2017,52(12):2522−2530. doi: 10.1111/ijfs.13537
[45] 刘欢. 产葡聚糖乳酸菌的筛选诱变及发酵条件优化[D]. 哈尔滨:东北农业大学, 2015. [LIU H. Screening and mutagenesis of dextran-producing lactic acid bacteria and optimization of fermentation conditions[D]. Harbin:Northeast Agricultural University, 2015.] LIU H. Screening and mutagenesis of dextran-producing lactic acid bacteria and optimization of fermentation conditions[D]. Harbin: Northeast Agricultural University, 2015.
[46] KIM D, ROBYT J F. Properties of Leuconostoc mesenteroides B-512FMC constitutive dextransucrase[J]. Enzyme and Microbial Technology,1994,16(12):1010−1015. doi: 10.1016/0141-0229(94)90134-1
[47] VASILEVA T, IVANOVA I, ILIEV I. Purification and characterization of glucosyltransferases from new strains Leuconostoc mesenteroides[J]. Biotechnology and Biotechnological Equipment,2009,23:693−697. doi: 10.1080/13102818.2009.10818519
[48] SONG L P, MIAO M, JIANG B, et al. Leuconostoc citreum SK24.002 glucansucrase:Biochemical characterisation and de novo synthesis of α-glucan[J]. International Journal of Biological Macromolecules,2016,91:123−131. doi: 10.1016/j.ijbiomac.2016.05.019
[49] 马亚君. 源于罗伊氏乳杆菌SK24.003葡聚糖蔗糖酶的性质与应用[D]. 无锡:江南大学, 2016. [MA Y J. Properties and applications of dextran sucrase derived from Lactobacillus reuteri SK24.003[D]. Wuxi:Jiangnan University, 2016.] MA Y J. Properties and applications of dextran sucrase derived from Lactobacillus reuteri SK24.003[D]. Wuxi: Jiangnan University, 2016.
[50] GUZMAN Y F, HURTADO G B, OSPINA S A. New dextransucrase purification process of the enzyme produced by Leuconostoc mesenteroides IBUN 91.2.98 based on binding product and dextranase hydrolysis[J]. Journal of Biotechnology,2018,265:8−14. doi: 10.1016/j.jbiotec.2017.10.019
[51] ZHAO B, DU R P, WANG J Y, et al. Purification and biochemical characterization of a novel glucansucrase from Leuconostoc citreum B-2[J]. Biotechnology Letters,2020,42(8):1535−1545. doi: 10.1007/s10529-020-02881-6
[52] GIRARD E, LEGOY M D. Activity and stability of dextransucrase from Leuconostoc mesenteroides NRRL B-512F in the presence of organic solvents[J]. Enzyme and Microbial Technology,1999,24(7):425−432. doi: 10.1016/S0141-0229(98)00166-5





 下载:
下载:
 下载:
下载:



