Safety Evaluation of Peony Protein
-
摘要: 本研究旨在研究牡丹蛋白的安全性,为牡丹蛋白在食品领域中的应用提供科学依据。通过小鼠急性经口毒性试验、大鼠28 d经口毒性试验和90 d经口毒性试验评价其安全性。结果表明,急性经口毒性试验(灌胃剂量11700 mg/kg)小鼠无中毒反应,亦无动物死亡;大鼠28 d及90 d经口毒性试验中牡丹蛋白各剂量组(1500、3000、6000 mg/kg)大鼠食物利用率、脏体比及各项生命活动与空白组相比均无异常,血常规指标及血生化指标值与空白组均无显著性差异(P>0.05),脏器病理切片显示大鼠各组织形态完好,未见中毒性病变。证明在低于11700 mg/kg剂量范围内牡丹蛋白无毒,具备应用于食品领域的前景。Abstract: This study aimed to assess the safety and toxicity of peony protein and provide a scientific basis for its application in food industry. The safety evaluation included acute oral toxicity tests in mice, as well as 28 d and 90 d oral toxicity tests in rats. The results demonstrated that no signs of poisoning or mortality were observed in the acute oral toxicity test (intragastric dose of 11700 mg/kg) conducted on mice. Furthermore, in the 28 d and 90 d oral toxicity tests conducted on rats, no abnormal changes were observed in terms of food utilization, organ weight ratios, and various physiological activities, when compared to the control group (1500, 3000, 6000 mg/kg). Additionally, there were no significant differences (P>0.05) in blood routine and blood biochemical indices between the treatment groups and the control group. Histopathological examination of organ tissues revealed intact morphology without any toxic lesions. These findings provided solid evidence that peony protein was non-toxic in the dose range of less than 11700 mg/kg and hold promising potential for application in the food industry.
-
Keywords:
- peony protein /
- safety toxicity /
- hematology /
- blood biochemical indicators /
- plant protein
-
油用牡丹作为近年来新兴的优良木本油料作物,具有生长适应性强、耐干旱贫瘠,出油率高等特点[1−2]。油用牡丹籽压榨得到的牡丹籽油富含α-亚麻酸、亚油酸、油酸等不饱和脂肪酸[3−4]。牡丹籽粕是油用牡丹籽经脱壳压榨制取牡丹籽油后的副产物,产出率高达60%~80%[5−7]。已有研究表明牡丹籽粕中富含蛋白质、脂类和多糖等成分,其中牡丹蛋白含量较高,占牡丹籽粕的28%,且氨基酸种类丰富[8−11],有研究表明其具有降低胆固醇、改善心血管疾病等效果[12−16]。但牡丹籽粕目前仅被作为肥料或者饲料使用,甚至被当做废弃物处理,在污染环境的同时,也造成了资源的严重浪费[17−18]。
当前我国植物蛋白产业的发展已较为成熟,在植物蛋白中大豆蛋白占据主导地位,广泛应用于食品领域[19−20]。由于我国可用于种植大豆的耕地仅占全国总耕地面积的2.4%,难以满足每年1亿多吨大豆需求量[21],导致我国大豆对外依赖性高的问题十分严峻。与大豆蛋白相比,油用牡丹种植范围宽广,在干旱、山坡等地均可种植,不与粮食争地,且原料成本低廉。课题组前期研究利用醇提-碱提-酸沉-闪蒸热处理法从牡丹籽粕中制备得到牡丹蛋白,其吸油性、起泡性、乳化性、乳化稳定性及泡沫稳定性均优于大豆分离蛋白,吸水性、吸油性及乳化稳定性均高于酪蛋白[22],具有在食品领域广泛应用的功能特性。
牡丹蛋白作为新植物蛋白源,其安全性评价研究相对较少,本文以通过醇提-碱提-酸沉-闪蒸热处理方法得到的牡丹蛋白为受试物,开展小鼠急性经口毒性试验、大鼠28 d经口毒性试验和90 d经口毒性试验,从生理指标、血液指标、组织病理学等层面对牡丹蛋白的安全性进行综合评估,全面了解牡丹蛋白的潜在风险和安全性水平,填补牡丹蛋白在安全性评价领域的研究空白,以期为牡丹蛋白在食品领域中的应用提供科学依据。
1. 材料与方法
1.1 材料与仪器
牡丹籽蛋白(纯度≥94.32%) 实验室自制[22];总蛋白测定试剂盒、白蛋白测定试剂盒、葡萄糖测定试剂盒、甘油三酯测定试剂盒、总胆固醇测定试剂盒、丙氨酸氨基转移酶测定试剂盒、天门冬氨酸氨基转移酶测定试剂盒、碱性磷酸酶测定试剂盒、肌酐测定试剂盒、尿素测定试剂盒、氯测定试剂盒、钾测定试剂盒、钠测定试剂盒 北京豪迈生物工程有限公司;兽用血细胞分析用试剂包 深圳迈瑞生物医疗电子股份公司;SPF 级 ICR 4 周龄小鼠 40只(雌雄各半)、SPF 级 SD 3 周龄大鼠 100只(雌雄各半) 济南朋悦实验动物繁育有限公司提供,许可证号 SCXK鲁20190003,经齐鲁工业大学(山东省科学院)菏泽分院动物伦理委员会批准使用。
Human star 600自动生化分析仪 德国胡曼生化诊断有限责任公司;TG16WS高速离心机 长沙湘智离心机仪器有限公司;BC-5130五分类血液分析仪 深圳迈瑞生物医疗电子股份公司;BMJ-1B组织包埋机、RSJ-1A组织染色机 天津爱华医疗器械有限公司。
1.2 实验方法
1.2.1 急性经口毒性试验
1.2.1.1 动物分组及灌胃剂量
采用急经口毒性试验中的限量法进行[3]。小鼠适应性喂养1周后,随机分为空白组和试验组,每组20只,雌雄各半。配制牡丹蛋白混悬液至最大溶解度(130 mg/mL),试验前6 h禁食不禁水。试验组连续灌胃三次,每次间隔6 h,灌胃总剂量11700 mg/kg,空白组给予等剂量蒸馏水,末次灌胃2 h后正常进食[23]。
1.2.1.2 测量指标
连续14 d观察小鼠活动情况,记录中毒表现及死亡情况。每3 d称量小鼠体重及饲料剩余量,按式(1)计算大鼠对饲料的食物利用率[24];试验结束后,处死小鼠,摘取心、肝、脾、肺及肾并称重,按式(2)计算脏体比[25]。
食物利用率(%)=小鼠总体重增加量总进食量×100 (1) 脏体比(%)=脏器重量动物体重×100 (2) 1.2.2 28 d经口毒性试验
1.2.2.1 动物分组及灌胃剂量
大鼠适应性喂养1周后,随机分为空白组和牡丹蛋白低、中、高剂量组,每组12只,雌雄各半。根据市售植物蛋白粉成人(70 kg/人)日推荐摄入量(10 g/次/d)计算牡丹蛋白灌胃剂量。市售植物蛋白粉中蛋白含量为80%,则成人每日推荐摄入蛋白粉剂量约为114 mg/kg,按折算系数6.25折算成大鼠剂量为712.5 mg/kg[26]。设计低、中、高剂量组灌胃浓度分别为1500、3000、6000 mg/kg(相当于人体推荐摄入量的13.16、26.32、52.63倍),每组每天灌胃2次,连续灌胃28 d,每次灌胃体积为20 mL/kg,空白组灌胃等剂量蒸馏水,试验期间大鼠正常饮食饮水[27]。
1.2.2.2 测量指标
每周称量大鼠体重和饲料剩余量并计算食物利用率,28 d后腹主动脉取血,使用五分类血液分析仪测定血常规(血红蛋白、红细胞计数、白细胞计数、中性细胞、淋巴细胞、单核细胞、嗜酸、嗜碱细胞含量)和血清生化指标(总蛋白、白蛋白、葡萄糖、甘油三酯、总胆固醇、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶、肌酐、尿素、氯、钾、钠),取心、肝、脾、肺及肾称重并计算脏体比,HE染色观察脏器病变情况。
1.2.3 90 d经口毒性试验
方案及测量指标同28 d经口毒性试验,灌胃周期调整为90 d[28]。
1.3 数据处理
采用SPSS 20.0软件进行统计分析,数据以平均数±标准差表示,组间比较采用单因素方差分析,多重比较方差齐时用LSD检验,方差不齐时用Dunnett’s T3检验,P<0.05为差异具有统计学意义。
2. 结果与分析
2.1 急性经口毒性试验结果
2.1.1 体重及食物利用率
小鼠灌胃牡丹蛋白溶液后,食量、活动均正常。试验结束后,空白组与试验组小鼠均未出现死亡,试验组小鼠的活动、毛色、食量与空白组相比均无明显差异,且活动状况与精神状态均未有异常。由表1可知,各组雄性体重大于雌性,雌性食物利用率大于雄性。试验组与空白组相比,体重、食物利用率均无显著性差异(P>0.05),雌性试验组体重增长量与空白组相比显著降低(P<0.05),表明牡丹蛋白对雌性小鼠的体重增长有一定影响。因其他指标无显著性差异,综合考虑,牡丹蛋白对小鼠生长发育及饮食无显著影响。
表 1 急毒试验小鼠体重与食物利用率情况Table 1. Weight and food utilization rate of mice in acute toxicity test性别 组别 原始体重(g) 终体重(g) 体重增长量(g) 总进食量(g) 食物利用率(%) 雌性 空白组 21.77±1.18 28.04±1.37 5.17±1.13 329.01±21.74 7.90±1.21 试验组 21.93±0.94 26.74±1.3 4.32±0.52* 321.41±24.01 11.30±2.28 雄性 空白组 22.89±1.12 33.69±2.18 9.59±1.78 430.61±64.18 6.74±0.02 试验组 23.82±1.12 33.83±1.74 8.75±1.58 428.49±19.63 10.21±0.41 注:*表示与空白组相比有显著性差异(P<0.05),**表示与空白组相比有极显著性差异(P<0.01);表5同。 2.1.2 脏体比
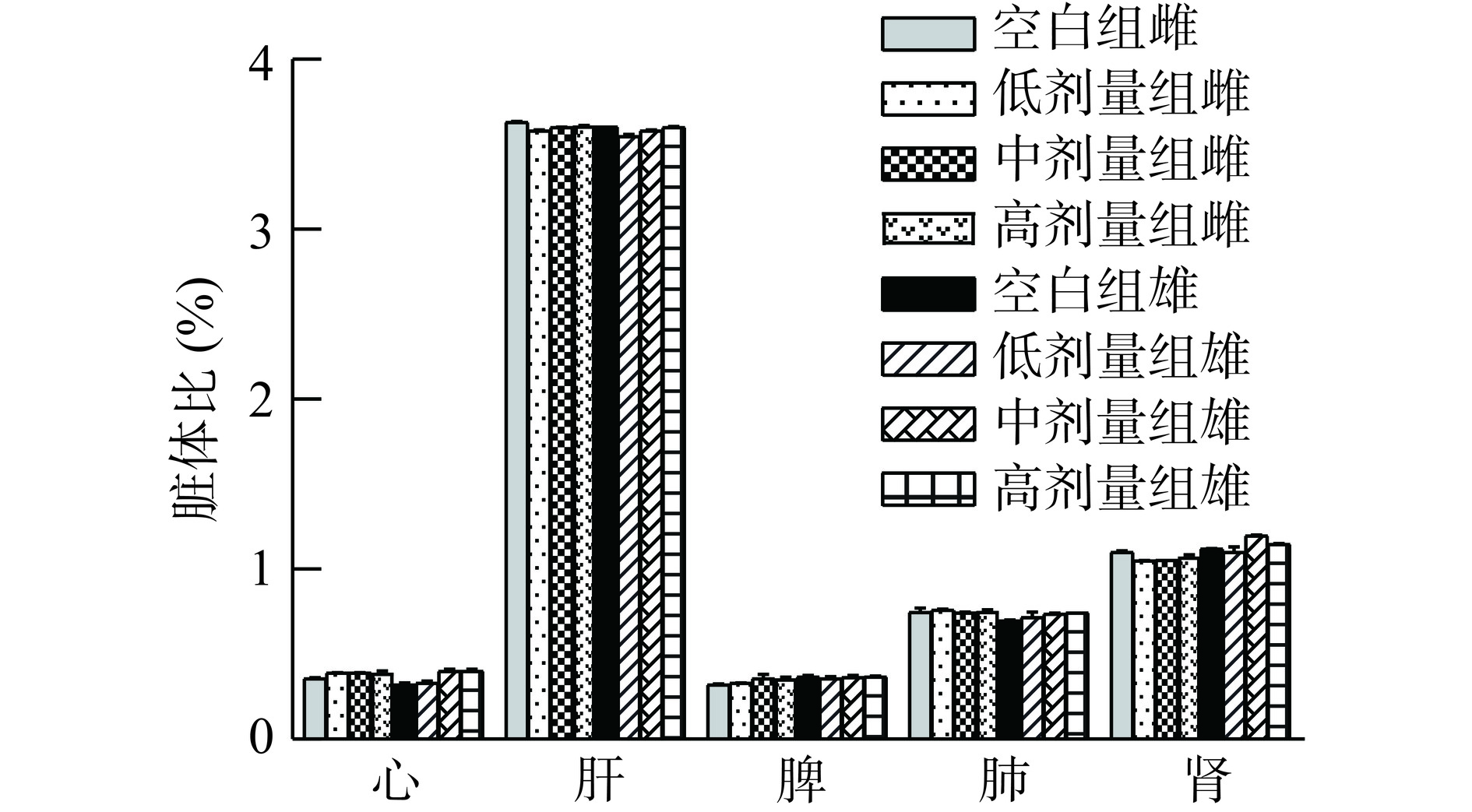
脏体比是动物安全性评价试验中的常用指标[29],可反映受试物对动物机体的损伤程度。空白组与试验组的脏体比如图1所示,与空白组相比,试验组小鼠心、肝、脾、肺及肾各脏器的脏体比无明显差异(P>0.05),且处于正常水平。表明表明小鼠生长发育正常,牡丹蛋白未对小鼠的器官生长和发育产生不良影响。
2.1.3 剂量分级
由GB 15193.3-2014《食品安全国家标准 急性经口毒性试验》表G.1急性毒性(LD50)剂量分级表可知小鼠一次经口LD50在5001~15000 mg/kg范围内为实际无毒。急性毒性试验表明牡丹蛋白的LD50>11700 mg/kg,在实际无毒范围内。
2.2 28 d经口毒性试验结果
2.2.1 体重及食物利用率
大鼠连续灌胃牡丹蛋白溶液28 d内,无死亡情况,未发现大鼠中毒及其他异常现象。大鼠进食量和饮水量正常、大小便无异物、生长发育状态良好。各组大鼠体重增长与食物利用率情况如表2所示,牡丹蛋白各剂量组与空白组相比,大鼠体重增长与食物利用率均无显著性差异(P>0.05)。表明牡丹蛋白28 d内对大鼠的摄食行为和能量代谢没有显著影响,可以维持大鼠的正常生理功能和体重平衡。
表 2 28 d毒性试验大鼠体重与食物利用率情况Table 2. Weight and food utilization rate of rats in 28 d toxicity test性别 组别 原始体重(g) 终体重(g) 体重增长量(g) 总进食量(g) 食物利用率(%) 雌性 空白组 65.09±3.37 177.12±19.11 112.02±17.61 2727.77 26.42 低剂量组 65.99±1.38 176.5±11.5 110.5±10.48 2627.84 25.23 中剂量组 68.94±4.47 180.93±9.42 111.99±7.23 2748.49 24.45 高剂量组 67.27±1.81 184.65±7.79 117.38±8.44 2605.57 26.03 雄性 空白组 67.71±2.85 229.72±18.14 162±15.65 3263.08 29.79 低剂量组 69.36±2.04 231.77±14.76 162.4±14.13 3240.81 30.07 中剂量组 70.63±2.78 243.45±12.36 172.81±10.95 3369.43 30.77 高剂量组 72.39±2.04 240.47±12.06 168.07±11.35 3342.71 30.17 2.2.2 脏体比
测量不同剂量组的大鼠脏体比,结果如图2所示。与空白组进行比较,发现牡丹蛋白各剂量组与空白组之间的脏体比没有显著性差异(P>0.05)。结果表明,在实验过程中,各剂量组的大鼠机体生命活动表现出正常水平,器官的生长和发育也没有出现异常情况。这意味着牡丹蛋白在各剂量组下对大鼠的整体健康没有产生不良影响。
2.2.3 血常规指标的测定
血液中的血细胞主要是红细胞、白细胞和血小板。28 d经口毒性试验血常规指标测定结果如表3所示,牡丹蛋白各剂量组与空白组的各项血细胞数量大体一致,其变化在正常水平范围内,无显著性差异(P>0.05)。表明牡丹蛋白溶液能被大鼠有效吸收和利用,以维持正常的血细胞计数和血红蛋白水平,满足大鼠正常的血细胞生成和功能需求。
表 3 28 d经口毒性试验血常规指标Table 3. Blood routine indexes of oral toxicity test at 28 d组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 白细胞
(×109/L)3.39±1.74 3.06±1.48 3.64±1.67 3.84±1.89 3.91±1.87 4.14±1.64 4.05±1.73 3.88±1.63 中性细胞(%) 0.55±0.46 0.53±0.17 0.63±0.22 0.61±0.17 0.55±0.29 0.55±0.17 0.52±0.24 0.43±0.47 淋巴细胞(%) 3.67±1.20 3.56±1.27 3.74±1.49 3.12±1.71 3.15±1.48 3.50±1.36 3.31±1.09 3.25±1.29 单核细胞(%) 0.09±0.08 0.13±0.06 0.20±0.07 0.26±0.12 0.19±0.10 0.21±0.14 0.24±0.26 0.23±0.30 嗜酸细胞(%) 0.07±0.03 0.05±0.04 0.06±0.02 0.06±0.03 0.07±0.03 0.08±0.04 0.08±0.04 0.07±0.04 嗜碱细胞(%) 0.01±0.01 0.01±0.01 0.01±0.01 0.01±0.01 0.02±0.01 0.01±0.01 0.02±0.01 0.01±0.01 红细胞
(×1012/L)6.00±0.51 6.16±0.31 5.66±0.70 6.15±0.39 6.83±1.05 6.12±1.10 6.13±0.85 5.38±1.17 血红蛋白(g/L) 133.60±7.9 139.17±6.40 132.83±8.68 137.50±8.60 139.50±8.53 139.00±7.57 139.50±7.69 135.20±7.78 2.2.4 血生化指标的测定
生化指标检测主要用于检测机体肝肾功能、血糖、血脂、电解质水平是否正常,对于评价机体是否处于正常状态具有重要意义[30]。28 d经口毒性试验血生化指标测定结果如表4所示,牡丹蛋白各剂量组各项生化指标值无异常波动,与空白组相比均无显著性差异(P>0.05)。表明牡丹蛋白对大鼠生理机能无影响,在大鼠体内具有良好的生物相容性,不引起明显的代谢紊乱或毒性反应。
表 4 28 d经口毒性试验血生化指标Table 4. Blood biochemical indexes of oral toxicity test at 28 d组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 总蛋白(g/L) 50.51±1.76 51.09±1.08 49.03±1.74 48.09±1.16 49.78±2.77 52.32±2.02 47.58±2.78 47.30±2.78 白蛋白(g/L) 32.39±0.89 34.34±0.63 31.05±0.75 31.47±1.01 36.58±1.49 35.39±1.41 36.28±1.32 37.40±1.32 丙氨酸氨基转移酶(U/L) 54.68±3.84 55.75±3.35 55.02±3.69 56.26±3.75 61.94±5.98 62.13±4.66 59.97±4.93 61.34±4.68 天门冬氨酸氨基转移酶(U/L) 210.15±5.63 211.76±5.46 204.03±5.19 201.12±5.09 219.76±6.38 223.92±5.43 217.52±5.29 216.97±6.21 碱性磷酸酶 (U/L) 142.75±9.55 150.18±7.41 153.58±8.42 147.77±9.36 178.76±6.88 177.89±7.91 185.00±8.90 183.57±7.40 尿素(μmol/L) 5.49±1.24 5.48±0.96 5.33±1.19 5.23±0.86 6.29±0.59 6.11±0.64 5.78±0.71 5.83±0.81 肌酐(μmol/L) 71.91±3.18 63.86±2.52 69.81±3.09 67.45±3.01 69.67±2.74 63.30±2.82 69.80±2.05 67.75±2.53 葡萄糖(mmol/L) 7.68±1.25 6.80±1.00 7.46±1.22 7.36±0.96 6.30±1.24 6.32±1.27 6.55±1.43 6.89±1.47 总胆固醇(mmol/L) 1.11±0.26 1.19±0.39 1.08±0.26 1.04±0.15 1.17±0.38 1.06±0.28 0.97±0.26 1.10±0.26 甘油三酯(mmol/L) 0.84±0.32 0.72±0.29 0.79±0.3 0.76±0.22 0.84±0.18 0.78±0.24 0.75±0.16 0.73±0.16 氯(mmol/L) 112.31±2.07 111.74±2.36 108.99±2.02 111.30±2.90 118.50±2.34 110.73±2.10 110.43±1.73 109.67±1.86 钾(mmol/L) 6.37±0.11 6.21±0.24 6.21±0.11 6.19±0.11 7.20±0.40 7.03±0.71 7.22±0.24 7.18±0.24 钠(mmol/L) 129.37±3.09 129.87±3.08 125.62±3.02 124.10±2.13 128.34±2.92 129.47±2.05 124.16±2.36 126.13±2.36 2.2.5 HE染色结果
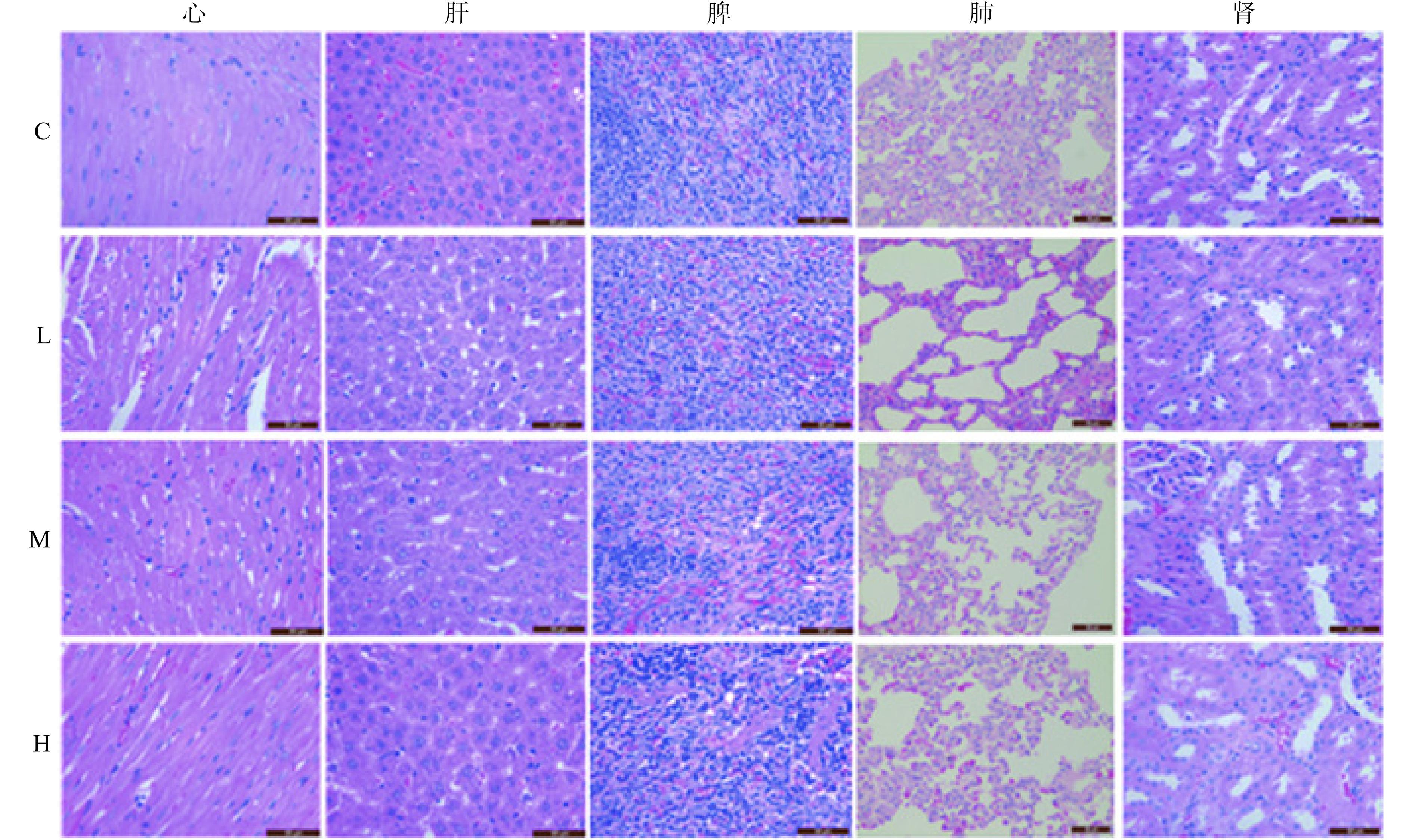
连续灌胃牡丹蛋白溶液28 d后,取大鼠脏器进行HE染色,观察各脏器病变情况。结果如图3所示,牡丹蛋白各剂量组与空白组大鼠的心脏、肝脏、脾脏、肺脏及肾脏的病理组织学观察均未见明显异常。表明连续灌胃大鼠牡丹蛋白28 d后,并没有对大鼠的脏器产生明显的病理变化、功能紊乱或毒性病变。这进一步证明了牡丹蛋白的安全性和对大鼠健康的无害性。
![]() 图 3 28 d毒性试验大鼠脏器病理切片图(400×)注:C-空白组,L-牡丹蛋白低剂量组,M-牡丹蛋白中剂量组,H-牡丹蛋白高剂量组;图5同。Figure 3. Pathological section map of rat organs in 28 d toxicity test (400×)
图 3 28 d毒性试验大鼠脏器病理切片图(400×)注:C-空白组,L-牡丹蛋白低剂量组,M-牡丹蛋白中剂量组,H-牡丹蛋白高剂量组;图5同。Figure 3. Pathological section map of rat organs in 28 d toxicity test (400×)2.3 90 d经口毒性试验结果
2.3.1 体重及食物利用率
连续灌胃牡丹蛋白溶液90 d内,各组均未出现死亡,且行为活动、精神状态、排泄物等均表现正常,生长发育状态良好。各组大鼠体重增长与食物利用率如表5所示,牡丹蛋白各剂量组与空白组相比,大鼠体重增长与食物利用率均无显著性差异(P>0.05)。表明灌胃牡丹蛋白90 d未对大鼠的生长和发育产生明显的影响。
表 5 90 d毒性试验大鼠体重与食物利用率情况Table 5. Weight and food utilization rate of rats in 90 d toxicity test性别 组别 原始体重(g) 终体重(g) 体重增长量(g) 总进食
量(g)食物利
用率(%)雌性 空白组 87.23±4.85 290.64±21.37 203.41±21.28 9616.41 11.00 低剂量组 95.45±1.42** 280.75±21.12 185.29±21.33 9943.91 9.73 中剂量组 95.75±2.46** 277.49±31.95 181.73±30.51 9897.37 9.55 高剂量组 87.84±4.52 265.59±28.94 177.75±28.52 9315.62 9.92 雄性 空白组 85.58±3.07 519.63±49.2 434.04±48.86 14007.68 16.37 低剂量组 86.04±9.3 526.58±19.84 440.54±18.79 13853.63 16.69 中剂量组 82.88±3.54 537.7±57.28 454.82±57.08 13860.36 17.25 高剂量组 83.35±6.44 520.59±37.79 437.24±40.41 13333.21 17.20 2.3.2 脏体比
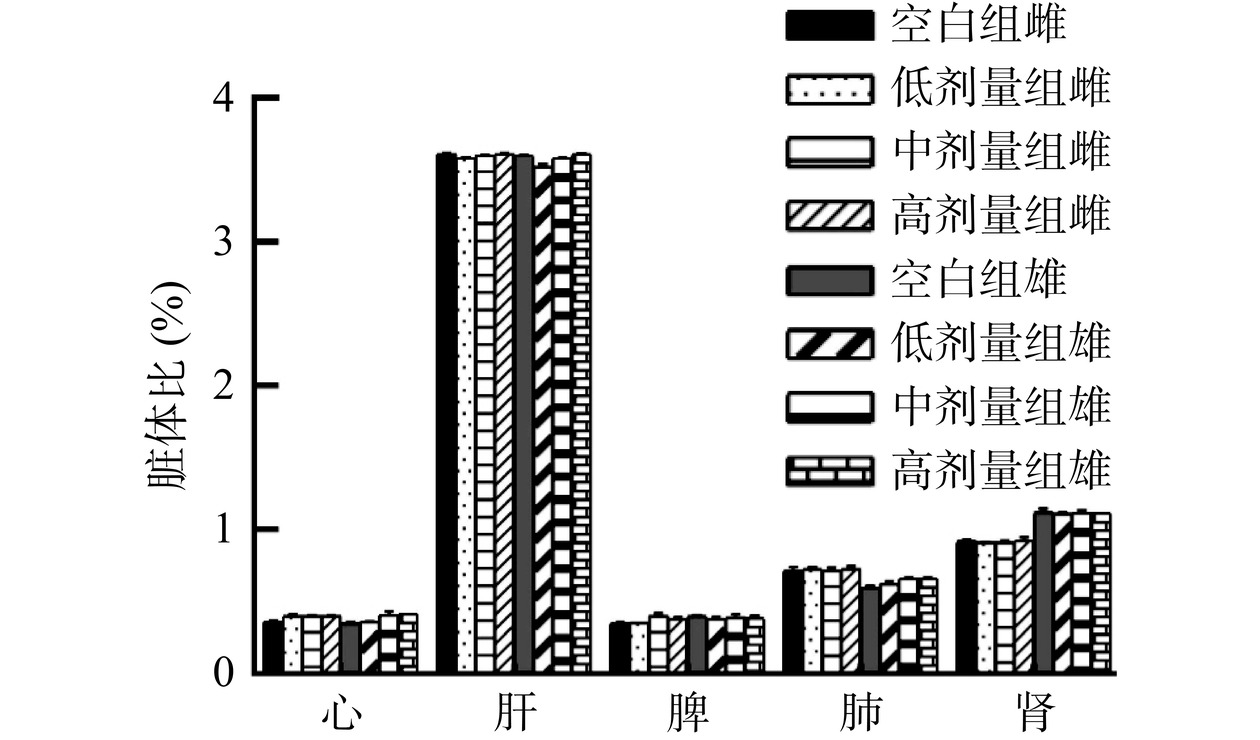
连续灌胃牡丹蛋白90 d后各组大鼠脏体比情况如图4所示,同性别下,牡丹蛋白各剂量组与空白组相比无显著性差异(P>0.05)。表明连续灌胃牡丹蛋白90 d未对大鼠器官生长和发育产生不良影响。
2.3.3 血常规指标的测定
90 d经口毒性试验血常规指标如表6所示,牡丹蛋白各剂量组与空白组的各项血细胞数量大体一致,其变化在正常水平范围内,无显著性差异(P>0.05)。表明连续灌胃牡丹蛋白90 d未对大鼠血细胞造成损害。
表 6 90 d经口毒性试验血常规指标Table 6. Blood routine indexes of oral toxicity test at 90 d组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 白细胞(×109/L) 3.43±2.08 3.48±2.07 3.65±2.16 3.27±2.10 5.16±2.24 5.47±2.14 5.02±2.35 5.74±2.16 中性细胞(%) 0.54±0.29 0.66±0.45 0.58±0.39 0.64±0.31 0.844±0.83 0.94±0.91 0.81±0.82 0.89±0.93 淋巴细胞(%) 2.61±1.77 2.59±1.55 2.76±1.52 2.55±1.95 3.97±1.17 3.87±1.73 3.85±1.51 3.95±1.04 单核细胞(%) 0.23±0.11 0.28±0.12 0.24±0.15 0.29±0.13 0.30±0.31 0.38±0.24 0.36±0.16 0.38±0.31 嗜酸细胞(%) 0.05±0.05 0.05±0.04 0.06±0.04 0.07±0.06 0.21±0.28 0.28±0.26 0.20±0.26 0.23±0.24 嗜碱细胞(%) 0.01±0.01 0.01±0.01 0.01±0.01 0.01±0.01 0.02±0.01 0.01±0.01 0.01±0.01 0.02±0.01 红细胞(×1012/L) 7.04±2.13 7.15±1.89 7.23±1.98 6.98±2.08 7.69±3.33 7.37±3.41 7.35±3.32 7.42±3.24 血红蛋白(g/L) 156.67±9.17 151.60±8.93 158.40±9.07 157.00±8.90 153.00±8.94 155.00±9.03 154.00±8.71 151.83±9.15 2.3.4 血生化指标的测定
90 d经口毒性试验生化指标如表7所示,牡丹蛋白各剂量组各项生化指标值均无异常波动,各项指标均处于正常水平,与空白组相比无显著性差异(P>0.05)。表明连续灌胃牡丹蛋白90 d不影响大鼠的肝脏功能、肾脏排泄和其他重要的代谢机制,机体各器官功能运转正常。
表 7 90 d经口毒性试验血生化指标Table 7. Blood biochemical indexes of oral toxicity test at 90 d组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 总蛋白(g/L) 60.6±3.40 66.63±5.87 66.08±5.87 62.67±5.11 58.76±1.49 58.39±3.25 60.59±3.25 56.81±1.70 白蛋白(g/L) 31.4±1.59 34.22±1.94 31.44±1.94 31.89±2.48 29.03±1.51 28.92±1.97 28.40±1.97 28.36±0.55 丙氨酸氨基转移酶(U/L) 81.6±5.11 84.86±5.01 88.54±5.01 85.25±5.48 71.30±5.34 79.02±5.26 72.95±5.36 74.31±5.29 天门冬氨酸氨基转移酶(U/L) 153.11±6.03 160.12±5.62 156.00±5.92 159.08±5.61 156.89±8.53 157.66±9.95 158.10±9.95 155.88±9.36 碱性磷酸酶(U/L) 113.06±7.10 116.03±6.83 124.47±6.71 105.74±7.18 112.51±9.84 109.37±9.59 111.95±9.79 114.75±9.92 尿素(μmol/L) 6.64±3.33 6.32±2.48 6.24±2.48 6.40±3.43 4.93±3.50 5.18±2.69 4.62±2.69 4.78±2.28 肌酐(μmol/L) 61.23±9.03 57.64±9.65 58.27±9.45 60.36±9.04 63.26±6.20 60.70±5.83 62.47±5.83 62.04±6.01 葡萄糖(mmol/L) 8.95±1.63 9.68±2.08 9.31±2.08 8.88±1.99 9.95±1.52 9.03±2.28 9.15±2.28 9.51±2.47 总胆固醇(mmol/L) 1.07±0.20 1.15±0.14 1.18±0.14 1.22±0.24 1.13±0.08 1.16±0.18 1.25±0.18 1.28±0.31 甘油三酯(mmol/L) 0.84±0.10 0.78±0.12 0.70±0.12 0.72±0.13 0.89±0.14 0.80±0.11 0.94±0.11 0.87±0.15 氯(mmol/L) 105.44±2.66 108.28±2.56 106.40±2.73 102.05±2.44 106.37±2.34 105.44±2.56 103.02±2.86 107.23±2.80 钾(mmol/L) 6.23±0.40 6.78±0.59 6.32±0.64 6.79±0.46 6.82±0.15 7.17±0.28 7.31±0.28 7.32±0.24 钠(mmol/L) 144.92±2.67 154.54±2.61 144.64±2.33 147.92±2.22 144.09±2.61 146.65±2.68 152.28±2.53 143.15±2.18 2.3.5 HE染色结果
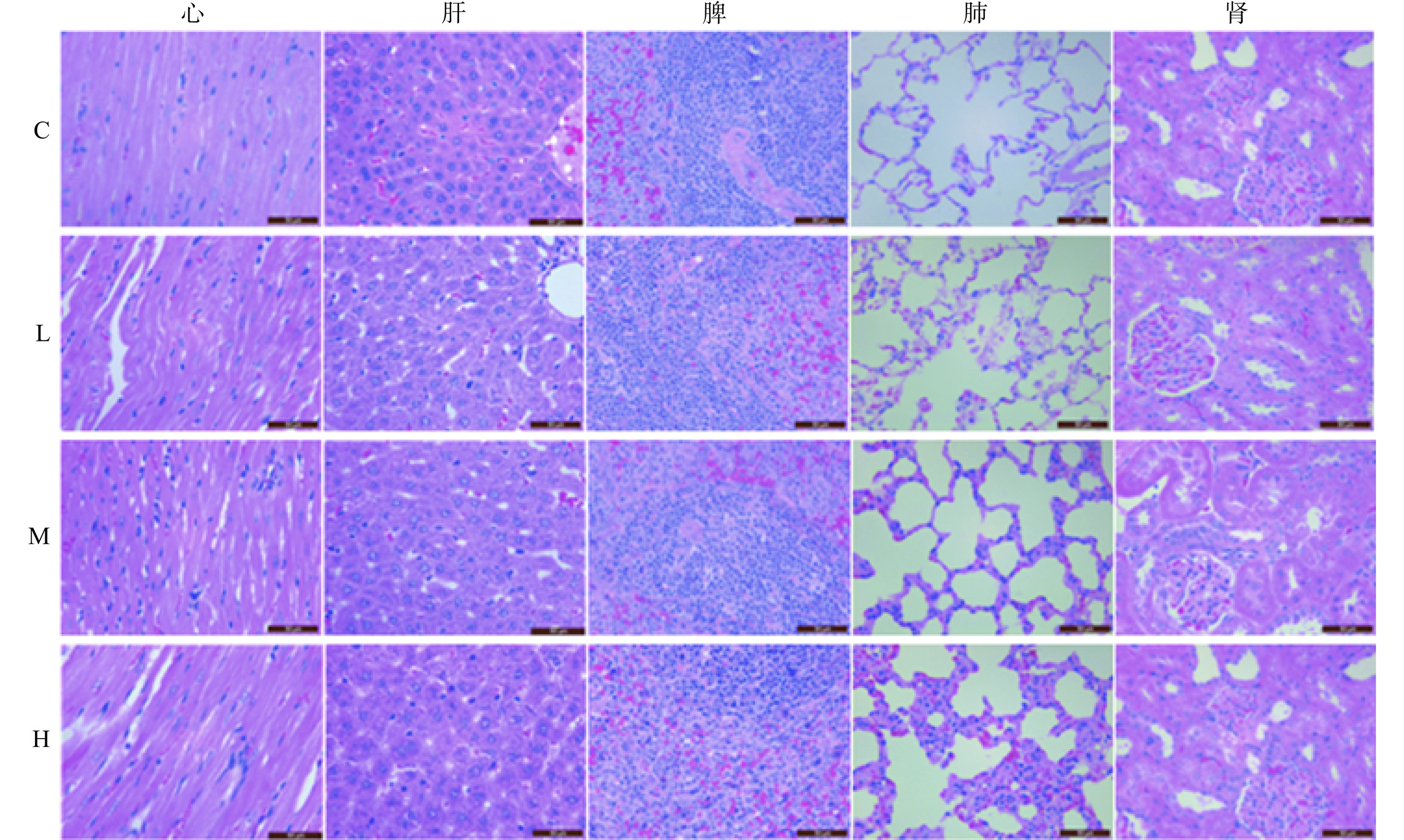
连续灌胃牡丹蛋白溶液90 d后,取大鼠心、肝、脾、肺及肾进行HE染色。结果如图5所示,牡丹蛋白各剂量组与空白组大鼠的心、肝、脾、肺、肾中均未见中毒性病变,表明牡丹蛋白对大鼠各组织的形态结构无明显影响。
3. 结论
急性经口毒性试验表明,在灌胃牡丹蛋白溶液后14 d内,各组小鼠均无死亡状况。与空白组相比,试验组小鼠体重、食物利用率与脏体比均无显著性差异(P>0.05),处于正常水平。
28 d与90 d经口毒性试验结果表明,牡丹蛋白低、中、高剂量组大鼠食物利用率、脏体比及各项生命活动与空白组相比无异常,血常规指标及血生化指标值与空白组无显著性差异(P>0.05),脏器病理切片显示大鼠各组织形态完好,未见中毒性病变。由此可知,长期灌胃牡丹蛋白溶液对大鼠无毒性作用。综上可知,在11700 mg/kg剂量范围内牡丹蛋白安全无毒,可应用于食品领域,同时本研究可为牡丹蛋白的开发提供实验依据。
-
图 3 28 d毒性试验大鼠脏器病理切片图(400×)
注:C-空白组,L-牡丹蛋白低剂量组,M-牡丹蛋白中剂量组,H-牡丹蛋白高剂量组;图5同。
Figure 3. Pathological section map of rat organs in 28 d toxicity test (400×)
表 1 急毒试验小鼠体重与食物利用率情况
Table 1 Weight and food utilization rate of mice in acute toxicity test
性别 组别 原始体重(g) 终体重(g) 体重增长量(g) 总进食量(g) 食物利用率(%) 雌性 空白组 21.77±1.18 28.04±1.37 5.17±1.13 329.01±21.74 7.90±1.21 试验组 21.93±0.94 26.74±1.3 4.32±0.52* 321.41±24.01 11.30±2.28 雄性 空白组 22.89±1.12 33.69±2.18 9.59±1.78 430.61±64.18 6.74±0.02 试验组 23.82±1.12 33.83±1.74 8.75±1.58 428.49±19.63 10.21±0.41 注:*表示与空白组相比有显著性差异(P<0.05),**表示与空白组相比有极显著性差异(P<0.01);表5同。 表 2 28 d毒性试验大鼠体重与食物利用率情况
Table 2 Weight and food utilization rate of rats in 28 d toxicity test
性别 组别 原始体重(g) 终体重(g) 体重增长量(g) 总进食量(g) 食物利用率(%) 雌性 空白组 65.09±3.37 177.12±19.11 112.02±17.61 2727.77 26.42 低剂量组 65.99±1.38 176.5±11.5 110.5±10.48 2627.84 25.23 中剂量组 68.94±4.47 180.93±9.42 111.99±7.23 2748.49 24.45 高剂量组 67.27±1.81 184.65±7.79 117.38±8.44 2605.57 26.03 雄性 空白组 67.71±2.85 229.72±18.14 162±15.65 3263.08 29.79 低剂量组 69.36±2.04 231.77±14.76 162.4±14.13 3240.81 30.07 中剂量组 70.63±2.78 243.45±12.36 172.81±10.95 3369.43 30.77 高剂量组 72.39±2.04 240.47±12.06 168.07±11.35 3342.71 30.17 表 3 28 d经口毒性试验血常规指标
Table 3 Blood routine indexes of oral toxicity test at 28 d
组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 白细胞
(×109/L)3.39±1.74 3.06±1.48 3.64±1.67 3.84±1.89 3.91±1.87 4.14±1.64 4.05±1.73 3.88±1.63 中性细胞(%) 0.55±0.46 0.53±0.17 0.63±0.22 0.61±0.17 0.55±0.29 0.55±0.17 0.52±0.24 0.43±0.47 淋巴细胞(%) 3.67±1.20 3.56±1.27 3.74±1.49 3.12±1.71 3.15±1.48 3.50±1.36 3.31±1.09 3.25±1.29 单核细胞(%) 0.09±0.08 0.13±0.06 0.20±0.07 0.26±0.12 0.19±0.10 0.21±0.14 0.24±0.26 0.23±0.30 嗜酸细胞(%) 0.07±0.03 0.05±0.04 0.06±0.02 0.06±0.03 0.07±0.03 0.08±0.04 0.08±0.04 0.07±0.04 嗜碱细胞(%) 0.01±0.01 0.01±0.01 0.01±0.01 0.01±0.01 0.02±0.01 0.01±0.01 0.02±0.01 0.01±0.01 红细胞
(×1012/L)6.00±0.51 6.16±0.31 5.66±0.70 6.15±0.39 6.83±1.05 6.12±1.10 6.13±0.85 5.38±1.17 血红蛋白(g/L) 133.60±7.9 139.17±6.40 132.83±8.68 137.50±8.60 139.50±8.53 139.00±7.57 139.50±7.69 135.20±7.78 表 4 28 d经口毒性试验血生化指标
Table 4 Blood biochemical indexes of oral toxicity test at 28 d
组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 总蛋白(g/L) 50.51±1.76 51.09±1.08 49.03±1.74 48.09±1.16 49.78±2.77 52.32±2.02 47.58±2.78 47.30±2.78 白蛋白(g/L) 32.39±0.89 34.34±0.63 31.05±0.75 31.47±1.01 36.58±1.49 35.39±1.41 36.28±1.32 37.40±1.32 丙氨酸氨基转移酶(U/L) 54.68±3.84 55.75±3.35 55.02±3.69 56.26±3.75 61.94±5.98 62.13±4.66 59.97±4.93 61.34±4.68 天门冬氨酸氨基转移酶(U/L) 210.15±5.63 211.76±5.46 204.03±5.19 201.12±5.09 219.76±6.38 223.92±5.43 217.52±5.29 216.97±6.21 碱性磷酸酶 (U/L) 142.75±9.55 150.18±7.41 153.58±8.42 147.77±9.36 178.76±6.88 177.89±7.91 185.00±8.90 183.57±7.40 尿素(μmol/L) 5.49±1.24 5.48±0.96 5.33±1.19 5.23±0.86 6.29±0.59 6.11±0.64 5.78±0.71 5.83±0.81 肌酐(μmol/L) 71.91±3.18 63.86±2.52 69.81±3.09 67.45±3.01 69.67±2.74 63.30±2.82 69.80±2.05 67.75±2.53 葡萄糖(mmol/L) 7.68±1.25 6.80±1.00 7.46±1.22 7.36±0.96 6.30±1.24 6.32±1.27 6.55±1.43 6.89±1.47 总胆固醇(mmol/L) 1.11±0.26 1.19±0.39 1.08±0.26 1.04±0.15 1.17±0.38 1.06±0.28 0.97±0.26 1.10±0.26 甘油三酯(mmol/L) 0.84±0.32 0.72±0.29 0.79±0.3 0.76±0.22 0.84±0.18 0.78±0.24 0.75±0.16 0.73±0.16 氯(mmol/L) 112.31±2.07 111.74±2.36 108.99±2.02 111.30±2.90 118.50±2.34 110.73±2.10 110.43±1.73 109.67±1.86 钾(mmol/L) 6.37±0.11 6.21±0.24 6.21±0.11 6.19±0.11 7.20±0.40 7.03±0.71 7.22±0.24 7.18±0.24 钠(mmol/L) 129.37±3.09 129.87±3.08 125.62±3.02 124.10±2.13 128.34±2.92 129.47±2.05 124.16±2.36 126.13±2.36 表 5 90 d毒性试验大鼠体重与食物利用率情况
Table 5 Weight and food utilization rate of rats in 90 d toxicity test
性别 组别 原始体重(g) 终体重(g) 体重增长量(g) 总进食
量(g)食物利
用率(%)雌性 空白组 87.23±4.85 290.64±21.37 203.41±21.28 9616.41 11.00 低剂量组 95.45±1.42** 280.75±21.12 185.29±21.33 9943.91 9.73 中剂量组 95.75±2.46** 277.49±31.95 181.73±30.51 9897.37 9.55 高剂量组 87.84±4.52 265.59±28.94 177.75±28.52 9315.62 9.92 雄性 空白组 85.58±3.07 519.63±49.2 434.04±48.86 14007.68 16.37 低剂量组 86.04±9.3 526.58±19.84 440.54±18.79 13853.63 16.69 中剂量组 82.88±3.54 537.7±57.28 454.82±57.08 13860.36 17.25 高剂量组 83.35±6.44 520.59±37.79 437.24±40.41 13333.21 17.20 表 6 90 d经口毒性试验血常规指标
Table 6 Blood routine indexes of oral toxicity test at 90 d
组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 白细胞(×109/L) 3.43±2.08 3.48±2.07 3.65±2.16 3.27±2.10 5.16±2.24 5.47±2.14 5.02±2.35 5.74±2.16 中性细胞(%) 0.54±0.29 0.66±0.45 0.58±0.39 0.64±0.31 0.844±0.83 0.94±0.91 0.81±0.82 0.89±0.93 淋巴细胞(%) 2.61±1.77 2.59±1.55 2.76±1.52 2.55±1.95 3.97±1.17 3.87±1.73 3.85±1.51 3.95±1.04 单核细胞(%) 0.23±0.11 0.28±0.12 0.24±0.15 0.29±0.13 0.30±0.31 0.38±0.24 0.36±0.16 0.38±0.31 嗜酸细胞(%) 0.05±0.05 0.05±0.04 0.06±0.04 0.07±0.06 0.21±0.28 0.28±0.26 0.20±0.26 0.23±0.24 嗜碱细胞(%) 0.01±0.01 0.01±0.01 0.01±0.01 0.01±0.01 0.02±0.01 0.01±0.01 0.01±0.01 0.02±0.01 红细胞(×1012/L) 7.04±2.13 7.15±1.89 7.23±1.98 6.98±2.08 7.69±3.33 7.37±3.41 7.35±3.32 7.42±3.24 血红蛋白(g/L) 156.67±9.17 151.60±8.93 158.40±9.07 157.00±8.90 153.00±8.94 155.00±9.03 154.00±8.71 151.83±9.15 表 7 90 d经口毒性试验血生化指标
Table 7 Blood biochemical indexes of oral toxicity test at 90 d
组别 雌性 雄性 空白组 低剂量组 中剂量组 高剂量组 空白组 低剂量组 中剂量组 高剂量组 总蛋白(g/L) 60.6±3.40 66.63±5.87 66.08±5.87 62.67±5.11 58.76±1.49 58.39±3.25 60.59±3.25 56.81±1.70 白蛋白(g/L) 31.4±1.59 34.22±1.94 31.44±1.94 31.89±2.48 29.03±1.51 28.92±1.97 28.40±1.97 28.36±0.55 丙氨酸氨基转移酶(U/L) 81.6±5.11 84.86±5.01 88.54±5.01 85.25±5.48 71.30±5.34 79.02±5.26 72.95±5.36 74.31±5.29 天门冬氨酸氨基转移酶(U/L) 153.11±6.03 160.12±5.62 156.00±5.92 159.08±5.61 156.89±8.53 157.66±9.95 158.10±9.95 155.88±9.36 碱性磷酸酶(U/L) 113.06±7.10 116.03±6.83 124.47±6.71 105.74±7.18 112.51±9.84 109.37±9.59 111.95±9.79 114.75±9.92 尿素(μmol/L) 6.64±3.33 6.32±2.48 6.24±2.48 6.40±3.43 4.93±3.50 5.18±2.69 4.62±2.69 4.78±2.28 肌酐(μmol/L) 61.23±9.03 57.64±9.65 58.27±9.45 60.36±9.04 63.26±6.20 60.70±5.83 62.47±5.83 62.04±6.01 葡萄糖(mmol/L) 8.95±1.63 9.68±2.08 9.31±2.08 8.88±1.99 9.95±1.52 9.03±2.28 9.15±2.28 9.51±2.47 总胆固醇(mmol/L) 1.07±0.20 1.15±0.14 1.18±0.14 1.22±0.24 1.13±0.08 1.16±0.18 1.25±0.18 1.28±0.31 甘油三酯(mmol/L) 0.84±0.10 0.78±0.12 0.70±0.12 0.72±0.13 0.89±0.14 0.80±0.11 0.94±0.11 0.87±0.15 氯(mmol/L) 105.44±2.66 108.28±2.56 106.40±2.73 102.05±2.44 106.37±2.34 105.44±2.56 103.02±2.86 107.23±2.80 钾(mmol/L) 6.23±0.40 6.78±0.59 6.32±0.64 6.79±0.46 6.82±0.15 7.17±0.28 7.31±0.28 7.32±0.24 钠(mmol/L) 144.92±2.67 154.54±2.61 144.64±2.33 147.92±2.22 144.09±2.61 146.65±2.68 152.28±2.53 143.15±2.18 -
[1] 宋红卫, 张惠喜, 孙启亮. 牡丹籽粕——蛋白质饲料新资源[J]. 饲料博览,2020,338(6):40−41,45. [SONG Hongwei, ZHANG Huixi, SUN Qiliang. Peony seed meal—A new resource for protein feed[J]. Feed Review,2020,338(6):40−41,45.] SONG Hongwei, ZHANG Huixi, SUN Qiliang. Peony seed meal—A new resource for protein feed[J]. Feed Review, 2020, 338(6): 40−41,45.
[2] 刘嘉琪. 油用牡丹的发展现状[J]. 山西林业科技,2019,48(3):61−62. [LIU Jiaqi. Development status of oil peony[J]. Shanxi Forestry Science and Technology,2019,48(3):61−62.] doi: 10.3969/j.issn.1007-726X.2019.03.026 LIU Jiaqi. Development status of oil peony[J]. Shanxi Forestry Science and Technology, 2019, 48(3): 61−62. doi: 10.3969/j.issn.1007-726X.2019.03.026
[3] JIN F, XU J, LIU X R, et al. Roasted tree peony (Paeonia ostii) seed oil:Benzoic acid levels and physicochemical characteristics[J]. International Journal of Food Properties,2019,22(1):499−510. doi: 10.1080/10942912.2019.1588902
[4] LIN X X, YI X P, NI S. Optimization of ultrasonic-assisted extraction and fatty acid composition of oil from Paeonia suffruticosa Andr. seed[J]. Journal of Oleo Science,2021,70(1):39−49. doi: 10.5650/jos.ess20206
[5] 王青, 孙金月, 刘超等. 响应曲面法优化提取牡丹籽粕蛋白的工艺及应用研究[J]. 食品工业,2017,38(1):117−121. [WANG Qing, SUN Jinyue, LIU Chao, et al. Study on protein extraction technology from peony seed meals optimized by response surface methodology[J]. The Food Industry,2017,38(1):117−121.] WANG Qing, SUN Jinyue, LIU Chao, et al. Study on protein extraction technology from peony seed meals optimized by response surface methodology[J]. The Food Industry, 2017, 38(1): 117−121.
[6] DENG R X, GAO J Y, YI J P, et al. Peony seeds oil by-products:Chemistry and bioactivity[J]. Industrial Crops & Products,2022,187:115333.
[7] QIU S, WANG X, ZAN M, et al. The insight into separation of oleic, linoleic, and alpha-linolenic acid in peony seed oil from eutectic behaviors, polymorphic transition and solid-liquid phase equilibrium[J]. LWT-Food Science & Technology,2021,138:110738.
[8] 马贵敏, 程丹丹, 黄志强, 等. 牡丹籽油营养成分、功能及其应用[J]. 中国野生植物资源,2021,40(7):61−65. [MA Guimin, CHENG Dandan, HUANG Zhiqiang, et al. Nutrient ingredient, function and application of peony seed oil[J]. Chinese Wild Plant Resources,2021,40(7):61−65.] doi: 10.3969/j.issn.1006-9690.2021.07.012 MA Guimin, CHENG Dandan, HUANG Zhiqiang, et al. Nutrient ingredient, function and application of peony seed oil[J]. Chinese Wild Plant Resources, 2021, 40(7): 61−65. doi: 10.3969/j.issn.1006-9690.2021.07.012
[9] 张凯月, 贺春玲, 侯小改, 等. 油用牡丹经济价值和景观生态价值研究现状[J]. 中国农学通报,2019,35(10):66−71. [ZHANG Kaiyue, HE Chunling, HOU Xiaogai, et al. Economic value and landscape ecological value of oil tree peony:Research status[J]. Chinese Agricultural Science Bulletin,2019,35(10):66−71.] ZHANG Kaiyue, HE Chunling, HOU Xiaogai, et al. Economic value and landscape ecological value of oil tree peony: Research status[J]. Chinese Agricultural Science Bulletin, 2019, 35(10): 66−71.
[10] YANG X, ZHANG D, SONG L M, et al. Chemical profile and antioxidant activity of the oil from peony seeds (Paeonia suffruticosa Andr.)[J]. Oxidative Medicine and Cellular Longevity,2017,2017:9164905.
[11] 姚瑶. 牡丹籽油及剩余物应用与研究进展[J]. 山东化工,2022,51(4):66−68. [YAO Yao. Application and research progress of peony seed oil and residues[J]. Shandong Chemical Industry,2022,51(4):66−68.] doi: 10.3969/j.issn.1008-021X.2022.04.019 YAO Yao. Application and research progress of peony seed oil and residues[J]. Shandong Chemical Industry, 2022, 51(4): 66−68. doi: 10.3969/j.issn.1008-021X.2022.04.019
[12] 高蕾蕾. 牡丹籽蛋白的理化和功能特性及多肽的抗氧化活性研究[D]. 济南: 齐鲁工业大学, 2018. [GAO Leilei. Study on physicochemical and functional properties of peony seed protein and antioxidant activity of polypeptides[D]. Jinan: Qilu University of Technology, 2018.] GAO Leilei. Study on physicochemical and functional properties of peony seed protein and antioxidant activity of polypeptides[D]. Jinan: Qilu University of Technology, 2018.
[13] 高蕾蕾, 李迎秋. 植物蛋白的研究进展[J]. 江苏调味副食品,2018,155(4):6−10,16. [GAO Leilei, LI Yingqiu. Research progress of plant protein[J]. Jiangsu Condiment and Subsidiary Food,2018,155(4):6−10,16.] doi: 10.16782/j.cnki.32-1235/ts.2018.04.002 GAO Leilei, LI Yingqiu. Research progress of plant protein[J]. Jiangsu Condiment and Subsidiary Food, 2018, 155(4): 6−10,16. doi: 10.16782/j.cnki.32-1235/ts.2018.04.002
[14] KWEK E, ZHU H Y, DING H F, et al. Peony seed oil decreases plasma cholesterol and favorably modulates gut microbiota in hypercholesterolemic hamsters[J]. European Journal of Nutrition,2022,61(5):2341−2356. doi: 10.1007/s00394-021-02785-9
[15] SU J H, MA C Y, LIU C X, et al. Hypolipidemic activity of peony seed oil rich in alpha-linolenic, is mediated through inhibition of lipogenesis and upregulation of fatty acid beta-oxidation[J]. Journal of Food Science,2016,81(4):H1001−H10019.
[16] WU G, SHEN Y, NIE R, et al. The bioactive compounds and cellular antioxidant activity of herbaceous peony (Paeonia lactiflora Pall.) seed oil from China[J]. Journal of Food Science,2020,85(11):3815−3822. doi: 10.1111/1750-3841.15463
[17] 陈容, 胡素素, 郑淳坚, 等. 牡丹籽蛋白提取工艺及其多肽应用研究进展[J]. 现代食品,2021(19):23−27. [CHEN Rong, HU Susu, ZHENG Chunjian, et al. Research progress on extraction technology of peony seed protein and its polypeptide application[J]. Modern Food,2021(19):23−27.] CHEN Rong, HU Susu, ZHENG Chunjian, et al. Research progress on extraction technology of peony seed protein and its polypeptide application[J]. Modern Food, 2021(19): 23−27.
[18] LU J, HUANG Z Q, LIU Y S, et al. The optimization of extraction process, antioxidant, whitening and antibacterial effects of Fengdan peony flavonoids[J]. Molecules,2022,27(2):506. doi: 10.3390/molecules27020506
[19] 张元元. 功能性大豆蛋白的制备及其应用研究[D]. 广州:华南理工大学, 2012. [ZHANG Yuanyuan. The preparation and application of functional soy protein[D]. Guangzhou:South China University of Technology, 2012.] ZHANG Yuanyuan. The preparation and application of functional soy protein[D]. Guangzhou: South China University of Technology, 2012.
[20] 郭顺堂, 徐婧婷, 刘欣然, 等. 我国植物蛋白资源高效利用途径与技术创新[J]. 食品科学技术学报,2019,37(6):8−15. [GUO Shuntang, XU Jingting, LIU Xinran, et al. Efficient utilization and technological innovation of plant-based protein resources in China[J]. Journal of Food Science and Technology,2019,37(6):8−15.] doi: 10.3969/j.issn.2095-6002.2019.06.002 GUO Shuntang, XU Jingting, LIU Xinran, et al. Efficient utilization and technological innovation of plant-based protein resources in China[J]. Journal of Food Science and Technology, 2019, 37(6): 8−15. doi: 10.3969/j.issn.2095-6002.2019.06.002
[21] 陈伟斌. 大豆分离蛋白的功能性和改性研究进展[J]. 粮食加工,2006(4):67−71. [CHEN Weibin. Research progress on functional and modification of soybean protein isolate[J]. Grain Processing,2006(4):67−71.] CHEN Weibin. Research progress on functional and modification of soybean protein isolate[J]. Grain Processing, 2006(4): 67−71.
[22] 鹿杰, 黄志强, 邱敏, 等. 牡丹籽蛋白的制备工艺及其性质研究[J]. 粮食与油脂,2022,35(5):97−102. [LU Jie, HUANG Zhiqiang, QIU Min, et al. Study on the preparation technology and properties of peony seed protein[J]. Grain and Oil,2022,35(5):97−102.] LU Jie, HUANG Zhiqiang, QIU Min, et al. Study on the preparation technology and properties of peony seed protein[J]. Grain and Oil, 2022, 35(5): 97−102.
[23] 国家卫生和计划生育委员会. GB/15193.3-2014 食品安全国家标准 急性经口毒性试验[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission. GB/15193.3-2014 National standard for food safety Acute oral toxicity test[S]. Beijing:China Standard Press, 2016.] National Health and Family Planning Commission. GB/15193.3-2014 National standard for food safety Acute oral toxicity test[S]. Beijing: China Standard Press, 2016.
[24] 黄丹民. 鳄嘴花特征活性组分对HepA移植瘤小鼠的抗肿瘤机制与安全性评价的研究[D]. 镇江:江苏大学, 2016. [HUANG Danmin. Research on characteristic components active in-gredients HepA transplanted anti-tumor tumor bearing mice anti tumor mechanism and safety evaluation of Clinacanyhus nutans (Burm. F.) Linau[D]. Zhenjiang:Jiangsu University, 2016.] HUANG Danmin. Research on characteristic components active in-gredients HepA transplanted anti-tumor tumor bearing mice anti tumor mechanism and safety evaluation of Clinacanyhus nutans (Burm. F.) Linau[D]. Zhenjiang: Jiangsu University, 2016.
[25] 马小龙. 归芪多糖的急性和亚急性毒性评价及延缓大鼠衰老作用机制的研究[D]. 兰州:兰州理工大学, 2016. [MA Xiaolong. Evaluation of acute and subacute toxicity of Guiqi polysaccharides and the mechanism of action of delaying aging in rats[D]. Lanzhou:Lanzhou University of Technology, 2016.] MA Xiaolong. Evaluation of acute and subacute toxicity of Guiqi polysaccharides and the mechanism of action of delaying aging in rats[D]. Lanzhou: Lanzhou University of Technology, 2016.
[26] 国家卫生和计划生育委员会. GB/15193.22-2014食品安全国家标准 28天经口毒性试验[S]. 北京:中国标准出版社, 2014. [National Health and Family Planning Commission. GB/15193.22-2014 National food safety standard 28-day oral toxicity test[S]. Beijing:China Standard Press, 2014.] National Health and Family Planning Commission. GB/15193.22-2014 National food safety standard 28-day oral toxicity test[S]. Beijing: China Standard Press, 2014.
[27] 赵伟, 孙国志. 不同种实验动物间用药量换算[J]. 畜牧兽医科技信息,2010,401(5):52−53. [ZHAO Wei, SUN Guozhi. Conversion of drug dosage between different experimental animals[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine,2010,401(5):52−53.] ZHAO Wei, SUN Guozhi. Conversion of drug dosage between different experimental animals[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2010, 401(5): 52−53.
[28] 国家卫生和计划生育委员会. GB/15193.13-2015食品安全国家标准 90天经口毒性试验[S]. 北京:中国标准出版社, 2015. [National Health and Family Planning Commission. GB/15193.13-2015 National standard for food safety 90-day oral toxicity test[S]. Beijing:China Standard Press, 2015.] National Health and Family Planning Commission. GB/15193.13-2015 National standard for food safety 90-day oral toxicity test[S]. Beijing: China Standard Press, 2015.
[29] 施文祥, 欧超燕, 李胜联, 等. 短期乙醇暴露对雌性大鼠生长发育的影响[J]. 内科,2012,7(3):225−227. [SHI Wenxiang, OU Chaoyan, LI Shenglian, et al. Effects of short-term ethanol exposure on growth and development of female rats[J]. Internal Medicine,2012,7(3):225−227.] doi: 10.3969/j.issn.1673-7768.2012.03.005 SHI Wenxiang, OU Chaoyan, LI Shenglian, et al. Effects of short-term ethanol exposure on growth and development of female rats[J]. Internal Medicine, 2012, 7(3): 225−227. doi: 10.3969/j.issn.1673-7768.2012.03.005
[30] WANG M G, QIU H, ZHANG R Z, et al. Subchronic toxicity of herbal compound "Jiedu Huayu" granules in rat[J]. BMC Complementary and Alternative Medicine,2017,17(1):1−8. doi: 10.1186/s12906-016-1505-2





 下载:
下载:

 下载:
下载:
