Application of Wet Glycosylation Modified Soybean Protein Isolate in Hypo-allergenic Chiba Tofu
-
摘要: 为寻求高效的糖基化改性条件和良好的应用途径,本文以葡萄糖、木糖两种单糖为糖基供体,探究反应时间、反应温度、蛋白与糖比例、蛋白浓度对大豆分离蛋白湿法糖基化反应的影响,分析大豆分离蛋白-葡萄糖复合物(SPI-葡萄糖)、大豆分离蛋白-木糖复合物(SPI-木糖)致敏性的变化,并将SPI-葡萄糖、SPI-木糖应用于低致敏千页豆腐生产。结果表明,木糖相较于葡萄糖更易与大豆分离蛋白发生糖基化反应,但也更容易有类黑素产生。在蛋白浓度为25 mg/mL时,糖基化反应程度最高,并且糖基化反应程度与反应温度、反应时间、糖添加量呈正相关。SDS-PAGE和傅里叶变换红外光谱分析结果表明糖基化改性使大豆分离蛋白和糖分子发生了共价结合,SPI的自由氨基减少。糖基化反应程度越高,SPI致敏性越低,SPI-木糖接枝物致敏性降低程度最高可达50%,以其为原料经谷氨酰胺转氨酶(TG酶)交联所制作的千页豆腐有良好的弹性和咀嚼性。Abstract: Two monosaccharides, glucose and xylose, were used as glycosyl donors to investigate the effects of reaction time, reaction temperature, protein-to-sugar ratio and protein concentration on the wet glycosylation reaction of soybean protein isolate. The allergenicity of SPI-glucose derivative (SPI-glucose) and SPI-xylose derivative (SPI-xylose) was analyzed. SPI-glucose and SPI-xylose were used to produce the hypo-allergenic Chiba tofu. The results showed that xylose was more likely to glycosylate with SPI than glucose, but it was also more likely to produce melanoidin. The highest degree of glycosylation reaction was observed at the protein concentration of 25 mg/mL. The degree of glycosylation reaction was positively correlated with the reaction temperature, reaction time, and the amount of sugar added. The results of SDS-PAGE and fourier transform infrared spectroscopy showed that glycosylation caused covalent binding of SPI and sugar molecules, and the free amino group content of SPI was reduced. The degree of glycosylation reaction was negatively correlated with the allergenicity of SPI, and the allergenicity of SPI-xylose could be reduced by up to 50%. Chiba tofu made from SPI-xylose using glutamine aminotransferase (TGase) had good elasticity and chewiness.
-
Keywords:
- soybean protein isolate /
- glucose /
- xylose /
- glycosylation /
- allergenicity /
- Chiba tofu
-
大豆分离蛋白(soybean protein isolate,SPI)由低温脱脂豆粕加工而成,蛋白质含量在90%以上,其中7S和11S蛋白约占70%,而这两种蛋白也是大豆中最主要的致敏蛋白[1−2]。SPI因营养价值高、功能特性好,在食品领域广泛应用。千页豆腐就是以SPI为主要原料的一种低脂、低碳水化合物但富含蛋白质的大豆制品,其口感细腻、软弹、吸汁性好,而且没有传统豆腐的豆腥味,具有广阔的市场前景[3−4]。近年来,随着大豆制品销量的增加,大豆过敏的发病率也逐年上升,大豆蛋白过敏这一食品安全问题也不容忽视[5]。据统计,大豆过敏患者约占食物过敏总人数的25%,而目前治疗过敏的最有效方法仍是远离过敏原[6]。因此,降低食物致敏性已成为研究热点。已有研究通过热处理[7]、酶水解[8]、发酵、基因修饰、栽培育种[9]和糖基化[5]等方法消除大豆蛋白过敏原。其中,糖基化改性被认为是一种有前景的降低食物蛋白致敏性的方法[10]。
糖基化反应是美拉德反应的前期阶段,蛋白质中氨基酸侧链的ε-氨基与碳水化合物的羰基共价连接而形成糖蛋白[11]。糖基化反应受多种因素影响,通过控制反应条件,可以使糖基化反应生成特定产物,掩盖食物的过敏原表位,从而降低食物致敏性,还可改善蛋白质的功能特性[12]。已有研究通过糖基化改性,来改善蛋白质的乳化性、溶解性、凝胶性[13−15]。还有研究通过糖基化反应制备大豆分离蛋白-乳糖复合物,发现β-伴大豆球蛋白的抗原性降低了50%以上[16]。在花生7S球蛋白的糖基化修饰中,也发现了降低致敏的作用[17],但也有研究发现美拉德反应终产物会激发更强烈的免疫应答[18]。傅玲琳等[19]通过多酚-大豆蛋白共价复合物溶液与低聚还原糖进行糖基化反应制备低致敏大豆蛋白粉,在降低大豆蛋白致敏性的同时也减少了其中的糖基化终末产物。糖基化改性蛋白在肉丸、蛋糕等产品中也有应用,并且有良好的效果[20]。蛋白质糖基化改性的研究还有很多,但大部分研究所用糖的种类比较单一,而且在降低蛋白致敏性方面的研究仍存在争议。此外,糖基化反应产物在食品中的应用较少,作为主要原料应用于低致敏豆制品的研究更是未见报道,经糖基化改性后的SPI能否具有良好功能特性尚待探究。
本文以葡萄糖、木糖两种小分子糖为糖基供体,对SPI进行湿法糖基化改性,探究绿色、高效的糖基化改性条件,研究糖基化改性程度与SPI致敏性的联系,实现其在低致敏千页豆腐中的应用,对于降低SPI的致敏性,减少过敏的发生,保障食品安全,推动SPI广泛应用具有重要意义。
1. 材料与方法
1.1 材料与仪器
D-无水葡萄糖(分析纯)、D-木糖(分析纯)、β-巯基乙醇(分析纯)、冰乙酸(分析纯)、甲醇(分析纯)、溴化钾(光谱纯) 上海麦克林生化科技有限公司;大豆分离蛋白(蛋白质≥85%)、邻苯二甲醛(OPA)、四硼酸钠(分析纯)、20% SDS溶液、考马斯亮蓝R250(染料含量>65%)、Precast-Gel变性蛋白预制胶(浓度4%~15%)、彩虹245 plus光谱蛋白Marker(5~245 kDa)、2×蛋白上样缓冲液(含巯基还原剂)、Bradford蛋白定量试剂盒、TBST缓冲液、牛血清白蛋白(BSA ≥98%)、单组分TMB显色液、TG酶-大豆分离蛋白(100 U/g ) 北京索莱宝科技有限公司;HRP标记的山羊抗人IgE Sigma公司。
THZ-82A水浴恒温振荡器 常州荣华仪器制造有限公司;TGL-185M高速离心机 平凡仪器仪表有限公司;LGJ-18A冷冻干燥机 北京四环福瑞科仪有限公司;UVmini-1240紫外可见分光光度计 日本岛津公司;SPECTRUM 100傅里叶变换红外光谱仪 PkinElmer;CT3物性分析仪 阿美特克-博勒飞公司;DYY-6C电泳仪 北京市六一仪器厂;Model 550酶标仪 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 SPI糖基化产物的制备
1.2.1.1 SPI溶液制备
称取一定量SPI溶解于蒸馏水中,在常温下,磁力搅拌2 h至充分溶解,离心(2500×g)30 min,取上清液,存放于4 ℃。
1.2.1.2 糖基化产物制备
反应温度对糖基化反应的影响:向25 mg/mL SPI溶液中加入等比例葡萄糖或木糖,搅拌至充分溶解,调pH至8.0,装入离心管中,密封,分别在60、75、90 ℃温度下水浴振荡反应3 h,取出,迅速冰浴15 min,存放于4 ℃。
反应时间对糖基化反应的影响:向25 mg/mL SPI溶液中加入等比例葡萄糖或木糖,搅拌至充分溶解,调pH至8.0,装入离心管中,密封,分别在90 ℃下水浴振荡反应0、0.5、1、2、3、4、5、6 h,取出,迅速冰浴15 min,存放于4 ℃。
蛋白浓度对糖基化反应的影响:调整SPI溶液蛋白浓度为7.5、15、25、35 mg/mL,分别加入等比例葡萄糖或木糖,搅拌至充分溶解,调pH至8.0,装入离心管中,密封,在90 ℃下水浴振荡反应3 h,取出,迅速冰浴15 min,存放于4 ℃。
蛋白与糖比例对糖基化反应的影响:向25 mg/mL SPI溶液中按蛋白与糖质量比3:1、2:1、1:1、1:2、1:3分别加入葡萄糖或木糖,搅拌至充分溶解,调pH至8.0,装入离心管中,密封,在90 ℃温度下水浴振荡反应3 h,取出,迅速冰浴15 min,存放于4 ℃。
1.2.1.3 糖基化改性大豆分离蛋白样品制备
将糖基化反应后的蛋白溶液pH调至4.5,静置30 min后离心(1000 r/min)5 min,将沉淀复溶至40 mg/mL,用NaOH调pH至7.0,置于冷冻干燥机中冻干24 h,用玛瑙研钵磨成细粉,保存于干燥器中,得到糖基化改性大豆分离蛋白样品。
1.2.2 糖基化产物接枝度测定
参考文献[10]的OPA法测定自由氨基含量并计算糖基化产物的接枝度。
1.2.2.1 试剂配制
试剂1:称取40 mg OPA于棕色试剂瓶中,加入1 mL甲醇溶解,再加入3 mL蒸馏水,混匀备用;试剂2:向50 mL棕色容量瓶中,加入2.5 mL 20%(W/W)SDS溶液,25 mL 0.1 mol/L硼砂,100 μL β-巯基乙醇,用蒸馏水定容后备用。两种试剂均现用现配。
1.2.2.2 接枝度测定及计算
取0.3 mL试剂1、3.7 mL试剂2于10 mL离心管中,加入200 μL样品液,并以200 μL蒸馏水为空白对照,混匀后于35 ℃反应2 min,测定其在340 nm的吸光值A(340 nm)。
接枝度(%)=A1−A2A1×100 式中:A1:未糖基化SPI在340 nm的吸光值;A2:糖基化后样品在340 nm的吸光值。
1.2.3 糖基化产物褐变程度测定
参考文献[10]的方法,分别取2 mL相同蛋白浓度的样品液于离心管中,各加入里面1 mL 20%(W/W)SDS溶液,1 mL 0.1 mol/L硼砂溶液,混匀后,测定其在420 nm的吸光值A(420 nm)。
1.2.4 SDS-PAGE凝胶电泳
用Bradford法测定蛋白浓度,调整各蛋白样品溶液浓度为2 mg/mL。将蛋白样品溶液与2×蛋白上样缓冲液1:1混合,沸水浴5 min后离心。按电泳预制胶要求进行电泳,加样5 μL。当彩虹Marker谱带全部显现时,停止电泳。分离电泳胶,摇床振荡染色20 min后,用脱色液漂洗至凝胶底色接近无色。
1.2.5 傅里叶红外光谱分析
将溴化钾在105 ℃烘箱中烘干3 h,称取200 mg溴化钾于玛瑙研钵中,在红外灯下研磨均匀,加入2 mg样品研磨均匀,将研磨好的样品倒入模具中,上下振动铺平,在压片机上压片,升压至压25~30 MPa,停留1 min,取出压成透明的薄片,用Spectum进行4000~400 cm−1全波段扫描,扫描32次。以200 mg溴化钾薄片为背景。
1.2.6 致敏性测定
1.2.6.1 ELISA相关溶液配制
包被液(pH9.6的CBS溶液):称取0.7950 g碳酸钠、1.4650 g碳酸氢钠,溶解后,定容至500 mL,存放于4 ℃;封闭液(1% BSA):称取0.2 g BSA,加入20 mL TBST,存放于4 ℃;一抗:人血清用1% BSA稀释10倍;二抗:山羊抗人IgE-HRP酶标记物用1% BSA稀释2000倍。
参考文献[21]的间接ELISA法将蛋白样品稀释至5 μg/mL,包被96孔酶标板,每孔100 μL,每个样品做三次平行,用封板膜封好,4 ℃过夜。次日倾去孔内液体,拍干,用TBST洗涤3次,每孔100 μL,每次1 min。拍干后,每孔加入150 μL封闭液进行封闭,37 ℃孵育2 h,TBST洗涤3次,拍干;每孔加入100 μL一定稀释度的一抗血清(人抗大豆蛋白血清),37 ℃孵育2 h,TBST洗涤3次,拍干;每孔加入100 μL一定稀释度的二抗(山羊抗人HRP-IgE),37 ℃孵育1 h,TBST洗涤6次,拍干;每孔加入100 μL TMB,37℃避光反应15 min,取出后迅速加入50 μL 1 mol/L硫酸,终止反应,在30 min内,用酶标仪测定各孔在450 nm处的OD值。以未改性SPI为对照。
OD样=OD测−OD白 (1) 致敏性降低(%)=OD0−OD1OD0×100 (2) 式中:OD样:样品真实的OD值;OD测:测得的样品OD值;OD白:空白孔的OD值;OD0:对照组样品的真实OD值;OD1:实验组样品的真实OD值。
1.2.7 千页豆腐制备
称取7.5 g SPI加入40 g蒸馏水,搅打5 min,至表面光滑,无明显颗粒,再加入0.75 g TG酶,搅拌4 min,混合均匀后,加入7.5 g大豆油,快速搅拌3 min,至充分乳化,颜色发白,加入2.5 g玉米淀粉,搅拌2 min,至均匀细腻,将其倒入平皿中,抹平,盖上保鲜膜,于45 ℃放置1 h,定型。取出放于95 ℃,5 min,进行灭酶处理。
1.2.8 千页豆腐质构测定
选用直径10 mm的圆柱探头(TA 10),进行TPA测定。将豆腐切成半径为2 cm、高度为1 cm的四分之一圆柱形,测试速度1.00 mm/s,模式为50%压缩比,压力为5.0 g,重复3次。
1.3 数据处理
每个实验重复测量3次,所得数据用SPSS 21软件计算平均值±标准差,并进行方差分析,P<0.05表示差异显著,用 Origin 2018 绘图。
2. 结果与分析
2.1 糖基化反应接枝度分析
研究表明,SPI与糖的糖基化反应会使蛋白质分子中的自由氨基和糖分子的羰基发生共价连接,因此,通过OPA法测定反应体系中大豆蛋白自由氨基的变化可反映出SPI糖基化反应的程度[22]。
对不同反应条件下糖基化反应产物的接枝度进行测定,发现各个反应条件下木糖都比葡萄糖更容易与SPI发生糖基化反应,且反应速度更快。由此看来,分子量更小的五碳醛糖比六碳醛糖更易发生糖基化反应[23]。王鲁慧等[15]也发现分子量更小的葡萄糖比麦芽糖更易与SPI发生美拉德反应。
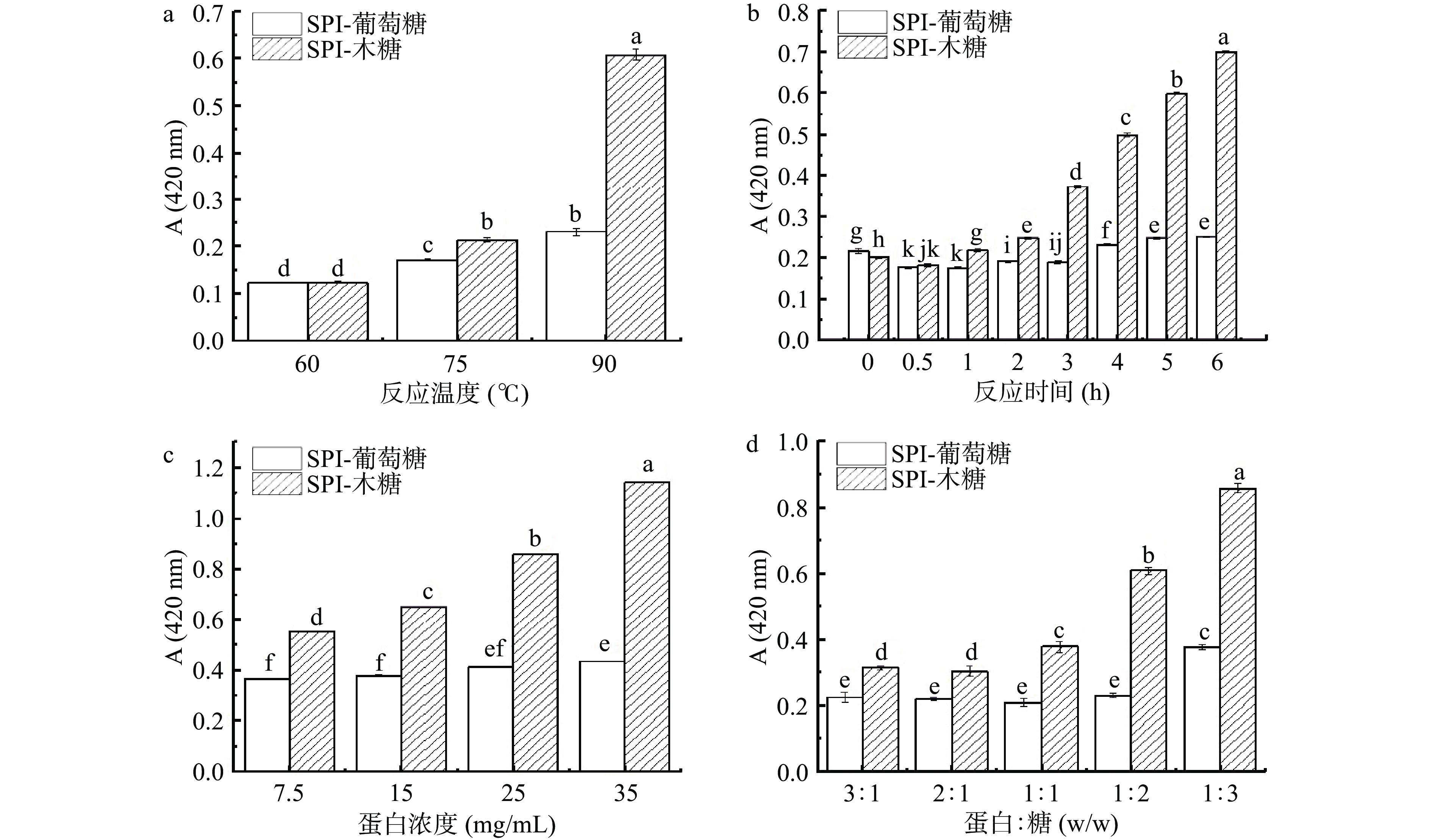
反应温度、反应时间对SPI-葡萄糖、SPI-木糖糖基化反应程度影响的变化规律是一致的,糖基化反应程度随反应温度的升高和反应时间的延长而明显提高(P<0.05),并且木糖反应体系的糖基化反应程度较葡萄糖反应体系更高。由图1a可知,当反应温度为60 ℃时,SPI-葡萄糖糖基化反应程度很低,糖基化反应几乎不能进行,说明此时的温度所提供的能量不足以使SPI-葡萄糖、SPI-木糖糖基化反应发生。当体系温度达到75 ℃,反应程度有所提高,当反应体系达到90 ℃时,反应程度显著提高(P<0.05)。由图1b可知,反应时间对糖基化反应程度有很大影响,SPI与葡萄糖在加热2 h后糖基化反应程度才有明显提升,而SPI与木糖发生糖基化反应所需能量较低,因此,糖基化反应程度从开始就在稳步提升。
从图1c可以看出,糖基化反应的接枝度(DG)随着蛋白浓度的增加,表现出先增加后基本不变甚至略有降低的趋势,并且接枝度在蛋白浓度为25 mg/mL时以达到最高水平。这表明在蛋白与糖的质量比一定时,随着蛋白浓度的提高,蛋白质分子与糖分子之间碰撞的机率增加,自由氨基更易与羰基结合,糖基化反应更易发生;而当蛋白浓度增加到一定程度时,蛋白质分子之间发生交联,不利于糖基化反应发生[24]。同时,糖基化反应程度也受蛋白与糖比例的影响(图1d),SPI-葡萄糖、SPI-木糖的DG均随着糖的比例的增加而增加,并且在蛋白与糖的比例大于1:1时,有明显提高。杜昱蒙等[24]也发现随着葡萄糖添加量的增加,接枝度不断增加。
2.2 糖基化反应褐变程度分析
糖基化反应常常会伴随褐变现象的发生,随着反应的深入,颜色也越来越深,褐变产生的一类物质统称为类黑素,其最大吸收波长在420 nm。因此,通过测定糖基化反应产物在420 nm的吸光度可以反映蛋白的褐变程度,从而间接反映出蛋白糖基化改性的程度[22]。
从图2可以看出,随蛋白浓度增加,反应时间的延长,糖的比例的增加,糖基化产物的褐变程度加深,进一步说明其糖基化反应程度提高了。随反应条件的变化,相比于SPI-木糖,SPI-葡萄糖的褐变程度变化较为缓慢。由此看来,蛋白浓度对SPI-木糖褐变程度的影响程度比对其接枝度的影响程度高,而对SPI-葡萄糖的影响程度不大,木糖反应体系较葡萄糖反应体系更易发生褐变,而褐变程度的提高会影响蛋白产品的感官品质。因此,想要使糖基化产物具有良好的色泽,选择合适的糖基供体是关键,同时还可通过控制糖基化反应的进程来实现[23]。
为得到具有较高糖基化反应程度、相似DG,并且褐变程度尽可能低的SPI-葡萄糖与SPI-木糖样品进行后续研究,以排除糖种类之外其他因素干扰,综合分析图1与图2的结果,选择糖基化反应条件。由于SPI-葡萄糖、SPI-木糖的DG在所选的反应温度与反应时间范围内呈现一直上升的趋势(图1),基于对糖基化反应程度的考虑,确定反应温度90 ℃、反应时间6 h。蛋白浓度25 mg/mL,SPI-葡萄糖与SPI-木糖的DG均达到最高且无显著差异,因此确定蛋白浓度为25 mg/mL。SPI与葡萄糖的比例在1:3时,DG较1:2略高,但相差不大(P>0.05),而1:2时褐变程度明显更低,因此,确定SPI-葡萄糖的蛋白与糖比例为1:2。同时,由于蛋白与糖比例为1:1的SPI-木糖与1:2的SPI-葡萄糖的DG没有显著差异。因此,确定SPI-木糖的蛋白与糖比例为1:1。
2.3 糖基化改性大豆分离蛋白SDS-PAGE分析
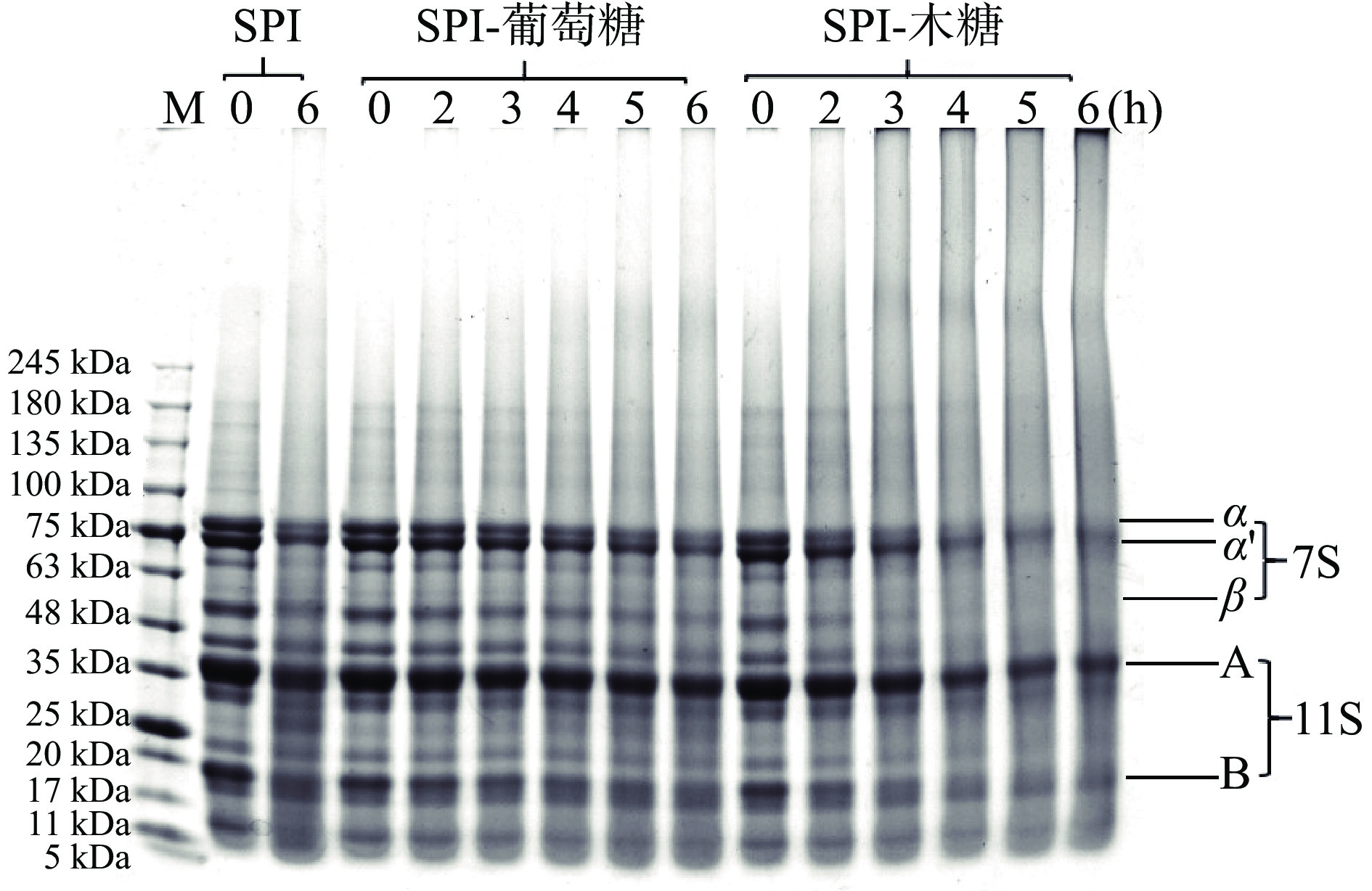
通过图3的电泳谱带可以发现,β-伴大豆球蛋白(11S球蛋白)的α亚基的分子量大小在78 kDa左右、α'亚基的分子量大小在70 kDa左右、β亚基的分子量大小在55 kDa左右,大豆球蛋白(7S球蛋白)的酸性多肽链A的分子量大小在35 kDa左右,碱性多肽链B的分子量大小在18 kDa左右[25]。在反应温度、蛋白与糖比例相同的情况下,反应不同时间的SPI-葡萄糖、SPI-木糖的电泳图谱显示,随着DG的增加,亚基谱带越来越浅,当DG增加到一定程度时,会有新的大分子量谱带出现,说明葡萄糖、木糖在糖基化反应过程中与SPI结合,形成高分子量产物[24,26−27]。糖基化改性程度越高的蛋白,亚基谱带变浅越明显。这一方面是因为电泳胶染色液中的考马斯亮蓝通过与蛋白质分子中的自由氨基、巯基等活性基团结合,从而将蛋白的亚基谱带显现出来,当SPI发生糖基化反应后,自由氨基减少,从而减少了蛋白质分子与考马斯亮蓝的结合,使得条带颜色变浅[22,26]。另一方面也可能是大豆蛋白之间或大豆蛋白与葡萄糖、木糖交联形成聚集物的结果,从而无法顺利通过凝胶而卡在上方孔洞处[28]。
由电泳图谱还可以看出,随着反应的进行,SPI-木糖的7S亚基首先消失,而11S亚基,特别是其碱性亚基,比较难反应,在SPI-乳糖接枝物中也有类似现象[10]。这可能是因为11S碱性亚基中,参与糖基化反应的主要氨基酸—赖氨酸和精氨酸含量较低[22]。
SDS-PAGE方法也可以作为一种分析蛋白致敏性的方法,它快速简单、可实现多组分同时分析,并且具有高分辨力,但其准确度较低,需要与其它方法结合分析。大豆蛋白的7S组分的致敏性最强,根据电泳谱带中7S蛋白亚基的深浅,可以粗略判断糖基化改性大豆分离蛋白的致敏性强度。SPI糖基化改性程度越高,DG越高,亚基谱带颜色越浅,致敏性越低。
2.4 糖基化改性大豆分离蛋白结构分析
根据2.1与2.2的结果,分别制备接枝度较高、褐变程度较低SPI-葡萄糖与SPI-木糖。用傅里叶变换红外光谱分析糖基化改性大豆分离蛋白的二级结构[29]。结果如图4所示。从红外谱图可以看出,SPI的糖基化产物在3300 cm−1左右处的峰更加明显,这是因为3400 cm−1附近的-OH键的伸缩振动强度增加,使得羟基振动峰增强,说明经大豆分离蛋白糖基化改性后,有糖分子接枝到蛋白分子上,使分子中-OH增多[21]。SPI的糖基化产物在1500 cm−1左右的两个峰强度也发生了变化,这两个峰分别对应着C=O伸缩振动和N-H弯曲振动,说明糖基化反应使大豆蛋白中的自由氨基减少[21]。在1800~500 cm−1范围内,糖基化改性大豆分离蛋白峰的强度和形状与未改性SPI有明显差异,糖基化反应产物在此范围内吸收更明显,说明蛋白质和糖分子发生了共价结合。
2.5 糖基化改性大豆分离蛋白的致敏性
ELISA法具有灵敏度高、特异性强、操作简单等优点,可对未经分离提取情况下食品进行定性以及定量分析[21]。采用间接ELISA法测定接枝度最高的SPI-木糖、SPI-葡萄糖样品的致敏性。以未改性的SPI为对照,视其致敏性为100%,致敏性降低程度为0,分析糖基化改性后SPI相对于未改性SPI的致敏性降低程度,结果如图5。
SPI-木糖比SPI-葡萄糖的致敏性降低程度更高(P<0.05)。这是因为SPI-木糖的接枝度更高,糖基化改性程度更高,糖基化反应能够掩盖大豆蛋白的过敏原表位,降低其致敏性。经与木糖糖基化改性,SPI的致敏性降低程度最高能达到50%左右[16]。糖基化改性的方法能使SPI的致敏性有所降低,但其致敏性降低程度不高,由SDS-PAGE图谱(图3)可以看出,当糖基化反应程度较高时,大分子量谱带增多。因此,可能是随糖基化反应进行,会发生美拉德反应后期的蛋白质交联,使大豆蛋白产生新的可以与IgE抗体结合的表位,从而使蛋白质的致敏性较糖基化反应阶段有所提升,致敏性降低程度达不到很高的水平[30]。
2.6 千页豆腐的质构特性
分别以SPI、SPI-木糖和SPI-葡萄糖为主要原料,通过谷氨酰胺转氨酶(TG酶)交联制作千页豆腐,采用质构仪测定其硬度、弹性、咀嚼性等质构特性,结果如图6。与SPI制作的普通千页豆腐相比,SPI-葡萄糖和SPI-木糖所制作低致敏千页豆腐的硬度都更低(P<0.05),咀嚼性也有所下降,但弹性与普通千页豆腐没有显著性差异(P>0.05),说明SPI-葡萄糖和SPI-木糖仍保有较好的功能特性。千页豆腐硬度的降低与其含水量相关[3],糖基化改性改变了大豆蛋白的结构,并且引入更多糖侧链,使其持水性等质构特性得到了改善[26]。因此,SPI-葡萄糖和SPI-木糖在蛋白交联形成千页豆腐凝胶时吸收了更多的水分,使产品的含水量更高,保水性较好,硬度更低,质地更加柔软,适口性更好。7S和11S蛋白的比例对大豆蛋白凝胶的硬度、弹性等也起着至关重要的作用,11S组分含量越高,越有利于豆腐凝胶的形成[31−33]。通过SDS-PAGE电泳图可以看出,SPI-木糖与SPI-葡萄糖的11S蛋白组分都部分参与了糖基化反应,从而使所制得千页豆腐的硬度降低,但糖基化程度更高的SPI-木糖的7S组分破坏更彻底,这使得其11S蛋白的比例更高,因而,与SPI-葡萄糖所制得的低致敏千页豆腐相比,SPI-木糖所制作的低致敏千页豆腐硬度适中、有较好的弹性和咀嚼性,并且具有更低的致敏性(图5)。
3. 结论
本文以SPI为原料,通过湿法糖基化接枝葡萄糖、木糖。实验结果表明,糖基化改性使SPI和糖分子发生了共价结合,SPI的自由氨基减少,-OH增多,致敏性最高的7S亚基更易被糖基化。木糖比葡萄糖容易发生糖基化反应,但也更容易发生褐变。当蛋白浓度为25 mg/mL时,SPI的糖基化反应程度最高,并且糖基化反应程度与温度、反应时间、糖添加量成正相关。SPI-木糖的致敏性降低程度较SPI-葡萄糖高,可达50%,且以其为原料所制作的千页豆腐也可具有良好的质构特性。这为实现糖基化改性大豆分离蛋白在低致敏千页豆腐中的应用提供了理论依据。
糖基化改性能够降低SPI的致敏性,但程度不高,并且会使蛋白发生褐变,影响产品的感官品质,可通过控制美拉德反应进程,减少类黑素的产生。大豆蛋白各个蛋白亚基致敏性的差异也有待进一步探究。
-
-
[1] JOHN H, CHANDRA P, GIRI S K, et al. Effect of processing methods on 11S/7S protein and nitrogen solubility index of soy protein isolate[J]. Journal of The Institution of Engineers (India): Series A,2021,102(4):989−994. doi: 10.1007/s40030-021-00564-7
[2] WESLEY B, JAMES R B, HUGH A S. Allergenicity of major component proteins of soybean determined by enzyme-linked immunosorbent assay (ELISA) and immunoblotting in children with atopic dermatitis and positive soy challenges[J]. Journal of Allergy and Clinical Immunology,1988,81(6):1135−1142. doi: 10.1016/0091-6749(88)90881-0
[3] 武志明, 朱玉蓉. 千页豆腐的加工工艺研究[J]. 农产品加工,2019(10):32−33,39. [WU Z M, ZHU Y R. Processing technology of thousands of pages of bean curd[J]. Farm Products Processing,2019(10):32−33,39. WU Z M, ZHU Y R . Processing technology of thousands of pages of bean curd[J]. Farm Products Processing,2019 (10 ):32 −33,39 .[4] 江连洲, 冉安琪, 贾子璇, 等. 不同贮藏期大豆蛋白对千页豆腐品质的影响[J]. 农业工程学报,2019,35(20):311−318. [JIANG L Z, RAN A Q, JIA Z X, et al. Effect of soy protein on the quality of Qianye tofu in different storage periods[J]. Transactions of the Chinese Society of Agricultural Engineering,2019,35(20):311−318. JIANG L Z, RAN A Q, JIA Z X, et al . Effect of soy protein on the quality of Qianye tofu in different storage periods[J]. Transactions of the Chinese Society of Agricultural Engineering,2019 ,35 (20 ):311 −318 .[5] VAN D L J, MANUEL S J, JAVIER M F, et al. In vitro glycation and antigenicity of soy proteins[J]. Food research international,2007,40(1):153−160. doi: 10.1016/j.foodres.2006.09.006
[6] HEFLE S L, TAYLOR S L. Food allergy and the food industry[J]. Current Allergy and Asthma Reports,2004,4(1):55−59. doi: 10.1007/s11882-004-0044-y
[7] 朱丽. 大豆7S球蛋白致敏性的降低及其抗酶解肽段去除的研究[D]. 无锡:江南大学, 2020. [ZHU L. Study on the allergenicity reduction of soybean 7S globulin and the elimination of peptide fractions resistant to enzymatic hydrolysis[D]. Wuxi:Jiangnan University, 2020. ZHU L. Study on the allergenicity reduction of soybean 7S globulin and the elimination of peptide fractions resistant to enzymatic hydrolysis[D]. Wuxi: Jiangnan University, 2020.
[8] 王章存, 刘洋, 安广杰, 等. 大豆 β-伴球蛋白脱糖基化及其酶解后抗原活性变化[J]. 中国粮油学报,2020,12(35):62−66. [WANG Z C, LIU Y, AN G J, et al. Deglycosylation of soybean β-conglycinin and changes in its antigenic activity after enzymatic hydrolysis[J]. Journal of the Chinese Cereals and Oils Association,2020,12(35):62−66. WANG Z C, LIU Y, AN G J, et al . Deglycosylation of soybean β-conglycinin and changes in its antigenic activity after enzymatic hydrolysis[J]. Journal of the Chinese Cereals and Oils Association,2020 ,12 (35 ):62 −66 .[9] 马小梅, 彭乔烽, 魏嘉. 大豆致敏蛋白脱敏方法研究进展[J]. 农业科技与信息,2020(19):64−68. [MA X M, PENG Q F, WEI J. Research progress on desensitization of soybean sensitizing protein[J]. Agricultural Science-Technology and Information,2020(19):64−68. doi: 10.3969/j.issn.1003-6997.2020.19.026 MA X M, PENG Q F, WEI J . Research progress on desensitization of soybean sensitizing protein[J]. Agricultural Science-Technology and Information,2020 (19 ):64 −68 . doi: 10.3969/j.issn.1003-6997.2020.19.026[10] 管军军. 微波合成大豆蛋白-糖接枝物机理、结构及功能性[D]. 无锡:江南大学, 2005. [GUAN J J. Mechanism, conformation and functional properties of soy protein-saccharide grafts synthesized by microwave[D]. Wuxi:Jiangnan University, 2005. GUAN J J. Mechanism, conformation and functional properties of soy protein-saccharide grafts synthesized by microwave[D]. Wuxi: Jiangnan University, 2005.
[11] YUAN F Z, AHMED I, LÜ L T, et al. Impacts of glycation and transglutaminase-catalyzed glycosylation with glucosamine on the conformational structure and allergenicity of bovine β-lactoglobulin[J]. Food & Function,2018,9(7):3944−3955.
[12] 杨智翔, 殷海成, 陈莹, 等. 糖基化大豆抗原蛋白的结构与功能特性研究进展[J]. 食品安全质量检测学报,2022,13(17):5716−5722. [YANG Z X, YIN H C, CHEN Y, et al. Advances on structural and functional properties of glycated soybean antigen proteins[J]. Journal of Food Safety & Quality,2022,13(17):5716−5722. doi: 10.3969/j.issn.2095-0381.2022.17.spaqzljcjs202217036 YANG Z X, YIN H C, CHEN Y, et al . Advances on structural and functional properties of glycated soybean antigen proteins[J]. Journal of Food Safety & Quality,2022 ,13 (17 ):5716 −5722 . doi: 10.3969/j.issn.2095-0381.2022.17.spaqzljcjs202217036[13] 潘男, 李芳菲, 董依迪, 等. 糖基化改性提高大豆分离蛋白凝胶特性的研究[J]. 食品工业科技,2017,38(22):31−36. [PAN N, LI F F, DONG Y D, et al. Improvement of gelling properties of soybean protein isolate by glycosylation modification[J]. Science and Technology of Food Industry,2017,38(22):31−36. PAN N, LI F F, DONG Y D, et al . Improvement of gelling properties of soybean protein isolate by glycosylation modification[J]. Science and Technology of Food Industry,2017 ,38 (22 ):31 −36 .[14] 周洋莹, 郑红莉, 杨文钰, 等. 大豆分离蛋白-大豆低聚糖糖基化产物溶解性和乳化性分析[J]. 食品与发酵工业,2020,46(1):118−124. [ZHOU Y Y, ZHENG H L, YANG W Y, et al. Modification of solubility and emulsifying properties of soybean protein isolate by glycosylating with soybean oligosaccharide[J]. Food and Fermentation Industries,2020,46(1):118−124. ZHOU Y Y, ZHENG H L, YANG W Y, et al . Modification of solubility and emulsifying properties of soybean protein isolate by glycosylating with soybean oligosaccharide[J]. Food and Fermentation Industries,2020 ,46 (1 ):118 −124 .[15] 王鲁慧, 肖军霞, 徐同成, 等. 湿热条件下大豆分离蛋白与葡萄糖、麦芽糖的美拉德反应[J]. 食品科学,2018,39(16):19−26. [WANG L H, XIAO J X, XU T C, et al. Maillard reaction of soybean protein isolate with glucose and maltose under wet heating conditions[J]. Food Science,2018,39(16):19−26. doi: 10.7506/spkx1002-6630-201816004 WANG L H, XIAO J X, XU T C, et al . Maillard reaction of soybean protein isolate with glucose and maltose under wet heating conditions[J]. Food Science,2018 ,39 (16 ):19 −26 . doi: 10.7506/spkx1002-6630-201816004[16] 张楠, 布冠好, 朱婷伟, 等. 糖基化反应对大豆蛋白-乳糖复合物抗原性及结构的影响[J]. 现代食品科技,2015,31(8):117−121. [ZHANG N, BU G H, ZHU T W, et al. Effect of glycosylation on the antigenicity and structural properties of soybean protein isolate-lactose conjugate[J]. Modern Food Science and Technology,2015,31(8):117−121. ZHANG N, BU G H, ZHU T W, et al . Effect of glycosylation on the antigenicity and structural properties of soybean protein isolate-lactose conjugate[J]. Modern Food Science and Technology,2015 ,31 (8 ):117 −121 .[17] SHI Y F , WANG M J, DING Y T, et al. Effects of Maillard reaction on structural modification and potential allergenicity of peanut 7S globulin (Ara h 1)[J]. Journal of the Science of Food and Agriculture, 2020, 100(15):5617-5626.
[18] MALGORZATA T, HANNAH E Z, ARIFA E, et al. Enhanced uptake of processed bovine β-lactoglobulin by antigen presenting cells:Identification of receptors and implications for allergenicity[J]. Molecular Nutrition & Food Research,2021,65(8):200834.
[19] 傅玲琳, 王彦波, 张巧智, 等. 一种低致敏大豆蛋白粉及其制备方法:中国, 202011152976.2[P]. 2021-02-23. [FU L L, WANG Y B, ZHANG Z Q, et al. A kind of hypoallergenic soy protein powder and its preparation method:China, 202011152976.2[P]. 2021-02-23. FU L L, WANG Y B, ZHANG Z Q, et al. A kind of hypoallergenic soy protein powder and its preparation method: China, 202011152976.2[P]. 2021-02-23.
[20] 夏爽. 超声-糖基化改性对大豆分离蛋白的影响及应用[D]. 天津:天津科技大学, 2019. [XIA S. Effect of ultrasonic pretreatment-glycosylation modification on soy protein isolate and application[D]. Tianjin:Tianjin University of Science and Technology, 2019. XIA S. Effect of ultrasonic pretreatment-glycosylation modification on soy protein isolate and application[D]. Tianjin: Tianjin University of Science and Technology, 2019.
[21] 朱婷伟. 糖基化修饰对大豆蛋白过敏原抗原性的影响研究[D]. 郑州:河南工业大学, 2015. [ZHU T W. Research on glycation modification to soybean protein antigenicity[D]. Zhengzhou:Henan University of Technology, 2015. ZHU T W. Research on glycation modification to soybean protein antigenicity[D]. Zhengzhou: Henan University of Technology, 2015.
[22] 穆利霞. 大豆蛋白—糖接枝改性及其结构与功能特性研究[D]. 广州:华南理工大学, 2010. [MU L X. The research of conformation and functional properties of soy protein-saccharide conjugates[D]. Guangzhou:South China University of Technology, 2010. MU L X. The research of conformation and functional properties of soy protein-saccharide conjugates[D]. Guangzhou: South China University of Technology, 2010.
[23] 徐世涛, 朱秋劲, 胡颖, 等. 不同种类糖对酪蛋白糖基化接枝改性的影响[J]. 食品与发酵工业,2019,45(20):118−123. [XU S T, ZHU Q J, HU Y, et al. Effects of different kinds of sugars on grafting modification for casein glycosylation[J]. Food and Fermentation Industries,2019,45(20):118−123. XU S T, ZHU Q J, HU Y, et al . Effects of different kinds of sugars on grafting modification for casein glycosylation[J]. Food and Fermentation Industries,2019 ,45 (20 ):118 −123 .[24] 杜昱蒙, 陈振家, 施小迪, 等. 葡萄糖糖基化大豆分离蛋白的凝胶抗冻性研究[J]. 中国粮油学报,2016,31(10):45−49. [DU Y M, CHEN Z J, SHI X D, et al. Antifreeze capacity of glucose glycosylated soybean protein isolate gel[J]. Journal of the Chinese Cereals and Oils Association,2016,31(10):45−49. DU Y M, CHEN Z J, SHI X D, et al . Antifreeze capacity of glucose glycosylated soybean protein isolate gel[J]. Journal of the Chinese Cereals and Oils Association,2016 ,31 (10 ):45 −49 .[25] 李丽芳, 黄文胜, 张九凯, 等. 超高效液相色谱-串联质谱法检测大豆主要过敏原蛋白[J]. 食品科学,2020,41(24):316−324. [LI L F, HAUNG W S, ZHANG J K, et al. Determination of major soybean allergens by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2020,41(24):316−324. doi: 10.7506/spkx1002-6630-20190923-278 LI L F, HAUNG W S, ZHANG J K, et al . Determination of major soybean allergens by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2020 ,41 (24 ):316 −324 . doi: 10.7506/spkx1002-6630-20190923-278[26] 杜沁岭, 周思懿, 吴岱泽, 等. 湿法糖基化处理大豆11S蛋白后的表面活性变化[J]. 中国粮油学报,2021,36(1):80−88. [DU Q L, ZHOU S Y, WU D Z, et al. Changes in surface activity of soybean 11S protein treated by glycosylation by means of wet-heating[J]. Journal of the Chinese Cereals and Oils Association,2021,36(1):80−88. doi: 10.3969/j.issn.1003-0174.2021.01.014 DU Q L, ZHOU S Y, WU D Z, et al . Changes in surface activity of soybean 11S protein treated by glycosylation by means of wet-heating[J]. Journal of the Chinese Cereals and Oils Association,2021 ,36 (1 ):80 −88 . doi: 10.3969/j.issn.1003-0174.2021.01.014[27] BU G H, ZHU T W, CHEN F S, et al. Effects of saccharide on the structure and antigenicity of β-conglycinin in soybean protein isolate by glycation[J]. European Food Research and Technology,2015,240(2):285−293. doi: 10.1007/s00217-014-2326-5
[28] MEINLSCHMIDT P, UEBERHAM E, LEHMANN J, et al. The effects of pulsed ultraviolet light, cold atmospheric pressure plasma, and gamma-irradiation on the immunoreactivity of soy protein isolate[J]. Innovative Food Science & Emerging Technologies,2016,38:374−383.
[29] GU F, KIM J M, ABBAS S, et al. Structure and antioxidant activity of high molecular weight Maillard reaction products from casein–glucose[J]. Food Chemistry,2009,120(2):505−511.
[30] MALEKI S J, CHUNG S, CHAMPAGNE E T, et al. The effects of roasting on the allergenic properties of peanut proteins[J]. The Journal of Allergy and Clinical Immunology,2000,106(4):763−768. doi: 10.1067/mai.2000.109620
[31] POYSA V, WOODROW L, YU K. Effect of soy protein subunit composition on tofu quality[J]. Food Research International,2005,39(3):309−317.
[32] JAMES A T, YANG A. Interactions of protein content and globulin subunit composition of soybean proteins in relation to tofu gel properties[J]. Food Chemistry,2016,194:284−289. doi: 10.1016/j.foodchem.2015.08.021
[33] 邓涵. 转谷氨酰胺酶交联协同热加工对豆腐品质特性和潜在致敏性的影响[D]. 南昌:南昌大学, 2018. [DENG H. Effect of cross-linking with transglutaminase and thermal processing on quality and potential allergenicity of tofu[D]. Nanchang:Nanchang University, 2018. DENG H. Effect of cross-linking with transglutaminase and thermal processing on quality and potential allergenicity of tofu[D]. Nanchang: Nanchang University, 2018.
-
期刊类型引用(4)
1. 姜振旭,王朝兴,王宇亮,赵宏,沈宇,孙诗晴,马永哲,宋明明,张宇. 基于GEO数据库结合网络药理学和分子对接技术探究玉竹抗抑郁作用机制. 食品工业科技. 2025(01): 359-366 .  本站查看
本站查看
2. 卜佳亮,申林,孟媛,朴英实. 基于网络药理学和分子对接技术探讨人参有效成分治疗特应性皮炎的作用机制. 皮肤性病诊疗学杂志. 2025(01): 33-41 .  百度学术
百度学术
3. 赵钜阳,方胥伟,顾丽雅,杨斐然,高世勇,李文兰. 基于网络药理学及分子对接技术研究槐花的抗肥胖作用机制. 食品工业科技. 2024(24): 42-49 .  本站查看
本站查看
4. 刘浩,杨洪柳,柳志诚,王文琪,梁敬臣,刘永刚. 基于网络药理学和分子对接研究黄芩治疗白癜风的作用机制. 现代药物与临床. 2023(08): 1872-1880 .  百度学术
百度学术
其他类型引用(4)






 下载:
下载:



 下载:
下载:



