Research Progress in Metal Ion Chelated Peptides of Marine Sources
-
摘要: 海洋多肽是生物多肽的重要来源之一,海洋来源多肽种类多并且易于被金属离子修饰,因此海洋来源的肽制备金属离子螯合肽有着天然优势,有望成为未来金属螯合肽研究热点。本文综述了海洋来源金属螯合肽的螯合机理,对单齿螯合模式、双齿螯合模式以及 α 螯合模式三种螯合模式进行了说明。同时归纳总结了肽的大小、肽的氨基酸种类和位置以及一些特殊的基团和残基等因素对螯合效果的影响。列举了海洋来源金属螯合肽的制备及纯化方法,分析了不同方法的优缺点。此外,总结了金属螯合肽促进金属离子吸收、抑菌和抗氧化等生物活性,可为金属离子螯合肽制备、功能活性分析及螯合机理研究提供参考。Abstract: Marine peptides are one of the important sources of biological peptides. Marine peptides have many types and are easy to be modified by metal ions. Marine peptides have natural advantages in the preparation of metal ion chelated peptides, and are expected to become a research hotspot of metal ion chelated peptides in the future. In this paper, the chelating mechanism of metal ion chelated peptides from ocean is reviewed. Single dentate chelating mode, double dentate chelating mode and α chelating mode, three chelating modes are described. At the same time, the effects of peptide size, amino acid type and position, some special residues on the chelation effect are summarized. The preparation and purification methods of metal chelate peptides from ocean are listed. The advantages and disadvantages of different methods are analyzed. In addition, the biological activities of metal ion chelated peptides such as promoting metal ion absorption, bacteriostatic and antioxidant are summarized. This paper can provide technical support for the preparation, functional activity analysis and chelating mechanism study of metal ion chelated peptides in the future.
-
肽是以食用蛋白为原料,经过酶解、分离、纯化等制成的新型蛋白水解产品,担负着信息传递、营养和功能调控作用,对机体从细胞、组织到器官、系统,以致整体行为等均发挥着重要的调节、平衡和协调作用。大自然提供了各种不同的肽,其中最大供应者是海洋资源,海洋生物多样性高,生物种类占全球的一半,同时海洋恶劣的生存环境促使海洋生物蛋白具有多样性,在不同蛋白酶的作用下产生的肽种类更多,功能性更好[1]。
肽具有重要的研究、开发和应用价值。肽的活性功能根据氨基酸的排列顺序及组成不同而变化,已有研究表明,肽具有抗菌[2]、抗冻[3]、抗氧化[4]、抗肥胖[5]、抗糖尿病[6]、降血压[7]、抗肿瘤[8]等活性。对于人类来说,肽具有着重要的地位,在食品、保健品、药品、化妆品等领域中均有应用,如Cooper等[9]研发了一种新型的靶向治疗药物—肽-药物偶联物(PDC),大大推进了癌症的靶向治疗。从食鱼海洋锥形蜗牛Conus magus中分离出来的Prialt肽,已在美国市场上市销售,是一种通过拮抗N型钙通道起作用的镇痛药[10]。此外还有许多通过审批进入市场的肽类生物制药产品,如普卡那肽、杜拉鲁肽等治疗骨质疏松症和Ⅱ型糖尿病的药物,且得到了广泛应用。
金属元素在维持人体正常生命活动中起着重要的作用,金属元素的缺乏会引起缺铁性贫血、骨质疏松等多种疾病[11]。现有商业化金属元素补充剂的溶解性差、生物利用度低和胃肠道刺激性限制了它们的进一步应用。因此,安全稳定、高效吸收且价格优惠的金属元素补充剂具有广阔的市场前景,已然成为目前科学研究和产品开发的热点。金属离子螯合肽是由肽与金属离子螯合反应构成的环状化合物,可作为运输钙、铁、锌等微量元素的载体。它可以利用肽的吸收功能,提高金属离子在人体内的吸收速度和利用率,与无机金属离子相比具有很大的优势[12]。与普通肽相比,金属螯合肽经过了金属的螯合反应,能发挥更多的作用[13]。而利用海洋来源的肽进行金属螯合,具有肽原料获取容易,肽的骨架和侧链易于修饰,螯合率高等明显优势[14],有望成为未来金属螯合肽研究的热点。目前已有关于海洋来源肽的相关特性的综述,但是文献时间较早,且综述内容较为单一,只针对肽的生物活性进行重点综述,尚无关于海洋来源的金属螯合肽的综述。本文对海洋来源的金属螯合肽最新研究进展进行综述,总结了当前研究成果,内容包含螯合机理、制备与分离纯化方法以及生物活性,并提出了一些未来可能的研究方向,内容更系统全面,对于后续进行金属螯合肽研究能起到有效的参考。
1. 海洋来源金属离子螯合肽螯合机理
1.1 螯合机理
研究发现,金属离子与肽螯合的机理是:金属离子可与肽类在氨基、羧基、肽键等位置上发生配位,以共价键形式结合,侧链中的氧、硫原子,可以提供孤对电子与金属离子结合[13]。
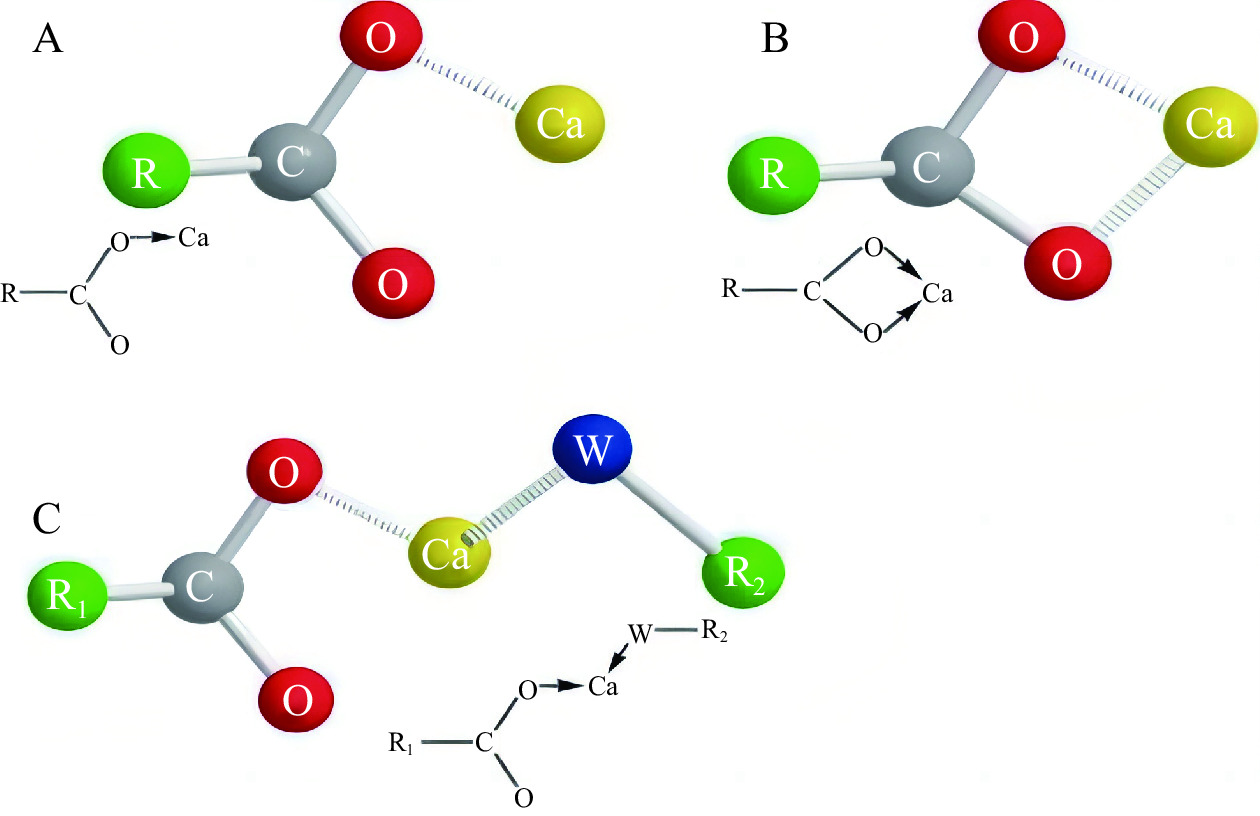
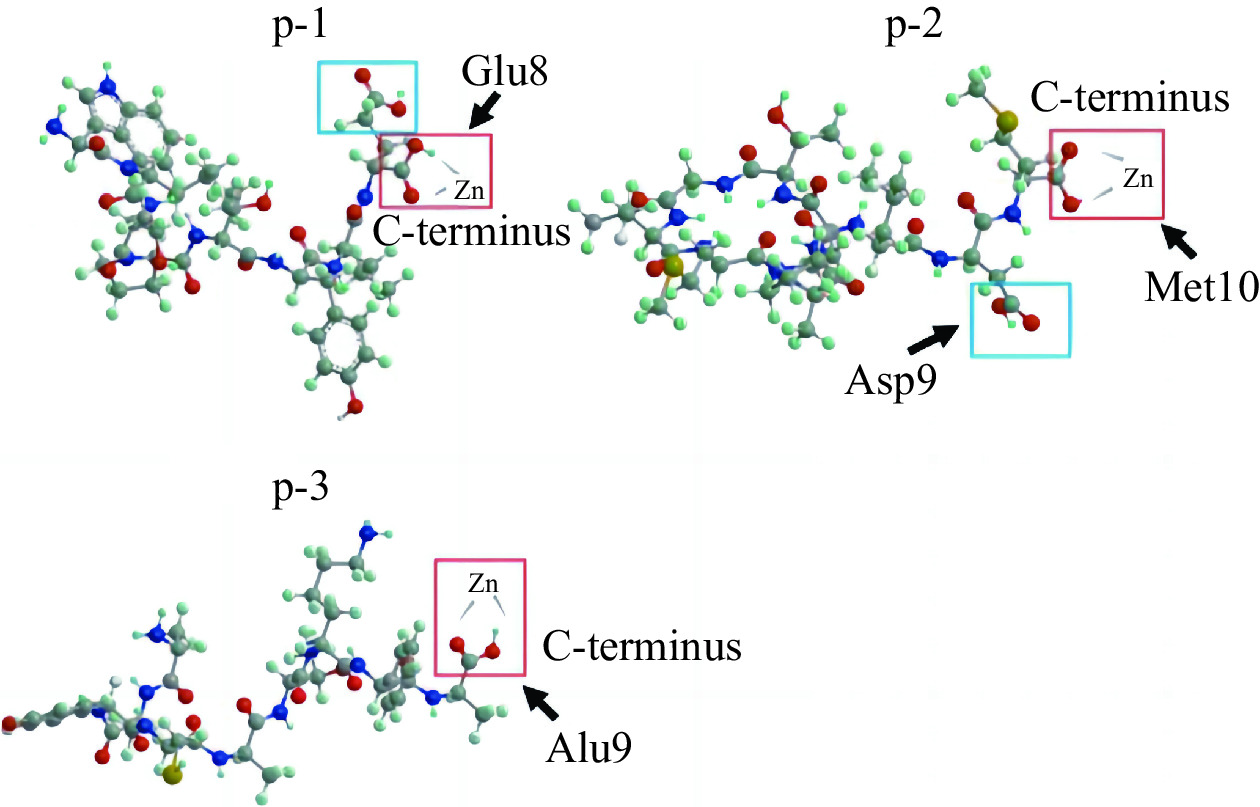
海洋多肽与金属离子存在三种主要螯合模式,即单齿螯合模式,Ca2+仅与COO−上的一个氧原子螯合;双齿螯合模式,COO−上的两个氧均可与Ca2+结合;α螯合模式,Ca2+与羧酸盐中的一个氧和来自其它钙结合基团的一个合适的有机原子(O、N、S等)螯合[15](图1[17])。如Lin等[16]在研究Fe2+螯合特性和提高Fe2+螯合肽生物利用率的机制中发现,Fe2+是以单齿和双齿螯合方式与Glu-Glu残基的羧基氧原子进行螯合的;Zhang等[17]从太平洋鳕鱼骨明胶水解物中纯化出的钙结合十肽,其Ca2+与Lys-10的羧酸O原子和侧链氨基N原子结合,通过α螯合模式形成钙螯合肽。目前的金属螯合肽螯合方式基本属于这三种,但近年来Liu等[18]研究了海参合成肽的锌螯合机制,研究发现,海参肽p-1、p-2和p-3与锌的结合主要是通过与C末端游离羧基的相互作用(图2)。这表明,锌螯合可以依赖于与肽C末端的游离羧基结合,说明金属离子与肽之间的螯合方式存在更多模式。因此肽与金属离子的螯合模式存在多样性,如何比较不同螯合模式对金属螯合肽活性影响,以及筛选出最佳的螯合模式,乃至探究更多的螯合模式,均可成为未来研究者的相关方向。
1.2 螯合效果影响因素
目前研究发现,影响金属离子螯合效果的因素主要与海洋多肽的结构特性有关,如肽的大小、肽的氨基酸种类和位置、一些特殊氨基酸基团等[19]。表1列举了部分海洋来源金属螯合肽及螯合金属和位点。
表 1 部分海洋来源金属螯合肽及螯合金属及位点Table 1. Some marine source metal chelating peptides and their chelating sites金属螯合肽 蛋白原料 金属来源 螯合位点 锌离子螯合肽 牡蛎[20] ZnSO4·7H2O 锌离子与羰基金属-受体方式、锌离子与氨基金属-供体方式、锌离子与羧基电荷-电荷方式 罗非鱼皮[21] ZnSO4 酰胺键,氨基的氮原子和羧基的氧原子 南极磷虾[22] ZnSO4 肽的羧基氧原子和氨基氮原子 海参[23] ZnSO4·7H2O 肽链碳端的-COOH的羟基 铁离子螯合肽 鲍鱼内脏[24] FeSO4 肽骨架的氨基、羧酸盐端基以及肽键 鱼鳞[25] FeCl2·4H2O 肽中的氨基、羧基、肽键 阿拉斯加鳕鱼骨[26] FeSO4·7H2O 肽的羧酸盐基团和肽键 钙离子螯合肽 海洋鱼骨胶原肽[27] CaCl2 肽中的氨基和羧基 太平洋鳕鱼骨[17] CaCl2 Asp-3和Lys-10的羧酸根的氧原子和Lys-10的侧链氨基的氮原子 凤尾鱼汁[28] 牡蛎壳 –NH2、COO-、N–H、C=O、C-H和-OH基团 1.2.1 肽的大小
肽的大小对肽与金属离子螯合有较大影响,研究显示低分子量的海洋多肽具有更高的螯合能力。如Chen等[29]研究罗非鱼皮胶原蛋白肽组分分子量对其锌螯合能力和锌配合物生物利用度的影响,结果显示分子量<1000 Da的肽表现出较高的锌螯合能力;Guo等[30]从阿拉斯加鳕鱼皮中提取出的分子量为345 Da的肽有最佳螯合铁能力。但Chen等[31]从牡蛎蛋白水解物中分离得到的分子量>1800 Da的肽也有较高的锌螯合能力,说明分子量>1000 Da的海洋多肽也具有较高的金属螯合能力。这说明不同来源的海洋多肽与金属离子结合性质有差异,以及各研究采用的分子量测定方法不同,导致肽分子量不同,从而结论出现差异,但其相关原理还需要进一步进行研究来揭示。
1.2.2 氨基酸种类及位置
氨基酸种类及位置对于肽与金属离子螯合也有重要影响。表2列出了部分海洋来源金属螯合肽的重要氨基酸。研究表明,有金属螯合活性的肽,氨基酸组成中一般具有组氨酸(His)、半胱氨酸(Cys)、谷氨酸(Glu)、天冬氨酸(Asp)等。
表 2 部分海洋来源金属螯合肽关键氨基酸Table 2. Key amino acids of metal chelated peptides from some marine sourcesGuo等[30]从阿拉斯加鳕鱼皮中提取的铁螯合肽的氨基酸序列为Ser-Cys-His;孙如男等[32]从南极磷虾粉中提取的金属螯合肽蛋白基料中天冬氨酸(Asp)、谷氨酸(Glu)、组氨酸(His)的含量超过1/3;吴长平等[33]从鳗鱼尾中提取制备的鳗鱼钙螯合肽中谷氨酸(Glu)和天冬氨酸(Asp)含量最高。这些研究说明了氨基酸种类对肽与金属离子螯合能力的影响。
另有研究显示,组氨酸、半胱氨酸、天冬氨酸、谷氨酸等氨基酸的螯合活性则取决于它们在序列中的位置[34]。如Munoz等[35]研究了Metallothionein(MT)中半胱氨酸的位置对于结合Cd2+的影响,发现其结构的稳定性和反应性由β结构域序列中的半胱氨酸决定。
1.2.3 特殊的基团和残基
随着红外光谱等技术的发展与应用,海洋多肽与金属离子的结合位点和螯合过程得到了更多揭示。研究发现,一些氨基酸与金属离子的螯合能力是氨基酸上的特殊基团决定的[39−40]。例如,碱性氨基酸如组氨酸(His)是由于其咪唑环而具有高螯合活性[30];而酸性氨基酸如谷氨酸是以γ-COO−、天冬氨酸是以β- COO−作为金属离子的结合位点[41],从而具有较好的螯合能力。由罗非鱼蛋白水解得到钙螯合肽Trp-Glu-Trp-Leu-His-Tyr-Trp的螯合能力主要与Glu的羧基和His的咪唑基相关[42];Chen等[31]研究指出,牡蛎肽肽分子表面的亲水性基团(-OH、-COOH、-NH2)的分布在与锌的结合中扮演重要的角色。
虽然现在对于影响海洋来源多肽与金属离子螯合的因素研究较多,但是关于螯合位点的准确位置、空间构效、氨基酸组成序列对螯合活性影响的具体机理以及动态过程等内容,还需要进一步探索。
2. 海洋来源金属离子螯合肽的制备技术
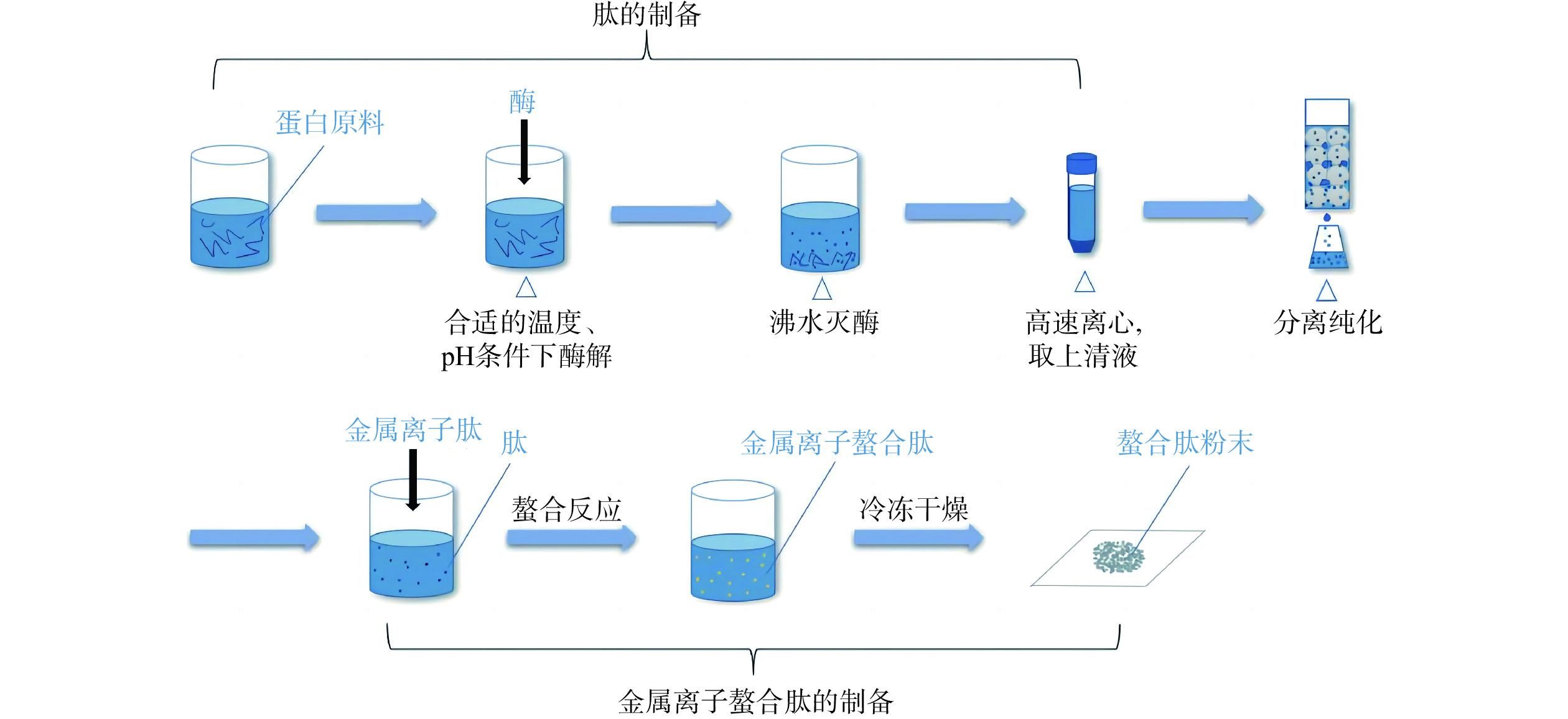
金属离子螯合肽制备大致流程如图3所示。
2.1 肽的制备
海洋来源金属离子螯合肽制备前首先要进行肽的制备。肽的制备方法有酶解法、化学提取法[43]、微生物发酵法[44]等,在肽制备完成后再进行金属螯合反应。海洋产品一般价格较高,因此多以海产品加工副产物作为肽的蛋白原料,如骨、皮、磷等,可以延长海产品的加工链,提高附加值。酶解法具有高效性,应用广泛,但受温度、pH等环境因素影响较大;微生物发酵法效率高,工艺简单,生产成本低,但是存在菌株的安全性问题;化学提取法虽然操作简单,但所使用的化学试剂有毒且对环境危害较大,近年来研究较少。
2.1.1 酶解法
酶解法是近年来的研究中应用最广泛的方法,具有高效、安全、条件温和可控等优点,即在适宜的温度、pH等条件下,用不同蛋白酶对海洋蛋白原料进行水解产生肽类产品。近年来,科研人员在蛋白酶种类、料液比、酶解工艺等方面进行了较多研究[45],一般采用单因素实验、响应面试验等确定最佳的酶解工艺。
超声波、微波是有效的辅助酶解方式,利用超声波在液体传播时产生的空化作用将细胞破碎,微波热效应破壁,可以缩短提取时间和提高提取效率。干建松[46]采用超声波辅助酶解法酶解海带蛋白制备抗氧化肽,王溢等[47]采用微波辅助酶解法制取鱼鳞胶原蛋白肽,实验结果均表明,这些辅助酶解的方法有助于缩短酶解时间。此外,不同处理方式对多肽的结构也有影响,从而影响肽的活性。王楠等[48]研究了微波辅助酶解对甲鱼蛋白肽抗氧化活性的影响,发现微波辅助处理的肽DPPH自由基清除率较未经微波处理提高了11.34%。
除单酶酶解之外,也有用双酶、三酶等多酶复合酶解的方法,可大大提高酶解效率[49−50]。与单酶酶解的方法相比,在多酶酶解的工艺条件下,要考虑酶的种类、配比和其应用的条件对研究结果影响。高雅鑫等[51]在双酶水解牡蛎蛋白的工艺中,使用的酶为中性蛋白酶和风味蛋白酶,两种蛋白酶添加量之比1:1,酶解液中氨基态氮的含量与理论值接近,结果良好。丁树慧等[52]实验筛选出中性蛋白酶和碱性蛋白酶为最佳水解脱脂鱼粉的酶,最优酶解条件为碱性蛋白酶与中性蛋白酶酶活力配比为6:4,在pH为8时用碱性蛋白酶酶解2 h,将pH降为7时用中性蛋白酶酶解3 h,总加酶量为2500 U/g,酶解温度为50 ℃,该条件下水解度高达41.84%。
在酶解法制备海洋多肽的方面研究已较为成熟,优势明显,但获取高活性的肽并且提高制备效率仍是所追求的目标,还有许多要改善的问题,如酶解过程复杂,酶解产物中含有多种肽,对于目标肽的分离筛选过程较繁琐,而且生物酶价格较高等。可以尝试将化学、物理及微生物方法与酶解法相结合,研发新的酶解体系,以获得高质量的酶解产物。
2.1.2 微生物发酵法
微生物发酵法是利用微生物菌种使代谢产生的蛋白酶水解底物蛋白,继而从发酵液中分离纯化多肽产物的方法。使用的菌株需要安全性高,而且产酶丰富、生长迅速。目前海洋多肽制备过程常用的发酵菌株有枯草芽孢杆菌、曲霉菌、乳酸菌等。现有的研究中有应用单一菌种发酵的方法,也有将多菌种结合使用的方法[53],混菌发酵的优势在于不同菌株共同产生蛋白酶,水解效率更高,但是要考虑最优的多菌种共生条件。王銮等[54]固态发酵榛仁粕制备降血压肽的研究中发现,混菌发酵获得的活性肽ACE抑制率大幅度提高。
Venegas-Ortega等[55]的研究表明乳酸菌蛋白水解酶系中的细胞膜结合蛋白酶对肽的产生及其生物活性起到重要作用。杨柳等[56]用枯草芽胞杆菌发酵脱脂南极磷虾粉制备南极磷虾肽的工艺中,多肽得率较高而且抗氧化活性良好。邢瀚文等[57]以罗非鱼鱼皮为原料,利用枯草芽孢杆菌固态发酵制备胶原蛋白肽,通过超滤的方法分离纯化得到三种胶原蛋白肽,产物水解度和多肽含量均较高,抗氧化性强。
基于微生物的复杂酶系,发酵法生产效率高,生产成本低,易于投入工业化生产[58],并且微生物的肽酶可以除去苦味肽,从而可以改良肽产品的风味[59]。但是也存在部分菌株安全性低,而且容易受到有害微生物的污染的问题。随着现代发酵技术的进步,微生物发酵法有望成为研究的热点。
2.2 金属离子螯合肽的制备
金属离子螯合肽是金属离子与肽以定量的摩尔比连系而构成的具备环状布局的有机化合物,金属离子与肽的质量比、制备的pH、温度和时间等都会对反应产生影响,不同螯合工艺的螯合速度和获得螯合产物的理化性质都有所不同。例如在海洋多肽与金属离子质量比较低时,螯合反应不充分,螯合率较低,而质量比较高时会造成肽的浪费且纯度降低;pH较低或者较高都不利于产物生成[60]。因此,优化金属离子螯合肽生产工艺,获取高螯合率、高活性的螯合肽是研究中最为重要的一环。Cai等[61]采用响应面法优化鳕鱼皮胶原蛋白肽与亚铁离子螯合反应的条件,螯合肽得率为37.31%。阚文翰等[62]将酶解得到的多肽粗提物先经Q Sepharose FF阴离子交换色谱与RP-HPLC色谱法两步分离再进行螯合反应,得到的酪蛋白磷酸肽具有更高的锌螯合活性。
由于蛋白原料不同,酶解获得的多肽氨基酸组成和结构也会存在差异,而且螯合的金属离子种类也不相同,所以不同金属离子螯合肽制备的螯合特性都会有所不同。
2.3 具有螯合活性的肽的分离纯化
经蛋白酶酶解获得的产物组成较为复杂,为了获取纯度更高的海洋来源金属螯合多肽,通常还需要进行螯合肽的纯化。肽的矿物质结合能力与其分子量和长度有关,可以通过超滤、色谱、层析等方法进行分离。
超滤利用膜两侧压差截留水中大分子的物质,而透过水和小分子的颗粒,具有操作简单、能耗低、对物料组分无影响、回收率高、过滤效果好等优点[63],在海洋活性肽分离提取中有着极为广阔的应用前景。Yang等[64]用超滤膜制备了低分子量的胶原蛋白肽,并制成了钙离子螯合肽,具有作为钙补充剂的良好潜力。但超滤技术应用中也存在半透膜堵塞,造成蛋白质的转化率降低的问题,因此也常将其与其他技术相结合来应用[59]。
色谱法是利用不同物质理化性质的差异进行分离的,不同的物质在两相之间的分配比不同,因而在移动速度方面就产生了差别,随着流动相的运动,混合物不同组分在固定相上相互分离,是分离纯化多肽最常用的技术之一。它包括离子交换色谱、高效液相色谱、吸附色谱等,能有效地分离纯化多种所需特定的肽段。Sudhakar等[65]通过离子交换和凝胶过滤色谱纯化印度鱿鱼的水解产物,纯化的肽表现出很强的自由基清除、金属螯合和还原能力。Lin等[66]在罗非鱼皮肤胶原蛋白铁螯合肽的研究中,通过固定化金属亲和色谱法获得了罗非鱼皮胶原铁螯合肽,然后通过反向高效液相色谱法对其进行纯化,并通过液相色谱法进行鉴定,纯化并鉴定出四种铁螯合肽。
层析法分离效果好,条件温和,应用广泛,但也有分辨率不高,分离操作较慢的缺点,而色谱法具有分离效率高、分析速度快、检测灵敏度高的优点,因此在研究中使用多种方法结合具有更好的效果[67]。例如Zhang等[17]采用羟基磷灰石特异性亲和柱层析和反相高效液相色谱分离得到了一种新的十肽,表现出较高的钙结合活性。Zhang等[68]通过 Sephadex G-25 凝胶过滤色谱和 C18 反相高效液相色谱 (RP-HPLC) 从裂殖壶菌蛋白水解产物中纯化出一种特异性钙结合肽。虽然分离纯化多肽的方法很多,获取高纯度、高活性的海洋来源金属螯合肽仍然是值得关注的重点,目前多技术联合使用的方法已展现出巨大的优势,仍会成为未来发展的方向。
3. 海洋来源金属螯合肽的主要生物活性
海洋来源多肽本身具有抗菌、抗氧化、抗冻、抗炎、免疫调节、抑制血管紧张素转化酶等多种活性[2−4],当海洋来源多肽与不同金属离子以共价键的形式结合形成金属螯合肽后,理化性质发生改变,具备了促进人体金属离子的吸收等新的生物活性,同时可以改善或辅助治疗人体因金属离子缺乏导致的部分病症。表3列举了部分海洋来源的金属离子螯合肽及其生物学活性。
表 3 海洋来源金属离子螯合肽主要生物活性Table 3. Main biological activity of marine source metal ion chelating peptides生物活性 金属螯合肽 蛋白原料 具体效用 促进金属离子吸收 铁离子、亚铁离子螯合肽 阿拉斯加鳕鱼骨架、带鱼[26,71] 改善铁缺乏症,治疗贫血 钙离子螯合肽 小球藻[72] 作补钙剂 抑菌活性 亚铁离子螯合肽 带鱼[39] 构建跨膜离子通道破裂细菌对多种细菌,尤其是革兰氏阳性菌
起良好抑制作用锌离子螯合肽 章鱼下脚料[74] 破坏细菌细胞膜、细胞壁,释放杀菌物质 抗氧化活性 钙离子螯合肽 蛏子、罗非鱼[75−76] 对羟自由基的清除率和超氧阴离子自由基起清除、抑制作用 亚铁离子螯合肽 马鲛鱼、带鱼、鳀鱼、梅童鱼[77] 对羟自由基、超氧阴离子、二苯基苦基苯肼(DPPH)起清除、抑制作用 锌离子螯合肽 鱼[78] 提高体内锌含量,降低肝匀浆中丙二醛含量,提高总抗氧化能力 3.1 促进金属离子的吸收,改善贫血、骨质疏松等症状
海洋来源金属螯合肽能显著提高人体对金属离子的吸收。人体对金属元素的补充主要有两个方式:食补和服用金属离子营养制剂[69]。其主要的吸收部位在小肠,但一般情况下金属离子经消化道吸收率较低,且受存在形式、内源因素、加工处理、食物种类等因素影响,吸收利用率一般在10%~85%不等,部分甚至不足10%[70]。金属螯合肽将多肽与金属离子结合,使人体胃肠消化吸收多肽的同时吸收金属离子,达到补充金属离子的目的。
海洋来源铁螯合肽能够显著增强人体对铁离子和亚铁离子的吸收。铁在人体组织对正常生理功能的维持过程中起重要作用,是人体所必需的微量元素[69]。铁作为血红蛋白的组成部分,参与氧气在人体内的运输与储存。除此之外,铁不仅是大多数酶的组成部分,参与细胞代谢,还能维持正常的造血功能,增强神经系统和免疫系统的功能。缺铁会导致贫血、发育不良和孕产妇死亡率增加等。铁离子螯合肽和亚铁离子螯合肽的摄入可以有效改善铁缺乏症导致的贫血。通过调整血红蛋白、血清铁和转铁蛋白水平,恢复铁与转铁蛋白结合能力从而展示出抗贫血的活性。Ma等[26]使用阿拉斯加鳕鱼骨架来源的亚铁离子螯合肽对铁缺乏症贫血大鼠进行治疗,摄入后缺铁模型大鼠的增重、身高和血液学参数均恢复到了正常水平。袁宁等[71]从血细胞方面进行分析,用带鱼蛋白源亚铁肽螯合治疗缺铁大鼠,治疗后血液中血红蛋白浓度和红细胞数量显著升高。证明其改善作用明显。
海洋来源钙螯合肽作为补钙剂具有良好的效用。钙对人体骨骼健康起着至关重要的作用,尤其是对儿童和老年人而言。钙的摄入量和生物利用度低可能导致钙缺乏症,表现为骨组织微结构退化,导致骨脆性和骨折风险增加。Hua等[72]研究了小球藻水解肽钙螯合物在SD大鼠体内的作用,研究发现,钙螯合肽可使体重增加且增加了血清钙、骨活性、骨矿物质密度(BMD)和骨矿物质含量(BMC)的水平,同时降低血清碱性磷酸酶(ALP)水平并抑制骨的形态学变化,证明其是有效的补钙剂。
3.2 抑菌活性
除促进金属离子吸收,提高生物利用率外,海洋来源金属离子螯合肽也表现出良好的抑菌活性。其作用机理主要是通过引起细菌形态、细胞成分、膜电位、细胞内活性氧(ROS)水平和细胞内酶活性的变化[73],实现抑菌效果。
亚铁螯合多肽可以通过构建跨膜离子通道达到使菌体结构破坏的目的,菌体会因内部物质外流泄露而死亡。故而海洋来源多肽螯合亚铁可以表现出良好的抑菌活性。钟明杰[39]研究发现带鱼蛋白源亚铁螯合肽对革兰氏阳性菌和革兰氏阴性菌均具有良好的抑菌效果。其实验通过牛津杯双层平板法测定该亚铁螯合肽对金黄色葡萄球菌、沙门氏菌、枯草芽孢杆菌、大肠杆菌均有不同的抗性作用。尤其是对革兰氏阳性菌有较好的抑菌效果。从该实验结果中可以看出亚铁螯合多肽的抑菌效果较好,且作用较为广泛。
海洋来源锌离子螯合肽通过破坏细菌的细胞膜和细胞壁,增加细胞通透性,造成细菌结构损伤并且释放具有杀菌活性的物质达到抑菌效果。此外,还可以通过ROS触发途径诱导金黄色葡萄球菌细胞死亡。Fang等[74]研究了章鱼下脚料多肽与锌的螯合物,发现锌离子螯合肽对金黄色葡萄球菌具有显著的抗菌能力,其最小抑菌浓度(MIC)为1.56 mg/mL。该实验结果主要证实了锌离子螯合肽针对金黄色葡萄球菌的杀菌作用明显。
综上,海洋来源金属离子螯合肽在抑菌方面的作用较为广泛,对多种常见革兰氏阴性菌、革兰氏阳性菌均展现出较好的抑菌活性,尤其对革兰氏阳性菌有突出的抑菌效果。
3.3 抗氧化活性
人体内的未配对电子的金属离子会催化Fenton反应产生自由基,海洋来源金属螯合肽能够结合这些金属离子从而阻断自由基的产生,在人体中表现出一定的抗氧化活性。同时肽和金属离子螯合阻碍金属与脂类和过氧化物的相互作用,从而实现抗氧化。海洋来源的多种不同金属离子螯合肽如钙离子螯合肽、亚铁离子螯合肽、锌离子螯合肽均对多种自由基展现出了较好的清除或抑制效果。
在钙离子金属螯合肽方面,王梦娅等[75]用硫代巴比妥酸法验证了蛏子多肽钙螯合物表现出的抗氧化活性相当于α生育酚的71.08%。Wang等[76]实验验证罗非鱼来源钙离子螯合肽浓缩液对羟自由基的清除率和对超氧阴离子自由基的抑制率分别为6.60%和51.67%,实验结果显示效果良好。
在亚铁离子螯合肽方面,林慧敏等[77]对马鲛鱼、带鱼、鳀鱼、梅童鱼蛋白源亚铁螯合肽进行自由基清除研究,四种鱼类蛋白源亚铁螯合肽均出现不同程度的清除羟自由基、超氧阴离子、二苯基苦基苯肼(DPPH)等自由基的活性,实验证实了多种鱼蛋白来源亚铁螯合肽对自由基均有清除或抑制作用。
锌离子螯合肽方面,鱼蛋白来源锌离子螯合肽可以明显提高小鼠肝脏、血清中的锌含量,显著降低小鼠肝匀浆中丙二醛含量,提高总抗氧化能力[78]。同时经Yang等[78]实验证实鱼蛋白锌离子螯合肽的抗氧化使用效果优于同剂量的葡萄糖酸锌或硫酸锌。
综上,海洋来源金属离子螯合肽能表现出较好的抗氧化生物活性,在对多种自由基进行清除和抑制时均有一定的效果,并在部分应用中优于同剂量的化学抗氧化剂。
4. 总结与展望
综上所述,海洋来源金属螯合肽主要的螯合模式是单齿螯合、双齿螯合模式和α螯合模式,但是关于螯合位点的位置、空间构效、氨基酸组成序列对螯合活性影响的具体机理以及动态过程等内容,还需要进一步探索。海洋来源金属螯合肽以超声或微波辅助的复合酶解法为主要制备方法,采用色谱法、超滤法及层析法进行分离纯化。金属离子螯合肽可以作为金属离子补充剂同时也具备抗菌、抗氧化等多肽功能的生物活性。目前,其主要的制备方法的研究已较为成熟,后续研究可以围绕纯化方法的工艺优化、生物活性及其作用机制等方面展开。国内外对海洋来源的金属离子螯合肽在螯合后与螯合前生物活性的区别与原因的研究目前较少,可进行更进一步的探索。
-
表 1 部分海洋来源金属螯合肽及螯合金属及位点
Table 1 Some marine source metal chelating peptides and their chelating sites
金属螯合肽 蛋白原料 金属来源 螯合位点 锌离子螯合肽 牡蛎[20] ZnSO4·7H2O 锌离子与羰基金属-受体方式、锌离子与氨基金属-供体方式、锌离子与羧基电荷-电荷方式 罗非鱼皮[21] ZnSO4 酰胺键,氨基的氮原子和羧基的氧原子 南极磷虾[22] ZnSO4 肽的羧基氧原子和氨基氮原子 海参[23] ZnSO4·7H2O 肽链碳端的-COOH的羟基 铁离子螯合肽 鲍鱼内脏[24] FeSO4 肽骨架的氨基、羧酸盐端基以及肽键 鱼鳞[25] FeCl2·4H2O 肽中的氨基、羧基、肽键 阿拉斯加鳕鱼骨[26] FeSO4·7H2O 肽的羧酸盐基团和肽键 钙离子螯合肽 海洋鱼骨胶原肽[27] CaCl2 肽中的氨基和羧基 太平洋鳕鱼骨[17] CaCl2 Asp-3和Lys-10的羧酸根的氧原子和Lys-10的侧链氨基的氮原子 凤尾鱼汁[28] 牡蛎壳 –NH2、COO-、N–H、C=O、C-H和-OH基团 表 2 部分海洋来源金属螯合肽关键氨基酸
Table 2 Key amino acids of metal chelated peptides from some marine sources
表 3 海洋来源金属离子螯合肽主要生物活性
Table 3 Main biological activity of marine source metal ion chelating peptides
生物活性 金属螯合肽 蛋白原料 具体效用 促进金属离子吸收 铁离子、亚铁离子螯合肽 阿拉斯加鳕鱼骨架、带鱼[26,71] 改善铁缺乏症,治疗贫血 钙离子螯合肽 小球藻[72] 作补钙剂 抑菌活性 亚铁离子螯合肽 带鱼[39] 构建跨膜离子通道破裂细菌对多种细菌,尤其是革兰氏阳性菌
起良好抑制作用锌离子螯合肽 章鱼下脚料[74] 破坏细菌细胞膜、细胞壁,释放杀菌物质 抗氧化活性 钙离子螯合肽 蛏子、罗非鱼[75−76] 对羟自由基的清除率和超氧阴离子自由基起清除、抑制作用 亚铁离子螯合肽 马鲛鱼、带鱼、鳀鱼、梅童鱼[77] 对羟自由基、超氧阴离子、二苯基苦基苯肼(DPPH)起清除、抑制作用 锌离子螯合肽 鱼[78] 提高体内锌含量,降低肝匀浆中丙二醛含量,提高总抗氧化能力 -
[1] SABLE R, PARAJULI P, JOIS S. Peptides, peptidomimetics, and polypeptides from marine sources:A wealth of natural sources for pharmaceutical applications[J]. Marine Drugs,2017,15(4):124. doi: 10.3390/md15040124
[2] HOU X, HU Z, CHEN G, et al. Antimicrobial peptides:Antibacterial mechanism and therapeutic use[J]. Microbiology,2009,36(1):97−105.
[3] WANG S, ZHAO J, CHEN L, et al. Preparation, isolation and hypothermia protection activity of antifreeze peptides from shark skin collagen[J]. LWT - Food Science and Technology,2014,55(1):210−217. doi: 10.1016/j.lwt.2013.07.019
[4] YANG Q, CAI X, LIU Z, et al. Antioxidant assessment of Schizochytrium meal protein enzymatic hydrolysate and its potential application[J]. Journal of Aquatic Food Product Technology,2019,28(4):413−426. doi: 10.1080/10498850.2019.1595799
[5] NAGAOKA S, FUTAMURA Y, MIWA K, et al. Identification of novel hypocholesterolemic peptides derived from bovine milk β-lactoglobulin[J]. Biochemical and Biophysical Research Communications,2001,281(1):11−17. doi: 10.1006/bbrc.2001.4298
[6] PATIL S P, GOSWAMI A, KALIA K, et al. Plant-derived bioactive peptides:A treatment to cure diabetes[J]. International Journal of Peptide Research and Therapeutics,2020,26(2):955−968. doi: 10.1007/s10989-019-09899-z
[7] ESCUDERO E, MORA L, TOLDRÁ F. Stability of ACE inhibitory ham peptides against heat treatment and in vitro digestion[J]. Food Chemistry,2014,161:305−311. doi: 10.1016/j.foodchem.2014.03.117
[8] 汪少芸, 杨倩, 蔡茜茜, 等. 食源性功能肽的研究进展[J]. 食品与机械,2020,36(6):1−10. [WANG Shaoyun, YANG Qian, CAI Qianqian, et al. Research progress of foodborne functional peptides[J]. Food & Machinery,2020,36(6):1−10.] WANG Shaoyun, YANG Qian, CAI Qianqian, et al. Research progress of foodborne functional peptides[J]. Food & Machinery, 2020, 36(6): 1−10.
[9] COOPER B M, IEGRE J, DONOVAN D H O, et al. Peptides as a platform for targeted therapeutics for cancer:Peptide-drug conjugates (PDCs)[J]. Chemical Society Reviews,2021,50(3):1480−1494. doi: 10.1039/D0CS00556H
[10] POPE J E, DEER T R. Ziconotide:A clinical update and pharmacologic review[J]. Expert Opinion on Pharmacotherapy,2013,14(7):957−966. doi: 10.1517/14656566.2013.784269
[11] 王延华, 王卫东. 生命必需金属元素与人体健康[J]. 昭乌达蒙族师专学报(自然科学版),2001(6):44−46. [WANG Yanhua, WANG Weidong. Life essential metal elements and human health[J]. Journal of Zhaowuda Mongolian Teachers College (Natural Science Edition),2001(6):44−46.] WANG Yanhua, WANG Weidong. Life essential metal elements and human health[J]. Journal of Zhaowuda Mongolian Teachers College (Natural Science Edition), 2001(6): 44−46.
[12] 王晓萍, 郭晓娜, 朱科学, 等. 固定化金属亲和层析富集麦胚蛋白金属螯合肽的研究[J]. 中国粮油学报,2015,30(3):101−105. [WANG Xiaoping, GUO Xiaona, ZHU Kexue, et al. Enrichment of metal chelate peptides in wheat embryo protein by immobilized metal affinity chromatography[J]. China Journal of Cereals and Oils,2015,30(3):101−105.] WANG Xiaoping, GUO Xiaona, ZHU Kexue, et al. Enrichment of metal chelate peptides in wheat embryo protein by immobilized metal affinity chromatography[J]. China Journal of Cereals and Oils, 2015, 30(3): 101−105.
[13] 布冠好, 王孟丽. 肽与金属离子螯合物的研究进展[J]. 食品工业,2021,42:323−326. [BU Guanhao, WANG Mengli. Research progress of peptides and metal ions chelates[J]. Food Industry,2021,42:323−326.] BU Guanhao, WANG Mengli. Research progress of peptides and metal ions chelates[J]. Food Industry, 2021, 42: 323−326.
[14] WU R, WU C, LIU D, et al. Overview of antioxidant peptides derived from marine resources:The sources, characteristic, purification, and evaluation methods[J]. Applied Biochemistry and Biotechnology,2015,176(7):1815−1833. doi: 10.1007/s12010-015-1689-9
[15] KAHLEN J, SALIMI L, SULPIZI M, et al. Interaction of charged amino-acid side chains with ions:An optimization strategy for classical force fields[J]. The Journal of Physical Chemistry B,2014,118(14):3960−3972. doi: 10.1021/jp412490c
[16] LIN S, HU X, YANG X, et al. GLPGPSGEEGKR:Fe2+ chelating characterization and potential transport pathways for improving Fe2+ bioavailability in Caco-2 cells[J]. Food Bioscience,2022,48:101806. doi: 10.1016/j.fbio.2022.101806
[17] ZHANG K, LI J, HOU H, et al. Purification and characterization of a novel calcium-biding decapeptide from Pacific cod (Gadus macrocephalus) bone:Molecular properties and calcium chelating modes[J]. Journal of Functional Foods,2019,52:670−679. doi: 10.1016/j.jff.2018.11.042
[18] LIU X, WANG Z, YIN F, et al. Zinc-chelating mechanism of sea cucumber (Stichopus japonicus)-derived synthetic peptides[J]. Marine Drugs,2019,17(8):438. doi: 10.3390/md17080438
[19] 李雪芬, 杜斌, 丁轲, 等. 金属螯合肽分离纯化及其抗氧化活性的研究进展[J]. 中国食物与营养,2016,22(3):35−39. [LI Xuefen, DU Bin, DING Ke, et al. Research progress in separation, purification and antioxidant activities of metal-chelated peptides[J]. Food and Nutrition in China,2016,22(3):35−39.] doi: 10.3969/j.issn.1006-9577.2016.03.008 LI Xuefen, DU Bin, DING Ke, et al. Research progress in separation, purification and antioxidant activities of metal-chelated peptides[J]. Food and Nutrition in China, 2016, 22(3): 35−39. doi: 10.3969/j.issn.1006-9577.2016.03.008
[20] WANG Z, CHENG S, WU D, et al. Hydrophobic peptides from oyster protein hydrolysates show better zinc-chelating ability[J]. Food Bioscience,2021,41:100985. doi: 10.1016/j.fbio.2021.100985
[21] 柯枭, 胡晓, 杨贤庆, 等. 罗非鱼皮胶原蛋白肽-锌螯合物的制备及结构表征与体外消化分析[J]. 食品与发酵工业,2021,47(14):38−44. [KE Xiao, HU Xiao, YANG Xianqing, et al. Preparation, structural characterization and in vitro digestion of Tilapia skin collagen peptide-zinc chelate[J]. Food and Fermentation Industry,2021,47(14):38−44.] doi: 10.13995/j.cnki.11-1802/ts.026625 KE Xiao, HU Xiao, YANG Xianqing, et al. Preparation, structural characterization and in vitro digestion of Tilapia skin collagen peptide-zinc chelate[J]. Food and Fermentation Industry, 2021, 47(14): 38−44. doi: 10.13995/j.cnki.11-1802/ts.026625
[22] SUN R, LIU X, YU Y, et al. Preparation process optimization, structural characterization and in vitro digestion stability analysis of Antarctic krill (Euphausia superba) peptides-zinc chelate[J]. Food Chemistry,2021,340:128056. doi: 10.1016/j.foodchem.2020.128056
[23] 王紫旭. 海参锌螯合多肽的制备和鉴定及其促锌吸收作用的研究[D]. 大连:大连工业大学, 2021. [WANG Zixu. Preparation and identification of zinc chelating polypeptide of sea cucumber and its promoting effect on zinc absorption[D]. Dalian:Dalian Polytechnic University, 2021.] WANG Zixu. Preparation and identification of zinc chelating polypeptide of sea cucumber and its promoting effect on zinc absorption[D]. Dalian: Dalian Polytechnic University, 2021.
[24] WU W, JIA J, WEN C, et al. Optimization of ultrasound assisted extraction of abalone viscera protein and its effect on the iron-chelating activity[J]. Ultrasonics Sonochemistry,2021,77:105670. doi: 10.1016/j.ultsonch.2021.105670
[25] 覃宇, 鞠守勇. 鱼鳞多肽亚铁螯合物的制备及结构表征[J]. 西南农业学报,2020,33(2):456−463. [QIN Yu, JU Shouyong. Preparation and structural characterization of fish scale polypeptide ferrous chelates[J]. Southwest Chinese Journal of Agricultural Sciences,2020,33(2):456−463.] QIN Yu, JU Shouyong. Preparation and structural characterization of fish scale polypeptide ferrous chelates[J]. Southwest Chinese Journal of Agricultural Sciences, 2020, 33(2): 456−463.
[26] MA X, LIU C, SONG W, et al. Evaluating the efficacy of a ferrous-ion-chelating peptide from Alaska pollock frame for the improvement of iron nutritional status in rats[J]. Food & Function,2019,10(8):4888−4896.
[27] 高菲, 王维有, 鲁军, 等. 海洋鱼骨胶原肽钙螯合物的制备及红外光谱表征[J]. 中国海洋大学学报(自然科学版),2015,45(1):47−54. [GAO Fei, WANG Weiyou, LU Jun, et al. Preparation and infrared spectroscopy characterization of collagen peptide calcium chelates from marine fish bone[J]. Journal of Ocean University of China (Natural Science),2015,45(1):47−54.] GAO Fei, WANG Weiyou, LU Jun, et al. Preparation and infrared spectroscopy characterization of collagen peptide calcium chelates from marine fish bone[J]. Journal of Ocean University of China (Natural Science), 2015, 45(1): 47−54.
[28] KE H, MA R, LIU X, et al. Highly effective peptide-calcium chelate prepared from aquatic products processing wastes:Stickwater and oyster shells[J]. LWT,2022,168:113947. doi: 10.1016/j.lwt.2022.113947
[29] CHEN L, SHEN X, XIA G. Effect of molecular weight of tilapia (Oreochromis Niloticus) skin collagen peptide fractions on zinc-chelating capacity and bioaccessibility of the zinc-peptide fractions complexes in vitro digestion[J]. Applied Sciences,2020,10(6):2041. doi: 10.3390/app10062041
[30] GUO L, HOU H, LI B, et al. Preparation, isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J]. Process Biochemistry,2013,48(5-6):988−993. doi: 10.1016/j.procbio.2013.04.013
[31] CHEN D, LIU Z, HUANG W, et al. Purification and characterisation of a zinc-binding peptide from oyster protein hydrolysate[J]. Journal of Functional Foods,2013,5(2):689−697. doi: 10.1016/j.jff.2013.01.012
[32] 孙如男, 冷凯良, 高华, 等. 南极磷虾金属螯合肽蛋白基料的酶解制备工艺优化[J]. 食品科技,2020,45(7):159−165. [SUN Runan, LENG Kaliang, GAO Hua, et al. Optimization of preparation technology of metal chelate peptide protein base of Krill Antarctic by enzymolysis[J]. Food Science and Technology,2020,45(7):159−165.] SUN Runan, LENG Kaliang, GAO Hua, et al. Optimization of preparation technology of metal chelate peptide protein base of Krill Antarctic by enzymolysis[J]. Food Science and Technology, 2020, 45(7): 159−165.
[33] 吴长平, 钟芳芳, 霍国昌, 等. 鳗鱼钙螯合肽制备工艺研究[J]. 现代食品科技,2018,34(1):181−187. [WU Changping, ZHONG Fangfang, HUO Guochang, et al. Study on preparation technology of calcium chelated peptides from eel[J]. Modern Food Science and Technology,2018,34(1):181−187.] WU Changping, ZHONG Fangfang, HUO Guochang, et al. Study on preparation technology of calcium chelated peptides from eel[J]. Modern Food Science and Technology, 2018, 34(1): 181−187.
[34] KULA E, KOCADAG KOCAZORBAZ E, MOULAHOUM H, et al. Extraction and characterization of novel multifunctional peptides from Trachinus draco (greater weever) myofibrillar proteins with ACE/DPP4 inhibitory, antioxidant, and metal chelating activities[J]. Journal of Food Biochemistry,2020,44(5):e13179.
[35] MUNOZ A, PETERING D H, SHAW C F. Structure-reactivity relationships among metallothionein three-metal domains:Role of non-cysteine amino acid residues in lobster metallothionein and human metallothionein-3[J]. Inorganic Chemistry,2000,39(26):6114−6123. doi: 10.1021/ic000485s
[36] LI X, CHI C, LI L, et al. Purification and identification of antioxidant peptides from protein hydrolysate of scalloped hammerhead (Sphyrna lewini) cartilage[J]. Marine Drugs,2017,15(3):61. doi: 10.3390/md15030061
[37] 刘艳, 鲁军, 陈亮, 等. 牡蛎肽锌螯合物的制备工艺研究[J]. 食品工业科技,2016,37(8):257−261. [LIU Yan, LU Jun, CHEN Liang, et al. Study on preparation technology of oyster peptide zinc chelate[J]. Science and Technology of Food Industry,2016,37(8):257−261.] doi: 10.13386/j.issn1002-0306.2016.08.045 LIU Yan, LU Jun, CHEN Liang, et al. Study on preparation technology of oyster peptide zinc chelate[J]. Science and Technology of Food Industry, 2016, 37(8): 257−261. doi: 10.13386/j.issn1002-0306.2016.08.045
[38] 周亮. 鱼鳞胶原小肽螯合锌的制备研究[D]. 武汉:湖北工业大学, 2014. [ZHOU Liang. Preparation of zinc chelated by small peptide in fish scale collagen[D]. Wuhan:Hubei University of Technology, 2014.] ZHOU Liang. Preparation of zinc chelated by small peptide in fish scale collagen[D]. Wuhan: Hubei University of Technology, 2014.
[39] 钟明杰. 带鱼下脚料蛋白水解螯合物制备及生物特性研究[D]. 青岛:中国海洋大学, 2009. [ZHONG Mingjie. Preparation and biological properties of protein hydrolyzed chelate from hairtail fish leftovers[D]. Qingdao:Ocean University of China, 2009.] ZHONG Mingjie. Preparation and biological properties of protein hydrolyzed chelate from hairtail fish leftovers[D]. Qingdao: Ocean University of China, 2009.
[40] 吴卫平, 邓尚贵, 徐涛, 等. 鳕鱼皮水解蛋白亚铁修饰产物(Fe-FPH)结构及营养分析[J]. 浙江海洋学院学报(自然科学版),2010,29(2):136−141. [WU Weiping, DENG Shanggui, XU Tao, et al. Structure and nutrition analysis of hydrolyzed protein (Fe-FPH) from cod skin[J]. Journal of Zhejiang Ocean University (Natural Science Edition),2010,29(2):136−141.] WU Weiping, DENG Shanggui, XU Tao, et al. Structure and nutrition analysis of hydrolyzed protein (Fe-FPH) from cod skin[J]. Journal of Zhejiang Ocean University (Natural Science Edition), 2010, 29(2): 136−141.
[41] WANG X, GUO X, ZHU K, et al. Enrichment of metal chelating peptides from wheat germ protein by immobilized-metal ion affinity chromatography[J]. Journal of the Chinese Cereals and Oils Association,2015,30(3):101−105.
[42] CHAROENPHUN N, CHEIRSILP B, SIRINUPONG N, et al. Calcium-binding peptides derived from tilapia (Oreochromis niloticus) protein hydrolysate[J]. European Food Research and Technology,2013,236(1):57−63. doi: 10.1007/s00217-012-1860-2
[43] 张纯丽, 马美湖. 活性多肽提取分离方法研究进展[J]. 农产品加工(学刊),2006(3):27−29,32. [ZHANG Chunli, MA Meihu. Research progress on extraction and separation of active polypeptides[J]. Agricultural Products Processing (Journal),2006(3):27−29,32.] ZHANG Chunli, MA Meihu. Research progress on extraction and separation of active polypeptides[J]. Agricultural Products Processing (Journal), 2006(3): 27−29,32.
[44] 林金莺, 曾庆祝, 安琪. 枯草芽孢杆菌发酵火麻仁粕的研究[J]. 中国调味品,2011,36(8):31−36. [LIN Jinying, ZENG Qingzhu, AN Qi. Study on fermentation of flaxseed meal by Bacillus subtilis[J]. Chinese Condiment,2011,36(8):31−36.] LIN Jinying, ZENG Qingzhu, AN Qi. Study on fermentation of flaxseed meal by Bacillus subtilis[J]. Chinese Condiment, 2011, 36(8): 31−36.
[45] 付雪媛, 杜芬, 孙呈浩, 等. 蛤蜊肽的制备工艺优化及其增强免疫活性[J]. 食品工业科技,2023,44(9):244−253 [FU Xueyuan, DU Fen, SUN Chenghao, et al. Optimization of preparation technology of clam peptide and its enhancement of immune activity[J]. Science and Technology of Food Industry,2023,44(9):244−253.] FU Xueyuan, DU Fen, SUN Chenghao, et al. Optimization of preparation technology of clam peptide and its enhancement of immune activity[J]. Science and Technology of Food Industry, 2023, 44(9): 244−253.
[46] 干建松. 超声辅助酶解海带蛋白制备抗氧化肽及其活性研究[J]. 中国食品添加剂,2022,33(5):64−72. [GAN Jiansong. Preparation of antioxidant peptide and its activity by enzymolysis of kelp protein assisted by ultrasound[J]. China Food Additives,2022,33(5):64−72.] GAN Jiansong. Preparation of antioxidant peptide and its activity by enzymolysis of kelp protein assisted by ultrasound[J]. China Food Additives, 2022, 33(5): 64−72.
[47] 王溢, 盛彩虹, 袁宏丽, 等. 微波辅助酶解前处理对鱼鳞胶原蛋白肽粉品质的影响[J]. 食品工业科技,2014,35(20):170−173. [WANG Yi, SHENG Caihong, YUAN Hongli, et al. Effect of microwave assisted digestion pretreatment on the quality of fish collagen peptide powder[J]. Science and Technology of Food Industry,2014,35(20):170−173.] WANG Yi, SHENG Caihong, YUAN Hongli, et al. Effect of microwave assisted digestion pretreatment on the quality of fish collagen peptide powder[J]. Science and Technology of Food Industry, 2014, 35(20): 170−173.
[48] 王楠, 陈晓媛, 饶桂维, 等. 微波辅助酶解对甲鱼蛋白肽抗氧化活性的影响[J]. 中国食品学报,2017,17(11):131−137. [WANG Nan, CHEN Xiaoyuan, RAO Guiwei, et al. Effects of microwave-assisted enzymatic hydrolysis on antioxidant activity of turtle protein peptides[J]. Acta Food Sinica,2017,17(11):131−137.] WANG Nan, CHEN Xiaoyuan, RAO Guiwei, et al. Effects of microwave-assisted enzymatic hydrolysis on antioxidant activity of turtle protein peptides[J]. Acta Food Sinica, 2017, 17(11): 131−137.
[49] 施永清, 王巧巧, 吴丹丽, 等. 响应面试验优化双酶酶解法制备鱼鳞抗菌肽工艺及其抑菌性能分析[J]. 食品科学,2018,39(6):155−161. [SHI Yongqing, WANG Qiaoqiao, WU Danli, et al. Response surface test optimization of the preparation of antibacterial peptides from fish scale by enzymolysis with double enzymes and analysis of their antibacterial properties[J]. Food Science,2018,39(6):155−161.] doi: 10.7506/spkx1002-6630-201806025 SHI Yongqing, WANG Qiaoqiao, WU Danli, et al. Response surface test optimization of the preparation of antibacterial peptides from fish scale by enzymolysis with double enzymes and analysis of their antibacterial properties[J]. Food Science, 2018, 39(6): 155−161. doi: 10.7506/spkx1002-6630-201806025
[50] 李桂芬, 何定芬, 郑霖波, 等. 响应面法优化金枪鱼蛋白抗痛风活性肽制备工艺[J]. 浙江海洋大学学报(自然科学版),2020,39(1):41−50. [LI Guifen, HE Dingfen, ZHENG Linbo, et al. Optimization of preparation technology of tuna protein anti-gout active peptide by response surface method[J]. Journal of Zhejiang Ocean University (Natural Science Edition),2020,39(1):41−50.] LI Guifen, HE Dingfen, ZHENG Linbo, et al. Optimization of preparation technology of tuna protein anti-gout active peptide by response surface method[J]. Journal of Zhejiang Ocean University (Natural Science Edition), 2020, 39(1): 41−50.
[51] 高雅鑫, 杨森, 李雨恬, 等. Box-Behnken法优化双酶协同水解牡蛎蛋白工艺[J]. 食品工业科技,2018,39(10):117−121, 127. [GAO Yanxin, YANG Sen, LI Yutian, et al. Optimization of bienzyme synergistic hydrolysis of oyster protein by Box-Behnken method[J]. Science and Technology of Food Industry,2018,39(10):117−121, 127.] GAO Yanxin, YANG Sen, LI Yutian, et al. Optimization of bienzyme synergistic hydrolysis of oyster protein by Box-Behnken method[J]. Science and Technology of Food Industry, 2018, 39(10): 117−121, 127.
[52] 丁树慧, 王立梅, 齐斌, 等. 双酶分步水解低值海洋鱼粉制备低聚肽的研究[J]. 食品研究与开发,2017,38(24):42−47. [DING Shuhui, WANG Limei, QI Bin, et al. Preparation of oligopeptides from low-value marine fish meal by two-enzyme step hydrolysis[J]. Food Research and Development,2017,38(24):42−47.] DING Shuhui, WANG Limei, QI Bin, et al. Preparation of oligopeptides from low-value marine fish meal by two-enzyme step hydrolysis[J]. Food Research and Development, 2017, 38(24): 42−47.
[53] 王銮, 包怡红, 张宇, 等. 固态发酵法制备榛仁肽工艺优化及其生物活性[J]. 经济林研究,2018,36(1):131−136,140. [WANG Luan, BAO Yihong, ZHANG Yu, et al. Preparation of hazelnut peptide by solid fermentation and its biological activity[J]. Economic Forest Research,2018,36(1):131−136,140.] WANG Luan, BAO Yihong, ZHANG Yu, et al. Preparation of hazelnut peptide by solid fermentation and its biological activity[J]. Economic Forest Research, 2018, 36(1): 131−136,140.
[54] 王銮, 包怡红, 康宁. 混菌固态发酵榛仁粕制备降血压肽工艺优化研究[J]. 中国粮油学报,2018,33(12):35−41. [WANG Luan, BAO Yihong, KANG Ning. Optimization of preparation of blood pressure reducing peptide from hazelnut meal by solid-state fermentation with mixed bacteria[J]. Journal of Grain and Oils of China,2018,33(12):35−41.] WANG Luan, BAO Yihong, KANG Ning. Optimization of preparation of blood pressure reducing peptide from hazelnut meal by solid-state fermentation with mixed bacteria[J]. Journal of Grain and Oils of China, 2018, 33(12): 35−41.
[55] VENEGAS-ORTEGA M G, FLORES-GALLEGOS A C, MARTÍNEZ-HERNÁNDEZ J L, et al. Production of bioactive peptides from lactic acid bacteria:A sustainable approach for healthier foods[J]. Comprehensive Reviews in Food Science and Food Safety,2019,18(4):1039−1051. doi: 10.1111/1541-4337.12455
[56] 杨柳, 郑汉丰, 郭全友, 等. 枯草芽胞杆菌发酵制备南极磷虾肽及其体外抗氧化活性研究[J]. 食品与发酵工业,2022,48(14):84−92. [YANG Liu, ZHENG Hanfeng, GUO Quanyou, et al. Preparation of peptides from Krill Antarctic by Bacillus subtilis fermentation and its antioxidant activity in vitro[J]. Food and Fermentation Industry,2022,48(14):84−92.] YANG Liu, ZHENG Hanfeng, GUO Quanyou, et al. Preparation of peptides from Krill Antarctic by Bacillus subtilis fermentation and its antioxidant activity in vitro[J]. Food and Fermentation Industry, 2022, 48(14): 84−92.
[57] 邢瀚文, 韩玮, 施文正, 等. 固态发酵法制备罗非鱼皮胶原蛋白肽及其抗氧化活性研究[J]. 食品与发酵工业,2020,46(19):104−110. [XING Hanwen, HAN Wei, SHI Wenzheng, et al. Preparation of tilapia skin collagen peptide and its antioxidant activity by solid fermentation[J]. Food and Fermentation Industry,2020,46(19):104−110.] XING Hanwen, HAN Wei, SHI Wenzheng, et al. Preparation of tilapia skin collagen peptide and its antioxidant activity by solid fermentation[J]. Food and Fermentation Industry, 2020, 46(19): 104−110.
[58] 范吉釴, 柯义强, 刘红海, 等. 发酵法制备生物活性肽的研究进展[J]. 安徽农学通报,2020,26(23):19−23. [FAN Jiyi, KE Yiqiang, LIU Honghai, et al. Research progress on preparation of bioactive peptides by fermentation[J]. Anhui Agricultural Science Bulletin,2020,26(23):19−23.] doi: 10.3969/j.issn.1007-7731.2020.23.007 FAN Jiyi, KE Yiqiang, LIU Honghai, et al. Research progress on preparation of bioactive peptides by fermentation[J]. Anhui Agricultural Science Bulletin, 2020, 26(23): 19−23. doi: 10.3969/j.issn.1007-7731.2020.23.007
[59] LAFARGA T, ACIÉN-FERNÁNDEZ F G, GARCIA-VAQUERO M. Bioactive peptides and carbohydrates from seaweed for food applications:Natural occurrence, isolation, purification, and identification[J]. Algal Research,2020,48:101909. doi: 10.1016/j.algal.2020.101909
[60] 林海燕, 王珊珊, 马玉洁, 等. 南极磷虾肽-亚铁螯合物的制备及理化性质分析[J]. 食品研究与开发,2020,41(19):87−93. [LIN Haiyan, WANG Shanshan, MA Yujie, et al. Preparation and physicochemical properties of peptide-ferrous chelates from Krill Antarctic[J]. Food Research and Development,2020,41(19):87−93.] LIN Haiyan, WANG Shanshan, MA Yujie, et al. Preparation and physicochemical properties of peptide-ferrous chelates from Krill Antarctic[J]. Food Research and Development, 2020, 41(19): 87−93.
[61] CAI B, CHRN X, PAN J, et al. Optimization of preparation process for cod skin collagen peptide-iron (Ⅱ) chelate via response surface methodology[J]. Food Science,2012(33):48−52.
[62] 阚文翰. 高活性酪蛋白磷酸肽螯合锌的制备及表征[D]. 合肥:安徽农业大学, 2017. [KAN Wenhan. Preparation and characterization of zinc chelated with high activity casein phosphopeptide[D]. Hefei:Anhui Agricultural University, 2017.] KAN Wenhan. Preparation and characterization of zinc chelated with high activity casein phosphopeptide[D]. Hefei: Anhui Agricultural University, 2017.
[63] 于群. 超滤技术在蛋白质分离纯化中的应用研究[J]. 当代化工研究,2020(22):137−138. [YU Qun. Application of ultrafiltration technology in protein separation and purification[J]. Contemporary Chemical Industry Research,2020(22):137−138.] YU Qun. Application of ultrafiltration technology in protein separation and purification[J]. Contemporary Chemical Industry Research, 2020(22): 137−138.
[64] YANG X, YU X, YAGOUB A G, et al. Structure and stability of low molecular weight collagen peptide (prepared from white carp skin) -calcium complex[J]. LWT,2021,136:110335. doi: 10.1016/j.lwt.2020.110335
[65] SUDHAKAR S, NAZEER R A. Structural characterization of an Indian squid antioxidant peptide and its protective effect against cellular reactive oxygen species[J]. Journal of Functional Foods,2015,14:502−512. doi: 10.1016/j.jff.2015.02.028
[66] LIN S, HU X, LI L, et al. Preparation, purification and identification of iron-chelating peptides derived from tilapia (Oreochromis niloticus) skin collagen and characterization of the peptide-iron complexes[J]. LWT,2021,149:111796. doi: 10.1016/j.lwt.2021.111796
[67] HU G, WANG D, SUN L, et al. Isolation, purification and structure identification of a calcium-binding peptide from sheep bone protein hydrolysate[J]. Foods,2022,11(17):2655. doi: 10.3390/foods11172655
[68] ZHANG L, LIN Y, WANG S. Purification of algal calcium-chelating peptide and its physical chemical properties[J]. Journal of Aquatic Food Product Technology,2018,27(4):518−530. doi: 10.1080/10498850.2018.1449153
[69] 李争显, 李伟, JIAJUN L, 等. 常见金属元素对人体的作用及危害[J]. 中国材料进展,2020,39(12):934−944. [LI Zhengxian, LI Wei, JIAJUN L, et al. Effects and hazards of common metal elements on human body[J]. Progress in Materials in China,2020,39(12):934−944.] LI Zhengxian, LI Wei, JIAJUN L, et al. Effects and hazards of common metal elements on human body[J]. Progress in Materials in China, 2020, 39(12): 934−944.
[70] 李亚妮, 马丽艳, 黄昆仑, 等. 膳食来源中硒的生物利用率的研究进展[J]. 中国食物与营养,2019,25(9):5−9. [LI Yani, MA Liyan, HUANG Kunlun, et al. Research progress on the bioavailability of selenium from dietary sources[J]. Food and Nutrition of China,2019,25(9):5−9.] LI Yani, MA Liyan, HUANG Kunlun, et al. Research progress on the bioavailability of selenium from dietary sources[J]. Food and Nutrition of China, 2019, 25(9): 5−9.
[71] 袁宁, 林慧敏, 邓尚贵, 等. 带鱼蛋白亚铁螯合肽抗贫血活性及安全性评价[J]. 现代食品科技,2016,32(11):274−279. [YUAN Ning, LIN Huimin, DENG Shanggui, et al. Antianaemic activity and safety evaluation of protein ferrous chelate peptides of hairtail fish[J]. Modern Food Science and Technology,2016,32(11):274−279.] YUAN Ning, LIN Huimin, DENG Shanggui, et al. Antianaemic activity and safety evaluation of protein ferrous chelate peptides of hairtail fish[J]. Modern Food Science and Technology, 2016, 32(11): 274−279.
[72] HUA P, XIONG Y, YU Z, et al. Effect of Chlorella pyrenoidosa protein hydrolysate-calcium chelate on calcium absorption metabolism and gut microbiota composition in low-calcium diet-fed rats[J]. Marine Drugs,2019,17(6):348. doi: 10.3390/md17060348
[73] FAN C, WANG X, SONG X, et al. Identification of a novel walnut iron chelating peptide with potential high antioxidant activity and analysis of its possible binding sites[J]. Foods,2023,12(1):226. doi: 10.3390/foods12010226
[74] FANG Z, XU L, LIN Y, et al. The preservative potential of Octopus scraps peptides-zinc chelate against Staphylococcus aureus:Its fabrication, antibacterial activity and action mode[J]. Food Control,2019,98:24−33. doi: 10.1016/j.foodcont.2018.11.015
[75] 王梦娅, 陈媛媛, 钱文举, 等. 大竹蛏源多肽与钙螯合物的制备工艺及生物活性研究[J]. 湖北农业科学,2017,56(8):1530−1533, 1540. [WANG Mengya, CHEN Yuanyuan, QIAN Wenju, et al. Preparation and bioactivity of polypeptide and calcium chelate from razor clam[J]. Hubei Agricultural Sciences,2017,56(8):1530−1533, 1540.] WANG Mengya, CHEN Yuanyuan, QIAN Wenju, et al. Preparation and bioactivity of polypeptide and calcium chelate from razor clam[J]. Hubei Agricultural Sciences, 2017, 56(8): 1530−1533, 1540.
[76] WANG Jingyu, ZHANG Yehui, ZHANG Yousheng, et al. The effect of different structure of chelated peptides of Channa argus on antioxidant activity[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(10):93−99.
[77] 林慧敏, 张宾, 邓尚贵, 等. 舟山海域4种低值鱼酶解蛋白亚铁螯合物自由基清除活性与抑菌活性研究[J]. 中国食品学报,2012,12(1):19−24. [LIN Huimin, ZANG Bin, DENG Shanggui, et al. Study on free radical scavenging activity and bacteriostatic activity of ferrous chelate of four low-value fish enzymolytic proteins in Zhoushan Sea area[J]. Chinese Journal of Food Science,2012,12(1):19−24.] LIN Huimin, ZANG Bin, DENG Shanggui, et al. Study on free radical scavenging activity and bacteriostatic activity of ferrous chelate of four low-value fish enzymolytic proteins in Zhoushan Sea area[J]. Chinese Journal of Food Science, 2012, 12(1): 19−24.
[78] YANG Jie, ZHAO Honglei, XU Shufen, et al. Antioxidant and zinc supplementation effect of zinc chelating small peptides from fish protein in mice[J]. Journal of Huazhong Agricultural University,2011,30(4):516−520.





 下载:
下载:
 下载:
下载:



