Recent Advances of Stability and Stabilization Technology of Natural Astaxanthin
-
摘要: 虾青素是自然界中最强的抗氧化物质,同时兼有抗炎、抗肿瘤、调节免疫力等生理功能,在食品、药品和化妆品领域都有广泛的应用。但是,天然虾青素不稳定,在提取和储存及加工过程中容易降解。因此,提高虾青素的稳定性是当前该领域的研究热点之一。本文从虾青素自身结构、提取溶剂以及加工和储藏环境三个方面介绍了影响虾青素稳定性的因素和机理,并对比了现有的虾青素稳态化体系,如乳液、微胶囊、脂质体及纳米颗粒和纳米分散体的基本原理、效果及优缺点。多种虾青素稳态化体系能够不同程度地提高其水溶性、稳定性和生物利用度,但普遍存在工艺复杂、成本高等缺点。未来研究应聚焦各类稳态化技术的基础理论,借助分子模拟技术推动虾青素稳态化体系向更加高效、绿色和智能发展。Abstract: Natural astaxanthin is the strongest antioxidant in nature, and shows many physiological functions such as anti-inflammatory, anti-tumor and immune regulation. Astaxanthin has been widely used in the fields of food, medicine and cosmetics. However, natural astaxanthin is unstable and easily degraded during extraction, storage and processing. Therefore, many studies have focused on improving the stability of astaxanthin. In this paper, the factors and mechanisms affecting the stability of astaxanthin are introduced from three aspects: The astaxanthin structure, extraction solvent and the processing and storage environment. The basic principles, effects, advantages and disadvantages of existing astaxanthin stabilization systems, such as emulsions, microcapsules, liposomes, nanoparticles and nanodispersions are compared. The water solubility, stability and bioavailability of astaxanthin can be enhanced to varying degrees, while there are generally shortcomings of complex process and high cost. Future research should focus on the basic theory of various stabilization technologies, and promote the development of astaxanthin stabilization systems to be more efficient, green and intelligent with the help of molecular simulation technology.
-
Keywords:
- astaxanthin /
- stability /
- stabilization technology /
- research progress
-
色素在人类历史上有着几千年的应用历史,色素的开发、使用以及安全性一直是全球广泛关注的焦点和科学研究的热点。色素可分为天然色素和人工合成色素。天然色素是来源于自然界中带颜色的物质的总称,主要来自于植物的花、叶、果实和种子,还有少部分来源于昆虫和微生物[1]。人工合成色素是指采用人工化学合成方法所获得的有机色素。与天然色素相比,人工合成色素可表现出不同程度的毒性:一般毒性、遗传毒性、致癌性及联合毒性[2]。人们对健康的高度关注以及日益严格的食品药品法规促使从自然资源中获取天然色素成为广泛需求。
虾青素作为类胡萝卜素家族的重要一员,不仅是天然物质中最强的抗氧化物质[3],同时具有抗炎[4]、抗癌[5]、预防心血管疾病[6]、减缓衰老[7]、改善机体运动机能[8]等重要生理活性。因此,虾青素在保健品、食品、药品、化妆品和饲料等市场有良好的应用前景[9]。2010年,我国第17号公告批准雨生红球藻为新资源食品,雨生红球藻来源的虾青素被允许添加到除婴幼儿食品的各类食品饮料中[10]。据Global Market Insights市场数据显示,预计到2024年全球虾青素市场规模将达8亿美元,其中北美市场年复合增长率将超过3.5%,亚太地区将成为市场增长的主要贡献地区(超2.5亿美元)[11]。然而,天然虾青素结构不稳定,易降解,导致其生物活性和生理功能降低,从而限制其应用。因此,提高天然虾青素的稳定性是当前的研究热点之一,目前已有许多虾青素递送系统的相关报道。但该领域处于起步阶段,往往忽略了虾青素提取和加工储藏过程中稳定性的变化规律,缺乏综合的基础数据和系统性分析。只有全面了解影响天然虾青素稳定性的因素及本质规律,才能更好开发和完善稳态化技术。
本文综述了天然虾青素自身结构、提取溶剂以及加工和储藏环境条件对稳定性的影响规律及原因,归纳并比较了乳液、微胶囊、脂质体及纳米封装技术对天然虾青素的保护效果、技术特点和稳态化基本原理,最后基于现有虾青素稳态化技术提出几点展望,为虾青素的保护和递送提供一定的参考价值。
1. 虾青素的概况
虾青素(astaxanthin),又名变胞藻黄素、虾红素、虾黄素、虾黄质和龙虾壳色素[12],是目前发现的具有最强抗氧化活性的物质,其抗氧化能力远远高于维生素 E、β-胡萝卜素、番茄红素等现有的天然抗氧化剂,被称为“超级维生素E”[13−14]。
1.1 虾青素的化学结构
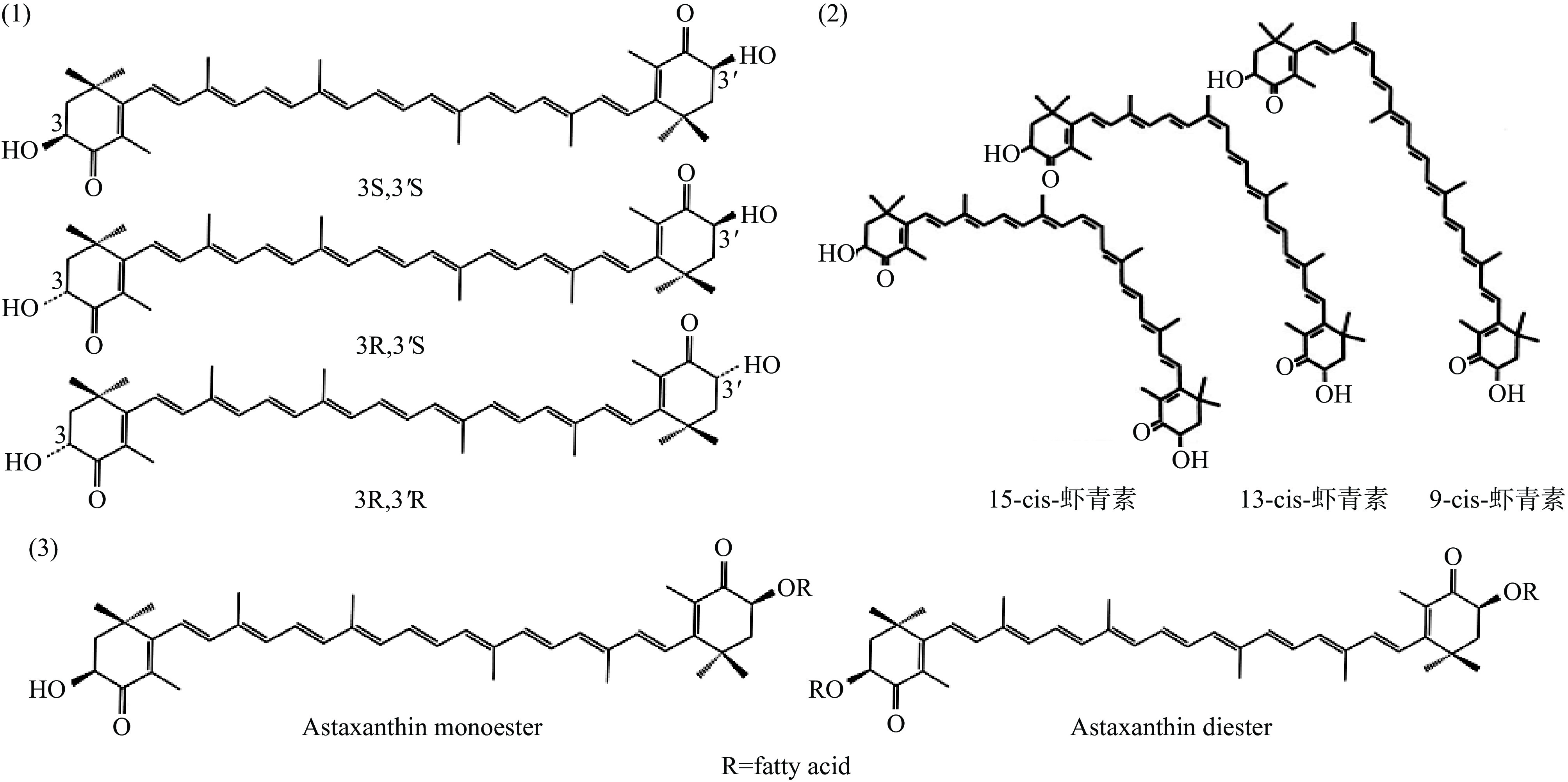
虾青素共轭双键链两端的手性碳原子C-3和C-3'分别以R或S的形式存在,分别产生3种立体异构体(如图1(1)所示),即全顺式(3S,3'S)、顺-反式(3S,3'R)和全反式(3R,3'R),其中(3S,3'S)和(3R,3'R)异构体为镜像(对映体)[15]。多个共轭双键和末端含有的不饱和酮基使虾青素具有活泼的电子效应,能吸引自由基未配对电子或向自由基提供电子,从而清除自由基,同时能够通过物理方式淬灭单线态氧。
虾青素在其分子的线型部分有多个双键,每个双键都可以是Z式(顺式)或E式(反式),全 E结构是最稳定的结构,因为分支基团不竞争空间位置[16]。现已发现,天然虾青素中9、13和15位有Z式结构,因此虾青素可能的几何异构体有全E,(9Z),(13Z),(15Z)等(如图1(2)所示)。同时,虾青素在其末端环状结构中各有一个羟基,这种自由羟基可与脂肪酸形成酯。一个羟基与脂肪酸成酯,称虾青素单酯,两个则称为双酯(如图1(3)所示)。酯化后,其疏水性及稳定性增强[16−17]。可见,天然虾青素形态多样,不同分子结构决定了虾青素之间稳定性存在差异。
1.2 虾青素的来源
目前,虾青素的生产主要有化学合成、生物合成和天然提取三种方式。化学合成分为全合成和半合成法:全合成法是以化工原料为原材料,通过化学合成反应生成;而半合成法是利于角黄质、叶黄素和玉米黄质等类胡萝卜素作为原料制备虾青素[18]。此法需要多步化学反应和生物催化反应,且合成的虾青素是多种构型的混合物,并含有副产物,合成过程存在较大安全风险[19]。生物合成法是利用酵母、藻类和细菌生产虾青素的方法。此法生成的虾青素结构明确(多为反式结构)、副产物少,但产率低、培养条件严格,实现大规模生产的关键在于使用廉价培养原料以及选育优质高产菌种[20]。目前从天然资源中提取虾青素成本较低、可规模化生产,能够缓解市场对虾青素的需求。主要从雨生红球藻、红发夫酵母和虾蟹甲壳等资源中采用植物油[21]、有机溶剂[22]、离子液体[23]和低共熔溶剂[24]等提取虾青素。天然虾青素在稳定性、抗氧化活性、生物吸收效果及安全性等方面普遍优于合成的虾青素[25−27]。
2. 天然虾青素的稳定性及影响因素
天然虾青素具有优良的功能特性,对开发相应的功能产品具有重要价值。然而,在实际应用中,首要面对的挑战是虾青素的不稳定。首先,虾青素的共轭双键使其具有活泼的化学性质。其次,不同溶剂的极性差异会影响溶解度和稳定性。最后,虾青素在加工及储藏等过程中易受光照、温度等影响而发生降解。许多研究对虾青素稳定性的分析只关注了其中的某一个方面,却忽略了多重因素的影响。本文将从虾青素自身结构、提取溶剂和加工及储藏环境三个角度综合分析天然虾青素的稳定性影响因素及变化规律。
2.1 虾青素自身结构
与叶黄素、维生素C、β-胡萝卜素等相比,共轭双键、羟基和酮基的存在使虾青素兼具亲水性和疏水性,也使其更容易与自由基反应,结构发生变化[28]。另一方面,大多数天然虾青素以酯化形式存在,含有各种脂肪酸,包括C16:0、硬脂酸(C18:0)、C18:1、亚油酸(C18:2)和γ-亚麻酸(C18:3)[29]。研究表明,酯化虾青素比游离虾青素更稳定,例如,在含有DL-薄荷醇:辛酸的微乳液中,游离虾青素的半衰期为13.86 d,而虾青素酯半衰期为69.31 d[17]。而且稳定性与酯化程度呈正相关。此外,碳链长度的增加和脂肪酸不饱和度的降低有利于提高虾青素酯的稳定性,其中虾青素二十二碳六烯酸二酯是虾青素酯中最稳定的形式[16]。
因此,在食品、医药和化妆品的生产加工中应当注意区分不同结构的虾青素,明确其自身结构对稳定性的影响,针对性的采取保护措施,有效延长产品的货架期,促进虾青素的高效利用。
2.2 提取溶剂
溶剂与虾青素分子间的相互作用对其稳定性有直接作用,而且不同的提取条件(温度、时间等)对提取过程中虾青素的结构都有重要影响,但以往的许多研究中忽略了溶剂性质本身对虾青素的影响。虾青素,不溶于水,具有脂溶性,易溶于氯仿、丙酮、苯等有机溶剂[22]和植物油、鱼油等[21]。植物油提取的效果差且需要高温,虾青素易降解[30];有机溶剂虽然提取率高,但有机溶剂的极性很强,不利于保持虾青素结构的稳定[31]。因此理想的萃取技术应当兼具高萃取率和虾青素稳定性两大功能。研究证明,咪唑基离子液体(Ionic liquids,ILs),例如1-丁基-3-甲基咪唑氯([BMIM][Cl])、1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6])等提取类胡萝卜素的半衰期比丙酮高,说明ILs提取的类胡萝卜素比丙酮提取的稳定更好[23]。前期研究证明,疏水性季铵类和季膦类离子液体比咪唑类离子液体对虾青素溶解性更强,而且虾青素在三丁基氯化磷([P4448]Cl)中浓度变化与色差参数呈现良好的数学关系[32]。但是,ILs价格昂贵和生物相容性较差等缺点限制了其被广泛用于商业提取虾青素。
低共熔溶剂(Deep eutectic solvent,DES)是一种新兴绿色溶剂,是氢键受体(HBA)和氢键供体(HBD)的共晶混合物。研究表明,虾青素在低共熔溶剂微乳液中比在有机溶剂(乙醇、甲醇和丙酮)中表现出更好的稳定性[17]。此外用DES萃取的虾青素比用有机溶剂萃取的抗氧化活性要高[33],且酸性DES更有利于虾青素的溶解[34]。因此,DES是有机溶剂和离子液体的良好代替溶剂。综上,对于虾青素萃取溶剂的选择要从成本、环保、安全、溶解度和稳定性等多个方面综合考量。
2.3 加工及储藏环境条件
2.3.1 光照
光对虾青素有两种作用效应:a.形成顺反双键电磁波谱向蓝端漂移2~10 nm;b.加速虾青素的氧化,载色体降解断裂,光谱向紫外区漂移,并失去颜色[35]。将虾青素提取液分别置于避光、室内自然光、紫外光和日光连续照射条件下, 6 h后日光照射的虾青素保留率仅为0.57%,而避光样品则无明显变化[36]。与之类似,毛丽哈·艾合买提等[37]指出,紫外光会破坏虾青素的稳定性。因此,虾青素对日光和紫外光都十分敏感,在提取、储藏和使用等过程中应注意避光。
2.3.2 温度
高温对大部分生物活性物质都具有显著的破坏作用,虾青素应低温储藏以减缓其降解。多项研究表明,虾青素提取液的稳定性随温度升高而下降。例如,在4 ℃贮存的虾青素提取液的吸光值保持不变,而70 ℃下贮存6 h后虾青素残存率仅为30%左右[36]。类似的,将虾青素油在60 ℃以下储藏1 h后,虾青素的损失率不到2%,而当储藏温度达到80 ℃以上时,损失率超过20%[38]。
2.3.3 pH
环境酸碱性会不同程度地影响虾青素的溶解及稳定性。弱碱性环境对虾青素稳定性的影响不大,但长期弱酸环境会破坏稳定性[39]。此外,虾青素酯在弱碱环境下会发生皂化反应转化为游离虾青素[37]。虽然虾青素的溶解度和抗氧化活性在酸性条件下都显著提高,但过酸会影响虾青素的稳定性[32]。因此,在虾青素储藏过程中保持溶液呈现中性或弱碱性将有利于维持虾青素结构和功能的稳定。
2.3.4 金属离子
金属离子会促进虾青素的氧化,使其溶解褪色,甚至出现浑浊。宋素梅等[40]研究发现,Fe2+、Fe3+、Cu2+会使虾青素的保留率发生明显下降。不仅如此,Fe2+、Cu2+、K+的加入会使虾青素提取液出现浑浊[36]。因此,在虾青素的生产和运输过程中,应尽量避免铁器和含Fe2+和Cu2+物质的添加。
2.3.5 氧
氧会与虾青素发生自动氧化、光敏氧化和化学氧化等。当虾青素暴露在空气中室温25 ℃避光保存30 d后,游离虾青素的保留率仅为20%,而微胶囊化虾青素可达80%[41]。这可能是因为空气中的氧与虾青素发生氧化反应,使虾青素发生分解。有研究试图采用添加抗氧化剂来提高虾青素的稳定性,但是发现添加抗氧化剂2,6二叔丁基对甲酚(BHT)不会提高虾青素的稳定性,而且VC和Na2SO3这两种抗氧化剂反而会使虾青素稳定性降低[36]。这可能是由于虾青素的抗氧化性能远高于 VC、Na2SO3, 虾青素为保护 VC和Na2SO3 不受氧化而自身发生氧化。
3. 天然虾青素的稳态化技术
天然虾青素虽然具有较强的抗氧化性能,但它存在高度不饱和结构,使其暴露于高温、光照等条件下时,有化学降解的倾向,会导致其褪色和生物活性的衰退,同时限制了它在食品、医药、化妆品领域的应用。为了提高虾青素在应用领域的利用率,人们研究了不同的稳态化技术,包括乳液封装技术、微胶囊化技术、脂质体和纳米级别的封装技术等。因此,下文将介绍以上各种技术用来包埋虾青素的过程以及包埋后虾青素的稳定性,同时对比不同稳态化技术的稳态效果及优缺点。
3.1 乳液运载体系
运载虾青素的乳液体系是将虾青素溶于有机相中,然后将该有机相充分分散于含有乳化剂的水相体系中,并在一定的外力作用下(如搅拌、均质、超声波等)形成胶体体系[42]。除了传统乳液,近年来逐渐兴起的纳米乳液、微乳液、Pickering乳液和多层乳液,这些乳液制备技术、成分的更新迭代以及功能的多样性都促进了虾青素稳态化技术迅速发展(如表1所示)。
表 1 运载虾青素的乳液体系Table 1. Astaxanthin-loaded emulsion system乳液类型 乳化剂 制备方法 储藏条件 虾青素的稳定性 参考文献 乳液 乳清分离蛋白、吐温20 重复预混膜乳化法 常温储藏3周 虾青素降解30% [57] 乳清蛋白和黄原胶 高压均质法 在5~37 ℃储藏15 d 虾青素降解10%~12% [43] 纳米乳液 甘油酯和氢化卵磷脂 高压均质法 光热条件下储藏1个月 Zeta电位<−41 mV [58] 聚山梨酸20、酪蛋白酸钠、
阿拉伯胶溶剂扩散法 25 ℃储藏8周 虾青素降解20% [48] 微乳液 大豆卵磷脂 高压均质法 4 ℃避光储藏1周 虾青素降解14.66% [46] 吐温80 高压均质法 37 ℃荧光照射下储存20 d 平均粒径<100 nm [59 Pickering乳液 羽扇豆蛋白聚集物和麦芽糊精 高压均质法 25 ℃储藏4周 虾青素降解11.9% [52] 多层乳液 壳聚糖和果胶 − 37 ℃下储藏15 d 色差参数(a*和b*)下降缓慢 [56] 乳清蛋白和波斯胶 高压均质法 60 ℃下储藏15 d 虾青素降解10% [60] 3.1.1 传统乳液
传统乳液也称为常规乳液或巨型乳液,指液滴半径在300 nm~100 μm之间的粗分散体系,随时间的推移有破乳的趋势。以往蛋白质和多糖乳化剂的结合具有良好稳定作用,但在紫外线或热处理下倾向于降解包埋在其中的物质[43]。最新研究发现,酪蛋白-咖啡酸-葡萄糖稳定的乳状液因含有多酚类物质(咖啡酸)而有利于保护内部虾青素对抗不利环境[44]。但传统乳液本身动力学不稳定,如何进一步保持乳液本身的稳定性一直是该领域的难题。
3.1.2 纳米乳液
纳米乳液一般由水、油和表面活性剂组成,通过高压均质法可以达到较小的粒径(50~200 nm)而且动力学稳定,相比传统乳液可以更好地提高活性物质的稳定性和生物利用度[45]。乳化剂的选择及复合乳化剂的使用是制备性质优良的纳米乳液的关键。
将以大豆卵磷脂为乳化剂制备的运载虾青素纳米乳液与游离虾青素在同样条件放置一周,前者的虾青素的保留率为85.34%,远大于后者的54.92%[46]。此外,小分子乳化剂、蛋白质和多糖的混合物被证明可大大提高所制备乳液的特性[47]。比如,使用复合乳化剂(聚山梨酸20、酪蛋白酸钠、阿拉伯胶)制备虾青素纳米乳液,在25 ℃保存8周后,虾青素的降解率仅为20%[48]。但是,高压均质易使体系中敏感化合物结构发生变化,生物活性降低且热力学不稳定,这些问题仍需进一步解决。
3.1.3 微乳液
与纳米乳液相比,微乳液的粒径较小(10~100 nm之间)且呈透明状,在表面活性剂的作用下能够自发形成,属于热力学稳定的体系[49]。微乳液具有良好特性,包括优良的稳定性、低粘度和强增溶亲脂性化合物的能力,是一种兼顾溶解度和稳定性的虾青素萃取溶剂。近年来,离子液体基微乳液[50]和低共熔溶剂基微乳液[17]在虾青素的提取及稳定性方面表现出良好的效果。与有机溶剂相比,微乳液能提高虾青素的溶解性,而且游离虾青素和虾青素酯在低共熔溶剂基微乳液中表现出来的贮藏稳定性比在有机溶剂中更好[17]。
3.1.4 Pickering乳液
传统的表面活性剂(如多糖和蛋白质)稳定的乳液,通常热力学不稳定,随着时间的推移,发生絮凝、聚结和奥斯特瓦尔德成熟而分解。而Pickering乳液通过胶体颗粒提高自身的稳定性[51]。常见的胶体颗粒有蛋白基颗粒(如羽扇豆蛋白颗粒[52])或多糖-蛋白基颗粒(如醇溶蛋白和海藻酸钠[53])。同时 Pickering乳液运载的虾青素对热、高温或金属离子的耐受力比游离虾青素更强[54]。
3.1.5 多层乳液
“多层乳液”是一种包埋虾青素的新兴技术,它由许多生物聚合物层(或乳化剂)包裹脂滴组成,这些脂滴通过吸引的静电相互作用沉积在彼此上组成[55]。研究表明,在贮藏过程中,壳聚糖-果胶多层乳液中虾青素的降解速度要比在传统乳液中慢3~4倍[56]。但是,多层乳液技术也面临挑战,首先要设计出合理的系统组成,其次优化影响稳定性的多种因素(如生物聚合物类型、液滴浓度、离子强度等)。
无论是常规乳液还是近年来逐渐兴起的纳米乳液、微乳液、Pickering乳液和多层乳液,自身性质的不稳定极大地限制了其作为虾青素等生物活性物质封装及运载体系的应用,目前该领域的研究重点主要集中在提高乳液本身的稳定性。相比而言,微乳液、Pickering乳液和多层乳液因含有两亲性的物质,乳液稳定性显著提高。但是进一步提高虾青素的提取率、封装效果以及储藏稳定性的探索还十分缺乏,需要在乳液组成方面加强理论研究。
3.2 微胶囊化运载体系
3.2.1 基本方法
将虾青素包覆于壁材基质(液体/固体、均匀/非均匀材质等)中,可以保护虾青素免受外界干扰[61]。常见方法包括喷雾干燥法[62]、冷冻干燥法[63]和复凝聚法[64]等。表2列举了这几种虾青素微胶囊包埋技术的工艺参数、包埋效果、稳态效果等。喷雾干燥法快速、简单、经济,但干燥温度过高会损害芯材[62]。相比而言,冷冻干燥法的低温冻结状态能有效保护内部的虾青素,但耗时长,运行成本高[63]。复凝聚法虽不需要有机溶剂和高温,适用于食品领域,但此法的包封率普遍偏低[65]。因此,明确各法的原理、使用条件、工艺参数及优缺点对制备良好性能的虾青素微胶囊具有重要意义。
表 2 包埋虾青素的微胶囊体系Table 2. Astaxanthin-loaded microencapsulation system壁材类别 壁材名称 壁材
配比芯壁
材比乳化剂 制备方法 包埋率
(%)储藏条件 虾青素稳定性 参考
文献蛋白质类/
碳水类明胶/麦芽糊精 2:1 1:6 单硬脂酸甘油酯/
蔗糖脂肪酸酯喷雾干燥法 38.02 26 ℃避光
储存10 d虾青素保留率:43.98%(微胶囊)>
24.02%(虾青素油树脂)[70] 玉米醇溶蛋白/
低聚壳寡糖1:1 − − 复凝聚法+
冷冻干燥94.34 紫外光照射
9.5 h虾青素保留率:82.4%(微胶囊)
>60%(游离)[69] 酪蛋白酸钠/
乳糖1:1 1:2 − 喷雾干燥法 86.06 5、25、40 ℃
储藏26 d虾青素浓度各自从13.76 μg/g下降至
10.16、8.28 和6.48 μg/g[71] 蛋白质类/
亲水胶类明胶/腰果胶 1:2.5 − − 复凝聚法 59.9 36 ℃储藏43 d 虾青素保留率:47%(微胶囊)
>9%(游离)[72] 碳水类/
碳水类蔗糖/麦芽
糊精/纯胶1:1:1 − 吐温20/蔗糖酯/
司班60喷雾干燥法 30.60 30 ℃储藏8 d 虾青素残留率:80%(微胶囊)
>2%(游离)[73] 纯胶/麦芽糊精 1:1 − 吐温20/蔗糖酯/
司班60喷雾干燥法 17.10 常温光照条件下
储藏8 d虾青素残留率:80%(微胶囊)
>4%(游离)[74] 麦芽糊精/羟丙
基-β-环糊精1:2.9 − 聚山梨酯-80 喷雾干燥法 98.77 室温25 ℃密封,自然光
条件下储藏30 d虾青素保留率:85%(微胶囊)
>45%(游离)[41] 油脂类/
碳水类β-环糊精/蔗糖
脂肪酸酯1:1 − − 冷冻干燥法 86.90 25 ℃避光条件
下储藏虾青素损失13.1% [63] 鱼卵磷脂/
麦芽糊精− − − 喷雾干燥法 90.12 − 微观结构、红外光谱以及热稳定性表明
微胶囊虾青素稳定性更高[75] 3.2.2 常见壁材
壁材的组成和选择对微胶囊性质至关重要,同时也是获得高效率和性能优越的微胶囊产品的条件。理想的壁材应当具备:高浓低粘(高浓度时具有良好的流动性)、优越的乳化性能、易干燥和脱溶以及价格低廉等优点[66−67]。常见壁材包括碳水化合物类(蔗糖、麦芽糊精、玉米纤维)、亲水胶类(阿拉伯胶和腰果胶)、蛋白质类(乳清蛋白和明胶)和油脂类(蔗糖脂肪酸酯、卵磷脂)。
实际应用过程中通常将几种壁材混合使用,例如蛋白质和碳水化合物的复配、蛋白质和亲水胶类的复配等。壁材复配的种类及比例是微胶囊包埋的过程中形成稳定体系的关键因素,但需根据应用要求合理复配。
a.碳水化合物之间的复配以及与蛋白质或亲水胶类的复配。碳水化合物虽具有低黏度和很好的溶解性,但由于其高孔隙率和低乳化能力,常与蛋白质或者胶体复配达到高致密性效果[68−69]。比如,玉米醇溶蛋白和低聚壳寡糖(OCH)以1:1的比例作为壁材制备的虾青素微胶囊,不仅包封率高(94.34%±0.64%),而且能抵御紫外光的照射,虾青素保留率为82.4%,远大于游离虾青素的60%[69]。此外,添加乳化剂可显著改善虾青素稳定性和包封效率[41]。
b.蛋白质和亲水胶类的复配。蛋白质虽然具有良好的乳化性能,但蛋白颗粒易聚集且易被蛋白酶水解。但亲水胶体能改善蛋白质的表面活性及黏度,增强壁材的稳定性。例如,用乳清蛋白和阿拉伯胶作为壁材包埋虾青素酯制备的微胶囊被发现对强酸(pH4)环境有良好的抗性[64]。
c.油脂类与碳水化合物的复配。研究表明,以β-环糊精和蔗糖脂肪酸酯(配比1:1)作为壁材包埋的虾青素在不同温度下的稳定性比游离虾青素更好[63]。可能的原因是蔗糖脂肪酸酯等油脂类物质能促进β-环糊精结晶化,在分子表面形成致密网状结构,稳定内部的虾青素。
虽然虾青素微胶囊通过几种壁材的复配能够达到良好的稳态效果和封装效率,但是壁材之间的相互作用以及微观分子结构尚不清晰,需要加强分子水平的深入研究,才能为封装虾青素的微胶囊的精准设计提供理论依据。
3.3 脂质体运载体系
脂质体是由同心磷脂双分子层分散在水相中,经自聚集形成的超微球状多孔粒子,具有内外层亲水,中间带有疏水层的囊泡结构[76]。它不仅可以在水核内包封极性物质,也可在磷脂形成的非极性区域包封非极性物质。通常脂质体的制备方法有溶剂注入法[77]、反相蒸发法[78]、薄膜分散法[76]、薄膜超声法[79]等。
如表3所示,以磷脂酰胆碱为原料制备的虾青素脂质体,包封率达到97.68%,且表现出良好的贮藏稳定性[80]。但是常规脂质体会有缺陷,如易氧化、易聚集。因此脂质体的表面修饰是提高稳定性和封装效率的因素。各种多糖(如壳聚糖[81])、蛋白质(如乳铁蛋白)已被用作膜表面改性剂。Wu等[82]研究指出,脂质体包封虾青素比游离虾青素的保留率提高10%,同时磷脂酰胆碱半乳糖和磷脂酰胆碱新琼脂糖等改性脂质体与原始的磷脂酰胆碱脂质体相比,虾青素的封装效率及抗氧化活性更高,修饰磷脂的极性头存在的大量羟基有助于在膜表面形成氢键提高稳定性。
表 3 运载虾青素的脂质体体系Table 3. Astaxanthin-loaded liposome system原料 制备方法 包封率(%) 理化指标 储藏条件 虾青素稳定性 参考
文献粒径(nm) 平均PDI值 平均Zeta
电位(mV)磷脂酰胆碱 薄膜超声法 97.68 80.62 0.20 −31.80 4 ℃和25 ℃避光储藏 虾青素保留率分别为82.29%和
61.32%[80] 磷脂、胆固醇 乙醇注入法 35.28 143.2 − − 50 ℃水浴加热3 h 虾青素脂质体降解3.36% [83] 卵磷脂、胆固醇 薄膜超声法 − 191 0.47 −34.0 4 ℃避光保存2、4、6、8 d t1/2 :游离虾青素<
虾青素脂质体[81] 磷脂酰胆碱/磷脂酰
半乳糖/磷脂酰琼脂糖薄膜超声法 72.6/85.72/88.93 − − − 35 ℃放置30 min 虾青素保留率:60%(游离)<
70%(脂质体)[82] 除单一脂质体外,复合脂质体的制备也是近年来的研究热点。脂质体的双层囊泡结构能将虾青素和细菌素分别包埋在脂层和水层中,且互不影响,是同时具有抗氧化和防腐作用的物质[78]。制备脂质体所需的辅料与设备所需的成本都相对较高,而且高剂量脂质体可能会产生高毒性。目前脂质体稳定虾青素的安全性评价的相关研究还很缺乏。
3.4 纳米级别的运载体系
除了纳米脂质体和纳米乳液外,还有纳米颗粒和纳米分散体等封装虾青素的技术。
3.4.1 纳米颗粒
纳米颗粒通常由天然聚合物组装,比如,蛋白质、多糖和合成聚合物等[39]。它是一种具有特殊物理性质(如均匀性、强渗透性等)的理想载体,可以用于包裹活性物质,减少外界影响,并在接受特定刺激后实现靶向释放[84−85]。纳米颗粒载体的选择会对稳定虾青素发挥不同的效果。例如,当包裹于多糖-蛋白质(海藻酸盐和壳聚糖)制备的聚合物纳米颗粒时,虾青素的水溶性、稳定性及生物活性都显著增强[86−87]。如表4所示,纳米颗粒包裹虾青素已经被证明可改善其稳定性。但纳米颗粒潜在的毒性会对人体健康和环境造成影响[88]。
表 4 运载虾青素的纳米颗粒和纳米分散体体系Table 4. Astaxanthin-loaded nanoparticles and nanodispersions system方法 载体或乳化剂名称 制备方法 包封率(%) 理化指标 储藏条件 虾青素稳定性 参考
文献平均粒径
(nm)平均
PDI值平均Zeta
电位(mV)纳米颗粒(NPs) 乳清蛋白 乳化-溶剂
蒸发法96.0 80~130 − −20~−30 常温紫外光
照射2 h虾青素保留率:70.5%(NPs)>
4.1%(游离)[94] 壳寡糖和聚乙烯乳酸-羟基乙酸共聚物(PLGA) 反溶剂沉淀法+静电沉积法 PLGA
(50:50):85.8 PLGA
(75:25):93.5PLGA
(50:50):500
PLGA
(75:25):600− − 室温避光
储存72 h虾青素纳米颗粒沉淀速率小于
游离虾青素[95] 乳清蛋白与阿拉伯胶 复合凝聚法 92.93 265.71±0.55 − −13.44 4 ℃储存
15 d虾青素保留率高达
90.78%[96] 薏米醇溶蛋白与
阿拉伯胶反溶剂沉淀法 55.07 163.43 0.12 −18.20 − 添加阿拉伯胶后明显增加pH
和盐离子稳定性[88] 低聚壳聚糖与海藻酸盐 油水乳化+
离子凝胶法71.3 264 − −22.1 紫外光
照射2 h虾青素保留率:90%(NPs)>18%
(游离)[86] 玉米蛋白、豌豆蛋白和果胶 共组装 94.22 100~200 0.25~0.30 −30~-50 − 虾青素NPs在不同pH、光和温度的保留率
提高[97] 纳米分散体 乳化剂(吐温20、酪蛋白酸钠和阿拉伯树胶) 乳化-蒸发技术 − 86.51 0.354 − 4 ℃储存3周 平均粒径无明显变化/虾青素降解27.7% [93] 乳化剂(聚山梨酸酯20、酪蛋白酸钠和阿拉
伯树胶)乳化-扩散技术 − 98.30 0.348 − 紫外光照射 三组分复合稳定剂比单组分具有更高的稳定性 [92] 3.4.2 纳米分散体
纳米分散体是将纳米颗粒稳定分散于分散介质中形成的胶体体系[89]。纳米分散体中的虾青素是通过乳化剂稳定的,设计的关键在于优化乳化剂类型及用量[90]。例如,采用明胶和其他活性物质组合使用时可改善稳定效果,其中明胶与酪蛋白酸钠复合作为乳化剂的纳米分散体表现出最低的虾青素降解率[90],原因可能是酪蛋白酸钠结构上存在半胱氨酸残基、二硫键等官能团,可清除自由基,防止脂质氧化[91]。适当的乳化剂组合因能在界面上形成分子复合物,从而提高乳液分散性能,发挥稳定虾青素的效果[92−93](如表4所示)。
3.5 虾青素稳态化技术的比较
3.5.1 稳定性效果
虽然现在对天然虾青素的稳态化技术研究日益增多,但是不同方法之间的比较研究十分缺乏。对比表1至表4,根据不同稳态化技术的原理以及虾青素的储藏效果可以得出的结论是:微乳液固有的热力学稳定性以及采用胶体颗粒代替传统乳化剂的 Pickering乳液的稳定虾青素效果比传统乳液的效果好(虾青素的降解率普遍小于20%);包裹在微胶囊中的虾青素因为壁材的保护作用,其稳定性优于自身稳定性较差的乳液体系,虾青素保留率可以达到85%。虾青素在脂质体、纳米颗粒和纳米分散体同样能起到保护虾青素的效果,但与原材料和工艺参数等因素有关。因此,应综合考虑并根据实际情况选择最理想的稳态化方法。
3.5.2 各项技术存在的问题
虽然现有的虾青素稳态化技术在不同程度上提高了虾青素的稳定性,但也存在各自的问题亟待解决。乳液体系自身稳定性较差,所以使用的乳化剂含量较高,不仅增加了生产成本,同时加大了乳液运载的难度[58]。微胶囊化技术通常需要借助喷雾干燥等产生微小粒径,工艺复杂,设备投入高以及生产能耗大[45]。脂质体所需的辅料与设备所需的成本都相对较高,且高剂量脂质体可能会产生高毒性[76]。制备性能良好的纳米分散体面临粒径较大、制备工艺复杂、原料昂贵且储存困难、不易实现规模化生产的困境[90]。
4. 结论与展望
天然虾青素具有极高的生物活性和药用价值,在食品、医药以及化妆品领域有广阔的应用前景。但是,天然虾青素因自身结构、提取过程以及储存环境表现出性质的和功能的不稳定性限制了其生物功能的发挥。乳液、微胶囊、脂质体、纳米颗粒及纳米分散体等多种虾青素运载体系的构建有助于提高天然虾青素的稳定性,并展现出不同的技术特点。就目前而言,虾青素的乳液、微胶囊、脂质体及纳米颗粒等运载体系正以不同速度发展。但是,整体而言,现有虾青素稳态化技术仍处于初步研究阶段,且还有许多科学问题需要解决,因此今后应该注意以下几点:a.加强基础研究,结合分子模拟等技术从分子水平设计乳化剂的复配或壁材的复配,优化稳态系统的结构,提高天然虾青素的封装和稳定效果;b.寻求更绿色、更智能的体系,如采用低共熔溶剂、新型表面活性剂以及响应型乳液;c.关注虾青素的提取体系、稳态体系和应用递送体系三者之间的关联性和连续性;d.加快对虾青素稳态化体系安全性评价方法和评价体系的建立。
-
表 1 运载虾青素的乳液体系
Table 1 Astaxanthin-loaded emulsion system
乳液类型 乳化剂 制备方法 储藏条件 虾青素的稳定性 参考文献 乳液 乳清分离蛋白、吐温20 重复预混膜乳化法 常温储藏3周 虾青素降解30% [57] 乳清蛋白和黄原胶 高压均质法 在5~37 ℃储藏15 d 虾青素降解10%~12% [43] 纳米乳液 甘油酯和氢化卵磷脂 高压均质法 光热条件下储藏1个月 Zeta电位<−41 mV [58] 聚山梨酸20、酪蛋白酸钠、
阿拉伯胶溶剂扩散法 25 ℃储藏8周 虾青素降解20% [48] 微乳液 大豆卵磷脂 高压均质法 4 ℃避光储藏1周 虾青素降解14.66% [46] 吐温80 高压均质法 37 ℃荧光照射下储存20 d 平均粒径<100 nm [59 Pickering乳液 羽扇豆蛋白聚集物和麦芽糊精 高压均质法 25 ℃储藏4周 虾青素降解11.9% [52] 多层乳液 壳聚糖和果胶 − 37 ℃下储藏15 d 色差参数(a*和b*)下降缓慢 [56] 乳清蛋白和波斯胶 高压均质法 60 ℃下储藏15 d 虾青素降解10% [60] 表 2 包埋虾青素的微胶囊体系
Table 2 Astaxanthin-loaded microencapsulation system
壁材类别 壁材名称 壁材
配比芯壁
材比乳化剂 制备方法 包埋率
(%)储藏条件 虾青素稳定性 参考
文献蛋白质类/
碳水类明胶/麦芽糊精 2:1 1:6 单硬脂酸甘油酯/
蔗糖脂肪酸酯喷雾干燥法 38.02 26 ℃避光
储存10 d虾青素保留率:43.98%(微胶囊)>
24.02%(虾青素油树脂)[70] 玉米醇溶蛋白/
低聚壳寡糖1:1 − − 复凝聚法+
冷冻干燥94.34 紫外光照射
9.5 h虾青素保留率:82.4%(微胶囊)
>60%(游离)[69] 酪蛋白酸钠/
乳糖1:1 1:2 − 喷雾干燥法 86.06 5、25、40 ℃
储藏26 d虾青素浓度各自从13.76 μg/g下降至
10.16、8.28 和6.48 μg/g[71] 蛋白质类/
亲水胶类明胶/腰果胶 1:2.5 − − 复凝聚法 59.9 36 ℃储藏43 d 虾青素保留率:47%(微胶囊)
>9%(游离)[72] 碳水类/
碳水类蔗糖/麦芽
糊精/纯胶1:1:1 − 吐温20/蔗糖酯/
司班60喷雾干燥法 30.60 30 ℃储藏8 d 虾青素残留率:80%(微胶囊)
>2%(游离)[73] 纯胶/麦芽糊精 1:1 − 吐温20/蔗糖酯/
司班60喷雾干燥法 17.10 常温光照条件下
储藏8 d虾青素残留率:80%(微胶囊)
>4%(游离)[74] 麦芽糊精/羟丙
基-β-环糊精1:2.9 − 聚山梨酯-80 喷雾干燥法 98.77 室温25 ℃密封,自然光
条件下储藏30 d虾青素保留率:85%(微胶囊)
>45%(游离)[41] 油脂类/
碳水类β-环糊精/蔗糖
脂肪酸酯1:1 − − 冷冻干燥法 86.90 25 ℃避光条件
下储藏虾青素损失13.1% [63] 鱼卵磷脂/
麦芽糊精− − − 喷雾干燥法 90.12 − 微观结构、红外光谱以及热稳定性表明
微胶囊虾青素稳定性更高[75] 表 3 运载虾青素的脂质体体系
Table 3 Astaxanthin-loaded liposome system
原料 制备方法 包封率(%) 理化指标 储藏条件 虾青素稳定性 参考
文献粒径(nm) 平均PDI值 平均Zeta
电位(mV)磷脂酰胆碱 薄膜超声法 97.68 80.62 0.20 −31.80 4 ℃和25 ℃避光储藏 虾青素保留率分别为82.29%和
61.32%[80] 磷脂、胆固醇 乙醇注入法 35.28 143.2 − − 50 ℃水浴加热3 h 虾青素脂质体降解3.36% [83] 卵磷脂、胆固醇 薄膜超声法 − 191 0.47 −34.0 4 ℃避光保存2、4、6、8 d t1/2 :游离虾青素<
虾青素脂质体[81] 磷脂酰胆碱/磷脂酰
半乳糖/磷脂酰琼脂糖薄膜超声法 72.6/85.72/88.93 − − − 35 ℃放置30 min 虾青素保留率:60%(游离)<
70%(脂质体)[82] 表 4 运载虾青素的纳米颗粒和纳米分散体体系
Table 4 Astaxanthin-loaded nanoparticles and nanodispersions system
方法 载体或乳化剂名称 制备方法 包封率(%) 理化指标 储藏条件 虾青素稳定性 参考
文献平均粒径
(nm)平均
PDI值平均Zeta
电位(mV)纳米颗粒(NPs) 乳清蛋白 乳化-溶剂
蒸发法96.0 80~130 − −20~−30 常温紫外光
照射2 h虾青素保留率:70.5%(NPs)>
4.1%(游离)[94] 壳寡糖和聚乙烯乳酸-羟基乙酸共聚物(PLGA) 反溶剂沉淀法+静电沉积法 PLGA
(50:50):85.8 PLGA
(75:25):93.5PLGA
(50:50):500
PLGA
(75:25):600− − 室温避光
储存72 h虾青素纳米颗粒沉淀速率小于
游离虾青素[95] 乳清蛋白与阿拉伯胶 复合凝聚法 92.93 265.71±0.55 − −13.44 4 ℃储存
15 d虾青素保留率高达
90.78%[96] 薏米醇溶蛋白与
阿拉伯胶反溶剂沉淀法 55.07 163.43 0.12 −18.20 − 添加阿拉伯胶后明显增加pH
和盐离子稳定性[88] 低聚壳聚糖与海藻酸盐 油水乳化+
离子凝胶法71.3 264 − −22.1 紫外光
照射2 h虾青素保留率:90%(NPs)>18%
(游离)[86] 玉米蛋白、豌豆蛋白和果胶 共组装 94.22 100~200 0.25~0.30 −30~-50 − 虾青素NPs在不同pH、光和温度的保留率
提高[97] 纳米分散体 乳化剂(吐温20、酪蛋白酸钠和阿拉伯树胶) 乳化-蒸发技术 − 86.51 0.354 − 4 ℃储存3周 平均粒径无明显变化/虾青素降解27.7% [93] 乳化剂(聚山梨酸酯20、酪蛋白酸钠和阿拉
伯树胶)乳化-扩散技术 − 98.30 0.348 − 紫外光照射 三组分复合稳定剂比单组分具有更高的稳定性 [92] -
[1] NABI B G, MUKHTAR K, AHMED W, et al. Natural pigments:Anthocyanins, carotenoids, chlorophylls, and betalains as colorants in food products[J]. Food Bioscience,2023,52:102403−102403. doi: 10.1016/j.fbio.2023.102403
[2] 汪文秀. 人工合成色素对人体的危害及天然色素的应用前景[J]. 食品安全导刊,2019(25):72−73. [WANG W X. Harm of artificial pigments to human body and application prospect of natural pigments[J]. China Food Safety Magazine,2019(25):72−73.] WANG W X . Harm of artificial pigments to human body and application prospect of natural pigments[J]. China Food Safety Magazine,2019 (25 ):72 −73 .[3] ZHAO T, YAN X, SUN L, et al. Research progress on extraction, biological activities and delivery systems of natural astaxanthin[J]. Trends in Food Science & Technology,2019,91(C):354−361.
[4] ZHOU X, ZHANG F, HU X, et al. Inhibition of inflammation by astaxanthin alleviates cognition deficits in diabetic mice[J]. Physiology Behavior,2015,151:412−420. doi: 10.1016/j.physbeh.2015.08.015
[5] NAGENDRAPRABHU P, SUDHANDIRAN G. Astaxanthin inhibits tumor invasion by decreasing extracellular matrix production and induces apoptosis in experimental rat colon carcinogenesis by modulating the expressions of ERK-2, NFkB and COX-2[J]. Invest New Drugs,2011,29(2):207−224. doi: 10.1007/s10637-009-9342-5
[6] PASHKOW F J, WATUMULL D G, CAMPBELL C L. Astaxanthin:A novel potential treatment for oxidative stress and inflammation in cardiovascular disease[J]. American Journal of Cardiology,2008,101(10A):58D−68D.
[7] PENG J, YUAN J P, WANG J H. Effect of diets supplemented with different sources of astaxanthin on the gonad of the sea urchin Anthocidaris crassispina[J]. Nutrients,2012,4(8):922−934. doi: 10.3390/nu4080922
[8] CAO Y R, YANG L, QIAO X, et al. Dietary astaxanthin:An excellent carotenoid with multiple health benefits[J]. Critical Reviews in Food Science and Nutrition,2021,63(18):21−27.
[9] 刘兴海, 邱诗波, 杜桂涛, 等. 天然色素的提取、稳定性改进及其应用进展探究[J]. 数字印刷,2022(1):1−25. [LIU X H, QIU S B, DU G T, et al. Research progress on extraction, stability improvement and application of natural pigments[J]. Printing and Digital Media Technology Study,2022(1):1−25.] LIU X H, QIU S B, DU G T, et al . Research progress on extraction, stability improvement and application of natural pigments[J]. Printing and Digital Media Technology Study,2022 (1 ):1 −25 .[10] 食品安全标准与监测评估司. 关于批准雨生红球藻等新资源食品的公告(2010年 第17号)[S]. 北京:中华人民共和国国家卫生健康委员会, 2010. [Food Safety Standards and Monitoring and Evaluation Division. Notice on the approval of Haematococcus pluvialis and other new resource foods (No.17 of 2010)[S]. Beijing:National Health Commission of the people's Republic of China, 2010.] Food Safety Standards and Monitoring and Evaluation Division. Notice on the approval of Haematococcus pluvialis and other new resource foods (No.17 of 2010)[S]. Beijing: National Health Commission of the people's Republic of China, 2010.
[11] Global Industry Analysts I. Astaxanthin:Global strategic business report[R/OL]. (2023-01). Astaxanthin:Global Strategic Business Report (researchandmarkets. com).
[12] HIGUERA-CIAPARA I, FÉLIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin:A review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition,2006,46(2):185−196. doi: 10.1080/10408690590957188
[13] FANG H H, NIU J. Diet supplementation of astaxanthin mitigates cadmium induced negative effects on oxidative, inflammatory and non-specific immune responses, and the intestinal morphology in Trachinotus ovatus[J]. Comparative Biochemistry and Physiology, Part C,2022,260(C):109407.
[14] LIU X, LUO Q, RAKARIYATHAM K, et al. Antioxidation and anti-ageing activities of different stereoisomeric astaxanthin in vitro and in vivo[J]. Journal of Functional Foods,2016,25:50−61. doi: 10.1016/j.jff.2016.05.009
[15] ANEESH P A, AJEESHKUMAR K K, LEKSHMI R G K, et al. Bioactivities of astaxanthin from natural sources, augmenting its biomedical potential:A review[J]. Trends in Food Science & Technology,2022,125:81−90.
[16] YANG L, QIAO X, GU J, et al. Influence of molecular structure of astaxanthin esters on their stability and bioavailability[J]. Food Chemistry,2021,343:128497. doi: 10.1016/j.foodchem.2020.128497
[17] LI Y, HU K, HUANG C, et al. Improvement of solubility, stability and antioxidant activity of carotenoids using deep eutectic solvent-based microemulsions[J]. Colloids Surf B Biointerfaces,2022,217:112591. doi: 10.1016/j.colsurfb.2022.112591
[18] 陈丹, 汪锋, 蒋珊, 等. 虾青素化学和生物合成研究进展[J]. 食品工业科技,2021,42(21):445−453. [CHEN D, WANG F, JIANG S, et al. Research progress on chemical and biological synthesis of astaxanthin[J]. Science and Technology of Food Industry,2021,42(21):445−453.] CHEN D, WANG F, JIANG S, et al . Research progress on chemical and biological synthesis of astaxanthin[J]. Science and Technology of Food Industry,2021 ,42 (21 ):445 −453 .[19] FAKHRI S, ABBASZADEH F, DARGAHI L, et al. Astaxanthin:A mechanistic review on its biological activities and health benefits[J]. Pharmacological Research,2018,136:1−20. doi: 10.1016/j.phrs.2018.08.012
[20] KHOO K S, LEE S Y, OOI C W, et al. Recent advances in biorefinery of astaxanthin from Haematococcus pluvialis[J]. Bioresource Technology,2019,288:121606. doi: 10.1016/j.biortech.2019.121606
[21] PU J, BECHTEL P J, SATHIVEL S. Extraction of shrimp astaxanthin with flaxseed oil:Effects on lipid oxidation and astaxanthin degradation rates[J]. Biosystems Engineering,2010,107(4):364−371. doi: 10.1016/j.biosystemseng.2010.10.001
[22] PAN-UTAI W, BOONPOK S, PORNPUKDEEWATTANA S. Combination of mechanical and chemical extraction of astaxanthin from Haematococcus pluvialis and its properties of microencapsulation[J]. Biocatalysis and Agricultural Biotechnology,2021,33:101979. doi: 10.1016/j.bcab.2021.101979
[23] MURADOR D C, BRAGA A R C, MARTINS P L G, et al. Ionic liquid associated with ultrasonic-assisted extraction:A new approach to obtain carotenoids from orange peel[J]. Food Research International,2019,126(C):108653.
[24] CHANDRA R V, HO T C, LEE H J, et al. Extraction of astaxanthin using ultrasound-assisted natural deep eutectic solvents from shrimp wastes and its application in bioactive films[J]. Journal of Cleaner Production,2021,284:125417. doi: 10.1016/j.jclepro.2020.125417
[25] 冯铭镭, 王磊, 龙晓文, 等. 不同来源虾青素对虹鳟红肌抗氧化和脂质代谢的影响[J]. 中国饲料,2023(1):82−88. [FENG M L, WANG L, LONG X W, et al. Effects of astaxanthin from different sources on antioxidation and lipid metabolism in red muscle of rainbow trout[J]. China Feed,2023(1):82−88.] FENG M L, WANG L, LONG X W, et al . Effects of astaxanthin from different sources on antioxidation and lipid metabolism in red muscle of rainbow trout[J]. China Feed,2023 (1 ):82 −88 .[26] LIM G B, LEE S Y, LEE E K, et al. Separation of astaxanthin from red yeast Phaffia rhodozyma by supercritical carbon dioxide extraction[J]. Biochemical Engineering Journal,2002,11(2):181−187.
[27] SU F, YU W, LIU J. Comparison of effect of dietary supplementation with Haematococcus pluvialis powder and synthetic astaxanthin on carotenoid composition, concentration, esterification degree and astaxanthin isomers in ovaries, hepatopancreas, carapace, epithelium of adult female Chinese mitten crab ( Eriocheir sinensis)[J]. Aquaculture,2020,523:735146−735146. doi: 10.1016/j.aquaculture.2020.735146
[28] 张莉莉, 李婉菁, 彭锦学, 等. 应用离子液体溶剂体系提取天然虾青素的研究进展[J]. 食品工业科技,2020,41(8):341−346. [ZHANG L L, LI W J, PENG J X, et al. Progress of extracting natural astaxanthin by ionic liquids[J]. Science and Technology of Food Industry,2020,41(8):341−346.] ZHANG L L, LI W J, PENG J X, et al . Progress of extracting natural astaxanthin by ionic liquids[J]. Science and Technology of Food Industry,2020 ,41 (8 ):341 −346 .[29] MOLINO A, RIMAURO J, CASELLA P, et al. Extraction of astaxanthin from microalga Haematococcus pluvialis in red phase by using generally recognized as safe solvents and accelerated extraction[J]. Journal of Biotechnology,2018,283:51−61. doi: 10.1016/j.jbiotec.2018.07.010
[30] KANG C D, SIM S J. Direct extraction of astaxanthin from Haematococcus culture using vegetable oils[J]. Biotechnology Letters,2008,30(3):441−444. doi: 10.1007/s10529-007-9578-0
[31] MEDDEB-MOUELHI F, MOISAN J K, BERGERON J, et al. Structural characterization of a novel antioxidant pigment produced by a photochromogenic microbacterium oxydans strain[J]. Applied Biochemistry and Biotechnology,2016,180(7):1286−1300. doi: 10.1007/s12010-016-2167-8
[32] CHENG W T, XIAN F, ZHOU Z, et al. Solubility and stability of carotenoids in ammonium- and phosphonium-based ionic liquids:Effect of solvent nature, temperature and water[J]. Molecules,2023,28(8):3618. doi: 10.3390/molecules28083618
[33] DENG M F, QU Y, NA Y, et al. Natural deep eutectic solvent and ultrasound:An efficient combination to extract astaxanthin from shrimp shells waste[EB/OL]. Liaoning:Shenyang Pharmaceutical University, 2022.
[34] 程婉婷, 陈世钰, 贤凤, 等. 酸性低共熔溶剂的理化特性及其与虾青素溶解度的相关性研究[J]. 化学试剂,2023,45(2):106−113. [CHENG W T, CHEN S Y, XIAN F, et al. Physicochemical properties of acidic deep eutectic solvents and the correlation with astaxanthin solubility[J]. Chemical Reagents,2023,45(2):106−113.] CHENG W T, CHEN S Y, XIAN F, et al . Physicochemical properties of acidic deep eutectic solvents and the correlation with astaxanthin solubility[J]. Chemical Reagents,2023 ,45 (2 ):106 −113 .[35] 姜启兴, 夏文水. 甲壳类加工下脚料中虾青素的提取研究[J]. 食品科技,2003(12):85−88. [JIANG Q X, XIA W S. Extraction astaxanthin from crustacean offal[J]. Food Science and Technology,2003(12):85−88.] doi: 10.3969/j.issn.1005-9989.2003.12.029 JIANG Q X, XIA W S . Extraction astaxanthin from crustacean offal[J]. Food Science and Technology,2003 (12 ):85 −88 . doi: 10.3969/j.issn.1005-9989.2003.12.029[36] 耿兆艳, 孙翰, 管斌, 等. 雨生红球藻粉虾青素的提取及稳定性研究[J]. 中国食品学报,2017,17(7):86−95. [GENG Z Y, SUN H, GUAN B, et al. Study on the Extraction of astaxanthin from Haematococcus pluvialis and the stability of astaxanthin[J]. Journal of Chinese Institute of Food Science and Technology,2017,17(7):86−95.] GENG Z Y, SUN H, GUAN B, et al . Study on the Extraction of astaxanthin from Haematococcus pluvialis and the stability of astaxanthin[J]. Journal of Chinese Institute of Food Science and Technology,2017 ,17 (7 ):86 −95 .[37] 毛丽哈·艾合买提, 吐力吾汗·阿米汗, 阿布都拉·艾尼瓦尔. 虾壳虾青素的提取及其稳定性研究[J]. 食品安全质量检测学报,2013,4(3):905−910. [MAOLIHA A, TULIWUHAN A, ABUDOULA A, et al. Extraction and stability research of shrimp astaxanthin[J]. Journal of Food Safety and Quality,2013,4(3):905−910.] MAOLIHA A, TULIWUHAN A, ABUDOULA A, et al . Extraction and stability research of shrimp astaxanthin[J]. Journal of Food Safety and Quality,2013 ,4 (3 ):905 −910 .[38] 王红霞, 杨雯, 田洪, 等. 雨生红球藻中虾青素的提取及稳定性研究[J]. 中国食品添加剂,2015(2):101−106. [WANG H X, YANG W, TIAN H, et al. Extraction and stability research of astaxanthin from H. pluvialis[J]. China Food Additives,2015(2):101−106.] WANG H X, YANG W, TIAN H, et al . Extraction and stability research of astaxanthin from H. pluvialis[J]. China Food Additives,2015 (2 ):101 −106 .[39] CHEN Y, SU W, TIE S, et al. Advances of astaxanthin-based delivery systems for precision nutrition[J]. Trends in Food Science & Technology,2022,127:63−73.
[40] 宋素梅, 刘富俊, 姜启兴, 等. 南极磷虾虾壳中虾青素稳定性的研究[J]. 食品工业科技,2012,33(18):96−98,102. [SONG S M, LIU F J, JIANG Q X, et al. Study on the stability of astaxanthin from Antarctic krill shells[J]. Science and Technology of Food Industry,2012,33(18):96−98,102.] SONG S M, LIU F J, JIANG Q X, et al . Study on the stability of astaxanthin from Antarctic krill shells[J]. Science and Technology of Food Industry,2012 ,33 (18 ):96 −98,102 .[41] 赵永强, 谈俊晓, 李来好, 等. 南极磷虾虾青素微胶囊制备工艺优化及其理化性质研究[J]. 渔业科学进展,2019,40(5):185−194. [ZHAO Y Q, TAN J X, LI L H, et al. Optimization of preparation process and physicochemical properties of Antarctic krill astaxanthin microcapsules[J]. Progress in Fishery Sciences,2019,40(5):185−194.] ZHAO Y Q, TAN J X, LI L H, et al . Optimization of preparation process and physicochemical properties of Antarctic krill astaxanthin microcapsules[J]. Progress in Fishery Sciences,2019 ,40 (5 ):185 −194 .[42] LONG B, SIQI H, J R O, et al. Recent innovations in emulsion science and technology for food applications[J]. Journal of Agricultural and Food Chemistry,2021,69(32):8944−8963. doi: 10.1021/acs.jafc.1c01877
[43] BOONLAO N, SHRESTHA S, SADIQ M B, et al. Influence of whey protein-xanthan gum stabilized emulsion on stability and in vitro digestibility of encapsulated astaxanthin[J]. Journal of Food Engineering,2020,272(C):109859.
[44] CHENG J, SHEN S, YANG H, et al. Improved physicochemical stability and bioaccessibility of astaxanthin-loaded oil-in-water emulsions by a casein-caffeic acid-glucose ternary conjugate[J]. Food Research International,2023,163:112153. doi: 10.1016/j.foodres.2022.112153
[45] NEVES M A, HASHEMI J, PRENTICE C. Development of novel bioactives delivery systems by micro/nanotechnology[J]. Current Opinion in Food Science,2015,1:7−12. doi: 10.1016/j.cofs.2014.09.002
[46] 吴婉仪, 李璐, 解新安, 等. 基于响应面法构建虾青素纳米乳液[J]. 食品工业科技,2018,39(10):204−210. [WU W Y, LI L, XIE X A, et al. Preparation of astaxanthin-loaded nanoemulsions by response surface methodology[J]. Science and Technology of Food Industry,2018,39(10):204−210.] WU W Y, LI L, XIE X A, et al . Preparation of astaxanthin-loaded nanoemulsions by response surface methodology[J]. Science and Technology of Food Industry,2018 ,39 (10 ):204 −210 .[47] KAN X H, CHEN G J, ZHOU W T, et al. Application of protein-polysaccharide Maillard conjugates as emulsifiers:Source, preparation and functional properties[J]. Food Research International,2021,150(PA):110740.
[48] ANARJAN N, TAN C P. Developing a three component stabilizer system for producing astaxanthin nanodispersions[J]. Food Hydrocolloids,2013,30(1):437−447. doi: 10.1016/j.foodhyd.2012.07.002
[49] LOKHANDE S S. Microemulsions as promising delivery systems:A review[J]. Asian Journal of Pharmaceutical Research,2019,9(2):90−96. doi: 10.5958/2231-5691.2019.00015.7
[50] GAO J, YOU J, KANG J, et al. Recovery of astaxanthin from shrimp ( Penaeus vannamei) waste by ultrasonic-assisted extraction using ionic liquid-in-water microemulsions[J]. Food Chemistry,2020,325:126850. doi: 10.1016/j.foodchem.2020.126850
[51] MILAD T, AREZOU K, SNEH P B, et al. Functionality developments of Pickering emulsion in food packaging:Principles, applications, and future perspectives[J]. Trends in Food Science & Technology,2023,132:171−187.
[52] BURGOS-DÍAZ C, OPAZO-NAVARRETE M, SOTO-AÑUAL M, et al. Food-grade Pickering emulsion as a novel astaxanthin encapsulation system for making powder-based products:Evaluation of astaxanthin stability during processing, storage, and its bioaccessibility[J]. Food Research International,2020,134(C):109244.
[53] LU Y, XINYU C, ANRAN G, et al. Chitosan/guar gum nanoparticles to stabilize Pickering emulsion for astaxanthin encapsulation[J]. LWT,2022,165:113727. doi: 10.1016/j.lwt.2022.113727
[54] XU Y, JIA Z, WANG J X, et al. Property and stability of astaxanthin emulsion based on Pickering emulsion templating with zein and sodium alginate as stabilizer[J]. International Journal of Molecular Sciences,2022,23(16):9386. doi: 10.3390/ijms23169386
[55] XIAOWEN S, CHENGZHEN L, DONGFENG W, et al. Effects of coating layers chitosan/pectin on lipid stability and in vitro digestion of astaxanthin-loaded multilayer emulsions[J]. LWT,2023,173:114282. doi: 10.1016/j.lwt.2022.114282
[56] LIU C, TAN Y, XU Y, et al. Formation, characterization, and application of chitosan/pectin-stabilized multilayer emulsions as astaxanthin delivery systems[J]. International Journal of Biological Macromolecules,2019,140:985−997. doi: 10.1016/j.ijbiomac.2019.08.071
[57] RIBEIRO H S, RICO L G, BADOLATO G G, et al. Production of O/W emulsions containing astaxanthin by repeated premix membrane emulsification[J]. Journal of Food Science,2005,70(2):E117−E123. doi: 10.1111/j.1365-2621.2005.tb07083.x
[58] KIM D M, HYUN S S, YUN P, et al. Identification of an emulsifier and conditions for preparing stable nanoemulsions containing the antioxidant astaxanthin[J]. International Journal of Cosmetic Science,2012,34(1):64−73. doi: 10.1111/j.1468-2494.2011.00682.x
[59] ZHOU Q, XU J, YANG S, et al. The effect of various antioxidants on the degradation of O/W microemulsions containing esterified astaxanthins from Haematococcus pluvialis[J]. Journal of Oleo Science,2015,64(5):515−525. doi: 10.5650/jos.ess14264
[60] BASSIJEH A, ANSARI S, HOSSEINI S M H. Astaxanthin encapsulation in multilayer emulsions stabilized by complex coacervates of whey protein isolate and Persian gum and its use as a natural colorant in a model beverage[J]. Food Research International,2020,137:109689. doi: 10.1016/j.foodres.2020.109689
[61] LU W, YANG X, SHEN J, et al. Choosing the appropriate wall materials for spray-drying microencapsulation of natural bioactive ingredients:Taking phenolic compounds as examples[J]. Powder Technology,2021,394:562−574. doi: 10.1016/j.powtec.2021.08.082
[62] SHEN Q, QUEK S Y. Microencapsulation of astaxanthin with blends of milk protein and fiber by spray drying[J]. Journal of Food Engineering,2014,123:165−171. doi: 10.1016/j.jfoodeng.2013.09.002
[63] 邢向英, 李玉宽, 董庆霖, 等. 虾青素微胶囊制备工艺的研究[J]. 化学工程,2018,46(1):7−11,26. [XING X Y, LI Y K, DONG Q L, et al. Study on the technology of astaxanthin microencapsules[J]. Chemical Engineering,2018,46(1):7−11,26.] XING X Y, LI Y K, DONG Q L, et al . Study on the technology of astaxanthin microencapsules[J]. Chemical Engineering,2018 ,46 (1 ):7 −11,26 .[64] 周庆新, 杨鲁, 陈芳甜, 等. 雨生红球藻虾青素酯微胶囊制备及其稳定特性研究[J]. 中国食品添加剂,2017(7):131−139. [ZHOU Q X, YANG L, CHEN F T, et al. Study on preparation and stability of microcapsule containing esterified astaxanthins from Haematococcus pluvialis[J]. China Food Additives,2017(7):131−139.] ZHOU Q X, YANG L, CHEN F T, et al . Study on preparation and stability of microcapsule containing esterified astaxanthins from Haematococcus pluvialis[J]. China Food Additives,2017 (7 ):131 −139 .[65] GABRIELA B M, NOEL B G, AGUSTÍN G, et al. Complex coacervation and freeze-drying using whey protein concentrate, soy protein isolate and arabic gum to improve the oxidative stability of chia oil[J]. Journal of the Science of Food and Agriculture,2023,103(7):3322−3333. doi: 10.1002/jsfa.12489
[66] SHAO P, XUAN S, WU W, et al. Encapsulation efficiency and controlled release of Ganoderma lucidum polysaccharide microcapsules by spray drying using different combinations of wall materials[J]. International Journal of Biological Macromolecules,2019,125:962−969. doi: 10.1016/j.ijbiomac.2018.12.153
[67] ZUOBING X, JIAYI X, QIXUAN Z, et al. Maltodextrin as wall material for microcapsules:A review[J]. Carbohydrate Polymers,2022,298:120113. doi: 10.1016/j.carbpol.2022.120113
[68] 贾新超, 徐建中, 杨文江, 等. 微胶囊化虾青素的工艺优化[J]. 中国调味品,2017,42(8):57−62. [JIA X C, XU J Z, YANG W J, et al. Process optimization of microencapsulated astaxanthin[J]. China Condiment,2017,42(8):57−62.] JIA X C, XU J Z, YANG W J, et al . Process optimization of microencapsulated astaxanthin[J]. China Condiment,2017 ,42 (8 ):57 −62 .[69] JIANG G L, ZHU M J. Preparation of astaxanthin-encapsulated complex with zein and oligochitosan and its application in food processing[J]. LWT,2019,106:179−185. doi: 10.1016/j.lwt.2019.02.055
[70] 符力丹. 雨生红球藻中虾青素的微胶囊化及其稳定性研究[D]. 济南:济南大学, 2016. [FU L D. Research on microencapsulation of astaxanthin in Haematococcus pluvialis and its stability[D]. Jinan:University of Jinan, 2016.] FU L D. Research on microencapsulation of astaxanthin in Haematococcus pluvialis and its stability[D]. Jinan: University of Jinan, 2016.
[71] PU J, BANKSTON J D, SATHIVEL S. Production of microencapsulated crawfish ( Procambarus clarkii) astaxanthin in oil by spray drying technology[J]. Drying Technology,2011,29(10):1150−1160. doi: 10.1080/07373937.2011.573155
[72] GOMEZ-ESTACA J, COMUNIAN T A, MONTERO P, et al. Encapsulation of an astaxanthin-containing lipid extract from shrimp waste by complex coacervation using a novel gelatin–cashew gum complex[J]. Food Hydrocolloids,2016,61:155−162. doi: 10.1016/j.foodhyd.2016.05.005
[73] 黄文哲. 以纯胶为主要壁材微胶囊化虾青素的研究[D]. 无锡:江南大学, 2009. [HUANG W Z. Study on astaxanthin microencapsulating by sodium octenylsuccinate[D]. Wuxi:Jiangnan University, 2009.] HUANG W Z. Study on astaxanthin microencapsulating by sodium octenylsuccinate[D]. Wuxi: Jiangnan University, 2009.
[74] 黄文哲, 杨哪, 谢正军, 等. 喷雾干燥制备虾青素微胶囊的工艺研究[J]. 食品工业科技,2010,31(7):239−242. [HUANG W Z, YANG N, XIE Z J, et al. Study on development of micro encapsulation of astaxanthin by spary drying[J]. Science and Technology of Food Industry,2010,31(7):239−242.] HUANG W Z, YANG N, XIE Z J, et al . Study on development of micro encapsulation of astaxanthin by spary drying[J]. Science and Technology of Food Industry,2010 ,31 (7 ):239 −242 .[75] 杜艳瑜, 黄璐瑶, 吴晨昕, 等. 大黄鱼鱼卵磷脂/麦芽糊精-虾青素微胶囊性质表征及其体外消化特性研究[J]. 食品与发酵工业,2023,49(13):177−182. [DU Y Y, HUANG L Y, WU C X, et al. Characterization and in vitro digestibility of large yellow croaker roe phospholipids/maltodextrin-astaxanthin microcapsules[J]. Food and Fermentation Industries,2023,49(13):177−182.] DU Y Y, HUANG L Y, WU C X, et al . Characterization and in vitro digestibility of large yellow croaker roe phospholipids/maltodextrin-astaxanthin microcapsules[J]. Food and Fermentation Industries,2023 ,49 (13 ):177 −182 .[76] PAN L, WANG H, GU K. Nanoliposomes as vehicles for astaxanthin:Characterization, in vitro release evaluation and structure[J]. Molecules,2018,23(11):2822. doi: 10.3390/molecules23112822
[77] SANGSURIYAWONG A, LIMPAWATTANA M, SIRIWAN D, et al. Properties and bioavailability assessment of shrimp astaxanthin loaded liposomes[J]. Food Science and Biotechnology,2019,28(2):529−537. doi: 10.1007/s10068-018-0495-x
[78] 李啟彬, 吕丽铙, 富思逸, 等. 细菌素QY-C与虾青素复合纳米脂质体制备及其特性评价[J]. 食品与发酵工业,2023,49(8):121−127. [LI Q B, LÜ L N, FU S Y, et al. Preparation and properties of complex nanoliposomes with bacteriocin QY-C and astaxanthin[J]. Food and Fermentation Industries,2023,49(8):121−127.] LI Q B, LÜ L N, FU S Y, et al . Preparation and properties of complex nanoliposomes with bacteriocin QY-C and astaxanthin[J]. Food and Fermentation Industries,2023 ,49 (8 ):121 −127 .[79] VINCENZO D L, MARIA M A, LIVIA G, et al. Liposomes containing nanoparticles:Preparation and applications[J]. Colloids and Surfaces B: Biointerfaces,2022,218:112737. doi: 10.1016/j.colsurfb.2022.112737
[80] PAN L, ZHANG S, GU K, et al. Preparation of astaxanthin-loaded liposomes:Characterization, storage stability and antioxidant activity[J]. CyTA - Journal of Food,2018,16(1):607−618. doi: 10.1080/19476337.2018.1437080
[81] QIANG M, PANG X, MA D, et al. Effect of membrane surface modification using chitosan hydrochloride and lactoferrin on the properties of astaxanthin-loaded liposomes[J]. Molecules,2020,25(3):610. doi: 10.3390/molecules25030610
[82] WU H, ZHANG H, LI X, et al. Preparation and characterization of phosphatidyl-agar oligosaccharide liposomes for astaxanthin encapsulation [J]. Food Chemistry, 2023, 404(Pt B):134601.
[83] 杨安平, 顾斯颖, 梁一俊, 等. 虾青素脂质体的制备与表征[J]. 医药导报,2020,39(9):1276−1280. [YANG A P, GU S Y, LIANG Y J, et al. Preparation and characterization of astaxanthin liposome[J]. Herald of Medicine,2020,39(9):1276−1280.] YANG A P, GU S Y, LIANG Y J, et al . Preparation and characterization of astaxanthin liposome[J]. Herald of Medicine,2020 ,39 (9 ):1276 −1280 .[84] KHAN I, SAEED K, KHAN I. Nanoparticles:Properties, applications and toxicities[J]. Arabian Journal of Chemistry,2019,12(7):908−931. doi: 10.1016/j.arabjc.2017.05.011
[85] TINGRUI Z, LU L, SUTICHA C, et al. Enhanced oral bioavailability from food protein nanoparticles:A mini review[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society,2022,354:146−154.
[86] SORASITTHIYANUKARN F N, MUANGNOI C, ROJSITTHISAK P, et al. Chitosan oligosaccharide/alginate nanoparticles as an effective carrier for astaxanthin with improving stability, in vitro oral bioaccessibility, and bioavailability[J]. Food Hydrocolloids,2022,124(PA):107246−107246.
[87] KIM E S, BAEK Y, YOO H J, et al. Chitosan-tripolyphosphate nanoparticles prepared by ionic gelation improve the antioxidant activities of astaxanthin in the in vitro and in vivo model[J]. Antioxidants (Basel),2022,11(3):479. doi: 10.3390/antiox11030479
[88] 谢灏婷, 张霞, 丁玉琴, 等. 阿拉伯胶对薏米醇溶蛋白-虾青素纳米颗粒性质影响[J]. 中国粮油学报,2022,37(6):83−90. [XIE H T, ZHANG X, DING Y Q, et al. Effect of arabic gum on properties of coixin-astaxanthin nanoparticles[J]. Journal of the Chinese Cereals and Oils Association,2022,37(6):83−90.] doi: 10.3969/j.issn.1003-0174.2022.06.013 XIE H T, ZHANG X, DING Y Q, et al . Effect of arabic gum on properties of coixin-astaxanthin nanoparticles[J]. Journal of the Chinese Cereals and Oils Association,2022 ,37 (6 ):83 −90 . doi: 10.3969/j.issn.1003-0174.2022.06.013[89] KALAITZAKI A, EMO M, STÉBÉ M J, et al. Biocompatible nanodispersions as delivery systems of food additives:A structural study[J]. Food Research International,2013,54(2):1448−1454. doi: 10.1016/j.foodres.2013.08.010
[90] ANARJAN N, NEHDI I A, SBIHI H M, et al. Preparation of astaxanthin nanodispersions using gelatin-based stabilizer systems[J]. Molecules,2014,19(9):14257−14265. doi: 10.3390/molecules190914257
[91] ANARJAN N, TAN C. Effects of selected polysorbate and sucrose ester emulsifiers on the physicochemical properties of astaxanthin nanodispersions[J]. Molecules,2013,18(1):768−777. doi: 10.3390/molecules18010768
[92] ANARJAN N, TAN C P, et al. Effects of storage temperature, atmosphere and light on chemical stability of astaxanthin nanodispersions[J]. JAOCS, Journal of the American Oil Chemists' Society,2013,90(8):1223−1227. doi: 10.1007/s11746-013-2270-8
[93] NAVIDEH A, ARBI N I, PING T C. Influence of astaxanthin, emulsifier and organic phase concentration on physicochemical properties of astaxanthin nanodispersions[J]. Chemistry Central Journal,2013,7(1):127. doi: 10.1186/1752-153X-7-127
[94] ZANONI F, VAKARELOVA M, ZOCCATELLI G. Development and characterization of astaxanthin-containing whey protein-based nanoparticles[J]. Marine Drugs,2019,17(11):627. doi: 10.3390/md17110627
[95] LIU C, ZHANG S, MCCLEMENTS D J, et al. Design of astaxanthin-loaded core-shell nanoparticles consisting of chitosan oligosaccharides and poly(lactic- co-glycolic acid):Enhancement of water solubility, stability, and bioavailability[J]. Journal of Agricultural and Food Chemistry,2019,67(18):5113−5121. doi: 10.1021/acs.jafc.8b06963
[96] 袁巧月, 吴梵, 王孝治, 等. 雨生红球藻虾青素纳米颗粒的制备及稳定性研究[J]. 食品工业科技,2022,43(16):98−104. [YUAN Q Y, WU F, WANG X Z, et al. Preparation and stability of nanoparticles containing astaxanthin from Haematococcus pluvialis[J]. Science and Technology of Food Industry,2022,43(16):98−104.] YUAN Q Y, WU F, WANG X Z, et al . Preparation and stability of nanoparticles containing astaxanthin from Haematococcus pluvialis[J]. Science and Technology of Food Industry,2022 ,43 (16 ):98 −104 .[97] TIANYU S, CHENGSHENG J, XINSHUO W, et al. Formation mechanism and stability of low environment-sensitive ternary nanoparticles based on zein-pea protein-pectin for astaxanthin delivery[J]. Food Bioscience,2023,52:102409. doi: 10.1016/j.fbio.2023.102409
-
期刊类型引用(1)
1. 刘丽桃,傅春燕,刘诗薇,周秀娟,谢雨芊,欧阳玉珍,王彪,葛金文. 响应面法优化降脂通脉方多糖的提取工艺研究. 中医药导报. 2024(12): 58-62 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



