Optimization of Proanthocyanidin Extraction from Cerasus humilis Pomace and Evaluation of Its in Vitro Antioxidant and Hypoglycemic Activity
-
摘要: 本研究以欧李果渣为原料,采用单因素结合正交试验对超声波辅助提取欧李果渣原花青素工艺进行优化,采用DPPH自由基清除实验、ABTS+自由基清除实验、FRAP法测定铁离子还原能力实验对纯化后的欧李果渣原花青素抗氧化活性进行评价,并采用α-葡萄糖苷酶活性抑制试验对其降糖活性进行评价。结果表明,各因素对欧李果渣中原花青素提取得率的影响程度排序为:超声温度>料液比>超声时间>乙醇浓度;最佳提取工艺为乙醇浓度70%,超声温度60 ℃,超声时间40 min,料液比1:30 g/mL,在此条件下欧李果渣中原花青素得率为15.37 mg/g。纯化后的欧李果渣原花青素清除DPPH自由基和ABTS+自由基的IC50值分别为0.10 mg/mL和7 µg/mL,抑制α-葡萄糖苷酶活性的IC50值为0.056 mg/mL。本研究提取工艺稳定可行,原花青素得率较高,该条件下提取纯化后的原花青素具有较强的体外抗氧化和降糖活性。Abstract: In this study, the ultrasonic-assisted extraction process of proanthocyanidins from Cerasus humilis pomace was optimized using single-factor combined with orthogonal experiments. The in vitro antioxidant activity and hypoglycemic activity of the purified proanthocyanidins from Cerasus humilis pomace were determined using the DPPH radical scavenging test, ABTS+ radical scavenging test, FRAP method and α-glucosidase activity inhibition test. The extraction rate of proanthocyanidins was influenced in the following order:Sonication temperature>material-liquid ratio>sonication time>ethanol concentration. The best extraction process was that using 70% ethanol, sonication temperature of 60 ℃, sonication time of 40 min, and material-liquid ratio of 1:30 g/mL. Under these conditions, the yield of proanthocyanidins was 15.37 mg/g. The IC50 values of DPPH and ABTS+ radicals scavenged by purified proanthocyanidins were 0.10 mg/mL and 7 µg/mL, respectively, and the IC50 value for inhibiting α-glucosidase activity was 0.056 mg/mL. The extraction process was stable and feasible, the yield of proanthocyanidins was high, and the purified proanthocyanidins had strong in vitro antioxidant activity and hypoglycemic activity.
-
Keywords:
- Cerasus humilis pomace /
- proanthocyanidins /
- extraction process /
- antioxidant /
- hypoglycemic
-
欧李(Cerasus humilis (Bge.) Sok.)是蔷薇科樱属小灌木,其果肉中含有多酚、维生素、氨基酸与多肽以及多种矿物质,具有很高的营养价值[1]。本团队前期研究表明,京欧系列欧李果富含多酚类成分,欧李鲜果肉中四大类主要多酚类成分,即总酚、总黄酮、总原花青素和总花青素含量分别可达1899 mg/100 g FW、1861 mg/100 g FW、1082 mg/100 g FW和39.3 mg/100 g FW[2]。近年来,随着欧李产品开发研究的进一步扩大,欧李果汁、果酒等多种食品加工逐步形成产业化,但加工过程中,欧李果肉榨汁后产生的大量欧李果渣作为废弃物被丢弃,造成了资源浪费。研究发现,葡萄皮渣和花生红衣一类的加工副产品富含原花青素,具有作为原花青素新来源的潜力[3]。同时,对此类副产品的利用符合循环经济理念,即副产品在被作为废物丢弃之前被尽可能多的再利用和提取[4],但有关欧李果渣资源回收开发的研究仍为空白。
原花青素是由不同数量的儿茶素或表儿茶素缩合而成的聚合物,又称缩合单宁[5]。原花青素在植物的根、茎、叶、花、果实、种子中均有分布,具有抗氧化、抗炎、抗糖尿病、抗衰老[6−11]等多种药理作用,其在体内的抗氧化活性是VC的20倍、VE的50倍[12−13]。此外,原花青素还可以通过与葡萄糖转运蛋白结合和竞争性抑制消化酶而发挥降血糖作用[14]。原花青素已经成为食品、医药、化妆品和工业生产等领域的研究热点[15−16]。原花青素提取主要以紫甘蓝、蓝靛果、蔓越莓等为原材料,采用有机溶剂萃取法、酶提取法、微波、超声辅助[17−19]等方法。田争福[20]采用响应面法对欧李鲜果原花青素的超声辅助提取法进行了优化,欧李果渣中可能也具有较高含量和良好活性的原花青素,但目前对于欧李果渣原花青素的含量、提取工艺和活性研究尚处空白。
本研究采用超声波辅助提取法提取欧李果渣中的原花青素,以原花青素得率为评价指标,采用单因素和正交试验得出最佳提取工艺,并进一步考察欧李果渣原花青素的体外抗氧化和降血糖活性。本研究旨在促进欧李产业副产物的合理利用,进一步拓展欧李资源综合开发并提升市场价值。
1. 材料与方法
1.1 材料与仪器
欧李果渣 取自宁夏林业研究院股份有限公司;原花青素B1(批号:PS010162,HPLC含量≥97.0%) 成都普思生物科技股份有限公司;抗坏血酸(批号:20211011) 天津市光复科技发展有限公司;2,2-联苯基-1-苦基肼基(DPPH,批号:C14357523)、2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,批号:C14003395),2,4,6-三吡啶基三嗪(TPTZ,批号:C14194535) 上海麦克林生化科技有限公司;过硫酸钾(批号:20210116)、无水乙醇(分析纯) 福晨(天津)化学试剂有限公司;三氯化铁六水合物(批号:C1518022)、醋酸-醋酸钠缓冲液(pH3.7) 国家化学试剂质检中心;阿卡波糖(批号:S25M11X109783)、PBS溶液(pH6.8)、α-葡萄糖苷酶(活力≥50 units/mg protein,批号:N25HS202422) 上海源叶生物科技有限公司;PBS溶液(pH7.2~7.4,批号:0824A21) 北京雷根生物技术有限公司;无水碳酸钠 分析纯,北京化工厂;娃哈哈水 杭州娃哈哈集团有限公司;盐酸 分析纯,北京市通广精细化工公司。
BT25S型1/100000电子分析天平 赛多利斯科学仪器北京有限公司;RE-52型旋转蒸发器、SHZ-Ⅲ型真空泵 上海亚荣生化仪器厂;FD-2A型真空冷冻干燥机 北京博医康实验仪器有限公司;KQ-400KDE型高功率数控超声波清洗器 昆山市超声仪器有限公司;BY-G20型高速离心机 北京白洋医疗器械有限公司;Synergy2多功能酶标仪 美国BioTek公司。
1.2 实验方法
1.2.1 欧李果渣原花青素提取工艺流程
取欧李果渣样品,剪刀剪碎,准确称取欧李果渣2.00 g,在超声功率500 W的条件下,以一定的乙醇浓度、超声时间、超声温度和液料比进行超声波辅助提取,5163×g离心力离心5 min,取上清液,即为欧李果渣原花青素提取液。
1.2.2 单因素实验设计
1.2.2.1 乙醇浓度对欧李果渣原花青素得率的影响
在液料比为1:30 g/mL,超声温度为50 ℃,超声时间为40 min,乙醇浓度分别为40%、50%、60%、70%、80%的条件下,考察乙醇浓度对欧李果渣原花青素得率的影响。
1.2.2.2 超声温度对欧李果渣原花青素得率的影响
在液料比为1:30 g/mL,乙醇浓度为60%,超声时间为40 min,超声温度分别为30、40、50、60、70 ℃的条件下,考察超声温度对欧李果渣原花青素得率的影响。
1.2.2.3 超声时间对欧李果渣原花青素得率的影响
在液料比为1:30 g/mL,超声温度为50 ℃,乙醇浓度为60%,超声时间分别为20、30、40、50、60 min的条件下,考察超声时间对欧李果渣原花青素得率的影响。
1.2.2.4 料液比对欧李果渣原花青素得率的影响
在乙醇浓度为60%,超声温度为50 ℃,超声时间为40 min,料液比分别为1:20、1:25、1:30、1:35、1:40 g/mL的条件下,考察料液比对欧李果渣原花青素得率的影响。
1.2.3 正交试验设计
根据单因素实验结果,对每个因素选择合适的水平,应用正交表(表1),开展L9(34)正交试验,根据得率得出欧李果渣原花青素的最佳提取工艺。
表 1 正交试验因素水平表Table 1. Factor levels for orthogonal tests水平 A B C D 乙醇浓度(%) 超声温度(℃) 超声时间(min) 料液比(g/mL) 1 50 40 30 1:25 2 60 50 40 1:30 3 70 60 50 1:35 1.2.4 原花青素标准曲线的绘制
精密吸取50 μL原花青素B1梯度稀释溶液(0、0.01、0.05、0.1、0.15、0.2、0.25、0.3 mg/mL)于96孔板中,加入用无水乙醇:水:浓盐酸=6:1:1的酸化乙醇配制的浓度为0.1%的4-二甲基氨基肉桂醛(DMAC)200 μL,静置20 min后在640 nm波长处测定吸光度。以原花青素B1浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,回归方程为Y=7.223X+0.0439(0~0.3 mg/mL,R2=0.9999)。
1.2.5 原花青素含量测定
取原花青素提取液,稀释5倍。按1.2.4方法进行显色并测定样品的吸光度,根据标准曲线方程计算提取液中原花青素的浓度,再计算出得率,即每克欧李果渣中提取的原花青素质量。计算公式如下:
W=C×V×fM (1) 式中:W为欧李果渣原花青素得率,mg/g;C为根据吸光度度计算出的原花青素浓度,mg/mL;V为原花青素提取液体积,mL;f为稀释倍数;M为欧李果渣取样量,g。
1.2.6 抗氧化活性测定
按照最佳提取工艺得到欧李果渣原花青素提取液,经AB-8大孔树脂法和明胶沉淀法纯化,冻干可得到纯度为≥98.1%的原花青素粉末,取冻干样品配制成1 mg/mL的样品溶液并进行梯度稀释,用于活性测定。
1.2.6.1 DPPH自由基清除率的测定
参考缪园欣等[21]的方法,称取0.1984 g DPPH用无水乙醇溶解并定容至50 mL,配制成0.1 mmol/L的DPPH储备液,取0.05、0.15、0.25、0.35、0.45、0.55 mg/mL的样品溶液各100 µL和等体积的0.1 mmol/L的DPPH无水乙醇溶液加入96孔板,充分混匀避光反应30 min,于517 nm波长处测定吸光度。用VC作阳性对照,每种样品测定3次,根据公式计算DPPH自由基清除率:
DPPH自由基清除率(%)=(1−A1−A2A0)×100 (2) 式中:A1为样品吸光度;A2为样品本底的吸光度;A0用无水乙醇代替样品测定的吸光度。
1.2.6.2 ABTS+自由基清除率的测定
参考王晗等[22]的方法,将7.5 mmol/L的ABTS溶液与2.5 mmol/L的K2S2O8溶液等体积混合,室温避光放置12~16 h,形成ABTS储备液。用0.1 mmol/L的磷酸盐缓冲液(pH7.4)稀释ABTS储备液,使其在734 nm处的吸光度为0.70±0.02,将150 µL的ABTS稀释液分别与5、15、25、35、45、55 µg/mL的样品溶液各50 µL混合,室温避光反应6 min后测定734 nm处的吸光度。用VC作阳性对照,每种样品测定3次,根据公式计算ABTS+自由基清除率:
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 (3) 式中:A1为样品吸光度;A2为样品本底的吸光度;A0用水代替样品测定的吸光度。
1.2.6.3 FRAP法对铁离子还原能力的测定
参考李新原等[23]的方法,配制10 mmol/L的TPTZ溶液、20 mmol/L的三氯化铁溶液低温避光备用。按照10:1:1的比例混合醋酸缓冲液(pH3.7)、10 mmol/L TPTZ溶液和20 mmol/L三氯化铁溶液配制FRAP工作液,现配现用。将样品溶液稀释至6个不同质量浓度:0.01、0.02、0.03、0.04、0.05、0.06 mg/mL。于96孔板中加入50 μL不同质量浓度的待测溶液,再加入200 μL FRAP工作液。室温避光反应20 min,测定593 nm处的吸光度。用VC作阳性对照,每个样本重复3次。
用去离子水将100 mmol/L FeSO4·7H2O溶液梯度稀释,取50 µL不同浓度的Fe2+标准溶液于96孔板中,加入FRAP工作溶液200 µL,室温下避光反应20 min,测定593 nm处的吸光度。每个浓度重复3次。以FeSO4的浓度(mmol/L)为自变量,以扣除空白对照的吸光度为因变量作图,并进行线性拟合,得到FeSO4标准曲线,回归方程为Y=3.4094X+0.0091(0~0.5 mmol/L,R2=0.9995)。根据回归方程计算出对应的FeSO4浓度,即为FRAP值,此值越大,表明其铁离子还原能力越强。
1.2.7 抑制α-葡萄糖苷酶的活性测定
参考孙美玲等[24]的方法,取0.02、0.04、0.06、0.08、0.10、0.12 mg/mL的样品溶液各10 µL分别与等体积的α-葡萄糖苷酶(8.335 nkat/mL)均匀混合,于37 ℃下保温15 min。然后加入20 µL的pNPG(5 mmol/L,溶解于pH为6.8的0.1 mol/L磷酸盐缓冲液中)在37 ℃反应30 min,添加150 μL Na2CO3(1 mol/L)终止反应,在405 nm处测定吸光度。以阿卡波糖为阳性对照,等体积磷酸盐缓冲液(0.1 mol/L,pH为6.8)代替α-葡萄糖苷酶溶液作对照组,抑制率公式如下:
W(%)=(1−A−A0A1−A2)×100 (4) 式中:W为样品溶液或阿卡波糖对α-葡萄糖苷酶的抑制率;A为样品的吸光度;A0为对照组的吸光度;A1为PBS和pNPG溶液与酶溶液混合反应的吸光度;A2为PBS和pNPG溶液混合反应的吸光度。
1.3 数据处理
本实验结果采用3次平行数据进行分析,均使用平均数±标准差表示,使用Microsoft Office Excel 2019进行实验数据分析;使用GraphPad Prism8软件进行绘图、IC50值计算和基于Turkey多重检验的单因素ANOVA分析。
2. 结果与分析
2.1 单因素实验
2.1.1 乙醇浓度对欧李果渣原花青素得率的影响
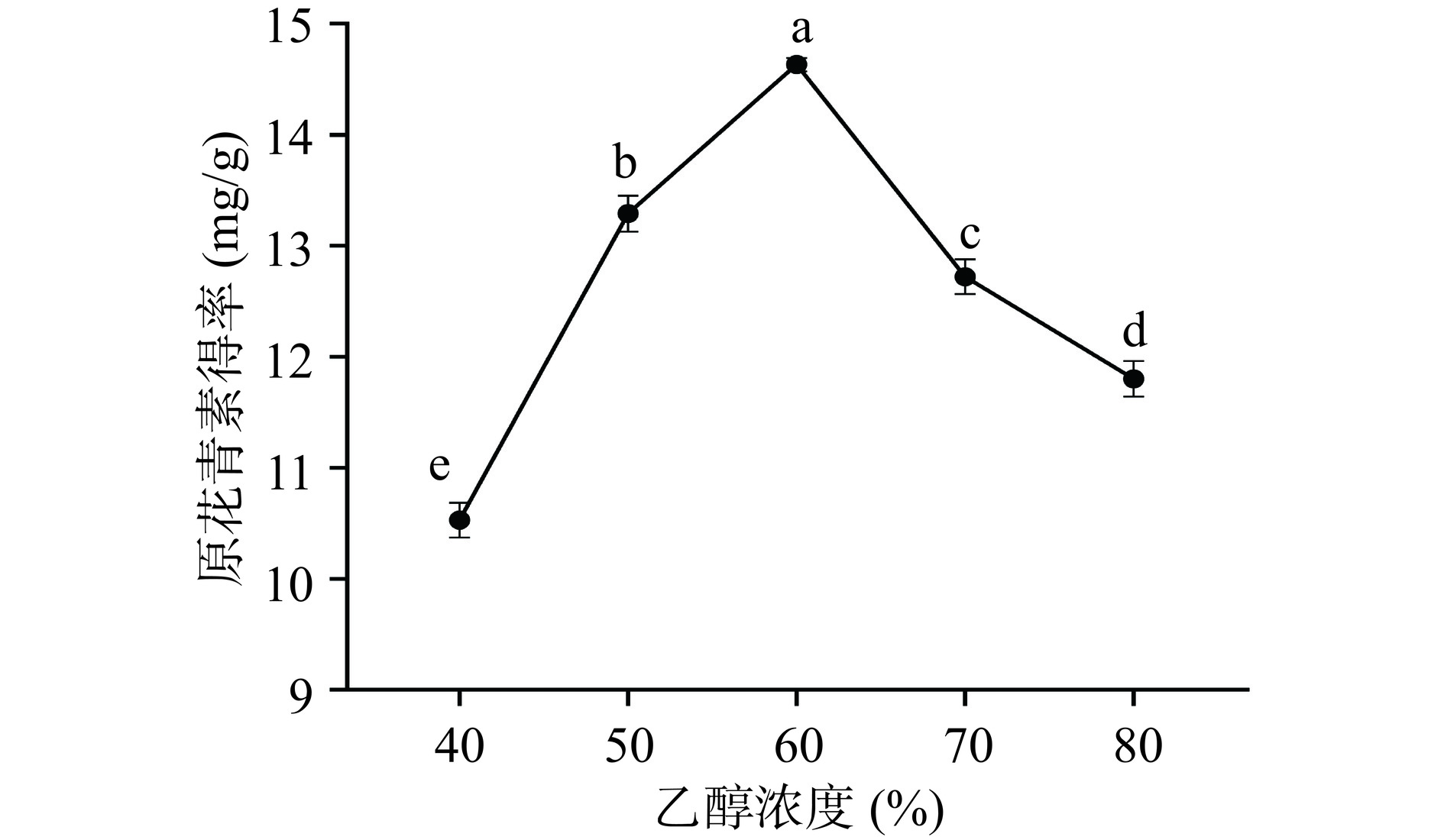
如图1所示,欧李果渣中原花青素得率随着乙醇浓度的提高呈现先升高后下降的趋势,当乙醇浓度为60%时,原花青素得率最大。当乙醇浓度高于60%后,原花青素的得率下降。这是由于乙醇浓度的增大,脂溶性成分溶出增加,导致原花青素得率下降[25]。也有可能与不同浓度的乙醇极性或者高浓度乙醇对原花青素分子破坏有关[26]。根据实验结果,在正交试验设计中,乙醇浓度选取50%~70%。
2.1.2 超声温度对欧李果渣原花青素得率的影响
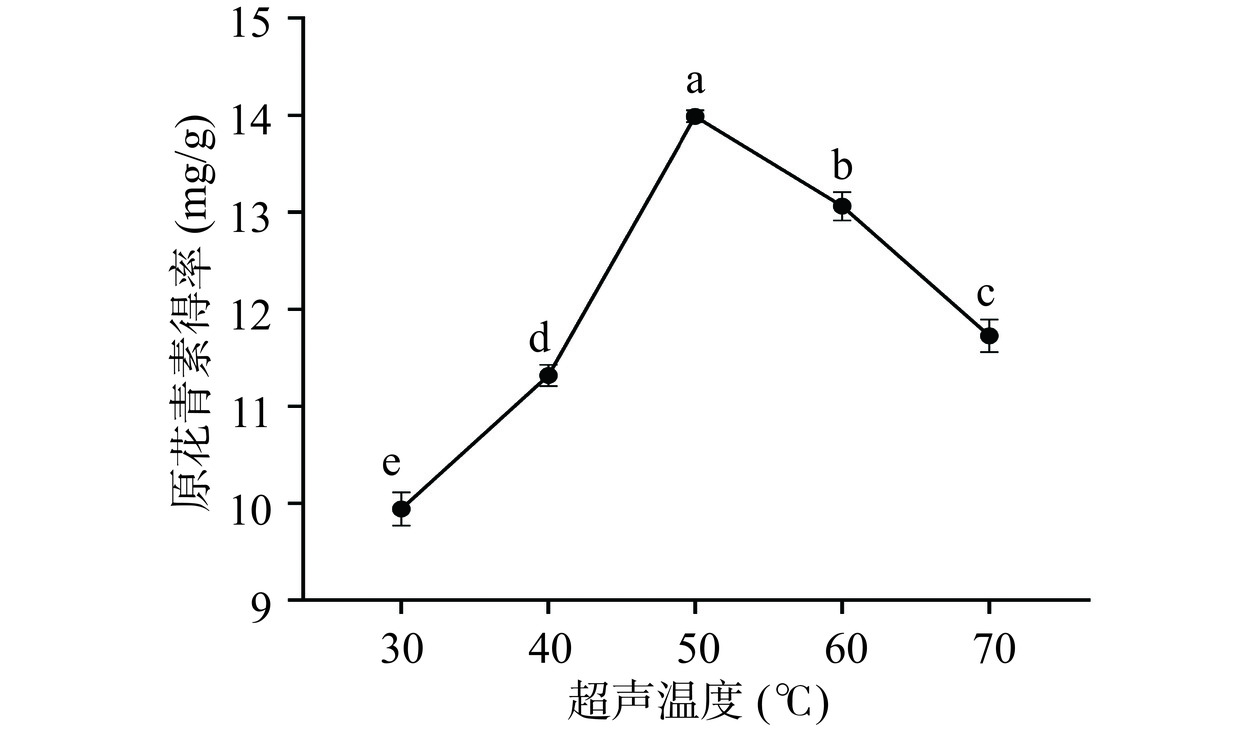
如图2所示,欧李果渣中原花青素得率在30~50℃范围内随着温度升高而增加,已有研究证明酚类物质释放速率和物质的量随温度升高而增加[27]。当温度高于50 ℃后,原花青素得率不断降低。高温会导致原花青素稳定性降低[28],原花青素的结构被破坏,高温下其他成分也可能溶出,以致原花青素的含量下降。根据实验结果,在正交试验设计中,超声温度选取40~60 ℃。
2.1.3 超声时间对欧李果渣原花青素得率的影响
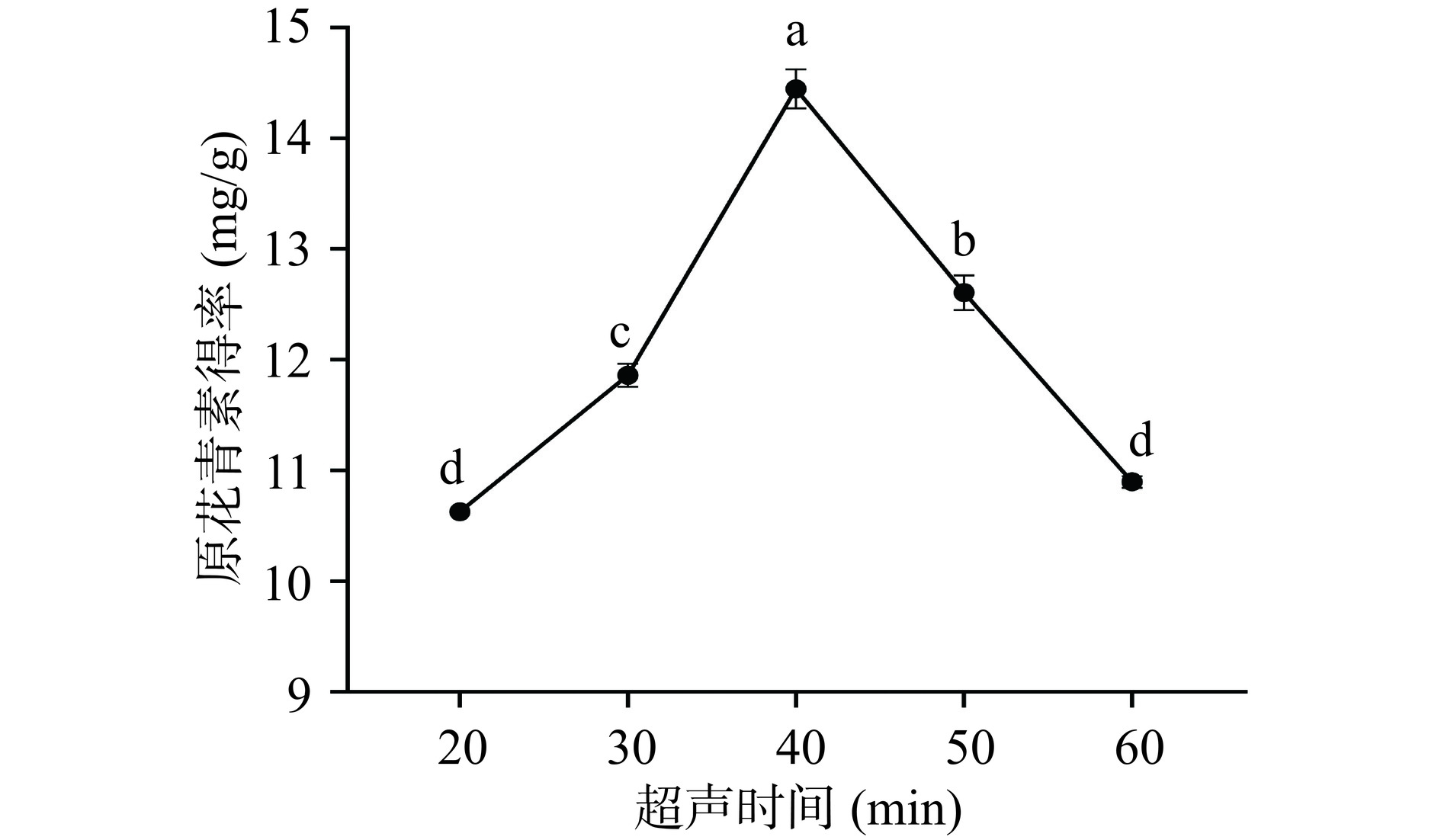
如图3所示,超声时间为40 min时,原花青素得率最大,超声时间多于40 min时,随着超声时间的延长,原花青素的得率逐渐降低。当时间低于40 min时,原花青素可能溶出还不够充分,但时间过长原花青素可能会与空气中的氧气发生氧化反应[29],导致得率下降。根据实验结果,在正交试验设计中,超声时间选取30~50 min。
2.1.4 料液比对欧李果渣原花青素得率的影响
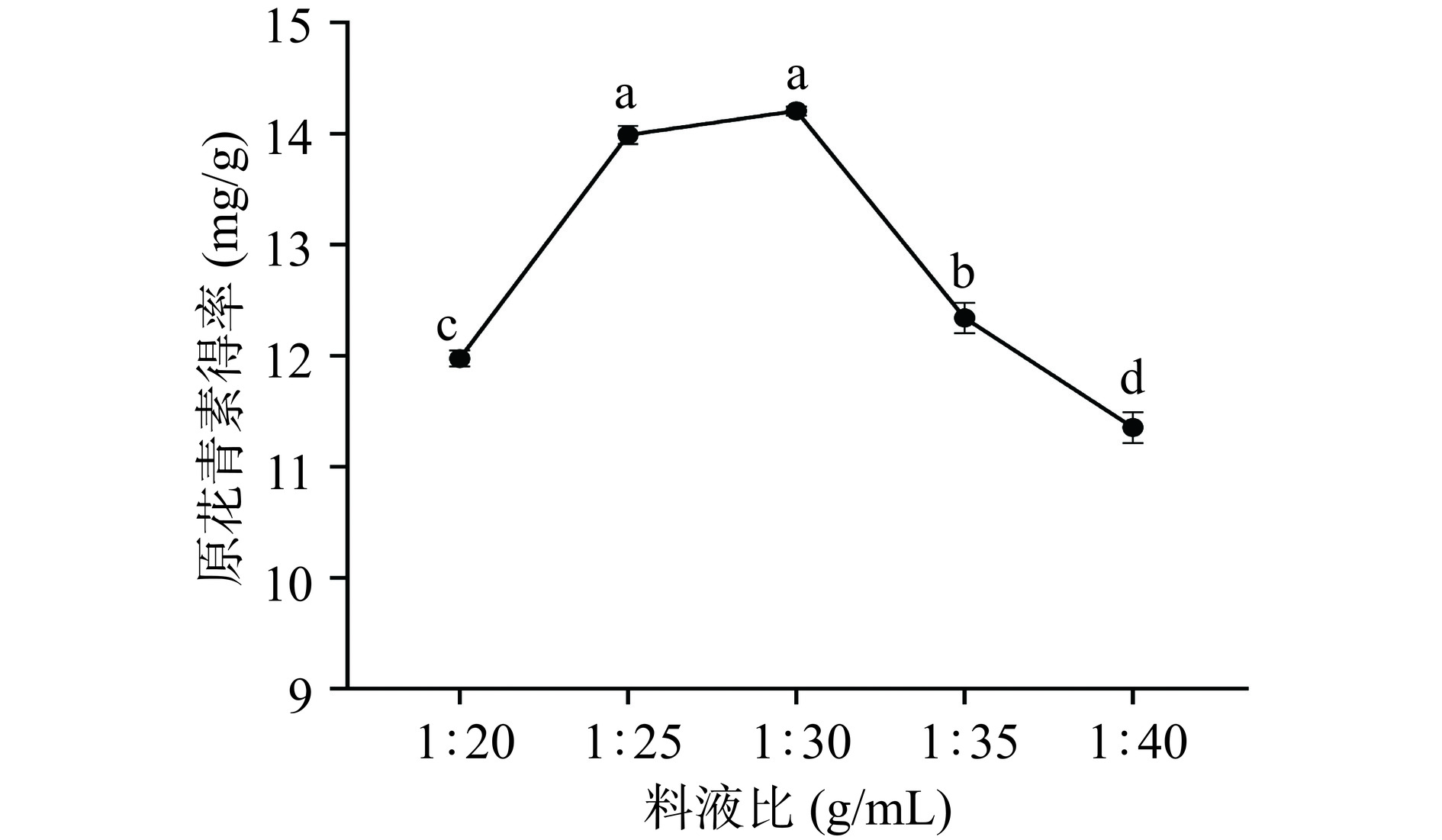
如图4所示,料液比在1:20~1:30 g/mL范围内,原花青素得率呈明显上升趋势,当料液比超过1:30 g/mL后,原花青素得率呈下降趋势。这可能是因为在料液比为1:30 g/mL时,原花青素已经基本溶出,因此随着溶剂体积的增加,其他成分可能会溶出,与原花青素反应或干扰原花青素稳定性,导致原花青素的得率反而降低[30]。根据实验结果,在正交试验设计中,料液比选取1:25~1:35 g/mL。
2.2 正交试验优化工艺
在单因素实验结果的基础上,对乙醇浓度、超声温度、超声时间、料液比4个因素进行四因素三水平的正交试验,正交试验结果如表2所示。
表 2 欧李果渣原花青素提取工艺正交试验结果Table 2. Results of orthogonal tests on the extraction process of proanthocyanidins from C. humilis pomace试验组 试验因素 得率(mg/g) A B C D 1 1 1 1 1 9.61 2 1 2 2 2 12.79 3 1 3 3 3 14.03 4 2 1 2 3 11.10 5 2 2 3 1 9.98 6 2 3 1 2 13.68 7 3 1 3 2 13.39 8 3 2 1 3 10.63 9 3 3 2 1 14.47 K1 36.43 34.10 33.92 34.06 K2 34.75 33.39 38.35 39.86 K3 38.49 42.17 37.40 35.75 k1 12.14 11.37 11.31 11.35 k2 11.58 11.13 12.78 13.29 k3 12.83 14.06 12.47 11.92 R 0.69 2.69 1.48 1.93 由表2可知,4个因素对欧李果渣中原花青素提取得率的影响顺序为:超声温度>料液比>超声时间>乙醇浓度,最佳提取工艺为A3B3C2D2,即乙醇浓度70%,超声温度60 ℃,超声时间40 min,料液比1:30 g/mL,在此条件下进行欧李果渣中原花青素提取,原花青素得率为15.37 mg/g,高于实验中所有结果,该工艺条件稳定可靠。
2.3 欧李果渣原花青素体外抗氧化活性
2.3.1 DPPH自由基清除能力
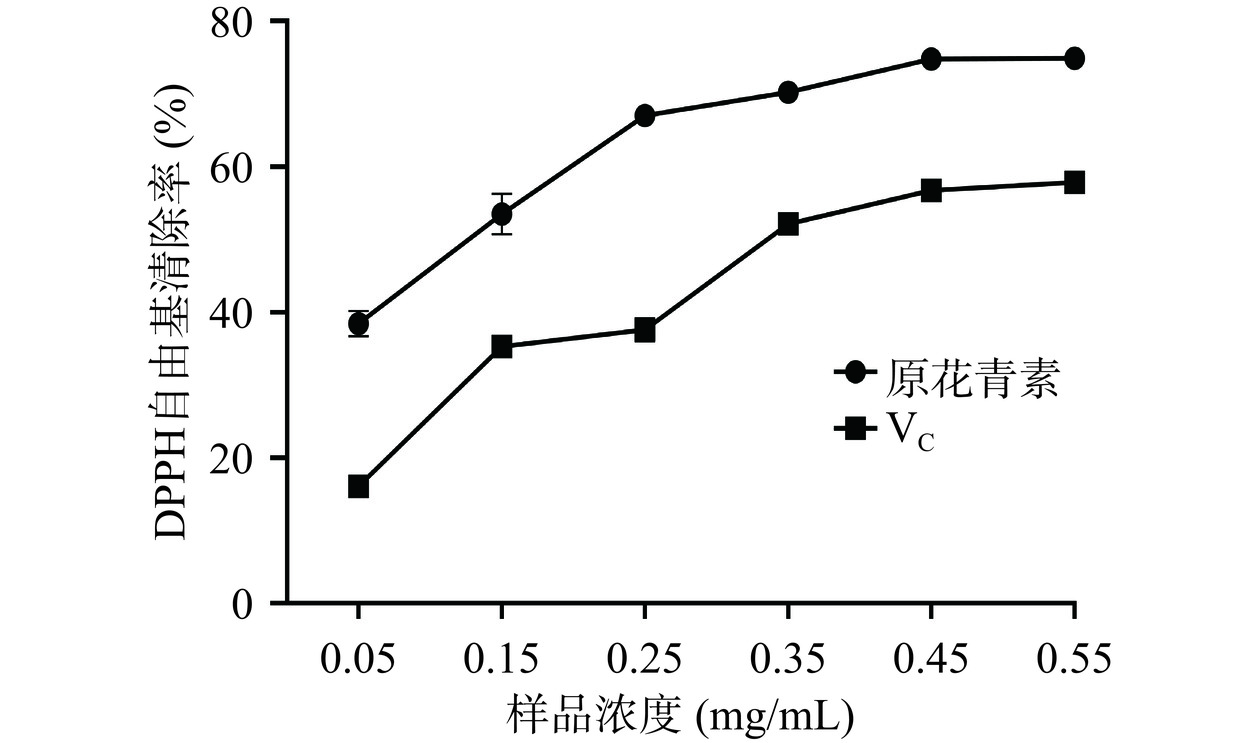
欧李果渣原花青素和VC的DPPH自由基清除能力测定结果如图5所示。欧李果渣原花青素和VC溶液对DPPH自由基的清除率随着浓度增加而升高。在浓度为0.05~0.55 mg/mL的浓度范围内,欧李果渣原花青素的DPPH自由基清除率从38.43%增加到74.87%,VC的DPPH自由基清除率从16.07%增加到57.84%。欧李果渣原花青素和Vc的IC50值分别为0.10和 0.35 mg/mL,欧李果渣原花青素的IC50值显著低于Vc的IC50值(P<0.05)。结果表明,欧李果渣原花青素比VC具有更强的DPPH自由基清除能力。
2.3.2 ABTS+自由基清除能力
欧李果渣原花青素和VC的ABTS+自由基清除能力测定结果如图6所示。欧李果渣原花青素和VC溶液对ABTS+自由基的清除率随着浓度增加而升高,在浓度为5~55 µg/mL的浓度范围内,欧李果渣原花青素的ABTS+自由基清除率从43.36%增加到99.78%,VC的ABTS+自由基清除率从14.87%增加到98.68%。欧李果渣原花青素和VC的IC50值分别为7和26 µg/mL,欧李果渣原花青素的IC50值显著低于VC的IC50值(P<0.05)。结果表明,欧李果渣原花青素比VC具有更强的ABTS+自由基清除能力。
2.3.3 FRAP法测铁离子还原能力
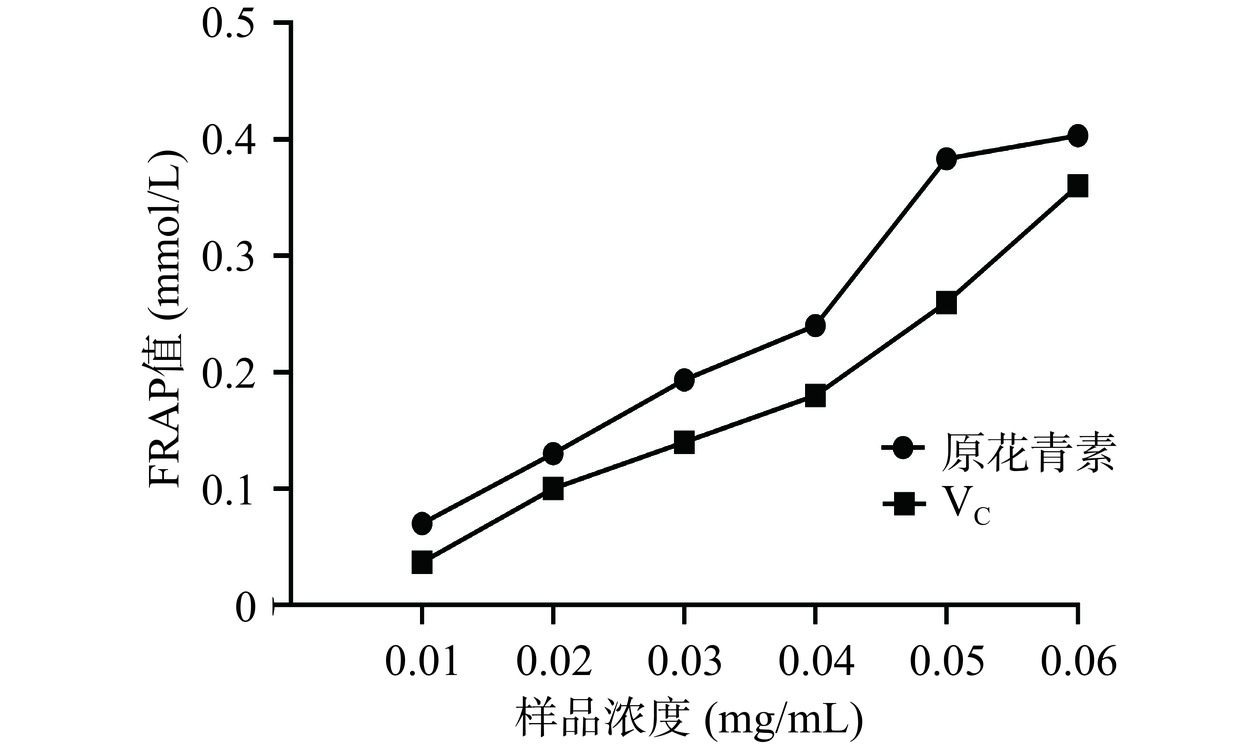
欧李果渣原花青素和VC的铁离子还原能力测定结果如图7所示。欧李果渣原花青素和VC溶液的FRAP值随着浓度增加而升高。在浓度为0.01~0.06 mg/mL的浓度范围内,欧李果渣原花青素的FRAP值从0.07 mmol/L增加到0.40 mmol/L,VC的FRAP值从0.04 mmol/L增加到0.36 mmol/L,欧李果渣原花青素的FRAP值显著高于VC的FRAP值(P<0.05)。结果表明,在相同浓度下,欧李果渣原花青素比VC具有更强的铁离子还原能力。
2.4 欧李果渣原花青素体外降糖活性
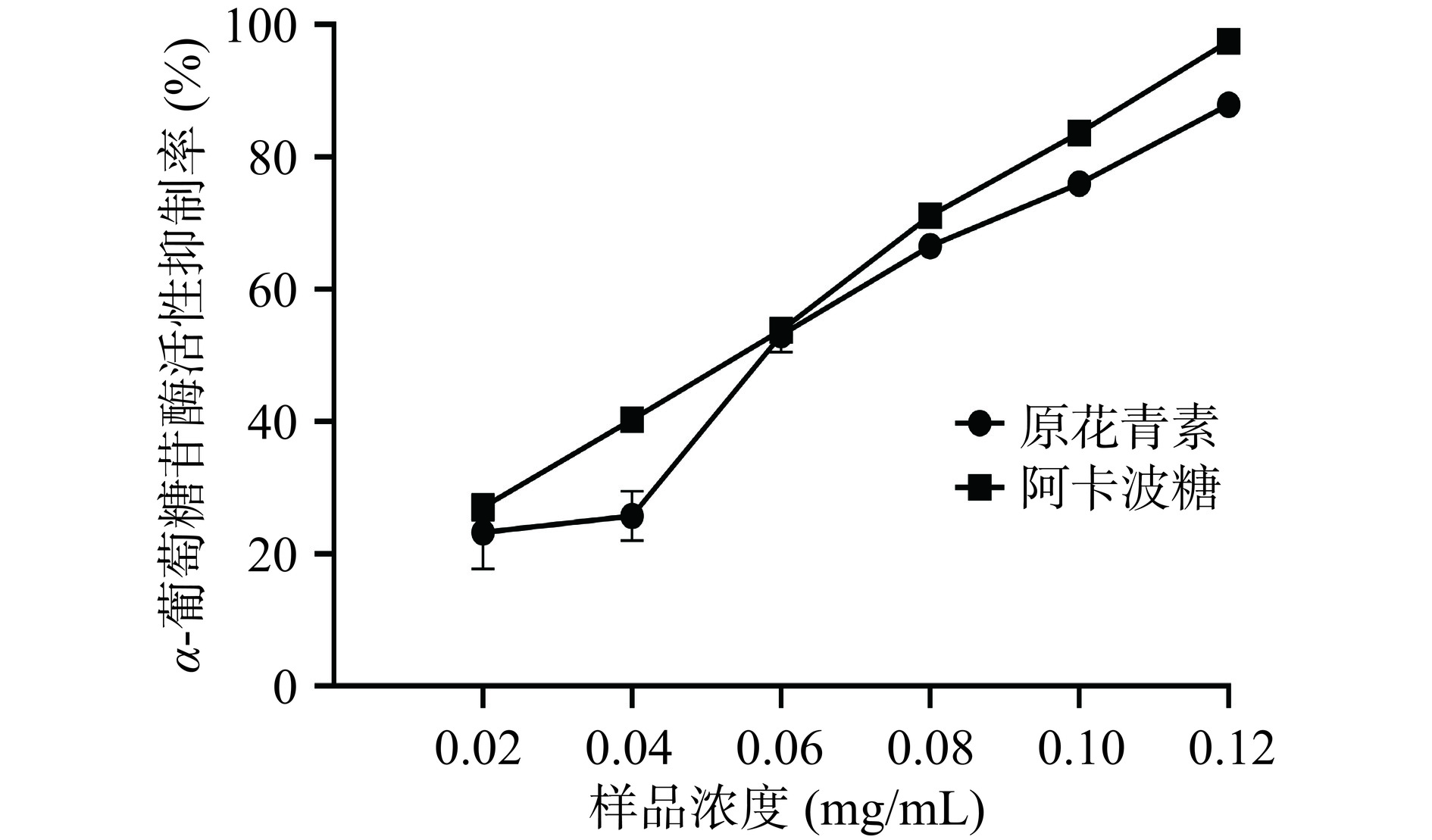
欧李果渣原花青素和阿卡波糖对α-葡萄糖苷酶的活性抑制测定结果如图8所示。欧李果渣原花青素和阿卡波糖溶液随着浓度增加对α-葡萄糖苷酶抑制率升高。在浓度为0.02~0.12 mg/mL的浓度范围内,欧李果渣原花青素对α-葡萄糖苷酶抑制率从23.24%增加到87.92%,阿卡波糖对α-葡萄糖苷酶抑制率从27.06%增加到97.48%。欧李果渣原花青素和阿卡波糖的IC50值分别为0.056和0.046 mg/mL。结果表明,欧李果渣原花青素具有一定的降糖效果,但弱于阿卡波糖,其可视为一种有效的α-葡萄糖苷酶抑制剂。
3. 结论
本研究采用超声波辅助溶剂方式对欧李果渣原花青素提取工艺进行优化,通过单因素和正交试验得到最佳工艺条件:乙醇浓度70%,超声温度60 ℃,超声时间40 min,料液比1:30 g/mL,在此条件下,欧李果渣原花青素得率为15.37 mg/g。通过对纯化后的欧李果渣原花青素进行体外抗氧化和降糖实验发现其对自由基的清除能力和抗氧化活性均显著强于VC,也具有良好的α-葡萄糖苷酶抑制能力,但其抗氧化和降血糖能力综合评价仍需要动物实验进一步验证。本研究为欧李果渣原花青素的产品开发以及欧李果渣的资源利用提供一定的理论依据,具有较好的应用前景。
-
表 1 正交试验因素水平表
Table 1 Factor levels for orthogonal tests
水平 A B C D 乙醇浓度(%) 超声温度(℃) 超声时间(min) 料液比(g/mL) 1 50 40 30 1:25 2 60 50 40 1:30 3 70 60 50 1:35 表 2 欧李果渣原花青素提取工艺正交试验结果
Table 2 Results of orthogonal tests on the extraction process of proanthocyanidins from C. humilis pomace
试验组 试验因素 得率(mg/g) A B C D 1 1 1 1 1 9.61 2 1 2 2 2 12.79 3 1 3 3 3 14.03 4 2 1 2 3 11.10 5 2 2 3 1 9.98 6 2 3 1 2 13.68 7 3 1 3 2 13.39 8 3 2 1 3 10.63 9 3 3 2 1 14.47 K1 36.43 34.10 33.92 34.06 K2 34.75 33.39 38.35 39.86 K3 38.49 42.17 37.40 35.75 k1 12.14 11.37 11.31 11.35 k2 11.58 11.13 12.78 13.29 k3 12.83 14.06 12.47 11.92 R 0.69 2.69 1.48 1.93 -
[1] 李卫东, 顾金瑞. 果药兼用型欧李的保健功能与药理作用研究进展[J]. 中国现代中药,2017,19(9):1336−1340. [LI W D, GU J R. Research progress on health function and pharmacological effect in Cerasus humilis of fruit medicine dual-purpose type[J]. Modern Chinese Medicine,2017,19(9):1336−1340.] LI W D, GU J R. Research progress on health function and pharmacological effect in Cerasus humilis of fruit medicine dual-purpose type[J]. Modern Chinese Medicine, 2017, 19(9): 1336−1340.
[2] LI W, LI O, ZHANG A, et al. Genotypic diversity of phenolic compounds and antioxidant capacity of Chinese dwarf cherry (Cerasus humilis (Bge.) Sok.) in China[J]. Scientia Horticulturae,2014,175:208−213. doi: 10.1016/j.scienta.2014.06.015
[3] SUÁREZ-EIROA B, FERNÁNDEZ E, MÉNDEZ-MARTÍNEZ G, et al. Operational principles of circular economy for sustainable development:Linking theory and practice[J]. Journal of Cleaner Production,2019,214:952−961. doi: 10.1016/j.jclepro.2018.12.271
[4] NETO R T, SANTOS S A O, OLIVEIRA J, et al. Impact of eutectic solvents utilization in the microwave assisted extraction of proanthocyanidins from grape pomace[J]. Molecules,2022,27:246.
[5] 刘玟君, 李金洲, 陈子隽, 等. 原花青素的研究进展[J]. 湖北农业科学,2021,60(14):5−9. [LIU M J, LI J Z, CHEN Z J, et al. Research progress of procyanidins[J]. Hubei Agricultural Sciences,2021,60(14):5−9.] LIU M J, LI J Z, CHEN Z J, et al. Research progress of procyanidins[J]. Hubei Agricultural Sciences, 2021, 60(14): 5−9.
[6] 谭永鹏, 李映伟, 程建华. 超声细胞破碎法提取黑果枸杞原花青素[J]. 食品工业,2021,42(12):26−31. [TAN Y P, LI Y W, CHENG J H. Extraction of proanthocyanidins from Lycium ruthenicum by ultrasonic cell ddisruption[J]. The Food Industry,2021,42(12):26−31.] TAN Y P, LI Y W, CHENG J H. Extraction of proanthocyanidins from Lycium ruthenicum by ultrasonic cell ddisruption[J]. The Food Industry, 2021, 42(12): 26−31.
[7] CÁDIZ-GURREA M L, BORRÁS-LINARES I, LOZANO-SÁNCHEZ J, et al. Cocoa and grape seed byproducts as a source of antioxidant and anti-inflammatory proanthocyanidins[J]. Int J Mol Sci,2017,18(2):376. doi: 10.3390/ijms18020376
[8] LI X, LIU J, CHANG Q, et al. Antioxidant and antidiabetic activity of proanthocyanidins from Fagopyrum dibotrys[J]. Molecules,2021,26(9):2417. doi: 10.3390/molecules26092417
[9] 方欢乐, 于晋茹, 陶炎炎, 等. 葡萄籽原花青素抗衰老作用的研究[J]. 食品与药品,2020,22(6):448−452. [FANG H L, YU J R, TAO Y Y, et al. Study on anti-aging effect of grape seed proanthocyanidins[J]. Food and Drug,2020,22(6):448−452.] FANG H L, YU J R, TAO Y Y, et al. Study on anti-aging effect of grape seed proanthocyanidins[J]. Food and Drug, 2020, 22(6): 448−452.
[10] RAVINDRANATHAN P, PASHAM D, BALAJI U, et al. Mechanistic insights into anticancer properties of oligomeric proanthocyanidins from grape seeds in colorectal cancer[J]. Carcinogenesis,2018,39(6):767−777. doi: 10.1093/carcin/bgy034
[11] ANTÓNIA NUNES M, PIMENTEL F, COSTA A S G, et al. Cardioprotective properties of grape seed proanthocyanidins:An update[J]. Trends in Food Science & Technology,2016,57:31−39.
[12] 只德贤, 张妮, 李建颖. 微波超声协同提取白刺果原花青素工艺及抗氧化性研究[J]. 食品工业科技,2022,43(13):171−179. [ZHI D X, ZHANG N, LI J Y. Microwave-ultrasonic extraction of proanthocyanidins from Nitraria and its antioxidant analysis[J]. Science and Technology of Food Industry,2022,43(13):171−179.] ZHI D X, ZHANG N, LI J Y. Microwave-ultrasonic extraction of proanthocyanidins from Nitraria and its antioxidant analysis[J]. Science and Technology of Food Industry, 2022, 43(13): 171−179.
[13] 高洁, 赵妍. 黑苦荞麦壳高聚原花青素降解及其抗氧化活性分析[J]. 食品研究与开发,2022,43(12):147−154. [GAO J, ZHAO Y. Degradation of polymeric proanthocyanidins in black buckwheat hulls and analysis of their antioxidant activity[J]. Food Research and Development,2022,43(12):147−154.] GAO J, ZHAO Y. Degradation of polymeric proanthocyanidins in black buckwheat hulls and analysis of their antioxidant activity[J]. Food Research and Development, 2022, 43(12): 147−154.
[14] CHEN J, THILAKARATHNA W, ASTATKIE T, et al. Optimization of catechin and proanthocyanidin recovery from grape seeds using microwave-assisted extraction[J]. Biomolecules,2020,10(2):243. doi: 10.3390/biom10020243
[15] 张星和, 侯洪波, 邹章玉, 等. 高黎贡山紫果西番莲果皮中原花青素的提取工艺及其稳定性[J]. 食品研究与开发,2022,43(20):147−155. [ZHANG X H, HOU H B, ZOU Z Y, et al. Extraction process and stability of proanthocyanidins from fruit peel of Passiflora edulis sims on gaoligong mountain[J]. Food Research and Development,2022,43(20):147−155.] ZHANG X H, HOU H B, ZOU Z Y, et al. Extraction process and stability of proanthocyanidins from fruit peel of Passiflora edulis sims on gaoligong mountain[J]. Food Research and Development, 2022, 43(20): 147−155.
[16] PIZZI A. Tannins:Prospectives and actual industrial applications[J]. Biomolecules,2019,9(8):344. doi: 10.3390/biom9080344
[17] PAWAR H S. Purification of 5-hydroxymethyl furfural from side products of fructose dehydration reaction in a green solvent[J]. Chemistry Select,2020,5(23):6851−6855.
[18] LIU B. LIU J, HUANG D. et al. Boric acid modified macroporous adsorption resin and its adsorption propertiesfor catechol compounds[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2020,595:124674. doi: 10.1016/j.colsurfa.2020.124674
[19] 门美福, 卢家成, 张鑫, 等. 微波辅助-酶解法提取紫甘蓝花青素的工艺研究[J]. 湖北农业科学, 2021, 60(10):124−128. [MEN M F, LU J C, ZHANG X, et al. Study on microwave-assisted enzymatic extraction method of anthocyanins from purplecabbage[J]. Hubei Agricultural Sciences, 2021, 60(10):124−128.] MEN M F, LU J C, ZHANG X, et al. Study on microwave-assisted enzymatic extraction method of anthocyanins from purplecabbage[J]. Hubei Agricultural Sciences, 2021, 60(10): 124−128.
[20] 田争福. 欧李原花青素提取及抗氧化性研究[D]. 银川:宁夏大学, 2021. [TIAN Z F. Study on extraction of proanthocyanidins from Cerasus humilis and antioxidant activity[D]. Yinchuan:Ningxia University, 2021.] TIAN Z F. Study on extraction of proanthocyanidins from Cerasus humilis and antioxidant activity[D]. Yinchuan: Ningxia University, 2021.
[21] 缪园欣, 廖明星, 孙爱红, 等. 超声-乙醇法提取铁皮石斛花总黄酮及其体外抗氧化性的研究[J]. 中国酿造,2019,38(4):155−159. [MIU Y X, LIAO M X, SUN A H, et al. Extraction of total flavonoids from Dendrobium officinale flowers by ultrasonic-ethanol synergistic and its antioxidant activity[J]. China Brewing,2019,38(4):155−159.] MIU Y X, LIAO M X, SUN A H, et al. Extraction of total flavonoids from Dendrobium officinale flowers by ultrasonic-ethanol synergistic and its antioxidant activity[J]. China Brewing, 2019, 38(4): 155−159.
[22] 王晗, 朱华平, 李文钊, 等. 越橘提取物中花青素分析及其体外抗氧化活性[J]. 食品工业科技,2019,40(23):60−65. [WANG H, ZHU H P, LI W Z, et al. Analysis of anthocyanin in bilberry extract and its antioxidant activity in vitro[J]. Science and Technology of Food Industry,2019,40(23):60−65.] WANG H, ZHU H P, LI W Z, et al. Analysis of anthocyanin in bilberry extract and its antioxidant activity in vitro[J]. Science and Technology of Food Industry, 2019, 40(23): 60−65.
[23] 李新原, 李斌, 颜廷才, 等. 超高压与超声波对蓝靛果多酚提取及抗氧化活性的影响[J]. 食品科学,2017,38(2):271−277. [LI X Y, LI B, YAN T C, et al. Comparative effects of ultra-high pressure and ultrasonic treatment on the extraction and antioxidant activity of polyphenols from Lonicera caerulea fruits[J]. Food Science,2017,38(2):271−277.] LI X Y, LI B, YAN T C, et al. Comparative effects of ultra-high pressure and ultrasonic treatment on the extraction and antioxidant activity of polyphenols from Lonicera caerulea fruits[J]. Food Science, 2017, 38(2): 271−277.
[24] 孙美玲, 冯晓光, 侯雪飞, 等. 水晶冰菜总黄酮大孔树脂纯化工艺及体外降糖活性研究[J]. 河南农业大学学报,2021,55(5):936−944. [SUN M L, FENG X G, HOU X F, et al. Purification technology and in vitro hypoglycemic activity of total flavonoids macroporous resins from Mesembryanthemum crystallinum[J]. Journal of Henan Agricultural University,2021,55(5):936−944.] SUN M L, FENG X G, HOU X F, et al. Purification technology and in vitro hypoglycemic activity of total flavonoids macroporous resins from Mesembryanthemum crystallinum[J]. Journal of Henan Agricultural University, 2021, 55(5): 936−944.
[25] 卢利平, 张利, 李铀, 等. 凤冈绿茶中原花青素的提取工艺优化[J]. 食品工业科技,2020,41(22):204−209, 231. [LU L P, ZHANG L, LI U, et al. Optimization of extraction technology of proanthocyanidins from green tea of fenggang[J]. Science and Technology of Food Industry,2020,41(22):204−209, 231.] LU L P, ZHANG L, LI U, et al. Optimization of extraction technology of proanthocyanidins from green tea of fenggang[J]. Science and Technology of Food Industry, 2020, 41(22): 204−209, 231.
[26] 钱玉玲, 王维维, 荣国强, 等. 超声波辅助提取蔓越莓中原花青素及其抗氧化性研究[J]. 凯里学院学报,2021,39(6):35−41. [QIAN Y L, WANG W W, RONG G Q, et al. Ultrasonic-assisted extraction of proanthocyanidins from cranberry and their antioxidant properties[J]. Journal of Kaili University,2021,39(6):35−41.] QIAN Y L, WANG W W, RONG G Q, et al. Ultrasonic-assisted extraction of proanthocyanidins from cranberry and their antioxidant properties[J]. Journal of Kaili University, 2021, 39(6): 35−41.
[27] MILLER K V, NOGUERA R, BEAVER J, et al. A mechanistic model for the extraction of phenolics from grapes during red wine fermentation[J]. Molecules,2019,24:1275. doi: 10.3390/molecules24071275
[28] 汪志慧, 孙智达, 谢笔钧. 莲房原花青素的稳定性及热降解动力学研究[J]. 食品科学,2011,32(7):77−82. [WANG Z H, SUN Z D, XIE P J. Stability and thermal degradation kinetics of procyanidins from lotus seed pods[J]. Food Science,2011,32(7):77−82.] WANG Z H, SUN Z D, XIE P J. Stability and thermal degradation kinetics of procyanidins from lotus seed pods[J]. Food Science, 2011, 32(7): 77−82.
[29] 王彦平, 陈月英, 孙瑞琳, 等. 超声波结合酶法提取葡萄皮渣原花青素工艺优化及其抗氧化活性[J]. 食品研究与开发,2021,42(24):74−79. [WANG Y P, CHEN Y Y, SUN R L, et al. Optimization of ultrasonic-enzymatic procyanidin extraction from grape pomace, and its antioxidant activity[J]. Food Research and Development,2021,42(24):74−79.] WANG Y P, CHEN Y Y, SUN R L, et al. Optimization of ultrasonic-enzymatic procyanidin extraction from grape pomace, and its antioxidant activity[J]. Food Research and Development, 2021, 42(24): 74−79.
[30] 林赛婷, 田君飞, 史荣祥, 等. 微波辅助低共熔溶剂高效提取油茶壳原花青素的工艺优化[J]. 应用化工,2023,52(2):398−403. [LIN, S T, TIAN, J F, SHI, R X, et al. Optimization of efficiently extracting procyanidins from Camellia oleifera shells by microwave-assisted deep eutectic solvent[J]. Applied Chemistry Industry,2023,52(2):398−403.] LIN, S T, TIAN, J F, SHI, R X, et al. Optimization of efficiently extracting procyanidins from Camellia oleifera shells by microwave-assisted deep eutectic solvent[J]. Applied Chemistry Industry, 2023, 52(2): 398−403.
-
期刊类型引用(5)
1. 李大荣,李小玲,周武先,张美德,蒋小刚,由金文,王华. 有机肥替代部分化肥对湖北贝母生长及土壤性质的影响. 中国农业科技导报(中英文). 2025(03): 216-226 .  百度学术
百度学术
2. 林旭东,董翼飞,凌建刚,朱麟. 不同温度对离土浙贝母贮藏品质及酶活性的影响. 食品工业科技. 2024(03): 302-309 .  本站查看
本站查看
3. 刘万青,董语迪,罗清. 浙贝母逆转恶性肿瘤耐药的研究进展. 遵义医科大学学报. 2024(01): 99-106 .  百度学术
百度学术
4. 李莉,陈军,朱洁,陈志禹,孙胡琳. PCR-RFLP法鉴别浙贝母及其混淆品湖北贝母. 中成药. 2024(07): 2465-2469 .  百度学术
百度学术
5. 李剑梅,郭玲玲,柴林山,张疏雨,朱万芹,谢存一. 蛹虫草-浙贝母-黑豆菌质固体双向发酵工艺及其抗肿瘤活性研究. 微生物学杂志. 2024(05): 45-54 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



