Effects of Melatonin Treatment on Lignification and Browning in Bamboo Shoots (Acidosasa edulis) Without Sheaths During Cold Storage
-
摘要: 为了研究外源褪黑素延缓冷藏去壳黄甜竹笋木质化和褐变的效果,将无机械伤、无病害且外观和尺寸比较均匀接近的黄甜竹笋剥壳、清洗,于150 μL/L次氯酸钠溶液中杀菌5 min,清洗后于空气中晾干。再于0.2 mmol/L褪黑素溶液和清水(对照)(均含有0.05%吐温-80和3 mL无水乙醇)中22 ℃下浸泡30 min,室温下空气中自然晾干约60 min,而后于(6±1)℃和RH 75%~80%下贮藏15 d,定期取样测定其品质指标以及与木质化、褐变、抗氧化相关酶的活性和基因表达量。结果表明,褪黑素处理显著地(P<0.05)下调了苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和肉桂醇脱氢酶(CAD)基因表达量及活性,从而抑制了笋肉组织的木质化进程;同时,褪黑素处理一方面显著地(P<0.05)提高去壳黄甜笋中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性并上调了对应基因表达量,以降低过氧化氢(H2O2)含量和超氧阴离子自由基(O2−·)的产生速率,从而延缓了相对电导率上升及丙二醛(MDA)的累积;另一方面,褪黑素降低了多酚氧化酶(PPO)活性并下调对应基因表达量,最终抑制了竹笋切面褐变。综上,外源褪黑素处理能够有效抑制冷藏去壳黄甜竹笋的褐变和木质化。Abstract: The effects of melatonin treatment on inhibiting lignification and browning, including firmness, lignin content, enzyme activities, and the expression level of genes encoding corresponding enzymes in bamboo (Acidosasa edulis) shoots without sheaths during cold storage were investigated. Bamboo shoots without physical injuries or infections and similar in shape and size were removed from their sheaths and cleaned with tap water and then disinfected with 150 μL/L sodium hypochlorite for 5 min, rinsed with tap water, and air-dried. The bamboo shoots were soaked in 0.2 mmol/L melatonin solution and water (control) (both containing 0.05% Tween-80 and 3 mL anhydrous ethanol) at 22 ℃ for 30 minutes, air-dried at room temperature for approximately 60 min and subsequently stored at 6±1 °C accompanied by 75%~80% RH for 15 days. Quality parameters and activities of key enzymes and gene expression involved in lignification and browning of bamboo shoots were periodically determined during cold storage to investigate the related mechanism. The results showed that melatonin treatment significantly (P<0.05) decreased the activities of phenylalanine ammonia lyase (PAL), peroxidase (POD) and cinnamyl alcohol dehydrogenase (CAD), and the expression of these lignin synthesis-related enzymes, which contributed to retarding lignification process in bamboo shoots. Meanwhile, melatonin treatment decreased hydrogen peroxide (H2O2) content and the production rate of superoxide anion radical (O2−·), delayed the increase of MDA content and relative leakage rate by significantly (P<0.05) increasing the activities of superoxide dismutase (SOD), catalase (CAT) and the expression of their encoding genes. On the other hand, melatonin treatment reduced the activities of polyphenol oxidase (PPO) and the expression of the encoding genes in bamboo shoots, consequently delaying the enzymatic browning of bamboo shoots. Thus, exogenous melatonin treatment could effectively inhibit browning and lignification of cold shelled yellow sweet bamboo shoots.
-
Keywords:
- bamboo shoot /
- melatonin /
- lignification /
- browning /
- cold storage
-
黄甜竹(Acidosasa edulis)是禾本科酸竹属(Acidosasa)混生竹,主要分布在我国福建、江西、浙江一带。黄甜竹出笋时间集中在每年4~5月份,其笋味道鲜爽清甜、笋肉组织口感细腻,富含蛋白质、氨基酸、膳食纤维等多种营养素;然而由于出笋期间环境温度较高,采后黄甜竹笋难以贮藏,尤其是极易快速褐变和木质化。
褪黑素(Melatonin,MT)是一种色氨酸衍生物,不仅存在于哺乳动物和人类体内,也广泛存在于植物组织中。相关研究指出,褪黑素是一种新的植物生长激素,与植物生长发育、成熟衰老以及胁迫应答和抗病等过程密切相关[1]。樱桃采前喷洒外源褪黑素能够提高其内源褪黑素含量,进而诱导细胞分裂素合成和抑制果实成熟[1]。采后相关研究发现,外源褪黑素处理能够有效地延缓贮藏期间果实品质的下降、保持细胞膜完整性和延缓褐变。有学者研究发现,褪黑素处理能够抑制车厘子[2]、猕猴桃[3]等果实采后冷藏期间品质劣变,主要体现在延缓了果实硬度下降和失重,通过提高抗氧化酶活性进而抑制活性氧累积,同时抑制细胞膜通透性增加,进而延缓了褐变和果肉色泽明亮度下降;褪黑素处理也能够显著地减轻25 ℃下贮藏的荔枝果实褐变[4],其主要机制在于褪黑素处理通过调控细胞膜脂质代谢和能量代谢,抑制了细胞膜渗透性增加,延迟了细胞的衰亡和褐变进程。近年来研究发现,采后外源褪黑素处理对于抑制果蔬采后木质化也有明显的效果。采用50 μmol/L褪黑素通过抑制PAL、4CL、CAD和POD酶活性,进而有效地延缓了冷藏期间枇杷的木质化进程[5];在高节笋上,褪黑素可能通过降低木质素合成相关酶活性以及提高了抗氧化能力,进而延缓了高节笋贮藏过程中木质化进程[6];类似的结果在茭白采后木质化进程中也得到证实[7]。在延缓采后果蔬褐变方面,有研究发现,外源MT处理显著延缓了草莓褐变,其与提高了FaTDC、FaT5H等MT合成基因表达,进而诱导草莓果实累积MT有关[8]。贾乐等[9]和代惠芹等[10]研究发现,外源褪黑素处理显著地提高了香菇和双孢蘑菇组织的抗氧化能力和抑制了褐变相关酶活性,从而有效地延缓了组织褐变。
去壳竹笋能够为竹笋相关预制菜的加工提供洁净的原料,也是竹笋类净菜加工的主体原料。然而,关于褪黑素对去壳冷藏黄甜竹笋组织褐变和木质化的影响研究尚未见报道。因此,本研究拟重点探究外源褪黑素处理对去壳黄甜竹笋冷藏期间木质化和褐变的影响及对有关酶的研究,以探索去壳竹笋新型保鲜方法。
1. 材料与方法
1.1 材料与仪器
黄甜竹笋 五月初早上6:00采集于浙江省丽水市遂昌县实验基地,现场采挖同一竹林、笋体直径和长度基本相同、外观完好、无病虫害的黄甜竹笋,于1.5 h内运回实验室;L-苯丙氨酸、愈创木酚、4-香豆酸、辅酶A(coenzyme A)、三氯乙酸(trichloroacetic acid,TCA)、硫代巴比妥酸(thiobarbituric acid,TBA)、氮蓝四唑(nitro-blue tetrazolium,NBT)、核黄素、邻苯二酚、聚乙二醇6000、β-巯基乙醇、四氯化钛、浓硫酸、丙酮、曲拉通X-100、次氯酸钠、吐温-80等 均为分析纯,国药集团化学试剂有限公司;褪黑素、松柏醇,美国Sigma公司;PureLink® plant RNA Extraction Kit、PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit、SYBR®Premix Ex TaqTM(Tli Rnase Plus) 日本TaKaRa Bio Inc公司。
Micro 17R型高速冷冻离心机 美国Thermo Fisher公司;T6型紫外可见分光光度计 北京普析通用仪器有限责任公司;TPAV-120恒温恒湿箱 日本ISUZU公司;TA.XT PlusC质构仪 英国SMS公司;柯尼卡CR-10Plus色差仪 日本柯尼卡公司;iQTM5多重实时荧光定量PCR仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 材料处理
切除基部3 cm竹笋组织,小心剥除笋壳,用150 μl/L次氯酸钠溶液浸泡5 min杀菌后,用自来水冲洗3~4遍。选取324根去壳笋,将其分成2组,分别浸入0.2 mmol/L褪黑素溶液和清水(溶液中均含0.05%的吐温-80和3 mL无水乙醇)中室温下浸泡30 min。然后,捞出于阴凉处自然晾干,分别放入洁净塑料筐中,外罩0.05 mm厚保鲜袋,不封口,于6±1 ℃,RH 75%~80%下贮藏15 d。期间每3 d取样,测定基部切面的色差,笋体基部切口往上2~4 cm的组织用于检测相关指标,每个实验三次重复。
1.2.2 测定指标与方法
1.2.2.1 色泽
用色差仪测定笋基部切面L*值。每3 d随机取9根黄甜竹笋,测定笋基部切面L*值,其中每株在切面测定3个点,取平均值。
1.2.2.2 相对电导率、丙二醛(MDA)、超氧阴离子自由基(O2−·)生成速率和过氧化氢(H2O2)含量
均参照曹建康等[11]的方法并稍作修改:a. 相对电导率测定:取自笋基部切口向上2~3 mm的约1 mm厚度笋肉组织圆环,用打孔器间隔120°取直径10 mm的圆片,将9片圆片放入大试管中,加入20.0 mL去离子水,真空渗透10 min,后摇床振荡15 min,分别测定煮沸前后的电导率,计算获得相对电导率;b. 丙二醛含量测定:称取3.0 g冷冻竹笋组织,加入5.0 mL TCA溶液,于4 ℃、10000×g离心20 min,去2.0 mL上清液,分别于450、532和600 nm测定吸光度值,计算获得丙二醛含量;c. O2−·生成速率测定:称取3.0 g冷冻笋肉组织,加入5.0 mL提取缓冲液(含 1 mmol/L EDTA,0.3% Triton X-100和2% PVP),冰浴下研磨匀浆,于12000×g、4 ℃ 离心20 min,取1.0 mL上清液,加入1.0 mL 50 mmol/L、pH7.8磷酸缓冲液和1.0 mL 1 mmol/ L的盐酸羟胺溶液,摇匀后于25 ℃保温1 h。取出后加入对氨基苯磺酸溶液和α-萘胺溶液,保温后显色,测定530 nm处吸光度值,依据标准曲线查出超氧阴离子物质的量,通过计算获取O2−·生成速率;d. H2O2含量测定:称取5.0 g冷冻竹笋组织样品,加入5.0 mL预冷的丙酮,在通风橱中冰浴条件下研磨成匀浆后,于12000×g、4 ℃离心20 min,吸取1.0 mL提取液,按照与制作标准曲线相同的方法进行测定,需用−20 ℃预冷丙酮将离心得到的沉淀物反复洗涤2~3次,直到除去色素,再将沉淀用硫酸完全溶解后进行比色,计算获取H2O2含量。
1.2.2.3 硬度
取1.0~1.4 cm厚笋肉,用质构仪P/2探头进行穿刺实验,测试深度为4 mm,穿刺速度为0.5 mm/s,感应力为5 g,单位为N。
1.2.2.4 纤维素和木质素含量
参照Zeng等[12]的方法并稍作修改:a. 纤维素含量测定: 称取30.0 g竹笋样品,加50 mmol/L Tris-HCl 缓冲液(pH7.2)室温振荡提取3 h,后14000×g离心15 min,残渣用水、乙醇和丙酮洗涤,空气晾干;称取50 mg残渣, 加入5 mL 2 mmol/L三氟乙酸,120 ℃保温90 min;残渣用水和乙醇离心洗涤,后加入5 mL 12 mmol/L 硫酸溶解,稀释后定容,恩酮作为显色剂进行比色定量;b. 木质素含量测定:称取50.0 g竹笋样品,加20 mL浓度72%的H2SO4,研磨匀浆,于室温下静置6 h,混合液转入500 mL平底烧瓶,加入200 mL去离子水,100 ℃回流2.5 h,接着趁热过滤,用90 ℃热去离子水反复洗涤,105 ℃烘干至恒重,结果以鲜重百分比表示。
1.2.2.5 PAL、CAD、POD、PPO活性
PAL、POD、PPO活性参照曹建康等[11]的方法,CAD活性测定参照Zeng等[12]的方法并稍作修改:a. PAL活性测定:称取3.0 g冷冻笋肉,冰浴研磨成匀浆,而后离心,取2支试管,都分别加入3.0 mL 50 mmol/L、pH8.8硼酸缓冲液、0.5 mL 20 mmol/L L-苯丙氨酸溶液,两支试管中分别加入0.5 mL酶提取液和0.5 mL煮沸5 min的失活酶液作为对照,37 ℃保温60 min 后,加入0.1 mL 6 mol/L盐酸终止反应,与波长290 nm处测定吸光度值;b. POD活性测定:称取3.0 g冷冻笋肉,加入5.0 mL提取缓冲液,冰浴研磨成匀浆,离心取上清液。反应体系为:3.0 mL 25mmol/L 愈创木酚溶液和0.5 mL酶提取液,加入200 μL 0.5 mol/L H2O2溶液迅速混合启动反应,于470 nm处测定吸光度值;c. PPO活性:称取3.0 g冷冻笋肉,加入5.0 mL提取缓冲液,冰浴研磨成匀浆,离心取上清液。反应体系为:4.0 mL 50 mmol/L 、pH5.5的乙酸-乙酸钠缓冲液 溶液和1 mL 50 mmol/L邻苯二酚溶液,加入100 μL 酶提取液,于420 nm处测定吸光度值;d. CAD活性测定:称取5.0 g冷冻笋肉,加入10 mL Tris-HCl 缓冲液提取(200 mmol/L、pH7.5),研磨提取后14000×g 离心 15 min。反应体系为:100 mmol/L Tris-HCl 缓冲液(pH8.8)、20 mmol/L 松柏醇、5 mmol/L NADP+和50 μL酶提取液,400 nm波长下测定吸光度值。
1.2.2.6 SOD、CAT活性
参照Li等[13]的方法并稍作修改:称取5.0 g冷冻笋肉,加入5.0 mL 0.2 mmol/L磷酸缓冲液(pH7.8),冰浴研磨成匀浆,而后4 ℃、 8000×g离心 10 min,取上清液。a. SOD活性测定:取5支试管,各加入提取液0.05 mL(作为对照的2支试管以缓冲液代替),2.25 mL pH7.8、50 mmol/L的磷酸盐缓冲液,0.2 mL 195 mmol/L的蛋氨酸溶液,0.1 mL 1 mmol/L的EDTA溶液,0.2 mL 1.125 mmol/L的NBT溶液,再加入0.1 mL 60 mmol/L的核黄素溶液,混匀后将1支对照管置于暗处,其它各管置于4000 lx光强度下反应30 min,迅速取出,置于暗处终止反应。以不照光管作为空白参比调零,迅速测定波长560 nm下其它各管的吸光度值;b. CAT活性测定:吸取2.0 mL蒸馏水,再加入1.0 mL 0.2% H2O2,最后加入0.1 mL提取液,迅速混合,同时开始计时。以蒸馏水为参比,于波长240 nm下测定吸光度值。
1.2.2.7 木质素代谢和褐变相关酶基因表达
参照Zheng等[14]和戴丹等[15]的方法并稍作修改。逆转录实验采用SuperScript™ II 1st Strand cDNA Synthesis Kit进行逆转录试验;Real-time PCR 检测:用多重实时荧光定量 PCR 仪进行扩增,引物及条件如表1,扩增总体系为 25 μL,反应体系共25 μL,包括:ddH2O 10.5 μL,SYBR Premix Ex TaqTM(2×)12.5 μL,PCR-F(10 μmol/L)0.5 μL,PCR-R(10 μmol/L)0.5 μL,模板cDNA1.0 μL。反应条件:95 ℃预变性1 min;50个循环(95 ℃变性10 s;60 ℃退火25 s,收集荧光);在55~95 ℃之间分析熔解曲线。
表 1 定量 PCR 引物序列及反应条件Table 1. Real-time PCR primers and conditions物种名称 基因名称 基因序列号 引物序列 扩增长度(bp) 溶解温度(℃) Phyllostachys edulis(毛竹) Actin FJ601918.1 F:TGCCCTTGATTATGAGCAGG
R:AACCTTTCTGCTCCGATGGT108 60 Phyllostachys edulis(毛竹) cinnamyl alcohol dehydrogenase
(CAD)EF549577.1 F:GGTCACCGTGATCAGCTCGT
R:TTACCTTCATTTGCTCGGCG104 60 Phyllostachys edulis(毛竹) polyphenol oxidase (PPO) PH01000032G1250 F:ATAGCGCTGATGAAGGCGAT
R:TGGATCTGCACGTTCAGCTC132 60 Phyllostachys edulis(毛竹) Peroxidase (POD) FP092331.1 F:GGCATGATCCACCAGCTCAC
R:TTCCTCCTGATCTCCCCCTG116 60 Phyllostachys prominens(高节竹) phenylalanine ammonia-lyase
(PAL1)AY450643.2 F:CTCCGTGTTTGCCAAGGTTG
R:GAGCGGCCCTCAGTGATTCT132 60 Phyllostachys edulis(毛竹) superoxide dismutase (SOD) PH01002962G0030 F:GCCACCTACGTCGCCAACTA
R:GAACTTGATGGCGCTCTGGA104 60 Bambusa emeiensis(慈竹) catalase(CAT) PH01000019G1840 F:CATGCATGCGTTTGGATTTG
R:CAGAATAGCCGCTTTGAGCG102 60 1.3 数据处理
实验采用随机设计法设计3组生物学重复实验。数值表示为平均值±标准差(n=3),统计学差异分析采用SPSS软件进行Duncan’s multiple range test 检测,当P<0.05时,认为处理组之间存在显著差异。
2. 结果与分析
2.1 褪黑素处理对黄甜竹笋的硬度和基部切面褐变的影响
2.1.1 褪黑素处理对黄甜竹笋的硬度的影响
冷藏过程中,黄甜竹笋笋肉组织的硬度随着冷藏时间的延长呈逐渐上升趋势,MT处理在9~15 d内显著(P<0.05)减缓了笋肉硬度的上升,相较于对照组,褪黑素处理组的笋肉组织硬度下降幅度为20%~41%;在冷藏第15 d时,褪黑素处理组的去壳黄甜竹笋硬度较0 d增加了2倍,对照组硬度较0 d增加了2.83倍(图1)。
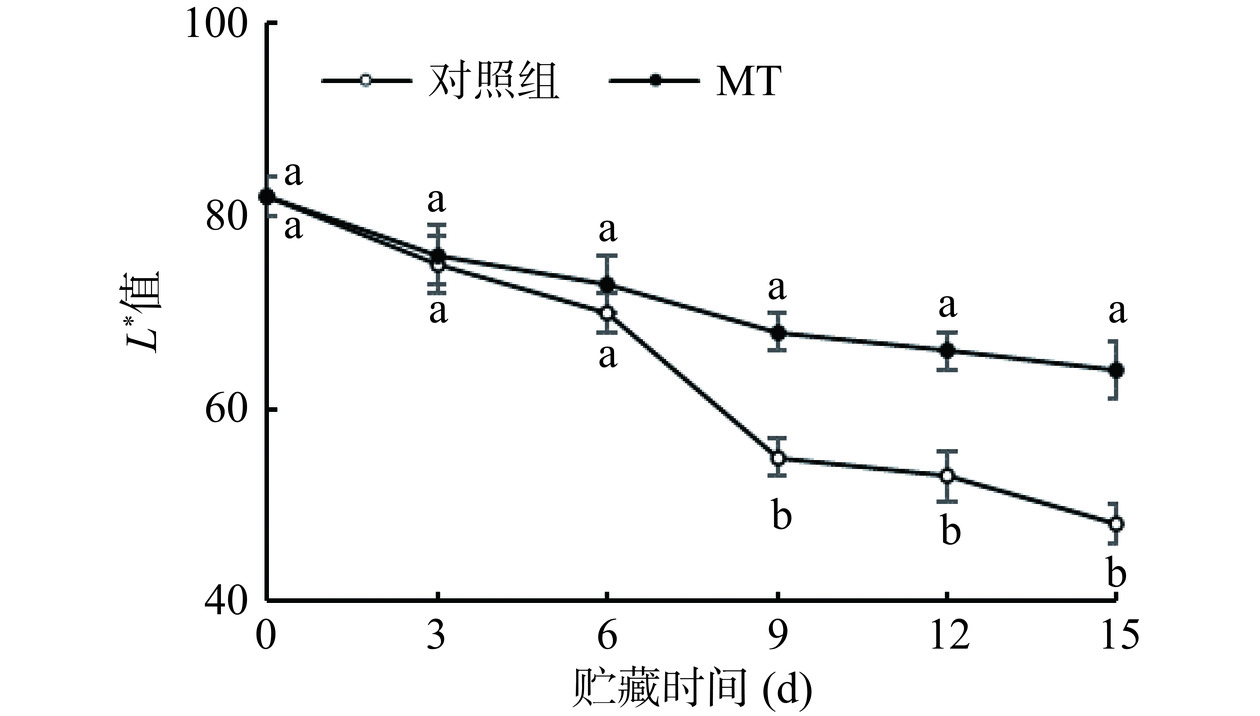
由图2可见,冷藏15 d后,对照组去壳黄甜竹笋的笋体和基部切面褐变明显,而褪黑素处理组的笋体和基部切面仅颜色较刚去壳时变暗一些,基本呈现均匀的棕黄色,具有较好的外观品质。同时,冷藏过程中,黄甜竹笋的L*值呈逐渐下降趋势,且褪黑素处理组的黄甜竹笋L*值在9~15 d高于对照组且差异显著(P<0.05),增幅为24%~33%;褪黑素处理组的去壳黄甜竹笋基部切面色差L*较0 d降低了22%,对照组L*较0 d降低了41%(图3)。说明褪黑素处理能够抑制去壳黄甜竹笋笋肉组织硬度增加和基部切面L*下降。
2.2 褪黑素处理对去壳黄甜竹笋的木质化影响
2.2.1 褪黑素处理对木质素和纤维素含量影响
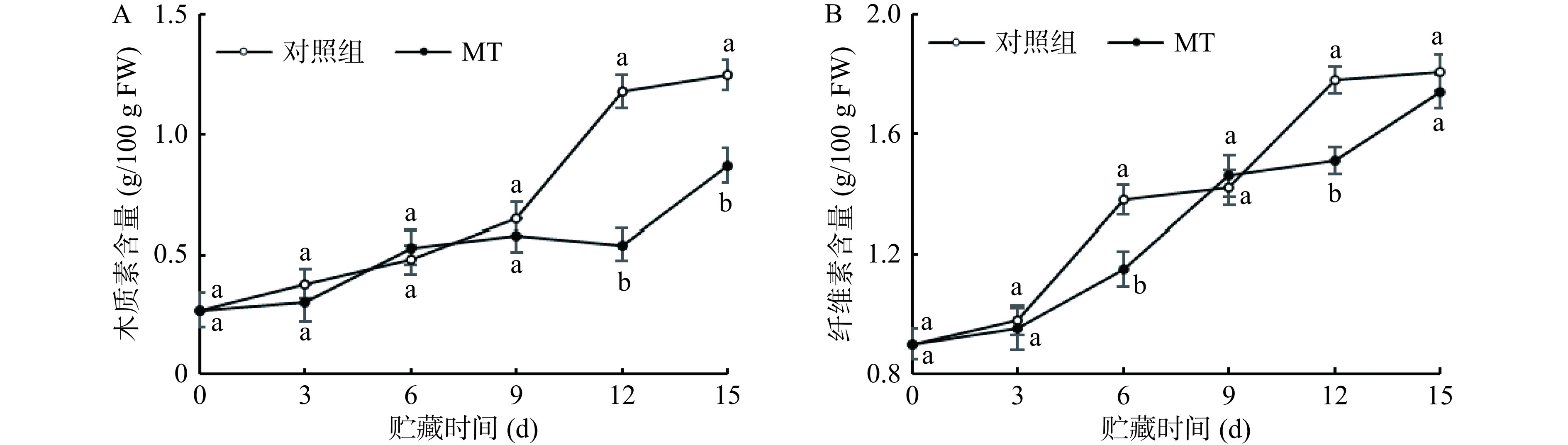
冷藏过程中,黄甜竹笋笋肉组织的木质素、纤维素含量随着冷藏时间的延长呈逐渐上升趋势,褪黑素处理组在12~15 d内显著(P<0.05)抑制了木质素含量的累积,相较于对照组,褪黑素处理组的黄甜竹笋中木质素含量的降低幅度为30%~54%;在第6、12 d显著(P<0.05)抑制了纤维素含量的累积,相较于对照组,褪黑素处理的黄甜竹笋中纤维素含量的降低幅度分别为17%和15%。在冷藏第15 d时,褪黑素处理组的去壳黄甜竹笋木质素和纤维素较0 d分别增加了2.22倍和0.93倍,对照组对应指标较0 d分别增加了3.63倍和1.01倍。说明褪黑素处理能够有效抑制去壳黄甜竹笋中木质素和纤维素的累积(图4A和图4B)。
2.2.2 褪黑素处理对PAL、POD和CAD活性及基因表达的影响
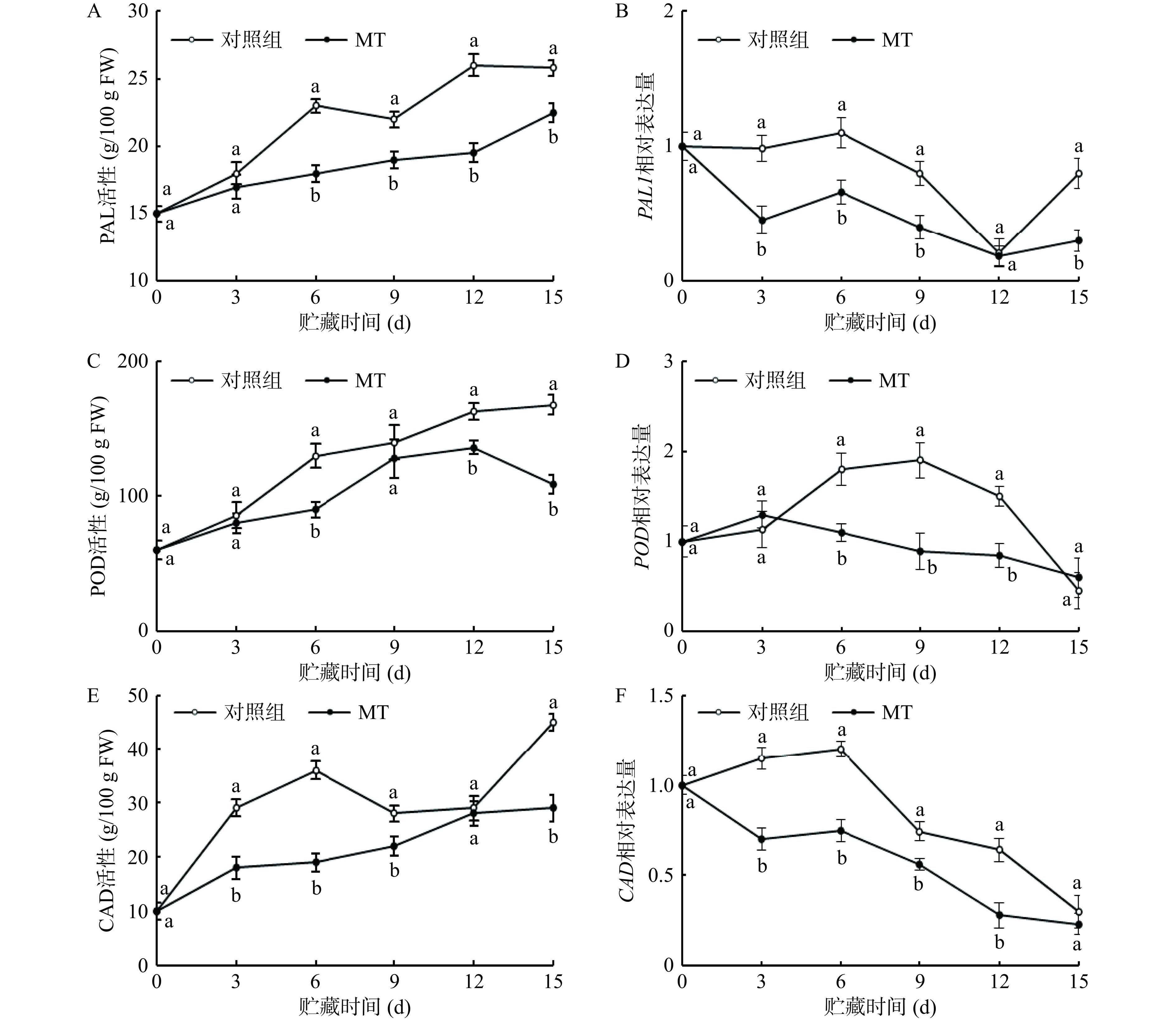
如图5所示,对照组与褪黑素处理组黄甜竹笋中PAL和POD活性在贮藏期内均总体呈现上升趋势,且伴有明显波动,褪黑素处理组黄甜竹笋中PAL和POD活性分别在6~15 d、6 d和12~15 d内显著(P<0.05)低于对照组,降低的幅度分别为14%~25%、31%和17%~35%(图5A和图5C);对照组黄甜竹笋中CAD活性呈先上升后下降再上升的波动变化,而褪黑素处理组黄甜竹笋中CAD活性呈平缓上升,且在3~9 d和第15 d低于对照组且差异显著(P<0.05),降低的幅度分别为21%~47%和36%(图5E)。
在冷藏期间,对照组中PAL1基因相对表达水平先上升而后下降再上升,褪黑素处理组黄甜竹笋中PAL1先下降后上升再下降而后平缓上升,褪黑素处理组黄甜竹笋中PAL1基因相对表达水平在第3~9 d、第15 d显著(P<0.05)低于对照组,分别降低了34%~54%和63%(图5B);对照组和褪黑素处理组黄甜竹笋中POD基因相对表达水平均先上升后下降,褪黑素处理在6~12 d显著(P<0.05)下调了黄甜竹笋中POD基因相对表达水平,相较于对照组,下调幅度为39%~53%(图5D);对照组中CAD基因相对表达水平总体先上升后下降,而褪黑素处理组黄甜竹笋中CAD基因相对表达水平总体呈先下降后上升再下降的趋势,褪黑素处理组的黄甜竹笋中CAD基因相对表达水平在3~12 d显著(P<0.05)低于对照组,降低的幅度为24%~56%(图5F)。以上结果说明褪黑素处理有助于抑制木质素代谢关键酶活性,并下调对应基因表达水平,进而抑制木质化进程。
2.3 褪黑素处理对去壳黄甜竹笋褐变影响
2.3.1 褪黑素处理对MDA含量和电导率的影响
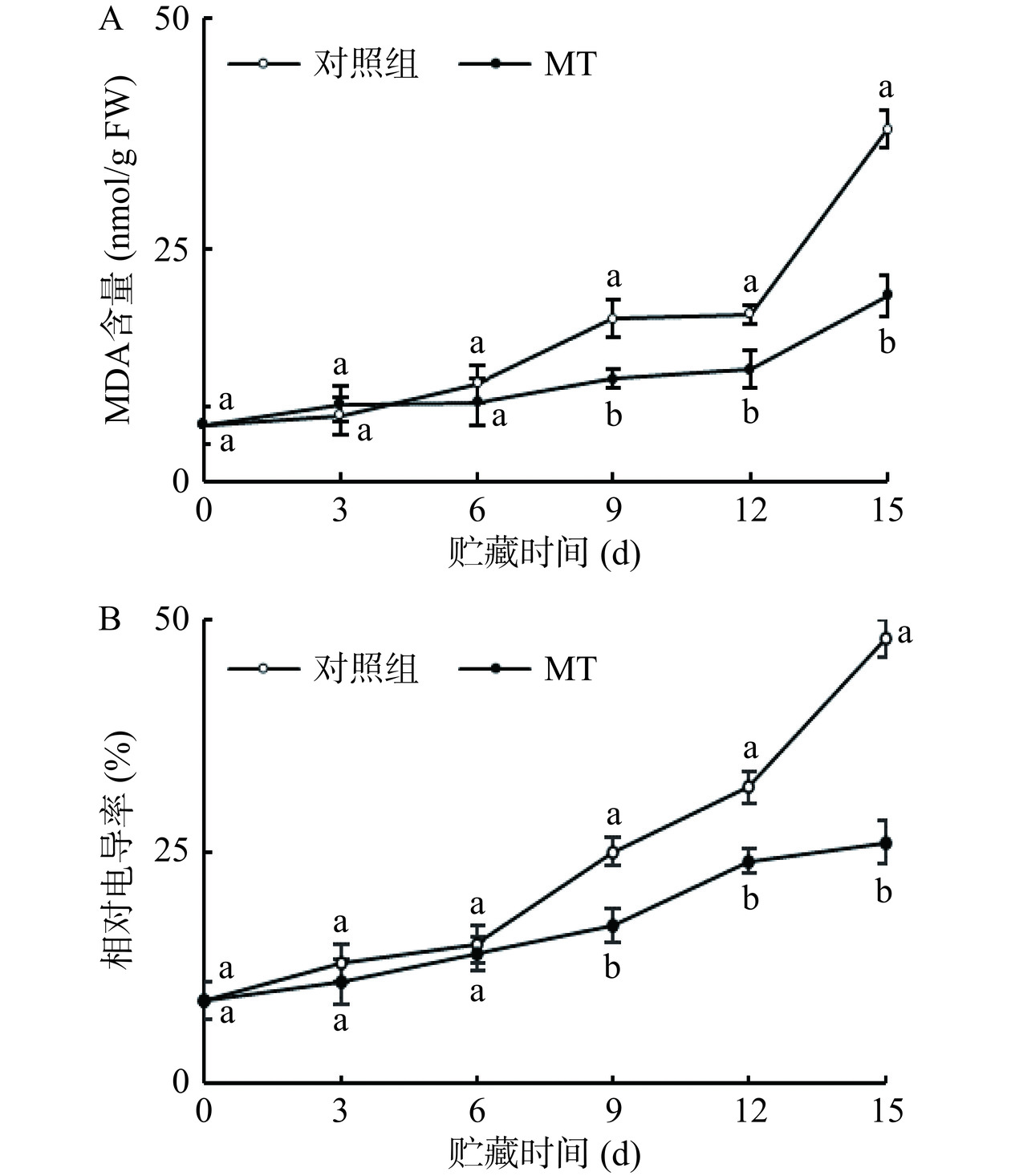
MDA含量随着冷藏时间的延长也呈现上升趋势,在贮藏的前6 d内,褪黑素处理组的黄甜竹笋的MDA含量与对照组差异不明显,而后9~15 d显著(P<0.05)低于对照组,降低幅度为33%~47%(图6A)。冷藏过程中,黄甜竹笋的电导率随着贮藏时间的延长逐渐升高,在冷藏的0~6 d内,褪黑素处理组黄甜竹笋的电导率与对照组差异不明显,其后的9~15 d内,显著(P<0.05)低于对照组,降低幅度为25%~46%(图6B)。在冷藏第15 d时,褪黑素处理组的去壳黄甜竹笋MDA含量和相对电导率较0 d分别增加了2.33倍和1.89倍,对照组对应指标较0 d分别增加了5.33倍和4.33倍。说明,褪黑素处理能够有效抑制去壳黄甜竹笋MDA累积和相对电导率上升。
2.3.2 褪黑素处理对活性氧生成及其清除酶系的影响
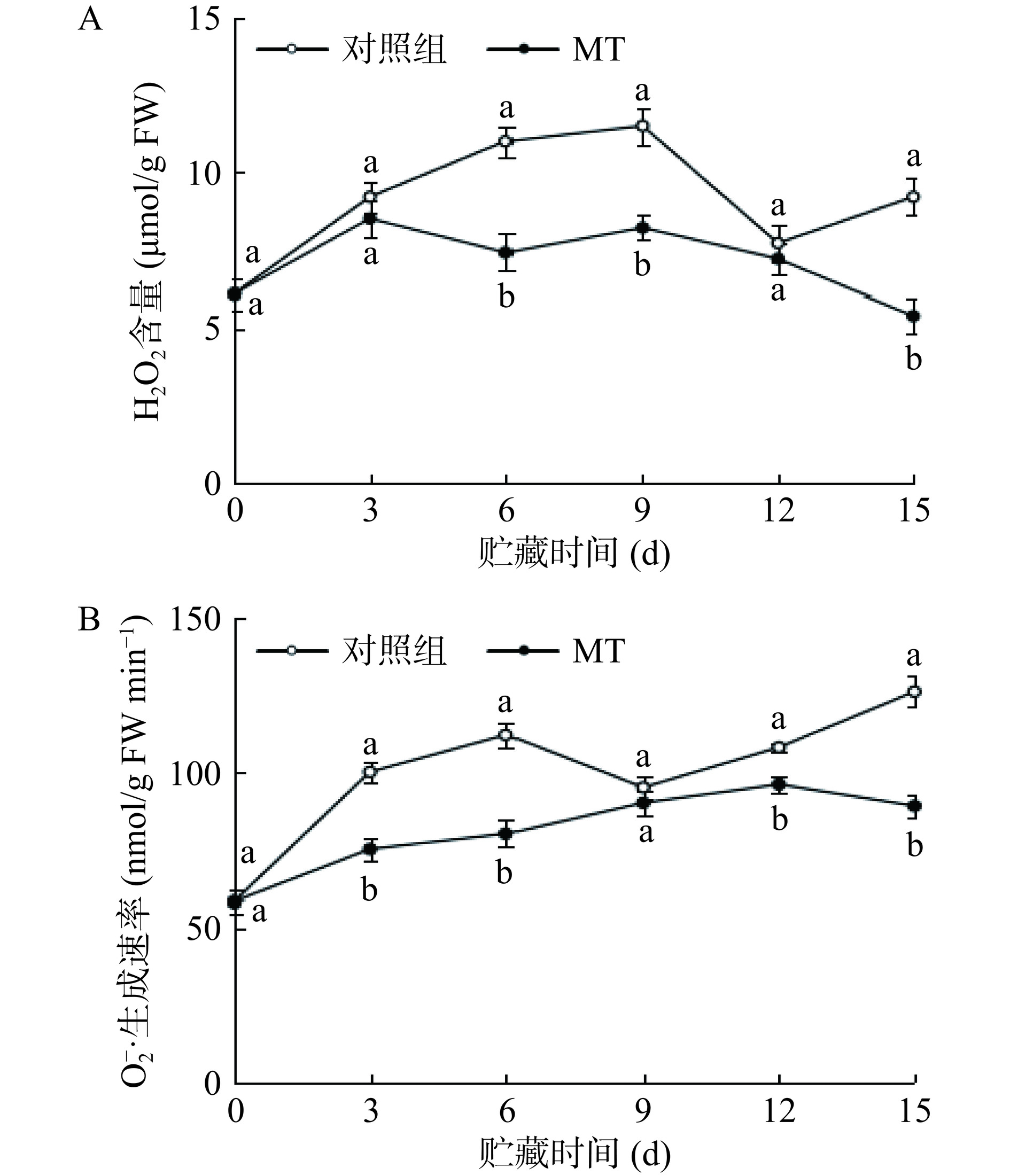
2.3.2.1 褪黑素处理对H2O2含量和O2−·生成速率的影响
H2O2含量随着冷藏时间的延长总体呈先上升后下降的波动变化趋势,在冷藏的6~9 d和第15 d,褪黑素处理组黄甜竹笋的H2O2含量显著(P<0.05)低于对照组,降低幅度分别为29%~33%和41%(图7A)。冷藏期间,对照组中O2−·的生成速率呈先上升后下降在上升的趋势,褪黑素处理组黄甜竹笋中O2−·的生成速率呈缓慢上升而后下降的趋势,在冷藏的3~6 d和第12~15 d,褪黑素处理组黄甜竹笋的O2−·生成速率显著(P<0.05)低于对照组,降低的幅度分别为25%~29%和12%~29%(图7B)。在冷藏第15 d时,褪黑素处理组的去壳黄甜竹笋H2O2含量较0 d减少了11%,O2−·生成速率较贮藏初期增加了53%,而未经褪黑素处理的二者则分别增加了51%和116%。说明褪黑素处理能够有效抑制去壳黄甜竹笋H2O2累积和O2−·生成速率上升,从而能有效地降低去壳黄甜竹笋贮藏期间细胞的活性氧胁迫。
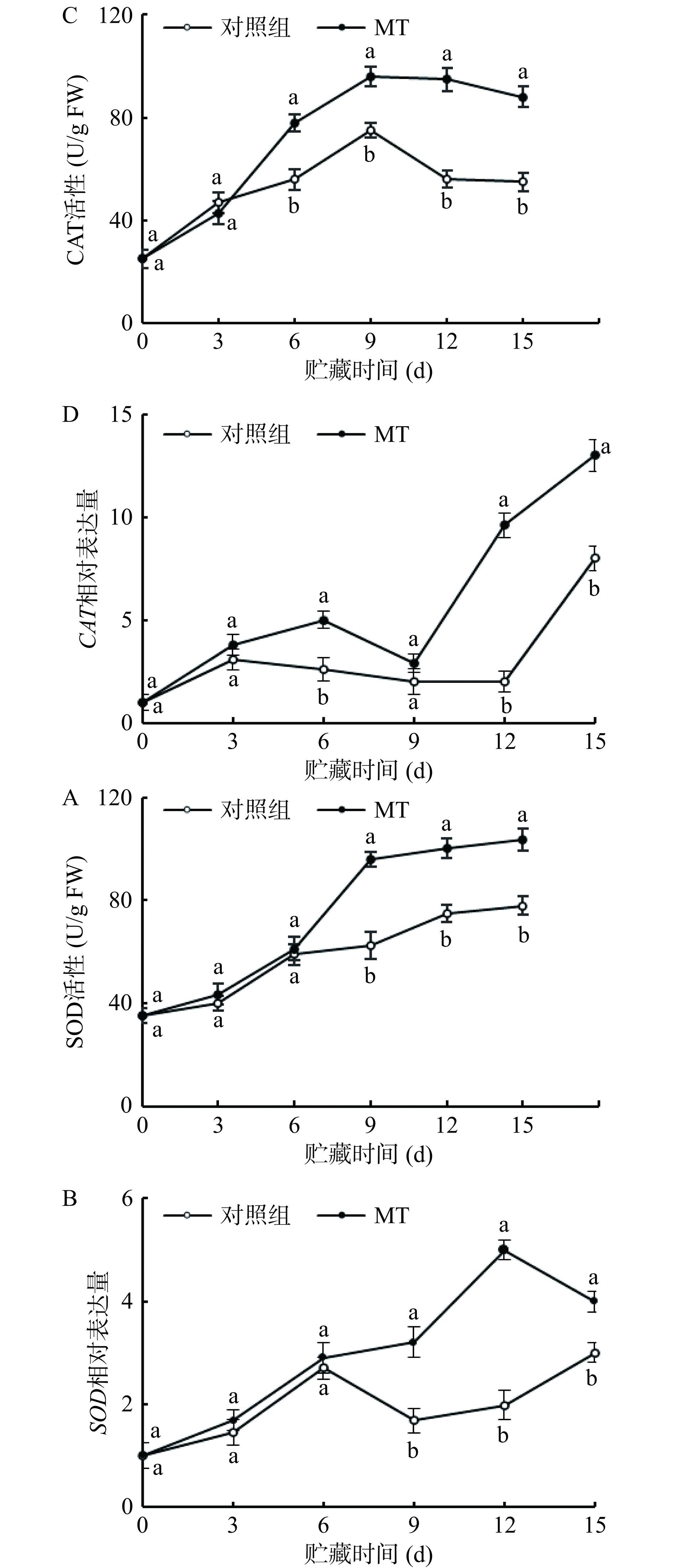
2.3.2.2 褪黑素处理对SOD和CAT活性和基因表达的影响
对照组与褪黑素处理组黄甜竹笋中SOD活性在贮藏期内总体呈现上升趋势且伴有轻微波动,CAT活性在贮藏期内总体呈现先上升后下降趋势且伴有波动,褪黑素处理组黄甜竹笋中SOD和CAT活性分别在9~15 d和6~15 d内显著(P<0.05)高于对照组,增幅分别为33%~54%和 28%~70%(图8A和图8C)。冷藏期间,对照组中SOD基因相对表达水平呈先上升后下降再上升的趋势,褪黑素处理组的黄甜竹笋中SOD基因相对表达水平总体呈先上升后下降的趋势;对照组与褪黑素处理组的黄甜竹笋中CAT基因相对表达水平总体呈先上升而后下降再上升的趋势且伴有较大波动,褪黑素处理组在9~15 d显著(P<0.05)提高了黄甜竹笋中SOD基因相对表达水平,相较于对照组,增幅为33%~153%(图8B),在第6 d和12~15 d显著(P<0.05)提高了黄甜竹笋中CAT基因相对表达水平,相较于对照,增幅分别为92%和63%~380%(图8D)。
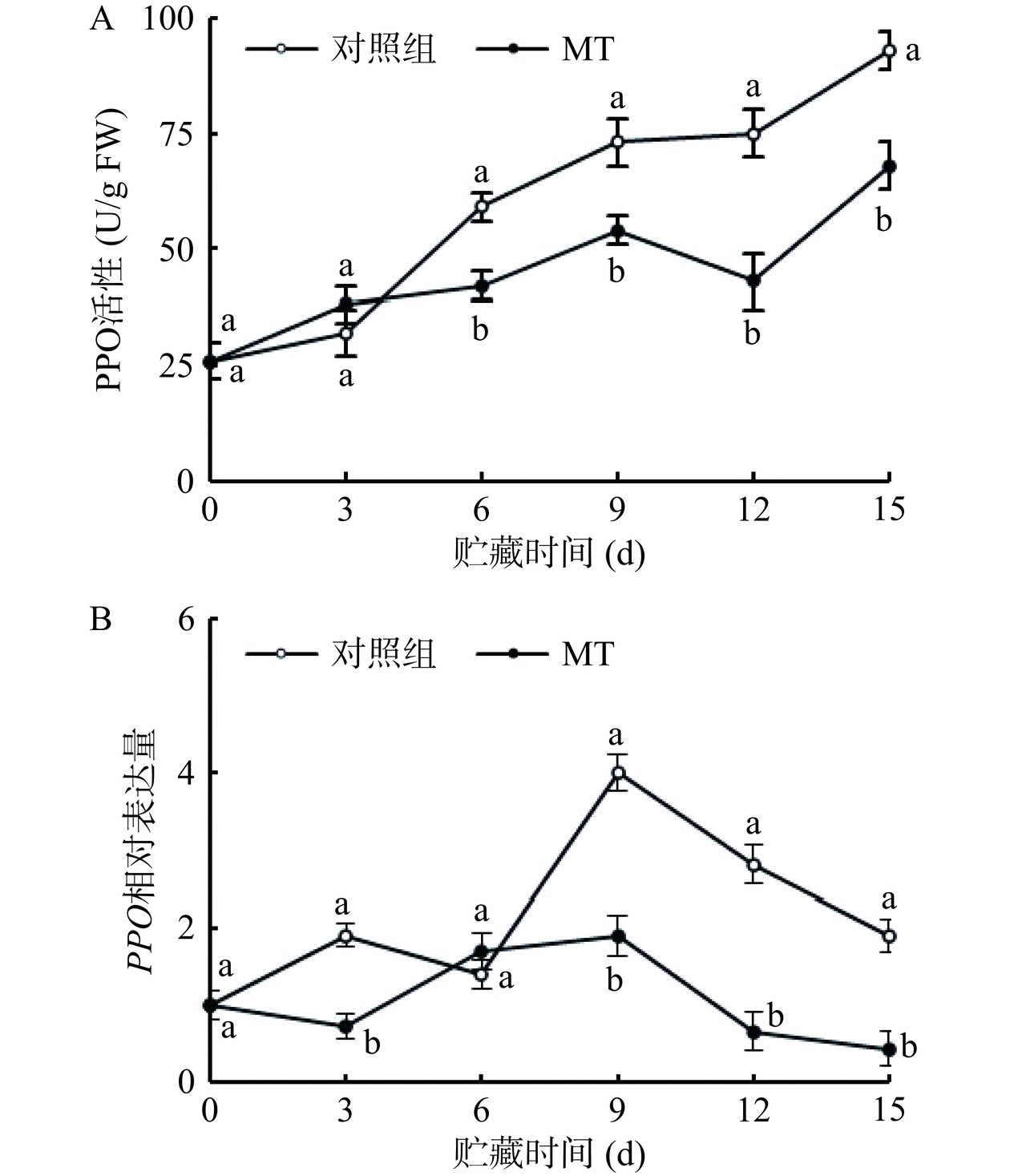
2.3.3 褪黑素处理对黄甜竹笋PPO活性和基因表达的影响
在贮藏期内对照组与褪黑素处理组黄甜竹笋中PPO活性总体呈现上升趋势,伴有轻微波动,褪黑素处理组黄甜竹笋中PPO酶活性6~15 d内显著(P<0.05)低于对照组,降低的幅度为26%~43%(图9A)。对照组与褪黑素处理组的黄甜竹笋中PPO基因相对表达水平冷藏期间总体呈先上升而后下降的趋势且伴有波动,褪黑素处理在第3 d和9~15 d显著(P<0.05)降低了黄甜竹笋中PPO基因相对表达水平,相较于对照组,降低的幅度分别为62%和53%~77%(图9B)。
3. 讨论
竹笋采后极易发生木质化,表现为木质素和纤维素快速累积,导致笋肉硬度增加、食用品质下降[12,14,16]。植物组织中的木质素经由苯丙烷类途径合成,是一系列酶促反应联动的结果。PAL、CAD和POD在催化合成木质素单体并聚合成为木质素大分子的代谢中起主要作用[12,16]。采后适度热处理[17]和外源草酸[16]均可通过抑制PAL、CAD和POD活性进而延缓笋的木质化,延缓笋肉硬度上升。而木质素的合成必然受到相关关键酶的基因表达调控。例如,EjCAD1、EjPOD两个基因参与了调控枇杷果实中木质素合成[18],梨组织中木质素合成则受到PpCAD1和PpCAD2基因的调控[19]。另外,许多研究表明,PAL、CAD和POD活性与对应基因的表达协同调控木质素的合成 [18,20−21]。Yang等[7]发现,褪黑素处理显著抑制了采后20 ℃下贮藏的茭白中PAL、CAD 和 POD活性和对应基因表达量,进而延缓了茭白的木质素累积。Li等[13]研究指出,外源褪黑素抑制了去壳高节笋中PAL、POD和CAD活性和调控次生细胞壁生物合成的转录因子SND2、KNAT7、MYB20和MYB85的表达,进而延缓了笋肉组织木质化。本研究结果也表明,褪黑素处理降低了黄甜竹笋中PAL、CAD和POD活性,下调了PAL1、POD和CAD的基因表达水平,进而延缓了木质素和纤维素的累积,抑制了笋肉木质化。
除了木质化外,竹笋贮藏期间还易发生褐变。果蔬褐变的发生主要是在有氧条件下,酚类底物在PPO、POD等酶催化下发生酶促反应的结果[22]。研究证明,活性氧(reactive oxygen species,ROS)很大程度上参与了细胞衰老尤其是对细胞膜的破坏[23],因为活性氧水平的提高不仅会改变细胞膜的完整性,也会与不饱和脂肪酸发生反应进而导致脂质过氧化,进而加速组织褐变[24]。在果蔬成熟过程中,抗氧化酶如:SOD、POD、CAT、APX等在清除活性氧方面起着重要的作用,SOD将O2−·转化为H2O2,同时CAT、POD将H2O2转化为H2O和O2[25−26],SOD和清除H2O2的酶系的协同作用共同赋予了细胞抗氧化的能力和对活性氧胁迫的耐受性。相关研究表明,褪黑素处理之所以能够减轻香蕉[27]、双孢菇[24]、红毛丹[28]、鲜切甘薯[23]褐变均与其抑制了组织中的PPO、POD的活性以及下降了其基因表达量有关。而如水杨酸处理雷竹笋[29]、外源草酸处理去壳高节笋[16]同样也是由于降低了POD和PPO活性从而延缓了褐变。除了PPO和POD外,活性氧及其清除酶系也可能参与了采后果实褐变过程。在红毛丹[28]、鲜切甘薯[23]研究中均发现,外源褪黑素处理除了可抑制果实中POD和PPO活性外,还同时提高SOD和CAT活性,抑制H2O2和MDA累积,延缓相对电导率上升。另外,草酸处理能抑制去壳马蹄笋褐变中也存在类似的机制[15]。本研究同样表明,褪黑素处理显著(P<0.05)抑制了冷藏下去壳黄甜竹笋中PPO和POD活性上升,下调了PPO和POD基因表达水平;提高了SOD和CAT活性,同时上调了SOD和CAT基因表达水平,延缓了H2O2含量的累积和降低了O2−·的生成速率,进而抑制了笋肉组织MDA的累积和电导率的上升,有效延缓了笋基部切面褐变。
以上结果综合表明,褪黑素处理能够有效调控冷藏下去壳黄甜竹笋的木质素合成代谢和褐变关键酶活性及基因表达水平,进而达到延缓木质化和抑制褐变的效果。
4. 结论
采后0.2 mmol/L褪黑素处理显著(P<0.05)抑制了冷藏下去壳黄甜竹笋中PPO和POD活性,下调了PPO和POD基因表达水平;提高了SOD和CAT活性,同时上调了SOD和CAT基因表达水平,抑制了H2O2的累积和O2−·生成速率上升,抑制了笋肉组织MDA的累积和电导率的上升,有效延缓了笋基部切面褐变;同时褪黑素处理也显著(P<0.05)地下调了PAL1、POD和CAD的基因表达水平,抑制了冷藏下黄甜竹笋中PAL、CAD和POD活性,延缓了笋肉组织中木质素累积,保持了较好的感官和食用品质。
-
表 1 定量 PCR 引物序列及反应条件
Table 1 Real-time PCR primers and conditions
物种名称 基因名称 基因序列号 引物序列 扩增长度(bp) 溶解温度(℃) Phyllostachys edulis(毛竹) Actin FJ601918.1 F:TGCCCTTGATTATGAGCAGG
R:AACCTTTCTGCTCCGATGGT108 60 Phyllostachys edulis(毛竹) cinnamyl alcohol dehydrogenase
(CAD)EF549577.1 F:GGTCACCGTGATCAGCTCGT
R:TTACCTTCATTTGCTCGGCG104 60 Phyllostachys edulis(毛竹) polyphenol oxidase (PPO) PH01000032G1250 F:ATAGCGCTGATGAAGGCGAT
R:TGGATCTGCACGTTCAGCTC132 60 Phyllostachys edulis(毛竹) Peroxidase (POD) FP092331.1 F:GGCATGATCCACCAGCTCAC
R:TTCCTCCTGATCTCCCCCTG116 60 Phyllostachys prominens(高节竹) phenylalanine ammonia-lyase
(PAL1)AY450643.2 F:CTCCGTGTTTGCCAAGGTTG
R:GAGCGGCCCTCAGTGATTCT132 60 Phyllostachys edulis(毛竹) superoxide dismutase (SOD) PH01002962G0030 F:GCCACCTACGTCGCCAACTA
R:GAACTTGATGGCGCTCTGGA104 60 Bambusa emeiensis(慈竹) catalase(CAT) PH01000019G1840 F:CATGCATGCGTTTGGATTTG
R:CAGAATAGCCGCTTTGAGCG102 60 -
[1] TIJERO V, MUNOZ P, MUNNE-BOSCH S. Melatonin as an inhibitor of sweet cherries ripening in orchard trees[J]. Plant Physiology and Biochemistry,2019,140:88−95. doi: 10.1016/j.plaphy.2019.05.007
[2] WANG F, ZHANG X P, YANG Q Z, et al. Exogenous melatonin delays postharvest fruit senescence and maintains the quality of sweet cherries[J]. Food Chemistry,2019,301:125311. doi: 10.1016/j.foodchem.2019.125311
[3] WANG X, LIANG D, XIE Y, et al. Melatonin application increases accumulation of phenols substances in kiwifruit during storage[J]. Emirates Journal of Food and Agriculture,2019,31(5):361−367.
[4] WANG T, HU M J, YUAN D B, et al. Melatonin alleviates pericarp browning in litchi fruit by regulating membrane lipid and energy metabolisms[J]. Postharvest Biology and Technology,2020,160:111066. doi: 10.1016/j.postharvbio.2019.111066
[5] WANG D, CHEN Q Y, CHEN W W, et al. Melatonin treatment maintains quality and delays lignification in loquat fruit during cold storage[J]. Scientia Horticulturae,2021,284:110126. doi: 10.1016/j.scienta.2021.110126
[6] 楼君, 索金伟, 张慧, 等. 褪黑素处理对高节竹笋低温贮藏过程中木质化的影响[J]. 林业科学,2019,55(12):41−49. [LOU J, SUO J W, ZHANG H, et al. Effect of melatonin treatment on lignification of Phyllostachys prominens shoots during low temperature storage[J]. Scientia Silvae Sinicae,2019,55(12):41−49.] LOU J, SUO J W, ZHANG H, et al. Effect of melatonin treatment on lignification of Phyllostachys prominens shoots during low temperature storage[J]. Scientia Silvae Sinicae, 2019, 55(12): 41−49.
[7] YANG B Q, HAN Y C, WU W J, et al. Impact of melatonin application on lignification in water bamboo shoot during storage[J]. Food Chemistry:X,2022,13:100254.
[8] LIU C H, ZHENG H H, SHENG K L, et al. Effects of melatonin treatment on the postharvest quality of strawberry fruit[J]. Postharvest Biology and Technology,2018,139:47−55. doi: 10.1016/j.postharvbio.2018.01.016
[9] 贾乐, 韩延超, 房祥军, 等. 褪黑素处理对香菇采后品质及活性氧代谢的影响[J]. 食品科学,2021,42(23):229−236. [JIA L, HAN Y C, FANG X J, et al. Effect of melatonin treatment on postharvest quality and reactive oxygen species metabolism of Lentinus edodes[J]. Food Science,2021,42(23):229−236.] JIA L, HAN Y C, FANG X J, et al. Effect of melatonin treatment on postharvest quality and reactive oxygen species metabolism of Lentinus edodes[J]. Food Science, 2021, 42(23): 229−236.
[10] 代惠芹, 董桂君, 刘树泽, 等. 褪黑素处理对双孢蘑菇采后贮藏品质的影响[J]. 食用菌学报,2021,37(6):143−149. [DAI H Q, DONG G J, LIU S Z, et al. Effect of melatonin on postharvest storage quality of Agaricus bisporus[J]. Acta Edulis Fungi,2021,37(6):143−149.] DAI H Q, DONG G J, LIU S Z, et al. Effect of melatonin on postharvest storage quality of Agaricus bisporus[J]. Acta Edulis Fungi, 2021, 37(6): 143−149.
[11] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007:101−105,142−144. [CAO J K, JIANG W B, ZHAO Y M. Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M]. Beijing:China Light Industry Press, 2007:101−105,142−144.] CAO J K, JIANG W B, ZHAO Y M. Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M]. Beijing: China Light Industry Press, 2007: 101−105,142−144.
[12] ZENG F F, LUO Z S, XIE J W, et al. Gamma radiation control quality and lignification of bamboo shoots (Phyllostachys praecox f. prevernalis.) stored at low temperature[J]. Postharvest Biology and Technology, 2015, 102:17−24.
[13] LI C T, SUO J W, XUAN L L, et al. Bamboo shoot-lignification delay by melatonin during low temperature storage[J]. Postharvest Biology and Technology, 2019, 156:110933.
[14] ZHENG J, LI S E, MARATAB A, et al. Effects of UV-B treatment on controlling lignification and quality of bamboo (Phyllostachys prominens) shoots without sheaths during cold storage[J]. Journal of Integrative Agriculture, 2020, 19(5):1387−1395.
[15] 戴丹, 郑剑, 周成敏, 等. 草酸对冷藏去壳马蹄笋的保鲜效果及机制研究[J]. 核农学报,2021,35(10):2294−2304. [DAI D, ZHENG J, ZHOU C M, et al. Effects of oxalic acid on edible quality of bamboo shoots (Bambusa oldhami) without sheaths during cold storage and the related mechanism[J]. Journal of Nuclear Agricultural Sciences,2021,35(10):2294−2304.] DAI D, ZHENG J, ZHOU C M, et al. Effects of oxalic acid on edible quality of bamboo shoots (Bambusa oldhami) without sheaths during cold storage and the related mechanism[J]. Journal of Nuclear Agricultural Sciences, 2021, 35(10): 2294−2304.
[16] ZHENG J, LI S E, XU Y H, ZHENG X L. Effect of oxalic acid on edible quality of bamboo shoots (Phyllostachys prominens) without sheaths during cold storage[J]. LWT-Food Science and Technology,2019,109:194−200. doi: 10.1016/j.lwt.2019.04.014
[17] LUO Z S, FENG S M, PANG J, et al. Effect of heat treatment on lignification of postharvest bamboo shoots (Phyllostachys praecox f. prevernalis.) [J]. Food Chemistry, 2012, 135(4):2182−2187.
[18] SHAN L L, LI X, WANG P, et al. Characterization of cDNAs associated with lignification and their expression profiles in loquat fruit with different lignin accumulation[J]. Planta,2008,227(6):1243. doi: 10.1007/s00425-008-0696-2
[19] LU G L, LI Z J, ZHANG X F, et al. Expression analysis of lignin-associated genes in hard end pear (Pyrus pyrifolia Whangkeumbae) and its response to calcium chloride treatment conditions[J]. Journal of Plant Growth Regulation,2015,34(2):251−262. doi: 10.1007/s00344-014-9461-x
[20] BAUCHER M, HALPIN C, PETIT-CONIL M, et al. Lignin:genetic engineering and impact on pulping[J]. Critical Reviews in Biochemistry and Molecular Biology,2003,38(4):305−350. doi: 10.1080/10409230391036757
[21] ANTEROLA A M, LEWIS N G. Trends in lignin modification:a comprehensive analysis of the effects of genetic manipulations/mutations on lignification and vascular integrity[J]. Phytochemistry,2002,61(3):221−294. doi: 10.1016/S0031-9422(02)00211-X
[22] OLIVAS G I, MATTINSON D S, BARBOSA-CÁNOVAS G V. Alginate coatings for preservation of minimally processed ‘Gala’ apples[J]. Postharvest Biology and Technology,2006,45(1):89−96.
[23] LI Y X, ZHANG L, ZHANG L, et al. Exogenous melatonin alleviates browning of fresh-cut sweetpotato by enhancing anti-oxidative process[J]. Scientia Horticulturae,2022,297:110937. doi: 10.1016/j.scienta.2022.110937
[24] SHEKARI A, HASSANI R N, AGHDAM M S, et al. The effects of melatonin treatment on cap browning and biochemical attributes of Agaricus bisporus during low temperature storage[J]. Food Chemistry,2021,348:129074. doi: 10.1016/j.foodchem.2021.129074
[25] MONDAL K, SHARMA N S, MALHOTRA S P, et al. Antioxidant systems in ripening tomato fruits[J]. Biologia Plantarum,2004,48(1):49−53. doi: 10.1023/B:BIOP.0000024274.43874.5b
[26] MAGRI A, PETRICCIONE M. Melatonin treatment reduces qualitative decay and improves antioxidant system in highbush blueberry fruit during cold storage[J]. Journal of the Science of Food and Agriculture,2022,102(10):4229−4237. doi: 10.1002/jsfa.11774
[27] WANG Z Q, PU H L, SHAN S S, et al. Melatonin enhanced chilling tolerance and alleviated peel browning of banana fruit under low temperature storage[J]. Postharvest Biology and Technology,2021,179:111571. doi: 10.1016/j.postharvbio.2021.111571
[28] WEI D L, YANG J L, XIANG Y, et al. Attenuation of postharvest browning in rambutan fruit by melatonin is associated with inhibition of phenolics oxidation and reinforcement of antioxidative process[J]. Frontiers in Nutrition,2022,9:905006. doi: 10.3389/fnut.2022.905006
[29] LUO Z S, WU X, XIE Y, et al. Alleviation of chilling injury and browning of postharvest bamboo shoot by salicylic acid treatment[J]. Food Chemistry,2012,131(2):456−461. doi: 10.1016/j.foodchem.2011.09.007





 下载:
下载:


 下载:
下载:



