Optimization of Enzymatic Hydrolysis Preparation Process and Stability Evaluation of ACE Inhibitory Peptides from Antarctic Krill (Euphausia superba)
-
摘要: 优化建立南极磷虾蛋白源血管紧张素转化酶(Angiotensin-I converting enzyme,ACE)抑制肽的酶解制备工艺,并考察其稳定性。以脱脂南极磷虾粉为底物,以酶解产物的ACE抑制率为评价指标,从六种蛋白酶中筛选出制备南极磷虾ACE抑制肽的最佳蛋白酶为碱性蛋白酶;通过单因素实验和响应面试验优化确定最佳酶解工艺条件为:酶解时间3.4 h、料液比1:7(g/mL)、加酶量1.6%;在此条件下,酶解产物的ACE抑制率为74.37%±0.87%。该ACE抑制肽在温度20~100 ℃环境下具有良好的稳定性;在中性及弱碱性条件下较稳定,但在pH<7.0和pH>8.0条件下ACE抑制活性显著下降(P<0.05);经体外模拟胃肠道消化后仍能保持原有活性的86.96%。研究将为南极磷虾蛋白类健康食品和食源性多肽类降压药物的开发提供支撑。Abstract: Enzymatic hydrolysis preparation process of angiotensin-I converting enzyme (ACE) inhibitory peptides from Antarctic krill (Euphausia superba) was optimized and its stability was evaluated. Using the degreased Antarctic krill meal as the substrate and the ACE inhibition rate of enzymatic hydrolysates as the evaluation index, alkaline protease was selected as the optimal protease for preparing ACE inhibitory peptides from Antarctic krill among six types of proteases. The optimum enzymatic hydrolysis conditions were determined through single factor and response surface experiments, which were finally confirmed as follows: Enzymatic hydrolysis time of 3.4 h, material liquid ratio of 1:7 (g/mL) and enzyme dosage of 1.6%. Under these conditions, the ACE inhibition rate of enzymatic hydrolysates was 74.37%±0.87%. The obtained ACE inhibitory peptides exhibited good thermal stability at temperatures ranging from 20 ℃ to 100 ℃ and were relatively stable under neutral and weak alkaline conditions. The ACE inhibitory activity of the peptides decreased significantly under pH<7.0 and pH>8.0 conditions (P<0.05). The peptides could maintain 86.96% of the original ACE inhibitory activity after simulated gastrointestinal digestion in vitro. The present research provides scientific support for the development of Antarctic krill protein-derived healthy foods and food-derived peptides-based antihypertensive drugs.
-
南极磷虾(Euphausia superba)是南大洋生态系统中的关键物种,生物量约达6.5~10亿吨,是全球现存的资源极其丰富而开发利用程度很低的单种可捕生物资源,加快对其的开发利用具有重要意义[1−2]。我国南极磷虾渔业经过十余年发展已取得长足进步,但目前针对南极磷虾的高值化利用仍集中于南极磷虾油等脂质类产品的开发,对蛋白资源的利用明显不足[3−4]。明确南极磷虾蛋白的生物活性,拓展其在健康食品及生物医药制品领域的应用,对于提高南极磷虾资源利用率和推动南极磷虾产业发展具有重要意义。
高血压是影响我国居民健康的常见慢性疾病之一,其以动脉血压持续升高为主要临床特征,是导致脑卒中、冠心病、心力衰竭等心脑血管疾病的重要危险因素[5−6]。血管紧张素转化酶(Angiotensin-I converting enzyme,ACE)在调节血压平衡中发挥重要作用[7],其通过将血管紧张素Ⅰ转化为血管紧张素Ⅱ(血管收缩剂),使具有舒张血管作用的缓激肽失活,促进醛固酮分泌而引起血压升高[6−8]。通过抑制ACE活性可以达到治疗高血压的效果,但由于长期服用卡托普利、依那普利等化学合成ACE抑制剂易引发肾脏损害、血管水肿、高血钾症、味觉障碍等问题[9−11],寻找天然来源且安全可靠的ACE抑制剂显得尤为迫切。
食源性多肽类ACE抑制剂具有安全性高、易吸收、副作用小等优势[7,10,12],为预防和治疗高血压提供了新的途径。近年来,从马面鱼皮[7]、大黄鱼[9]、牡蛎[13]、大西洋鲑鱼皮[14]、比目鱼[15]等海洋食品原料蛋白质中制备的多肽陆续被证明具有良好的ACE抑制活性,南极磷虾蛋白源ACE抑制肽的开发也因此得到关注。Zhao等[16]从脱脂南极磷虾粉酶解液中分离得到八个具有ACE抑制活性的多肽,证明了南极磷虾蛋白酶解产物在开发ACE抑制剂方面的潜力,但目前关于南极磷虾ACE抑制肽的制备工艺及其稳定性尚缺乏较为全面的研究。综上,本研究以酶解产物的ACE抑制率为评价指标,筛选出酶解脱脂南极磷虾粉制备ACE抑制肽的最适蛋白酶,通过单因素实验和响应面试验对工艺条件进行优化,并系统考察温度、酸碱度、模拟胃肠道消化等条件对南极磷虾ACE抑制肽稳定性的影响,以期为南极磷虾蛋白资源的精准利用和高值产品开发提供科学支撑。
1. 材料与方法
1.1 材料与仪器
脱脂南极磷虾粉 青岛南极维康生物科技有限公司;碱性蛋白酶(Alcalase 2.4 L 250000 U/mL) 丹麦诺维信生物技术有限公司;胰蛋白酶(250000 U/g)、胃蛋白酶(10000 U/g)、中性蛋白酶(50000 U/g)、风味蛋白酶(30000 U/g)、木瓜蛋白酶(800000 U/g)、Lowry法蛋白浓度测定试剂盒 北京索莱宝科技有限公司;血管紧张素转化酶(ACE,25 U/g) 上海鼓臣生物技术有限公司;N-[3-(2-呋喃基)丙烯酰基]-L-苯丙酰胺-甘氨酸-甘氨酸{N-[3-(2-Furyl)acryloyl]-Phe-Gly-Gly,FAPGG} Sigma-Aldrich公司;硼酸、四硼酸钠、磷酸二氢钠、磷酸氢二钠、氢氧化钠、甲醛等试剂 分析纯,国药集团化学试剂有限公司。
SHA-B型恒温振荡器、HH-4型数显恒温水浴锅 常州智博瑞仪器制造有限公司;ST3100型pH计 奥豪斯仪器(常州)有限公司;Neofuge 15R型高速冷冻离心机 上海力申科学仪器有限公司;UV1-102II型紫外/可见分光光度计 上海天美科学仪器有限公司;ZD-2型自动电位滴定仪 上海仪电科学仪器股份有限公司;CTFD-10P型真空冷冻干燥机 青岛永合创信电子科技有限公司;ES502S型电子天平 天津市德安特传感技术有限公司;BSA224S-CW型电子分析天平 赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1 蛋白酶的筛选
以脱脂南极磷虾粉为底物,分别在6种蛋白酶的最适pH和温度条件下(碱性蛋白酶55 ℃,pH7.5;胰蛋白酶37 ℃,pH8.0;胃蛋白酶40 ℃,pH2.5;中性蛋白酶45 ℃,pH7.0;风味蛋白酶50 ℃,pH7.0;木瓜蛋白酶55 ℃,pH6.5)进行酶解反应,根据底物质量加入2.0%(v/m或m/m)的蛋白酶、按照料液比1:6(g/mL)加入磷酸盐缓冲液,混匀后酶解3 h,反应结束后于沸水浴加热20 min,冷却至室温,7500 r/min离心20 min,收集上清液,测定ACE抑制率。
1.2.2 单因素实验
筛选出的最佳蛋白酶在上述pH和温度条件下,以酶解产物的ACE抑制率和水解度为评价指标,进行酶解时间、料液比、加酶量的单因素优化实验。料液比1:6(g/mL)、加酶量2.0%(v/m),酶解时间分别为1、2、3、4、5 h,进行酶解反应;酶解时间3 h、加酶量2.0%(v/m),料液比分别为1:4、1:5、1:6、1:7、1:8(g/mL),进行酶解反应;酶解时间3 h、料液比1:6(g/mL),加酶量分别为1.0%、1.5%、2.0%、2.5%、3.0%(v/m),进行酶解反应;酶解结束后于沸水浴加热20 min,冷却至室温,7500 r/min离心20 min,收集上清液,测定ACE抑制率和水解度。
1.2.3 响应面试验
根据单因素实验结果,采用Box-Behnken试验设计方法对酶解时间(h)、料液比(g/mL)、加酶量(%)进行三因素三水平设计,见表1。以ACE抑制率为响应值,对试验数据进行回归分析,确定最佳酶解工艺条件。
表 1 响应面试验因素与水平设计Table 1. Factors and levels of response surface experiment因素 水平 −1 0 1 A酶解时间(h) 3 4 5 B料液比(g/mL) 1:6 1:7 1:8 C加酶量(%) 1.0 1.5 2.0 1.2.4 南极磷虾ACE抑制肽的稳定性
采用优化确定的最佳工艺条件制备脱脂南极磷虾粉酶解液,经真空冷冻干燥即得南极磷虾ACE抑制肽样品,考察温度、pH以及体外模拟胃肠道消化对其稳定性的影响。
1.2.4.1 温度对南极磷虾ACE抑制肽稳定性的影响
参照文献[7,17]方法进行测定:取适量样品用去离子水配制成0.5 mg/mL的溶液,分别置于25、37、60、80、100 ℃水浴中保温1 h,保温结束后冷却至室温,测定ACE抑制率。
1.2.4.2 pH对南极磷虾ACE抑制肽稳定性的影响
参照文献[7,17]方法进行测定:取适量样品分别用pH2.0、4.0、6.0、7.0、8.0、10.0的磷酸盐缓冲液(0.1 mol/L)配制成0.5 mg/mL的溶液,置于37 ℃水浴中保温1 h,结束后调节溶液pH至7.0,测定ACE抑制率。
1.2.4.3 体外模拟胃肠道消化对南极磷虾ACE抑制肽稳定性的影响
参照文献[7,17]方法进行测定:取适量样品用pH2.0的磷酸盐缓冲液(0.1 mol/L)配制成0.5 mg/mL的溶液,加入底物质量分数4.0%(m/m)的胃蛋白酶,置于37 ℃水浴振荡消化反应1.5 h,消化完成后分成两部分,一部分沸水浴加热10 min终止反应,为胃消化样品;剩余部分继续反应,用1 mol/L氢氧化钠溶液调节pH至7.5,加入底物质量分数4.0%(m/m)的胰蛋白酶,置于37 ℃水浴振荡消化反应2 h,反应完成后沸水浴加热10 min终止反应,为胃肠消化样品;分别测定消化前、胃消化、胃肠消化样品的ACE抑制率。
1.2.5 ACE抑制率的测定
参考文献[17]方法进行测定:移取550 μL样品溶液,加入275 μL FAPGG溶液(0.25 mmol/L,使用0.1 mol/L硼酸盐缓冲液配制),混匀,然后加入275 μL ACE酶液(0.125 U/mL),混匀后立即测定340 nm下吸光值,然后于37 ℃孵育30 min,反应结束后再次测定340 nm处吸光值,以蒸馏水代替样品溶液做对照,计算ACE抑制率,公式如下:
ACE抑制率(%)=(对照组吸光值差值−样品组吸光值差值)/对照组吸光值差值×100
1.2.6 水解度的测定
水解度为酶解液中氨基酸态氮含量与总氮含量的比值[4,7],公式如下:
水解度(%)=氨基酸态氮含量/总氮含量×100
氨基酸态氮含量的测定参照GB 5009.235-2016中酸度计法的规定执行:移取5 mL酶解液于100 mL容量瓶中,定容混匀后吸取20 mL于250 mL锥形瓶中,加蒸馏水60 mL,用0.05 mol/L氢氧化钠标准溶液滴定至pH为8.2。加入10 mL甲醛溶液,混匀1 min,再用0.05 mol/L氢氧化钠标准溶液继续滴定至pH为9.2,记录加入甲醛溶液后消耗氢氧化钠标准溶液的体积为V1。另取80 mL蒸馏水于250 mL锥形瓶中,重复上述操作做空白组,记录加入甲醛溶液后消耗氢氧化钠标准溶液的体积为V2。计算氨基酸态氮含量,公式如下:
氨基酸态氮含量(g/100 mL)=(V1−V2)×0.05×0.014×100
总氮含量的测定参照GB 5009.5-2016中凯氏定氮法的规定执行:移取适量酶解液(记录体积V)至消化管中,再加入0.4 g硫酸铜、6 g硫酸钾及20 mL硫酸于消化炉消化,至消化液呈绿色透明状,取出冷却后定容至50 mL,用0.05 mol/L盐酸标准溶液于自动凯氏定氮仪上实现自动加液、蒸馏和滴定过程,记录吸取消化液的体积为Vc,记录消耗盐酸标准溶液的体积为Va。以蒸馏水代替样品溶液做空白组,记录消耗盐酸标准溶液的体积为Vb。计算总氮含量,公式如下:
总氮含量(g/100 mL)=(Va−Vb)×0.05×0.014×100/(V×Vc/100)
1.3 数据处理
实验数据采用“平均值±标准偏差”的形式表示,采用IBM SPSS 27.0、Excel 2007、Origin 2018、Design Expert 8.0.6等软件进行数据处理和图表绘制。采用单因素方差分析进行组间多重比较,以P<0.05为差异具有统计学意义。
2. 结果与分析
2.1 蛋白酶的筛选
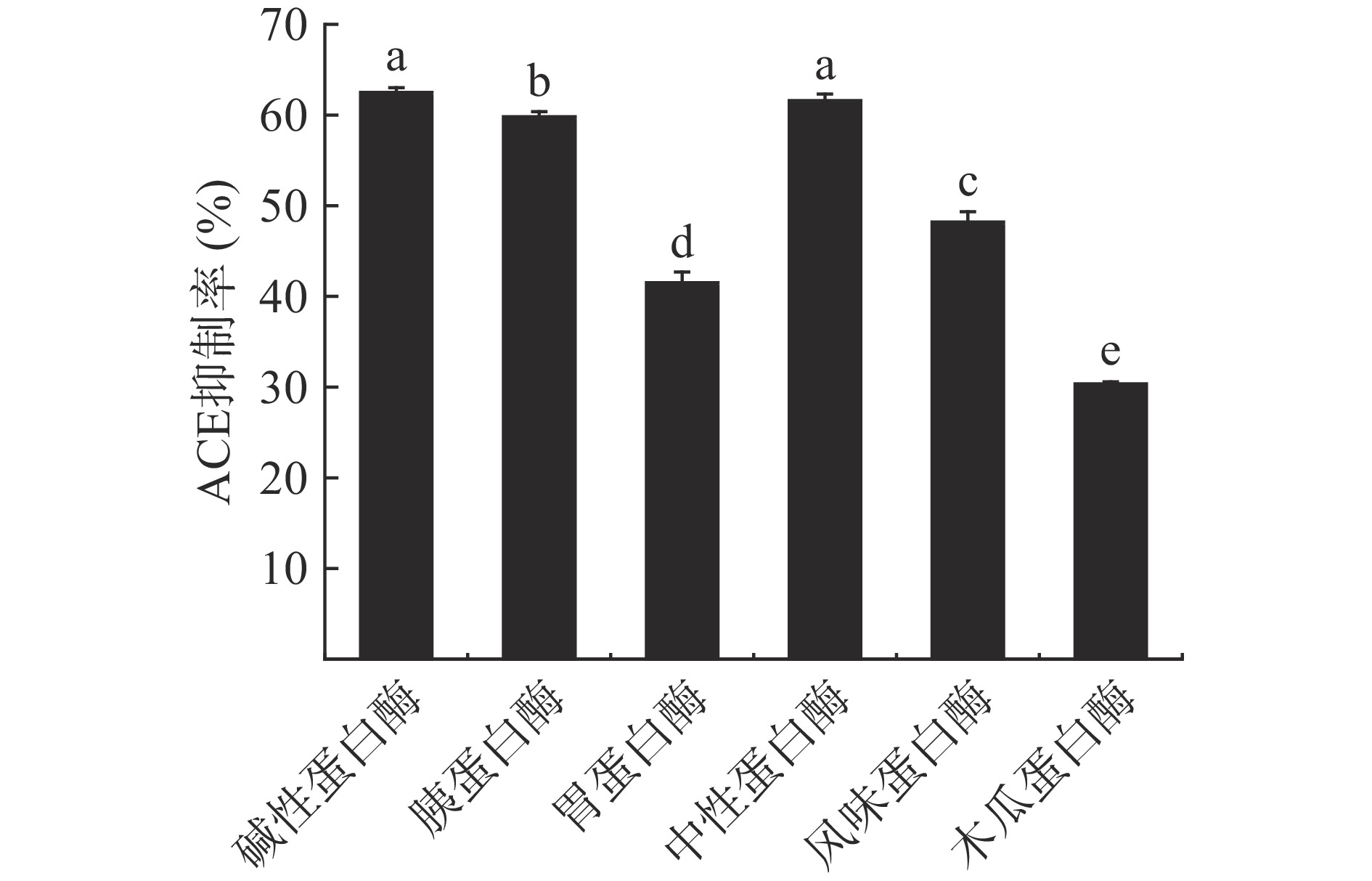
不同蛋白酶对酶解产物ACE抑制活性的影响见图1。相较于其他4种蛋白酶,碱性蛋白酶与中性蛋白酶酶解产物具有更好的ACE抑制活性(P<0.05),其中,碱性蛋白酶酶解产物的ACE抑制率最高,达到62.50%±0.52%。不同蛋白酶酶解脱脂南极磷虾粉获得的产物活性存在差异,这与蛋白酶的底物特异性有关[13]。碱性蛋白酶主要作用于含疏水性羧基的肽键,可水解产生较多的末端带有疏水性氨基酸的多肽[13]。Kohmura等[18]的研究指出,与末端为亲水性氨基酸的多肽相比,末端为疏水性氨基酸的多肽更易与ACE活性中心部位结合,达到更好的抑制ACE活性的作用效果。综合考虑蛋白酶的使用成本及酶解产物的ACE抑制活性,本研究确定采用碱性蛋白酶进行南极磷虾ACE抑制肽的制备。
2.2 单因素实验
2.2.1 酶解时间对酶解产物ACE抑制活性和水解度的影响
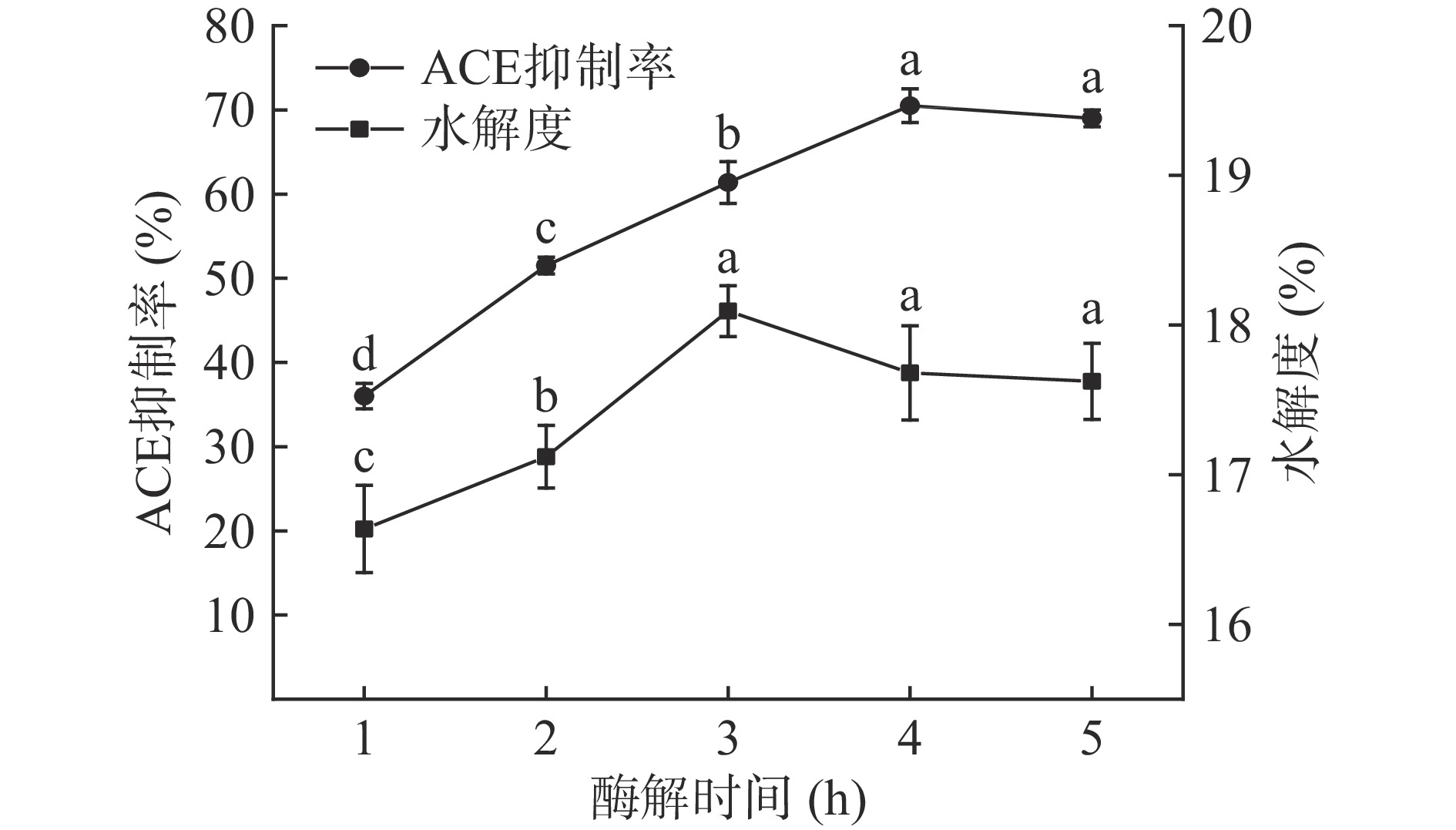
酶解时间对酶解产物ACE抑制活性和水解度的影响见图2。酶解时间在1~4 h范围时,酶解产物的ACE抑制活性随着酶解时间的延长而逐渐提高;当酶解时间为4 h时,酶解产物的ACE抑制活性最强(P<0.05),ACE抑制率为70.50%±2.00%;而后随着酶解时间的延长,酶解产物的ACE抑制活性无显著性变化(P>0.05)。酶解时间在1~3 h范围时,酶解产物的水解度显著升高(P<0.05),而后随着酶解时间延长,酶解产物的水解度无显著性变化(P>0.05)。随着酶解时间的增加,酶解反应充分进行,具有ACE抑制活性的多肽逐渐增加,ACE抑制率不断升高;但当酶解时间继续延长,具有ACE抑制活性的多肽增加的同时,也易因发生过度水解而遭到破坏[17,19−20],酶解产物的ACE活性相对稳定。酶解时间在4 h时,酶解产物的ACE抑制率最高,且此时酶解产物水解度处于较高水平。综上,选择酶解时间3~5 h进行后续优化。
2.2.2 料液比对酶解产物ACE抑制活性和水解度的影响
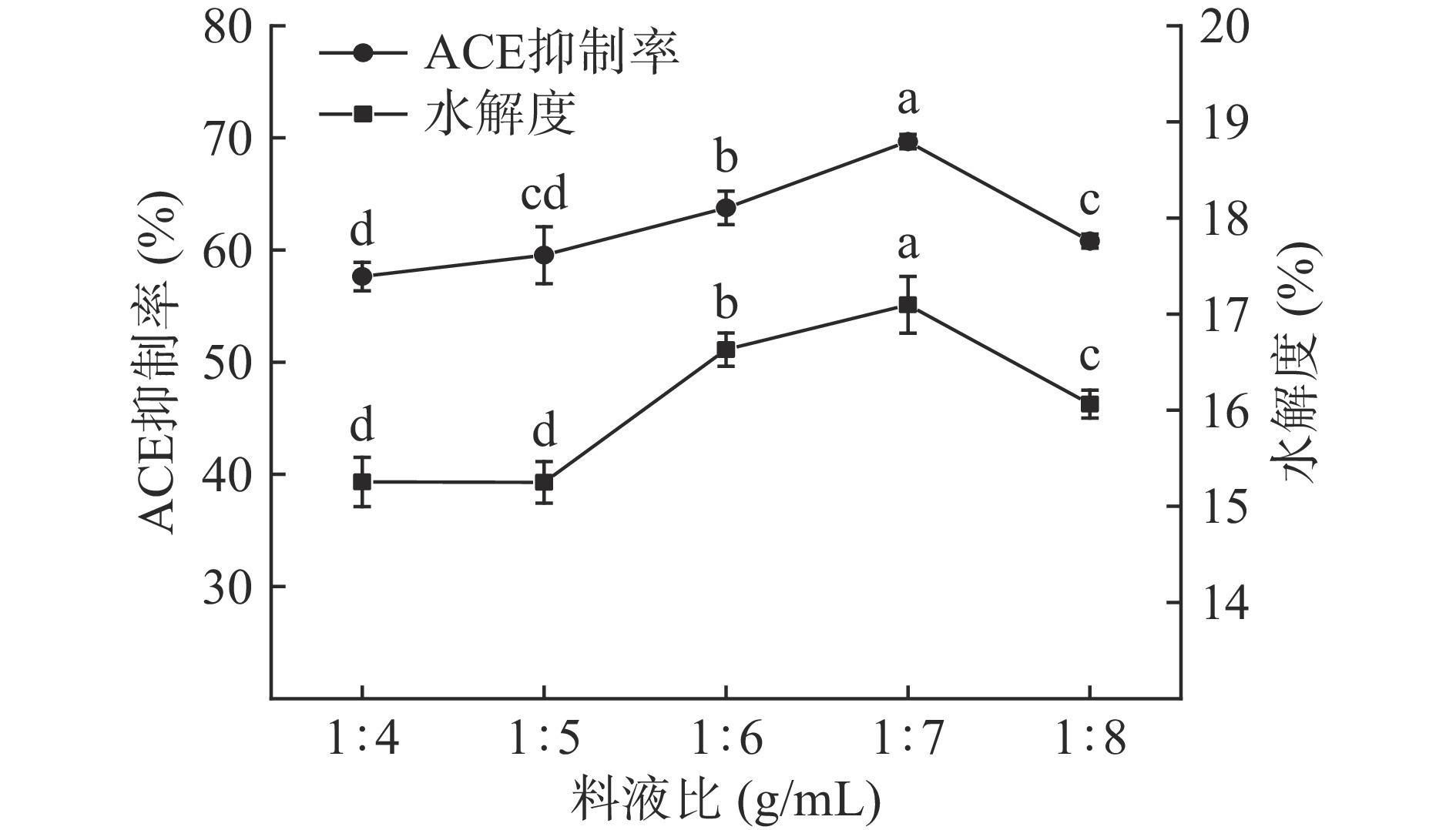
料液比对酶解产物ACE抑制活性和水解度的影响见图3。料液比在1:4~1:8(g/mL)范围时,酶解产物的ACE抑制活性随着料液比的增加先升高后下降;当料液比为1:7(g/mL)时,酶解产物的ACE抑制活性显著最强(P<0.05),ACE抑制率为69.67%±0.63%。料液比1:4~1:8(g/mL)范围时,酶解产物的水解度先升高后下降,变化显著(P<0.05)。料液比偏低时,反应体系过于黏稠,蛋白酶无法与底物充分结合,酶解生成的具有ACE抑制活性的多肽较少;随着料液比的增加,酶与底物有效接触,酶解反应充分进行,具有ACE抑制活性的多肽逐渐增多,酶解产物ACE抑制率升高;当料液比继续增加时,底物与蛋白酶的有效碰撞结合有所降低,具有ACE抑制活性的多肽生成减少,酶解产物ACE抑制率出现下降[7,17,20]。料液比在1:7(g/mL)时,酶解产物的ACE抑制率与水解度均处于最优水平。综上,选择料液比1:6~1:8(g/mL)进行后续优化。
2.2.3 加酶量对酶解产物ACE抑制活性和水解度的影响
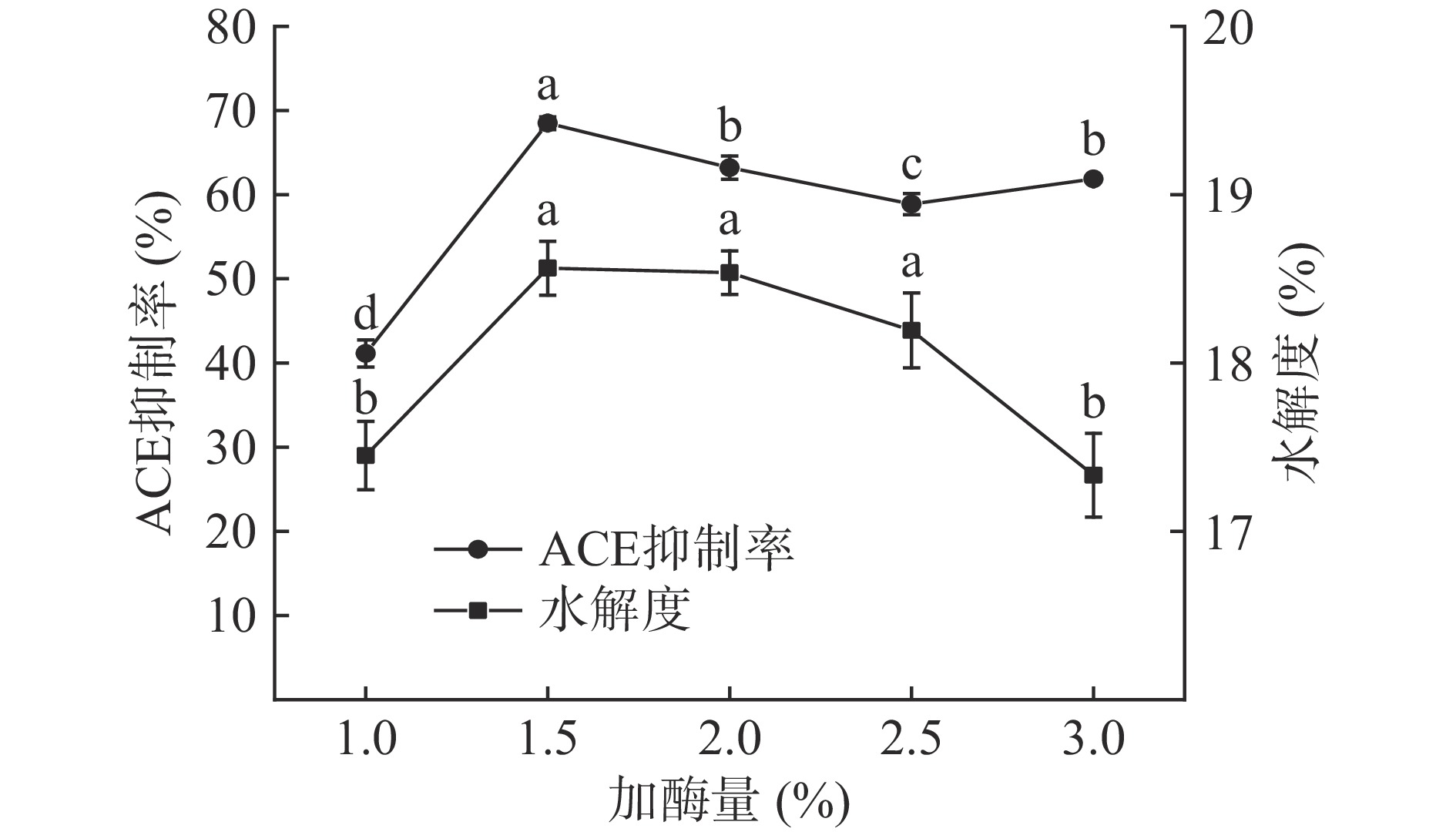
加酶量对酶解产物ACE抑制活性和水解度的影响见图4。加酶量在1.0%~1.5%范围时,酶解产物的ACE抑制活性随着加酶量的增加而升高;当加酶量为1.5%时,酶解产物的ACE抑制活性显著最强(P<0.05),ACE抑制率为68.49%±0.76%;而后随着加酶量的增加,酶解产物的ACE抑制活性显著降低(P<0.05)。加酶量在1.0%~3.0%范围时,酶解产物的水解度先上升后下降,变化显著(P<0.05)。随着加酶量的增加,底物逐渐被水解,具有ACE抑制活性的多肽释放增加,ACE抑制率不断升高;但当加酶量继续增加,蛋白酶与底物结合达到过饱和状态而易导致底物过度水解,具有ACE抑制活性的多肽遭到破坏,酶解产物活性降低[5,17,19]。加酶量在1.5%时,酶解产物的ACE抑制率与水解度均处于最优水平。综上,选择料加酶量1.0%~2.0%%进行后续优化。
2.3 响应面试验
根据单因素实验结果,依据Box-Behnken试验设计原理,对酶解时间(A)、料液比(B)与加酶量(C)进行三因素三水平响应面优化,实验结果见表2。对响应面实验数据进行二次多元回归拟合,得到酶解产物ACE抑制率(Y)与自变量A、B、C的回归方程为:Y=74.41−2.82A−0.95B+2.03C−1.68AB−1.52AC−4.05BC−2.53A2−5.97B2−6.11C2
表 2 Box-Behnken试验设计与结果Table 2. Box-Behnken experimental design and results试验号 因素 Y:ACE抑制率(%) A B C 1 1 1 0 60.26 2 0 −1 −1 58.08 3 0 0 0 73.68 4 1 −1 0 64.55 5 −1 1 0 70.63 6 −1 0 −1 63.94 7 1 0 −1 62.72 8 0 0 0 71.24 9 −1 0 1 71.85 10 0 0 0 75.64 11 0 1 −1 63.33 12 0 0 0 76.18 13 0 −1 1 69.42 14 1 0 1 64.55 15 0 0 0 75.29 16 −1 −1 0 68.20 17 0 1 1 58.46 对实验模型及回归方程进行显著性分析,结果见表3。该回归模型的F值为18.88、P=0.0004<0.01,表明建立的模型极显著;失拟项F值为0.58、P=0.6582>0.05,表明失拟项不显著;说明实验产生的随机误差对实验结果影响较小,模型与数据的拟合程度较高。该回归模型的R2=0.9604,调整系数R2adj=0.9096,信噪比Adeq Precision=12.391>4,表明该回归方程的可信度较高[21]。变异系数CV值为2.68%,表明该实验重现性好,模型可靠性较高[22]。此外,在本实验中,A、BC、B2、C2对酶解产物ACE抑制率影响极显著(P<0.01),C对酶解产物ACE抑制率影响显著(P<0.05),B、AB、AC对酶解产物ACE抑制率影响不显著(P>0.05)。由F值可知,各因素对酶解产物ACE抑制活性的影响程度为:A>C>B,即酶解时间>加酶量>料液比。以上分析表明,实验结果可靠性高,建立的模型可用于酶解脱脂南极磷虾粉制备ACE抑制肽工艺条件的分析和预测。
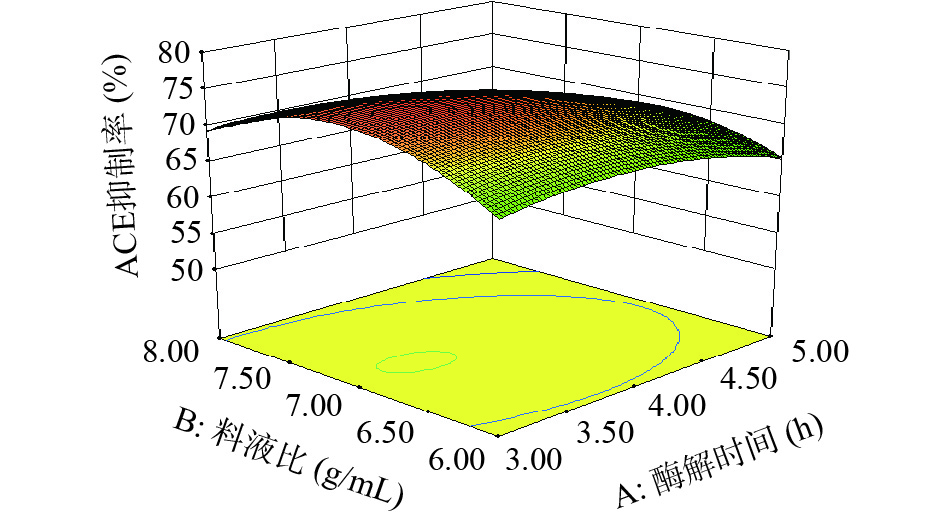
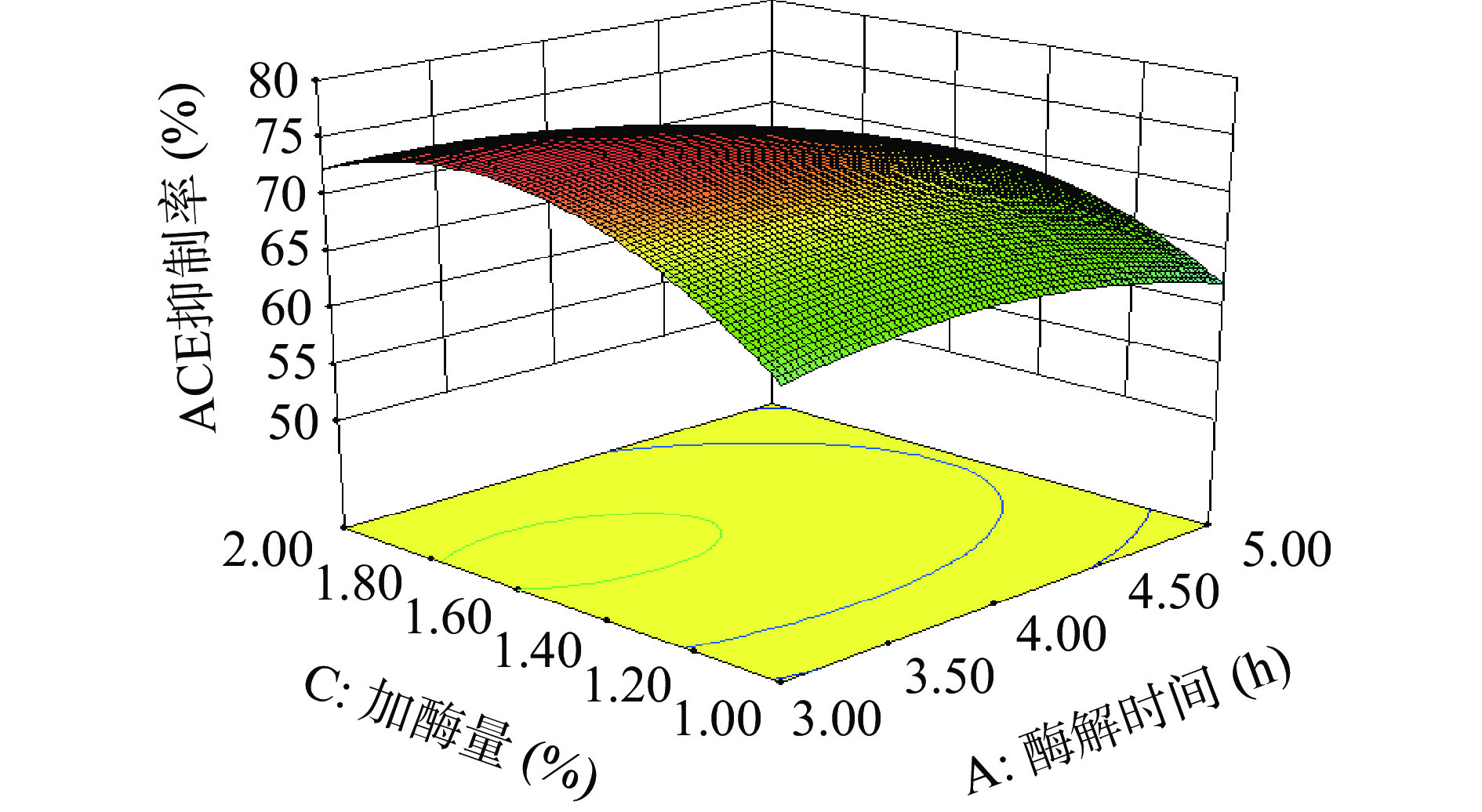
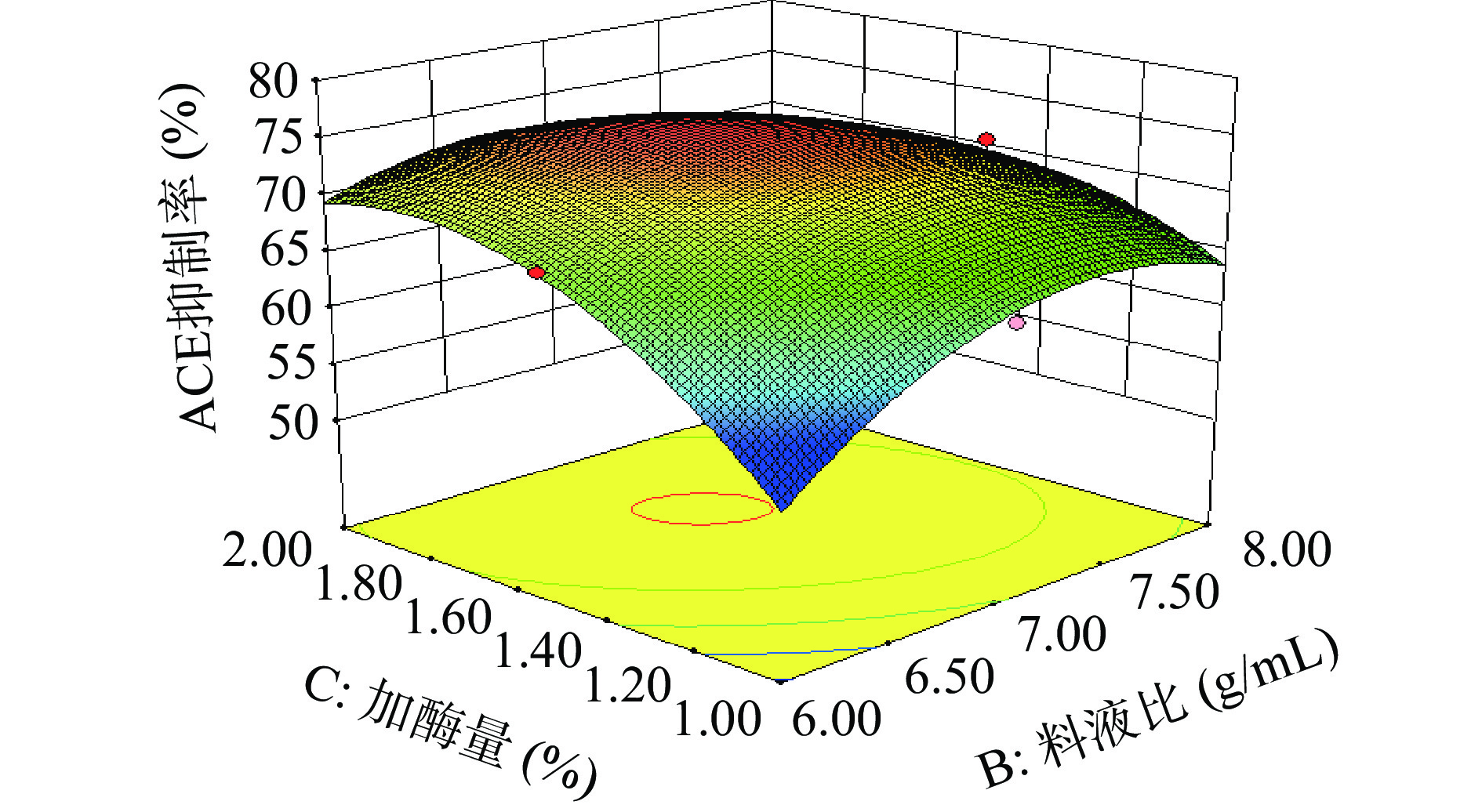
表 3 回归模型方差分析Table 3. Variance analysis of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 557.56 9 61.95 18.88 0.0004 ** A酶解时间 63.51 1 63.51 19.35 0.0032 ** B 料液比 7.16 1 7.16 2.18 0.1831 C 加酶量 32.85 1 32.85 10.01 0.0158 * AB 11.29 1 11.29 3.44 0.1060 AC 9.24 1 9.24 2.82 0.1372 BC 65.69 1 65.69 20.02 0.0029 ** A2 26.88 1 26.88 8.19 0.0243 * B2 150.03 1 150.03 45.72 0.0003 ** C2 157.41 1 157.41 47.96 0.0002 ** 残差 22.97 7 3.28 失拟项 6.97 3 2.32 0.58 0.6582 不显著 纯误差 16.00 4 4.00 总和 580.54 16 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 酶解时间、料液比、加酶量之间交互作用对酶解产物ACE抑制率的影响见图5~图7。响应面中曲面越陡,说明两因素之间的交互作用对酶解产物ACE抑制率的影响越显著;轴向等高线密度与交互作用影响强度成正比[23]。通过对比图5~图7,交互作用BC的响应面曲线有显著陡坡,轴向等高线密度小,说明酶解时间一定时,料液比与加酶量的交互作用对酶解产物ACE抑制率的影响显著;而交互作用AB、AC的响应面曲线坡度较小且相对平滑,轴向等高线密度大,说明酶解时间与料液比的交互作用、酶解时间与加酶量的交互作用对酶解产物ACE抑制率的影响不显著;各因素两两交互作用分析结果与方差分析中显著性结果一致。
通过Design Expert 8.0.6软件分析得到采用碱性蛋白酶酶解脱脂南极磷虾粉制备ACE抑制肽的最优工艺条件为:酶解时间3.39 h、料液比1:6.92(g/mL)、加酶量1.63%;在此条件下,酶解产物ACE抑制率预测为75.58%。为便于实际应用,将最佳酶解工艺条件调整为:酶解时间3.4 h、料液比1:7(g/mL)、加酶量1.6%。在此条件下进行六次验证实验,获得的酶解产物ACE抑制率为74.37%±0.87%,与理论值基本一致,证明该模型可靠、工艺整体可行。
2.4 南极磷虾ACE抑制肽的稳定性
2.4.1 温度对南极磷虾ACE抑制肽稳定性的影响
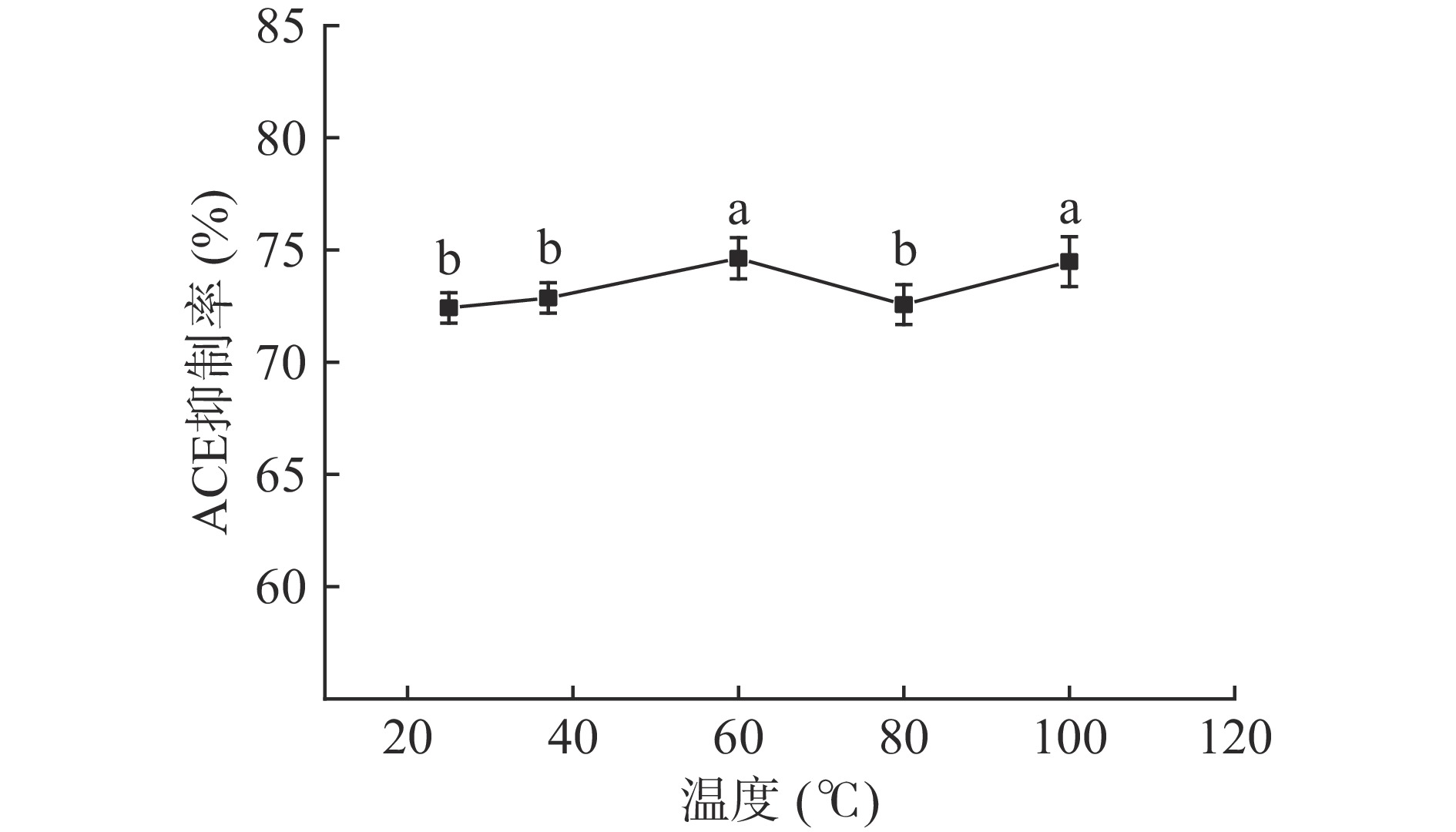
南极磷虾ACE抑制肽在25~60 ℃范围时活性相对稳定,ACE抑制率在72.42%±0.68%以上(图8);当温度继续升高,ACE抑制率出现显著先下降而后升高现象(P<0.05)。高温条件易导致多肽变性聚集,引起活性下降[24−25];而暴露于更高温度环境中原有多肽链会分解生成新的小肽,产生协同效应,从而提高原有活性[26−28];南极磷虾ACE抑制肽在不同高温条件下活性出现差异性变化,推测与以上原因有关。综上,南极磷虾ACE抑制肽具有良好的热稳定性,能够在热处理加工过程中保持较高的活性。
2.4.2 pH对南极磷虾ACE抑制肽稳定性的影响
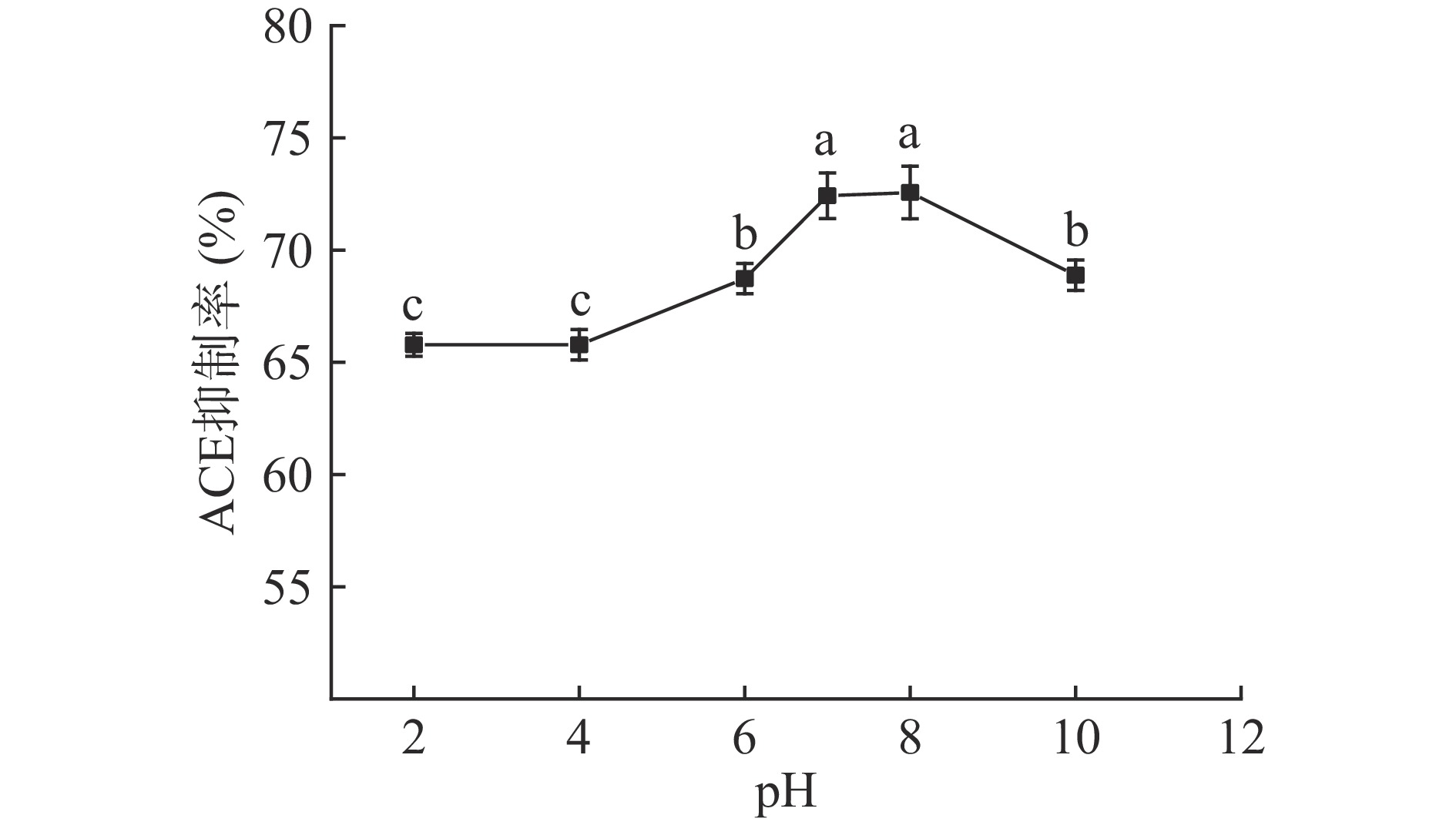
南极磷虾ACE抑制肽在pH2.0~10.0范围内,随着pH的增加,其ACE抑制活性先升高后下降(图9);在pH7.0~8.0条件下,南极磷虾ACE抑制肽的活性最高,酸性或碱性条件对其活性均影响显著(P<0.05)。在碱性条件下,多肽易发生外消旋或脱酰胺反应,导致活性减弱[29];而酸性条件会影响多肽的溶解度,导致活性下降[30]。因此,南极磷虾ACE抑制肽的加工贮藏过程应注意避免强酸、强碱条件的影响。
2.4.3 模拟胃肠道消化对南极磷虾ACE抑制肽稳定性的影响
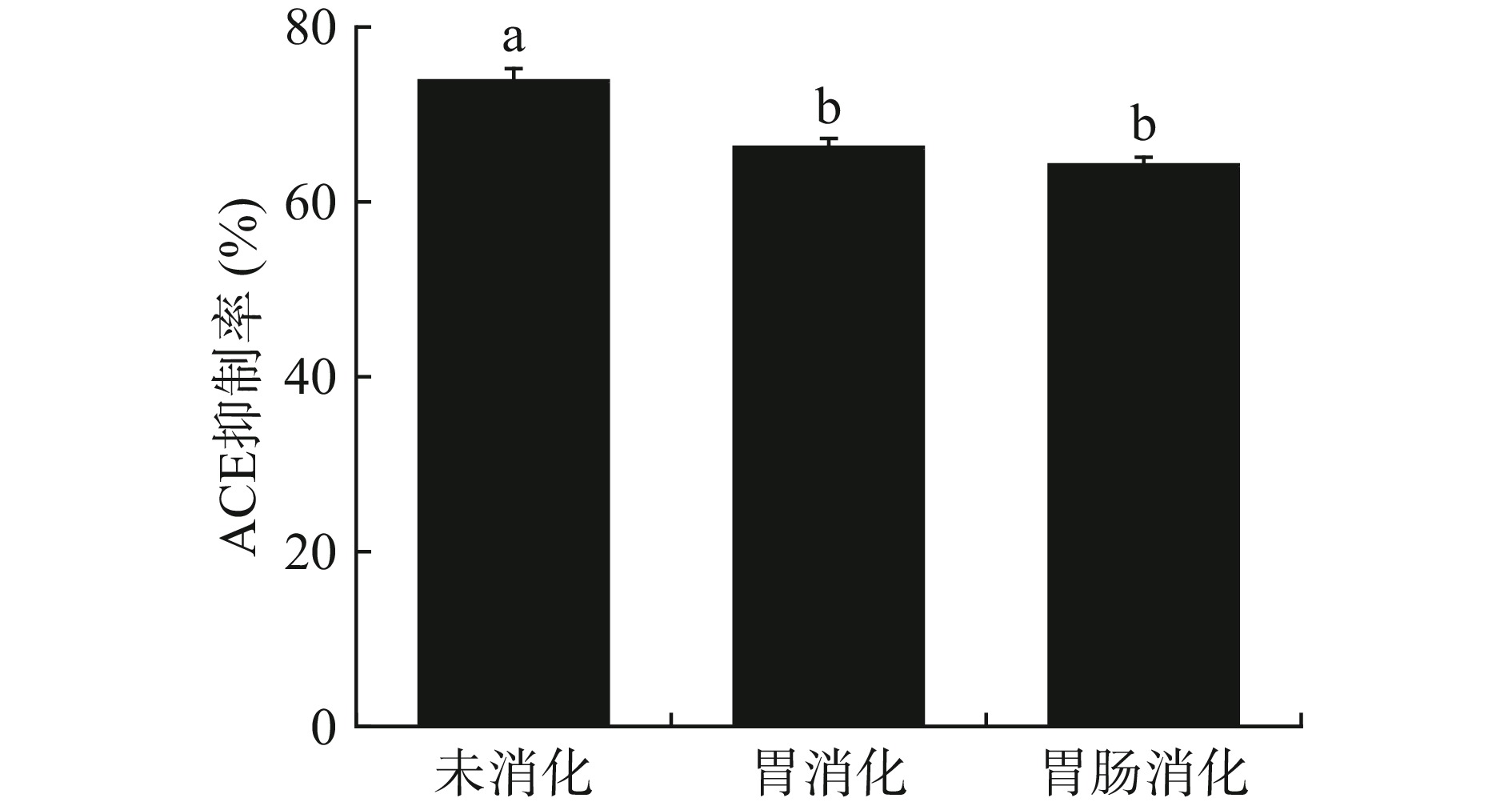
南极磷虾ACE抑制肽经模拟胃液消化处理后,其ACE抑制率由73.85%±1.39%下降至66.24%±1.00%,再经模拟肠液消化处理后,其ACE抑制率下降至64.22%±0.86%(图10)。多肽的生物活性主要依靠肽链中氨基酸分子间的协同作用,因此,氨基酸与多肽相比活性较弱[7]。南极磷虾ACE抑制肽在胃肠消化过程中,经胃蛋白酶、胰蛋白酶的作用进一步水解成分子量更小的短肽及游离氨基酸,部分具有ACE抑制活性的多肽被破坏,从而导致ACE抑制活性降低[27]。南极磷虾ACE抑制肽经胃肠道消化后,其活性仍能保持原有的86.96%,较好的消化稳定性有利于其作为功能原料在健康食品中应用。
3. 结论
本研究优化了南极磷虾ACE抑制肽的酶解制备工艺,并对其稳定性进行了评价。工艺研究结果表明,碱性蛋白酶是酶解脱脂南极磷虾粉制备南极磷虾ACE抑制肽的最佳酶;经单因素实验与响应面试验优化确定的最佳工艺条件为:酶解时间3.4 h、料液比1:7(g/mL)、加酶量1.6%,在此条件下,酶解产物的ACE抑制率为74.37%±0.87%。稳定性研究结果表明,采用优化工艺制备获得的南极磷虾ACE抑制肽具有良好的热稳定性和体外消化稳定性;pH条件对其稳定性具有一定影响,其相关产品在加工和贮藏过程中应避免强酸或强碱条件的影响。研究结果对于支撑南极磷虾蛋白资源应用于降压类健康食品和医药制品等的开发具有积极意义。
-
表 1 响应面试验因素与水平设计
Table 1 Factors and levels of response surface experiment
因素 水平 −1 0 1 A酶解时间(h) 3 4 5 B料液比(g/mL) 1:6 1:7 1:8 C加酶量(%) 1.0 1.5 2.0 表 2 Box-Behnken试验设计与结果
Table 2 Box-Behnken experimental design and results
试验号 因素 Y:ACE抑制率(%) A B C 1 1 1 0 60.26 2 0 −1 −1 58.08 3 0 0 0 73.68 4 1 −1 0 64.55 5 −1 1 0 70.63 6 −1 0 −1 63.94 7 1 0 −1 62.72 8 0 0 0 71.24 9 −1 0 1 71.85 10 0 0 0 75.64 11 0 1 −1 63.33 12 0 0 0 76.18 13 0 −1 1 69.42 14 1 0 1 64.55 15 0 0 0 75.29 16 −1 −1 0 68.20 17 0 1 1 58.46 表 3 回归模型方差分析
Table 3 Variance analysis of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 557.56 9 61.95 18.88 0.0004 ** A酶解时间 63.51 1 63.51 19.35 0.0032 ** B 料液比 7.16 1 7.16 2.18 0.1831 C 加酶量 32.85 1 32.85 10.01 0.0158 * AB 11.29 1 11.29 3.44 0.1060 AC 9.24 1 9.24 2.82 0.1372 BC 65.69 1 65.69 20.02 0.0029 ** A2 26.88 1 26.88 8.19 0.0243 * B2 150.03 1 150.03 45.72 0.0003 ** C2 157.41 1 157.41 47.96 0.0002 ** 残差 22.97 7 3.28 失拟项 6.97 3 2.32 0.58 0.6582 不显著 纯误差 16.00 4 4.00 总和 580.54 16 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 -
[1] 赵宪勇, 左涛, 冷凯良, 等. 南极磷虾渔业发展的工程科技需求[J]. 中国工程科学,2016,18(2):85−90 doi: 10.3969/j.issn.1009-1742.2016.02.013 ZHAO X Y, ZUO T, LENG K L, et al. Engineering science and technology challenges in the Antarctic krill fishery[J]. Strategic Study of Chinese Academy of Engineering,2016,18(2):85−90. doi: 10.3969/j.issn.1009-1742.2016.02.013
[2] 高颖, 王彦超, 常耀光, 等. 三种低氟南极磷虾肽的ACE抑制作用及抗氧化活性研究[J]. 食品工业科技,2016,37(2):82−87, 92 doi: 10.13386/j.issn1002-0306.2016.02.008 GAO Y, WANG Y C, CHANG Y G, et al. ACE inhibition and antioxidant activities of three types of Antarctic krill ( Euphausia superba) peptides with low fluorine content[J]. Science and Technology of Food Industry,2016,37(2):82−87, 92. doi: 10.13386/j.issn1002-0306.2016.02.008
[3] 刘柯欣, 林松毅, 胡胜杰, 等. 南极磷虾蛋白营养与功能特性及食用安全性研究进展[J]. 食品科学,2022,43(7):263−272 doi: 10.7506/spkx1002-6630-20210301-007 LIU K X, LIN S Y, HU S J, et al. Advances in our knowledge of the nutritional and functional properties and safety of Antarctic krill proteins[J]. Food Science,2022,43(7):263−272. doi: 10.7506/spkx1002-6630-20210301-007
[4] 孙如男, 冷凯良, 高华, 等. 南极磷虾金属螯合肽蛋白基料的酶解制备工艺优化[J]. 食品科技,2020,45(7):159−165 doi: 10.13684/j.cnki.spkj.2020.07.028 SUN R N, LENG K L, GAO H, et al. Optimization of enzymatic hydrolysis preparation of the protein-based material for the production of Antarctic krill metal-chelating peptide[J]. Food Science and Technology,2020,45(7):159−165. doi: 10.13684/j.cnki.spkj.2020.07.028
[5] 汤海霞, 张艳, 葛武鹏, 等. 酶解法制备绵羊乳酪蛋白ACE抑制肽的工艺优化及其抑制机制[J]. 中国食品学报,2022,22(6):220−231 doi: 10.16429/j.1009-7848.2022.06.023 TANG H X, ZHANG Y, GE W P, et al. Optimization of enzymatic preparation of ACE inhibitory peptide from sheep milk casein and its inhibition mechanism[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(6):220−231. doi: 10.16429/j.1009-7848.2022.06.023
[6] ZHENG S L, LUO Q B, SUO S K, et al. Preparation, identification, molecular docking study and protective function on HUVECs of novel ACE inhibitory peptides from protein hydrolysate of skipjack tuna muscle[J]. Marine Drugs,2022,20(3):176. doi: 10.3390/md20030176
[7] 蔡金秀, 夏姗姗, 马佳雯, 等. 马面鱼皮ACE抑制肽的制备、分离纯化及稳定性[J]. 中国食品学报,2022,22(3):225−234 doi: 10.16429/j.1009-7848.2022.03.025 CAI J X, XIA S S, MA J W, et al. Preparation, isolation and stability of collagen ACE inhibitory peptides from the skin of navodon septentrionalis ACE[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(3):225−234. doi: 10.16429/j.1009-7848.2022.03.025
[8] YU D Y, WANG C, SONG Y F, et al. Discovery of novel angiotensin-converting enzyme inhibitory peptides from Todarodes pacificus and their inhibitory mechanism: In silico and in vitro studies[J]. International Journal of Molecular Sciences,2019,20(17):4159. doi: 10.3390/ijms20174159
[9] 纪慧卓, 陈嘉钰, 李欣, 等. 大黄鱼蛋白源ACE抑制三肽的虚拟筛选、体外活性验证及分子机制[J]. 食品工业科技,2021,42(6):125−129, 143 doi: 10.13386/j.issn1002-0306.2020060287 JI H Z, CHEN J Y, LI X, et al. Screening, in vitro activity and molecular mechanism of ACE inhibitory tirpeptides from Larimichthys crocea protein[J]. Science and Technology of Food Industry,2021,42(6):125−129, 143. doi: 10.13386/j.issn1002-0306.2020060287
[10] MIRZAEI M, MIRDAMADI S, SAFAVI M. Structural analysis of ACE-inhibitory peptide (VL-9) derived from Kluyveromyces marxianus protein hydrolysate[J]. Journal of Molecular Structure,2020,1213:128199. doi: 10.1016/j.molstruc.2020.128199
[11] SUO S K, ZHAO Y Q, WANG Y M, et al. Seventeen novel angiotensin converting enzyme (ACE) inhibitory peptides from the protein hydrolysate of Mytilus edulis:Isolation, identification, molecular docking study, and protective function on HUVECs[J]. Food & Function,2022,13(14):7831−7846.
[12] ZHONG C, SUN L C, YAN L J, et al. Production, optimisation and characterisation of angiotensin converting enzyme inhibitory peptides from sea cucumber ( Stichopus japonicus) gonad[J]. Food & Function,2018,9(1):594−603.
[13] 苑园园, 于宏伟, 田益玲, 等. 酶法制备牡蛎ACE抑制肽的条件优化[J]. 中国食品学报,2013,13(3):115−121 doi: 10.16429/j.1009-7848.2013.03.010 YUAN Y Y, YU H W, TIAN Y L, et al. Enzymatic preparation of angiotensin I-converting enzyme inhibitory peptides derived from oyster[J]. Journal of Chinese Institute of Food Science and Technology,2013,13(3):115−121. doi: 10.16429/j.1009-7848.2013.03.010
[14] LEE J K, JEON J K, BYUN H G. Antihypertensive effect of novel angiotensin I converting enzyme inhibitory peptide from chum salmon ( Oncorhynchus keta) skin in spontaneously hypertensive rats[J]. Journal of Functional Foods,2014,7:381−389. doi: 10.1016/j.jff.2014.01.021
[15] KO J Y, KAND N, LEE J H, et al. Angiotensin I-converting enzyme inhibitory peptides from an enzymatic hydrolysate of flounder fish ( Paralichthys olivaceus) muscle as a potent anti-hypertensive agent[J]. Process Biochemistry,2016,51(4):535−541. doi: 10.1016/j.procbio.2016.01.009
[16] ZHAO Y Q, ZHANG L, TAO J, et al. Eight antihypertensive peptides from the protein hydrolysate of Antarctic krill ( Euphausia superba):Isolation, identification, and activity evaluation on human umbilical vein endothelial cells (HUVECs)[J]. Food Research International,2019,121:197−204. doi: 10.1016/j.foodres.2019.03.035
[17] 陈秋銮, 陈雪芹, 马倩, 等. 酶解法制备牡丹籽ACE抑制肽及其稳定性[J]. 食品工业科技,2020,41(19):149−156. [CHEN Q L, CHEN X Q, MA Q, et al. Preparation and stability of ACE inhibitory peptides from peony seed meal by enzymatic hydrolysis[J]. Science and Technology of Food Industry,2020,41(19):149−156. doi: 10.13386/j.issn1002-0306.2020.19.024 CHEN Q L, CHEN X Q, MA Q, et al . Preparation and stability of ACE inhibitory peptides from peony seed meal by enzymatic hydrolysis[J]. Science and Technology of Food Industry,2020 ,41 (19 ):149 −156 . doi: 10.13386/j.issn1002-0306.2020.19.024[18] KOHMURA M, NIO N, ARIYOSHI Y. Inhibition of angiotensin-converting enzyme by synthetic peptide fragments of human κ-Casein[J]. Agricultural and Biological Chemistry,1990,54(3):835−836.
[19] 王振斌, 刘加友, 陈兵兵, 等. 响应面优化酶法制备芝麻饼粕ACE抑制肽研究[J]. 中国粮油学报,2015,30(9):88−93 doi: 10.3969/j.issn.1003-0174.2015.09.017 WANG Z B, LIU J Y, CHEN B B, et al. The response surface optimizate preparation of sesame dregs’ ACE inhibitory peptides with enzyme[J]. Journal of the Chinese Cereals and Oils Association,2015,30(9):88−93. doi: 10.3969/j.issn.1003-0174.2015.09.017
[20] 贾叶叶, 田洪磊, 詹萍, 等. 酶法制备沙漠果蛋白ACE抑制肽工艺的研究[J]. 食品工业科技,2016,37(6):264−274 doi: 10.13386/j.issn1002-0306.2016.06.046 JIA Y Y, TIAN H L, ZHAN P, et al. Preparation of ACE inhibitory peptides from Brazil nut protein by enzymatic hydrolysis[J]. Science and Technology of Food Industry,2016,37(6):264−274. doi: 10.13386/j.issn1002-0306.2016.06.046
[21] 张婉迎, 杨俊杰, 杨松, 等. 响应面优化桑葚果粉喷雾干燥研究[J]. 食品工业,2018,39(7):182−185 ZHANG W Y, YANG J J, YANG S, et al. Optimization of spray drying of mulberry powder by response surface method[J]. The Food Industry,2018,39(7):182−185.
[22] 陈冰冰, 欧颖仪, 叶灏铎, 等. 富硒辣木叶蛋白ACE抑制肽的酶解工艺优化及活性研究[J]. 食品工业科技,2022,43(3):1−9 CHEN B B, OU Y Y, YE H D, et al. Optimization of enzymatic hydrolysis process and activity of ACE inhibitory peptides from selenium-rich Moringa oleifera leaves protein[J]. Science and Technology of Food Industry,2022,43(3):1−9.
[23] 李珊, 梁俭, 冯群, 等. 桂七青芒果皮多糖提取工艺的响应面优化及其体外抗氧化活性[J]. 食品工业科技,2019,40(4):220−225, 231 doi: 10.13386/j.issn1002-0306.2019.04.036 LI S, LANG J, FENG Q, et al. Optimization of polysaccharides from guiqi-mango peels by response surface methodology and its antioxidant activity in vitro[J]. Science and Technology of Food Industry,2019,40(4):220−225, 231. doi: 10.13386/j.issn1002-0306.2019.04.036
[24] 姚轶俊, 张晶, 鞠兴荣, 等. 菜籽抗氧化肽WDHHAPQLR的环境稳定性研究[J]. 中国粮油学报,2019,34(8):54−60 doi: 10.3969/j.issn.1003-0174.2019.08.010 YAO Y J, ZHANG J, JU X R, et al. Environmental stability of rapeseed antioxidant peptide WDHHAPQLR[J]. Journal of the Chinese Cereals and Oils Association,2019,34(8):54−60. doi: 10.3969/j.issn.1003-0174.2019.08.010
[25] ZHU Q, XUE J, WANG P, et al. Identification of a novel ACE inhibitory hexapeptide from camellia seed cake and evaluation of its stability[J]. Foods,2023,12(3):501. doi: 10.3390/foods12030501
[26] TAO M, WANG C, LIAO D, et al. Purification, modification and inhibition mechanism of angiotensin I-converting enzyme inhibitory peptide from silkworm pupa ( Bombyx mori) protein hydrolysate[J]. Process Biochemistry,2017,54:172−179. doi: 10.1016/j.procbio.2016.12.022
[27] ESCUDERO E, MORA L, TOLDRÁ F. Stability of ACE inhibitory ham peptides against heat treatment and in vitro digestion[J]. Food Chemistry,2014,161:305−311. doi: 10.1016/j.foodchem.2014.03.117
[28] 刘鑫烔, 宋铖铖, 乔变文, 等. 两种皮氏蛾螺ACE抑制肽的稳定性和抑制活性[J]. 食品工业科技,2020,41(19):7−12, 19 doi: 10.13386/j.issn1002-0306.2020.19.002 LIU X J, SONG C C, QIAO B W, et al. Research on the stability and activity of two ACE inhibitory peptides from Volutharpa ampullaceal perryi[J]. Science and Technology of Food Industry,2020,41(19):7−12, 19. doi: 10.13386/j.issn1002-0306.2020.19.002
[29] ZHU S, WANG S, WANG L, et al. Identification and characterization of an angiotensin-I converting enzyme inhibitory peptide from enzymatic hydrolysate of rape ( Brassica napus L.) bee pollen[J]. LWT-Food Science and Technology,2021,147:111502. doi: 10.1016/j.lwt.2021.111502
[30] PEREIRA A M, LISBOA C R, SANTOS T D, et al. Bioactive stability of microalgal protein hydrolysates under food processing and storage conditions[J]. Journal of Food Science and Technology,2019,56(10):4543−4551. doi: 10.1007/s13197-019-03915-2
-
期刊类型引用(3)
1. 陈亮,郭江涛,李倩,徐锋,陈滕. 基于OBE面向科教融合的药物分析学教学改革研究. 广东化工. 2024(06): 177-178+152 .  百度学术
百度学术
2. 王雪,潘兆平,陈嘉序,郝丹丹,苏志鹏,马双双,肖佳豪,付复华. 茶枝柑与不同品种温州蜜柑果皮的非靶向代谢组学比较与分析. 食品科学. 2024(14): 133-141 .  百度学术
百度学术
3. 宋娟,康三江,张海燕,曾朝珍,袁晶,慕钰文,苟丽娜. 基于高温高湿条件下苹果加工过程中代谢产物的多样性分析. 寒旱农业科学. 2024(08): 711-723+785 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:
