Effects of Ultra-high Pressure Assisted Enzymatic Hydrolysis on Structure and Antioxidant Activity of Hemp Protein Isolate
-
摘要: 本研究以汉麻分离蛋白(Hemp Protein Isolate,HPI)为原料,通过超高压辅助酶解反应对HPI进行改性,测定不同压力下汉麻蛋白酶解产物(hydrolysate of hemp protein isolate,HPIH)的聚丙烯酰胺凝胶电泳(SDS polyacrylamide gelelectrophoresis,SDS-PAGE)电泳特性、表面疏水性、巯基含量、傅立叶红外光谱和内源荧光光谱分析改性前后汉麻分离蛋白的结构变化。结果表明,超高压(ultra-high pressure,UHP)(0.1、100、200、300 MPa)处理对HPI酶解反应具有一定的辅助作用,且随压力的升高酶解反应程度逐渐增大,分子量逐渐降低;HPI经改性后,疏水性基团逐渐暴露,表面疏水性随压力的增大先上升后下降,且变化差异性显著(P<0.05),在200 MPa时表面疏水性达到最大;酶解反应后,HPIH游离巯基含量显著降低(P<0.05),而表面巯基含量随压力增大呈先上升后下降的趋势;通过测定改性前后蛋白质氨基酸组成及含量可知,改性前后HPI氨基酸组成不变,但各氨基酸含量存在不同程度下降;由傅立叶红外光谱图可以看出,与HPI相比,HPIH的吸收峰强度、峰型及峰面积等均发生不同程度变化,说明超高压辅助酶解反应使蛋白质二级结构发生改变;内源荧光光谱显示,HPIH荧光强度增大且最大发射波长发生红移,说明酶解反应改变了HPI的三级结构;抗氧化活性结果表明,适当的压力处理可有效提升酶解产物的抗氧化能力,当压力为200 MPa时,HPIH的DPPH、ABTS+自由基清除能力及还原能力达到最高。综上所述,超高压辅助酶解改性处理能显著改变汉麻分离蛋白的二、三级结构,暴露出疏水基团等活性基团,从而提高其抗氧化性。
-
关键词:
- 汉麻分离蛋白(HPI) /
- 超高压(UHP) /
- 结构 /
- 抗氧化活性
Abstract: Hemp Protein Isolate (HPI) was used as raw material to modify HPI through ultrahigh pressure assisted enzymatic hydrolysis reaction. The SDS-PAGE electrophoresis characteristics, surface hydrophobicity, sulfhydryl content, FTIR and endogenous fluorescence of the hydrolysate of hemp protein isolate (HPIH) were determined under different pressures to investigate the structural changes of the HPI before and after modification. The results showed that ultra-high pressure (UHP) (0.1, 100, 200, 300 MPa) treatment had a certain auxiliary effect on HPI enzymolysis reaction, and with the increase of pressure, the degree of enzymolysis reaction increased gradually, and the molecular weight decreased gradually. After HPI modification, the hydrophobic groups were gradually exposed, and the surface hydrophobicity increased first and then decreased with the increase of pressure, the change difference was significant (P<0.05). The surface hydrophobicity reached the maximum at 200 MPa. After enzymolysis, the free sulfhydryl content of HPIH decreased significantly (P<0.05), while the surface sulfhydryl content increased first and then decreased with the increase of pressure. The determination of amino acid composition and content of protein before and after modification showed that the amino acid composition of HPI remained unchanged before and after modification, but the contents of various amino acids decreased to varying degrees. According to the fourier infrared spectroscopy, compared with HPI, the absorption peak intensity, peak shape and peak area of HPIH changed to different degrees, indicating that the secondary structure of protein was changed by the ultra-high pressure assisted enzymatic hydrolysis reaction. The endogenous fluorescence spectra showed that the fluorescence intensity of HPIH increased and the maximum emission wavelength was redshifted, indicating that the tertiary structure of HPI was changed by the enzymatic hydrolysis reaction. The results of antioxidant activity showed that appropriate pressure treatment could effectively improve the antioxidant capacity of enzymatic hydrolysis products. When the pressure was 200 MPa, the reducing power of HPIH of DPPH· and ABTS+· reached the highest. In conclusion, ultrahigh pressure assisted enzymatic hydrolysis modification can significantly change the secondary and tertiary structure of HPI, exposing hydrophobic groups and other active groups, thereby improving its antioxidant properties. -
汉麻(Cannabis sativa L.)属荨麻目、汉麻种的一年生草本植物,又名大麻、火麻等[1]。汉麻存活能力较强,在我国各地都能种植,其中以广西巴马汉麻种植及食用历史最为悠久[2]。汉麻蛋白中含有8种人体必需氨基酸[3],其中组氨酸和精氨酸的含量比较高,被认为是一种适合老年人和婴儿的优质蛋白[4]。汉麻蛋白质除氨基酸种类及含量丰富外还具有增强免疫力、抗氧化、抗疲劳、降血糖、维持肠道菌群平衡等作用,是一种多功效植物蛋白资源[5−6]。但汉麻蛋白质溶解度较低,功能性质较差[7],导致其难以作为原辅料应用于食品及营养保健品生产中,因此,有必要通过某些技术手段改善其功能特性以更好地开发利用汉麻蛋白,提升其市场竞争力。
利用超高压(ultra-high pressure,UHP)辅助酶解技术处理蛋白质,会使蛋白质结构以及功能性质发生改变[8−9],实现蛋白质功能性质多元化的同时,也解决了目前酶解改性技术存在的酶解过程随机、酶利用率低和酶解效率低等问题[10],提高其应用价值。研究表明压力的施加会使蛋白质构象改变,发生多肽链的伸展和立体结构的松散并且巯基含量及表面疏水性等也会发生变化[10−11],若在超高压环境下进行酶解反应,会使蛋白质结构进一步改变进而影响酶与底物之间的酶解效应,从而表现蛋白质功能性质的改善、酶解进程加快以及水解度的有效提高[12−13]。因此,利用超高压辅助酶解反应改性汉麻分离蛋白(hemp protein isolate,HPI),探究HPI潜在功能性价值,对充分开发利用植物蛋白资源十分重要。
前期基础研究已经确认超高压辅助酶解反应的最优条件:加酶量(复合蛋白酶)5000 U/g、酶解改性pH8.0、酶解改性温度55 ℃、酶解改性时间50 min。在此基础上本研究利用超高压辅助酶解反应对HPI进行改性处理,探究改性后HPI结构特性的变化,以及对其抗氧化活性功能的影响,对指导实际生产和充分利用HPI资源具有重要的现实意义。
1. 材料与方法
1.1 材料与仪器
汉麻分离蛋白(食品级96%) 黑龙江省大庆市星火牧场;氢氧化钠、铁氰化钾 天津凯通化学试剂有限公司;磷酸氢二钠、磷酸二氢钠 天津市光复科技发展有限公司;甘氨酸 上海吉至生化科技有限公司;乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA) Amesco分子生物试剂;复合蛋白酶(试剂级)、考马斯亮蓝G-250、牛血清蛋白三羟甲基氨基甲烷(Tris)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 北京Solarbio科技有限公司;三氯乙酸 北京京土恒盛商贸有限公司;三氯化铁 台山市粤侨试剂塑料有限公司;硫酸亚铁 国药集团化学试剂有限公司;水杨酸 天津市化工三厂有限公司;过氧化氢 上海凌峰化学试剂有限公司;8-苯胺-1-萘磺酸(8-Anilino-1-naphthalenesulfonic Acid,ANS) Sigma公司;以上试剂均为分析纯。
HHP-400超高压设备 沈阳人和机电工程设备有限公司;FD5-3型冷冻干燥机 美国SIM公司;8400s傅立叶变红外光谱仪 日本岛津公司;721型分光光度计 日立科学仪器(北京)有限公司;HH-4型数显恒温水浴锅、DF-1集热式磁力搅拌器 金坛市双捷实验仪器厂;DYCZ-40D型转印电泳仪 北京六一仪器厂;721型分光光度计 上海元析仪器有限公司;PT-3502G型酶标仪 北京普天新桥技术有限公司;PHS-3C型pH计 梅特勒-托利多仪器有限公司;Sartorius BSA223S型电子天平 赛多利斯科学仪器(北京)有限公司;GZX-9140MBE型电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;L-8900氨基酸分析仪 天美(中国)科学仪器有限公司。
1.2 实验方法
1.2.1 超高压辅助酶解反应条件
配制50 g/L的汉麻蛋白溶液,用1 mol/L NaOH溶液调节溶液pH至最适值。随后加入蛋白酶与上述溶液混匀,将此蛋白溶液密封在聚氯乙烯袋中,放入HHP-400超高压设备中于不同压力(0.1、100、200、300 MPa)下,在设定温度中进行酶解改性反应单因素实验,以溶解度及水解度为判定指标,筛选出最适酶解反应条件。水解物经FD5-3型冷冻干燥机进行冻干得到蛋白样品。经前期基础研究确定,最佳酶解反应条件为:复合蛋白酶加酶量5000 U/g、改性pH8.0、改性温度55 ℃、改性时间50 min,此条件下HPI的溶解度达到83.55%,水解度达到10.5%[14]。
1.2.2 SDS-PAGE电泳分析
参考文献[15]方法,略有改动。分别选取分子量范围在14.4~97.4 kDa以及3.3~31 kDa的蛋白质标准品用于原蛋白质与改性蛋白质样品电泳分析。制样:将蛋白质样品配制成浓度为2 mg/mL的溶液,加入蛋白上样缓冲液(含β-巯基乙醇),混匀后,沸水浴5 min,上样量为10 μL。制胶:配制12%分离胶、5%浓缩胶用于原蛋白质电泳分析以及20%分离胶、10%夹层胶、4%浓缩胶用于改性蛋白质电泳分析,配制完成后,分别依次注入两板之间,插入梳子等待凝胶形成。电泳:上层胶电压80 V,时间30 min,下层胶电压120 V,时间100 min(原蛋白);30 V跑1~2 h后,待指示前沿到达分离胶时,调至100 V,跑5~6 h(改性蛋白样品)。染色与脱色:使用考马斯亮蓝R-250进行染色,染色时间控制在20 min左右,染色结束后使用脱色液(冰醋酸10%,甲醇30%)脱色至条带清晰。
1.2.3 表面疏水性的测定
参考文献[16]方法,略有改动。用0.01 mol/L的磷酸盐缓冲液(pH7.0)将蛋白质样品稀释至0.025~0.02 mg/mL,配制8 mmol/L 8-苯胺基-1-萘磺酸(ANS)溶液作为荧光探针。分别取稀释样品5 mL与ANS溶液50 μL混合均匀后避光反应20 min,使用荧光分光光度计测定其荧光强度,测试所用激发波长、发射波长分别为390 nm、470 nm,空白对照为缓冲液与ANS混合溶液。蛋白质的表面疏水性为蛋白质浓度与荧光强度拟合回归方程的斜率。
1.2.4 汉麻分离蛋白结构分析
1.2.4.1 氨基酸含量及组成分析
取冻干蛋白质样品0.1 g于水解管中,加入10~15 mL 6 mol/L HCl,将水解管置于冷冻剂中,充氮气保护,在鼓风干燥箱(110 ℃)中水解22 h后,将水解液定容至50 mL,准确吸取1 mL于试管中,待干燥完全后,用1 mL柠檬酸钠缓冲溶液(pH2.2)复溶,过滤后上样,采用氨基酸自动分析仪进行分析[17]。
1.2.4.2 傅立叶红外光谱分析
参考文献[18]方法,略有改动。将待测样品在干燥器内用P2O5干燥两星期备用。先将溴化钾置于烘箱(105 ℃)烘干后压成薄片,将其放入载片槽中使用红外光谱仪进行分析参比。再称取20 mg蛋白质样品与KBr粉末(比例为1:100)混匀后放入研钵中充分研磨,压成薄片,利用傅立叶红外光谱仪进行全波段扫描(400~4000 cm−1),分辨率4 cm−1。
1.2.4.3 巯基含量的测定
参考文献[19]方法,略有改动。游离巯基的测定:将蛋白质样品配制成10 mg/mL的溶液,取1 mL与pH8.0的Tris-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、8 mol/L尿素、0.04 mol/L EDTA)5 mL于EP管中,加入4 mg/mL的DTNB溶液0.04 mL,混合均匀后于室温下静置反应20 min,在412 nm处测量其吸光度值记为A412。
表面巯基的测定:将蛋白质样品配制成10 mg/mL的溶液,取1 mL与pH8.0的Tris-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、0.04 mol/L EDTA)5 mL于EP管中,混合均匀后于室温下静置反应20 min,在412 nm处测量其吸光度值记为A412。计算公式如下:
巯基含量(µmol/g)=A412×DC×ε (1) 式中:A412表示412 nm处的吸光值;D表示稀释倍数;ε表示消光系数,13600 mol−1/cm;C表示样品浓度,mg/mL。
1.2.4.4 内源荧光光谱分析
参考文献[20]方法,略有改动。将蛋白质样品用0.01 mol/L、pH7.0磷酸盐缓冲液配制成浓度为1 mg/mL的溶液,取1 mL置于四通比色皿中,利用荧光分光光度计进行内源荧光光谱扫描,设置激发波长、发射波长分别为295 nm、310~450 nm,扫描速度1200 nm/min,以磷酸盐缓冲溶液为空白对照。
1.2.5 汉麻分离蛋白抗氧化活性的测定
1.2.5.1 DPPH自由基清除率测定
参考文献[21]方法并略作改动,称取DPPH粉末5 mg,在避光环境下使用适量无水乙醇充分溶解,再定容至100 mL,配制成50 µg/mL的DPPH溶液,该溶液现用现配。按照表1添加溶液,分别充分混合均匀后,室温避光反应30 min,于波长517 nm处采用酶标仪测定吸光度,计算公式如式(2)。
表 1 DPPH自由基清除活性测定各试剂添加量Table 1. DPPH free radical scavenging activity determination of reagent addition amount溶液名称 As(µL) Ac(µL) Ab(µL) DPPH溶液 100 0 100 样品溶液 100 100 0 样品溶剂溶液 0 0 100 无水乙醇溶液 0 100 0 DPPH自由基清除率(\%)=1−As−AcAb×100 (2) 式中:As表示样品与DPPH混合液吸光值;Ac表示样品与无水乙醇混合液吸光值;Ab表示蒸馏水与DPPH混合液吸光值。
1.2.5.2 ABTS+自由基清除率测定
参考文献[22]方法并略作改动,称取ABTS 200 mg,过硫酸钾34.4 mg,溶于50 mL蒸馏水中,搅拌均匀,避光静置24 h后,作为ABTS母液。用95%乙醇将适量ABTS母液稀释至吸光度值在0.7±0.02内(OD734)待用,该溶液现用现配。按照表2添加溶液,分别充分混合均匀后,室温避光反应5 min,在波长734 nm处采用酶标仪测定吸光度,计算公式如式(3)。
表 2 ABTS+自由基清除活性测定各试剂添加量Table 2. ABTS+ free radical scavenging activity determination of reagent addition amount溶液名称 As(µL) Ab(µL) ABTS溶液 180 180 样品溶液 20 0 样品溶剂溶液 0 20 ABTS+自由基清除率(%)=Ab−AsAb×100 (3) 式中:Ab表示蒸馏水与ABTS混合液吸光值;As表示样品与ABTS混合液吸光值。
1.2.5.3 还原能力测定
参考文献[23]方法并略作改动,分别配制PBS缓冲溶液(0.2 mol/L)、铁氰化钾溶液(1%)、氯化铁溶液(0.1%)、三氯乙酸溶液(10%)。将一定浓度蛋白质样品溶液、PBS缓冲溶液和铁氰化钾溶液按照1:1:5比例混匀,于50 ℃水浴锅中静置20 min,然后室温下加入与样品溶液一致比例的三氯乙酸溶液,4000 r/min离心10 min后保留上清液。按照下表3添加溶液,分别充分混合均匀后,于波长700 nm处采用酶标仪测定吸光度,计算公式如式(4)。
表 3 还原能力测定各试剂添加量Table 3. Reducing power determination of reagent addition amount组别 上清液(µL) 氯化铁溶液(µL) 蒸馏水(µL) 样品组A2 70 70 70 空白组A1 0 70 140 还原能力(nm)=A2−A1 (4) 式中:A2表示样品与氯化铁混合液吸光值;A1表示蒸馏水与氯化铁混合液吸光值。
1.3 数据处理
采用IBM SPSS Statistics26进行显著性分析(P<0.05);利用Statistic 8、Origin 2019 Pro软件对数据进行分析及绘图,所有实验组均进行三次平行实验,数据采用平均值±标准差的形式表示。
2. 结果与分析
2.1 超高压辅助酶解反应对HPI电泳特性的影响
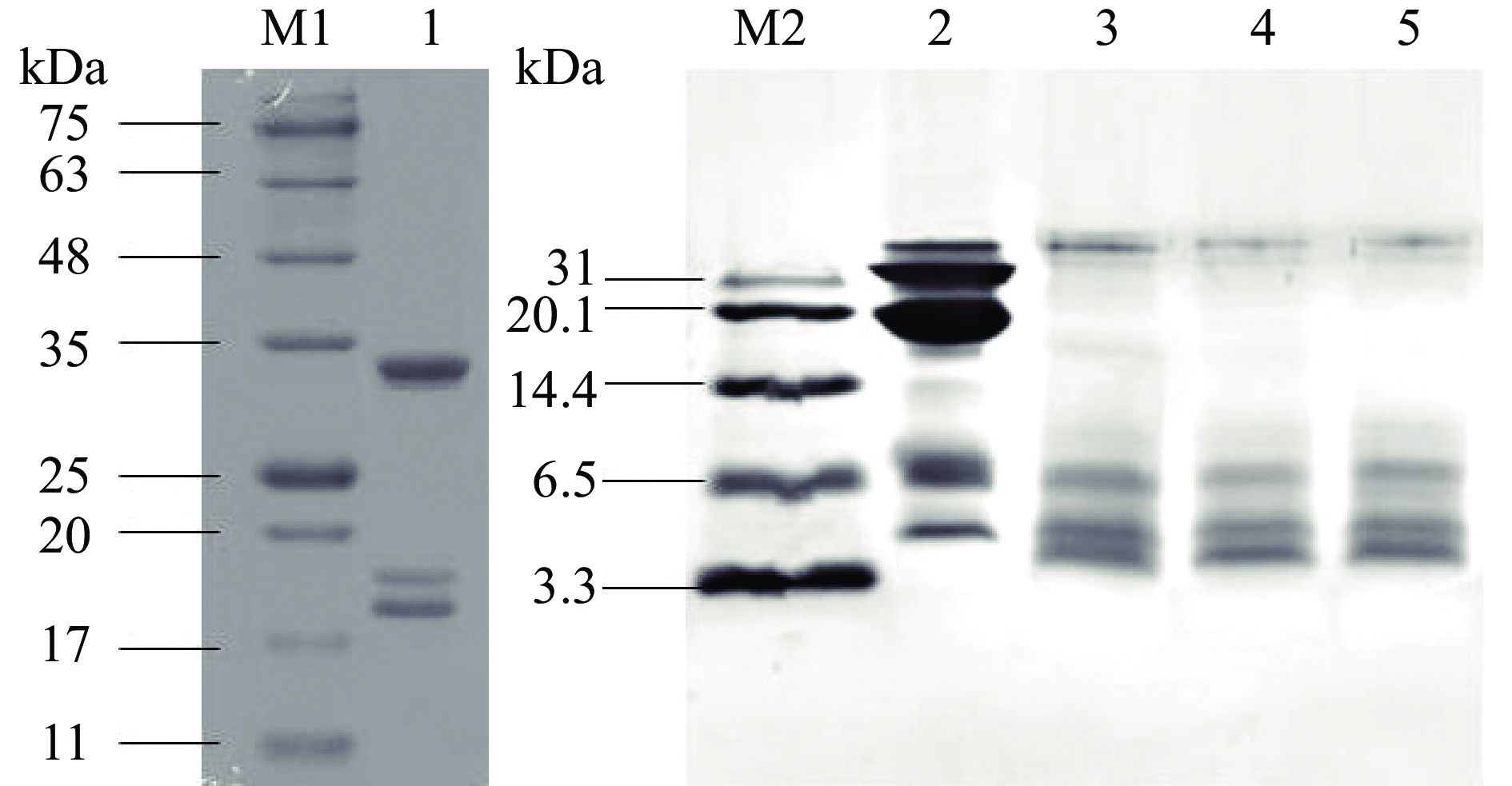
图1为超高压辅助酶解反应前后HPI凝胶电泳图,通过各条带对比进行汉麻分离蛋白酶解物分子量分析。由于改性后产物蛋白分子量有所降低,在标准凝胶电泳中条带呈现效果不佳,因此使用低分子量电泳对酶解产物分子量进行分析。由图1可知,改性前后蛋白质的亚基组成发生明显改变,HPI在电泳图中可见三条明显条带,最大分子量在34 kDa左右,经酶解改性后,产物蛋白分子量明显降低,且压力的增加增大了HPI的酶解程度,分子量降低更加明显,但不同压力处理下酶解产物条带的进样口附近均有聚集体存在,说明仍有一部分大分子量蛋白质未被酶解。
2.2 超高压辅助酶解反应对HPI表面疏水性的影响
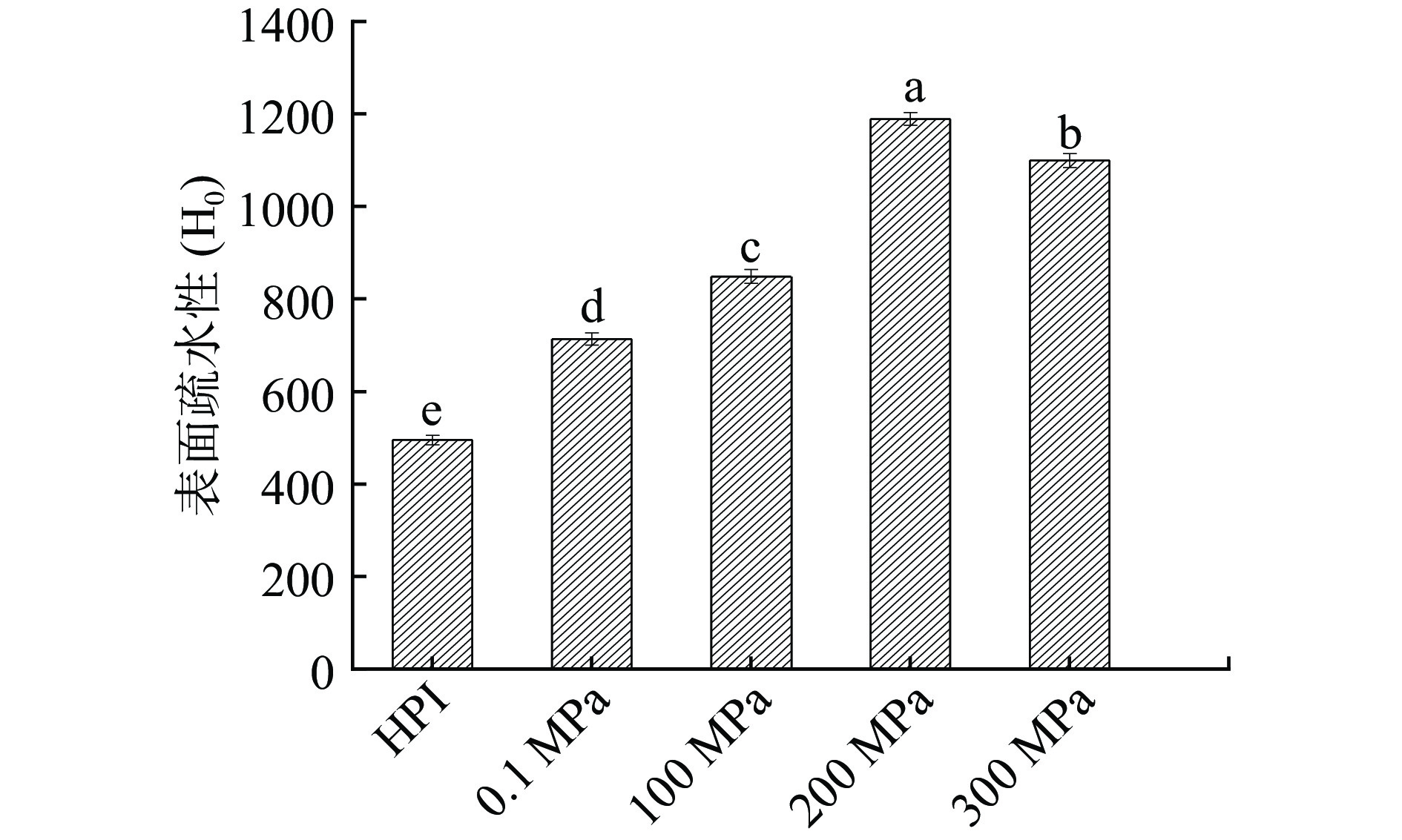
表面疏水性表示蛋白质分子表面上疏水基团的数量,是判断蛋白质构象及功能性质变化的重要指标之一。当蛋白质结构发生伸展或折叠时,其表面疏水区域会随之暴露或埋藏,与乳化性、起泡性等有着紧密联系,通常蛋白质表面疏水性越强,蛋白质乳化性及起泡性越好[24]。如图2所示为超高压辅助酶解反应对产物表面疏水性的影响,随着压力的增大,汉麻蛋白酶解产物(HPIH)的表面疏水性先升高后降低,在200 MPa时表面疏水性最强,当压力升到300 MPa时有所下降,但仍高于未经水解HPI。这是因为蛋白质经过高压酶解后结构变得更加松散,肽链展开,使蛋白质分子疏水基团逐渐暴露,从而表面疏水性增强,然而300 MPa压力处理时表面疏水性有所降低可能是因为在压力的作用下水解物重新聚集,使暴露于表面的疏水基团重新被隐藏于蛋白分子内部[25]。可见,超高压与酶解反应在提高HPI表面疏水性方面存在着协同作用,表面疏水性的提高将会对酶解产物乳化性等功能性质产生有益影响。
2.3 超高压辅助酶解反应对HPI氨基酸组成及含量的影响
超高压辅助酶解改性前后HPI氨基酸组成及含量如表4所示。由于样品处理是使用酸水解法,色氨酸遭到破坏,故氨基酸组成与含量分析中不包括对色氨酸的分析。
表 4 不同压力下酶解产物氨基酸含量Table 4. Amino acid content of enzymatic hydrolysis products under different pressures氨基酸 HPI 0.1 MPa 100 MPa 200 MPa 300 MPa 天冬氨酸(Asp) 7.36±0.04a 6.63±0.02b 6.51±0.05c 6.61±0.02b 6.57±0.03bc 苏氨酸(Thr)* 2.26±0.02a 2.18±0.01b 2.15±0.02bc 2.13±0.01c 2.12±0.02c 丝氨酸(Ser) 3.56±0.02a 3.17±0.01c 3.38±0.03b 3.15±0.02c 3.09±0.02d 谷氨酸(Glu) 12.3±0.04a 11.0±0.04d 10.4±0.04e 11.5±0.02c 12.0±0.05b 甘氨酸(Gly) 2.70±0.03a 2.43±0.01b 2.27±0.01d 2.44±0.01b 2.37±0.01c 丙氨酸(Ala) 2.78±0.01a 2.53±0.02b 2.56±0.02b 2.46±0.01c 2.40±0.02d 半胱氨酸(Cys) 0.69±0.02a 0.68±0.01a 0.64±0.01b 0.61±0.01c 0.63±0.01bc 缬氨酸(Val)* 2.83±0.03a 2.63±0.02b 2.47±0.02c 2.61±0.02b 2.62±0.02b 甲硫氨酸(Met)* 1.38±0.01a 1.32±0.02b 1.12±0.02c 1.14±0.01c 1.27±0.01b 异亮氨酸(IIe)* 2.55±0.03a 2.36±0.03b 2.52±0.01a 2.24±0.01c 2.38±0.02b 亮氨酸(Leu)* 4.20±0.04a 3.90±0.03d 4.12±0.04b 4.05±0.03c 4.14±0.03b 酪氨酸(Tyr) 2.16±0.01a 2.00±0.01c 2.12±0.01b 1.96±0.01d 1.91±0.01e 苯丙氨酸(Phe)* 3.21±0.03a 3.18±0.01ab 3.15±0.02b 3.04±0.03c 2.99±0.03c 赖氨酸(Lys)* 1.60±0.01a 1.58±0.02ab 1.54±0.01c 1.57±0.01b 1.52±0.01c 组氨酸(His) 1.72±0.01a 1.64±0.01c 1.66±0.01b 1.53±0.01d 1.50±0.01e 精氨酸(Arg) 9.39±0.04a 8.83±0.03d 9.23±0.05b 9.27±0.03b 9.10±0.04c 脯氨酸(Pro) 2.53±0.01a 2.14±0.01bc 2.09±0.02d 2.16±0.02b 2.12±0.02cd 注:标注*的为必需氨基酸,a~d表示压力组间差异显著(P<0.05)。 氨基酸含量及组成决定了蛋白质的营养价值,由表4可知,改性前后HPI氨基酸组成不变且种类齐全,均含有17种氨基酸,7种必需氨基酸和10种非必需氨基酸。而酶解产物总氨基酸含量存在不同程度下降。非必需氨基酸方面,对于食物中鲜味物质的呈现有着非常重要作用的谷氨酸和天冬氨酸含量较高[26],酶解产物的天冬氨酸含量在0.1、100、200、300 MPa时分别降低了9.92%、11.55%、10.19%和10.73%;谷氨酸含量在0.1、100、200、300 MPa时分别降低了10.57%、15.45%、6.50%和2.44%。另外,作为维持婴幼儿生长发育必不可少的精氨酸含量总体来说也十分丰富,虽然其含量在0.1、100、200、300 MPa时分别降低了5.96%、1.70%、1.28%和3.09%,但仍远高于土豆蛋白、小麦蛋白与玉米蛋白等常见植物蛋白质中的精氨酸含量(2%~4%)[27]。必需氨基酸中,缬氨酸、异亮氨酸含量降低幅度较大,其中缬氨酸在0.1、100、200、300 MPa时分别降低了7.07%、12.72%、7.77%和7.42%;异亮氨酸在0.1、100、200、300 MPa时分别降低了7.45%、1.17%、12.16%和6.67%。由以上结果可知,虽然HPI经超高压辅助酶解改性后各氨基酸存在不同程度损失,但整体来看酶解产物在营养价值方面仍具备一定优势,因此HPI及HPIH可以作为优质的植物蛋白质资源以提升其在食品加工应用中的附加值。
2.4 超高压辅助酶解反应对HPI二级结构的影响
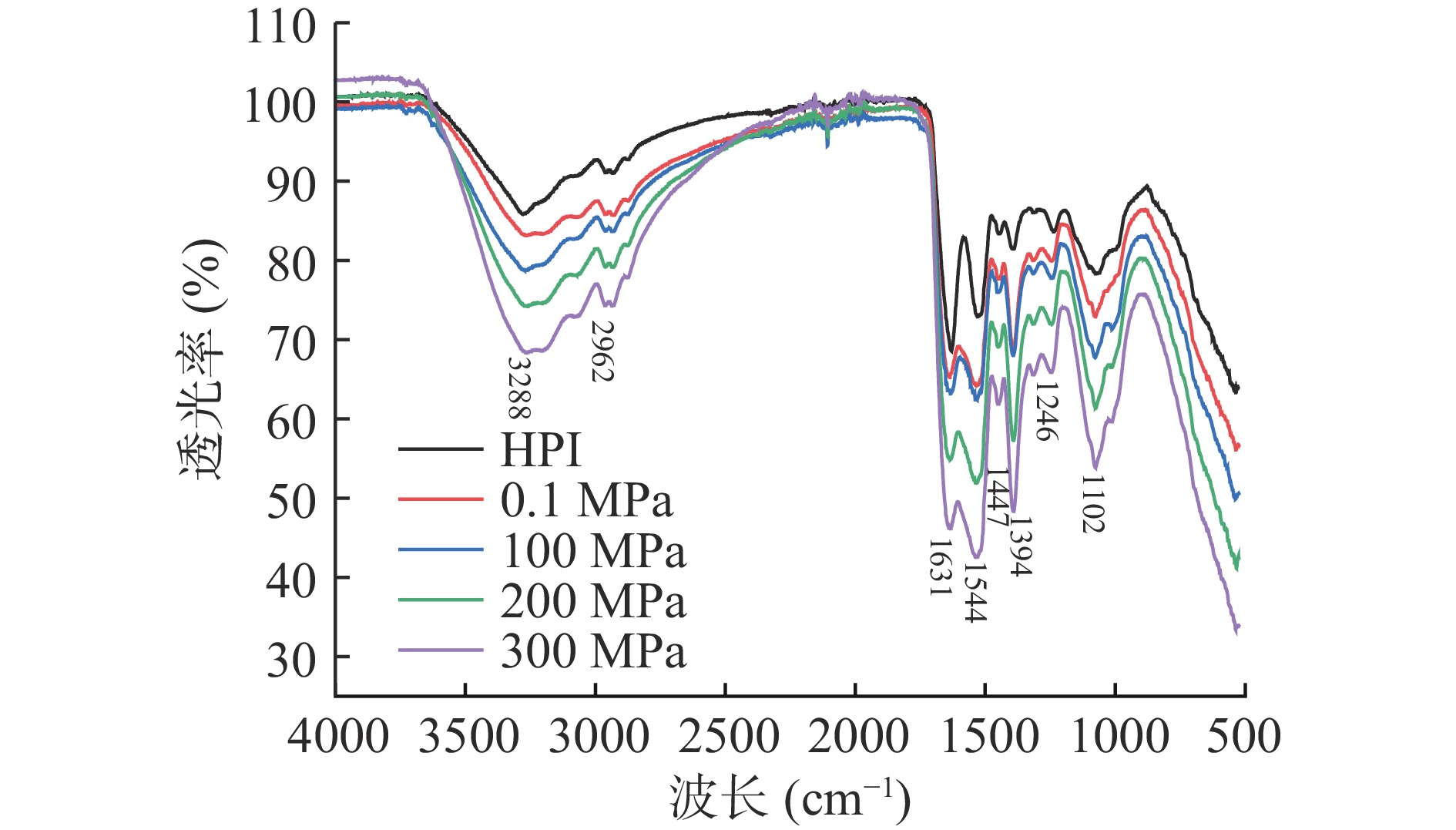
傅立叶红外光谱常被用于分析蛋白质中氨基酸基团变化情况,是探究蛋白质和多肽二级结构变化的重要手段。HPI经超高压辅助酶解反应改性前后红外谱图如图3所示,蛋白质在3288、2962、1631、1544、1447、1394、1246、1102 cm−1左右存在明显吸收峰,其中在3288 cm−1附近处的吸收峰为羟基伸缩振动,酰胺基团中的N-H的伸缩振动;2962 cm−1附近的吸收峰为甲基、亚甲基中C-H的对称和反对称伸缩振动;1631 cm−1附近处尖锐的吸收峰为酰胺Ⅰ带C=O伸缩振动;1544 cm−1、1447 cm−1附近处为蛋白酰胺II带中N-H的弯曲振动;1394、1246 cm−1处吸收峰为酰胺Ⅲ带中C-N伸缩振动;1102 cm−1处由C-O-C伸缩振动引起[28]。从谱图中可以看出,与HPI相比,不同压力下的HPIH峰型由尖锐变得相对平缓,主要是经过酶解改性后产物中分子间氢键增多所致。酶解产物在不同波长下吸收峰的面积和峰形均存在一定差异,且随着压力的变化,峰位发生了不同程度的偏移,峰强度也发生改变,可见HPI经超高压辅助酶解改性后结构发生了明显变化,从而影响了其理化及功能性质[29]。
2.5 超高压辅助酶解反应对HPI三级结构的影响
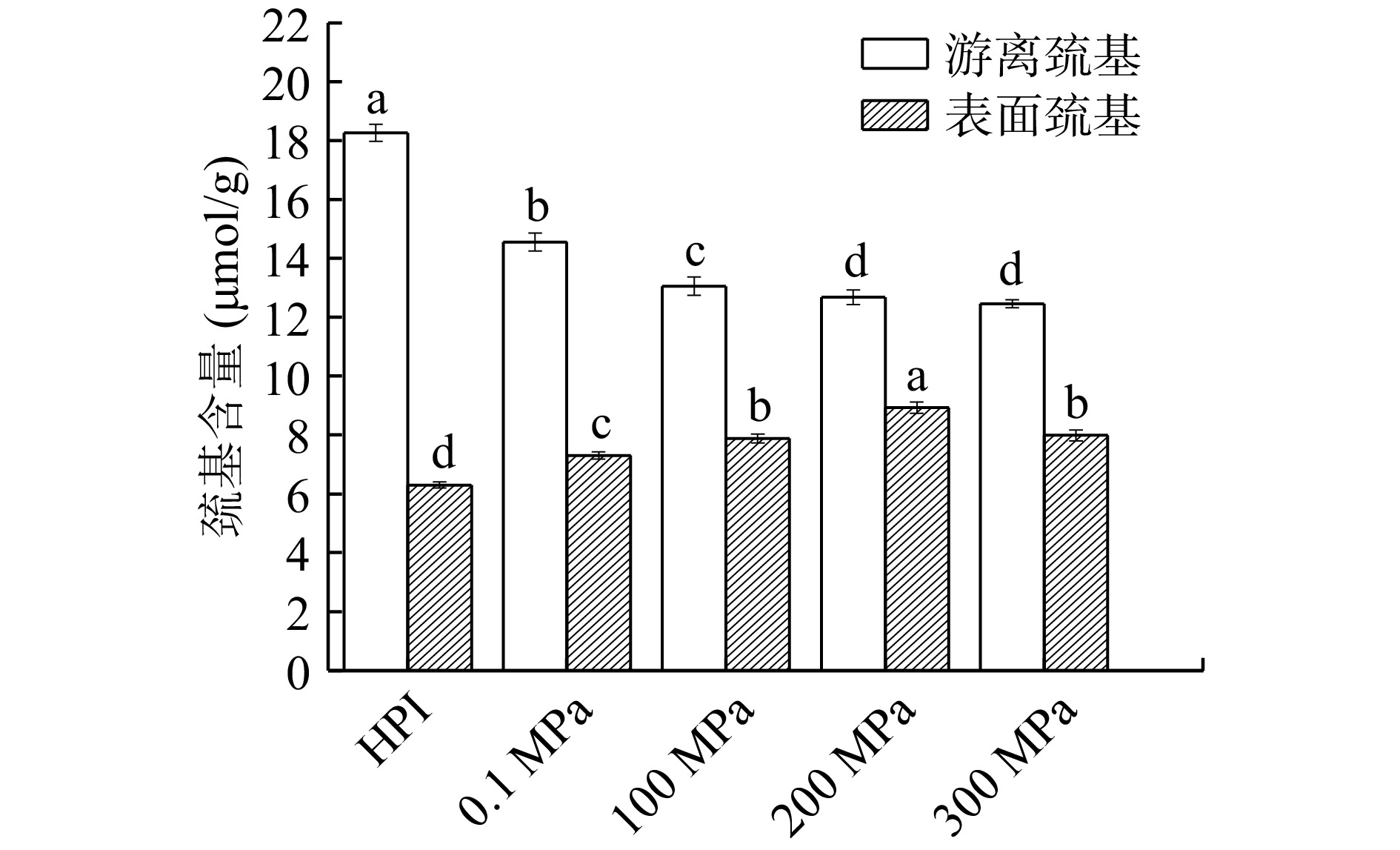
巯基作为蛋白质一种重要的功能基团,属于维持蛋白质三级结构稳定的弱次级键,巯基含量变化与蛋白质结构改变及功能性质的改善密切相关。由图4可知,与HPI相比,酶解产物的表面巯基含量呈先上升后下降的趋势,200 MPa以内的压力处理导致表面巯基含量升高,是由于在超高压酶解反应作用下多肽链更加伸展,使包埋在蛋白质内部的疏水基团及巯基基团暴露,因而表面巯基含量增加,当压力增加至300 MPa时,蛋白质在高压环境下发生重折叠,使暴露于表面的巯基重新包埋于蛋白质分子内部,导致其含量降低。HPIH游离巯基含量随着压力的增加而显著减少,是因为一些暴露到分子表面的巯基基团会发生氧化反应转化成二硫键,而且在压力及酶解作用下,新产生的游离巯基也会发生重组导致二硫键的生成,因此游离巯基含量降低,这与Zhao等[30]在探究花生蛋白酶解改性时巯基含量变化结果类似。
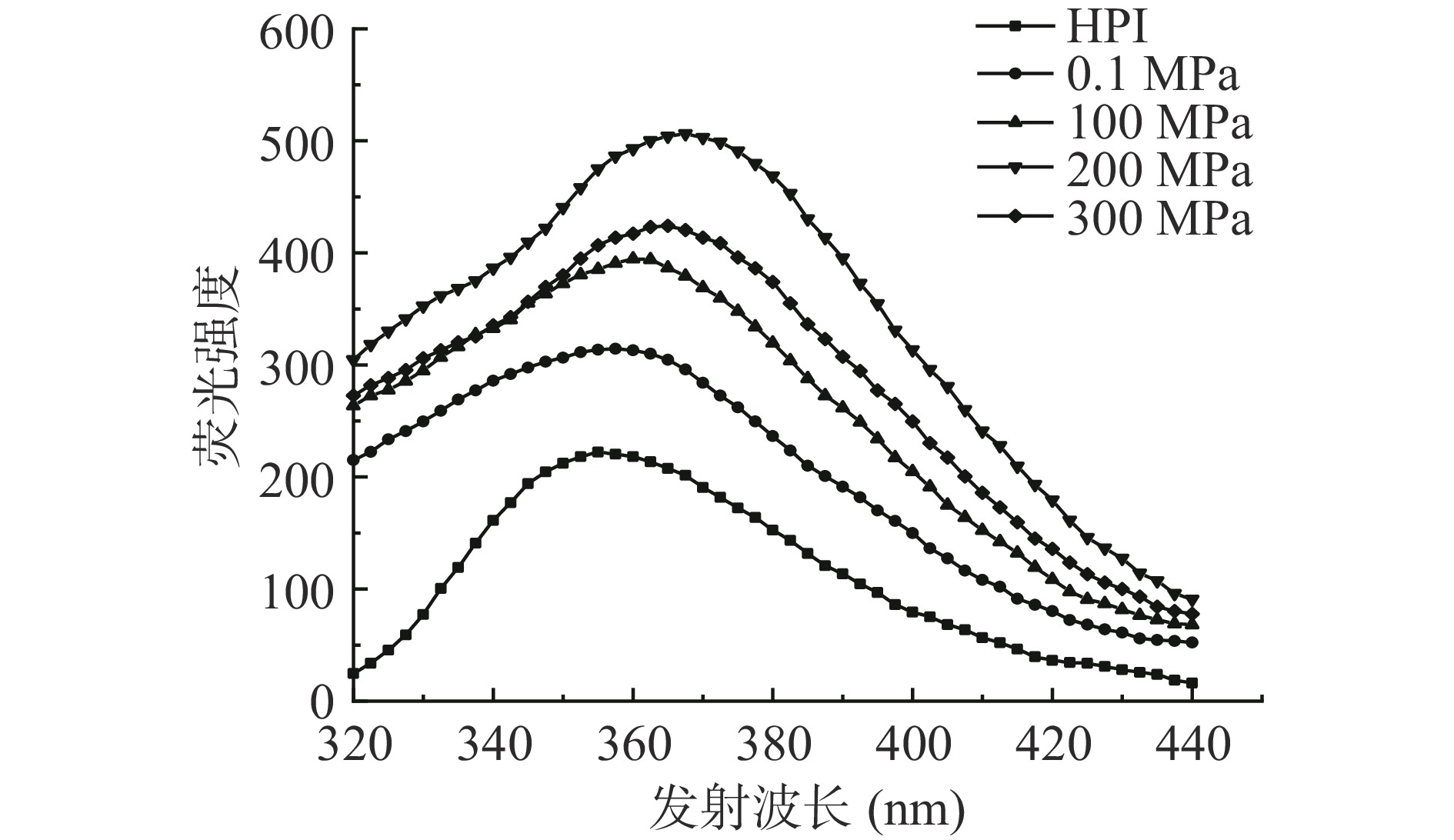
蛋白质中的色氨酸等芳香族氨基酸在特定波长下可被激发产生荧光,可通过荧光强度和最大发射波长的改变判断蛋白质三级结构的变化。超高压辅助酶解改性产物荧光光谱如图5所示,在0.1~300 MPa压力处理下,HPIH的荧光强度随压力增大呈现先升高后降低的趋势,当压力为200 MPa时,荧光强度最大,压力达到300 MPa时,荧光强度反而下降。此外,与HPI相比,酶解产物最大发射波长均发生一定程度红移。出现以上现象可能是因为在酶解反应后,蛋白质部分结构发生了伸展,内部疏水区被破坏,芳香族疏水性基团逐渐显露,更多的色氨酸从蛋白质分子内部非极性环境中逐渐暴露于溶剂中,导致荧光强度升高[31]。但压力升高至300 MPa时,蛋白质分子发生聚集,芳香族疏水性基团重新被包裹起来,因此荧光强度较200 MPa处理时有所降低。以上结果表明,超高压辅助酶解反应处理破坏了HPI分子间作用力,蛋白质三级结构发生改变,这与图2表面疏水性结果一致。
2.6 超高压辅助酶解反应对HPI抗氧化活性的影响
2.6.1 超高压辅助酶解反应对HPI清除DPPH自由基的影响
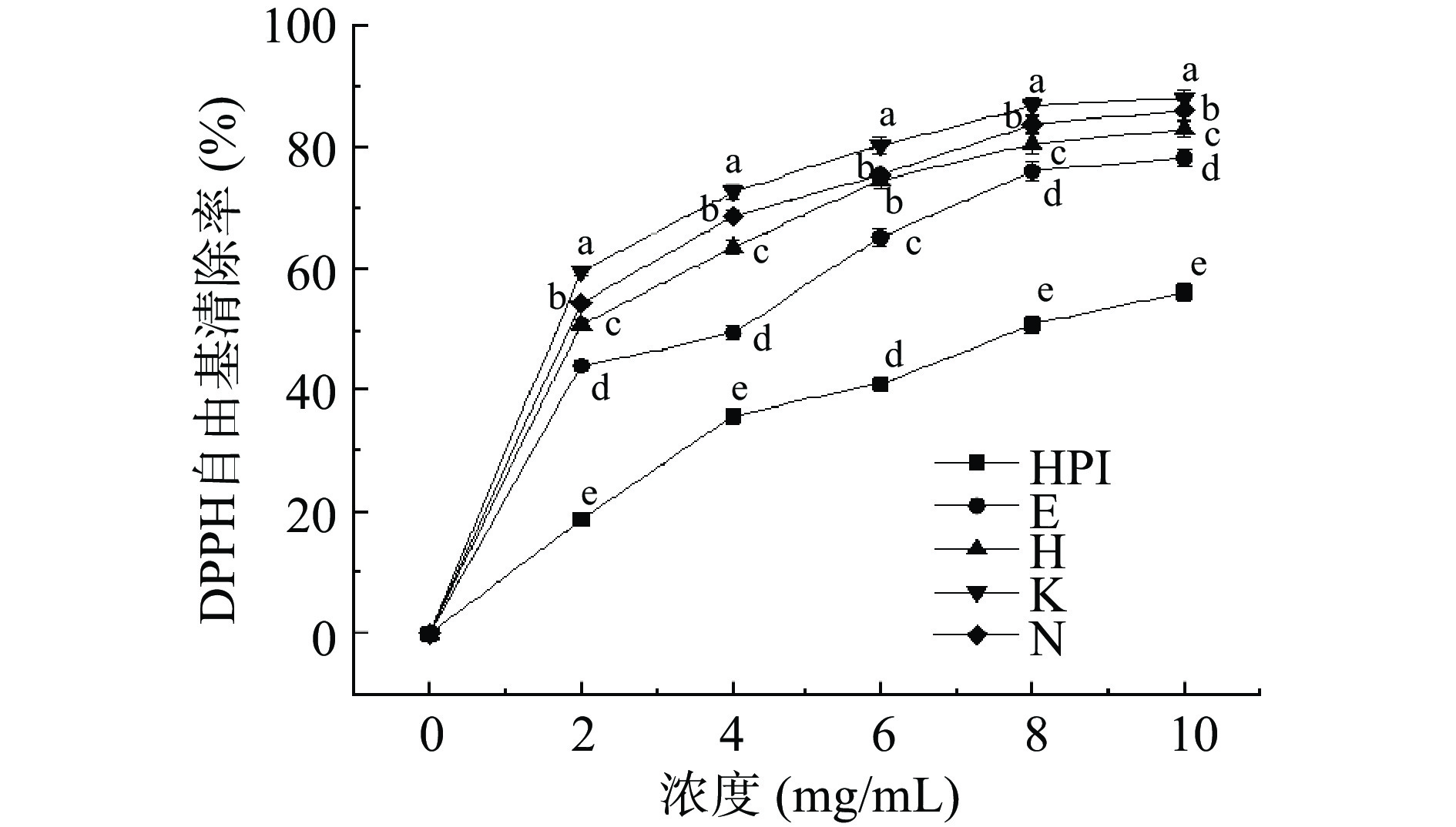
DPPH自由基可在有机溶剂中稳定存在,在乙醇溶液呈紫色,吸收峰为517 nm。因具有单一电子,故能接受一个电子或氢离子。当与抗氧化剂作用时,可使体系颜色变浅或消失,吸光值下降[32]。图6为超高压辅助酶解反应对不同浓度下酶解产物清除DPPH自由基的影响,可以看出,HPIH与HPI均呈现一定的抗氧化能力,且样品浓度与其对DPPH自由基的清除能力呈一定剂量关系,即自由基清除率随样品浓度的增大而增大。HPI经过酶解改性后,DPPH自由基清除能力显著提升,当压力在0.1~300 MPa时,HPIH自由基清除率随压力的增加先增大后减小,在200 MPa时达到最大值。是因为在200 MPa压力范围内,压力的增加使蛋白质构象逐渐发生改变,蛋白质结构伸展,酶解作用增强,产生大量具有抗氧化活性的小分子肽段,因此DPPH自由基清除率增大,但压力过大(300 MPa)会导致蛋白质重新发生聚集且蛋白酶失活[33],对水解反应产生抑制作用,从而导致清除率降低。
2.6.2 超高压辅助酶解反应对HPI清除ABTS+自由基的影响
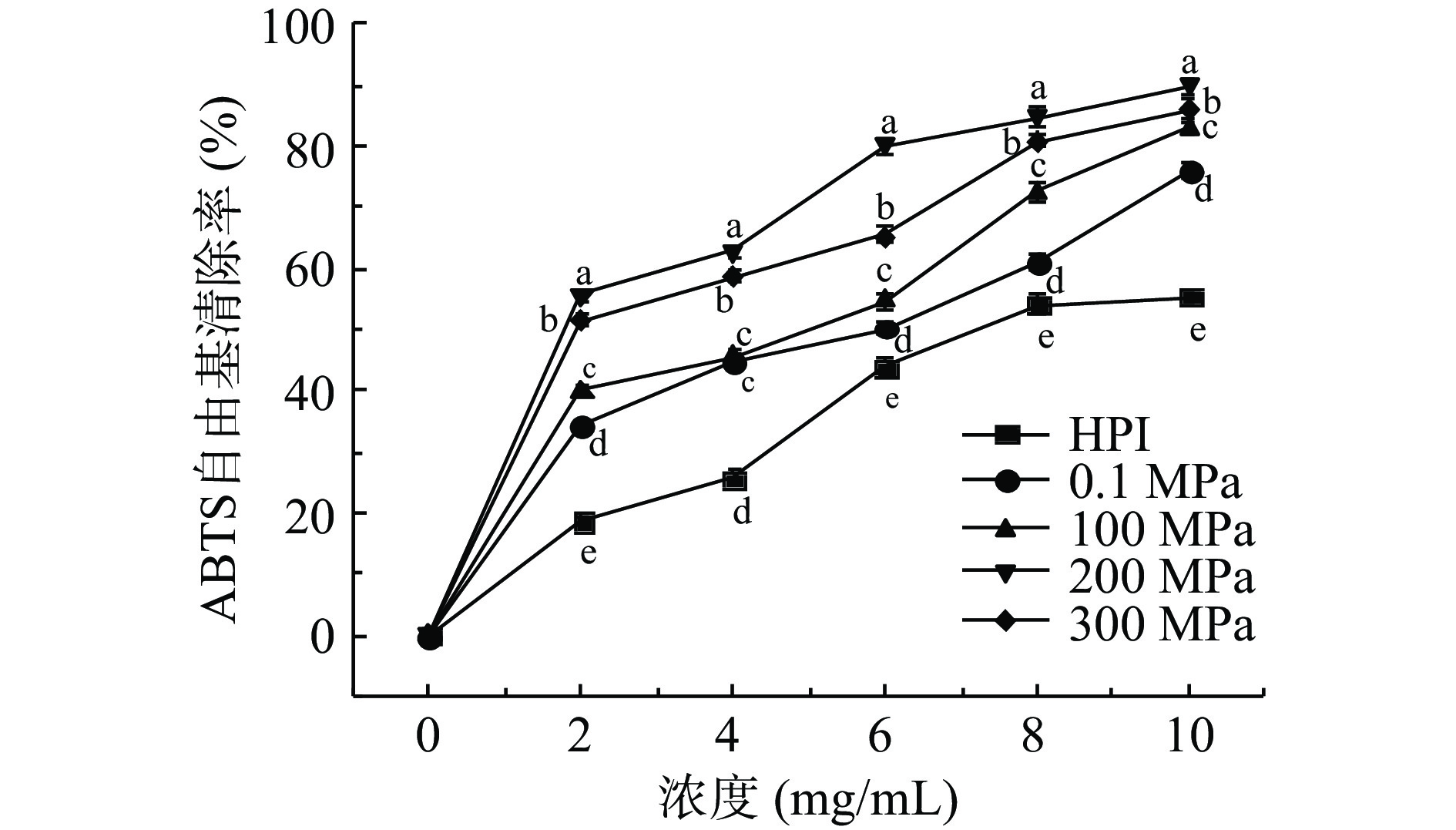
ABTS与过硫酸钾反应,可以生成绿色的ABTS+自由基,该自由基在734 nm处有最大吸收,当体系中加入抗氧化剂时,会使其在734 nm处的吸光度降低[34]。经计算,得到超高压辅助酶解反应产物在不同浓度下的ABTS+自由基清除率,如图7所示,在2~10 mg/mL浓度范围内,ABTS+自由基清除能力随着样品浓度的增加而逐渐增强。总体来看,HPIH对ABTS+自由基的清除能力从大到小依次为200、300、100、0.1 MPa,较HPI相比,均有不同程度增强,这是因为HPI经酶解及超高压处理后其蛋白结构发生变化,因此使得酶解产物的ABTS+自由基的清除率提高,这对于HPI酶解产物抗氧化性的研究是一个积极的结果[35]。此前,赵贵川[36]在探究压力对米渣蛋白酶解物抗氧化能力影响的实验中发现,当压力过大时,酶解产物抗氧化能力反而降低,本实验结论与之相类似。
2.6.3 超高压辅助酶解反应对HPI还原能力影响
还原能力测定原理是抗氧化剂使铁氰化钾的Fe3+还原成Fe2+(亚铁氰化钾),亚铁氰化钾进一步与三氯化铁反应生成在700 nm处有最大吸光度的普鲁士蓝,因此测定700 nm处吸光度大小可以间接反映抗氧化剂还原能力的大小,吸光度越大,还原能力越强[37]。图8为超高压辅助酶解反应对不同浓度下酶解产物还原能力的影响,HPI经过改性后,其产物的还原能力均有所增加,且随着处理压力的提高,呈现先增后减的趋势,在不同样品浓度下,200 MPa处理下的HPIH均具有最大吸光度,而在300 MPa处理下还原能力反而降低,这说明适当的压力处理可以最大程度提升酶解产物的抗氧化能力,与关海宁等[38]研究结果相符。
3. 结论
本研究通过超高压辅助酶解HPI,探究超高压处理条件对HPI结构和抗氧化活性的影响。随压力的增加蛋白质酶解反应程度增大,分子量逐渐降低。表面疏水性逐渐增加而后下降,在200 MPa时表面疏水性达到最大。HPIH总氨基酸含量在改性后均有不同程度下降,在非必需氨基酸中,天冬氨酸、谷氨酸、精氨酸含量下降明显,必需氨基酸中,异亮氨酸及缬氨酸含量降低幅度较大。HPI经超高压辅助酶解反应后其二级和三级结构发生了明显变化(P<0.05)。酶解产物的DPPH、ABTS+、还原能力均在200 MPa时达到最大值。综上所述, 超高压处理能显著改变HPI的二、三级结构,从而对抗氧化活性产生影响。本研究为超高压技术在汉麻蛋白产品中的应用提供了科学依据,有利于促进超高压技术在农产品加工领域的应用。
-
表 1 DPPH自由基清除活性测定各试剂添加量
Table 1 DPPH free radical scavenging activity determination of reagent addition amount
溶液名称 As(µL) Ac(µL) Ab(µL) DPPH溶液 100 0 100 样品溶液 100 100 0 样品溶剂溶液 0 0 100 无水乙醇溶液 0 100 0 表 2 ABTS+自由基清除活性测定各试剂添加量
Table 2 ABTS+ free radical scavenging activity determination of reagent addition amount
溶液名称 As(µL) Ab(µL) ABTS溶液 180 180 样品溶液 20 0 样品溶剂溶液 0 20 表 3 还原能力测定各试剂添加量
Table 3 Reducing power determination of reagent addition amount
组别 上清液(µL) 氯化铁溶液(µL) 蒸馏水(µL) 样品组A2 70 70 70 空白组A1 0 70 140 表 4 不同压力下酶解产物氨基酸含量
Table 4 Amino acid content of enzymatic hydrolysis products under different pressures
氨基酸 HPI 0.1 MPa 100 MPa 200 MPa 300 MPa 天冬氨酸(Asp) 7.36±0.04a 6.63±0.02b 6.51±0.05c 6.61±0.02b 6.57±0.03bc 苏氨酸(Thr)* 2.26±0.02a 2.18±0.01b 2.15±0.02bc 2.13±0.01c 2.12±0.02c 丝氨酸(Ser) 3.56±0.02a 3.17±0.01c 3.38±0.03b 3.15±0.02c 3.09±0.02d 谷氨酸(Glu) 12.3±0.04a 11.0±0.04d 10.4±0.04e 11.5±0.02c 12.0±0.05b 甘氨酸(Gly) 2.70±0.03a 2.43±0.01b 2.27±0.01d 2.44±0.01b 2.37±0.01c 丙氨酸(Ala) 2.78±0.01a 2.53±0.02b 2.56±0.02b 2.46±0.01c 2.40±0.02d 半胱氨酸(Cys) 0.69±0.02a 0.68±0.01a 0.64±0.01b 0.61±0.01c 0.63±0.01bc 缬氨酸(Val)* 2.83±0.03a 2.63±0.02b 2.47±0.02c 2.61±0.02b 2.62±0.02b 甲硫氨酸(Met)* 1.38±0.01a 1.32±0.02b 1.12±0.02c 1.14±0.01c 1.27±0.01b 异亮氨酸(IIe)* 2.55±0.03a 2.36±0.03b 2.52±0.01a 2.24±0.01c 2.38±0.02b 亮氨酸(Leu)* 4.20±0.04a 3.90±0.03d 4.12±0.04b 4.05±0.03c 4.14±0.03b 酪氨酸(Tyr) 2.16±0.01a 2.00±0.01c 2.12±0.01b 1.96±0.01d 1.91±0.01e 苯丙氨酸(Phe)* 3.21±0.03a 3.18±0.01ab 3.15±0.02b 3.04±0.03c 2.99±0.03c 赖氨酸(Lys)* 1.60±0.01a 1.58±0.02ab 1.54±0.01c 1.57±0.01b 1.52±0.01c 组氨酸(His) 1.72±0.01a 1.64±0.01c 1.66±0.01b 1.53±0.01d 1.50±0.01e 精氨酸(Arg) 9.39±0.04a 8.83±0.03d 9.23±0.05b 9.27±0.03b 9.10±0.04c 脯氨酸(Pro) 2.53±0.01a 2.14±0.01bc 2.09±0.02d 2.16±0.02b 2.12±0.02cd 注:标注*的为必需氨基酸,a~d表示压力组间差异显著(P<0.05)。 -
[1] 张雪蕾, 侯振平, 陈立强, 等. 汉麻提取物生物学功能及汉麻在动物营养上的应用[J]. 中国饲料,2022(13):123−129. [ZHANG Xuelei, HOU Zhenping, CHEN Liqiang, et al. The application of hemp in animal nutrition and the research progress in biological function of hemp extracts[J]. China Feed,2022(13):123−129.] ZHANG Xuelei, HOU Zhenping, CHEN Liqiang, et al . The application of hemp in animal nutrition and the research progress in biological function of hemp extracts[J]. China Feed,2022 (13 ):123 −129 .[2] 王冰, 杨杨, 范洪臣, 等. 热处理温度和离子强度对汉麻蛋白热聚集行为的影响[J]. 食品安全质量检测学报,2022,13(16):5337−5344. [WANG Bing, YANG Yang, FAN Hongchen, et al. Effects of heat treatment temperature and ionic strength on thermal aggregation behavior of hemp protein[J]. Journal of Food Safety & Quality,2022,13(16):5337−5344.] WANG Bing, YANG Yang, FAN Hongchen, et al . Effects of heat treatment temperature and ionic strength on thermal aggregation behavior of hemp protein[J]. Journal of Food Safety & Quality,2022 ,13 (16 ):5337 −5344 .[3] 田兆飞, 刘诗涵, 李立佳, 等. 火麻仁及其制品研究进展[J]. 农业科技与装备,2017(12):53−54. [TIAN Zhaofei, LIU Shihan, LI Lijia, et al. Research progress on hemp seed and its products[J]. Agricultural Science & Technology and Equipment,2017(12):53−54.] TIAN Zhaofei, LIU Shihan, LI Lijia, et al . Research progress on hemp seed and its products[J]. Agricultural Science & Technology and Equipment,2017 (12 ):53 −54 .[4] 庞鑫慧, 苏丹, 杨杨, 等. 汉麻蛋白改性及其表征方法的研究进展[J]. 食品研究与开发,2022,43(4):203−208. [PANG Xinhui, SU Dan, YANG Yang, et al. Research progress in hemp protein modification and its characterization methods[J]. Food Research and Development,2022,43(4):203−208.] PANG Xinhui, SU Dan, YANG Yang, et al . Research progress in hemp protein modification and its characterization methods[J]. Food Research and Development,2022 ,43 (4 ):203 −208 .[5] 石杰, 宋淑敏, 魏连会, 等. 汉麻籽蛋白的分级提取及产物功能特性的研究[J]. 粮食与油脂,2021,34(11):132−136. [SHI Jie, SONG Shumin, WEI Lianhui, et al. Study on fractionation of hemp seed protein and functional properties of the product[J]. Cereals & Oils,2021,34(11):132−136.] SHI Jie, SONG Shumin, WEI Lianhui, et al . Study on fractionation of hemp seed protein and functional properties of the product[J]. Cereals & Oils,2021 ,34 (11 ):132 −136 .[6] NOMAN A, WANG Y X, ZHANG C, et al. Antioxidant activities of optimized enzymatic protein hydrolysates from hybrid sturgeon ( Huso dauricus× Acipenser schrenckii) prepared using two proteases[J]. Journal of Aquatic Food Product Technology,2022,31(9):909−923. doi: 10.1080/10498850.2022.2120377
[7] 庞佳坤, 郑远荣, 刘振民, 等. 超高压对乳清分离蛋白结构和抗氧化活性的影响[J]. 食品与发酵工业,2020,46(4):72−77. [PANG Jiakun, ZHENG Yuanrong, LIU Zhenmin, et al. Effects of ultra-high pressure on structure and antioxidant activity of whey protein isolates[J]. Food and Fermentation Industries,2020,46(4):72−77.] PANG Jiakun, ZHENG Yuanrong, LIU Zhenmin, et al . Effects of ultra-high pressure on structure and antioxidant activity of whey protein isolates[J]. Food and Fermentation Industries,2020 ,46 (4 ):72 −77 .[8] ZHU Wenhui, ZHU Lunwei, YANG Wanlin, et al. Optimization of the enzymatic hydrolysis assisted by ultra-high pressure processing of alaska pollock frame for improving flavour[J]. Journal of Aquatic Food Product Technology,2020,29(6):567−576. doi: 10.1080/10498850.2020.1774022
[9] MARIA S D, FERRARI G, MARESCA P. Effects of high hydrostatic pressure on the conformational structure and the functional properties of bovine serum albumin[J]. Innovative Food Science and Emerging Technologies,2016,33:67−75. doi: 10.1016/j.ifset.2015.11.025
[10] BALASUBRAMANIAM V M, MARTÍNEZ-MONTEAGUDO S I, GUPTA R. Principles and application of high pressure-based technologies in the food industry[J]. Annual Review of Food Science and Technology,2015,6:435−462. doi: 10.1146/annurev-food-022814-015539
[11] CHAO D, JUNG S, ALUKO R E. Physicochemical and functional properties of high pressure-treated isolated pea protein[J]. Innovative Food Science and Emerging Technologies,2018,45:179−185. doi: 10.1016/j.ifset.2017.10.014
[12] PEYRANO F, SPERONI F, AVANZA M V. Physicochemical and functional properties of cowpea protein isolates treated with temperature or high hydrostatic pressure[J]. Innovative Food Science and Emerging Technologies,2016,33:38−46. doi: 10.1016/j.ifset.2015.10.014
[13] AMBROSI V, POLENTA G, GONZALEZ C, et al. High hydrostatic pressure assisted enzymatic hydrolysis of whey proteins[J]. Innovative Food Science and Emerging Technologies,2016,38:294−301. doi: 10.1016/j.ifset.2016.05.009
[14] 刘容旭, 李春雨, 王语聪等. 超高压辅助酶解法改性汉麻分离蛋白及其理化性质的研究[J/OL]. 食品工业科技:1−16[2023-07-07]. doi:10.13386/j.issn1002-0306.2023010016. [LIU Rongxu, LI Chunyu, WANG Yucong, et al. Study on the modification and physicochemical properties of hemp protein isolate by ultra-high pressure assisted enzymatic hydrolysis[J/OL]. Science and Technology of Food Industry:1−16[2023-07-07].] LIU Rongxu, LI Chunyu, WANG Yucong, et al. Study on the modification and physicochemical properties of hemp protein isolate by ultra-high pressure assisted enzymatic hydrolysis[J/OL]. Science and Technology of Food Industry: 1−16[2023-07-07]. doi: 10.13386/j.issn1002-0306.2023010016.
[15] 孙庆. 原花青素共价修饰在蛋清蛋白改性中的应用研究[D]. 南昌:南昌大学, 2021:49−54. [SUN Qing. Research of proccyandins on covalent conjugation application in modification of egg white protein[D]. Nanchang:Nanchang University, 2021:49−54.] SUN Qing. Research of proccyandins on covalent conjugation application in modification of egg white protein[D]. Nanchang: Nanchang University, 2021: 49−54.
[16] 范丽丽, 窦博鑫, 张晓琳, 等. 大豆7S球蛋白的MTGase条件对其表面疏水性与功能特性、溶液性质的影响及相关性分析[J]. 食品工业科技, 2020, 41(5):52−57,62. [FAN Lili, DOU Boxin, ZHANG Xiaolin, et al. Effect of MTgase conditions on surface hydrophobicity, functional properties and solution properties of soybean 7s globulin and correlation analysis of its indexes[J]. Science and Technology of Food Industry, 2020, 41(5):52−57,62.] FAN Lili, DOU Boxin, ZHANG Xiaolin, et al. Effect of MTgase conditions on surface hydrophobicity, functional properties and solution properties of soybean 7s globulin and correlation analysis of its indexes[J]. Science and Technology of Food Industry, 2020, 41(5): 52−57,62.
[17] LORENZO M, BORDIGA B, PÉREZ-ÁLVAREZ F, et al. The impacts of temperature, alcoholic degree and amino acids content on biogenic amines and their precursor amino acids content in red wine[J]. Food Research International,2017,99(1):328−335.
[18] SHEVKANI K, SINGH N, KAUR A, et al. Structural and functional characterization of kidney bean and field pea protein isolates:A comparative study[J]. Food Hydrocolloids,2015,43:679−689. doi: 10.1016/j.foodhyd.2014.07.024
[19] 应译娴. 可食植物种子中还原型谷胱甘肽(GSH)和蛋白巯基(P-SH)含量的测定[D]. 延吉:延边大学, 2018:498-555. [YING Yixian. Dertermination of reduced glutathione (GSH) and thiols in preteins (P-SH) in edible plant seeds[D]. Jilin:Yanbian University, 2018:498−555.] YING Yixian. Dertermination of reduced glutathione (GSH) and thiols in preteins (P-SH) in edible plant seeds[D]. Jilin: Yanbian University, 2018: 498−555.
[20] 孟繁松. 三维荧光光谱分析在肌氨酸氧化酶蛋白检测的应用[D]. 无锡:江南大学, 2021:202−255. [MENG Fansong. Application of three-dimensional fluorescence spectra for detecing sarcosine oxidase[D]. Wuxi:Jiangnan University, 2021:202−255.] MENG Fansong. Application of three-dimensional fluorescence spectra for detecing sarcosine oxidase[D]. Wuxi: Jiangnan University, 2021: 202−255.
[21] NEVIN K G, RAJMONAN T. Beneficial effects of virgin coconut oil on lipid parameters and in vitro LDL oxidation[J]. Clinical Biochemistry,2004,37(90):830.
[22] 钱燕芳, 石晨莹, 陈贵堂. 桑葚多糖超声提取、脱色工艺优化及其抗氧化活性分析[J]. 食品工业科技,2022,43(16):201−210. [QIAN Yanfang, SHI Chenying, CHEN Guitang. Optimization of ultrasound-assisted extraction and decolorization process of polysaccharides from mori fructus and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(16):201−210.] QIAN Yanfang, SHI Chenying, CHEN Guitang . Optimization of ultrasound-assisted extraction and decolorization process of polysaccharides from mori fructus and its antioxidant activity[J]. Science and Technology of Food Industry,2022 ,43 (16 ):201 −210 .[23] 吴兴雨. 亚麻蛋白的酶法提取、功能性质及应用研究[D]. 张家口:河北北方学院 , 2020:36−45. [WU Xingyu. Enzymatic extraction, functional properties and application of flax protein[D]. Zhangjiakou:HeBei North University, 2020:36−45.] WU Xingyu. Enzymatic extraction, functional properties and application of flax protein[D]. Zhangjiakou: HeBei North University, 2020: 36−45.
[24] 刘宁, 杨柳怡, 齐雅墨, 等. 限制性酶解-超高压处理对米渣蛋白乳化性的影响[J]. 陕西科技大学学报,2020,38(6):30−33,39. [LIU Ning, YANG Liuyi, QI Yamo, et al. Effect of controlled enzymolysis and high hydrostatic pressure on the emulsibility of rice residue protein[J]. Journal of Shaanxi University of Science & Technology,2020,38(6):30−33,39.] LIU Ning, YANG Liuyi, QI Yamo, et al . Effect of controlled enzymolysis and high hydrostatic pressure on the emulsibility of rice residue protein[J]. Journal of Shaanxi University of Science & Technology,2020 ,38 (6 ):30 −33,39 .[25] BAO Z J, ZHAO Y, WANG X Y, et al. Effects of degree of hydrolysis on the functional properties of egg yolk hydrolysate with alcalase[J]. Journal of Food Science and Technology,2017,54(3):669−678. doi: 10.1007/s13197-017-2504-0
[26] AHMED S M, ZHANG Q, CHEN J, et al. Millet grains:Nutritional quality, processing, and potential health benefits[J]. Comprehensive Reviews in Food Science and Food Safety,2013,12(3):281−295. doi: 10.1111/1541-4337.12012
[27] 谢海刚. 几种植物蛋白原料在蛋鸡日粮中的应用[J]. 黑龙江畜牧兽医,2017,518(2):166−167. [XIE Haigang. Application of several plant protein raw materials in laying hens diet[J]. Heilongjiang Animal Science and Veterinary Medicine,2017,518(2):166−167.] XIE Haigang . Application of several plant protein raw materials in laying hens diet[J]. Heilongjiang Animal Science and Veterinary Medicine,2017 ,518 (2 ):166 −167 .[28] GOUDA M, ZU L L, MA S M, et al. Influence of bio-active terpenes on the characteristics and functional properties of egg yolk[J]. Food Hydrocolloids,2018,80:222−230. doi: 10.1016/j.foodhyd.2018.02.009
[29] 敬思群, 王德萍, 周苗苗, 等. 动态高压微射流对大豆分离蛋白性质和结构的影响[J]. 食品工业,2021,42(12):318−322. [JING Siqun, WANG Deping, ZHOU Miaomiao, et al. Effect of dynamic high pressure microfluidization treatment on spi in aqueous solution[J]. The Food Industry,2021,42(12):318−322.] JING Siqun, WANG Deping, ZHOU Miaomiao, et al . Effect of dynamic high pressure microfluidization treatment on spi in aqueous solution[J]. The Food Industry,2021 ,42 (12 ):318 −322 .[30] ZHAO G L, LIU Y, ZHAO M M, et al. Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J]. Food Chemistry,2011,127:1438−1443. doi: 10.1016/j.foodchem.2011.01.046
[31] 谢雅雯, 涂宗财, 张露, 等. 动态高压微射流协同糖基化处理对 β-乳球蛋白热稳定性和结构的影响[J]. 食品与发酵工业,2018,44(10):110−117. [XIE Yawen, TU Zongcai, ZHANG Lu, et al. Effect of dynamic high pressure microfluidization treatment on spi in aqueous solution[J]. Food and Fermentation Industries,2018,44(10):110−117.] XIE Yawen, TU Zongcai, ZHANG Lu, et al . Effect of dynamic high pressure microfluidization treatment on spi in aqueous solution[J]. Food and Fermentation Industries,2018 ,44 (10 ):110 −117 .[32] 张洁. 黄芩总黄酮的超声提取工艺及其抗氧化活性研究[D]. 呼和浩特:内蒙古大学, 2011. [ZHANG Jie. Studies on ultrasonic extraction and antioxidant activities of flavonoids from scutellaria baicalensis georg[D]. Hohhot: Inner Mongolia University, 2011.] ZHANG Jie. Studies on ultrasonic extraction and antioxidant activities of flavonoids from scutellaria baicalensis georg[D]. Hohhot: Inner Mongolia University, 2011.
[33] GARCIA-MORA P, PEÑAS E, FRIAS J, et al. Savinase, the most suitable enzyme for releasing peptides from lentil protein concentrates with multifunctional properties[J]. Journal of Agricultural and Food Chemistry,2014,62(18):4166−4174. doi: 10.1021/jf500849u
[34] CRISTINA R C, RUDOLF J. Free radical scavenging (antioxidant activity) of natural dissolved organic matter[J]. Marine Chemistry,2015,177:668−676. doi: 10.1016/j.marchem.2015.10.008
[35] 马亚萍. 动态超高压均质处理对酪蛋白酶解特性的影响[D]. 新乡:河南科技学院, 2017. [MA Yaping. Effect of dynamic ultra-high pressure homogenization on enzymatic hydrolysis characteristics of casein[D]. Xinxiang:Henan Institute of Science and Technology, 2017.] MA Yaping. Effect of dynamic ultra-high pressure homogenization on enzymatic hydrolysis characteristics of casein[D]. Xinxiang: Henan Institute of Science and Technology, 2017.
[36] 赵贵川. 超高压处理对米渣蛋白水解物抗氧化活性的影响[D]. 长沙:中南林业科技大学, 2016:21−38. [ZHAO Guichuan. The research of UHP treatment on rice residue protein hydrolysate antioxidant activity[D]. Changsha:Central South University of Forestry and Technology, 2016:21−38.] ZHAO Guichuan. The research of UHP treatment on rice residue protein hydrolysate antioxidant activity[D]. Changsha: Central South University of Forestry and Technology, 2016: 21−38.
[37] 张天凤, 张振山, 王帅等. 亚麻籽粕提取物抗氧化成分及抗氧化活性研究[J]. 粮食与油脂,2021,34(12):137−141. [ZHANG Tianfeng, ZHANG Zhenshan, WANG Shuai, et al. Study on antioxidant components and antioxidant activity of flaxseed meal extract[J]. Cereals & Oils,2021,34(12):137−141.] ZHANG Tianfeng, ZHANG Zhenshan, WANG Shuai, et al . Study on antioxidant components and antioxidant activity of flaxseed meal extract[J]. Cereals & Oils,2021 ,34 (12 ):137 −141 .[38] 关海宁, 徐筱君, 孙薇婷, 等. 超高压协同酶法条件下不同分子量大豆分离蛋白水解肽乳化性及抗氧化性研究[J]. 食品安全质量检测学报,2022,13(12):3780−3786. [GUAN Haining, XU Xiaojun, SUN weiting, et al. Study on emulsification and antioxidant properties of soy protein isolate hydrolysatic peptides with different molecular weight by enzymatic hydrolysis under high hydrostatic pressure[J]. Journal of Food Safety & Quality,2022,13(12):3780−3786.] GUAN Haining, XU Xiaojun, SUN weiting, et al . Study on emulsification and antioxidant properties of soy protein isolate hydrolysatic peptides with different molecular weight by enzymatic hydrolysis under high hydrostatic pressure[J]. Journal of Food Safety & Quality,2022 ,13 (12 ):3780 −3786 . -
期刊类型引用(1)
1. 曾硕,马骎,申岱林,周建辉. 低温等离子体对展青霉素脱毒研究进展. 现代食品. 2024(14): 101-103 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:

 下载:
下载:



