Preparation of Multifunctional Optic-Magnetic Composite Nanomaterials and Its Application in Detection of Pesticide Residue in Citrus
-
摘要: 为构建一种稳定、结构可控的光-磁复合材料并将其用于农药残留检测当中,本实验采用高温溶剂热法制备上转换纳米材料(Upconversion Nanoparticles,UCNPs),研究温度、转速对UCNPs的影响,实现UCNPs的可控制备。采用反相微乳液法制备三种不同结构的多功能光-磁复合纳米材料,借助扫描电子显微镜(SEM)、透射电子显微镜(TEM)、X射线衍射仪(XRD)、振动样品磁强计(VSM)等方法研究多功能纳米材料的形貌、结构等性能。此外,利用此复合纳米材料研究柑橘中各类型农药的响应情况。实验结果表明,温度对UCNPs粒径大小起着决定性的作用。在不同结构的UCNPs-Fe3O4复合材料中,A结构(UCNPs材料粒径更大的卫星结构)的荧光特性更强;B结构(两种原材料粒径相近的交织结构)在室温下同时具有20.5 emu·g−1的饱和磁化强度和较高的荧光强度,性能平衡;C结构(Fe3O4材料粒径更大的卫星结构)的磁性最佳。同时,该复合材料对柑橘中菊酯类农药、新烟碱类农药、氨基甲酸酯类农药、有机磷农药均有一定响应,对菊酯类农药的响应最强,可用于开发菊酯类农药生物传感器。本研究采用简单普适的合成方法,为其他复合材料合成研究提供一定的理论思路,该材料有较佳的光-磁特性和生物相容性,在药物递送、成像等领域都有较大的应用潜力。Abstract: To construct a stable and structurally controllable optical-magnetic composite nanomaterials and use it in the detection of pesticide residues, the upconversion nanomaterials (UCNPs) were prepared by the high temperature solvothermal method in this work. The effects of temperature and rotational speed on UCNPs were investigated to achieve controllable preparation of UCNPs. Three kinds of multifunctional optic-magnetic composite nanomaterials with different structures were prepared by reversed-phase microemulsion method. Scanning electron microscope (SEM), transmission electron microscope (TEM), X-ray diffractometer (XRD), vibrating sample magnetometer (VSM) etc. were utilized to investigate the morphology, structure etc. of multifunctional composites. Furthermore, the response of multifunctional optic-magnetic composite nanomaterials to various pesticides in citrus was studied. The experimental results showed that temperature played a decisive role in the size of UCNPs. In different structures of UCNPs-Fe3O4 composites, the stronger fluorescence of A-structure (the satellite structure of UCNPs material with larger particle size) was obtained. B-structure (an interweave structure with similar particle sizes of UCNPs and Fe3O4) had a saturation magnetization of 20.5 emu·g−1 and high fluorescence intensity. C-structure (a satellite structure with larger particle size of Fe3O4 material) had best magnetic properties. Meanwhile, the multifunctional optic-magnetic composites had a certain response to pyrethroid pesticide, nicotine pesticide, carbamate pesticide and organophosphorus pesticide in citrus. Due to the strongest response to pyrethroid pesticide, they could be developed for the biosensor of pyrethroid pesticide. In this work, a simple and universal synthesis method was proposed to provide theoretical ideas for the synthesis of other composite materials. This material had a great application potential in drug delivery, imaging and other fields due to their good optic-magnetic properties and biocompatibility.
-
上转换纳米材料(Upconversion Nanoparticles,UCNPs)由无机基质及镶嵌在其中的稀土掺杂离子组成[1],可以通过双光子或多光子机制将较长波长的辐射转换为较短波长的荧光,具有毒性低、荧光量子产率高、背景噪声小、化学性质稳定等诸多优点[2−4]。由于这些优异的光学性能,UCNPs在生物成像、医疗治疗、食品检测等领域中体现出巨大的应用价值[5−7],受到众多研究人员的关注。Soumyashree等[8]利用UCNPs与大豆油、硬脂酸制备了荧光特性极佳的UCNPs油凝胶用于动物皮肤内层成像。Yin等[9]将壳核型UCNPs@SiO2@Ag与碳自掺杂石墨氮化碳(C-g-C3N4)柔性电极相组装,建立大肠杆菌O157:H7的超灵敏近红外响应光电化学传感平台,测定猪肉、卷心菜和牛奶样品中大肠杆菌,检出限低至2 CFU/mL。Wang等[10]基于红葡萄酒中的有机成分与UCNPs结合引起其荧光猝灭,开发了一种由6个传感器元件组成的传感器阵列,用于鉴别不同厂商的红葡萄酒。UCNPs用于食品、生化检测的研究越来越丰富,但有关UCNPs制备条件对其形貌及荧光特性影响的研究较少,UCNPs材料的形貌及荧光性能参差不齐,导致构建传感器性能不稳定。因此,需要加大UCNPs制备条件研究的力度,实现性能优异UCNPs的制备,进而提高检测的准确性和灵敏度[11]。
随着材料科学的发展,越来越多的研究者将两种或多种材料相复合制备出多功能复合材料,由于其优异的多功能特性,已成为近年来的研究热点[12−15]。一直以来Fe3O4在多功能复合材料中都具有举足轻重的地位,因其具有特殊的磁性和良好的生物相容性,在药物递送、细胞分离、干细胞标记、生化检测和磁共振成像等方向都有多种应用[16−18]。Yang等[19]制备了一种针对茜素红、醋酸硫素、孔雀石绿和酸性橙Ⅱ等离子染料的功能化磁响应型纳米复合吸附剂,利用静电吸附作用,以及聚离子液体的高官能团密度,对多种离子染料实现吸附。Chen等[20]利用适配体功能化的UCNPs和Fe3O4修饰的金纳米粒子(GNPs)制备了荧光纳米探针检测茶和水体中Pb(II)含量。Feng等[21]将g-C3N4、超顺磁氧化铁纳米球以及UCNPs相复合,构建出壳核卫星结构的多功能纳米平台用于特定肿瘤部位的光动力治疗。该材料磁性强、靶向性好、安全无痛,在未来磁性靶向肿瘤光动力治疗中有良好的前景。然而,由于Fe3O4材料容易团聚,导致构成的多功能复合材料大多尺寸不均匀,影响材料的性能和稳定性。因此,研究不同结构复合材料制备方法,实现复合材料的可控制备对于提升材料性能具有重要意义。
UCNPs纳米材料常用制备方法有高温热分解法及溶剂热法等,其中高温热分解法制备条件苛刻,需要高温退火,所合成的UCNPs纳米材料尺寸难以控制,不利于表面修饰等[22−24]。本研究采用体系稳定、条件易控的溶剂热法制备UCNPs,研究温度、转速等制备条件对UCNPs形貌及荧光的影响,实现UCNPs的可控制备。利用简单的反相微乳液法制备基于UCNPs的光-磁多功能纳米材料,研究不同结构多功能材料的磁性及荧光性能。目前使用农药仍是柑橘生产中不可或缺的防治措施,但农药的大量使用也严重影响着产业质量和人类健康,因此农药检测材料的研究也十分迫切。本实验考查了该复合材料对柑橘中各类型农药的响应情况,为后续开发食品、生化检测材料奠定基础。
1. 材料与方法
1.1 材料与仪器
六水合氯化钇(YCl3·6H2O)、六水合氯化镱(YbCl3·6H2O)、六水合氯化铒(ErCl3·6H2O) 纯度均>99.9%,1-十八烯(ODE)、油酸(OA) 纯度均>90%,美国Sigma-Aldrich公司;100、50、20 nm磁微球 纯度均>98%,上海阿拉丁公司;NaOH、NH4F、甲醇、乙醇、环己烷、正硅酸乙酯(TEOS) 分析纯,上海麦克林公司;沃柑 购于重庆市北碚区天生街道永辉超市;溴氰菊酯、氰戊菊酯、克百威、敌敌畏、氧化乐果、西维因 纯度均>98.0%,美国Sigma-Aldrich公司;氯氰菊酯、氟氯氰菊酯、吡虫啉、啶虫脒 纯度均>99.0%,美国Cato Research Chemicals公司。
Gemini SEM 300扫描电子显微镜 德国蔡司公司;JEM-F200透射电子显微镜 日本JEOL公司;Malvern Zetasizer Nano ZS90纳米粒径电位分析仪 英国马尔文仪器有限公司;Smartlab X射线衍射仪 日本Rigaku公司;Thermo Scientific K-Alpha X射线光电子能谱仪 美国Thermo公司; F-380A荧光分光光度计 港东科技公司;Spectrum 100傅里叶变换红外光谱仪 美国PerkinElmer公司;7404 Versa lab振动样品磁强计 美国Lake Shore公司。
1.2 实验方法
1.2.1 UCNPs材料的制备
采用溶剂热法制备不同粒径的UCNPs[25]。将0.78 mmol YCl3·6H2O、0.2 mmol YbCl3·6H2O和0.02 mmol ErCl3·6H2O置于100 mL的三颈烧瓶中,再加入6 mL OA和17 mL ODE,于磁力搅拌器以500 r/min混合均匀,通入氩气(反应全程均在氩气保护下进行),持续搅拌下加热至160 ℃,维持1 h,此时形成黄色的透明溶液。反应物冷却至室温后,滴入10.0 mL含2.5 mmol NaOH和4.0 mmol NH4F的甲醇溶液,并在室温下以500 r/min连续搅拌1 h,以确保NH4F充分反应。持续搅拌,将三颈烧瓶中反应物缓慢加热至80 ℃维持45 min以除去甲醇,然后升温至100 ℃,脱气10 min将甲醇完全去除。将反应物快速升温至300 ℃,并保持1 h,所得溶液自然冷却至室温。10000 r/min离心10 min,将沉淀用甲醇和乙醇交替洗涤4次,于60 ℃烘干8 h得到OA-UCNP。
1.2.1.1 温度对UCNPs材料的影响
在水热法制备UCNPs过程中,将甲醇除尽,充入氩气,将反应物分别升温至290、300、310 ℃,在该温度条件下进行晶核形成、增长,保持1 h,所得溶液自然冷却至室温,离心后将所得沉淀用甲醇和乙醇洗涤4次,于60 ℃烘干。利用扫描电镜及透射电镜观察其形貌,XRD考察其晶型,利用荧光分光光度计考察荧光性能。
1.2.1.2 转速对UCNPs材料的影响研究
在搅拌转速为300、400、500 r/min的条件下制备UCNPs,洗涤、干燥。利用扫描电镜及透射电镜观察其形貌,XRD考察其晶型,利用荧光分光光度计考察荧光性能。
1.2.2 UCNPs-Fe3O4材料的制备
在有机相中采用反相微乳液法,一步实现磁微球和UCNPs的相转变及交联[26]。在100 mL圆底烧瓶中加入30 mL环己烷溶液,300 r/min机械搅拌的同时加入3 mL 10 mg/mL Fe3O4纳米粒子环己烷溶液,持续搅拌。然后将3 mL 5 mg/mL UCNPs环己烷溶液与30 mL环己烷溶液混合均匀装入滴液漏斗中,再加入25 μL TEOS和4 mL 25%的氨水作为催化剂,于1 h内滴加至圆底烧瓶中,并保持300 r/min连续快速搅拌21 h。最后离心处理,收集沉淀物用乙醇清洗5次,再用2 T磁铁收集溶液中所得样品,弃去上清液,分散于超纯水中,重复上述步骤3次,将所得样品冷冻干燥,密封储藏。
1.2.3 不同材料配比对UCNPs-Fe3O4材料的影响
在制备UCNPs-Fe3O4材料时,分别以2:0、8:1、4:1、2:1、1:1、1:2的比例添加UCNPs和Fe3O4材料,制备方法同上,利用荧光分光光度计和振动样品磁强计分别考察所得样品的荧光性能和磁性。
1.2.4 表征方法
1.2.4.1 TEM/SEM表征
TEM:取适量样品,用无水乙醇洗涤三次,加入适量的无水乙醇超声15 min左右,待分散均匀后,取几滴分散好的液体逐滴滴加至碳膜附着的铜网上,使得样品薄薄分散一层,待乙醇挥发后,于200 kV加速电压下,上镜观察。
SEM:取微量碾磨为细粉末的样品直接粘于导电胶上,使用Quorum SC7620 溅射镀膜仪喷金45 s,喷金电流为10 mA;随后使用扫描电子显微镜拍摄样品形貌、能谱mapping等。形貌拍摄时加速电压为3 kV,能谱mapping拍摄时加速电压为15 kV,探测器为SE2二次电子探测器。
1.2.4.2 XRD表征
取0.5 g充分干燥的样品,平整铺于在洁净的样品台中,再用无水乙醇擦拭过的洁净盖玻片在其表面压制出平整的平面,得到均匀分布的待测样品。再在以下实验条件下进行XRD分析(非磁性样品的光源采用辐射源Cu靶,磁性样品的光源采用Co靶):扫描速率:5°/min,2θ角扫描范围:10~90°,扫描步长:0.02°。
1.2.4.3 粒径分析
取一定量的样品分散于去离子水中(质量分数0.1%),超声振荡5 min,用纳米粒度及Zeta电位分析仪测量平均粒径及分布,测试三次取平均值。
1.2.4.4 XPS表征
取适量样品压片后,贴于样品盘上,放进Thermo Scientific K-Alpha XPS仪器样品室中。当样品室中压力小于2.0×10−7 mbar时,将样品送入分析室,光斑大小为400 μm,工作电压12 kV,灯丝电流6 mA;全谱扫描通能为150 eV,步长1 eV;窄谱扫描通能为50 eV,步长0.1 eV。使用表面痕量碳的C1s峰(284.80 ev)作为校准基线。
1.2.5 基于复合材料的传感器在食品检测中的应用
将溴氰菊酯、氯氰菊酯、氟氯氰菊酯、氰戊菊酯、吡虫啉、啶虫脒、西维因、克百威、敌敌畏、氧化乐果标准品用无水乙醇分别配制为0.1 mg/mL母液,用去离子水稀释至终浓度为0.5 mg/L。分别取4 mL农药溶液,加入4 mg UCNPs-Fe3O4纳米材料,通过配有980 nm激光器的F-380A荧光分光光度计进行检测,所有样品均设置3组重复。分别计算农药对UCNPs-Fe3O4材料荧光的猝灭程度,以F0/F表示,F0为不添加农药时UCNPs-Fe3O4材料的荧光强度,F为加入农药后UCNPs-Fe3O4材料的荧光强度。
抽取当地市售柑橘样品全果于打浆机中破碎打浆,分别加入溴氰菊酯、氯氰菊酯、氟氯氰菊酯、氰戊菊酯、吡虫啉、啶虫脒、西维因、克百威、敌敌畏、氧化乐果标准品,使其最终浓度为0.5 mg/L。过滤提取4 mL清液,加入4 mg UCNPs-Fe3O4纳米材料,通过配有980 nm激光器的F-380A荧光分光光度计进行检测,所有样品均设置3组重复[27−29]。分别计算农药对UCNPs-Fe3O4材料荧光的猝灭程度,以F0/F表示,F0为不添加农药时UCNPs-Fe3O4材料的荧光强度,F为加入农药后UCNPs-Fe3O4材料的荧光强度。
1.3 数据处理
所有实验均设置3组重复,相关实验数据,使用Microsoft Office Excel 2019进行统计,并计算平均值和标准偏差,使用Jade 6 、Advantage、Zwin 2.2.5对数据进行分析。使用Origin 2018进行绘图。
2. 结果与分析
2.1 多功能纳米复合材料的制备原理
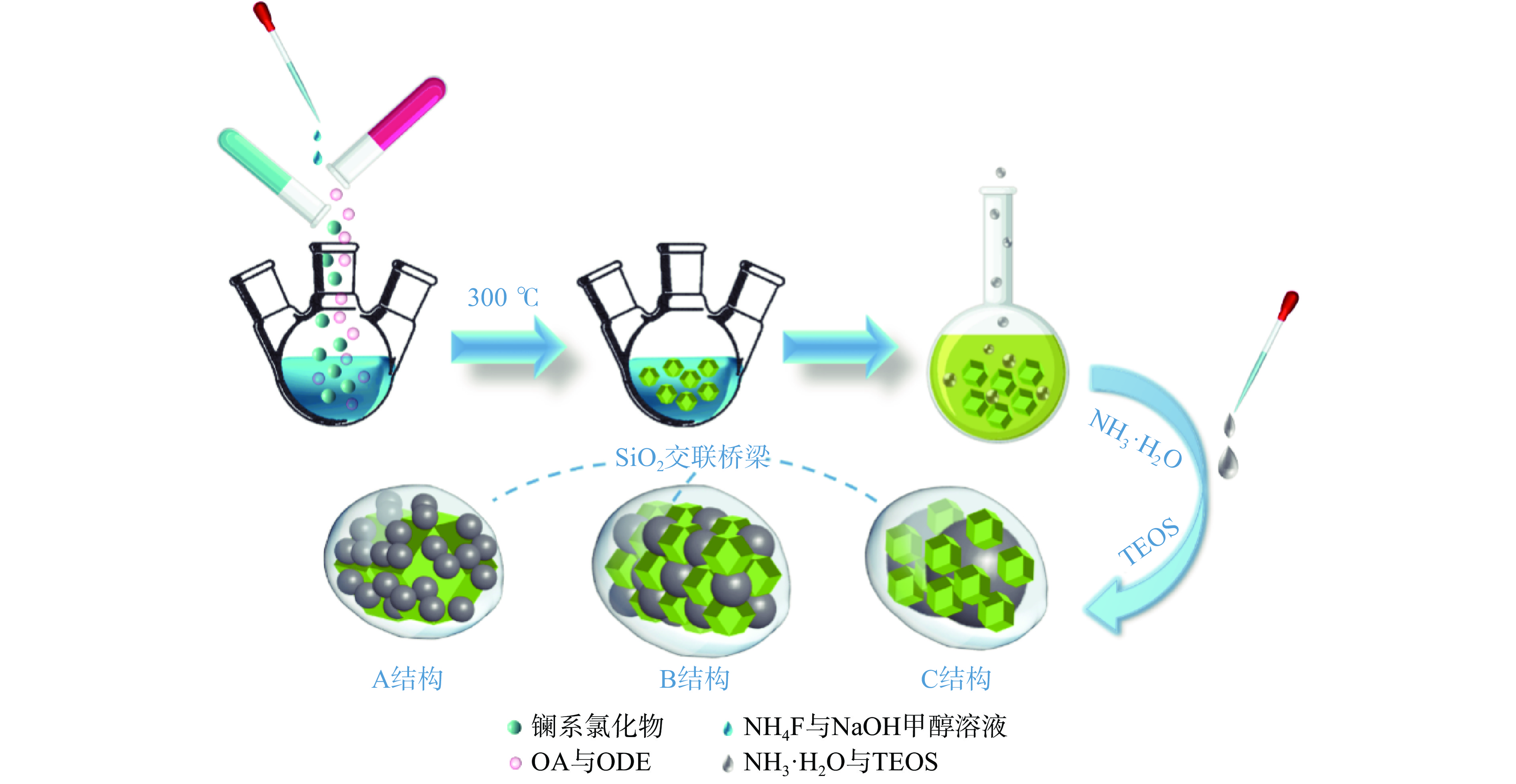
采用溶剂热法合成UCNPs,反应体系中镧系氯化物与油酸钠反应形成镧系-油酸盐前体,再加入NH4F和NaOH作为F−源和Na+源,形成黄色混浊溶液,生成无定形NaYF4晶核。随着反应的不断进行,非晶态NaYF4晶核开始生长,形成不规则的小纳米粒子,最终在高温下生长成形状规则的均匀纳米粒子,遵循奥斯特瓦尔德成熟机制[30]。将所得UCNPs纳米颗粒和不同粒径的Fe3O4分散在有机连续相中,加入TEOS和氨水,采用反相微乳液法以分散在连续有机相中的纳米颗粒为核心,进行二氧化硅球的生长,以此来达到对纳米颗粒的包覆和交联,该方法温和有效适用于多种油溶性纳米颗粒的相转变和结合,制备流程如图1所示。
2.2 UCNPs的制备
2.2.1 温度对UCNPs性能的影响
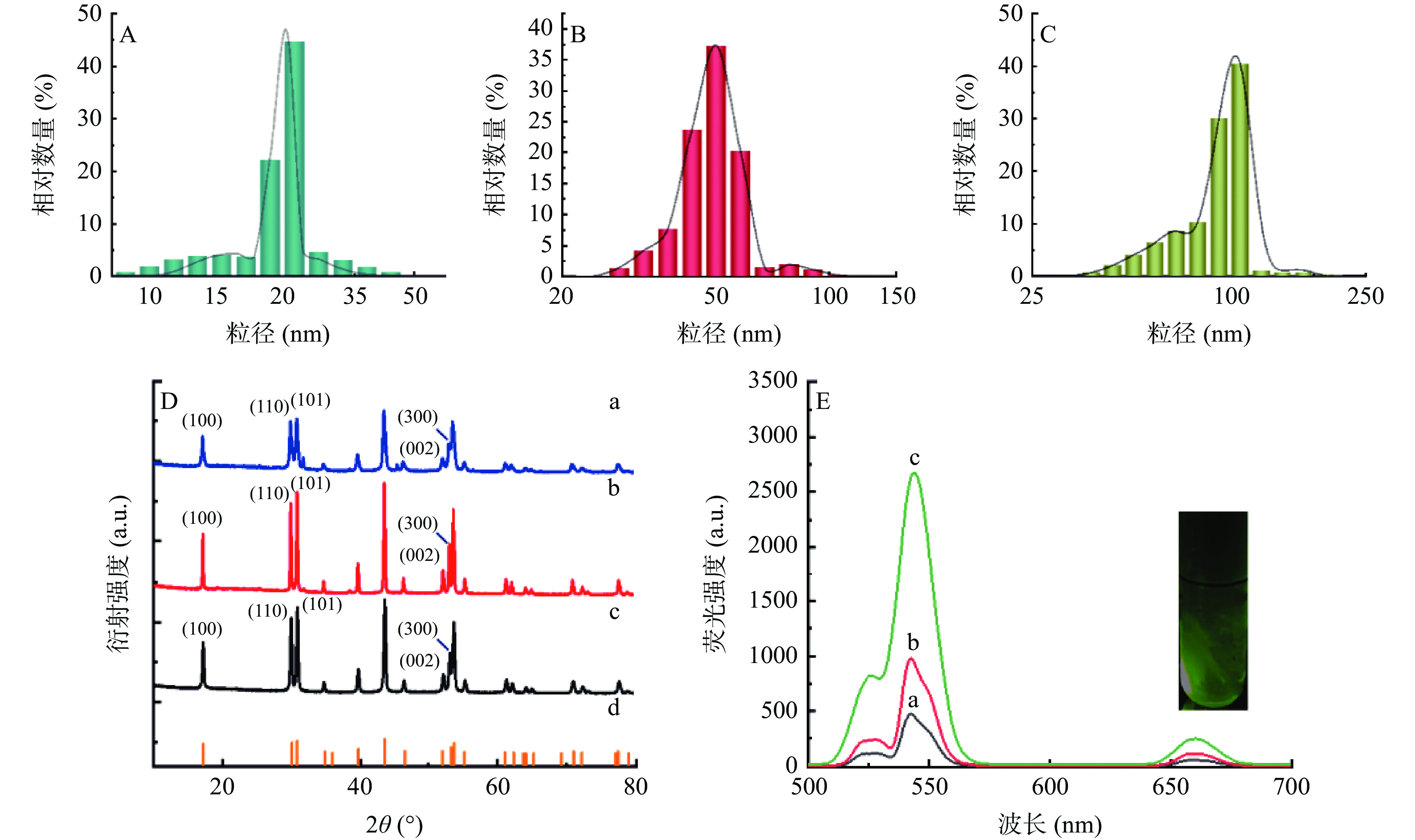
温度是UCNPs制备过程中的关键控制点,其对UCNPs形貌、晶型、粒径以及荧光性能等有重要影响。首先利用扫描电镜及透射电镜研究290、300、310 ℃合成温度对UCNPs形貌的影响。结果如图2所示,不同温度制备的UCNPs均呈现均匀分布,并且随着合成温度的升高UCNPs纳米材料由球形逐渐转变为六边形(AB→DE→GH),且其多边形的形貌愈加清晰和立体。另外,该纳米材料的粒径也随着温度的升高而变大,通过TEM图(C→F→I)也可以看出UCNPs粒径的变化。利用纳米粒径电位分析仪进一步确定纳米材料的粒径,结果如图3(A→C)所示,290、300、310 ℃下合成的纳米颗粒平均粒径约为20.41、49.05、93.92 nm,可进一步确定该纳米材料的粒径随合成温度的升高而增大。
利用XRD研究UCNPs的晶型。从图3D中可以看出,不同温度制备的UCNPs纳米材料的XRD谱图与标准卡片对比完全一致(JCPDS卡号为16-0334),进一步说明该纳米材料为六方晶相,且无其他相,表明该纳米材料的纯度高。在不同的合成温度下,纳米材料在[100]、[110]和[101]晶面间的相对强度有显著差异,导致了样品的形貌不同[31−32]。随着制备温度的降低,两个方向的生长速度相当,并产生了球状UCNPs[33]。制备温度升高后,纳米材料在[100]方向的生长速度可能较其他方向更快,产生了六棱柱状UCNPs。
本实验继续研究了合成温度对UCNPs荧光性能的影响。从图3E嵌图可以看出,在980 nm的激光器照射下,UCNPs纳米材料的环己烷溶液发出绿色荧光。根据荧光光谱图,UCNPs纳米材料在528、542和660 nm处分别有荧光发射峰,分别是Er3+的从4H11/2、4S3/2和4F9/2 到4I15/2的能级跃迁。在能量传递上转换系统中,Yb3+被作为理想的敏化剂来有效促进高吸收截面2F7/2至2F5/2的转变[34]。Yb3+的激发态能量与Er3+和Tm3+等激活剂的激发态能量相似,可作为优秀敏化剂给激活剂提供能量,且在常用的上转换激活剂中,Er3+具有最高的上转换效率[34]。另外,从荧光光谱图中还可发现,随着合成温度的增加,纳米材料的荧光强度逐渐增大。这可能与纳米材料的形貌有关。较高温度制备的UCNPs呈六棱柱结构,与290 ℃下制备的球状UCNPs相比,立体的六棱柱状尺寸更大,相对表面积更小,因此其表面缺陷就更少,而这些表面缺陷往往会造成荧光猝灭现象[35−36]。另一方面,UCNPs表面的OA也会影响纳米材料的荧光,具有高能量C-H或C-C的有机配体会猝灭镧系离子的荧光[25,35]。而球状UCNPs纳米材料具有更大的表面积,表面会包裹更多的OA。因此,与六棱状的UCNPs相比,球状UCNPs荧光强度较低。
综上可知,温度在290~310 ℃范围内,UCNPs纳米材料粒径随温度的升高从约20 nm增大到约94 nm,材料各晶面强度也有一定差异。并且随着制备温度的升高,荧光强度逐渐增加,在310 ℃下荧光性能最佳。
2.2.2 转速对UCNPs性能的影响
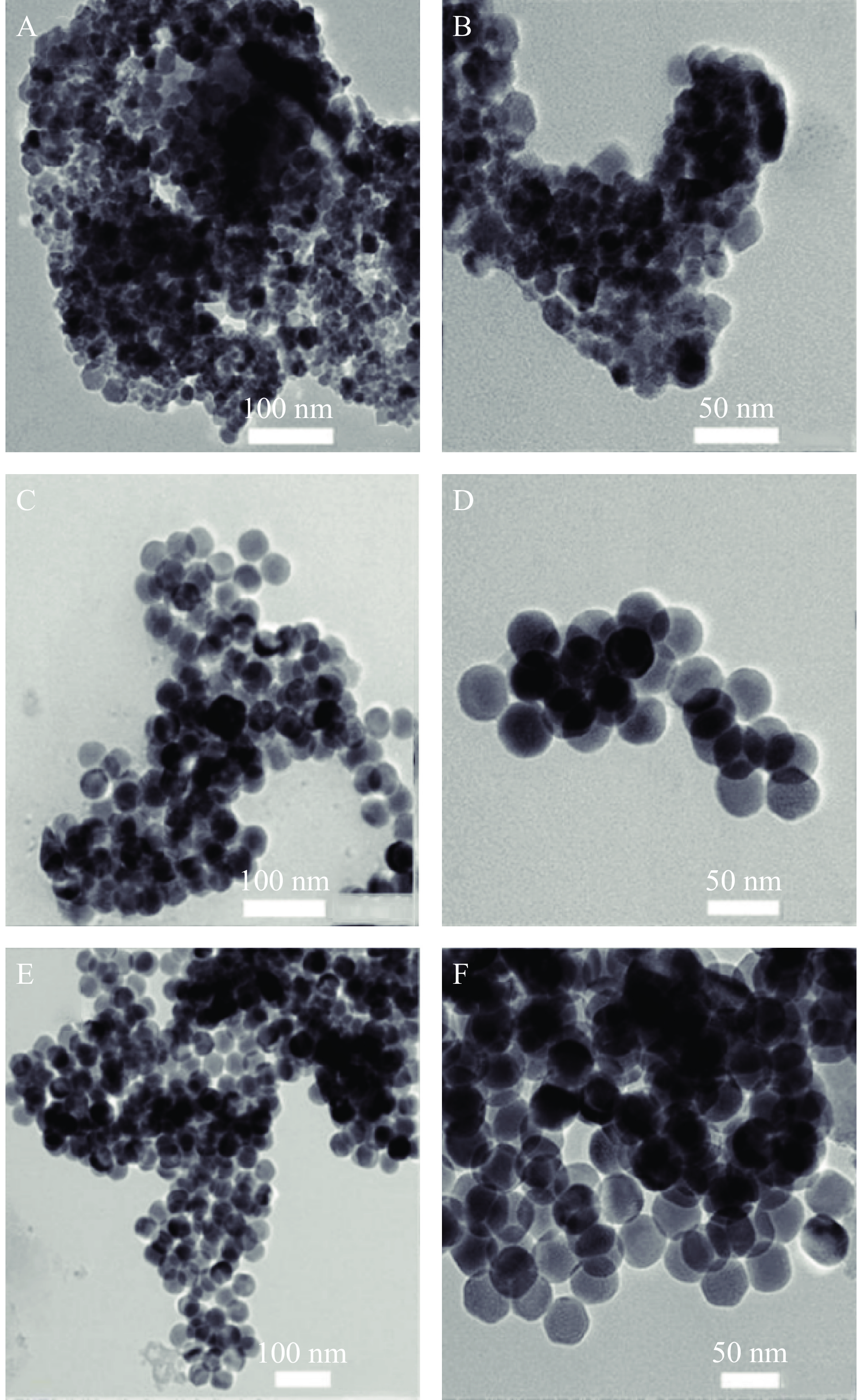
转速会影响UCNPs材料合成过程中的均匀性,进而影响UCNPs纳米材料的形貌、粒径和荧光强度等性能。在不同转速条件下(300、400、500 r/min)制备UCNPs纳米材料,利用TEM研究其形貌特征。根据图4可看出,随着转速的增加,纳米材料从刚开始的团聚,排列杂乱,逐渐变得形态均匀、排列整齐。当转速为300 r/min时,大部分纳米材料无法正常生长、排列(图4A、图4B)。当转速达到400 r/min时,样品的形貌开始变得清晰,但团聚较多,且粒径不一,还无法完全规律自主装(图4C、图4D)。转速调整为500 r/min后(图4E、图4F),可看见清晰的UCNPs呈现六边形形貌。相较于400 r/min转速下制备的样品,该样品粒径没有明显增长,但更加均匀统一,且团聚现象也有一定改善,可以正常规律自组装。UCNPS的形成符合溶解-再结晶的过程,而不是直接相变,高转速可以帮助纳米粒子更好地溶解-结晶,生成更加均匀的粒子,减少团聚现象,帮助其生长[37−38]。
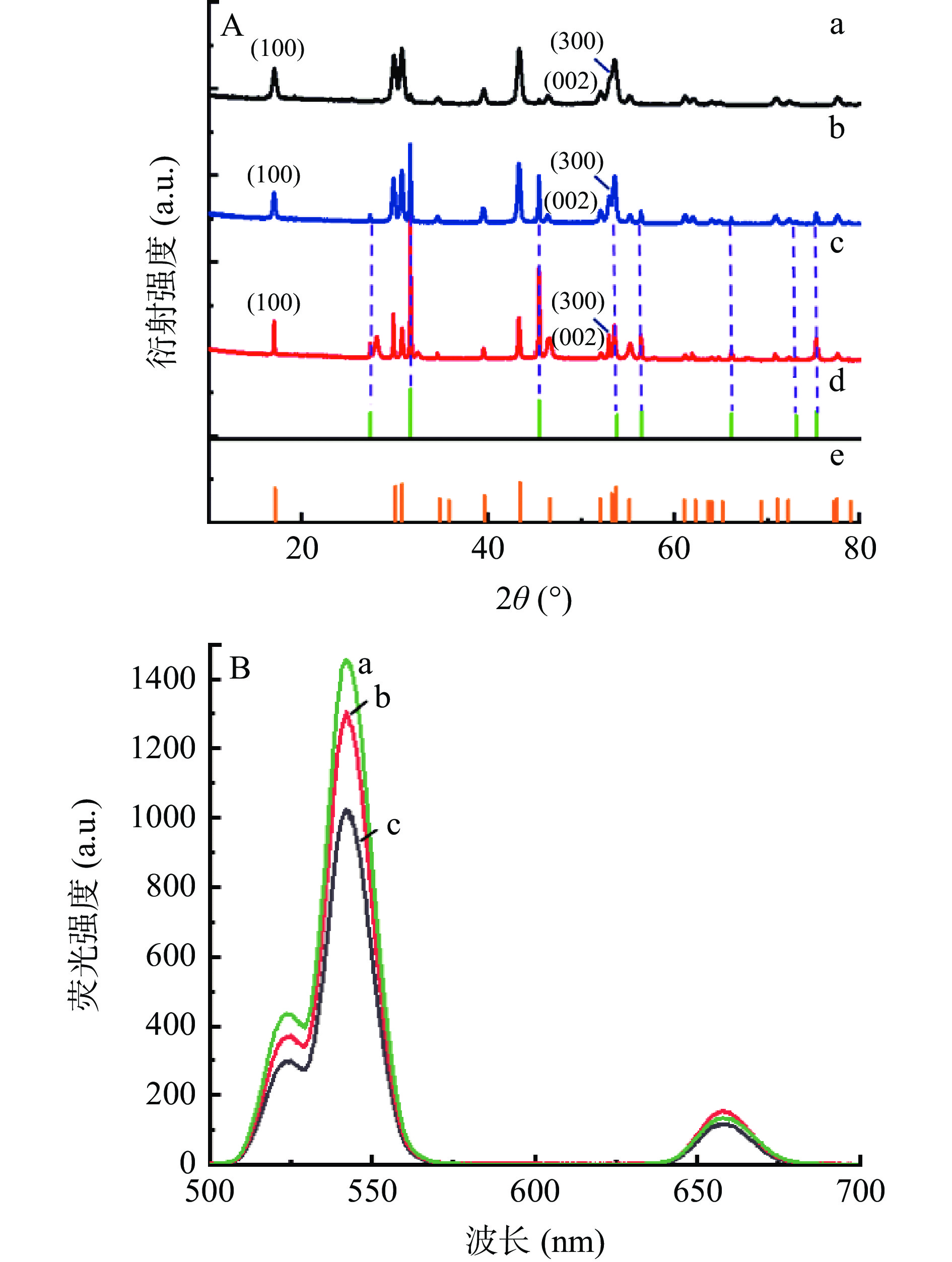
由UCNPs纳米材料的X射线衍射图(XRD)分析可知(图5A),合成转速500 r/min时(a)其谱图与标准卡片对比完全一致(e)(JCPDS卡号为16-0334)。当转速为400 r/min及以下时,出现了新的衍射峰(b),该衍射峰与NaCl所对应的衍射峰吻合(JCPDS卡号为75-0306),可能由于转速较低导致滴加NaOH和NH4F溶液时反应不完全,形成了NaCl[30,37]。同时NaCl晶体也可能使样品的形貌变得杂乱和无序。在低转速下,[300]面的衍射增强,[002]降低,推测出现球状或棒状的其他晶型[39]。研究其荧光特性(图5B)发现,随着转速的升高样品的荧光性能随之提升,但转速在400 r/min和450 r/min条件下制备的UCNPs荧光性能变化不大,转速升高至500 r/min时UCNPs荧光强度迅速升高,结合TEM和XRD结果分析,荧光性能较差与没有形成规则的六方相晶型有关,且生成的NaCl也会对荧光造成一定的影响。
综上,转速会影响UCNPs材料的均匀性及荧光强度。在300~500 r/min范围内,随着转速的升高,UCNPs纳米材料形貌更加均匀,荧光性能逐渐升高,500 r/min时荧光性能最佳。因此,制备UCNPs的最佳转速500 r/min。
2.3 UCNPs-Fe3O4光-磁纳米材料的结构研究
2.3.1 UCNPs-Fe3O4材料的构建
利用SiO2作为“桥梁”,将不同粒径的Fe3O4与UCNPs相交联,构建三种不同结构的光-磁复合材料,分别为A结构(Fe3O4包裹UCNPs的卫星结构材料)(图6A)、B结构(Fe3O4和UCNPs纳米材料均匀分布的交织结构)(图6B)、C结构(UCNPs包裹Fe3O4的卫星结构材料)(图6C)。图6A中可看出,A结构中小粒径的磁微球包围在大粒径的UCNPs纳米材料表面,形成了较多的暗部阴影。B结构中两类材料粒径相当交织在一起形成复合材料,图6B中高分辨透射电镜(HRTEM)显示出复合材料中两种粒径相近的晶体相互交错,其中0.28 nm的晶格间距对应Fe3O4的[220]面,0.48 nm对应UCNPs的[100]面。结合复合材料元素分布图分析,深蓝、亮黄、紫红、橙黄、浅蓝分别对应UCNPs代表元素F、Na、Y、Er、Yb,浅绿代表Fe,其分布均匀,表示两种材料均匀交联在一起。图6C显示出小粒径UCNPs包覆在Fe3O4微球的表面,表明交联成功。由于样品为强磁性,复合材料产生了一定的团聚现象,但从TEM图中依然可以较为清晰地观察到三种不同的结构。
2.3.2 UCNPs-Fe3O4材料的表征
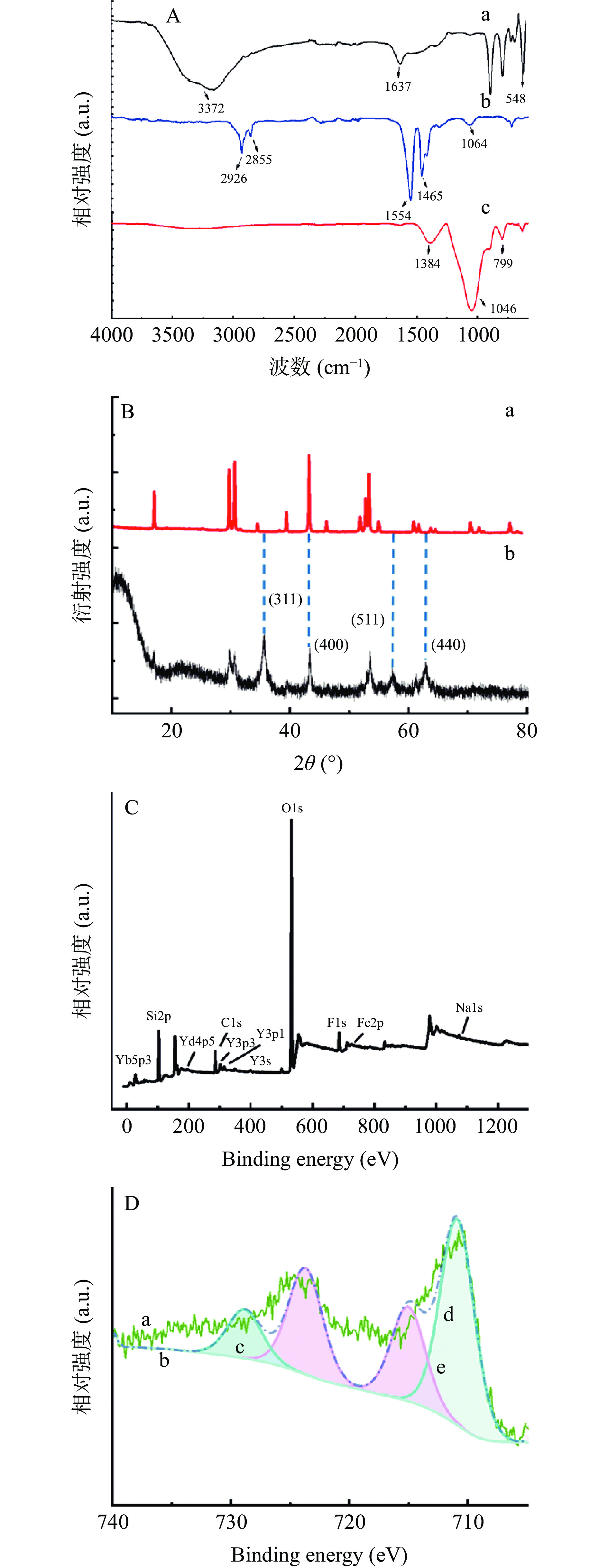
利用FT-IR对不同结构的UCNPs- Fe3O4纳米材料进行表征。如图7A所示,Fe3O4的强吸收带位于548 cm−1和1637 cm−1,这归因于Fe-O基团和H-O-H的伸缩振动。在3372 cm−1处的峰值归因于O-H 伸缩振动。2926 cm−1和2855 cm−1处的强峰分别与OA分子长烷基链上亚甲基(-CH2)的不对称和对称伸缩振动有关。此外,1554 cm−1和1465 cm−1的两个强吸收带归因于UCNP表面上羧酸根阴离子(COO−)的不对称和对称伸缩振动。二者通过TEOS交联后,其红外光谱图显示的1046 cm−1和799 cm−1的吸收带归因于Si-O-Si和Fe-O-Si的伸缩振动,在1384 cm−1处的峰值归因于H-O-H的伸缩振动,说明复合材料成功制备。
UCNPs-Fe3O4复合纳米材料的XRD图如图7B所示,UCNPs的特征峰并未消失,表明UCNPs的晶型未发生改变。然而,特征峰的强度减弱,同时2θ为35.5°、43.3°、57.3°和62.9°峰值处分别有[311]、[400]、[511]和[440]4个Fe3O4尖晶石结构的晶面衍射峰,在2θ为23.6°处有宽峰,说明该复合材料表面存在SiO2包裹层,进一步说明UCNPs-Fe3O4复合纳米材料制备成功。利用表面元素分析进一步验证复合材料的制备,如图7C所示,分别存在Y、Yb、Fe、Si、O等元素的信号峰,说明该复合材料中包含Y、Yb、Fe等元素。从图7D中可以看出,710.8 eV和723.8 eV处的峰值分别属于Fe 2p3/2和Fe 2p1/2,根据分析Fe2+含量为54.44%,可知该样品可能含有FeO;Fe3+的含量为45.56%,说明该样品中含有Fe2O3。此结果进一步证明了复合材料制备成功。
2.4 UCNPs-Fe3O4光-磁纳米材料的性能研究
2.4.1 不同材配料比对UCNPs-Fe3O4材料性能的影响
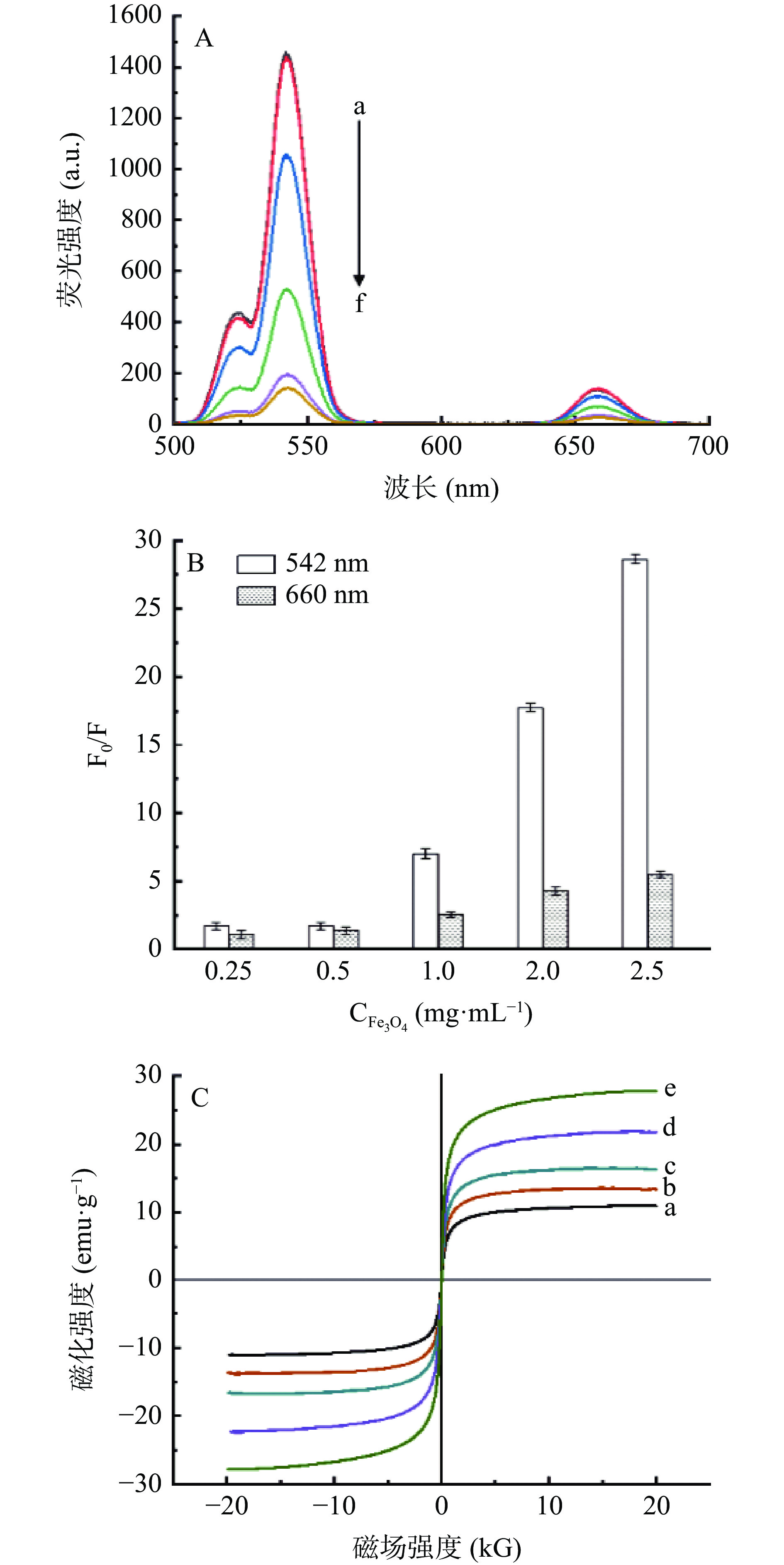
以A结构为研究对象,考察不同比例UCNPs和Fe3O4(8:1、4:1、2:1、1:1、1:2)对复合材料荧光和磁性的影响。从图8A可以看出,复合材料的荧光发射光谱与UCNPs的发射光谱基本一致,有两个最强的绿色发射峰:528 nm和542 nm分别属于Er3+的4H11/2→4I15/2和4S3/2→4I15/2跃迁。一个660 nm处的红色发射峰,属于Er3+的4F9/2→4I15/2跃迁,整体的发光强度由绿光主导,说明在材料复合制备过程中并没有对其荧光的发光方式产生影响。但Fe3O4达到一定浓度时对UCNPs荧光有作用,随着Fe3O4比例的增加,复合材料的荧光强度明显下降(图8A)。与542 nm处的荧光强度相比,Fe3O4对660 nm处的荧光的猝灭程度较弱(图8B)。同时,随着Fe3O4材料比例增大,复合材料的磁性显著增强,从mUCNPs:mFe3O4=8:1时饱和磁化强度10.9 emu·g−1增加至1:2时磁化强度27.8 emu·g−1(图8C)。但由于配比为2:1、1:1和1:2的荧光性能较差,故在8:1和4:1配比中进一步优选。二者的饱和磁化强度分别为10.9 emu·g−1和13.5 emu·g−1,但是在实际吸附过程中几乎没有差异,均可在30 s内从溶液中被2 T磁铁吸附。配比为8:1时,材料荧光特性最佳,因此选择UCNPs-Fe3O4配比8:1来制备后续实验材料。
![]() 图 8 不同材料配比制备的UCNPs-Fe3O4复合材料的荧光光谱图(A)、荧光猝灭(B)以及磁滞回归线(C)注:图A中,a、b、c、d、e、f mUCNPs:mFe3O4分别为未添加Fe3O4、8:1、4:1、2:1、1:1、1:2;图C中,a、b、c、d、e mUCNPs:mFe3O4分别为8:1、4:1、2:1、1:1、1:2。Figure 8. Fluorescence spectra (A), fluorescence quenching (B) and hysteresis regression line (C) of UCNPs-Fe3O4 composites prepared with different material ratios
图 8 不同材料配比制备的UCNPs-Fe3O4复合材料的荧光光谱图(A)、荧光猝灭(B)以及磁滞回归线(C)注:图A中,a、b、c、d、e、f mUCNPs:mFe3O4分别为未添加Fe3O4、8:1、4:1、2:1、1:1、1:2;图C中,a、b、c、d、e mUCNPs:mFe3O4分别为8:1、4:1、2:1、1:1、1:2。Figure 8. Fluorescence spectra (A), fluorescence quenching (B) and hysteresis regression line (C) of UCNPs-Fe3O4 composites prepared with different material ratios2.4.2 不同结构对UCNPs-Fe3O4材料性能的影响
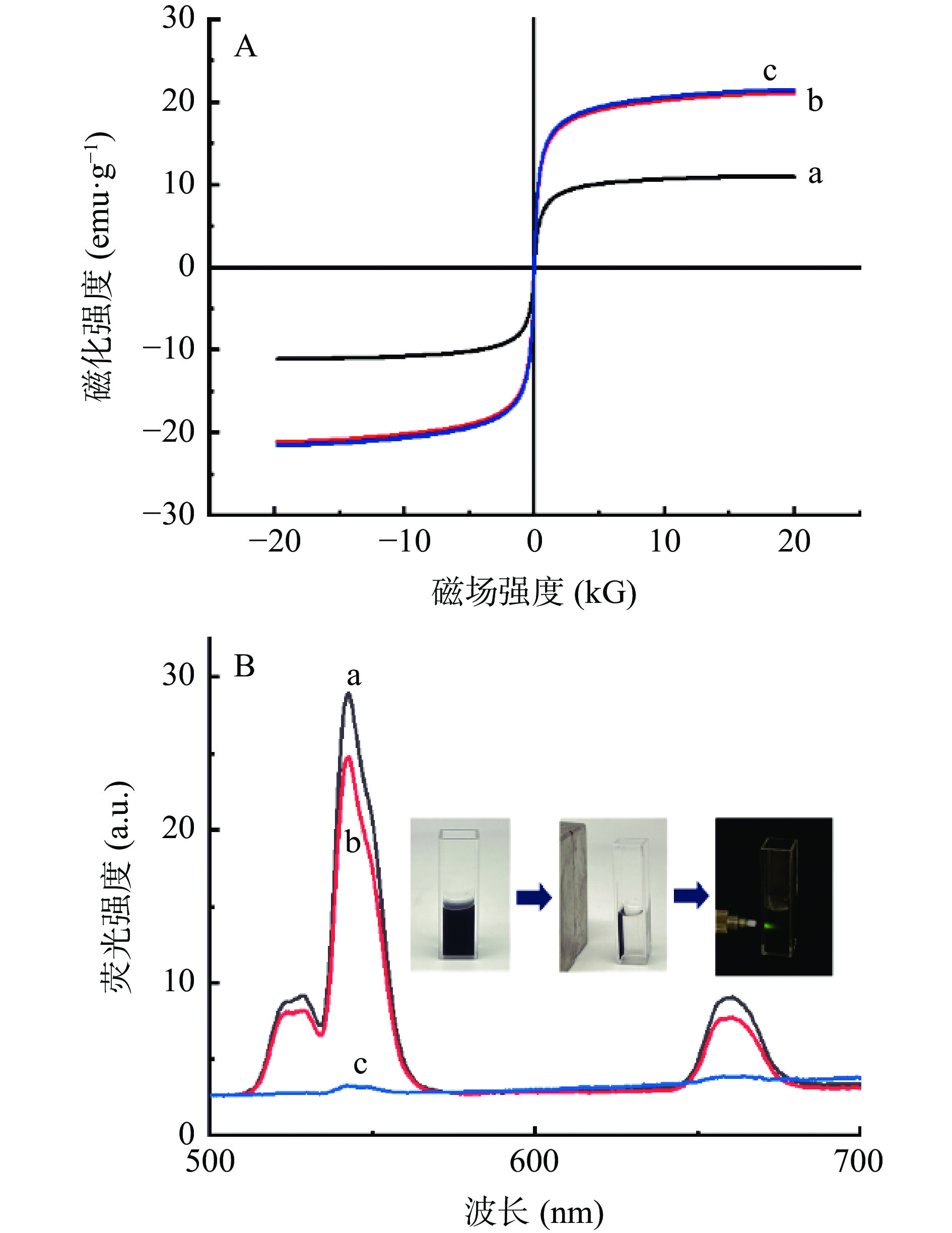
采用最佳的材料浓度配比构建三种不同结构的UCNPs-Fe3O4复合材料,研究复合材料的磁性及荧光特性。从磁滞回线(图9A)可看出,A结构的饱和磁化强度强度为10.9 emu·g−1,B、C结构的饱和磁化强度都可达到20.5 emu·g−1。这三种结构复合材料的饱和磁化强度与现有光-磁复合材料相比较,均具有不错的磁性[40−42]。在实际应用中三种结构复合材料吸附时间差异均小于3s。从荧光光谱图(图9B)可知,A结构的荧光强度最大,C结构的复合材料荧光几乎消失。三种复合材料的磁性和荧光性能可能与其磁性颗粒和荧光颗粒的粒径有较大关系,当磁性颗粒与荧光颗粒的粒径之比越大时其磁性就越强,同时其荧光效果下降,这可能与Fe3O4微球和UCNPs的结合位点和结合方式有关,可进一步深入研究[43]。A结构复合材料的荧光性能最佳,综合性能最强。因此,选择A结构复合材料进行进一步实验。
2.5 UCNPs-Fe3O4材料在食品检测中的应用
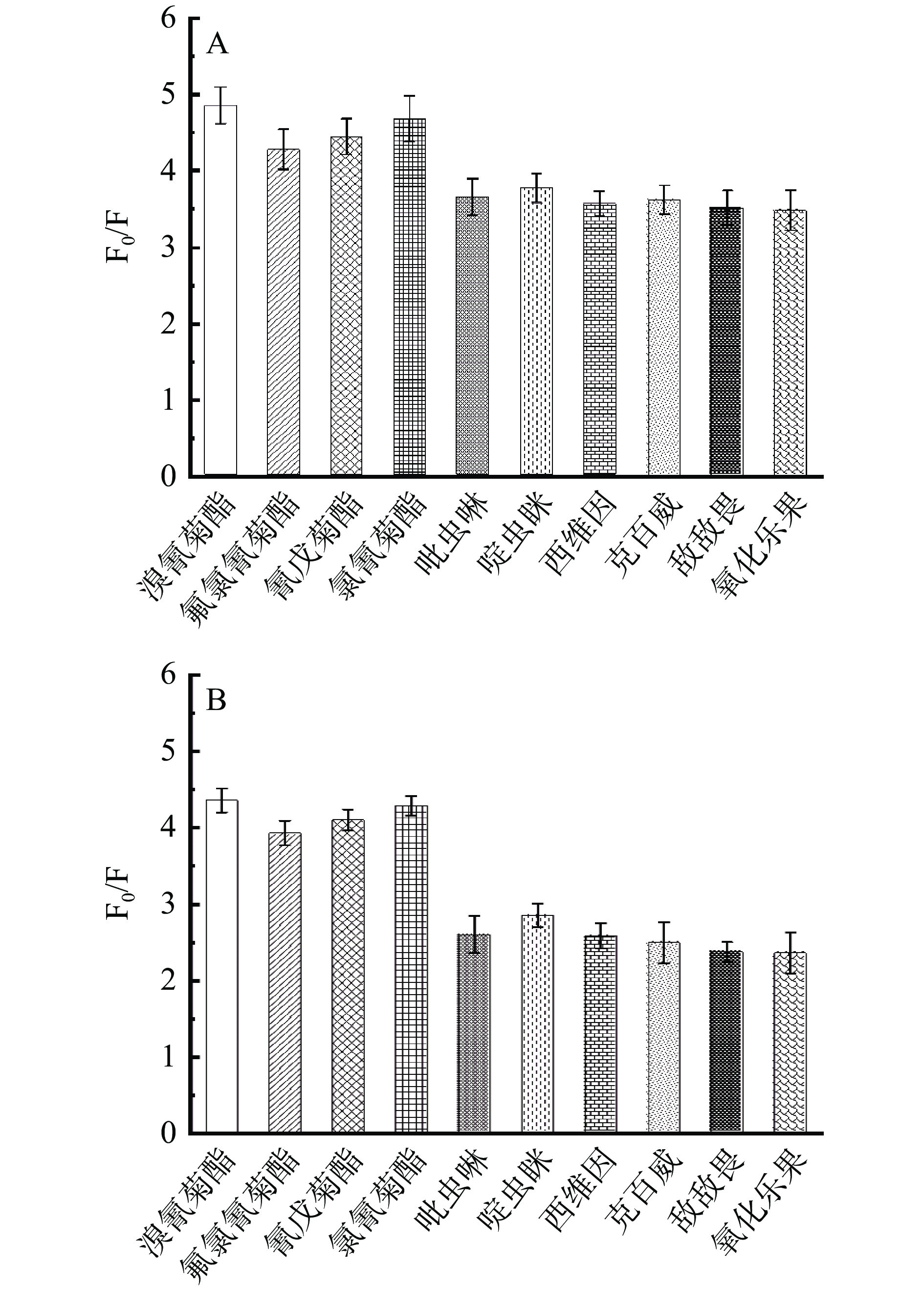
为了说明UCNPs-Fe3O4复合材料在食品安全中的应用,利用此材料考察柑橘中几种常复配农药(溴氰菊酯、氯氰菊酯、氟氯氰菊酯、氰戊菊酯、吡虫啉、啶虫脒、西维因、克百威、敌敌畏、氧化乐果)的响应情况(图10)。研究结果表明,在水体系中,菊酯类、新烟碱类、氨基甲酸酯类及有机磷类农药均造成UCNPs-Fe3O4复合材料的荧光猝灭,其中对菊酯类农药响应最强。对比橘汁体系,虽然橘汁呈黄色且有复杂基质成分,但各种农药仍会猝灭复合材料荧光,溴氰菊酯、氟氯氰菊酯、氰戊菊酯和氯氰菊酯对UCNPs-Fe3O4复合材料的猝灭程度F0/F分别为4.36、3.93、4.10和4.29,表明该复合材料具有较强的抗干扰能力。本实验并未对猝灭机理进行研究,但有相关研究表明农药造成UCNPs猝灭的原因为荧光共振能量转移或光电子能量转移[44]。基于本实验结果科研人员可根据不同的应用场景,将其与核酸适配体、抗体、分子印迹聚合物等相结合,构建具有特异性的农药传感体系。
3. 结论
本实验研究UCNPs制备条件对其形貌、荧光等性能的影响。利用此UCNPs进一步制备了三种不同结构的UCNPs-Fe3O4多功能光-磁复合材料,研究其相关性能,考察此复合材料对柑橘中常用农药的响应情况。结果表明,温度和转速对UCNPs的制备有重要影响,310 ℃和500 r/min的条件下能制备出粒径均匀,荧光性能极佳的高纯度六方相UCNPs材料。三种不同结构的UCNPs-Fe3O4多功能光-磁复合材料中,A结构荧光特性更强,室温下饱和磁强度为10.9 emu·g−1;B结构在室温下同时具有20.5 emu·g−1的饱和磁化强度和较高的荧光强度,性能平衡;C结构磁性最佳但荧光性能较差,不适合用于构建生物传感器但可应用于物质的磁性吸附和分离。复合材料对农药的响应结果表明,此复合材料对菊酯类、新烟碱类、氨基甲酸酯类及有机磷类农药均有响应,其中对菊酯类农药响应最强,同时对复杂柑橘基质有一定抗干扰能力。该复合材料有较佳的光-磁特性和生物相容性,可与抗体、分子印迹、核酸适配体等相结合,构建多功能生物传感器。
-
图 8 不同材料配比制备的UCNPs-Fe3O4复合材料的荧光光谱图(A)、荧光猝灭(B)以及磁滞回归线(C)
注:图A中,a、b、c、d、e、f mUCNPs:mFe3O4分别为未添加Fe3O4、8:1、4:1、2:1、1:1、1:2;图C中,a、b、c、d、e mUCNPs:mFe3O4分别为8:1、4:1、2:1、1:1、1:2。
Figure 8. Fluorescence spectra (A), fluorescence quenching (B) and hysteresis regression line (C) of UCNPs-Fe3O4 composites prepared with different material ratios
-
[1] YU Y, XU S, JIANG M H, et al. Near infrared triggered dual-functional NaYF4:Yb3+/Tm3+@NaYF4:Yb3+/Sm3+ core-shell ucnps for temperature sensing and photothermal conversion[J]. Physica B:Physics of Condensed Matter,2021,622:413340. doi: 10.1016/j.physb.2021.413340
[2] CHEN M, YAN Z Y, HAN L, et al. Upconversion fluorescence nanoprobe-based fret for the sensitive determination of shigella[J]. Biosensors,2022,12(10):795. doi: 10.3390/bios12100795
[3] NEHA D, SUDESHNA C. Upconversion nanoparticles:recent strategies and mechanism based applications[J]. Journal of Rare Earths,2022,40(9):1343−1359. doi: 10.1016/j.jre.2022.04.015
[4] CHEN H, DING B B, MA P A, et al. Recent progress in upconversion nanomaterials for emerging optical biological applications[J]. Advanced Drug Delivery Reviews,2022,188:114414. doi: 10.1016/j.addr.2022.114414
[5] CHEN B, WANG F. Emerging frontiers of upconversion nanoparticles[J]. Trends in Chemistry,2020,2(5):427−439. doi: 10.1016/j.trechm.2020.01.008
[6] ZHENG K Z, LOH K Y, WANG Y, et al. Recent advances in upconversion nanocrystals:expanding the kaleidoscopic toolbox for emerging applications [J]. Nano Today,2021,41:101315. doi: 10.1016/j.nantod.2021.101315
[7] SUO H, ZHU Q, ZHANG X, et al. High-security anti-counterfeiting through upconversion luminescence[J]. Materials Today Physics,2021,21:100520. doi: 10.1016/j.mtphys.2021.100520
[8] SOUMYASHREE D, KUNAL P, INDRANIL B, et al. Upconversion nanoparticle incorporated oleogel as probable skin tissue imaging agent[J]. Chemical Engineering Journal,2020,379(C):122272.
[9] YIN M M, LIU C W, GE R, et al. Paper-supported near-infrared-light-triggered photoelectrochemical platform for monitoring Escherichia coli O157:H7 based on silver nanoparticles-sensitized-upconversion nanophosphors[J]. Biosens Bioelectron,2022,203:114022. doi: 10.1016/j.bios.2022.114022
[10] WANG K, LI Y, LI H, et al. Upconversion fluorescent nanoparticles based-sensor array for discrimination of the same variety red grape wines[J]. Rsc RSC Advances,2019,9(13):7349−7355. doi: 10.1039/C8RA09959F
[11] CUI S S, CHEN H Y, ZHU H Y. Amphiphilic chitosan modified upconversion nanoparticles for in vivo photodynamic therapy induced by near-infrared light[J]. Journal of Materials Chemistry:An Interdisciplinary Journal Dealing with Synthesis, Structures, Properties and Applications of Materials, Particulary those Associated with Advanced Technology,2012,22(11):4861−4873.
[12] XU H, SUN X H, WU J, YU Y C, et al. Synthesis of magnetic metal-organic framework for efficient adsorption of disinfection by-products in water[J]. Colloids and Surfaces a:Physicochemical and Engineering Aspects,2023,660.
[13] LIN Y T, LI J F, CHEN S Y, et al. In situ construction of pyrite-marcasite-magnetite composite via FeS2 phase transformation and oxidation for the synergistic degradation of methyl orange and cr(vi)[J]. Separation and Purification Technology,2023,308:122764. doi: 10.1016/j.seppur.2022.122764
[14] GE H H, LIU X, YUAN H, et al. Biomimetic one-pot preparation of surface biofunctionalized silica-coated magnetic composites for dual enzyme oriented immobilization without pre-purification[J]. Enzyme and Microbial Technology,2023,164:110169. doi: 10.1016/j.enzmictec.2022.110169
[15] WANG M X, YOU X Y. Efficient adsorption of antibiotics and heavy metals from aqueous solution by structural designed pssma-functionalized-chitosan magnetic composite[J]. Chemical Engineering Journal,2023,454(3):140417.
[16] LEE W H, KIM J O. Mechanisms and novel performance of ZrO2/Fe3O4 composite for phosphate recovery from wastewater[J]. Chemical Engineering Journal,2023,453(1):1385−8947.
[17] LIU Q B, WANG Y H, LIU X L, et al. Glutaraldehyde base-cross-linked chitosan-silanol/Fe3O4 composite for removal of heavy metals and bacteria[J]. Environmental Science and Pollution Research International,2022,29(46):69439−69449. doi: 10.1007/s11356-022-20673-5
[18] XIAO M K, RUN Y B, SHUAILIN W, et al. Recovery of phosphorus from aqueous solution by magnetic TiO2*/Fe3O4 composites[J]. Chemical Physics Letters,2022,787:139234. doi: 10.1016/j.cplett.2021.139234
[19] YANG H, ZHANG J, LIU Y, et al. Rapid removal of anionic dye from water by poly (ionic liquid)-modified magnetic nanoparticles[J]. Journal of Molecular Liquids,2019,284:383−392. doi: 10.1016/j.molliq.2019.04.029
[20] CHEN M, HASSAN M, LI H, et al. Fluorometric determination of lead(ii) by using aptamer-functionalized upconversion nanoparticles and magnetite-modified gold nanoparticles[J]. Mikrochimica Acta,2020,187(1):85. doi: 10.1007/s00604-019-4030-4
[21] FENG L L, YANG D, HE F, et al. A core-shell-satellite structured Fe3O4@g-C3N4-ucnps-peg for t-1/t-2-weighted dual-modal mri-guided photodynamic therapy[J]. Advanced Healthcare Materials,2017,6(18):1700502. doi: 10.1002/adhm.201700502
[22] CHEN C L, LI C G, SHI Z. Current advances in lanthanide-doped upconversion nanostructures for detection and bioapplication[J]. Advanced Science,2016,3(10):1600029. doi: 10.1002/advs.201600029
[23] LIU G. Advances in the theoretical understanding of photon upconversion in rare-earth activated nanophosphors[J]. Chemical Society Reviews,2015,44(6):1635−1652. doi: 10.1039/C4CS00187G
[24] ZHANG Z, CHEN Y, ZHANG Y. Self-assembly of upconversion nanoparticles based materials and their emerging applications[J]. Small,2022,18(9):2103241. doi: 10.1002/smll.202103241
[25] LI Z Q, ZHANG Y. An efficient and user-friendly method for the synthesis of hexagonal-phase NaYF4:Yb, Er/Tm nanocrystals with controllable shape and upconversion fluorescence[J]. Nanotechnology,2008,19(34):345606. doi: 10.1088/0957-4484/19/34/345606
[26] ZHU X, ZHOU J, CHEN M, et al. Core-shell Fe3O4@NaLuF4:Yb, Er/Tm nanostructure for MRI, CT and upconversion luminescence tri-modality imaging[J]. Biomaterials,2012,33(18):4618−4627. doi: 10.1016/j.biomaterials.2012.03.007
[27] SU S S, MO Z R, TAN G Z, et al. Paa modified upconversion nanoparticles for highly selective and sensitive detection of Cu2+ ions[J]. Frontiers in Chemistry,2021,8:619764. doi: 10.3389/fchem.2020.619764
[28] OU Y Q, WANG L, AHMAD W, et al. A highly sensitive detection of carbendazim pesticide in food based on the upconversion-MnO2 luminescent resonance energy transfer biosensor[J]. Food Chemistry,2021,349:129157. doi: 10.1016/j.foodchem.2021.129157
[29] SU D, ZHAO X, YAN X, et al. Background-free sensing platform for on-site detection of carbamate pesticide through upconversion nanoparticles-based hydrogel suit[J]. Biosensors and Bioelectronics,2021,194:113598. doi: 10.1016/j.bios.2021.113598
[30] AN R, LIANG Y, DENG R, et al. Hollow nanoparticles synthesized via ostwald ripening and their upconversion luminescence-mediated boltzmann thermometry over a wide temperature range[J]. Light, Science & Applications,2022,11(1):217.
[31] LIU D, XU X, DU Y, et al. Three-dimensional controlled growth of monodisperse sub-50 nm heterogeneous nanocrystals[J]. Nature Communications,2016,7(1):10254. doi: 10.1038/ncomms10254
[32] ZHANG C, LEE J Y. Prevalence of anisotropic shell growth in rare earth core-shell upconversion nanocrystals[J]. Acs Nano,2013,7(5):4393−4402. doi: 10.1021/nn4009214
[33] KANG N, AI C, ZHOU Y, et al. Facile synthesis of upconversion nanoparticles with high purity using lanthanide oleate compounds[J]. Nanotechnology,2018,29(7):75601. doi: 10.1088/1361-6528/aa96ee
[34] HAKEEM D A, SU S S, MO Z R, et al. Upconversion luminescent nanomaterials:A promising new platform for food safety analysis[J]. Critical Reviews in Food Science and Nutrition,2022,62(32):8866−8907. doi: 10.1080/10408398.2021.1937039
[35] WANG L, LI X, LI Z, et al. A new cubic phase for a NaYF4 host matrix offering high upconversion luminescence efficiency[J]. Advanced Materials,2015,27(37):5528−5533. doi: 10.1002/adma.201502748
[36] STEPUK A, CASOLA G, SCHUMACHER C M, et al. Purification of NaYF4-based upconversion phosphors[J]. Chemistry of Materials,2014,26(6):2015−2020. doi: 10.1021/cm403459v
[37] LI D, SHAO Q, DONG Y, et al. Phase-, shape- and size-controlled synthesis of NaYF4:Yb3+, Er3+ nanoparticles using rare-earth acetate precursors[J]. Journal of Rare Earths,2014,32(11):1032−1036. doi: 10.1016/S1002-0721(14)60179-4
[38] RAJESH K, JOHANN P K, BENJAMIN V. An electron paramagnetic resonance spectroscopic investigation on the growth mechanism of NaYF4:Gd nanocrystals[J]. Angewandte Chemie,2012,51(26):6506−6510. doi: 10.1002/anie.201201025
[39] YUAN Z, LIN C, WANG Y L, et al. Anion additive-induced size, morphology, and local structure tuning of lanthanide-doped upconversion nanoparticles[J]. Advanced Materials Interfaces,2022,9(35):3771−3796.
[40] RASHIDI D S, IRANMANESH P, SALARIZADEH P. Fabrication, optimization, and characterization of ultra-small superparamagnetic Fe3O4 and biocompatible Fe3O4@ZnS core/shell magnetic nanoparticles:ready for biomedicine applications[J]. Materials Science & Engineering C,2019,98:205−212.
[41] LIANG X, FAN J, ZHAO Y, et al. Synthesis of NaYF4:Yb, Er upconversion nanoparticle-based optomagnetic multifunctional composite for drug delivery system[J]. Journal of Rare Earths,2021,39(5):579−586. doi: 10.1016/j.jre.2020.08.003
[42] XU J, LIU R, LI H, et al. Multifunctional upconversion nanoparticles based lret aptasensor for specific detection of As(iii) in aquatic products[J]. Sensors and Actuators. B, Chemical,2022,369:132271. doi: 10.1016/j.snb.2022.132271
[43] CHIEN H W, TSAI M T, YANG C H, et al. Interaction of LiYF4:Yb3+/Er3+/Ho3+/Tm3+@LiYF4:Yb3+ upconversion nanoparticles, molecularly imprinted polymers, and templates[J]. Rsc Advances,2020,10(59):35600−35610. doi: 10.1039/D0RA05771A
[44] QIN Y K, LI S, HONG Y, et al. Research process of synthesis, functionalization and application of upconversion nanoparticles in food safety detection[J]. Chinese Journal of Analytical Chemistry,2021,49(12):1955−1969.
-
期刊类型引用(2)
1. 张建,周岭. 新疆地区棉花秸秆粉碎还田及腐解现状调研. 中国农学通报. 2025(03): 48-58 .  百度学术
百度学术
2. 黄欣娅,李泓霖,郑业坤,运欢,郭婷,张宇昊,马良. 拟除虫菊酯农药类特异性传感体系构建及其在柑橘农残检测中的应用. 食品与发酵工业. 2024(17): 128-138 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:


 下载:
下载:



