Determination of 17 Kinds of Synthetic Colorants in Meat Products by UPLC-MS/MS
-
摘要: 为了建立超高效液相色谱-串联质谱法(UPLC-MS/MS)同时快速检测肉制品中17种合成色素的方法。经水振荡提取样品,正己烷除油,弱阴离子固相萃取柱(WAX)富集净化,以乙腈-5 mmol/L乙酸铵为流动相进行梯度洗脱,采取负离子扫描,在多反应监测模式(MRM)下,使17种目标化合物在ACQUITY UPLC HSS T3反相色谱柱上分离,使用外标法定量。结果表明,17种目标化合物在20~1200 μg/L的线性范围内相关系数均大于0.99,方法的检出限为0.01~0.05 mg/kg,定量限为0.03~0.15 mg/kg。17种目标化合物在阴性基质中通过添加3个不同加标水平(0.15、0.30和1.0 mg/kg)进行回收率测试,不同水平下的回收率为71.2%~103.5%,相对标准偏差(RSDs,n=6)范围为1.3%~4.9%。该方法净化效果好、操作简单、定量准确,适用于肉制品中合成色素的快速筛查以及快速定量分析。
-
关键词:
- 超高效液相色谱-串联质谱 /
- 色素 /
- 肉制品 /
- 弱阴离子固相萃取柱
Abstract: To establish a method for the rapid detection of 17 colorants in meat products by ultra performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS), samples were homogeneously extracted with water, degreased with n-hexane, enriched and purified with weak anion solid phase extraction (WAX) column. The seventeen compounds were separated on ACQUITY UPLC HSS T3 column by the gradient elution using acetonitrile-5 mmol/L ammonium acetate solution as mobile phase, detected by MS/MS with negative mode in multiple reaction monitoring (MRM) mode, and finally quantified by external standard method. The correlation coeffcients (r) of the seventeen compounds were above 0.99 in the mass concentration ranging from 20~1200 μg/L. The limits of detection and the limits of quantification of the method were 0.01~0.05 mg/kg and 0.03~0.15 mg/kg, respectively. The recoveries of seventeen analyses spiked at three levels (0.15, 0.30 and 1.0 mg/kg) in meat products ranged from 71.2% to 103.5% with the relative standard deviations (RSDs, n=6) ranged from 1.3%~4.9%. The method was easy to operate and with good purification effect. It could be applied to the rapid determination of the synthetic colorants in meat products . -
食品色泽是食品品质的一项重要指标,艳丽的色泽可提高人们的消费欲望。合成色素作为食品添加剂广泛应用在食品工业中,具有稳定性高、着色能力强、成本低廉、易调色等优点[1]。但合成色素主要以甲苯、苯等为原料,经过磺化、偶氮化等化学反应而制得,经人体代谢分解,可生成潜在的致癌物质,损害身体健康[2]。
在肉制品工业中,合成色素的使用有着严格要求,我国仅允许胭脂虫红、诱惑红等色素在肉制品中限量、限范围使用,而柠檬黄、苋菜红等常见合成色素禁止在肉制品中使用[3−4]。但在利益的驱动下,一些不法商家存在超范围、超限量使用色素的现象,甚至添加非食用色素,达到改善肉制品色泽的目的,危害食品安全[5]。据报道,在市场监督管理部门的日常监督抽检和专项抽检中,发现肉制品中检出酸性橙Ⅱ(酸性橙7)、酸性红1等非食用色素[6]。GB 5009.35-2016[7]、GB/T 9695.6-2008[8]、SN/T 1743-2006[9]及SN/T 3536-2013[10]等国家及行业标准中,规范了对柠檬黄、胭脂红、日落黄、酸性橙7等色素的检测方法,但是针对肉制品中可能非法添加酸性红1、偶氮玉红等化合物还没有相应的检测标准方法,缺少同时检测多种色素的技术,日常监督检测存在一定盲区。
目前,检测肉制品中色素常用方法包括薄层色谱法[11]、高效液相色谱法[12−14]以及液相色谱-串联质谱法[15−18]等。蒋荣华等[19]采用高效液相色谱法对肉制品中的苋菜红、柠檬黄、胭脂红等6种色素进行检测,方法的检出限为0.12~0.21 mg/kg,方法的回收率为70.33%~93.08%。王韦达等[20]建立了固相萃取-超高效液相色谱分析方法,对不同食品中的红2G进行检测,方法检出限为0.03 mg/kg,平均回收率在80%以上。李道霞等[21]建立了阴离子固相萃取-HPLC法测定肉制品中酸性橙Ⅱ、喹啉黄、红2G等色素的方法,该方法定量限为0.6~1.5 mg/kg,平均回收率为65.2%~102.0%。高效液相色谱法是目前国家标准、行业标准检测色素的主要方法,但是存在定性不准、灵敏度较差等问题,相较于高效液相色谱和薄层色谱法而言,高效液相色谱-串联质谱法具有定性准确、分析时间短等优势。因此,本文针对肉制品中超量超范围以及非法添加色素的现象,通过对样品前处理及液相色谱-串联质谱法测定条件进行优化,以期建立一种快速同时测定肉制品中酸性红1、酸性橙7等17种合成色素含量的方法,为肉制品中合成色素的滥用提供一种高效便捷的快速筛查及定量仪器方法,为食品安全监管提供技术支撑。
1. 材料与方法
1.1 材料与仪器
26批次火腿肠、26批次香肠、10批次鸭脖、10批次腊肉等样品 购自武汉市、鄂州市、黄石市的超市以及个体工商户;乙腈、正己烷、甲酸、氨水、乙酸铵 色谱纯,德国Merck公司;硫酸铵 分析纯,国药集团化学试剂有限公司 ;标准品信息见表1。
表 1 17种色素标准物质信息Table 1. Information of seventeen colorants序号 中文名 英文名 CAS号 分子式 生产厂家 纯度(%) 1 酸性红1 Azophloxine 3734-67-6 C18H13N3Na2O8S2 阿尔塔 98.2 2 偶氮玉红 Azorubin 3567-69-9 C20H12N2Na2O7S2 曼哈格 98.0 3 酸性紫7 Acid vilot 7 4321-69-1 C20H16N4Na2O9S2 阿尔塔 98.7 4 胭脂红SX Ponceau SX 4548-53-2 C18H14N2Na2O7S2 曼哈格 98.2 5 酸性红73 Acid Red 73 5413-75-2 C22H14N4Na2O7S2 曼哈格 97.8 6 酸性红26 Acid Red 26 3761-53-3 C18H14N2Na2O7S2 阿尔塔 97.7 7 酸性红18 Acid Red 18 2611-82-7 C20H11N2Na3O10S3 坛墨 98.3 8 新红 New Red 220658-76-4 C18H12N3O11S3 Na3 阿尔塔 99.3 9 诱惑红 Allura Red AC 25956-17-6 C18H14N2Na2O8S2 坛墨 96.6 10 苋菜红 Amaranth 915-67-3 C20H11N2Na3O10S3 曼哈格 98.4 11 酸性橙20 Acid orange 20 523-44-4 C16H11N2NaO4S 安谱 96.3 12 酸性橙7 Acid Orange 7 633-96-5 C16H11N2NaO4S 坛墨 98.9 13 橙黄G Orange G 1936-15-8 C16H10N2Na2O7S2 曼哈格 98.1 14 酸性黄17 Acid yellow 17 6359-98-4 C16H10Cl2N4O7S2Na2 阿尔塔 98.6 15 亮黄 Brilliant yellow 3051-11-4 C26H18N4Na2O8S2 阿尔塔 99.2 16 柠檬黄 Tartrazine 1934-21-0 C16H9N4Na3O9S2 安谱 99.8 17 日落黄 SunsetYellow FCF 2783-94-0 C16H10N2Na2O7S2 坛墨 99.9 WAX固相萃取柱(200 mg, 6 mL)、ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm) 美国Waters公司;AB 4500液质联用仪,配MultiQuant数据分析软件 美国AB SCIEX公司;ME204电子天平 梅特勒-托利多仪器有限公司;MultiVortex涡旋混合器 广州得泰仪器科技有限公司;CLT55 离心机 湖南湘仪实验室仪器开发有限公司;0.22 μm水系滤膜 天津津腾公司;Milli-Q超纯水系统 美国Millipore公司。
1.2 实验方法
1.2.1 标准溶液配制
分别精密称取17种待测成分的标准品适量于10 mL容量瓶中(精确至0.0001 g),加入少量超纯水进行溶解,定容到刻度,获得不同化合物的单一标准储备溶液,标准储备液浓度范围为0.10~2.3 mg/mL,精密量取适量标准储备液,用水稀释,配制成浓度均为10 μg/mL的混合标准溶液。所有标准溶液在4 ℃条件下贮存。
1.2.2 样品前处理
提取:取有代表性样品500 g,采用粉碎机粉碎后,再将其研磨成细粉状,装入洁净的玻璃盛样容器内,密封并标明标记。称取2.0 g(精确至0.01 g)粉碎样品于50 mL聚丙烯离心管中,加入10 mL水,涡旋混匀1 min,50 ℃下超声提取10 min,加入0.5 mL饱和硫酸铵溶液,振荡混匀1 min,8000 r/min离心10 min,转移上清液至25 mL具塞试管中,加入10 mL水再提取一次,合并两次滤液,用水定容到25 mL,此为提取液。
净化:将25 mL提取液全部转移到50 mL离心管,加入正己烷20 mL,涡旋混匀2 min,8000 r/min离心5 min,弃去全部上层正己烷,取10 mL下层溶液待净化。将10 mL待净化液通过已活化的WAX固相萃取柱,分别用3 mL水、3 mL 2%甲酸-甲醇淋洗,弃去淋洗液,用6 mL 5%氨水-甲醇洗脱,收集洗脱液,50 ℃水浴下氮吹至干,用水定容到1.0 mL,涡旋混匀,过0.22 μm水系滤膜(聚醚砜材质),待上机。
1.2.3 色谱条件
色谱柱:ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);进样量:5 μL;柱温:35 ℃;流动相:A相为5 mmol/L乙酸铵,B相为乙腈,流速0.3 mL/min;梯度洗脱条件如表2。
表 2 梯度洗脱程序Table 2. The gradient elution program流动相 时间(min) 0 0.5 7.5 8.5 8.6 10 A(%) 95 95 10 10 95 95 B(%) 5 5 90 90 5 5 1.2.4 质谱条件
离子源:电喷雾离子源;扫描方式:负离子扫描;检测方式:多反应监测;电喷雾电压:−4500 V;离子源温度:500 ℃;气帘气压力:35 psi;碰撞气压力:8 psi;雾化器压力:55 psi;辅助气压力:55 psi;入口电压:−10.0 V;碰撞室出口电压:−10.0 V。各色素的质谱参考条件见表3。
表 3 17种化合物的定性离子、定量离子、去簇电压和碰撞能量Table 3. Qualitative ion, quantitative ion, cone voltage and collision energy of seventeen compounds化合物名称 保留时间 (min) 扫描模式 母离子(m/z) 子离子(m/z) 去簇电压(V) 碰撞能量(eV) 酸性红1(Azophloxine) 4.38 [M-2Na]2− 231.4 179.0*;157.8 −50 −17/−22 偶氮玉红(Azorubin) 4.71 [M-2Na]2− 228.0 170.0*;221.0 −50 −26/−19 酸性紫7(Acid violet) 4.01 [M-2Na]2− 260.1 178.8*;157.7 −50 −19/−26 胭脂红SX(Ponceau SX) 4.78 [M-2Na]2− 217.0 198.6*;170.0 −50 −20/−24 酸性红73(Acid Red 73) 5.32 [M-2Na]2− 255.0 150.4*;241.0 −30 −17/−11 酸性红26(Acid Red 26) 4.75 [M-2Na]2− 217.0 136.3*;150.2 −40 −25/−19 酸性红18(Acid 18) 3.72 [M-3Na+H]2− 268.0 205.9*;221.0 −45 −19/−25 新红(New Red) 3.24 [M-3Na+H]2− 271.5 171.9*;227.0 −60 −21/−30 诱惑红(Allura Red AC) 4.22 [M-2Na]2− 225.0 207.0*;200.0 −40 −20/−24 苋菜红(Amaranth) 3.32 [M-3Na+H]2− 267.9 228.0*;221.0 −60 −21/−24 酸性橙20(Acid Orange 20) 5.14 [M-Na]− 327.0 246.7*;171.1 −50 −25/−33 酸性橙7(Acid Orange 7) 5.72 [M-Na]− 327.0 171.0*;156.0 −40 −31/−43 橙黄G(Orange G) 4.28 [M-2Na]2− 202.9 150.4*;189.0 −30 −12/−7 酸性黄17(Acid Yellow 17) 4.83 [M-2Na]2− 252.2 170.8*;106.9 −40 −22/−35 亮黄(Brilliant Yellow) 3.09 [M-2Na]2− 288.9 248.9*;196.2 −50 −21/−26 柠檬黄(Food Yellow 4) 3.96 [M-3Na+H]2− 232.9 211.0*;197.8 −30 −10/−20 日落黄(Sunset Yellow FCF) 3.91 [M-2Na]2− 203.0 170.8*;181.0 −40 −20/−35 注:*为定量离子对。 1.3 数据处理
使用Analyst软件采集数据,运用MultiQuant 3.0.2进行定性定量分析,使用Origin 9.0软件作图。
2. 结果与分析
2.1 色谱条件与质谱条件的优化
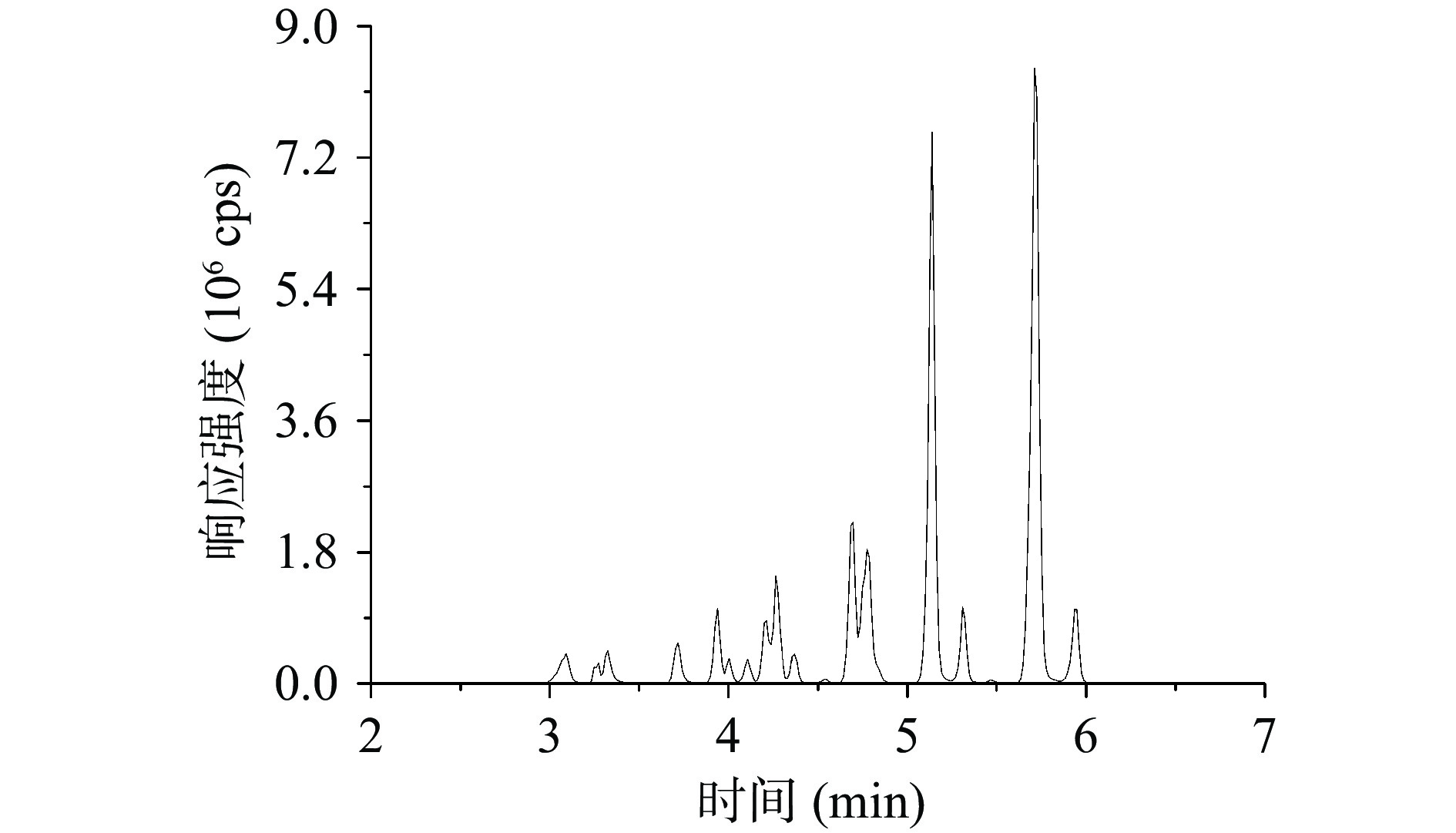
为准确获得17种色素的母离子,对质量浓度为0.5 mg/L的各化合物单一标准溶液依次进行了一级质谱扫描。实验结果表明,在负离子扫描模式下,含有1个钠离子的化合物能稳定形成[M-Na]−离子峰,含有2个钠离子的化合物能稳定形成[M-2Na]2−离子峰,含3个钠离子的化合物能同时稳定形成[M-3Na+H]2−和[M-3Na]3−离子峰,然而在后续的上机测试中,发现[M-3Na]3−响应极低,可能是因为[M-3Na]3−为源内裂解而产生[22],而[M-3Na+H]2−具有响应高且稳定的特点,因此选择[M-3Na+H]2−。为得到稳定性好、响应值高的定性定量子离子,对质谱和液相参数进行了优化,最佳参数见表3。在17种化合物中,一共含有3对同分异构体,分别是胭脂红SX和酸性红26(分子式均为C18H14N2Na2O7S2),酸性红18和苋菜红(分子式均为C20H11N2Na3O10S3),酸性橙7和酸性橙20(分子式均为C16H11N2NaO4S)。在实际的色谱分离中,通过改变流动相的梯度,能够很好地将酸性红18和苋菜红、酸性橙7和酸性橙20两对同分异构体进行色谱分离,再通过单一标准溶液确定其各自保留时间,苋菜红和酸性红18的保留时间分别为3.32 min和3.72 min,酸性橙20和酸性橙7的保留时间分别为5.14 min和5.72 min,它们互不干扰,保留时间的不一致使得它们满足定性定量要求;改变流动相洗脱比例,很难将胭脂红SX和酸性红26分离,但它们碎裂的离子对具有独立性和专一性,产生的碎裂离子互不干扰,因此定性定量不受影响。酸性红18和苋菜红,酸性橙7和酸性橙20的定量离子质谱图及总离子流图见图1。
2.2 样品前处理的优化
2.2.1 净化与上机测试
2.2.1.1 固相萃取柱的选择
肉制品需通过净化以除去油脂等干扰物,保证上机样品不污染仪器。有研究通过稀释提取液100倍来达到净化和减弱基质效应[17]。而更多的研究选择使用固相萃取柱对色素进行净化富集,包括WAX[23]、C18[24−25]、HLB[26],但尚无文献使用固相萃取柱富集净化的方法来同时测定文中所选取的17种色素,因此本研究通过空白加标的方式验证了几款不同的固相萃取柱对这些色素的回收率,其中上样、淋洗、洗脱步骤按照萃取柱产品推荐的步骤进行。实验结果表明,只有WAX同时对这17种化合物具有较强的保留能力,回收率在70%~110%之间,满足实验需要,因此选择WAX固相萃取柱。
2.2.1.2 上样溶液酸碱性的影响
pH可以改变化合物的离子化或质子化程度,从而影响目标化合物在固相萃取小柱中的保留情况[27]。本实验比较了不同酸碱性下17种化合物在固相萃取小柱的保留情况。将含量均为1000 ng的17种目标化合物分别添加到5 mL水、5 mL 0.1 mol/L硫酸铵、5 mL 1%氨水中,再全部通过已活化的WAX固相萃取柱,收集全部流出液,并测试目标化合物含量。实验发现水和0.1 mol/L硫酸铵上样后,流出液均不含目标物成分,说明WAX固相萃取柱能很好地保留这17种化合物。而1%氨水作为提取试剂进行上样,流出液含有部分目标物,特别是酸性红73、酸性红18、亮黄,在碱性上样条件下,目标物回收率不足50%。结合文献报道[28−29],在pH6.0左右时,含有磺酸基的色素能在弱阴离子固相萃取柱上柱有最佳保留[30],因此本研究通过加入适量饱和硫酸铵溶液使上样呈弱酸性(pH6.0)来增加其在阴离子固相萃取柱上的保留。
2.2.1.3 淋洗溶液的选择
淋洗剂的选择是影响固相萃取柱回收率的重要因素,它不仅能去除非特异性结合的杂质,而且还能最大程度地保留目标化合物,从而提高检测的准确性和灵敏度[31−32]。选择5%甲醇-水、50%甲醇水、及5%甲醇-水(含2%甲酸)、50%甲醇水(含2%甲酸)、100%甲醇(含2%甲酸)进行淋洗,结果表明它们均能很好地保留目标化合物而不流出固相萃取柱,但使用100%甲醇(含2%甲酸)淋洗效果最佳,原因是此时能有效除去固相萃取柱残留的水分,下一步洗脱液在相同氮吹条件下能短时间内完全氮吹至干,有助于定容操作。
2.2.1.4 滤膜的影响
实验发现使用尼龙材质的滤膜,对17种色素有不同程度的截留吸附,其中,通过尼龙滤膜后,偶氮玉红、胭脂红SX、酸性红73、酸性橙20、酸性橙7、亮黄被吸附100%,其他被吸附50%以上,而聚醚砜(PES)滤膜不吸附目标物,因此在进行过膜上机时,应严格测试所使用的滤膜,以保证合成色素不被滤膜材质所吸附。
2.3 线性范围、检出限、定量限、加标回收率及相对标准偏差
配制一系列标准溶液,以色素的质量浓度为横坐标,质谱的定量峰面积为纵坐标,绘制标准曲线,得出17种色素在20~1200 μg/L范围内具有良好的线性关系,R>0.99,以信噪比S/N=3确定检出限,以S/N=10确定定量限,17种化合物检出限(LOD)为0.01~0.05 mg/kg,定量限(LOQ)为0.03~0.15 mg/kg。在香肠空白基质中分别添加不同浓度标准溶液,按照本文方法进行处理,按高中低三水平对空白样品提取液进行添加,每个添加水平平行测定6次,计算回收率及相对标准偏差。各化合物在3个添加水平(0.15、0.30和1.0 mg/kg)下的回收率为71.2%~103.5%,相对标准偏差(RSDs,n=6)为1.3%~4.9%。线性范围、检出限、定量限、加标回收率及相对标准偏差具体结果见表4。
表 4 17种化合物的加标回收率、相对标准偏差、检出限、定量限及标准曲线及相关系数Table 4. Average spiked recoveries, relative standard deviations, LODs , LOQs, standard curve and correlation coefficient of seventeen compounds化合物名称 加标水平
(mg/kg)平均回收率
(%)RSD
(%)检出限
(mg/kg)定量限
(mg/kg)标准曲线及相关系数 酸性红1 0.15 103.5 2.3 0.02 0.06 y=1401x−1275,R=0.999 0.30 93.3 3.2 1.0 102.6 1.9 偶氮玉红 0.15 82.5 4.5 0.01 0.03 y=4827x+1349,R=0.999 0.30 89.5 3.6 1.0 94.1 2.8 酸性紫7 0.15 97.9 3.3 0.05 0.15 y=871x−178,R=0.999 0.30 92.1 3.9 1.0 103.5 1.8 胭脂红SX 0.15 89.3 4.2 0.01 0.03 y=5049x+2480,R=0.999 0.30 91.2 3.5 1.0 90.5 1.4 酸性红73 0.15 77.6 4.8 0.02 0.06 y=3758x−1199,R=0.999 0.30 72.2 4.7 1.0 80.1 3.6 酸性红26 0.15 80.2 4.8 0.01 0.03 y=4797x+2760,R=0.999 0.30 83.2 2.5 1.0 89.1 1.3 酸性红18 0.15 72.2 3.9 0.02 0.06 y=2781x−1265,R=0.999 0.30 79.6 4.2 1.0 78.3 1.9 新红 0.15 86.5 2.5 0.02 0.06 y=1158x−2425,R=0.999 0.30 87.3 3.3 1.0 86.3 4.4 诱惑红 0.15 89.2 2.9 0.02 0.06 y=3587x+6480,R=0.995 0.30 86.1 3.8 1.0 88.4 4.2 苋菜红 0.15 83.2 2.9 0.05 0.15 y=879x+799,R=0.999 0.30 92.1 2.8 1.0 81.7 4.2 酸性橙20 0.15 86.8 1.8 0.01 0.03 y=5590x+12015,R=0.998 0.30 92.1 4.2 1.0 87.3 4.9 酸性橙7 0.15 80.5 1.9 0.01 0.03 y=23275x+85100,R=0.996 0.30 86.3 3.1 1.0 87.5 3.9 橙黄G 0.15 86.2 2.5 0.02 0.06 y=1713x+1025,R=0.999 0.30 84.1 2.8 1.0 82.2 1.5 酸性黄17 0.15 80.5 3.9 0.01 0.03 y=6832x+65221,R=0.992 0.30 83.5 3.1 1.0 93.2 3.3 亮黄 0.15 71.2 4.9 0.05 0.15 y=477x−129,R=0.999 0.30 77.3 4.2 1.0 79.5 3.1 柠檬黄 0.15 95.2 3.6 0.05 0.15 y=2003x−2374,R=0.998 0.30 90.6 3.1 1.0 87.3 2.1 日落黄 0.15 89.1 3.5 0.01 0.03 y=4346x+9856,R=0.997 0.30 93.5 3.0 1.0 93.2 1.5 2.4 实际样品检测结果
采用优化建立的UPLC-MS/MS方法对市售香肠、火腿肠、熟制鸭脖、腊肉等72份样品进行检测。结果显示检出诱惑红样品6个,均为火腿肠,含量为0.71~2.7 mg/kg,含量低于国家标准限量15 mg/kg,为合格食品;检出酸性红1样品4个,均为香肠,含量为0.39~3.2 mg/kg,酸性红1为非法添加色素,值得监管部门的关注。
3. 结论
本文建立了同时测定肉制品中17种人工合成色素的UPLC-MS/MS检测方法。该方法重现性好、灵敏度高。17种色素在20~1200 μg/L范围内线性关系良好,R>0.99,方法的检出限为0.01~0.05 mg/kg,定量限为0.03~0.15 mg/kg。各色素在3个添加水平(0.15、0.30和1.0 mg/kg)下的回收率为71.2%~103.5%,相对标准偏差(RSDs,n=6)为1.3%~4.9%。对实际样品进行检测,结果表明在肉制品中含有非食用色素酸性红1,含量为0.39~3.2 mg/kg,值得监管部门的关注。本方法可实现同时分析肉制品中的17种色素,大大提高了检验效率,为检验人员提供了一个简单、快捷、高效的检验方法,也为食品安全提供了技术保障,还可对肉制品中色素相关检测数据进行累积从而进行必要的风险评估,为政府监管部门提供数据支持,具有实际意义和一定社会效益。
-
表 1 17种色素标准物质信息
Table 1 Information of seventeen colorants
序号 中文名 英文名 CAS号 分子式 生产厂家 纯度(%) 1 酸性红1 Azophloxine 3734-67-6 C18H13N3Na2O8S2 阿尔塔 98.2 2 偶氮玉红 Azorubin 3567-69-9 C20H12N2Na2O7S2 曼哈格 98.0 3 酸性紫7 Acid vilot 7 4321-69-1 C20H16N4Na2O9S2 阿尔塔 98.7 4 胭脂红SX Ponceau SX 4548-53-2 C18H14N2Na2O7S2 曼哈格 98.2 5 酸性红73 Acid Red 73 5413-75-2 C22H14N4Na2O7S2 曼哈格 97.8 6 酸性红26 Acid Red 26 3761-53-3 C18H14N2Na2O7S2 阿尔塔 97.7 7 酸性红18 Acid Red 18 2611-82-7 C20H11N2Na3O10S3 坛墨 98.3 8 新红 New Red 220658-76-4 C18H12N3O11S3 Na3 阿尔塔 99.3 9 诱惑红 Allura Red AC 25956-17-6 C18H14N2Na2O8S2 坛墨 96.6 10 苋菜红 Amaranth 915-67-3 C20H11N2Na3O10S3 曼哈格 98.4 11 酸性橙20 Acid orange 20 523-44-4 C16H11N2NaO4S 安谱 96.3 12 酸性橙7 Acid Orange 7 633-96-5 C16H11N2NaO4S 坛墨 98.9 13 橙黄G Orange G 1936-15-8 C16H10N2Na2O7S2 曼哈格 98.1 14 酸性黄17 Acid yellow 17 6359-98-4 C16H10Cl2N4O7S2Na2 阿尔塔 98.6 15 亮黄 Brilliant yellow 3051-11-4 C26H18N4Na2O8S2 阿尔塔 99.2 16 柠檬黄 Tartrazine 1934-21-0 C16H9N4Na3O9S2 安谱 99.8 17 日落黄 SunsetYellow FCF 2783-94-0 C16H10N2Na2O7S2 坛墨 99.9 表 2 梯度洗脱程序
Table 2 The gradient elution program
流动相 时间(min) 0 0.5 7.5 8.5 8.6 10 A(%) 95 95 10 10 95 95 B(%) 5 5 90 90 5 5 表 3 17种化合物的定性离子、定量离子、去簇电压和碰撞能量
Table 3 Qualitative ion, quantitative ion, cone voltage and collision energy of seventeen compounds
化合物名称 保留时间 (min) 扫描模式 母离子(m/z) 子离子(m/z) 去簇电压(V) 碰撞能量(eV) 酸性红1(Azophloxine) 4.38 [M-2Na]2− 231.4 179.0*;157.8 −50 −17/−22 偶氮玉红(Azorubin) 4.71 [M-2Na]2− 228.0 170.0*;221.0 −50 −26/−19 酸性紫7(Acid violet) 4.01 [M-2Na]2− 260.1 178.8*;157.7 −50 −19/−26 胭脂红SX(Ponceau SX) 4.78 [M-2Na]2− 217.0 198.6*;170.0 −50 −20/−24 酸性红73(Acid Red 73) 5.32 [M-2Na]2− 255.0 150.4*;241.0 −30 −17/−11 酸性红26(Acid Red 26) 4.75 [M-2Na]2− 217.0 136.3*;150.2 −40 −25/−19 酸性红18(Acid 18) 3.72 [M-3Na+H]2− 268.0 205.9*;221.0 −45 −19/−25 新红(New Red) 3.24 [M-3Na+H]2− 271.5 171.9*;227.0 −60 −21/−30 诱惑红(Allura Red AC) 4.22 [M-2Na]2− 225.0 207.0*;200.0 −40 −20/−24 苋菜红(Amaranth) 3.32 [M-3Na+H]2− 267.9 228.0*;221.0 −60 −21/−24 酸性橙20(Acid Orange 20) 5.14 [M-Na]− 327.0 246.7*;171.1 −50 −25/−33 酸性橙7(Acid Orange 7) 5.72 [M-Na]− 327.0 171.0*;156.0 −40 −31/−43 橙黄G(Orange G) 4.28 [M-2Na]2− 202.9 150.4*;189.0 −30 −12/−7 酸性黄17(Acid Yellow 17) 4.83 [M-2Na]2− 252.2 170.8*;106.9 −40 −22/−35 亮黄(Brilliant Yellow) 3.09 [M-2Na]2− 288.9 248.9*;196.2 −50 −21/−26 柠檬黄(Food Yellow 4) 3.96 [M-3Na+H]2− 232.9 211.0*;197.8 −30 −10/−20 日落黄(Sunset Yellow FCF) 3.91 [M-2Na]2− 203.0 170.8*;181.0 −40 −20/−35 注:*为定量离子对。 表 4 17种化合物的加标回收率、相对标准偏差、检出限、定量限及标准曲线及相关系数
Table 4 Average spiked recoveries, relative standard deviations, LODs , LOQs, standard curve and correlation coefficient of seventeen compounds
化合物名称 加标水平
(mg/kg)平均回收率
(%)RSD
(%)检出限
(mg/kg)定量限
(mg/kg)标准曲线及相关系数 酸性红1 0.15 103.5 2.3 0.02 0.06 y=1401x−1275,R=0.999 0.30 93.3 3.2 1.0 102.6 1.9 偶氮玉红 0.15 82.5 4.5 0.01 0.03 y=4827x+1349,R=0.999 0.30 89.5 3.6 1.0 94.1 2.8 酸性紫7 0.15 97.9 3.3 0.05 0.15 y=871x−178,R=0.999 0.30 92.1 3.9 1.0 103.5 1.8 胭脂红SX 0.15 89.3 4.2 0.01 0.03 y=5049x+2480,R=0.999 0.30 91.2 3.5 1.0 90.5 1.4 酸性红73 0.15 77.6 4.8 0.02 0.06 y=3758x−1199,R=0.999 0.30 72.2 4.7 1.0 80.1 3.6 酸性红26 0.15 80.2 4.8 0.01 0.03 y=4797x+2760,R=0.999 0.30 83.2 2.5 1.0 89.1 1.3 酸性红18 0.15 72.2 3.9 0.02 0.06 y=2781x−1265,R=0.999 0.30 79.6 4.2 1.0 78.3 1.9 新红 0.15 86.5 2.5 0.02 0.06 y=1158x−2425,R=0.999 0.30 87.3 3.3 1.0 86.3 4.4 诱惑红 0.15 89.2 2.9 0.02 0.06 y=3587x+6480,R=0.995 0.30 86.1 3.8 1.0 88.4 4.2 苋菜红 0.15 83.2 2.9 0.05 0.15 y=879x+799,R=0.999 0.30 92.1 2.8 1.0 81.7 4.2 酸性橙20 0.15 86.8 1.8 0.01 0.03 y=5590x+12015,R=0.998 0.30 92.1 4.2 1.0 87.3 4.9 酸性橙7 0.15 80.5 1.9 0.01 0.03 y=23275x+85100,R=0.996 0.30 86.3 3.1 1.0 87.5 3.9 橙黄G 0.15 86.2 2.5 0.02 0.06 y=1713x+1025,R=0.999 0.30 84.1 2.8 1.0 82.2 1.5 酸性黄17 0.15 80.5 3.9 0.01 0.03 y=6832x+65221,R=0.992 0.30 83.5 3.1 1.0 93.2 3.3 亮黄 0.15 71.2 4.9 0.05 0.15 y=477x−129,R=0.999 0.30 77.3 4.2 1.0 79.5 3.1 柠檬黄 0.15 95.2 3.6 0.05 0.15 y=2003x−2374,R=0.998 0.30 90.6 3.1 1.0 87.3 2.1 日落黄 0.15 89.1 3.5 0.01 0.03 y=4346x+9856,R=0.997 0.30 93.5 3.0 1.0 93.2 1.5 -
[1] AFFAT S S. Classifications, advantages, disadvantages, toxicity effects of natural and synthetic dyes:A review[J]. University of Thi-Qar Journal of Science,2021,8(1):130−135.
[2] SHARMA J, SHARMA S, SONI V. Classification and impact of synthetic textile dyes on aquatic flora:A review[J]. Regional Studies in Marine Science,2021,45:101802. doi: 10.1016/j.rsma.2021.101802
[3] MOTA I G C, NEVES R A M D, NASCIMENTO S S D C, et al. Artificial dyes:Health risks and the need for revision of international regulations[J]. Food Reviews International,2023,39(3): 1578−1593. doi: 10.1080/87559129.2021.1934694
[4] 国家卫生和计划生育委员会 . GB 2760-2014 食品安全国家标准 食品添加剂使用标准[S]. 北京:中国标准出版社, 2014 National Health and Family Planning Commission. GB 2760-2014 National standard for food safety Standard for the use of food additives[S]. Beijing:Standards Press of China, 2014.
[5] DONG M Y, WU H L, LONG W J, et al. Simultaneous and rapid screening and determination of twelve azo dyes illegally added into food products by using chemometrics-assisted HPLC-DAD strategy[J]. Microchemical Journal,2021,171:106775. doi: 10.1016/j.microc.2021.106775
[6] 山东省市场监督管理局. 19批次食品不合格[EB/OL]. (2020-04-26)[2022-12-14] https://ipraction.samr.gov.cn/gzdt/zlpg/art/2022/art_b710cfaf4c06426da794c6f530cc6d37.html Shandong Administration for Market Regulation. 19 batches of food are unqualified[EB/OL]. (2020-04-26)[2022-12-14] https://ipraction.samr.gov.cn/gzdt/zlpg/art/2022/art_b710cfaf4c06426da794c6f530cc6d37.html.
[7] 国家卫生和计划生育委员会. GB 5009.35-2016 食品安全国家标准 食品中合成着色剂的测定[S]. 北京:中国标准出版社, 2016 National Health and Family Planning Commission. GB 5009.35-2016 National standard for food safety Determination of synthetic colorants in food [S]. Beijing:Standards Press of China, 2016.
[8] 国家质量监督检验检疫总局 . GB/T 9695.6-2008 肉制品 胭脂红着色剂测定[S]. 北京:中国标准出版社, 2008 General Administration of Quality Supervision, Inspection and Quarantine of China. GB/T 9695.6-2008 Determination of carmine coloring agent in meat products[S]. Beijing:Standards Press of China, 2008.
[9] 国家质量监督检验检疫总局 . SN/T 1743-2006 食品中诱惑红、酸性红、亮蓝、日落黄的含量检测 高效液相色谱法[S]. 北京:中国标准出版社, 2006 General Administration of Quality Supervision, Inspection and Quarantine of China. SN/T 1743-2006 Detection of the content of temptation red, acid red, bright blue and sunset yellow in food High performance liquid chromatography[S]. Beijing:Standards Press of China, 2006.
[10] 国家质量监督检验检疫总局. SN/T 3536-2013 出口食品中酸性橙Ⅱ号的检测方法[S]. 北京:中国标准出版社, 2013 General Administration of Quality Supervision, Inspection and Quarantine of China. SN/T 3536-2013 Detection method of acid orange Ⅱ in export food[S]. Beijing:Standards Press of China, 2006.
[11] 张燕飞, 周娟, 仁增, 等. TLC结合HPLC-DAD法检查红花及西红花中13个红色色素[J]. 药物分析杂志,2020,40(9):1624−1631 doi: 10.16155/j.0254-1793.2020.09.13 ZHANG Y F, ZHOU J, REN Z, et al. Test of thirteen red pigments in Carthami Flos and Stigma Croci by TLC and HPLC-DAD[J]. Chinese Journal of Pharmaceutical Analysis,2020,40(9):1624−1631. doi: 10.16155/j.0254-1793.2020.09.13
[12] KARANIKOLOPOULOS G, GERAKIS A, PAPADOPOULOU K, et al. Determination of synthetic food colorants in fish products by an HPLC-DAD method[J]. Food Chemistry,2015,177:197−203. doi: 10.1016/j.foodchem.2015.01.026
[13] 梁剑锋, 李亚, 柯立坚, 等. 液液萃取-高效液相色谱法测定奶茶中六种合成色素含量[J]. 中国食品添加剂,2022,33(9):190−195 LIANG J F, LI Y, KE L J, et al. Determination of six synthetic pigments in milk tea by liquid-liquid extraction and high performance liquid chromatography[J]. China Food Additives,2022,33(9):190−195.
[14] 刘梅. 高通量合成色素测定方法的建立及其在熟肉制品检测中的应用[D]. 泰安:山东农业大学, 2018 LIU M. Establishment of high throughput detection method of synthetic pigments and application in cooked meat products[D]. Taian:Shandong Agricultural University, 2018.
[15] HAMEED E A A, ABD-ELHAMID G H, EL-DARDER O M, et al. Fast sensitive and accurate analysis of the most common synthetic food colorants in 65 egyptian commercial products using new HPLC–DAD and UPLC-ESI–MS/MS methods[J]. Food Analytical Methods,2022,15(12):3444−3457. doi: 10.1007/s12161-022-02370-8
[16] MARTIN F, OBERSON J M, MESCHIARI M, et al. Determination of 18 water-soluble artificial dyes by LC-MS in selected matrices[J]. Food Chemistry,2016,197:1249−1255. doi: 10.1016/j.foodchem.2015.11.067
[17] HU Z, QI P, WANG N, et al. Simultaneous determination of multiclass illegal dyes with different acidic-basic properties in foodstuffs by LC-MS/MS via polarity switching mode[J]. Food Chemistry,2020,309:125745. doi: 10.1016/j.foodchem.2019.125745
[18] TAMIM A A, ALRABEH M, TAMIMI A A, et al. Fast and simple method for the detection and quantification of 15 synthetic dyes in sauce, cotton candy, and pickle by liquid chromatography/tandem mass spectrometry[J]. Arabian Journal of Chemistry,2020,13(2):3882−3888. doi: 10.1016/j.arabjc.2019.09.008
[19] 蒋荣华, 吴玉杰, 温和心, 等. 肉制品中6种人工合成色素的快速测定[J]. 食品工业科技,2017,38(24):278−281, 302 doi: 10.13386/j.issn1002-0306.2017.24.054 JIANG R H, WU Y J, WEN H X, et al. Rapid detection methods for six kinds of synthetic pigments in meat products[J]. Science and Technology of Food Industry. 2017,38(24):278−281, 302. doi: 10.13386/j.issn1002-0306.2017.24.054
[20] 王韦达, 肖泽恩, 李芸, 等. 固相萃取超高效液相色谱法测定食品中非法添加色素红2G[J]. 食品研究与开发,2017,38(5):173−176 doi: 10.3969/j.issn.1005-6521.2017.05.036 WANG W D, XIAO Z E, LI Y, et al. Determination of red 2G in food by solid phase extraction-ultra high performance liquid chromatography[J]. Food Research and Development,2017,38(5):173−176. doi: 10.3969/j.issn.1005-6521.2017.05.036
[21] 李道霞, 黄丽娟, 唐昌云, 等. 阴离子固相萃取-HPLC法测定肉制品中13种合成色素[J]. 食品研究与开发,2021,42(17):157−164 doi: 10.12161/j.issn.1005-6521.2021.17.025 LI D X, HUANG L J, TANG C Y, et al. Determination of 13 synthetic colorants in meat products based on anionic solid phase extraction high performance liquid chromatography[J]. Food Research and Development,2021,42(17):157−164. doi: 10.12161/j.issn.1005-6521.2021.17.025
[22] 刘诗瑶. 色素高分辨质谱检测法的建立与易染色食品的风险监测[D]. 成都:成都大学, 2020 LIU S Y. Establishment of high resolution mass spectrometry for the detection of pigment and risk monitoring of easily dyed food[D]. Chengdu:Chengdu University, 2020.
[23] NGUYEN N V T, NGUYEN K N H, DAM K T T, et al. Simultaneous determination of 11 water-soluble dyes in food products and beverages by high performance liquid chromatography[J]. International Food Research Journal,2021,28(1):120−128. doi: 10.47836/ifrj.28.1.12
[24] QI P, ZHOU Q Q, LIN Z H, et al. Qualitative screening and quantitative determination of multiclass water-soluble synthetic dyes in foodstuffs by liquid chromatography coupled to quadrupole orbitrap mass spectrometry[J]. Food Chemistry,2021,360:129948. doi: 10.1016/j.foodchem.2021.129948
[25] GHOLAMI Z, MARHAMATIZADEH M H, YOUSEFINEJAD S, et al. Vortex-assisted dispersive liquid-liquid microextraction based on hydrophobic deep eutectic solvent for the simultaneous identification of eight synthetic dyes in jellies and drinks using HPLC-PDA[J]. Microchemical Journal,2021,170:106671. doi: 10.1016/j.microc.2021.106671
[26] CHEN D, WU M, XIE S, et al. Determination of tartrazine, lutein, capsanthin, canthaxanthin and β-carotene in animal-derived foods and feeds by HPLC method[J]. Journal of Chromatographic Science,2019,57(5):462−468. doi: 10.1093/chromsci/bmz019
[27] HAMMER J, HAFTKA J J H, SCHERPENISSE P, et al. Investigating hydrophilic and electrostatic properties of surfactants using retention on two mixed-mode liquid chromatographic columns[J]. Journal of Chromatography A,2018,1571:185−192. doi: 10.1016/j.chroma.2018.08.024
[28] 张毅, 夏义平, 林肖惠, 等. 固相萃取-高效液相色谱法测定果冻中8种人工合成色素[J]. 现代预防医学,2018,45(19):3581−3585 ZHANG Y, XIA Y P, LIN X H, et al. Determination of 8 synthetic colorants in jelly by solid phase extraction and high performance liquid chromatography[J]. Modern Preventive Medicine,2018,45(19):3581−3585.
[29] WANG X F, WANG Q, LI Z G, et al. Determination of 23 perfluorinated alkylated substances in water and suspended particles by ultra-performance liquid chromatography/tandem mass spectrometry[J]. Journal of Environmental Science and Health, Part A,2018,53(14):1277−1283. doi: 10.1080/10934529.2018.1528042
[30] CHUNG S W C. Quantification of permitted synthetic colours in food by liquid chromatographic methods:A review on analytical methods and theirperformance[J]. Food Additives & Contaminants:Part A,2021,38(10):1636−1655.
[31] 朱旭冉, 刘媛, 韩正政, 等. 分子印迹掺杂金属有机框架固相萃取-高效液相色谱-串联质谱法测定大米中10种磺酰脲类除草剂[J]. 食品工业科技,2020,41(2):213−219, 226 doi: 10.13386/j.issn1002-0306.2020.02.034 ZHU X R, LIU Y, HAN Z Z, et al. Determination of 10 sulfonylurea herbicides by High Performance Liquid Chromatography-Tandem Mass Spectrometric with molecularly imprinted polymers solid phase extraction doped metal organic frameworks[J]. Science and Technology of Food Industry,2020,41(2):213−219, 226. doi: 10.13386/j.issn1002-0306.2020.02.034
[32] 冉丹, 罗苏苏, 张可欣, 等. HPLC法检测蜜饯中20种合成着色剂含量[J]. 食品工业科技,2022,43(16):281−289 doi: 10.13386/j.issn1002-0306.2021100307 RAN D, LUO S S, ZHANG K X, et al. Determination of 20 kinds of synthetic colorants in candied fruit by HPLC[J]. Science and Technology of Food Industry,2022,43(16):281−289. doi: 10.13386/j.issn1002-0306.2021100307
-
期刊类型引用(1)
1. 周庆琼,胡凌,戚平,刘春生,彭名军,曾豪威,林子豪,陈婷,郑洁玲,毛新武. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法快速检测茶叶及其制品中35种合成色素. 食品安全质量检测学报. 2024(22): 138-146 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



