Effects of Four Kinds of Hydrogel Wall Materials on the Characteristics of Embedded Microcapsules HydrogelBall of Lactobacillus plantarum
-
摘要: 为提高植物乳杆菌的肠胃液耐受以及释放性能,并筛选适宜制备微胶囊晶球的壁材,本研究采用内源乳化法制备植物乳杆菌微胶囊并通过挤压法制备微胶囊晶球,通过测定包埋率、经胃液消化后存活率以及模拟肠液中对菌体的溶出效果等来评估海藻酸钠、黄原胶、结冷胶、果胶四种壁材对植物乳杆菌微胶囊性能的影响。结果表明:以海藻酸钠为壁材制备微胶囊晶球效果最好,晶球粒径为3.30 mm,水分含量为93.99%,结构紧致、微观形态良好;对植物乳杆菌的包埋率达87.14%,28 d后保留率为56.98%,仍保持在较高水平;体外模拟消化结果显示,植物乳杆菌经胃液消化后存活率高达71.49%,经肠道消化后释放量为2.51×109 CFU/g,表现出以海藻酸钠为壁材制备的微胶囊晶球良好的保护能力和缓释能力。Abstract: In this research, Lactobacillus plantarum microcapsules were prepared by endogenous emulsification and microcapsule spheres were prepared by extrusion. The effects of four wall materials, which were sodium alginate, xanthan gum, gellan gum, and pectin, on the performance of Lactobacillus plantarum microcapsules were evaluated by determining the rate of encapsulation, the rate of survival after digestion in gastric fluids, and the effect of the dissolution of the bacteria in simulated gastrointestinal fluids. It was to improve the gastrointestinal fluid tolerance as well as release properties of Lactobacillus plantarum and to screen the wall materials suitable for the preparation of microcapsules hydrogel ball. The results showed that the microcapsule hydrogel ball prepared with sodium alginate as the wall material had the best effect. The particle size of the crystal ball was 3.30 mm. the water content was 93.99%. The structure was compact and the microstructure was good. The embedding rate of Lactobacillus plantarum was 87.14%, and the retention rate was 56.98% after 28 days, which remained at a high level. Simulated digestion in vitro showed that the survival rate of Lactobacillus plantarum after digestion in gastric juice was as high as 71.49%, and the release amount after intestinal digestion was 2.51×109 CFU/g. It demonstrated the good protective and slow-release capability of microcapsule hydrogel balls prepared with sodium alginate as wall material.
-
Keywords:
- sodium alginate /
- xanthan gum /
- gellan gum /
- pectin /
- microencapsulated hydrogel ball
-
益生菌能产生多种活性物质,能在调控肠道微生态平衡及防治某些疾病中发挥重要作用[1−3],然而胃酸和肠道胆汁盐、消化酶等体内环境会致多数益生菌死亡。益生菌想要发挥其益生功效,必须保证益生菌在产品和宿主中都保持活性和代谢稳定[4]。GB 19302-2010《食品安全国家标准 发酵乳》规定乳酸菌数≥106 CFU/g(mL)益生菌才能发挥益生作用。植物乳杆菌(Lactobacillus plantarum)是一种能维持宿主肠道菌群平衡和提高人体免疫力的益生菌[5]。但部分植物乳杆菌稳定性较差,进入消化道后难以耐受胃酸、消化酶、胆汁酸等作用,限制了其益生功效的发挥[6]。
近年来,国内外研究人员使用了不同壁材对植物乳杆菌进行包埋。Ma等[7]采用乳蛋白为壁材制备植物乳杆菌微胶囊,包埋率达82%±5%。张宇琪等[8]采用海藻酸盐、低酯果胶和卵磷脂复合壁材制备植物乳杆菌微胶囊,包埋率最高达89.05%。要经纬等[6]采用海藻酸钠为壁材制备植物乳杆菌微胶囊,包埋率达85.1%。此外,微胶囊化是常用的益生菌包埋法,通过机械搅拌或者物理化学方法,使得壁材包埋芯材,使芯材与外部环境隔绝从而提高益生菌在恶劣环境中的生存能力,并有助于其在宿主肠道的定植,提高稳定性[7,9]。内源乳化法是微胶囊化的常用方法,其原理是将交联剂与芯材、壁材共混形成乳滴,在酸的作用下,内部交联形成微胶囊[10]。内源乳化法制备的微胶囊具有形态及粒径分布较为均一、安全可食用等特点,在食品加工中的应用前景广泛[11]。与一般微胶囊相比,经过二次包埋形成的“益生菌晶球”能有效提高益生菌的稳定性,如贮存稳定性、胃酸耐受性和温度耐受性等[12]。“益生菌晶球”是指包埋了益生菌的非干燥透明球体,晶球的主要成分为一种或多种具有离子凝胶性质的食品胶体[1]。Bosnea等[13]制备的微胶囊晶球在pH=2.0条件下处理3 h后,益生菌仅失活1.24 lg CFU/g,较微胶囊有大幅提高;刘仁杰等[14]制备的微胶囊晶球在体外消化实验中菌体存活率达85.73%。目前,未见有关于不同壁材的性能比较及其对微胶囊晶球制备的影响。同时,国内外学者对益生菌微胶囊晶球的研究较少。
因此,本实验以内源乳化法制备微胶囊晶球,通过对微胶囊形态、植物乳杆菌的包埋率与存活率释放量等的研究,比较分析和探讨海藻酸钠、黄原胶、结冷胶及果胶作为壁材包埋植物乳杆菌的效果及优缺点,为微胶囊晶球壁材的选择提供理论依据。
1. 材料与方法
1.1 材料与仪器
大豆油 金龙鱼官方旗舰店;刺梨水提物(含50%刺梨多糖) 食品级,陕西艾特生物科技有限公司;植物乳杆菌CICC-20265 中国工业微生物菌种保藏管理中心;MRS肉汤、MRS培养基 杭州微生物制剂有限公司;海藻酸钠、吐温80、冰乙酸、氯化钙 成都市科隆试剂有限责任公司;黄原胶 上海瑞永生物科技有限公司;果胶 上海阿拉丁生化科技股份有限公司;结冷胶、司盘80、猪胆盐(生物试剂) 上海麦克林生化科技股份有限公司;以上试剂均为分析纯;胃蛋白酶(3000 U/g) 上海如吉生物科技有限公司;胰蛋白酶(250 U/g) 上海源叶生物有限公司。
HMS-203D加热型磁力搅拌器 上海沪析仪器设备有限公司;MP511 pH计 上海三信仪表厂;5804R冷冻离心机 德国Eppendorf公司;MLS-3020高压灭菌锅 日本Sanyo公司;SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司;DHP-9052电热恒温培养箱 上海齐欣科学仪器有限公司;XDS-1B倒置生物显微镜 重庆光电仪器有限公司;Apreo 2C场发射电镜 德国Thermo公司;ZWY-240全温振荡培养箱 上海智城分析仪器制造有限公司;Spectrum RX/BX傅里叶变换红外光谱仪 PeakinElmer公司。
1.2 实验方法
1.2.1 菌悬液的制备
植物乳杆菌在液体MRS培养基中于37 ℃培养24 h,连续活化传代2~3次。将活化好的菌液于4 ℃,转速4000 r/min离心10 min,并用生理盐水洗涤2次,将洗涤后的菌体悬于生理盐水中,根据国标《GB 4789.35-2016 食品安全国家标准 食品微生物学检验 乳酸菌检验》对菌悬液进行计数,使菌液浓度为109 CFU/mL。
1.2.2 植物乳酸菌微胶囊晶球的制备
参考周艳林[11]和张明[15]的方法并略作修改。分别称取0.6 g刺梨水提物、3 g海藻酸钠/结冷胶/黄原胶/果胶和CaCO3粉末溶解于100 mL水中,搅拌均匀,配制含刺梨水提物、海藻酸钠/结冷胶/黄原胶/果胶和CaCO3的混合液;将植物乳杆菌悬液与配制的混合溶液按照体积比1:1混合均匀后,加入到3倍体积大豆油中(含体积分数1%的司盘80);机械搅拌形成油包水液滴后,加入200 µL冰醋酸(纯度≥99.5)继续搅拌;用水(含体积分数1%的吐温80)洗涤微胶囊乳液,收集微胶囊乳液;再将收集到的微胶囊乳液与0.6%海藻酸钠溶液按1:1混合,经磁力搅拌混合均匀后形成微胶囊乳液海藻酸钠溶胶;然后将微胶囊乳液海藻酸钠溶胶使用注射器从距液面5 cm处滴入5%氯化钙溶液中,制备微胶囊晶球;交联0.5 h后,即可获得刺梨多糖-水凝胶微胶囊晶球,再使用去离子水洗涤微胶囊晶球3次,最终获得刺梨多糖-水凝胶植物乳杆菌微胶囊晶球,备用。
1.2.3 包埋率的测定
将1 g微胶囊晶球加入到9 mL柠檬酸三钠溶液中,在摇床中于37 ℃、230 r/min摇晃30 min,取样,参照1.2.1进行活菌计数。植物乳杆菌包埋率(encapsulation yield,EY)可表示为:
EY(%)=m2m0×100 式中:EY,包埋率,%;m0,起始添加的活菌数,CFU/mL;m2,微胶囊晶球中包埋的活菌数,CFU/g。
1.2.4 水分含量的测定
参考曹珺等[1]的方法。称取约3 g微胶囊晶球,在105 ℃恒温烘箱中烘干,直到前后两次测定质量不变。水分含量可表示为:
水分含量(%)=M1−M2M1×100 式中:M1为烘干前质量,g;M2为烘干后质量,g。
1.2.5 微胶囊晶球的形态观察及粒径测定
参考周艳林等[16]的方法。取一个微胶囊晶球,置于载玻片上,用光学显微镜进行形态观察。用测微尺测定微胶囊的粒径,计数30个以上,取平均值。通过扫描电子显微镜观察经−80 ℃冷冻干燥12 h后的微胶囊晶球的微观结构。
1.2.6 傅里叶红外光谱扫描
参考Wu等[17]的方法。称取经−80 ℃冷冻干燥12 h的微胶囊晶球粉末,置于ATR附件上扫描,采集范围4000~600 cm−1,扫描次数16次,分辨率为4 cm−1。
1.2.7 微胶囊晶球储藏稳定性
用西林瓶密封保存微胶囊晶球,并于4 ℃冰箱中冷藏放置28 d,在0、7、14、21、28 d取微胶囊晶球按照1.2.1的方法测定活菌数,以菌悬液活菌数为对照。
1.2.8 模拟胃液消化的存活率
参考Hu等[18]的方法并略作修改。用0.2%(w/v)NaCl配制模拟胃液,用HCl调节pH至2.0,121 ℃灭菌15 min。在胃蛋白酶参与消化的情况下,在胃液中添加0.3%(w/v)胃蛋白酶。为了进行模拟消化,将0.5 g样品置于含有5 mL胃液的试管中,然后在37 ℃下以120 r/min连续搅拌2 h,将未经胃液消化的微胶囊晶球与经胃液消化2 h后微胶囊晶球分别加入到4.5 mL柠檬酸三钠溶液中,在摇床中于37 ℃、230 r/min摇晃30 min,取样,测定包被活菌数。存活率可表示为:
存活率(%)=E1−E2E1×100 式中:E1为未经胃液消化的微胶囊晶球包埋的活菌数,CFU/g;E2为经胃液消化2 h后的微胶囊晶球包埋的活菌数,CFU/g。
1.2.9 模拟肠液消化释放
参考Hu等[18]的方法并略作修改。将0.5 g样品置于5 ml无菌模拟肠液(0.05 mol/L KH2PO4、0.6%(w/v)胆盐和1.0%(w/v)的胰蛋白酶),调节pH为7.43,再在37 ℃下孵育3 h,模拟肠道消化。参照1.2.1的方法测定经肠道消化后释放的游离活菌数。每个实验重复三次。
1.3 数据处理
采用Excel 2019和Origin 2021软件进行数据统计分析和绘图,用SPSS Statistics v 20对数据进行处理,数据用平均数和标准差表示,进行One Way方差分析(ANOVA),采用Duncan法进行平均数的多重比较,显著水平设定为P<0.05。
2. 结果与分析
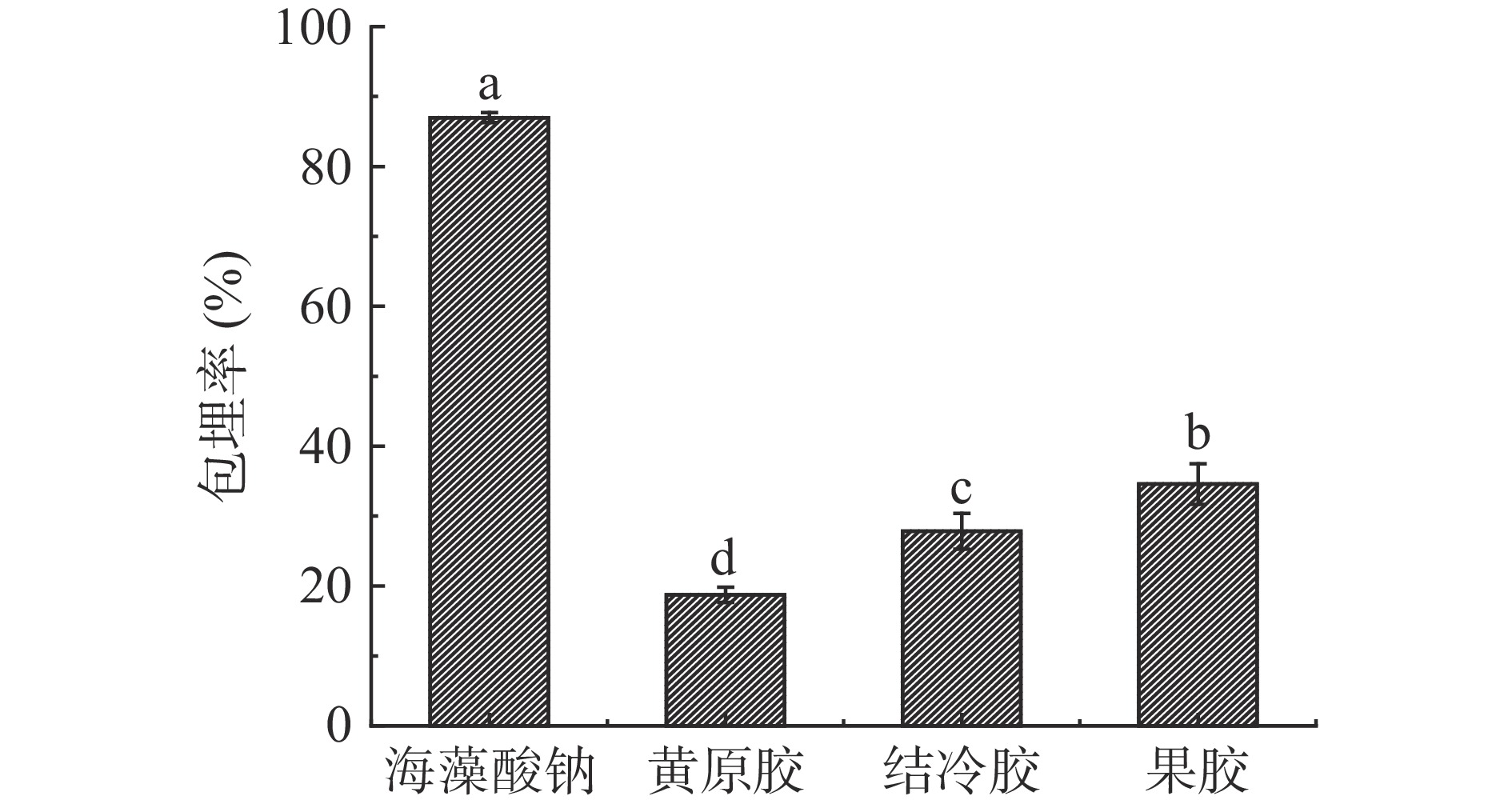
2.1 不同壁材微胶囊晶球的包埋率
不同壁材微胶囊晶球的包埋率如图1所示,四种不同壁材制作的微胶囊的包埋率从大到小依次为海藻酸钠、果胶、结冷胶、黄原胶,其中海藻酸钠的包埋率最高,达到86.99%±0.69%,黄原胶的包埋率较低仅为18.75%±1.08%。这可能是由于黄原胶微胶囊的表面膜层较厚且较致密,植物乳杆菌不易被包埋,故包埋率较低,王远一飞等[19]在制备壳聚糖黄原胶鼠李糖乳杆菌微胶囊时也发现此现象。此外,黄原胶、结冷胶、果胶与其他生物材料之间存在分子间相互作用及粘度协同作用,相较于单一壁材,用于二元或三元胶复合体系中能提高芯材的包埋率[20]。
2.2 不同壁材微胶囊晶球的理化性质
2.2.1 不同壁材微胶囊晶球的显微形态
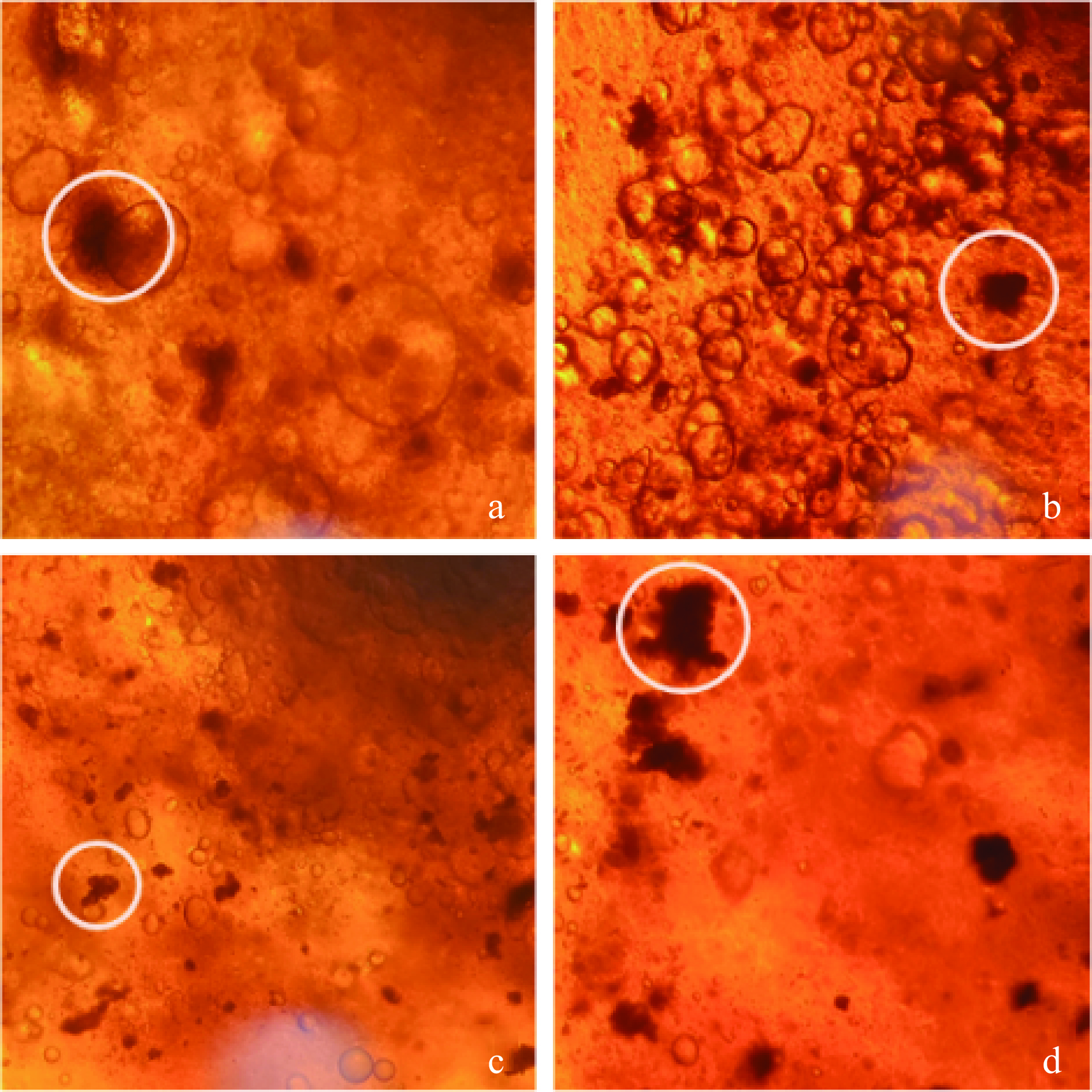
如图2所示,利用海藻酸钠、黄原胶、结冷胶、果胶四种不同的胶体为壁材形成的植物乳杆菌晶球均成型,其中除果胶制备的晶球的粘黏强度高,其余3种胶体制备的植物乳杆菌晶球表面光滑。Hu等[18]表示果胶的加入会影响晶球的形成,添加量过高会形成絮凝物,从而影响微胶囊成型。将制备的微胶囊晶球经光学显微镜扫描,如图3所示,内源乳化法制备的微胶囊为油包水结构,图中黑褐色部位为包埋物质。由图3可知,黄原胶制备的微胶囊具有更多的油包水液泡,这可能是由于黄原胶中羟基的存在使得微胶囊具有更高的亲水性,Rukmanikrishnan等[21]在制备κ-卡拉胶/黄原胶/结冷胶水凝胶膜时发现在膜中添加较高比例的黄原胶可显著提高膜的含水率也印证了此观点。
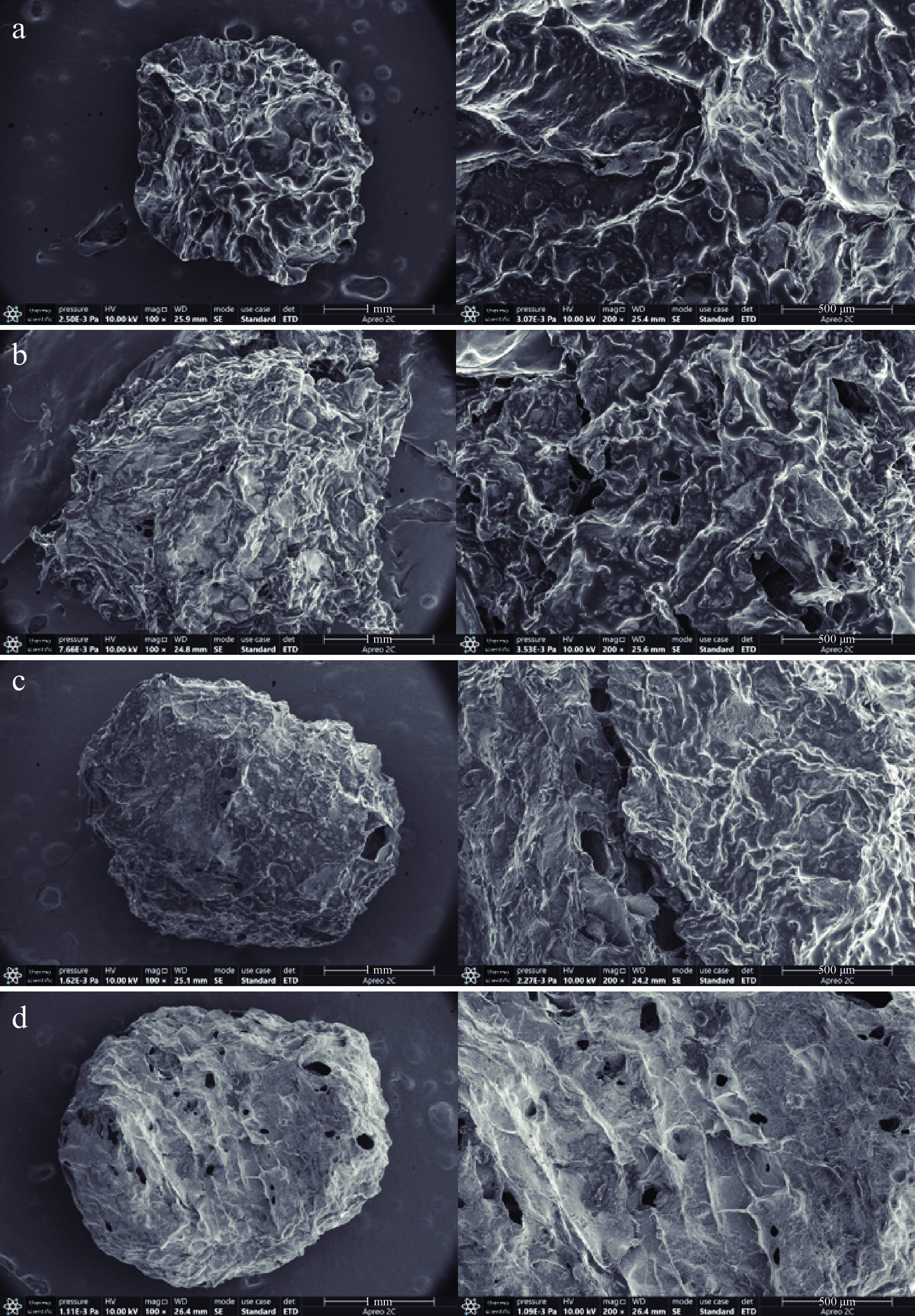
通过扫描电子显微镜观察微胶囊晶球,如图4所示。可知微胶囊晶球经冷冻干燥后,呈蜂窝状,表面褶皱,凹陷,仍维持球形外观,这是冷冻干燥常有的现象,其中海藻酸钠制备的微胶囊晶球经冻干后未出现孔隙,而黄原胶、结冷胶、果胶制成的微胶囊晶球出现孔隙,这可能是由于在冰醋酸的作用下,Ca2+释放与海藻酸钠形成致密的凝胶网络结构,提高了微胶囊晶球的稳定性。Sharifi等[22]利用乳清蛋白粉和阿拉伯结冷胶制备的植物乳杆菌微胶囊经冻干后也出现此现象。
2.2.2 不同壁材微胶囊晶球的水分含量和粒径
由表1可知,黄原胶和结冷胶制备的晶球粒径显著大于海藻酸钠和果胶制备的晶球(P<0.05),这可能是由于海藻酸钠和果胶较于黄原胶和结冷胶有更好的水溶性,也可能是海藻酸钠在交联过程中海藻酸链间的拥挤效应和静电斥力减小,导致Ca2+局部浓度的增加和海藻酸聚合物链间的局部聚集,从而使海藻酸水凝胶网络收缩[17,23]。结冷胶制备的微胶囊粒径最小,为(69.65±33.96)μm,黄原胶制备的微胶囊粒径最大,为(85.67±29.09)μm,这可能是由于结冷胶的粘度较高[24]。Yu等[25]在制备结冷胶包埋的疏水虾青素-亲水藻青素双重乳液时发现随着结冷胶浓度的增加,双乳状液凝胶球尺寸逐渐减小也印证了此观点。微胶囊的粒径影响微胶囊的特性[26],研究表明,粒径较小的微胶囊具有高比表面积和表面能,易自发团聚,影响微胶囊的粘附性和流动性[27]。
表 1 不同壁材微胶囊晶球的物理特性Table 1. Physical characteristics of microcapsule hydrogel ball with different wall materials水凝胶种类 海藻酸钠 黄原胶 结冷胶 果胶 晶球粒径(mm) 3.30±0.45b 3.59±0.65a 3.76±0.38a 3.28±0.41b 微胶囊粒径(μm) 83.55±30.39ab 85.67±29.09a 69.65±33.96b 73±18.41ab 水分含量(%) 93.99±0.15b 93.85±0.20b 95.45±0.08a 90.24±0.25c 注:表中同行不同小写字母表示差异显著(P<0.05)。 水分含量也是一个必须评估的重要参数,因为它可能会影响包封益生菌的活性,微生物在高水分含量值时仍然具有代谢活性,而在低水分含量值时则处于潜伏状态[27]。在本实验中四种壁材制作的晶球含水率较高,均达到90%以上,是由于用挤压法二次包埋了益生菌微胶囊,从而增加了制备的晶球的含水量,其中结冷胶制得的微胶囊晶球的水分含量最高,可能是由于结冷胶网络的形成使得水分子被限制在凝胶网络中[25]。此外,较高的含水量能赋予微胶囊晶球更佳的口感,从而增加可食用性[18]。
2.3 不同壁材微胶囊晶球的红外光谱表征
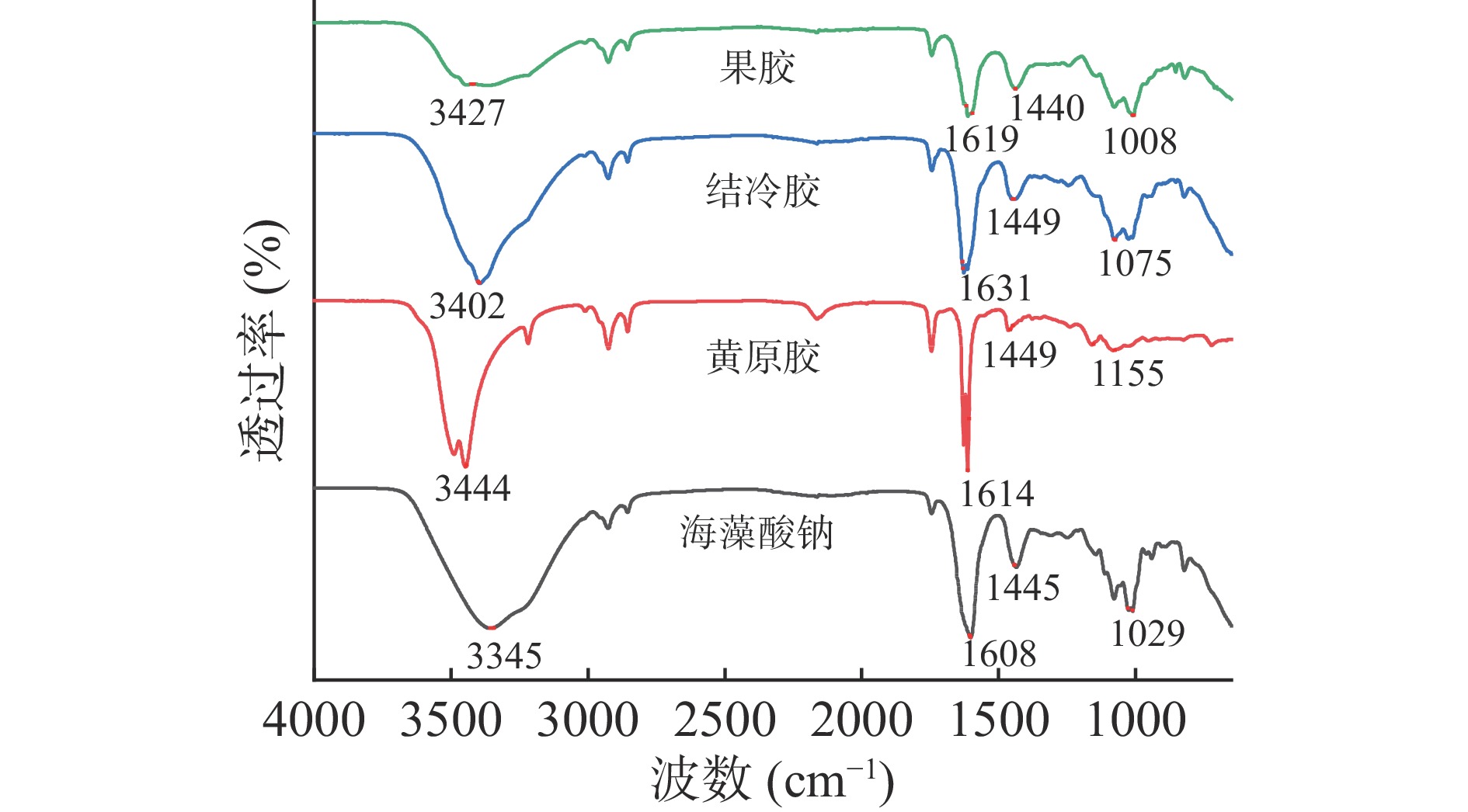
傅里叶变换红外图谱能够显示物质分子结构和具有特征性的化学键[28],从而对微胶囊晶球结构进行分析。图5分别为海藻酸钠、黄原胶、结冷胶以及果胶制作的微胶囊晶球的红外图谱,四条曲线在3400、1600、1450、1050 cm−1附近均具有特征吸收峰,其中3400 cm−1处宽而强的吸收峰是由−OH的伸缩振动形成的,其他三处依次为C=O、C−H的弯曲振动、C−O−C的伸缩振动[29],不同壁材包埋的微胶囊晶球均结合了壁材和芯材的特征峰,说明植物乳杆菌被有效的包埋起来。海藻酸钠包埋的微胶囊晶球相较于其他三种微胶囊晶球在3345 cm−1处具有更宽的峰型,说明可能形成了更强的氢键[26]。氢键的形成支持了壁材的相互作用,增加了微胶囊晶球的密封性。
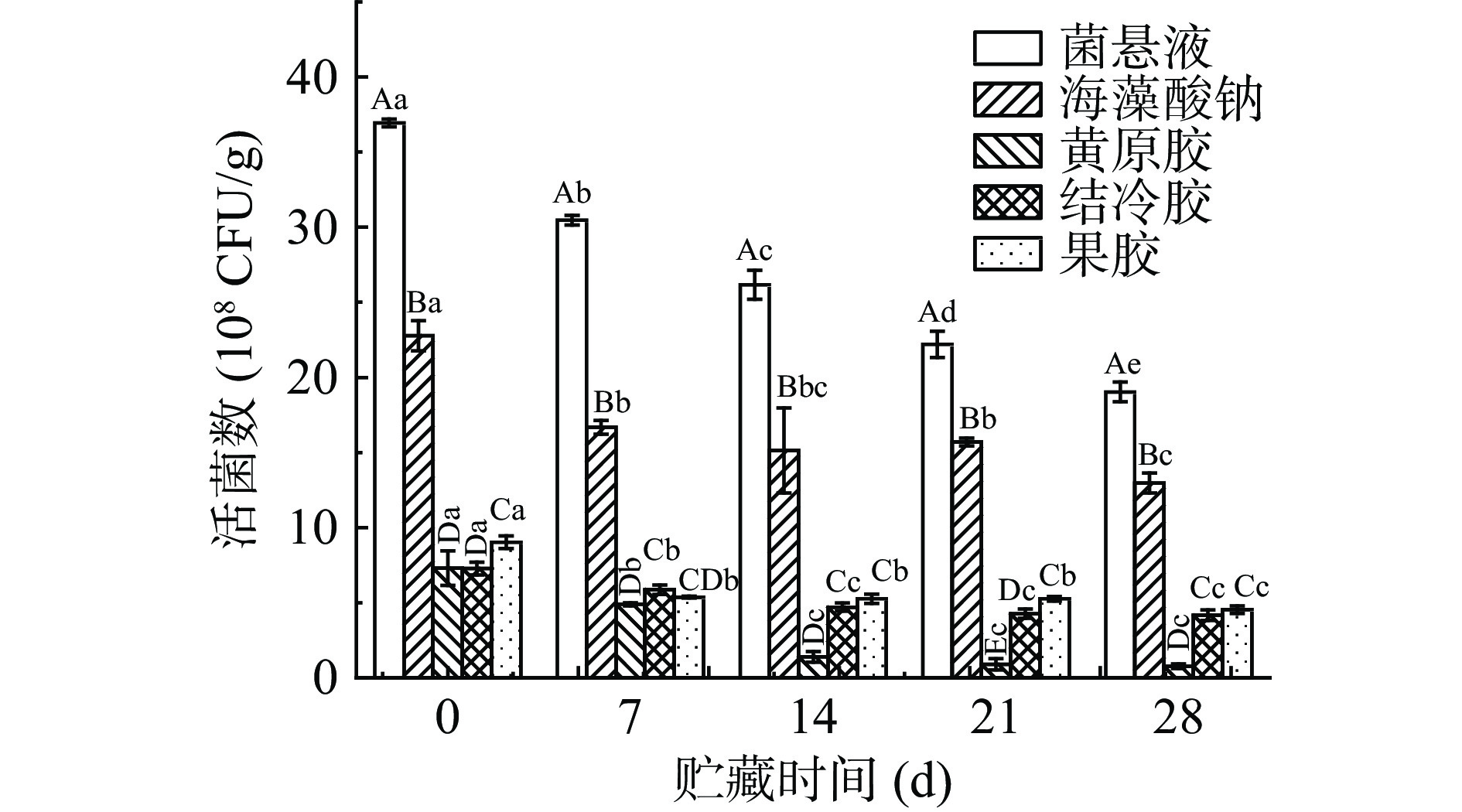
2.4 不同壁材微胶囊晶球的贮藏稳定性
如图6所示,随着贮藏时间的延长,各组植物乳杆菌均有所减少(P<0.05),这可能是由于环境胁迫所致[30]。其中,微胶囊化后的活菌数在7 d下降趋势有所放缓,经海藻酸钠包埋后的效果最佳,28 d时仍保留了66.95%。益生菌在作为配方产品时,应具有贮存期的耐受性[11]。用水凝胶作为壁材包埋益生菌可以延长益生菌的储藏时间。羧甲基魔芋葡甘聚糖-壳聚糖[31]、果胶-壳聚糖[32]等水凝胶做为壁材包埋益生菌的研究均印证了微胶囊化可增加益生菌的储藏稳定性。黄原胶包埋的微胶囊在14 d左右下降到较低指数级,这可能是由于黄原胶单一壁材的稳定性不高,在贮藏中易从固态变为乳液态[21]。
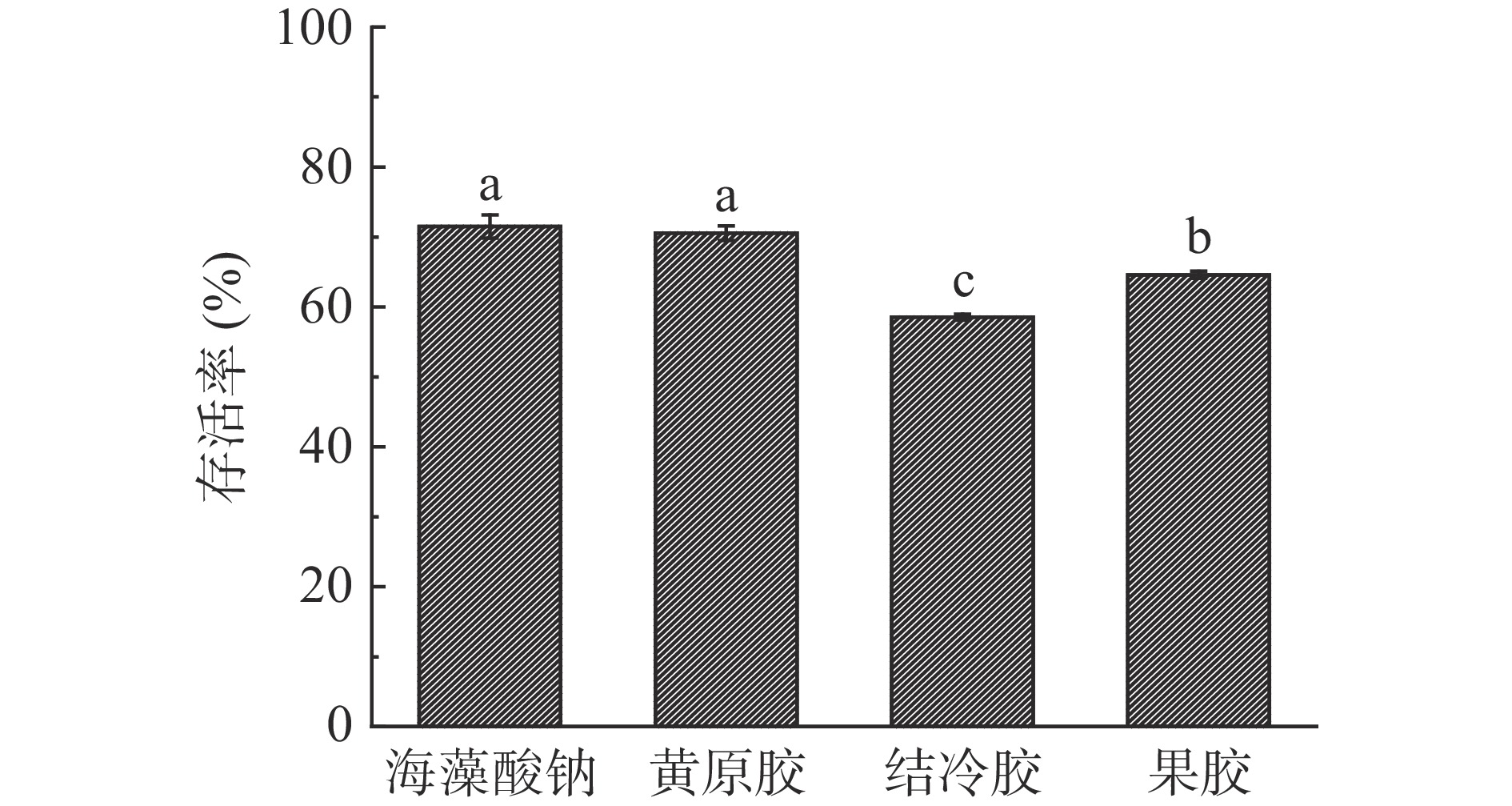
2.5 不同壁材微胶囊晶球在模拟胃液中的存活率
益生菌在模拟胃液中的存活率是确保菌体通过胃部定植肠道中发挥益生功能的重要指标。由图7可知,海藻酸钠和黄原胶制备的微胶囊晶球相较于果胶和结冷胶有更强的耐胃酸能力(P<0.05),两组微胶囊晶球在模拟胃液处理120 min后益生菌存活率仍有71.49%±1.63%和70.54%±1.05%,说明微胶囊可以有效保护益生菌在酸性环境中的存活。这可能是由于微胶囊结构致密,孔径较少,机械强度高,能较好地抵御胃液渗透,从而可以提高益生菌的存活率[16]。在实验中发现,海藻酸钠制备的微胶囊晶球在胃酸中收缩,这可能是由于:在酸性条件下,海藻酸纳羧基质子化,由于静电斥力减弱,导致海藻酸钠收缩[33]。元博[34]在使用海藻酸钠制备嗜酸乳杆菌及双歧杆菌微胶囊的研究中发现胃酸环境下,包埋后的微胶囊菌体存活率更高,达到70%以上,与本研究基本吻合。
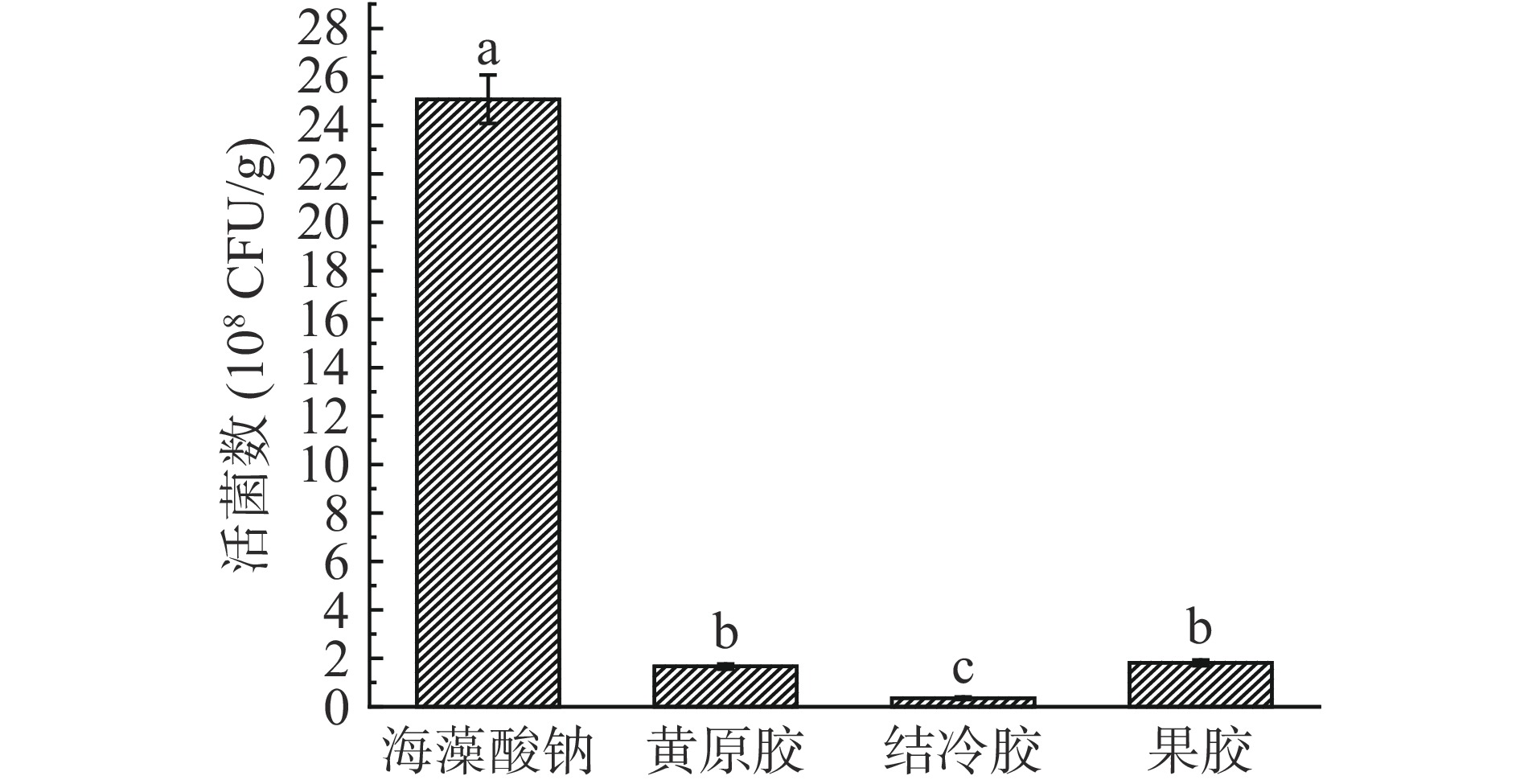
2.6 不同壁材微胶囊晶球在模拟肠液中的释放试验
益生菌微胶囊晶球在肠道中能否释放是判定微胶囊是否具有益生效果的重要条件。不同壁材制备的微胶囊晶球经模拟肠液消化后的释放活菌数见图8。由图可知,经肠道消化180 min后海藻酸钠制备的微胶囊晶球释放量最大,达(2.51±0.1)×109 CFU/g,表明其具有良好的肠溶性,而黄原胶、结冷胶、果胶制备的微胶囊晶球释放量均低于2×108 CFU/g。产生这一结果的主要原因可能是海藻酸钠可依赖Ca2+形成可逆性凝胶,当外界环境中存在与Ca2+结合能力更强的PO43+时,将引起凝胶结构破裂,进而释放出益生菌[35]。此外,植物乳杆菌微胶囊晶球在肠液中的释放量远远大于在胃液中的释放量,Zhao等[36]在研究中也发现微胶囊在肠液中的溶胀性明显要大于在胃液中的溶胀性,在胃液中,微胶囊呈收缩趋势,能有效保护益生菌免受酸性损伤。
3. 结论
本文以植物乳杆菌为芯材,以海藻酸钠、黄原胶、结冷胶以及果胶四种多糖水凝胶为壁材,通过内源乳化法制备微胶囊,并通过挤压法制备微胶囊晶球,探讨不同壁材对微胶囊晶球性能的影响。本研究认为四种壁材对植物乳杆菌的包埋具有较好的效果,形成的微胶囊晶球均为球形,外貌形态较好。海藻酸钠对植物乳杆菌的包埋率为86.99%,经胃液消化后存活率为71.49%,在模拟肠液中菌体的溶出量为2.51×109 CFU/g,表现出优异的效果,制成的微胶囊晶球贮藏稳定性好、结构紧密、性能良好。研究结果为植物乳杆菌微胶囊晶球的壁材选择提供借鉴方法,并有利于植物乳杆菌微胶囊化生产及其在食品工业中应用。
-
表 1 不同壁材微胶囊晶球的物理特性
Table 1 Physical characteristics of microcapsule hydrogel ball with different wall materials
水凝胶种类 海藻酸钠 黄原胶 结冷胶 果胶 晶球粒径(mm) 3.30±0.45b 3.59±0.65a 3.76±0.38a 3.28±0.41b 微胶囊粒径(μm) 83.55±30.39ab 85.67±29.09a 69.65±33.96b 73±18.41ab 水分含量(%) 93.99±0.15b 93.85±0.20b 95.45±0.08a 90.24±0.25c 注:表中同行不同小写字母表示差异显著(P<0.05)。 -
[1] 曹珺, 刘绒梅, 罗力文, 等. 益生菌包埋晶球的体外耐受性及其应用特性研究[J]. 中国乳品工业,2022,50(6):22−27 CAO J, LIU R M, LUO L W, et al. Researching on the tolerance and application characteristics of probiotic-embedded crystal spheres in vitro[J]. China Dairy Industry,2022,50(6):22−27.
[2] AOKI R, KAMIKADO K, SUDA W, et al. A proliferative probiotic Bifidobacterium strain in the gut ameliorates progression of metabolic disorders via microbiota modulation and acetate elevation[J]. Scientific Reports,2017,7(1):221−228. doi: 10.1038/s41598-017-00351-0
[3] D'ARGENIO V, SARNATARO D. Probiotics, prebiotics and their role in Alzheimer’s disease[J]. Neural Regeneration Research,2021,16(9):1768−1769. doi: 10.4103/1673-5374.306072
[4] FENSTER K, FREEBURG B, HOLLARD C, et al. The production and delivery of probiotics:A review of a practical approach[J]. Microorganisms,2019,7(3):83. doi: 10.3390/microorganisms7030083
[5] LA F G, WEBER P, MOHAJERI M H. Probiotics and the gut immune system:indirect regulation[J]. Probiotics and Antimicrobial Proteins,2018,10:11−21. doi: 10.1007/s12602-017-9322-6
[6] 要经纬, 朱含芳, 黄学成, 等. 植物乳杆菌微胶囊的制备工艺优化及特性分析[J]. 食品与发酵工业,2022:1−9 YAO J W, ZHU H F, HUANG X C, et al. Optimization of production process of Lactobacillus plantarum microencapsules and its properties[J]. Food and Fermentation Industries,2022,48(22):54−59
[7] MA L, HUO Q, ZHANG Q, et al. Characteristics of Lactobacillus plantarum LIP-1 microcapsules prepared using an aqueous phase separation method[J]. LWT,2020,129:109561. doi: 10.1016/j.lwt.2020.109561
[8] 张宇琪, 彭湉, 周新丽. 微滴喷射法制备植物乳杆菌微胶囊的试验研究[J]. 上海理工大学学报,2022,44(1):34−41 ZHANG Y Q, PENG T, ZHOU X L. Experimental study on preparation of Lactobacillus plantarum microcapsules by micro-droplet spray[J]. Journal of University of Shanghai for Science and Technology,2022,44(1):34−41.
[9] D’ORAZIO G, GENNARO P D, BOCCARUSSO M, et al. Microencapsulation of new probiotic formulations for gastrointestinal delivery: I n vitro study to assess viability and biological properties[J]. Applied Microbiology and Biotechnology,2015,99:9779−9789. doi: 10.1007/s00253-015-6853-1
[10] 朱莹丹. 植物乳杆菌LIP-1微胶囊制备工艺及其性能的研究[D]. 呼和浩特:内蒙古农业大学, 2015 ZHU Y D. Study on the preparation process of Lactobacillus plantarum LIP-1 microcapsules and its performance[D]. Hohhot:Inner Mongolia Agricultural University, 2015.
[11] 周艳林. KGM-ALG复合益生菌微胶囊的制备及功能评价[D]. 洛阳:河南科技大学, 2020:31−34 ZHOU Y L. Preparation and functional evaluation of KGM-ALG composite probiotic microcapsules[D]. Luoyang:Henan University of Science and Technology, 2020:31−34.
[12] 陈臣, 张晓丛, 袁海彬, 等. 益生菌包埋前沿技术及其研究进展[J]. 中国食品学报,2023:1−11 CHEN C, ZHANG X C, YUAN H B, et al. Research progress on the advanced technology of embedding for probiotics[J]. Journal of Chinese Institute of Food Science and Technology,2023:1−11.
[13] BOSNEA L A, MOSCHAKIS T, NIGAM P S, et al. Growth adaptation of probiotics in biopolymer-based coacervate structures to enhance cell viability[J]. LWT,2017,77:282−289. doi: 10.1016/j.lwt.2016.11.056
[14] 刘仁杰, 李哲, 毛思凝, 等. 复配及多层包埋植物乳杆菌微胶囊的制备及表征[J]. 食品工业科技,2020,41(5):12−16 doi: 10.13386/j.issn1002-0306.2020.05.003 LIU R J, LI Z, MAO S N, et al. Preparation and characterization of Lactobacillus plantarum microcapsules by compounding and multi-layer encapsulation[J]. Food Industry Science and Technology,2020,41(5):12−16. doi: 10.13386/j.issn1002-0306.2020.05.003
[15] 张明. 维生素C多重乳液水凝胶球的制备与评价[D]. 南京:东南大学, 2020:27 ZHANG M. Preparation and evaluation of vitamin C multiple emulsion hydrogel spheres[D]. Nanjing:Southeast University, 2020.
[16] 周艳林, 吴影, 马雨浩, 等. 魔芋葡甘聚糖-海藻酸钠复合益生菌微胶囊的构建及性能评价[J]. 食品与发酵工业,2019,45(20):52−60 doi: 10.13995/j.cnki.11-1802/ts.021548 ZHOU Y L, WU Y, MA Y H, et al. Construction and performance evaluation of konjac dextran-sodium alginate composite probiotic microcapsules[J]. Food and Fermentation Industry,2019,45(20):52−60. doi: 10.13995/j.cnki.11-1802/ts.021548
[17] WU B, LI Y, LI Y, et al. Encapsulation of resveratrol-loaded Pickering emulsions in alginate/pectin hydrogel beads:Improved stability and modification of digestive behavior in the gastrointestinal tract[J]. International Journal of Biological Macromolecules,2022,222:337−347. doi: 10.1016/j.ijbiomac.2022.09.175
[18] HU X, LIU C, ZHANG H, et al. In vitro digestion of sodium alginate/pectin co-encapsulated Lactobacillus bulgaricus and its application in yogurt bilayer beads[J]. International Journal of Biological Macromolecules,2021,193:1050−1058. doi: 10.1016/j.ijbiomac.2021.11.076
[19] 王远一飞, 丁武, 宋莹莹, 等. 壳聚糖黄原胶鼠李糖乳杆菌微胶囊的制备及其特性的研究[J]. 食品工业科技,2017,38(6):229−233 doi: 10.13386/j.issn1002-0306.2017.06.035 WANG Y Y F, DING W, SONG Y Y, et al. Preparation and characterization of chitosan xanthan gum Lactobacillus rhamnosus microcapsules[J]. Science and Technology of Food Industry,2017,38(6):229−233. doi: 10.13386/j.issn1002-0306.2017.06.035
[20] HOSSEIN H, KIABOUSH K. Effective variables on production and structure of xanthan gum and its food applications:A review[J]. Biocatalysis and Agricultural Biotechnology,2017,10:130−140. doi: 10.1016/j.bcab.2017.02.013
[21] RUKMANIKRISHNAN B, SAM S K, JAEWOONG L. Novel synergistic transparent k-carrageenan/xanthan gum/gellan gum hydrogel film:Mechanical, thermal and water barrier properties[J]. Int J Biol Macromol,2018,118(Pt A):561−568.
[22] SHARIFI S, REZAZAD-BARI M, ALIZADEH M, et al. Use of whey protein isolate and gum Arabic for the co-encapsulation of probiotic Lactobacillus plantarum and phytosterols by complex coacervation:Enhanced viability of probiotic in Iranian white cheese[J]. Food Hydrocolloids,2021,113:106496. doi: 10.1016/j.foodhyd.2020.106496
[23] XIAO J, SHI C, LI Y, et al. Pickering emulsions immobilized within hydrogel matrix with enhanced resistance against harsh processing conditions and sequential digestion[J]. Food Hydrocolloids,2017,62:35−42. doi: 10.1016/j.foodhyd.2016.07.025
[24] CHEN K, LEI L, QIAN Y, et al. Development of anti-photo and anti-thermal high internal phase emulsions stabilized by biomass lignin as a nutraceutical delivery system[J]. Food & Function,2019,10(1):355−365.
[25] YU H, WANG H, SU W, et al. Co-delivery of hydrophobic astaxanthin and hydrophilic phycocyanin by a pH-sensitive water-in-oil-in-water double emulsion-filled gellan gum hydrogel[J]. Food Hydrocolloids,2022,131:107810. doi: 10.1016/j.foodhyd.2022.107810
[26] 桑祯玉, 徐青青, 陈莹, 等. 不同壁材对三丁酸甘油酯微胶囊性质的影响[J/OL]. 中国油脂: 1−12 [2023-09-12]. http://kns.cnki.net/kcms/detail/61.1099.TS.20220928.1708.004.html[SANG Z Y, XU Q Q, CHEN Y, et al. Effects of different wall materials on properties of triglyceride microcapsules[J/OL]. China Oils and Fats: 1−12 [2023-09-12]. http://kns.cnki.net/kcms/detail/61.1099.TS.20220928.1708.004.html SANG Z Y, XU Q Q, CHEN Y, et al . Effects of different wall materials on properties of triglyceride microcapsules[J/OL]. China Oils and Fats: 1−12 [2023-09-12]. http://kns.cnki.net/kcms/detail/61.1099.TS.20220928.1708.004.html[27] MARLUCI P S, FABRICIO L T, MARCELA M R, et al. Microcapsules loaded with the probiotic Lactobacillus paracasei BGP-1 produced by co-extrusion technology using alginate/shellac as wall material:Characterization and evaluation of drying processes[J]. Food Research International,2016,89:582−590. doi: 10.1016/j.foodres.2016.09.008
[28] EMMANUEL D, ERIC K, LEE L F, et al. Effect of sodium carboxymethyl cellulose on complex coacervates formation with gelatin:Coacervates characterization, stabilization and formation mechanism[J]. Food Hydrocolloids,2017,69:111−120. doi: 10.1016/j.foodhyd.2017.01.035
[29] 毕成名, 徐丽梅, 祁百巍, 等. 牦牛酥油微胶囊的制备及其特性研究[J]. 食品工业科技,2022,43(23):226−235 doi: 10.13386/j.issn1002-0306.2022030273 BI C M, XU L M, QI B W, et al. Preparation and characterization of yak ghee microcapsules[J]. Food Industry Science and Technology,2022,43(23):226−235. doi: 10.13386/j.issn1002-0306.2022030273
[30] LEI B, CATHY F, DANIEL A, et al. Study of the cryotolerance of Lactobacillus acidophilus:Effect of culture and freezing conditions on the viability and cellular protein levels[J]. International Journal of Food Microbiology,2000,59(3):241−247. doi: 10.1016/S0168-1605(00)00361-5
[31] DING X, XU Y, WANG Y, et al. Carboxymethyl konjac glucomannan-chitosan complex nanogels stabilized double emulsions incorporated into alginate hydrogel beads for the encapsulation, protection and delivery of probiotics[J]. Carbohydrate Polymers,2022,289:119438. doi: 10.1016/j.carbpol.2022.119438
[32] 崔乃元, 高青山, 严昌国, 等. 果胶/壳聚糖合生元微胶囊制备及其体外人工胃肠道耐受性和储藏性能研究[J]. 中国畜牧兽医,2020,47(9):2799−2807 doi: 10.16431/j.cnki.1671-7236.2020.09.012 CUI N Y, GAO Q S, YAN C G, et al. Preparation of pectin/chitosan synbiote microcapsules and study on their tolerance and storage properties in vitro[J]. China Animal Husbandry and Veterinary Science,2020,47(9):2799−2807. doi: 10.16431/j.cnki.1671-7236.2020.09.012
[33] MIRGHABI A, IDKAIDEK N M, SALEM M S, et al. Formulation and release behavior of diclofenac sodium in compritol 888 matrix beads encapsulated in alginate[J]. Drug Development and Industrial Pharmacy,2000,26(7):791−795. doi: 10.1081/DDC-100101301
[34] 元博. 高存活率益生菌微胶囊的制备及特性研究[D]. 烟台:烟台大学, 2019:61 YUAN B. Preparation and characterization of probiotic microcapsules with high viability[D]. Yantai:Yantai University, 2019:61.
[35] VAZIRI A S, ALEMZADEH I, VOSSOUGHI M, et al. Co-microencapsulation of Lactobacillus plantarum and DHA fatty acid in alginate-pectin-gelatin biocomposites[J]. Carbohydrate Polymers,2018,199:266−275. doi: 10.1016/j.carbpol.2018.07.002
[36] ZHAO M, QIU F N, CHEN S, et al. Microencapsulation of Lactobacillus acidophilus CGMCC1.2686:Correlation between bacteria survivability and physical properties of microcapsules[J]. Food Biophysics,2015,10(3):292−299. doi: 10.1007/s11483-014-9389-5
-
期刊类型引用(2)
1. 郑敦锦,祝顺,敬思群,谭艳仪,张俊艳,郑庆东,丁志昆. 超高压物理改性处理提高甜菜红的热稳定性及应用. 中国食物与营养. 2024(06): 43-50 .  百度学术
百度学术
2. 李黄炜,梁茵瑜,范佳欣,陈旭,张书艳,朱杰. 酶解联合动态高压微射流制备淀粉/百里酚纳米乳液及其结构与性质分析. 食品工业科技. 2024(23): 121-128 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:

 下载:
下载:



