Effects of Enzyme-Microorganisms Synergy Treatment on Nutrient Functional Components and Biological Activities of Nannochloropsis oceanica
-
摘要: 为提高微拟球藻开发利用价值,本文开展了酶菌协同处理对微拟球藻营养功能成分及生物活性影响的研究。采用木瓜蛋白酶酶解微拟球藻,利用单因素和响应面试验获得其最佳酶解工艺,随后通过益生菌发酵酶解基质,研究发酵前后总酚、多肽和黄酮含量以及体外抗氧化和降血脂活性的变化,并对发酵后的微拟球藻酶液进行感官评价。结果表明:微拟球藻的最佳酶解工艺为:酶量5.0%、pH8.0、酶解时间4.0 h、酶解温度76 ℃;在此条件下酶解后发酵可有效提高产物中多肽的含量,其中混菌发酵组提高了近1.3倍,总酚含量提高了5.1%,同时总黄酮的含量降低了32.5%;酶菌协同处理显著增强了其抗氧化和胰脂肪酶抑制活性,其中混菌发酵组DPPH自由基清除率提高了1.2倍,胰脂肪酶清除率提高了59.4%。此外,发酵后感官评分显著提升。可见,酶菌协同发酵可显著提高微拟球藻多肽含量、抗氧化活性、降血脂活性及感官特性,为开发功能型发酵产品提供了参考和技术支持。Abstract: In order to improve the utilization value of N. oceanica, the effects of enzyme-bacteria synergy treatment on its nutritional and functional components as well as its biological activities were investigated. Papain was used to hydrolyze N. oceanica, and the enzymolysis process was optimized by single factor and response surface test. After fermented by lactic acid bacteria, the contents of total phenols, peptides and flavonoids as well as the antioxidant and hypolipidemic activities in vitro before and after fermentation were measured. Sensory evaluation was also performed. The results showed that the optimum enzymolysis process of N. oceanica was as follows: Enzyme amount 5.0%, pH8.0, enzymolysis time 4.0 h, enzymolysis temperature 76 ℃. Under this condition, the content of polypeptide significantly increased by nearly 1.3 times and the total phenolic content increased by 5.1%, while the total flavonoid content decreased by 32.5%. The antioxidant activity and pancreatic lipase inhibitory activity of the fermented products were enhanced, among which the DPPH free radical scavenging rate in mixed bacteria fermented group increased by 1.2 times, and the pancreatic lipase scavenging rate in mixed bacteria fermented group increased by 59.4%. Moreover, the sensory score of the sample after fermentation was significantly improved. In conclusion, the synergistic fermentation of enzyme-bacteria can significantly improve the polypeptide content, antioxidant activity, hypolipidemia activity and sensory properties of N. oceanica, thus provides reference and technical support for the development of functional fermentation products.
-
微拟球藻是真眼点藻纲微拟球藻属的一种海产经济微藻,其生长快、光合效率高、含油量高,是开发前景良好的未来食品[1−2]。微拟球藻高产二十碳五烯酸(Ethernet for Plant Automation,EPA)且不含二十二碳六烯酸(Docosahexaenoic Acid,DHA),EPA含量可达脂肪酸总量的30%,具备低硫、高氧、低十六烷值等特点[3−4],还富含藻多糖、蛋白质等营养功能成分,已于2021年被国家卫健委列为新资源食品。目前,微藻在食品领域的应用越来越广,市面上已有代餐粉、能量棒和饮品[5]等含微拟球藻的相关食品,但是还未见其发酵类型的产品。
酶菌协同发酵是指基质经酶解工艺后,再经益生菌菌株发酵的过程[6]。益生菌本身具有调节肠道菌群、抗氧化、改善机体免疫力等功能[7],通过发酵可明显改变基质组分、降解生物大分子物质,提高其功能活性和生物利用率,还可改善基质风味。杨洁芳等[8]利用酶菌协同制备大豆肽与实验室制备的酶解肽相比,其DPPH自由基清除率提高106.92%。邹俊哲等[9]研究表明酶菌协同处理得到的ACE抑制肽活性强于菌和酶单独作用时的效果。可见,作为前处理方法之一的酶菌协同工艺应用前景广泛,而微拟球藻丰富的营养成分可作为酶菌协同处理的理想基质。
基于以上现状,本研究以微拟球藻为原料,利用木瓜蛋白酶进行酶解,以多肽含量为指标,利用单因素和响应面法确定微拟球藻最佳酶解工艺条件。筛选适合菌种对酶解过后的微拟球藻进行发酵,明确不同菌/组合发酵的营养活性成分变化及其对体外抗氧化、降血脂活性的影响,同时对发酵过后的微拟球藻进行感官评定,为微拟球藻高值利用及功能型产品的开发提供参考与技术支持。
1. 材料与方法
1.1 材料与仪器
微拟球藻(Nannochloropsis oceanica)藻泥 由威海青逸未来生物技术有限公司提供;KB1植物乳杆菌(Lactiplantibacillus plantarum DY-1 CCTCCM2016137)、KB2干酪乳杆菌(Lacticaseibacillus casei KDB-LC CCTCCM2016431)、KB3嗜酸乳杆菌(Lactobacillus acidophilus KDB-03 CCTCCM2016429)、KB4发酵乳杆菌(Limosilactobacillus fermentum KDB-08 CCTCCM2016430) 为本实验室分离保存;木瓜蛋白酶(酶活力:80万 U/g) 北京索莱宝科技有限公司;1,2-二苦基-2-三硝基苯亚肼(DPPH)、2,4,6-三吡啶基-S-三嗪(TPTZ)、胰脂肪酶(酶活力:125 U/mg) SIGAMA(上海)贸易有限公司;牛磺胆酸钠 上海源叶生物科技有限公司;2,4-二硝基苯酚丁酸酯 上海麦克林生化科技有限公司;其他试剂为国产分析纯。
3K15台式冷冻离心机 德国SIGMA公司;756PC紫外分光光度计 上海舜宇恒平科学仪器有限公司;AR124CN电子分析天平 奥豪斯仪器(上海)有限公司;FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司;LDZF立式高压蒸汽灭菌器 上海申安医疗器械厂;INNOVA 43R恒温培养摇床 美国NBS公司;SHA-B恒温水浴锅 金坛市精达仪器制造厂。
1.2 实验方法
1.2.1 微拟球藻的酶解
1.2.1.1 工艺流程及操作要点
取2.8 g微拟球藻藻泥均质于100 mL蒸馏水中(1%干重),利用0.01 mol/L NaOH溶液或0.01 mol/L HCl溶液调整pH后加入木瓜蛋白酶充分混匀,置于相应温度的恒温水浴锅中酶解,沸水浴灭酶15 min即得微拟球藻酶解液。
1.2.1.2 单因素实验
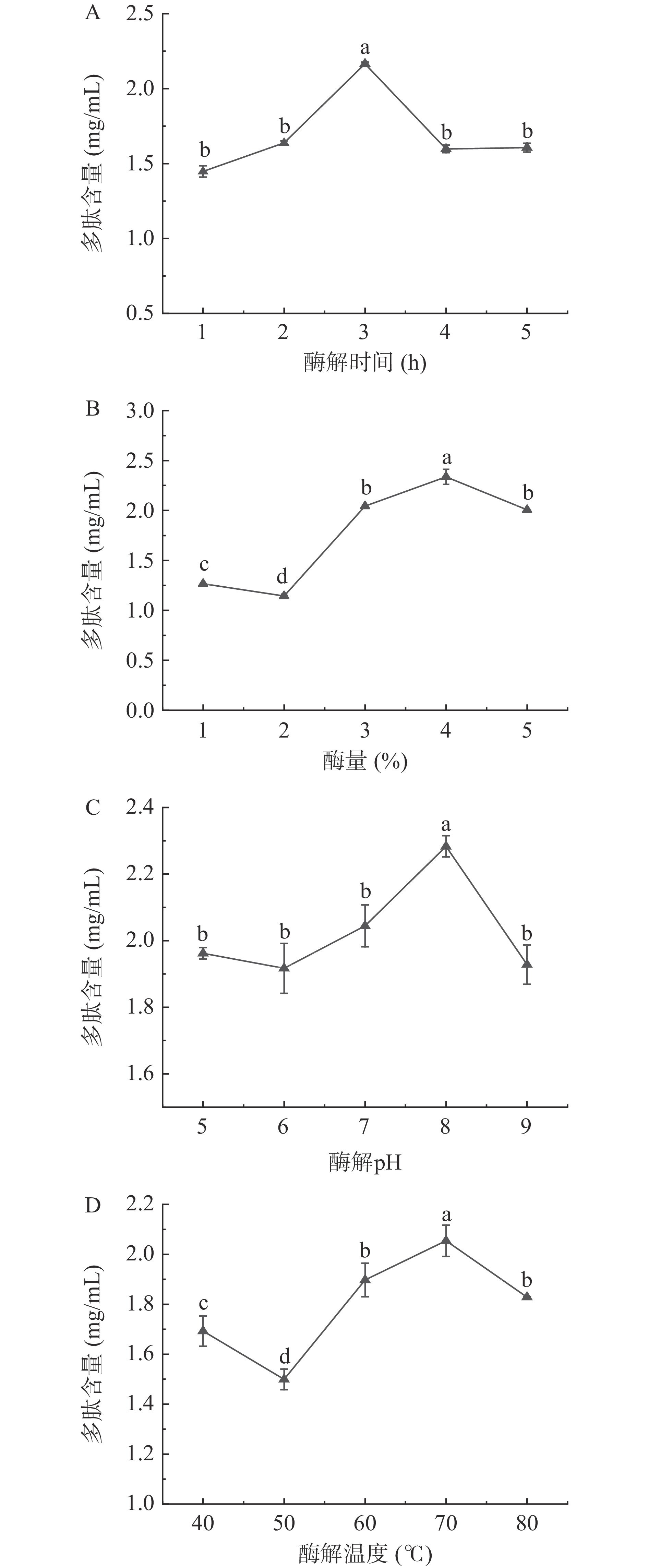
依次对酶量(1%、2%、3%、4%、5%)、酶解时间(1、2、3、4、5 h)、酶解温度(40、50、60、70、80 ℃)和pH(5、6、7、8、9)。当对酶量进行单因素实验时,酶解时间为3 h,酶解温度为60 ℃,pH为7;对酶解时间进行单因素实验时,酶量为3%,酶解温度为60 ℃,pH为7;对酶解温度进行单因素实验时,酶量为3%,酶解时间为3 h,pH为7;对pH进行单因素实验时,酶量为3%,酶解时间为3 h,酶解温度为60 ℃,均以多肽含量为指标。
1.2.1.3 响应面试验
基质中微拟球藻添加量为1%(w/v),木瓜蛋白酶酶量1%(w/v)。在单组实验设计的基础上,以酶量(A)、pH(B)、酶解时间(C)、酶解温度(D)为自变量,以多肽含量为响应值,利用响应面法确定微拟球藻的酶解最佳工艺。响应面优化因素水平表如表1所示。
表 1 响应面优化因素水平Table 1. Factors and level of response surface optimization因素 水平 −1 0 1 A酶量(%) 3 4 5 B pH 7 8 9 C酶解时间(h) 2 3 4 D酶解温度(℃) 60 70 80 1.2.1.4 多肽含量的测定
多肽:采用OPA法[10]。取50 μL上清液,加入2 mL 0.8 mg/mL OPA反应液后静置5 min,于340 nm处测定吸光度值,以胰蛋白胨为标品做标准曲线,得到回归方程y=3.2274x−0.3338,R2=0.9993。
1.2.2 微拟球藻的发酵
1.2.2.1 发酵菌种的活化
将4个菌株接种于MRS液态培养基中活化,传代培养2次后放置在37 ℃恒温培养摇床上振荡培养24 h备用。
1.2.2.2 微拟球藻的发酵
微拟球藻酶解后添加2%葡萄糖和1%的蛋白胨作为基质灭菌备用,分别接种KB1、KB2、KB3、KB4四株乳杆菌,混菌处理接种四菌等比例混合后均质得到的混合菌液,标记为MIX。单菌和混菌发酵接种量均为1%,置于摇床培养箱37 ℃培养24 h,转速80 r/min。对照(CK)组酶解灭菌后不进行发酵处理,放置于常温备用。取5 mL发酵后的样品于离心机5000 r/min离心5 min,取上清液备用。
1.2.3 发酵微拟球藻营养活性成分测定
1.2.3.1 菌量、产酸能力和还原糖含量的测定
菌量:将培养24 h的发酵微拟球藻酶解液取100 μL在MRS固体上进行涂布,在37 ℃下培养48 h后进行计数。按照式(1)计算菌体密度(CFU/mL)。
菌体密度(CFU/mL)=CV×M (1) 式中,平板上的菌落数为C;100 μL为V;稀释倍数为M。
pH和总酸:采用实验室pH计测定pH。参考国标GB/T 12456-2021测定总酸。
还原糖:采用DNS比色法[11]。取1 mL上清液加入2 mL的3,5-二硝基邻羟基苯甲酸溶液煮沸8 min显色,流水冷却后加纯净水稀释,在487 nm下测定吸光度,以葡萄糖标准溶液为标品做标准曲线,得到回归方程y=0.1636x−0.1601,R2=0.9991。
1.2.3.2 总酚、黄酮和多肽含量的测定
总酚:采用Folin-Ciocalteu法[12]。取0.2 mL样品上清液加入福林酚试剂反应5 min后加入3 mL 0.2 g/100 mL碳酸钠溶液,在75 ℃下反应15 min,流水冷却后在765 nm下测其吸光度,以没食子酸为标品做标准曲线,得到回归方程y=0.0069x−0.0003,R2=0.9955。
黄酮:采用NaNO2-AlCl3法[13]。取3 mL上清液,加入1 mL 0.5%的NaNO2反应5 min,加入1 mL 1%的AlCl3后25 ℃水浴 6 min,加入10 mL 1%的NaOH溶液,最后填补70%的乙醇至25 mL反应15 min,于510 nm测定吸光度值,以榭皮素为标品做标准曲线,得到回归方程y=3.4369x−0.0023,R2=0.9985。
多肽含量的测定同1.2.1.4。
1.2.3.3 抗氧化活性的测定
DPPH自由基清除能力的测定参照Martínez等[14]方法。取2.5 mL样品上清液,加入7.5 mL DPPH溶液暗处反应30 min(A1),对照组用样品加95%无水乙醇(A2),空白组用纯净水加DPPH溶液(A0),在517 nm处测得吸光度A1、A2、A0。用式(2)计算。
DPPH清除率(%)=(1−A1−A2A0)×100 (2) FRAP参考Benzie等[15]的方法进行测定。取0.3 mL样品上清液,加入2.7 mL TPTZ工作液37 ℃反应15 min,在595 nm处测其吸光度,以FeSO4为标品得到回归方程y=0.0037x+0.0003,R2=0.9999。
1.2.4 体外降血脂活性测定
牛磺胆酸钠结合率的测定参考何旭华等[16]的方法并稍作修改。取0.5 mL样品上清液,加入2 mL 0.3 mmol/L牛磺胆酸钠溶液在37 ℃摇晃1 h后,取0.5 mL与2 mL 65%的硫酸溶液75 ℃水浴25 min后冰浴10 min,387 nm处测定吸光度为A样品。A对照用60%乙醇溶液代替样品,A空白用磷酸钠缓冲液代替牛磺胆酸钠,按式(3)计算。
结合率(%)=(1−A样品−A空白A对照)×100 (3) 胰脂肪酶抑制率的测定参考黄雪薇等[17]的方法并稍作修改。取1 mL上清液与1 mL 0.5 mg/mL胰脂肪酶溶液37 ℃反应30 min,加入20 μL 4-硝基苯基丁酸酯溶液37 ℃反应10 min,以加酶加样品溶液为实验组Ai,不加入酶溶液为空白组A0,不加入样品溶液为正常组A,在405 nm处测定吸光值。按式(4)进行计算。
抑制率(%)=(1−Ai−A0A−A0)×100 (4) 1.2.5 感官评价分析
组织12名志愿者(6男6女,年龄18~40周岁)进行感官评测[18],感官品评表见表2。将适量微拟球藻发酵酶解液倒入品尝杯中并随机排号,从四个方面进行打分。
表 2 微拟球藻发酵酶解液感官品评标准表Table 2. Table of sensory evaluation criteria for fermentation enzyme hydrolysate of Nannochloropsis oceanica感官特性 评分标准 分值 香气(25分) 有发酵香气,无腥味等不良气味 18~25 香气较淡,带有轻微腥味等不良气味 11~17 基本没有香气,带有明显的腥味等不良气味 0~10 滋味(25分) 适口性较好,无涩、苦、腥等不良味道 18~25 适口性一般,有略微腥味、无苦味、无异味 11~17 适口性差,有较重腥味、苦味及异味 0~10 外观色泽(25分) 有少量沉淀或轻微分层,色泽均匀一致,呈绿色 18~25 有沉淀和分层,色泽较不均匀,绿色偏暗 11~17 沉淀较多,有分层现象,色泽不均匀,呈褐色 0~10 总体可接受性(25分) 乐意接受 18~25 基本能接受 11~17 完全不能接受 0~10 1.3 数据处理
上述试验均进行三次平行测定,数据以均值±标准差表示。采用Design-Expert 10软件进行响应面试验设计;用 SPSS 21软件进行数据分析及显著性分析;用Excel 2010软件对数据进行绘图。
2. 结果与分析
2.1 微拟球藻酶解的工艺优化
2.1.1 单因素实验结果
如图1A所示,随着酶解时间的增加多肽含量逐渐增多,并在3 h时出现了最大值,随后下降。这可能是因为基质中的蛋白质酶解后转化为多肽被释放出来,随着时间延长多肽进一步被降解为氨基酸,故而含量下降[19]。随着酶量的增加多肽含量不断增多,在4%时最高(图1B),而后有下降趋势。推测可能是酶量的增多导致微拟球藻中的成分被更充分的酶解从而使多肽被更多的释放出来,而酶量过高时酶分子之间的相互水解作用导致了酶解效果下降,从而多肽含量下降[20]。随着酶解pH的提高,多肽含量先下降后上升再下降,在pH8时含量最大(图1C)。pH影响酶分子和底物的离解状态,如果pH不在适当范围内酶的活性就会减弱失活,降低酶水解效率[21],而在pH8时酶的活性得到充分的释放,水解效率最高从而多肽含量最高。由图1D可知,随着酶解温度的增加,多肽含量先下降后缓慢上升再逐渐下降。当温度达到70 ℃时,多肽含量最高,随后温度升高多肽含量下降。这可能是温度对木瓜蛋白酶活性的影响,过低或过高的温度都会影响酶活,而越接近最佳温度酶活力越高,释放的多肽越多。综上,选择酶解时间2~4 h、酶量3%~5%、酶解pH7~9和酶解温度60~80 ℃进行响应面试验。
2.1.2 微拟球藻酶解响应面优化试验结果
综合上述试验结果,以酶量(A)、pH(B)、酶解时间(C)、酶解温度(D)为自变量,多肽含量为响应值,根据响应面法进行试验,试验设计与结果如表3所示。
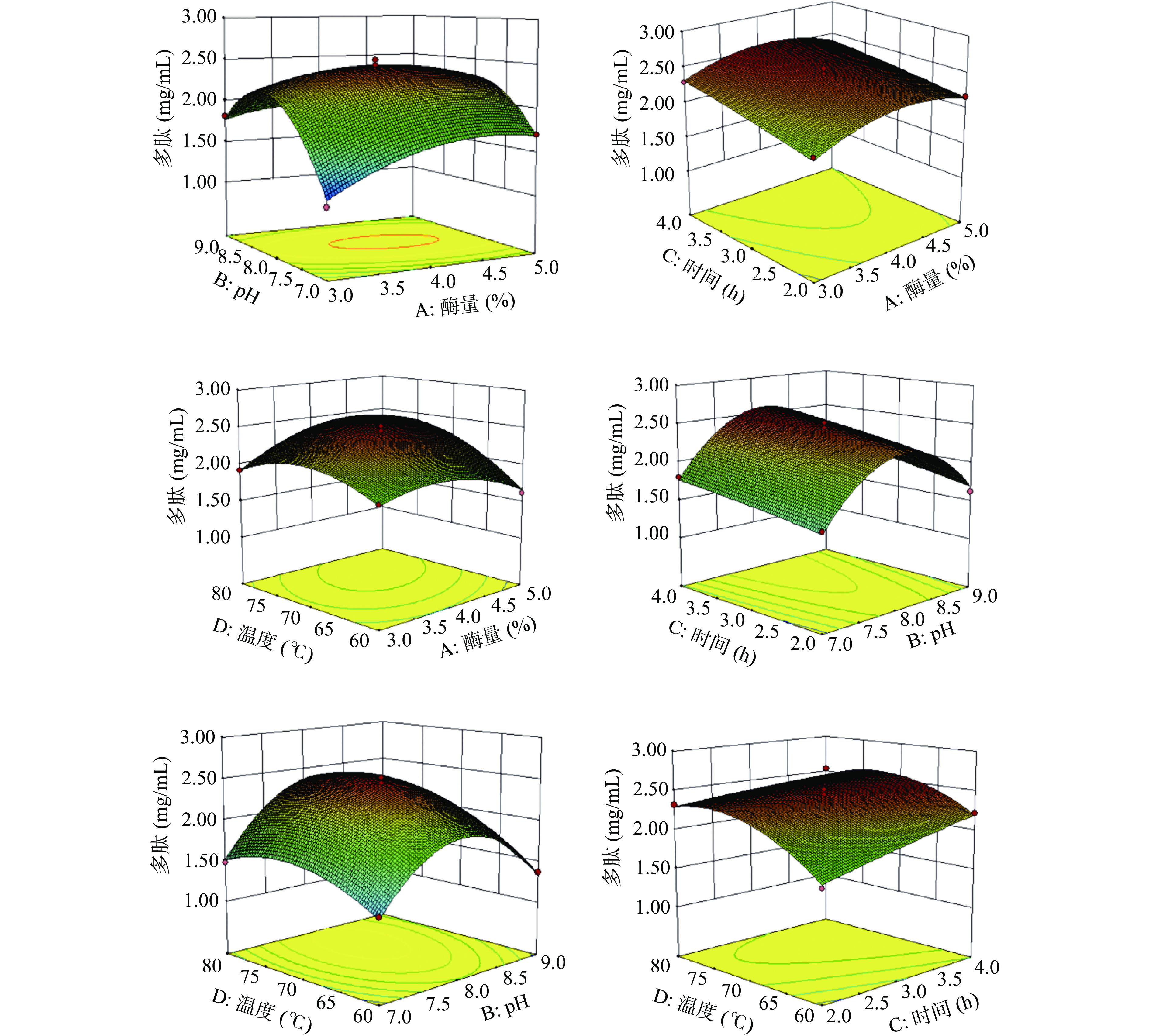
表 3 响应面试验设计及结果Table 3. Response surface test design and results实验号 A B C D R 多肽含量(mg/mL) 1 1 0 −1 0 2.17 2 1 1 0 −1 1.37 3 1 −1 0 0 1.70 4 0 1 0 1 1.88 5 0 −1 1 0 1.80 6 0 0 −1 −1 1.69 7 1 0 0 1 2.35 8 0 0 0 0 2.43 9 −1 0 0 −1 1.87 10 −1 −1 0 0 1.10 11 0 0 0 0 2.45 12 0 0 0 0 2.52 13 0 0 −1 −1 2.22 14 0 0 1 1 2.54 15 −1 0 0 1 1.92 16 −1 1 0 0 1.81 17 0 0 0 0 2.45 18 0 0 −1 1 2.32 19 1 0 0 −1 1.62 20 0 −1 0 −1 1.31 21 1 0 1 0 2.35 22 1 0 1 0 2.29 23 0 −1 0 1 1.48 24 0 0 0 0 2.38 25 0 1 1 0 1.99 26 0 −1 −1 0 1.55 27 1 1 0 0 1.67 28 0 0 −1 0 1.62 29 −1 0 −1 0 1.99 通过Design-export软件进行分析,得到多重二次响应面回归方程为:R=2.45+0.0731A+0.12B+0.15C+0.20D−0.18AB−0.030AC+0.17AD+0.030BC+0.085BD−0.077CD−0.23A2−0.67B2−0.015C2−0.26D2。根据表4和对应方程可知,A(酶量)、B(酶解pH)、C(酶解时间)和D(酶解温度)对微拟球藻酶解液的多肽含量影响极显著(P<0.01)。同时可以看出模型F=66.54,P<0.0001,模型极显著,失拟项F=2.27,P>0.05,失拟项在回归模型中无显著性,说明该模型拟合度好,R2=0.9852,R2adj=0.9704,结果表明,该回归模型可以解释97.04%的实验数据差异,与实际情况吻合较好。
表 4 回归模型的方差分析Table 4. Variance analysis of regression model来源 平方和 自由度 均方 F值 P值 显著性 模型 4.53 14 0.32 66.54 <0.0001 ** A 0.064 1 0.064 13.10 0.0028 ** B 0.16 1 0.16 33.45 <0.0001 ** C 0.28 1 0.28 58.30 <0.0001 ** D 0.48 1 0.48 99.54 <0.0001 ** AB 0.14 1 0.14 27.85 0.0001 ** AC 0.035 1 0.035 0.72 0.4101 AD 0.12 1 0.12 23.74 0.0002 ** BC 0.035 1 0.035 0.72 0.4089 BD 0.029 1 0.029 5.94 0.0287 * CD 0.024 1 0.024 4.90 0.0439 * A2 0.33 1 0.33 68.28 <0.0001 ** B2 2.92 1 2.92 599.86 <0.0001 ** C2 0.014 1 0.014 0.28 0.6029 D2 0.44 1 0.44 90.45 <0.0001 ** 残差 0.068 14 0.049 失拟项 0.058 10 0.058 2.27 0.2234 净误差 0.010 4 0.026 总差 4.60 28 注:“**”即P<0.01差异极显著 ;“*”即P<0.05差异显著。 图2为两因素交互作用对多肽含量影响的3D图。可以观察到交互项A(酶量)B(酶解pH)和交互项A(酶量)D(酶解温度)对微拟球藻酶解液的多肽含量影响极显著;交互项B(酶解pH)D(酶解温度)和交互项C(酶解时间)D(酶解温度)对微拟球藻酶解液的多肽含量影响显著;交互项A(酶量)C(酶解时间)和交互项B(酶解pH)C(酶解时间)对微拟球藻酶解液的多肽含量影响不显著。
经响应面优化得到最优微拟球藻酶解工艺为酶量5.000%、pH8.009、酶解时间4.000 h、酶解温度75.635 ℃,多肽含量的理论值为2.484 mg/mL。为便于实际操作,将其修改为酶量5%、pH8.0、酶解时间4 h、酶解温度76 ℃,试验得含量为2.45 mg/mL,与最佳值接近,说明该模型可用。
2.2 微拟球藻发酵酶液特性的变化
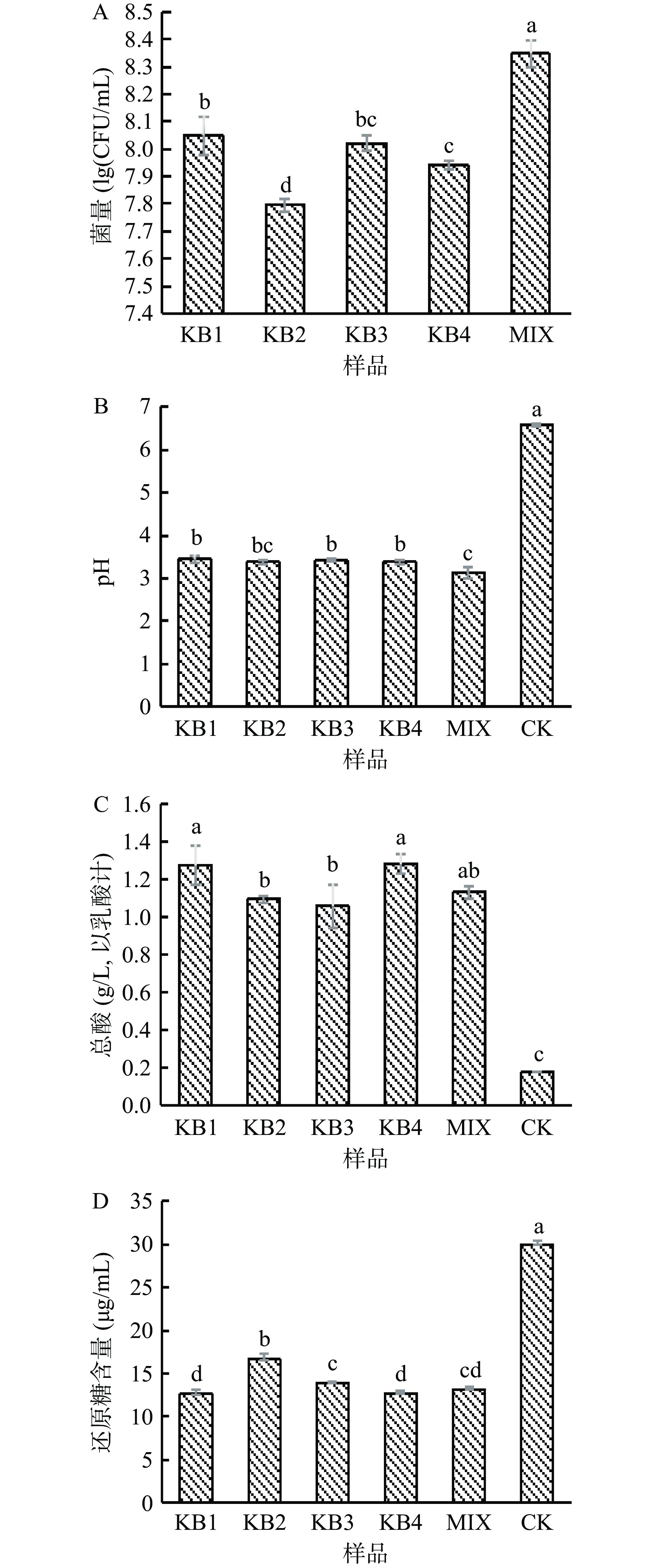
益生菌增殖是微拟球藻中有效物质生物转化的前提。微拟球藻发酵24 h后,混菌组活菌数最多,KB1次之,菌量均大于107 CFU/mL(图3A),说明微拟球藻是益生菌较好的生长基质,但是不同菌株之间具有一定的差异性,同时从侧面反映了微拟球藻在混菌发酵过程中乳杆菌之间的协同作用更加突出[22],所以混菌组有相对最多的活菌数。
![]() 图 3 微拟球藻酶解液发酵24 h后菌量(A)、pH(B)、总酸(C)、还原糖(D)的变化注:KB1为植物乳杆菌发酵微拟球藻;KB2为干酪乳杆菌发酵微拟球藻;KB3为嗜酸乳杆菌03发酵微拟球藻;KB4为嗜酸乳杆菌08发酵微拟球藻;MIX为四菌等比例发酵微拟球藻;CK为未发酵微拟球藻;图4~图7同。Figure 3. The changes of viable count (A), pH (B), total acid (C) and residual sugar (D) after 24 h fermentation of enzymatic hydrolysate of Nannochloropsis oceanica
图 3 微拟球藻酶解液发酵24 h后菌量(A)、pH(B)、总酸(C)、还原糖(D)的变化注:KB1为植物乳杆菌发酵微拟球藻;KB2为干酪乳杆菌发酵微拟球藻;KB3为嗜酸乳杆菌03发酵微拟球藻;KB4为嗜酸乳杆菌08发酵微拟球藻;MIX为四菌等比例发酵微拟球藻;CK为未发酵微拟球藻;图4~图7同。Figure 3. The changes of viable count (A), pH (B), total acid (C) and residual sugar (D) after 24 h fermentation of enzymatic hydrolysate of Nannochloropsis oceanica如图3B、3C所示,益生菌发酵24 h后pH均显著下降(P<0.05),总酸含量显著增加(P<0.05)。与CK组相比,各发酵处理总酸提高了4.9~6.1倍。益生菌发酵可通过戊糖磷酸途径(HMP)和糖酵解途径(EMP)途径将基质中的糖类代谢产生乳酸和CO2,其中,CO2会形成碳酸,醛类会被氧化成酸类,从而降低发酵液的pH[23]。可知发酵后微拟球藻酶液产酸降低了发酵液的pH,且提高了其总酸的含量。
由图3D可看出,发酵组的还原糖含量显著下降(P<0.05),其中KB4发酵降幅最大,达57.6%。由于发酵过程中乳酸菌对微拟球藻基质中的糖类物质进行降解代谢,为自身生长繁殖利用,导致还原糖含量降低[24]。可知乳杆菌在发酵微拟球藻酶液的过程中利用了还原糖促进自身的繁殖。
2.3 发酵微拟球藻酶液主要活性成分的变化
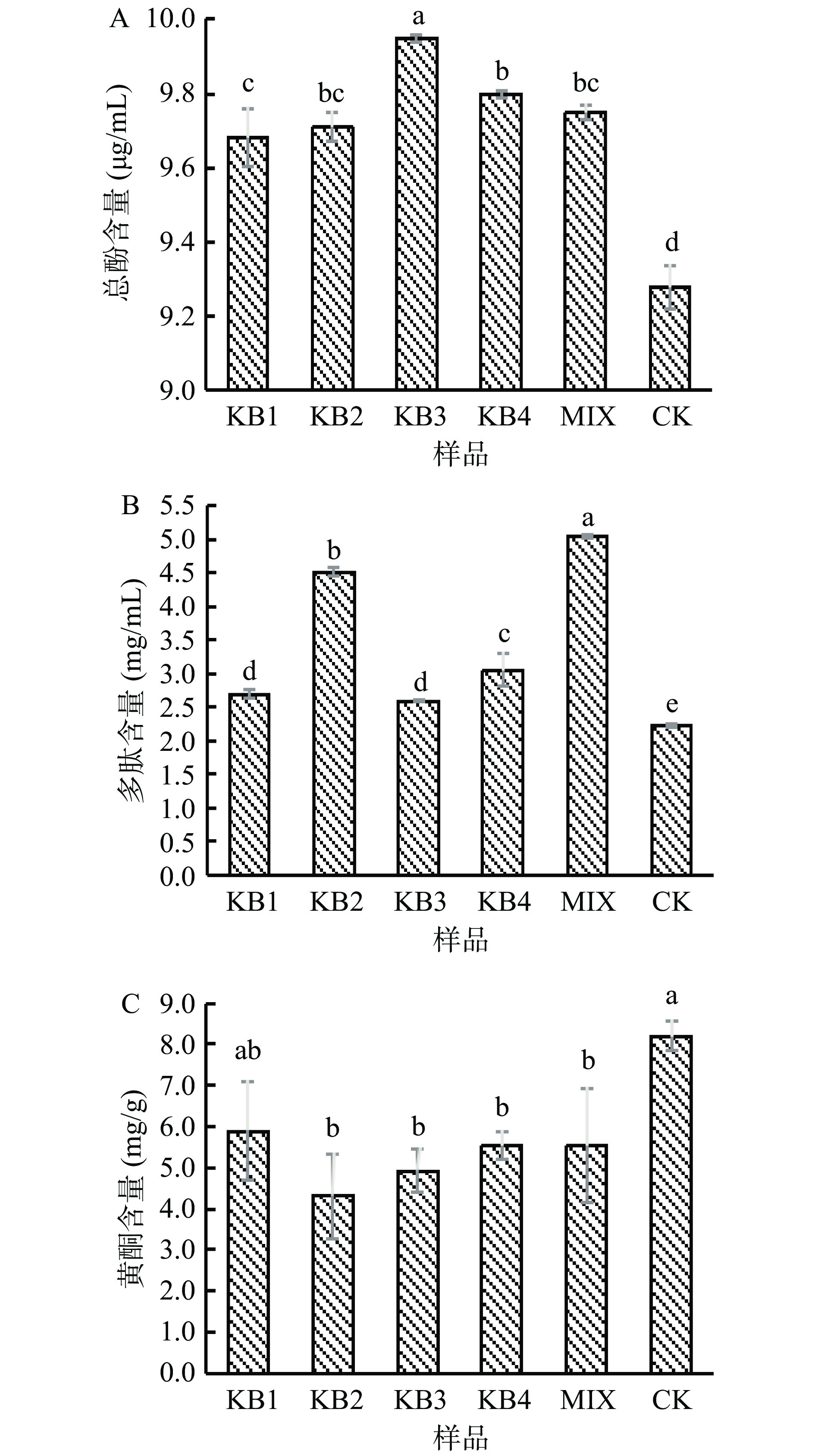
植物基质经益生菌发酵后,经过一系列生物转化,可显著改变基质营养和功能组分[5]。如图4A所示,不同处理条件下,总酚含量分别在9.3±0.1~10.0±0.0 μg/mL之间,与CK组相比,发酵组有上升且存在显著性差异(P<0.05)。总酚含量的提高可能是由于发酵过程产生的淀粉酶、纤维素酶等水解酶促进了总酚物质的释放,也可能与发酵过程中产生的单宁酶有关,单宁酶可以将复杂单宁降解为游离酚类物质从而提高总多酚的含量[25],所以发酵后微拟球藻酶液中多酚含量会有上升的趋势。
如图4B所示,发酵可显著提高微拟球藻多肽含量(P<0.05),与CK相比,混菌组多肽含量提高了近1.3倍。其原因可能是随着发酵的进行,菌株产酶量增加,特别是混菌酶系更加丰富,进一步酶切木瓜蛋白酶未发挥作用的位点使多肽增加,也有可能是微拟球藻在发酵过程中细胞的破坏程度不同,有效破坏微拟球藻细胞壁有利于胞内有效成分释放,使某些成分发生生物转化或者破坏一些大分子蛋白质的空间结构,从而将蛋白质分解成多肽等小分子物质[26],所以发酵后微拟球藻酶液中多肽含量会显著上升。
由图4C可知,除KB1组外其余组发酵后总黄酮含量显著下降(P<0.05)。其中,KB2组总黄酮下降幅度最大,降幅为47.3%,一个可能原因是乳杆菌产生的二次代谢产物与黄酮化合物反应生成衍生物;另一种可能性是乳杆菌酶系种类繁多,不同的酶系可引发的化学反应不同,若黄酮类成分因乳杆菌酶的酶解作用发生结构变化,也可能产生发酵后含量降低的情况[27]。综上,发酵后微拟球藻酶液中总酚和多肽的含量有上升趋势而黄酮含量呈现下降趋势。
2.4 发酵微拟球藻酶液抗氧化活性的变化
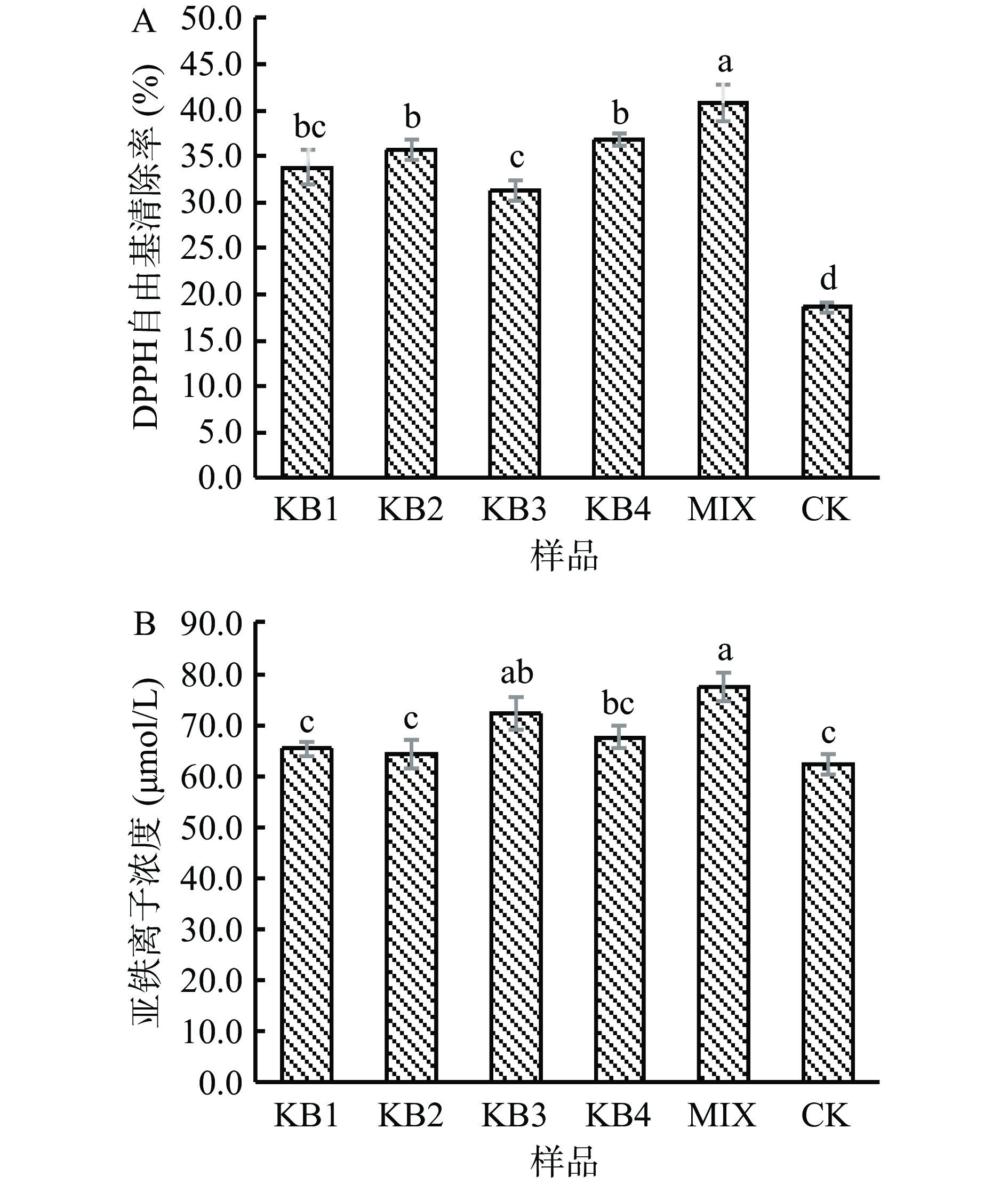
乳酸菌发酵可以促进植物基质中活性物质的释放及新活性成分的转化,增强发酵基质的生物活性功能[28−30]。Niccolai等[31]研究发现植物乳杆菌发酵螺旋藻能显著提高其抗氧化能力。由图5A可知,与CK相比,发酵组的DPPH自由基清除率显著提高(P<0.05),其中,MIX发酵组清除率最高,较CK提高了119.8%。FRAP代表的是亚铁离子浓度,浓度越高样品的抗氧化能力越强[32]。由图5B可以看出,发酵可明显提高其铁离子还原力,KB3发酵组和MIX发酵组与CK组差异显著(P<0.05),增幅为3.3%~24.3%。
抗氧化能力一般与黄碱素和植物单宁的含量呈显著正相关[13],且多肽等成分也有很好的抗氧化活性,从本文结果来看,发酵后总酚和多肽含量上升而黄酮含量下降,可能原因是发挥抗氧化作用的成分发生了改变,具有更高抗氧化活性物质的含量增加[33]。因此推测微拟球藻酶解后在益生菌的作用下,产生了一些有效的次生代谢产物,这些代谢产物取代了原来的活性成分发挥了抗氧化作用。可见,乳酸菌发酵可提高微拟球藻酶解液的抗氧化活性,但具有明显的菌株差异。
2.5 发酵微拟球藻酶液降血脂活性的变化
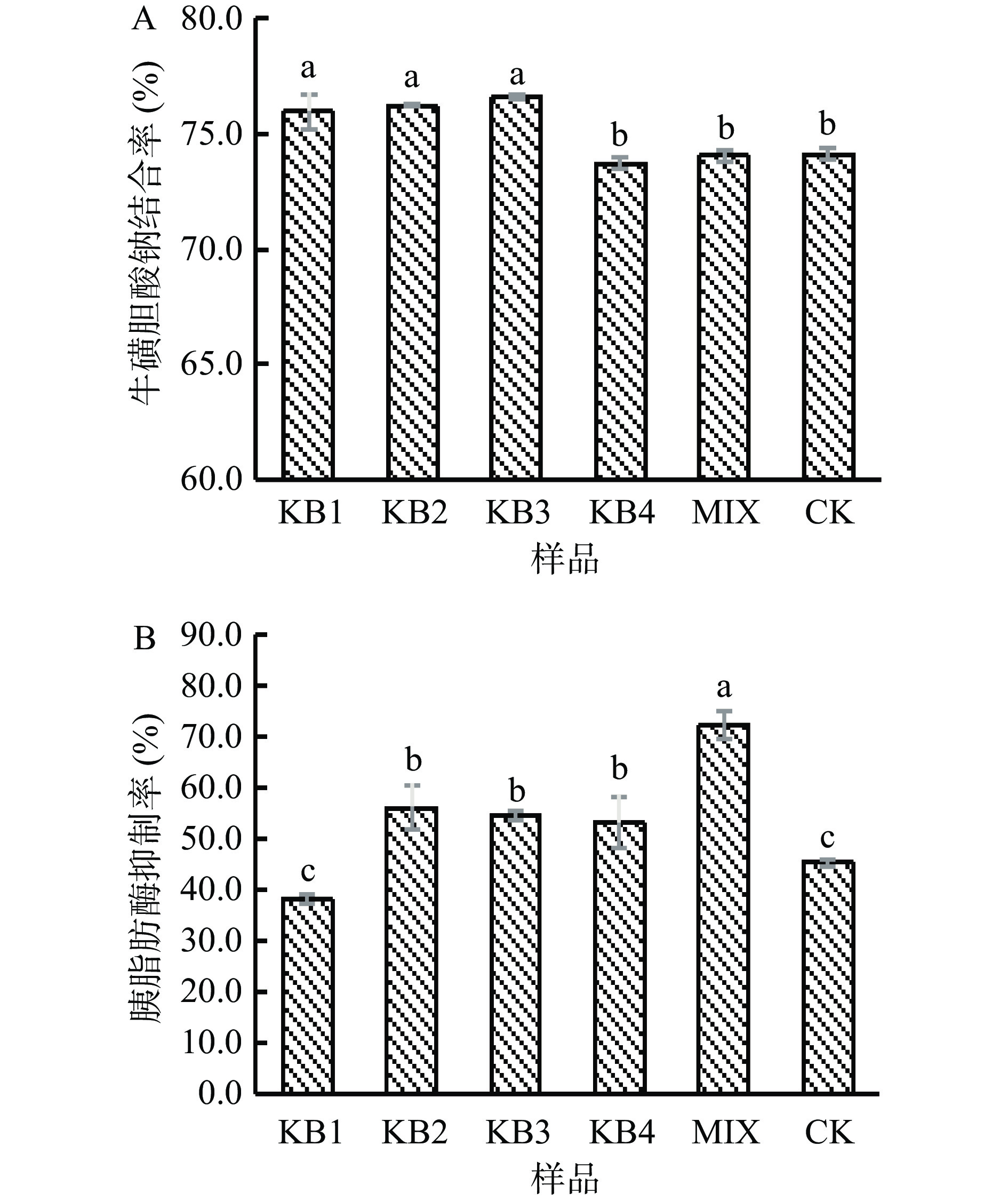
胆汁酸盐(胆汁酸的钠盐)可以增强脂肪和脂溶性营养物质在肠道中的水解程度,促进身体的消化吸收,因此样品对胆酸盐的结合率可以反映其降血脂的能力[34]。胰脂肪酶可促进脂肪的分解和吸收,抑制胰脂肪酶活性可以减少体内甘油单酯和脂肪酸,从而起到降血脂的作用[35]。如图6A、6B所示,不同菌株发酵微拟球藻酶液的牛磺胆酸钠结合率和胰脂肪酶抑制率各不相同。其中,KB1、KB2和KB3发酵组的牛磺胆酸钠结合率显著增加(P<0.05),分别较CK组提高2.5%、2.9%和3.3%,而KB4和MIX发酵组变化不显著(P>0.05);KB2、KB3和KB4和MIX发酵组的胰脂肪酶抑制率显著提高(P<0.05),与CK组相比增幅分别为23.9%、20.5%、17.2%和59.4%,而KB1发酵组变化不显著(P>0.05)。微拟球藻发酵产物的牛磺胆酸钠结合能力和胰脂肪酶活力抑制能力的不同可能与乳酸菌在基质中产生的特异性物质有关[36]。乳杆菌结合胆酸盐能力可能与其产生的胆盐水解酶有关,在厌氧条件下催化分离结合态的胆盐为去结合型胆盐[37],从而提高胆酸盐结合能力,乳酸菌胆盐水解酶不同,催化分离结合态胆盐的能力也就不同,所以发酵牛磺胆酸钠结合率不同。从发酵后胰脂肪酶抑制活性变化可知,混菌发酵后的抑制活性最高,推测其原因可能是多个乳杆菌发酵产生的某些有效物质的组成和结构存在差异,而这些物质在抑制脂肪酶活性上存在一定的协同效应[38]。综上可知,酶菌协同处理微拟球藻是提高其降血脂活性的有效方法。
2.6 发酵微拟球藻酶液的感官评定
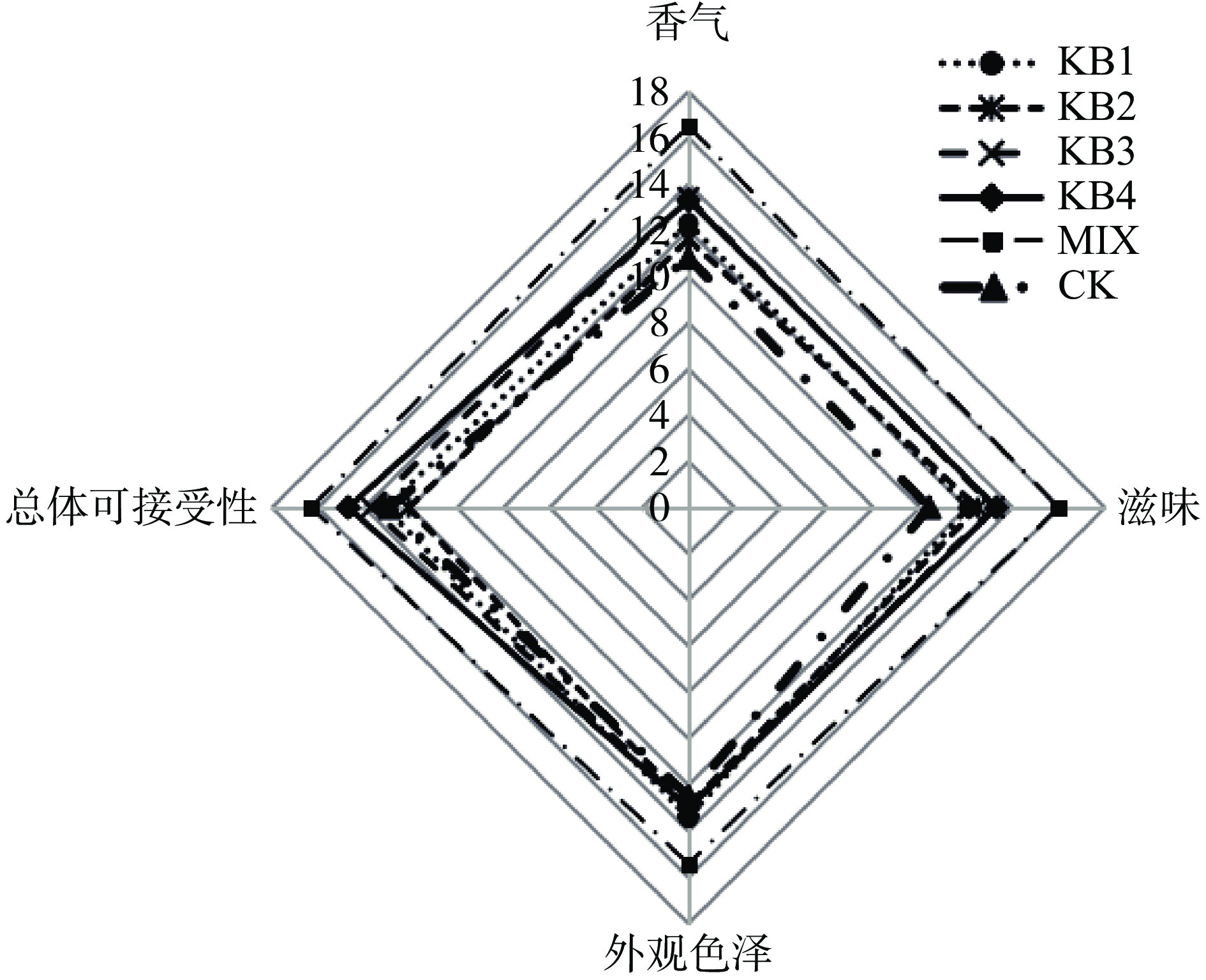
感官评定总分是香气、滋味、外观色泽、总体可接受性四部分总分之和。由图7可知,发酵对微拟球藻感官评价有积极作用,未经发酵的CK组感官评价最低,总分为46.6±8.6分,发酵后均有提高,且混菌发酵MIX组为最高总分64.2±6.2分,二者差异显著(P<0.05),尤其是发酵后滋味显著改善,能明显区别出未发酵与发酵微拟球藻,发酵后的微拟球藻对其自身的腥味等异味有很大的改善作用。
腥味物质主要有多不饱和脂肪酸、醛类、胺类和酮类物质[39],而乳酸菌发酵可以将醛类、酮类等转化为醇类和酯类等风味物质[40],从而缓解不良风味。从感官评定结果可以得知,通过发酵处理可以显著改善风味,特别是混菌发酵效果最佳。混菌发酵能够弥补单一菌株的不足,各菌株之间发挥协同作用,协同众多的酶系参与蛋白质、多糖等复杂成分的合成从而改善风味。顾赛麒等[41]报道了发酵海带后挥发物数量降至24种且感官评分到达70分,即发酵可改善海带的感官品质。从本实验来看,尽管微拟球藻经发酵后感官风味有显著提升,但是总体上得分较低,可能是由于该藻本身腥味较重,单纯发酵所改善的程度还很难达到让人愉悦的感官体验,后期还需结合其他去腥和改善风味的方法,从产品研发的角度进一步深入研究。
3. 结论
本文以微拟球藻藻泥为原料,采用木瓜蛋白酶酶解微拟球藻,利用单因素和响应面试验获得其最佳酶解工艺为:酶量5.0%、pH8.0、酶解时间4.0 h、酶解温度76 ℃;随后通过益生菌发酵酶解基质,酶菌协同处理后多肽的含量提高了20.9%~126.1%,总酚含量的提高幅度在4.3%~7.2%,同时总黄酮的含量降低幅度在28.1%~47.3%,混菌发酵组DPPH自由基清除率提高了119.8%而胰脂肪酶清除率提高了59.4%。
综上所述,微拟球藻酶解液发酵后的多肽含量及抗氧化活性和降血脂活性显著提高,具有辅助治疗高血脂的潜在功效。然而后期还需全面分析益生菌发酵对微拟球藻产物中营养功能成分的影响,解析物质变化规律,同时利用动物试验进一步验证其在慢性疾病防治方面的作用效果并阐释相关机制。此外,尽管发酵后风味显著改善,在研发消费者能普遍接受的产品方面还需进行更深入的研究。总之,酶菌协同处理是微拟球藻高值化利用的有效方式,可利用微拟球藻发酵产物开发功能型食品。
-
图 3 微拟球藻酶解液发酵24 h后菌量(A)、pH(B)、总酸(C)、还原糖(D)的变化
注:KB1为植物乳杆菌发酵微拟球藻;KB2为干酪乳杆菌发酵微拟球藻;KB3为嗜酸乳杆菌03发酵微拟球藻;KB4为嗜酸乳杆菌08发酵微拟球藻;MIX为四菌等比例发酵微拟球藻;CK为未发酵微拟球藻;图4~图7同。
Figure 3. The changes of viable count (A), pH (B), total acid (C) and residual sugar (D) after 24 h fermentation of enzymatic hydrolysate of Nannochloropsis oceanica
表 1 响应面优化因素水平
Table 1 Factors and level of response surface optimization
因素 水平 −1 0 1 A酶量(%) 3 4 5 B pH 7 8 9 C酶解时间(h) 2 3 4 D酶解温度(℃) 60 70 80 表 2 微拟球藻发酵酶解液感官品评标准表
Table 2 Table of sensory evaluation criteria for fermentation enzyme hydrolysate of Nannochloropsis oceanica
感官特性 评分标准 分值 香气(25分) 有发酵香气,无腥味等不良气味 18~25 香气较淡,带有轻微腥味等不良气味 11~17 基本没有香气,带有明显的腥味等不良气味 0~10 滋味(25分) 适口性较好,无涩、苦、腥等不良味道 18~25 适口性一般,有略微腥味、无苦味、无异味 11~17 适口性差,有较重腥味、苦味及异味 0~10 外观色泽(25分) 有少量沉淀或轻微分层,色泽均匀一致,呈绿色 18~25 有沉淀和分层,色泽较不均匀,绿色偏暗 11~17 沉淀较多,有分层现象,色泽不均匀,呈褐色 0~10 总体可接受性(25分) 乐意接受 18~25 基本能接受 11~17 完全不能接受 0~10 表 3 响应面试验设计及结果
Table 3 Response surface test design and results
实验号 A B C D R 多肽含量(mg/mL) 1 1 0 −1 0 2.17 2 1 1 0 −1 1.37 3 1 −1 0 0 1.70 4 0 1 0 1 1.88 5 0 −1 1 0 1.80 6 0 0 −1 −1 1.69 7 1 0 0 1 2.35 8 0 0 0 0 2.43 9 −1 0 0 −1 1.87 10 −1 −1 0 0 1.10 11 0 0 0 0 2.45 12 0 0 0 0 2.52 13 0 0 −1 −1 2.22 14 0 0 1 1 2.54 15 −1 0 0 1 1.92 16 −1 1 0 0 1.81 17 0 0 0 0 2.45 18 0 0 −1 1 2.32 19 1 0 0 −1 1.62 20 0 −1 0 −1 1.31 21 1 0 1 0 2.35 22 1 0 1 0 2.29 23 0 −1 0 1 1.48 24 0 0 0 0 2.38 25 0 1 1 0 1.99 26 0 −1 −1 0 1.55 27 1 1 0 0 1.67 28 0 0 −1 0 1.62 29 −1 0 −1 0 1.99 表 4 回归模型的方差分析
Table 4 Variance analysis of regression model
来源 平方和 自由度 均方 F值 P值 显著性 模型 4.53 14 0.32 66.54 <0.0001 ** A 0.064 1 0.064 13.10 0.0028 ** B 0.16 1 0.16 33.45 <0.0001 ** C 0.28 1 0.28 58.30 <0.0001 ** D 0.48 1 0.48 99.54 <0.0001 ** AB 0.14 1 0.14 27.85 0.0001 ** AC 0.035 1 0.035 0.72 0.4101 AD 0.12 1 0.12 23.74 0.0002 ** BC 0.035 1 0.035 0.72 0.4089 BD 0.029 1 0.029 5.94 0.0287 * CD 0.024 1 0.024 4.90 0.0439 * A2 0.33 1 0.33 68.28 <0.0001 ** B2 2.92 1 2.92 599.86 <0.0001 ** C2 0.014 1 0.014 0.28 0.6029 D2 0.44 1 0.44 90.45 <0.0001 ** 残差 0.068 14 0.049 失拟项 0.058 10 0.058 2.27 0.2234 净误差 0.010 4 0.026 总差 4.60 28 注:“**”即P<0.01差异极显著 ;“*”即P<0.05差异显著。 -
[1] 吕小京, 操德群, 徐年军. 响应面试验优化酶解法制备海洋微藻微拟球藻抗氧化肽工艺[J]. 食品科学,2018,39(6):183−188 doi: 10.7506/spkx1002-6630-201806029 LÜ X J, CAO D Q, XU N J. Optimization of enzymatic hydrolysis process for preparation of antioxidant peptides from marine Chlorella microalgae microphylla by response surface methodology[J]. Food Science,2018,39(6):183−188. doi: 10.7506/spkx1002-6630-201806029
[2] GUIMARÃES B O, VILLARREAL-TORIBIO B, GARCÍA-BARRERA T, et al. Effect of sulphur on selenium accumulation and speciation in Nannochloropsis oceanica[J]. Journal of Functional Foods,2022,96:1−11.
[3] XU Y. Biochemistry and biotechnology of lipid accumulation in the microalga Nannochloropsis oceanica[J]. Journal of Agricultural and Food Chemistry,2022,70(37):11500−11509. doi: 10.1021/acs.jafc.2c05309
[4] DU P R, MAJYAZOUB M E, THOMAS T, et al. Nannochloropsis oceanica as a microalgal food intervention in diet-induced metabolic syndrome in rats[J]. Nutrients,2021,13(11):3991−3993. doi: 10.3390/nu13113991
[5] 刘习军. 超声波辅助珠磨法破壁微拟球藻细胞[D]. 广州:华南理工大学, 2019 LIU X J. Disintegration of Nannochloropsis sp. cells in a turbine bead mill with ultrasonic assistance[D]. Guangzhou:South China University of Technology, 2019.
[6] 王芳, 贾万利, 张浩男, 等. 混合菌发酵对豆粕品质的影响[J]. 甘肃农业大学学报,2017,52(4):45−51 WANG F, JIA W L, ZHANG H N, et al. Effect of mixed bacteria fermentation on the quality of soybean meal[J]. Journal of Gansu Agricultural University,2017,52(4):45−51.
[7] 丁瑞雪, 武俊瑞, 岳喜庆, 等. 益生菌对肠道营养健康调控作用的研究进展[J]. 中国乳品工业,2018,46(1):24−32 doi: 10.3969/j.issn.1001-2230.2018.01.007 DING R X, WU J R, YUE X Q, et al. Research progress on the regulation of probiotics on intestinal nutrition and health[J]. China's Dairy Industry,2018,46(1):24−32. doi: 10.3969/j.issn.1001-2230.2018.01.007
[8] 杨洁芳, 刘会平, 张宇, 等. 菌酶协同制备大豆肽的工艺优化及其抗氧化特性的研究[J]. 食品工业科技,2013,34(13):245−249 YANG J F, LIU H P, ZHANG Y, et al. Study on fermentation conditions of the soybean peptides by cooperation of bacteria and enzyme and its antioxidant activity[J]. Science and Technology of Food Industry,2013,34(13):245−249.
[9] 邹俊哲, 林凯, 谯飞, 等. 菌酶协同发酵水解大米蛋白ACE抑制肽及其活性的研究[J]. 食品研究与开发,2019,40(9):1−7 ZOU J Z, LIN K, QIAO F, et al. Lactobacillus plantarum and Bacillus subtilis coupled with enzymes to remove riceprotein and the angiotensin I-converting enzyme inhibitory activities of removal liquid[J]. Food Research and Development,2019,40(9):1−7.
[10] ZHAO Z J, ZHANG L L, LOU Y G, et al. Inhibitory effect of polypeptides produced by Brevibacillus brevis on ochratoxigenic Fungi in the process of pile-fermentation of post-fermented tea[J]. Foods,2022,11(20):3243−3249. doi: 10.3390/foods11203243
[11] 牟佳红, 梁安雯, 覃超琳, 等. 酶解与发酵联合处理对黑木耳还原糖含量及抗氧化性能的影响[J]. 食品工业科技,2022,43(7):139−147 MU J H, LIANG A W, QIN C L, et al. Effect of enzymatic hydrolysis combined with fermentation treatment on reducing sugar content and antioxidant performance of Auricularia auricula[J]. Science and Technology of Food Industry,2022,43(7):139−147.
[12] ITZAMNÁ B P, JOSÉ Á G B. Physicochemical and antioxidant characterization of Justicia spicigera[J]. Food Chemistry,2017,218:305−312. doi: 10.1016/j.foodchem.2016.09.078
[13] 于金慧, 马德源, 刘云鹏, 等. 乳酸菌发酵对螺旋藻主要功效成分影响的初步研究[J]. 食品工业科技,2019,40(18):85−90 YU J H, MA D Y, LIU Y P, et al. Preliminary study on the effect of lactic acid bacteria fermentation on the main functional components of Spirulina[J]. Science and Technology of Food Industry,2019,40(18):85−90.
[14] MARTÍNEZ S, FUENTES C, CARBALLO J. Antioxidant activity, total phenolic content and total flavonoid content in sweet chestnut ( Castanea sativa Mill. ) cultivars grown in northwest Spain under different environmental conditions[J]. Foods,2022,11(21):3519−3529. doi: 10.3390/foods11213519
[15] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma(FRAP) as a measure of “antioxidant power”:The FRAP assay[J]. Analytical Biochemistry,1996,239(1):70−76. doi: 10.1006/abio.1996.0292
[16] 何旭华, 石志娇, 王安娜, 等. 黑果腺肋花楸叶黄酮的提取工艺优化及抗氧化、结合胆酸盐能力分析[J]. 食品工业科技,2023,44(2):1−8 HE X H, SHI Z J, WANG A N, et al. Optimization of extraction process of flavonoids from Aronia melanocarpas' leaves and analysis of their antioxidant and bile salt binding capacity[J]. Science and Technology of Food Industry,2023,44(2):1−8.
[17] 黄雪薇, 雷嗣超, 涂芬, 等. 板栗壳黄酮结构分析及其对胰脂肪酶活力的抑制作用[J]. 食品科学,2021,42(21):111−118 HUANG X W, LEI S C, TU F, et al. Structure analysis of flavonoid from chestnut shell and its inhibitory effect on pancreatic lipase activity[J]. Food Science,2021,42(21):111−118.
[18] 肖欣欣. 海带乳酸发酵制品的研制及贮藏期间菌相变化的研究[D]. 福州:福建农林大学, 2012 XIAO X X. Preparation of lactic acid fermented products from kelp and study on changes of microfacies during storage[D]. Fuzhou:Fujian Agriculture and Forestry University, 2012.
[19] 王惠敏, 李茜, 蔡甜甜, 等. 亚麻籽粕抗氧化肽制备工艺的响应面法优化[J]. 食品工业科技,2018,39(3):220−225 WANG H M, LI X, CAI T T, et al. Optimization of preparation of antioxidant peptides from flaxseed meal by response surface method[J]. Science and Technology of Food Industry,2018,39(3):220−225.
[20] 赵谋明. 食物蛋白酶解理论与技术[M]. 北京:化学工业出版社, 2017:125−137 ZHAO M M. Theory and technique of food protease hydrolysis[M]. Beijing:Chemical Industry Press, 2017:125−137.
[21] ZORIĆ N, KOPJAR N, RODRIGUEZ J V, et al. Protective effects of olive oil phenolics oleuropein and hydroxytyrosol against hydrogen peroxide-induced DNA damage in human peripheral lymphocytes[J]. Acta Pharmaceutica (Zagreb, Croatia),2021,71(1):131−141. doi: 10.2478/acph-2021-0003
[22] 项群然, 崔树茂, 唐鑫, 等. 协同发酵对发酵乳中益生菌活菌数及酸乳品质的影响[J]. 食品与发酵工业, 2023, 49(6):18−26 XIANG Q R, CUI S M, TANG X, et al. Effects of co-fermentation on the viable count of probiotics in the fermented milk and the quality of fermented milk[J]. Food and Fermentation Industries, 2023, 49(6):18−26.
[23] 赵吉春, 余洁, 谭正卫, 等. 发酵十字花科蔬菜中硫代葡萄糖苷代谢研究进展[J]. 食品科学,2021,42(23):381−389 doi: 10.7506/spkx1002-6630-20210518-223 ZHAO J C, YU J, TAN Z W, et al. Advances in glucosinolates metabolism in fermented cruciferous vegetables[J]. Food Science,2021,42(23):381−389. doi: 10.7506/spkx1002-6630-20210518-223
[24] LIU L, ZHANG R F, DENG Y Y, et al. Fermentation and complex enzyme hydrolysis enhance total soluble phenolic and antioxidant activity of rice bran pretreated by steaming with α-amylase[J]. Food Chemistry,2017,221:636−643. doi: 10.1016/j.foodchem.2016.11.126
[25] RODRIGUEZ H, CURIEL J A, MARIA L J, et al. Food phenolics and lactic acid bacteria[J]. International Journal of Food Microbiology,2009,132(23):79−90.
[26] 陈苏婉, 汤颖秀, 邢政, 等. 超声波辅助副干酪乳杆菌发酵脱脂乳粉制备多肽的动力学研究[J]. 食品工业科技,2019,40(11):133−138 doi: 10.13386/j.issn1002-0306.2019.11.023 CHEN S W, TANG Y X, XING Z, et al. Kinetic study on ultrasound-assisted fermentation of peptides from skimmed milk powder by Lactobacillus paracasei[J]. Science and Technology of Food Industry,2019,40(11):133−138. doi: 10.13386/j.issn1002-0306.2019.11.023
[27] 崔蕾, 舒泉湧, 朱爱华, 等. 不同月份短柄五加叶中总黄酮含量测定[J]. 广东化工,2021,48(9):239−241 CUI L, SHU Q Y, ZHU A H, et al. Determination of total flavonoids in the leaves of Acanthopanax senticosus in different months[J]. Guangdong Chemical Industry,2021,48(9):239−241.
[28] VIVEK K, MISHRA S, PRADHANR C, et al. Effect of probiotification with Lactobacillus plantarum MCC 2974 on quality of Sohiong juice[J]. LWT-Food Science and Technology,2019,108:55−60. doi: 10.1016/j.lwt.2019.03.046
[29] 杨姗姗, 李彤, 乌日娜, 等. 下一代益生菌对肥胖人群肠道微生物调控作用的研究进展[J]. 中国食品学报,2021,21(4):356−363 YANG S S, LI T, WU R N, et al. Research progress of next generation probiotics on the regulation of intestinal microbiota in obese population[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(4):356−363.
[30] 常青, 郑宝东, 张怡, 等. 生姜抗性淀粉对高脂血症大鼠降血脂作用和胆汁酸代谢的影响[J]. 食品科学,2022,43(7):147−157 CHANG Q, ZHENG B D, ZHANG Y, et al. Effect of ginger resistant starch on hypolipidemia and bile acid metabolism in hyperlipidemia rats[J]. Food Science,2022,43(7):147−157.
[31] NICCOLAI A, SHANNON E, ABUGHANNAM N, et al. Lactic acid fermentation of Arthrospira platensis (spirulina) biomass for probiotic-based products[J]. Journal of Applied Phycology,2019,31(2):1077−1083. doi: 10.1007/s10811-018-1602-3
[32] LU X N, ROSS C F, POWERS J R, et al. Determination of total phenolic content and antioxidant activity of garlic ( Allium sativum) and elephant garlic( Allium ampeloprasum) by attenuated total reflectance-Fourier transformed infrared spectroscopy[J]. Journal of Agricultural and Food Chemistry,2011,59(10):5215−5221. doi: 10.1021/jf201254f
[33] LI Z, TENG J, LIU Y, et al. Enhanced antioxidant activity forpple juice fermented with Lactobacillus plantarum ATCC14917[J]. Molecules,2018,24(1):51−63. doi: 10.3390/molecules24010051
[34] MATTHEW D W, IAIN A B R, J. CRAIG R, et al. The modulation of pancreatic lipase activity by alginates[J]. Food Chemistry,2014,146:478−484.
[35] JUREMA S M, DE S F M, RODRIGUES S G, et al. Coffee simulated inhibition of pancreatic lipase and antioxidant activities:Effect of milk and decaffeination[J]. Food Research International,2022,160:111730. doi: 10.1016/j.foodres.2022.111730
[36] 郭晶晶, 乌日娜, 安飞宇, 等. 植物乳杆菌WW对高脂血症大鼠体脂的影响[J]. 食品科学,2019,40(9):139−145 GUO J J, WU R N, AN F Y, et al. Effects of Lactobacillus plantarum WW on body fat in hyperlipidemia rats[J]. Food Science,2019,40(9):139−145.
[37] 张旻. 降胆固醇功能乳杆菌的筛选及降解机理研究[D]. 上海:上海交通大学, 2007:13-15 ZHANG M. Screening of lactobacillus for efficient cholesterol-lowering and study on its mechanisms[D]. Shanghai:Shanghai Jiao Tong University, 2007:13-15.
[38] 黎沙. 基于光谱法结合分子模拟技术研究黄酮化合物对胰脂肪酶的抑制作用机制[D]. 南昌:南昌大学, 2021:6-7 LI S. Study on the inhibitory effect of flavonoids on pancreatic lipase by spectroscopy combined with molecular simulation technology[D]. Nanchang:Nanchang University, 2021:6-7.
[39] 祝闻旸. 海带腥味物质分析与生物法脱腥研究[D]. 无锡:江南大学, 2022:10-13 ZHU W Y. Study on substance analysis and removal of fishy smell of kelp by biological method[D]. Wuxi:Jiangnan University, 2022:10-13.
[40] 张琦梦, 顾华蓉, 穆洪涛, 等. 基于GC-MS分析传统鱼露发酵过程中挥发性风味物质变化[J]. 中国酿造,2022,41(9):242−251 ZHANG Q M, GU H R, MU H T, et al. Analysis of volatile flavor components of traditional Chinese fish sauce during fermentation by GC-MS[J]. China Brewing,2022,41(9):242−251.
[41] 顾赛麒, 胡彬超, 张月婷, 等. 基于电子鼻、气-质联用技术和感官评价方法优化海带发酵脱腥工艺[J]. 食品与发酵工业,2020,46(19):124−129 CAI S Q, HU B C, ZHANG Y T, et al. The deodorization process of kelp fermentation was optimized based on electronic nose, gas-mass coupling technology and sensory evaluation[J]. Food and Fermentation Industries,2020,46(19):124−129.
-
期刊类型引用(1)
1. 黄素艳,曹荣,刘楠,孙永,周德庆,王珊珊. 提取方式对微拟球藻蛋白理化性质和功能特性的影响. 食品工业科技. 2025(01): 87-96 .  本站查看
本站查看
其他类型引用(0)





 下载:
下载:
 下载:
下载:



